基于枝状DNA的靶标触发信号级联放大的核酸检测方法与流程
本发明属于核酸分子检测的技术领域,涉及基于枝状dna的靶标触发信号级联放大的核酸检测方法,属于一种定性的核酸检测方法。
背景技术:
核酸的检测和分析对疾病的诊断和治疗起着非常重要的作用,如何快速精准地检测核酸序列是现代医学亟需解决的问题,也是个性化医疗的发展趋势,现主要检测的目标分为细菌和病毒病原体、癌症标志物、遗传性疾病等[1]。癌症是全球第二大致死病因[2],很多病人由于未及时发现疾病,而错过了最佳的诊断和治疗时间,因此癌症的早期诊断对于人类健康和安全来说是至关重要的[3]。核酸可以作为一种肿瘤标志物,比如循环肿瘤dna(ctdna)是从肿瘤细胞上脱落下来的游离在外周血部位的单碱基突变dna[4],携带有肿瘤细胞特异性的遗传信息,相对于正常人来说,它在癌症病人的血清中含量较高,若能在早期癌症患者的体内及时检出ctdna,则会在很大程度上提高癌症治愈的几率。细菌或病毒病原体的侵入会造成人体受到感染,当病原体dna发生核酸突变时,可能会使得病原体具备抗生素耐药性[5],因此可通过检测病原体dna来判断患者所感染的疾病。当核酸变异发生在基因组编码区时,可能会改变氨基酸序列和蛋白的功能,进而造成人体遗传性疾病的发生,因此对基因核酸的检测可预知遗传性疾病发生的概率。然而对于临床样品来说,核酸的浓度是很低的,比如ctdna的浓度在μg/l和ng/l之间,病原体dna的浓度处于pg/l的级别[6],因此如何在实际样品中实现高灵敏度、高精度的核酸检测仍然是现存的难题之一。
传统的核酸检测方法主要为基于核酸的直接杂交,包括印迹杂交、斑点杂交、原位杂交和酶联免疫吸附测定等方法[7],但这些方法大多费时费力,需要利用荧光或同位素进行标记,而且灵敏度普遍较低。随后发展了两种方法,即基因组测序技术和聚合酶链式反应(polymerasechainreaction,pcr)[8],测序技术可用于大规模多重序列分析,无需提前知道所测的序列,这种方法可以得到人类基因组的数据,个体性的基因组差异促进了个体医疗的发展,但测序方法存在固有的误差率、耗时长、昂贵等缺点,无法做到全民普及;pcr方法可大量增加靶标核酸的拷贝数,具有高灵敏度,但易出现假阳性或假阴性的结果,不能进行多重分析,且需要复杂的操作和精密的仪器,尽管这两种是现临床常用的方法,但其局限性限制了它们的发展。基于此,发展了很多体外扩增的方法来尽量规避这些缺点,同时降低检测限,提高灵敏度和准确性。体外扩增技术通常包括两类,分别是酶辅助的体外扩增技术和无酶参与的体外扩增技术。酶辅助的体外扩增技术包括滚环扩增反应(rollingcircleamplification,rca)[9]、连接酶链式反应(helicase-dependentamplification,hda)[10]、环介导的等温扩增(loop-mediatedisothermalamplification,lamp)、基于核酸序列的扩增(nucleicacidsequence-basedamplification,nasba)[11]和酶辅助的靶标循环放大方法(enzyme-assistedtargetrecycling,eatr)[12]等,由于这些反应均需要酶的参与,而酶的活性易受外界储存、运输和处理等条件的影响,影响反应的正常进行,因此酶辅助的扩增技术所需的反应条件比较苛刻,费用高。另外,无酶参与的体外扩增技术包括杂交链式反应(hybridizationchainreaction,hcr)[13]、链置换反应(stranddisplacementreaction,sdr)[14]、催化发卡组装(catalytichairpinassembly,cha)[15]和dna酶介导的反应(dnazyme-mediatedassays)[16],但这些方法对dna序列的设计要求较高,需要dna二级结构在一定条件下发生精确的动态响应,这些复杂的要求和扩增方法无疑增加了设计和实施的难度。
由于现有的核酸检测方法依然存在很多局限性,因此需开发新的方法实现靶标触发的信号级联放大的核酸检测。
参考文献
1.smith,s.j.,c.r.nemr,ands.o.kelley,chemistry-drivenapproachesforultrasensitivenucleicaciddetection.journaloftheamericanchemicalsociety,2017.139(3):p.1020-1028.
2.jayanthi,v.,a.b.das,andu.saxena,recentadvancesinbiosensordevelopmentforthedetectionofcancerbiomarkers.biosensorsandbioelectronics,2017.91:p.15-23.
3.wu,l.andx.qu,cancerbiomarkerdetection:recentachievementsandchallenges.chemicalsocietyreviews,2015.44(10):p.2963-2997.
4.alix-panabieres,c.andk.pantel,clinicalapplicationsofcirculatingtumorcellsandcirculatingtumordnaasliquidbiopsy.cancerdiscovery,2016.6(5):p.479-491.
5.chen,s.x.,d.y.zhang,andg.seelig,conditionallyfluorescentmolecularprobesfordetectingsinglebasechangesindouble-strandeddna.naturechemistry,2013.5(9):p.782-789.
6.labib,m.,e.h.sargent,ands.o.kelley,electrochemicalmethodsfortheanalysisofclinicallyrelevantbiomolecules.chemicalreviews,2016.116(16):p.9001-9090.
7.mansfield,e.s.,etal.,nucleicaciddetectionusingnon-radioactivelabellingmethods.molecularandcellularprobes,1995.9(3):p.145-156.
8.khodakov,d.,c.wang,andd.y.zhang,diagnosticsbasedonnucleicacidsequencevariantprofiling:pcr,hybridization,andngsapproaches.advanceddrugdeliveryreviews,2016.105(pta):p.3-19.
9.ali,m.m.,etal.,rollingcircleamplification:aversatiletoolforchemicalbiology,materialsscienceandmedicine.chemicalsocietyreviews,2014.43(10):p.3324-3341.
10.zhao,y.,etal.,isothermalamplificationofnucleicacids.chemicalreviews,2015.115(22):p.12491-12545.
11.hartman,m.r.,etal.,point-of-carenucleicaciddetectionusingnanotechnology.nanoscale,2013.5(21):p.10141-10154.
12.gerasimova,y.v.andd.m.kolpashchikov,enzyme-assistedtargetrecycling(eatr)fornucleicaciddetection.chemicalsocietyreviews,2014.43:p.6405-6438.
13.xu,g.,etal.,cyclingofrationalhybridizationchainreactiontoenableenzyme-freedna-basedclinicaldiagnosis.acsnano,2018.12(7):p.7213-7219.
14.wang,d.,etal.,highlyselectivedetectionofsingle-nucleotidepolymorphismsusingaquartzcrystalmicrobalancebiosensorbasedonthetoehold-mediatedstranddisplacementreaction.analyticalchemistry,2012.84(16):p.7008-7014.
15.zhou,h.,etal.,opticalnano-biosensinginterfacevianucleicacidamplificationstrategy:constructionandapplication.chemicalsocietyreviews,2018.47(6):p.1996-2019.
16.peng,h.,etal.,dnazyme-mediatedassaysforamplifieddetectionofnucleicacidsandproteins.analyticalchemistry,2018.90(1):p.190-207.
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种定性的、基于枝状dna的靶标触发信号级联放大的核酸检测方法。
本发明的技术方案概述如下:
基于枝状dna的靶标触发信号级联放大的核酸检测方法,包括如下步骤:
(1)制备一种n枝状dna:
设计并合成均带有相同的粘性末端的n条dna单链;分别溶于水中,振荡,得到n份终浓度为100μm的dna单链水溶液;n=3或4;
第1条dna单链从3'端到5'端,分为1-1段、1-2段和1-3段;1-1段和1-2段之和的dna单链的核苷酸数为28-44个,1-3段的dna单链为粘性末端,其核苷酸数为11-15个,共计39-59个;
第2条dna单链从3'端到5'端,分为2-1段、2-2段和2-3段;2-1段和2-2段之和的dna单链的核苷酸数为28-44个,2-3段的dna单链为粘性末端,其核苷酸数为11-15个,共计39-59个;
第n条dna单链从3'端到5'端,分为n-1段、n-2段和n-3段,n-1段和n-2段之和的dna单链的核苷酸数为28-44个;n-3段的dna单链为粘性末端,其核苷酸数为11-15个,共计39-59个;
第1条dna单链的1-2段核苷酸序列与第2条dna单链的2-1段核苷酸序列反向互补配对;
第2条dna单链的2-2段核苷酸序列与第n条dna单链的n-1段核苷酸序列反向互补配对;
第n条dna单链的n-2段核苷酸序列与第1条dna单链的1-1段核苷酸序列反向互补配对;
第1条dna单链的1-3段核苷酸序列、第2条dna单链的2-3段核苷酸序列、第n条dna单链的n-3段核苷酸序列与待测靶标核酸分子的5'端的一半序列均反向互补配对;
取等体积的n份dna单链水溶液,按照n条dna单链的等摩尔比混合,加入终浓度为80mm的nacl水溶液,加热至95℃再降至室温,制备得到n枝状dna;
(2)制备一种m枝状dna:
设计并合成均带有相同的粘性末端的、不同于步骤(1)粘性末端的m条dna单链;分别溶于水中,振荡,得到m份终浓度为100μm的dna单链水溶液;m=3或4;
第1条dna单链从5'端到3'端,分为1-1段、1-2段和1-3段;1-1段和1-2段之和的dna单链的核苷酸数为28-44个,1-3段的dna单链为粘性末端,其核苷酸数为11-15个,共计39-59个;
第2条dna单链从5'端到3'端,分为2-1段、2-2段和2-3段;2-1段和2-2段之和的dna单链的核苷酸数为28-44个,2-3段的dna单链为粘性末端,其核苷酸数为11-15个,共计39-59个;
第m条dna单链从5'端到3'端,分为m-1段、m-2段和m-3段,m-1段和m-2段之和的dna单链的核苷酸数为28-44个;m-3段的dna单链为粘性末端,其核苷酸数为11-15个,共计39-59个;
第1条dna单链的1-2段核苷酸序列与第2条dna单链的2-1段核苷酸序列反向互补配对;
第2条dna单链的2-2段核苷酸序列与第m条dna单链的m-1段核苷酸序列反向互补配对;
第m条dna单链的m-2段核苷酸序列与第1条dna单链的1-1段核苷酸序列反向互补配对;
第1条dna单链的1-3段核苷酸序列、第2条dna单链的2-3段核苷酸序列、第m条dna单链的m-3段核苷酸序列与待测靶标核酸分子的3'端的一半序列均反向互补配对;
取等体积的m份dna单链水溶液,按照m条dna单链的等摩尔比混合,加入终浓度为80mm的nacl水溶液,加热至95℃再降至室温,制备得到m枝状dna;
(3)将5'端修饰有巯基基团的核酸探针分子通过巯基连接在金基底表面,所述核酸探针分子的核苷酸从5'端到3'端分为p-1段和p-2段,共有核苷酸21-25个;p-1段核苷酸数为10个,均为腺嘌呤核苷酸,p-2段核苷酸数为11-15个,p-2可与待测靶标核酸分子3'端的一半序列互补配对;
(4)在步骤(3)获得的连接有核酸探针分子的金基底加入待测靶标核酸分子,反应,至生物传感器检测信号稳定,加入一种n枝状dna,反应,至生物传感器检测信号稳定,加入待测靶标核酸分子,反应,至生物传感器检测信号稳定,加入一种m枝状dna,反应,至生物传感器检测信号稳定;
(5)重复步骤(4),直至加入一种n枝状dna或一种m枝状dna后生物传感器检测信号不再波动,最终显示出级联放大的待测靶标核酸分子检测信号。
本发明的优点:
本发明的基于枝状dna的靶标触发信号级联放大的核酸检测方法,操作简便,无需酶的参与,无需分子标记,成本低廉,适用范围广泛,由于dna序列的可编程性使得该检测方法可针对于特定的核酸序列来设计,同时其级联放大的特点使其具有很好的灵敏性和准确度,该检测方法可应用于生物传感器、分子检测等领域。
附图说明
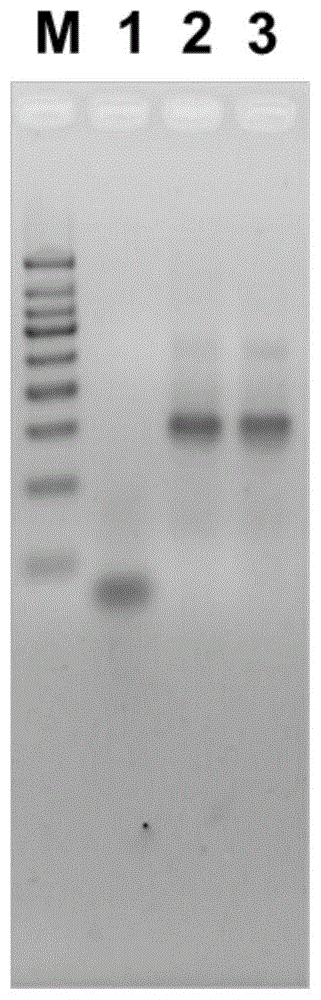
图1为验证合成n枝状dna和m枝状dna的电泳图(n=4,m=4),其中m:marker;1:单链dna(seqidno.1);2:实施例1中的n枝状dna;实施例1中的m枝状dna。
图2为待测靶标触发的信号级联放大的核酸检测信号图。
具体实施方式
生物传感器以石英晶体微天平为例。
n枝状dna和m枝状dna是两种不同粘性末端的枝状dna。
n枝状dna和m枝状dna的粘性末端是根据待测靶标分子的序列设计的,例如选择肿瘤标记物为待测靶标分子,利用本发明的方法可以检测样本中肿瘤标记物的存在与否。
下面通过具体实施例对本发明作进一步的说明。下面的实施例是为了使本领域的技术人员能够更好地理解本发明,但并不对本发明作任何限制。
实施例1
(1)制备n枝状dna,包括如下步骤:
设计并合成均带有相同的粘性末端的n条dna单链;分别溶于水中,振荡,得到n份终浓度为100μm的dna单链水溶液;n=4;
表1.制备n枝状dna的单链序列;n=4
第1条dna单链从3'端到5'端,分为1-1段、1-2段和1-3段,分别用加重下划线、双下划线和单下划线表示;1-1段和1-2段之和的dna单链的核苷酸数为36个,1-3段的dna单链为粘性末端,其核苷酸数为15个,共计51个;
第2条dna单链从3'端到5'端,分为2-1段、2-2段和2-3段,分别用加重下划线、双下划线和单下划线表示;2-1段和2-2段之和的dna单链的核苷酸数为36个,2-3段的dna单链为粘性末端,其核苷酸数为15个,共计51个;
第3条dna单链从3'端到5'端,分为3-1段、3-2段和3-3段,分别用加重下划线、双下划线和单下划线表示,3-1段和3-2段之和的dna单链的核苷酸数为36个;3-3段的dna单链为粘性末端,其核苷酸数为15个,共计51个;
第4条dna单链从3'端到5'端,分为4-1段、4-2段和4-3段,分别用加重下划线、双下划线和单下划线表示,4-1段和4-2段之和的dna单链的核苷酸数为36个;4-3段的dna单链为粘性末端,其核苷酸数为15个,共计51个;
第1条dna单链的1-2段核苷酸序列与第2条dna单链的2-1段核苷酸序列反向互补配对;
第2条dna单链的2-2段核苷酸序列与第3条dna单链的3-1段核苷酸序列反向互补配对;
第3条dna单链的3-2段核苷酸序列与第4条dna单链的4-1段核苷酸序列反向互补配对;
第4条dna单链的4-2段核苷酸序列与第1条dna单链的1-1段核苷酸序列反向互补配对;
第1条dna单链的1-3段核苷酸序列、第2条dna单链的2-3段核苷酸序列、第3条dna单链的3-3段核苷酸序列、第4条dna单链的4-3段核苷酸序列与待测靶标核酸分子的5'端的一半序列均反向互补配对;
取等体积的n份dna单链水溶液,按照n条dna单链的等摩尔比混合,加入终浓度为80mm的nacl水溶液,加热至95℃再降至室温,制备得到n枝状dna;n=4;
(2)制备m枝状dna,包括如下步骤:
设计并合成均带有相同的粘性末端的m条dna单链;分别溶于水中,振荡,得到m份终浓度为100μm的dna单链水溶液;m=4;
表2.制备m枝状dna的单链序列,m=4
第1条dna单链从5'端到3'端,分为1-1段、1-2段和1-3段,分别用点划线、曲线和虚线表示;1-1段和1-2段之和的dna单链的核苷酸数为36个,1-3段的dna单链为粘性末端,其核苷酸数为15个,共计51个;
第2条dna单链从5'端到3'端,分为2-1段、2-2段和2-3段,分别用点划线、曲线和虚线表示;2-1段和2-2段之和的dna单链的核苷酸数为36个,2-3段的dna单链为粘性末端,其核苷酸数为15个,共计51个;
第3条dna单链从5'端到3'端,分为3-1段、3-2段和3-3段,分别用点划线、曲线和虚线表示;3-1段和3-2段之和的dna单链的核苷酸数为36个;3-3段的dna单链为粘性末端,其核苷酸数为15个,共计51个;
第4条dna单链从5'端到3'端,分为4-1段、4-2段和4-3段,分别用点划线、曲线和虚线表示;4-1段和4-2段之和的dna单链的核苷酸数为36个;4-3段的dna单链为粘性末端,其核苷酸数为15个,共计51个;
第1条dna单链的1-2段核苷酸序列与第2条dna单链的2-1段核苷酸序列反向互补配对;
第2条dna单链的2-2段核苷酸序列与第3条dna单链的3-1段核苷酸序列反向互补配对;
第3条dna单链的3-2段核苷酸序列与第4条dna单链的4-1段核苷酸序列反向互补配对;
第4条dna单链的4-2段核苷酸序列与第1条dna单链的1-1段核苷酸序列反向互补配对;
第1条dna单链的1-3段核苷酸序列、第2条dna单链的2-3段核苷酸序列、第3条dna单链的3-3段核苷酸序列、第4条dna单链的4-3段核苷酸序列与待测靶标核酸分子的3'端的一半序列均反向互补配对;
取等体积的m份dna单链水溶液,按照m条dna单链的等摩尔比混合,加入终浓度为80mm的nacl水溶液,加热至95℃再降至室温,制备得到m枝状dna;m=4;
n枝状dna和m枝状dna的合成结果见图1;
(3)将5'端修饰有巯基基团的核酸探针分子seqidno.22通过巯基连接在金基底表面,包括如下步骤:
表3.5'端修饰有巯基基团的核酸探针分子的序列
a.所述的5'端修饰有巯基基团的核酸探针分子从5'端到3'端分为p-1段和p-2段,分别用单划线和双划线表示,共有核苷酸25个;p-1段核苷酸数为10个,均为腺嘌呤核苷酸;p-2段核苷酸数为15个,可与待测靶标核酸分子3'端的一半序列互补配对;
b.将5'端修饰有巯基基团的核酸探针分子溶于水中,振荡,得到终浓度为100μm的核酸探针分子溶液;将核酸探针分子溶液稀释至0.1μm,并加入终浓度为1mm的三(2-羧乙基)膦,振荡1h;
c.选用石英晶体微天平作为生物传感器,金芯片作为基底,将金基底浸泡在h2o、h2o2和nh3·h2o体积比为5:1:1的溶液中,在75℃水浴锅中处理5min,然后分别用水和乙醇清洗三次,n2吹干;
c.取步骤b处理过的核酸探针分子溶液200μl滴加在金基底表面,37℃条件下静置16h,然后用水和乙醇分别清洗三次,n2吹干;随后将固定有核酸探针分子的金基底浸泡在1mm6-巯基-1-己醇(mch)溶液中1h,然后用水和乙醇分别清洗三次,n2吹干;
(4)
a.选用石英晶体微天平为生物传感器;所述的待测靶标核酸分子seqidno.23的总碱基数为30个,分为两部分,5'端的15个碱基与n枝状dna的粘性末端互补配对,3'端的15个碱基与核酸探针分子、m枝状dna的粘性末端均互补配对;n=4;m=4;
b.在步骤(3)获得的连接有核酸探针分子的金基底加入待测靶标核酸分子,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;
c.加入n枝状dna,浓度为0.1μm,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;n=4;
d.加入待测靶标核酸分子,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;
e.加入m枝状dna,浓度为0.1μm,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;m=4;
f.重复步骤a-e,直至加入n枝状dna或m枝状dna后生物传感器检测信号不再波动,最终显示出级联放大的待测靶标核酸分子检测信号;n=4;m=4。
靶标触发的级联放大的核酸检测信号,见图2。从图2中可知,待测样品中含有靶标核酸分子。
实施例2
(1)制备n枝状dna,包括如下步骤:
设计并合成均带有相同的粘性末端的n条dna单链;分别溶于水中,振荡,得到n份终浓度为100μm的dna单链水溶液;n=3;
表4.制备n枝状dna的单链序列,n=3
第9条dna单链从3'端到5'端,分为9-1段、9-2段和9-3段,分别用加重下划线、双下划线和单下划线表示;9-1段和9-2段之和的dna单链的核苷酸数为28个,9-3段的dna单链为粘性末端,其核苷酸数为11个,共计39个;
第10条dna单链从3'端到5'端,分为10-1段、10-2段和10-3段,分别用加重下划线、双下划线和单下划线表示;10-1段和10-2段之和的dna单链的核苷酸数为28个,10-3段的dna单链为粘性末端,其核苷酸数为11个,共计39个;
第11条dna单链从3'端到5'端,分为11-1段、11-2段和11-3段,分别用加重下划线、双下划线和单下划线表示,11-1段和11-2段之和的dna单链的核苷酸数为28个;11-3段的dna单链为粘性末端,其核苷酸数为11个,共计39个;
第9条dna单链的9-2段核苷酸序列与第10条dna单链的10-1段核苷酸序列反向互补配对;
第10条dna单链的10-2段核苷酸序列与第11条dna单链的11-1段核苷酸序列反向互补配对;
第11条dna单链的11-2段核苷酸序列与第9条dna单链的9-1段核苷酸序列反向互补配对;
第9条dna单链的9-3段核苷酸序列、第10条dna单链的10-3段核苷酸序列、第11条dna单链的11-3段核苷酸序列与待测靶标核酸分子的5'端的一半序列均反向互补配对;
取等体积的n份dna单链水溶液,按照n条dna单链的等摩尔比混合,加入终浓度为80mm的nacl水溶液,加热至95℃再降至室温,制备得到n枝状dna;n=3;
(2)制备m枝状dna,包括如下步骤:
设计并合成均带有相同的粘性末端的m条dna单链;分别溶于水中,振荡,得到m份终浓度为100μm的dna单链水溶液;m=3;
表5.制备m枝状dna的单链序列,m=3
第12条dna单链从5'端到3'端,分为12-1段、12-2段和12-3段,分别用点划线、曲线和虚线表示;12-1段和12-2段之和的dna单链的核苷酸数为28个,12-3段的dna单链为粘性末端,其核苷酸数为11个,共计39个;
第13条dna单链从5'端到3'端,分为13-1段、13-2段和13-3段,分别用点划线、曲线和虚线表示;13-1段和13-2段之和的dna单链的核苷酸数为28个,13-3段的dna单链为粘性末端,其核苷酸数为11个,共计39个;
第14条dna单链从5'端到3'端,分为14-1段、14-2段和14-3段,分别用点划线、曲线和虚线表示;14-1段和14-2段之和的dna单链的核苷酸数为28个;14-3段的dna单链为粘性末端,其核苷酸数为11个,共计39个;
第12条dna单链的12-2段核苷酸序列与第13条dna单链的13-1段核苷酸序列反向互补配对;
第13条dna单链的13-2段核苷酸序列与第14条dna单链的14-1段核苷酸序列反向互补配对;
第14条dna单链的3-2段核苷酸序列与第12条dna单链的12-1段核苷酸序列反向互补配对;
第12条dna单链的12-3段核苷酸序列、第13条dna单链的13-3段核苷酸序列、第14条dna单链的14-3段核苷酸序列与待测靶标核酸分子的3'端的一半序列均反向互补配对;
取等体积的m份dna单链水溶液,按照m条dna单链的等摩尔比混合,加入终浓度为80mm的nacl水溶液,加热至95℃再降至室温,制备得到m枝状dna;m=3;
(3)将5'端修饰有巯基基团的核酸探针分子seqidno.24通过巯基连接在金基底表面,包括如下步骤:
表6.5'端修饰有巯基基团的核酸探针分子的序列
a.所述的5'端修饰有巯基基团的核酸探针分子从5'端到3'端分为p-1段和p-2段,分别用单划线和双划线表示,共有核苷酸21个;p-1段核苷酸数为10个,均为腺嘌呤核苷酸;p-2段核苷酸数为11个,可与待测靶标核酸分子3'端的一半序列互补配对;
b.将5'端修饰有巯基基团的核酸探针分子溶于水中,振荡,得到终浓度为100μm的核酸探针分子溶液;将核酸探针分子溶液稀释至0.1μm,并加入终浓度为1mm的三(2-羧乙基)膦,振荡1h;
c.选用石英晶体微天平作为生物传感器,金芯片作为基底,将金基底浸泡在h2o、h2o2和nh3·h2o体积比为5:1:1的溶液中,在75℃水浴锅中处理5min,然后分别用水和乙醇清洗三次,n2吹干;
c.取步骤b处理过的核酸探针分子溶液200μl滴加在金基底表面,37℃条件下静置16h,然后用水和乙醇分别清洗三次,n2吹干;随后将固定有核酸探针分子的金基底浸泡在1mm6-巯基-1-己醇(mch)溶液中1h,然后用水和乙醇分别清洗三次,n2吹干;
(4)
a.选用石英晶体微天平为生物传感器;所述的待测靶标核酸分子seqidno.25的总碱
基数为22个,分为两部分,5'端的11个碱基与n枝状dna的粘性末端互补配对,3'
端的11个碱基与核酸探针分子、m枝状dna的粘性末端均互补配对;n=3;m=3;
b.在步骤(3)获得的连接有核酸探针分子的金基底加入待测靶标核酸分子,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;
c.加入n枝状dna,浓度为0.1μm,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;n=3;
d.加入待测靶标核酸分子,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;
e.加入m枝状dna,浓度为0.1μm,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;m=3;
f.重复步骤a-e,直至加入n枝状dna或m枝状dna后生物传感器检测信号不再波动,最终显示出级联放大的待测靶标核酸分子检测信号;n=3;m=3。
实施例3
(1)制备n枝状dna,包括如下步骤:
设计并合成均带有相同的粘性末端的n条dna单链;分别溶于水中,振荡,得到n份终浓度为100μm的dna单链水溶液;n=4;
表7.制备n枝状dna的单链序列;n=4
第15条dna单链从3'端到5'端,分为1-1段、1-2段和1-3段,分别用加重下划线、双下划线和单下划线表示;15-1段和15-2段之和的dna单链的核苷酸数为44个,1-3段的dna单链为粘性末端,其核苷酸数为15个,共计59个;
第16条dna单链从3'端到5'端,分为16-1段、16-2段和16-3段,分别用加重下划线、双下划线和单下划线表示;16-1段和16-2段之和的dna单链的核苷酸数为44个,16-3段的dna单链为粘性末端,其核苷酸数为15个,共计59个;
第17条dna单链从3'端到5'端,分为17-1段、17-2段和17-3段,分别用加重下划线、双下划线和单下划线表示,17-1段和17-2段之和的dna单链的核苷酸数为44个;17-3段的dna单链为粘性末端,其核苷酸数为15个,共计59个;
第18条dna单链从3'端到5'端,分为18-1段、18-2段和18-3段,分别用加重下划线、双下划线和单下划线表示,18-1段和18-2段之和的dna单链的核苷酸数为44个;18-3段的dna单链为粘性末端,其核苷酸数为15个,共计59个;
第15条dna单链的15-2段核苷酸序列与第16条dna单链的16-1段核苷酸序列反向互补配对;
第16条dna单链的16-2段核苷酸序列与第17条dna单链的17-1段核苷酸序列反向互补配对;
第17条dna单链的17-2段核苷酸序列与第18条dna单链的18-1段核苷酸序列反向互补配对;
第18条dna单链的18-2段核苷酸序列与第15条dna单链的15-1段核苷酸序列反向互补配对;
第15条dna单链的15-3段核苷酸序列、第16条dna单链的16-3段核苷酸序列、第17条dna单链的17-3段核苷酸序列、第18条dna单链的18-3段核苷酸序列与待测靶标核酸分子的5'端的一半序列均反向互补配对;
取等体积的n份dna单链水溶液,按照n条dna单链的等摩尔比混合,加入终浓度为80mm的nacl水溶液,加热至95℃再降至室温,制备得到n枝状dna;n=4;
(2)制备m枝状dna,包括如下步骤:
设计并合成均带有相同的粘性末端的m条dna单链;分别溶于水中,振荡,得到m份终浓度为100μm的dna单链水溶液;m=3;
表8.制备m枝状dna的单链序列,m=3
第19条dna单链从5'端到3'端,分为19-1段、19-2段和19-3段,分别用点划线、曲线和虚线表示;19-1段和19-2段之和的dna单链的核苷酸数为44个,1-3段的dna单链为粘性末端,其核苷酸数为15个,共计59个;
第20条dna单链从5'端到3'端,分为20-1段、20-2段和20-3段,分别用点划线、曲线和虚线表示;20-1段和20-2段之和的dna单链的核苷酸数为44个,20-3段的dna单链为粘性末端,其核苷酸数为15个,共计59个;
第21条dna单链从5'端到3'端,分为21-1段、21-2段和21-3段,分别用点划线、曲线和虚线表示;21-1段和21-2段之和的dna单链的核苷酸数为44个;21-3段的dna单链为粘性末端,其核苷酸数为15个,共计59个;
第19条dna单链的19-2段核苷酸序列与第20条dna单链的20-1段核苷酸序列反向互补配对;
第20条dna单链的20-2段核苷酸序列与第21条dna单链的21-1段核苷酸序列反向互补配对;
第21条dna单链的21-2段核苷酸序列与第19条dna单链的19-1段核苷酸序列反向互补配对;
第19条dna单链的19-3段核苷酸序列、第20条dna单链的20-3段核苷酸序列、第21条dna单链的21-3段核苷酸序列与待测靶标核酸分子的3'端的一半序列均反向互补配对;
取等体积的m份dna单链水溶液,按照m条dna单链的等摩尔比混合,加入终浓度为80mm的nacl水溶液,加热至95℃再降至室温,制备得到m枝状dna;m=3;
(3)将5'端修饰有巯基基团的核酸探针分子seqidno.26通过巯基连接在金基底表面,包括如下步骤:
表9.5'端修饰有巯基基团的核酸探针分子的序列
a.所述的5'端修饰有巯基基团的核酸探针分子从5'端到3'端分为p-1段和p-2段,分别用单划线和双划线表示,共有核苷酸25个;p-1段核苷酸数为10个,均为腺嘌呤核苷酸;p-2段核苷酸数为15个,可与待测靶标核酸分子3'端的一半序列互补配对;
b.将5'端修饰有巯基基团的核酸探针分子溶于水中,振荡,得到终浓度为100μm的核酸探针分子溶液;将核酸探针分子溶液稀释至0.1μm,并加入终浓度为1mm的三(2-羧乙基)膦,振荡1h;
c.选用石英晶体微天平作为生物传感器,金芯片作为基底,将金基底浸泡在h2o、h2o2和nh3·h2o体积比为5:1:1的溶液中,在75℃水浴锅中处理5min,然后分别用水和乙醇清洗三次,n2吹干;
c.取步骤b处理过的核酸探针分子溶液200μl滴加在金基底表面,37℃条件下静置16h,然后用水和乙醇分别清洗三次,n2吹干;随后将固定有核酸探针分子的金基底浸泡在1mm6-巯基-1-己醇(mch)溶液中1h,然后用水和乙醇分别清洗三次,n2吹干;
(4)
a.选用石英晶体微天平为生物传感器;所述的待测靶标核酸分子seqidno.27的总碱基数为30个,分为两部分,5'端的15个碱基与n枝状dna的粘性末端互补配对,3'端的15个碱基与核酸探针分子、m枝状dna的粘性末端均互补配对;n=4;m=3;
b.在步骤(3)获得的连接有核酸探针分子的金基底加入待测靶标核酸分子,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;
c.加入n枝状dna,浓度为0.1μm,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;n=4;
d.加入待测靶标核酸分子,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;
e.加入m枝状dna,浓度为0.1μm,通入体积为2ml,反应约20min,至生物传感器检测信号稳定;m=3;
f.重复步骤a-e,直至加入n枝状dna或m枝状dna后生物传感器检测信号不再波动,最终显示出级联放大的待测靶标核酸分子检测信号;n=4;m=3。
序列表
<110>天津大学
<120>基于枝状dna的靶标触发信号级联放大的核酸检测方法
<160>27
<170>siposequencelisting1.0
<210>1
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttttgtgaatgaagagctcatccatgcctagactggcgataagtagccagc51
<210>2
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>2
ttttgtgaatgaagagctcagcaagcgttatgcgtctaggcatggatgagc51
<210>3
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttttgtgaatgaagagctctggtatgcatgtcggcataacgcttgctgagc51
<210>4
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttttgtgaatgaagagctggctacttatcgccacgacatgcataccagagc51
<210>5
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>5
cgaccgatgaatagcggtcagatccgtacctactcggccaatgttcagatg51
<210>6
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>6
cgagtaggtacggatctgcgtattgcgaacgactcggccaatgttcagatg51
<210>7
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>7
cgagtcgttcgcaatacggctgtacgtatggtctcggccaatgttcagatg51
<210>8
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>8
cgagaccatacgtacagcaccgctattcatcggtcggccaatgttcagatg51
<210>9
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>9
gattacttgaacacgctgtcctaaccatgaccgtcgaag39
<210>10
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>10
gattacttgaacttcgacggtcatgtactagatcagagg39
<210>11
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>11
gattacttgaacctctgatctagtagttaggacagcgtg39
<210>12
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>12
cacgctgtcctaaccatgaccgtcgaagagcctatcctg39
<210>13
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>13
cttcgacggtcatgtactagatcagaggagcctatcctg39
<210>14
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>14
cctctgatctagtagttaggacagcgtgagcctatcctg39
<210>15
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>15
ttttgtgaatgaagagctcatccatgcctagacagactggctggcgataagtagccagc59
<210>16
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>16
ttttgtgaatgaagagctcagcaagcgttatgcatgcgtctgtctaggcatggatgagc59
<210>17
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>17
ttttgtgaatgaagagctctggtatgcatgtcggtcggcatgcataacgcttgctgagc59
<210>18
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>18
ttttgtgaatgaagagctggctacttatcgccagccacgaccgacatgcataccagagc59
<210>19
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>19
cacgctgtcctaacgtcctaaccatgaccgcatgaccgtcgaaggccaatgttcagatg59
<210>20
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>20
cttcgacggtcatgcggtcatgtactagattactagatcagagggccaatgttcagatg59
<210>21
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>21
cctctgatctagtaatctagtagttaggacgttaggacagcgtggccaatgttcagatg59
<210>22
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>22
aaaaaaaaaagccaatgttcagatg25
<210>23
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>23
tcttcattcacaaaacatctgaacattggc30
<210>24
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>24
aaaaaaaaaatcaacatcagt21
<210>25
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>25
tagcttatcagactgatgttga22
<210>26
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>26
aaaaaaaaaagccaatgttcagatg25
<210>27
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>27
tcttcattcacaaaacatctgaacattggc30
- 还没有人留言评论。精彩留言会获得点赞!