西米杜鹃二醇及其制备方法和应用与流程
本发明属于天然药物化学领域,涉及一种三萜类化合物的制备方法及其在制备抗肿瘤药物中的应用。
背景技术:
癌症已成为我国居民疾病死因之首,且发病率和死亡率还在逐年攀升,对公众健康造成了巨大威胁。传统抗肿瘤药物多为细胞毒性药物,虽然在临床上具有一定的疗效,但是难以克服毒副作用强、选择性差以及易产生耐药性等缺陷,因此需要持续研发高效、低毒、特异性强的新型抗肿瘤药物,提高癌症病人的生存质量。天然产物的结构多样性和易于与生物大分子结合的特点,决定了其在参与生命生理过程中所具有的无可比拟的优势,这些都赋予了天然产物在新药研发中不可替代的重要地位,是发现药物先导结构和候选药物的重要来源。南欧大戟作为一种重要的植物资源,其次级代谢产物已经被报道具有多种结构类型以及多样的生物活性,尤其在抗肿瘤活性方面。因此,从南欧大戟中挖掘出具有抗肿瘤活性的代谢产物对于新型抗肿瘤药物的研发具有重要意义。
技术实现要素:
为了进一步发掘南欧大戟的药用价值,本发明提供一种从南欧大戟中提取的三萜类化合物,具有抗肿瘤活性。
本发明的另一目的是提供一种上述三萜类化合物的制备方法。
本发明的再一目的是提供一种上述三萜类化合物在治疗肿瘤方面的应用。
为实现上述目的,本发明采用如下技术方案。
一种三萜类化合物,简称为西米杜鹃二醇,其结构式如式(i)所示:
式(i)。
所述三萜类化合物的结构类型属于变异的何伯烷型三萜(e:b-friedo-hopanetypetriterpenoid),且在3位和22位有双羟基取代。
上述三萜类化合物的制备方法,包括以下步骤:
(1)南欧大戟干燥全草,粉碎后用乙醇浸提,浸提液浓缩得到粗浸膏;
(2)粗浸膏悬浮于水中,然后用乙酸乙酯萃取,将乙酸乙酯萃取相浓缩得到乙酸乙酯萃取物;
(3)将乙酸乙酯萃取物过d101大孔树脂柱层析,依次用30%、50%、80%和95%v/v的乙醇-水洗脱,得到4个组分a-d;
(4)将组分d过正相硅胶柱层析,依次用20:1、15:1、10:1、7:1、5:1v/v的石油醚-乙酸乙酯洗脱,得到组分d1-d8;
(5)将组分d8过sephadexlh-20凝胶柱层析,用1:1v/v的二氯甲烷-甲醇洗脱,得到组分d-8-1和d-8-2;
(6)将组分d-8-2经ymc-packods-a色谱柱,用95%-100%v/v的甲醇水溶液梯度洗脱,检测波长为210nm,收集保留时间27.0min的组分,除去溶剂得到南欧大戟提取成分纯品。
步骤(1)中,南欧大戟与乙醇的料液比为1:2.5(w/v)。
步骤(1)中,所述南欧大戟粉碎至粒度直径小于3mm。
步骤(1)中,所述浸提次数为4次,每次时间为7天。
步骤(1)中,浓缩为原体积的1/50-1/70。
步骤(2)中,所述粗浸膏与水的体积比为1:1-2。
步骤(2)中,所述乙酸乙酯与水的体积比为1:1。
步骤(2)中,所述乙酸乙酯萃取次数为1-3次。
步骤(6)中,流速3.0ml/min。
一种上述三萜类化合物在制备抗肿瘤、抗癌药物中的应用。所述肿瘤选自但不限于宫颈癌、乳腺癌和肺癌。
本发明具有以下优点:
本发明提供了一种从南欧大戟中提取的三萜类化合物以及其制备方法和在制备抗肿瘤药物中的应用。该三萜类化合物属于变异的何伯烷型三萜,且在3位和22位有双羟基取代。相对于已报道的西米杜鹃醇来讲,该化合物在c-22位多了一个羟基取代。该三萜类化合物能够显著抑制肿瘤细胞a549、hela、mcf-7和mda-mb-231的生长和导致其死亡,其作用机制是通过诱导细胞凋亡和引起细胞周期阻滞而导致肿瘤细胞死亡。本发明的提取的化合物为新型抗肿瘤药物的研发提供了物质基础,有利于南欧大戟的药用价值的进一步开发。
附图说明
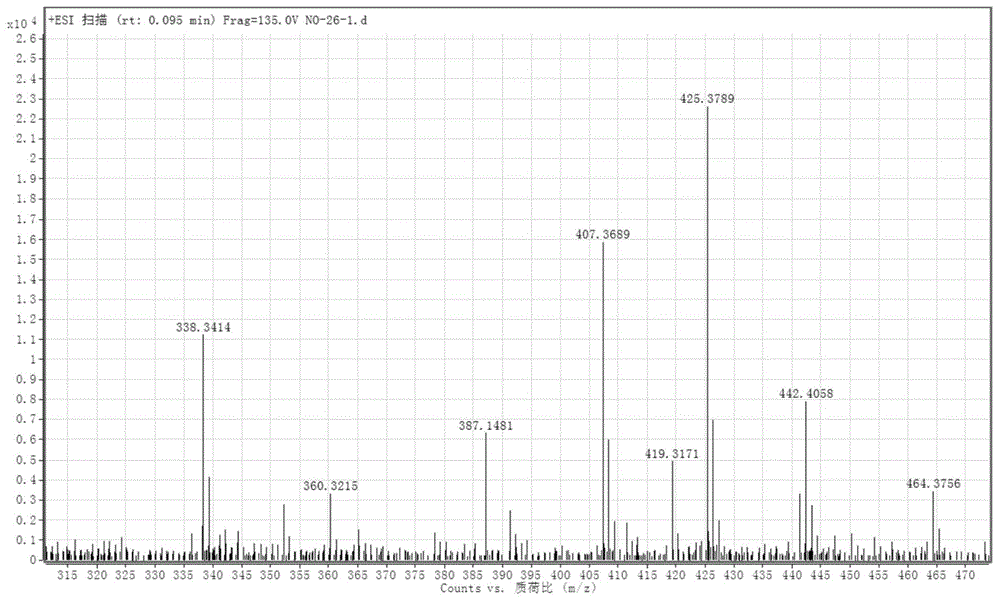
图1是西米杜鹃二醇的高分辨质谱;
图2是西米杜鹃二醇的氢谱;
图3是西米杜鹃二醇的碳谱;
图4是西米杜鹃二醇的二维cosy谱;
图5是西米杜鹃二醇的二维hsqc谱;
图6是西米杜鹃二醇的二维hmbc谱;
图7是西米杜鹃二醇的二维roesy谱;
图8是西米杜鹃二醇诱导hela细胞形态学的变化;
图9是西米杜鹃二醇显著诱导hela细胞凋亡;
图10是西米杜鹃二醇造成hela细胞周期阻滞。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
实施例1西米杜鹃二醇的制备
10kg南欧大戟干燥全草,粉碎至粒度直径小于3mm,用95%的乙醇浸泡提取4次,每次25l,每次7天。将乙醇提取液合并,减压浓缩得到粗浸膏1.5kg;
粗浸膏悬浮于2.0l的水中,然后用乙酸乙酯萃取三次,每次2.0l。合并乙酸乙酯萃取相,减压浓缩得到乙酸乙酯萃取物470g;
将该萃取物进行d101大孔树脂柱层析,用乙醇-水(v/v,30%、50%、80%和95%)洗脱,依次得到4个组分a-d;
组分d(190g)经正相硅胶柱层析,用石油醚-乙酸乙酯(v/v,20:1、15:1、10:1、7:1、5:1)洗脱,根据薄层层析分析洗脱液成分,收集得到组分d1-d8;
组分d8经凝胶(sephadexlh-20)柱层析,用二氯甲烷-甲醇(v/v,1:1)洗脱,得到2个组分d-8-1和d-8-2。
组分d-8-2经制备液相色谱纯化(色谱柱:ymc-packods-a,10×250mm,流速:3.0ml/min,检测波长为210nm),用甲醇-水(v/v,95%-100%)梯度洗脱,收集保留时间27.0min的组分,除去溶剂得到南欧大戟提取新成分纯品7.2mg。
南欧大戟提取新成分的物理性质:白色无定形粉末,易溶于乙腈、二甲亚砜和氯仿,不溶于水;比旋光度[α]d25+54.4(c0.72,chcl3);ecd(c0.04,mecn)λ(δε)210(+2.94)nm。
实施例2西米杜鹃二醇的结构鉴定
通过解析高分辨质谱(图1)得到脱水的分子离子峰m/z425.3774([m+h–h2o]+,理论值425.3778),结合碳谱(图3)数据确定了南欧大戟提取新成分的分子式为c30h50o2。通过进一步解析其氢谱(图2)和碳谱,以及与西米杜鹃醇核磁数据对比,发现该化合物的平面结构为变异的何伯烷型三萜(e:b-friedo-hopanetypetriterpenoid)。
表1提取成分的氢谱(600mhz,cdcl3)和碳谱(150mhz,cdcl3)数据
通过解析二维核磁谱图,包括cosy,hsqc,hmbc和roesy(图4-7)最终确定了南欧大戟提取新成分的结构。相对于西米杜鹃醇来讲,该成分在c-22位多了一个羟基取代。通过比对实验和理论计算ecd数据,确定了如下式所示的南欧大戟提取新成分的绝对构型,简称为西米杜鹃二醇:
实施例3西米杜鹃二醇的抗肿瘤活性
1.对不同体外肿瘤细胞抑制
采用mtt法将西米杜鹃二醇进行体外肿瘤细胞存活率测试,所筛选的肿瘤细胞株为hela、a549、mcf-7和mda-mb-231。具体过程如下:用dmso将西米杜鹃二醇配置成20mm的母液,然后用培养基稀释至0.50-45.0μm。将hela、mcf-7和mda-mb-231细胞用dmem(gibco)培养基培养,a549细胞用rpmi-1640(gibco)培养基培养,置于37℃含5%co2的细胞培养箱内。取处于对数生长期的细胞接种于96孔板中(100μl/孔,0.4-0.6×104细胞/孔),然后在37℃孵育24小时。弃去旧培养基,然后加入含有不同浓度西米杜鹃二醇的新鲜培养基,在37℃培养48小时。培养完毕,每孔加入10μl的3-(4,5-二甲基噻唑-2-酰基)-2,5-二苯基-溴化三唑(mtt)溶液(5mg/ml,sigma),然后在37℃下继续培养4小时。弃上清液后,每孔加入100μldmso溶液,使结晶物充分溶解。最后用spark酶标仪在490nm波长处测试每孔的吸收值。以阿霉素为阳性对照。
表2西米杜鹃二醇的体外抗肿瘤活性实验数据
结果显示,式(i)所示的西米杜鹃二醇对四种肿瘤细胞均具有明显的抑制活性,对hela和a549细胞的活性尤其显著,它们的ic50值如表2所示。因此本发明如式(i)所示的西米杜鹃二醇能用于制备抗肿瘤药物。
2.对hela细胞的诱导凋亡
dapi染色实验:将hela细胞接种于共聚焦培养皿上,培养24小时分别加入dmso(0.1%)和最终浓度为3.0,6.0和12.0μm的西米杜鹃二醇,共培养48小时。培养完毕后,加入4%的多聚甲醛,反应10min,然后用pbs液洗涤3次。最后,细胞与dapi染料(碧云天,江苏,中国)在黑暗中反应15min,洗涤3次,然后用倒置荧光显微镜(leicadmi8,德国)拍照。如图1所示,与阴性对照相比,用西米杜鹃二醇处理过的hela细胞出现明显的细胞皱缩、核固缩和核碎裂等细胞形态学的变化,尤其在6.0和12.0μm药物浓度处理时。dapi实验表明,西米杜鹃二醇能够有效的诱导hela细胞凋亡。
采用流式细胞术结合annexinv/pi双染实验考察凋亡的比例:将处于对数生长期的hela细胞接种于6孔板中,每孔约20万个细胞,于37℃培养24小时,然后加入最终浓度为3.0、6.0和12.0μm的西米杜鹃二醇,以及阴性对照dmso(0.1%),共培养48小时。细胞收集后用pbs液洗涤2次,然后轻轻的悬浮在结合溶液中。最后,hela细胞与annexin-v/fitc(5μl)和pi(5μl)(bdbiosciences,usa)在室温和黑暗环境下反应15min,然后用流式细胞仪(aceabiosciences,usa)分析细胞凋亡信息。凋亡细胞的比例通过novoexpress分析软件处理后获得。如图2所示,阴性对照dmso和3.0μm的西米杜鹃二醇的总凋亡比例(包括早凋和晚凋)分别为7.98%和9.83%,然而当西米杜鹃二醇的浓度增加到6.0和12.0μm时,hela细胞总的凋亡比例分别增加到27.27%和49.94%。该实验表明西米杜鹃二醇能够浓度依赖性的诱导hela细胞凋亡。
采用流式细胞术进一步验证了西米杜鹃二醇阻滞hela细胞的时期:具体实验如下:将hela细胞接种于6孔板中,每孔约20万个细胞,在37℃下培养24小时。分别加入最终浓度为3.0、6.0和12.0μm的西米杜鹃二醇,以及阴性对照dmso,共培养36小时。收集细胞,离心除去培养基,用pbs洗涤细胞2次,然后用70%冰冷的乙醇在4℃下固定过夜。移除乙醇,将细胞重新悬浮在冰冷的洗涤溶液中,离心。将细胞与pi染料(genview,usa)在37℃的黑暗环境中反应30min,用流式细胞仪检测处于不同周期阶段的细胞,然后用novoexpress软件处理数据。如图3所示,西米杜鹃二醇能够明显浓度依赖性的将hela细胞阻滞在s和g2生长期。
- 还没有人留言评论。精彩留言会获得点赞!