氨基酸纳米水凝胶及其制备方法和应用与流程
本发明涉及非生物抗体技术领域,更具体地,涉及一种氨基酸纳米水凝胶及其制备方法和应用。
背景技术:
抗体目前在临床检测、疾病的诊断与治疗、抗原及蛋白的纯化等方面发挥着重要作用。人工制备天然抗体主要通过多克隆抗体、单克隆抗体以及基因工程抗体等方法获得,其中单克隆抗体在临床诊断检测中应用最为普遍,但制备周期长、成本高,难以规模化生产,因而价格昂贵,且不能循环使用;另一方面抗体和蛋白质一样,对环境敏感,稳定性差,在高温及恶劣条件下容易失活,这又给储存、运输及应用带来极大不便。因此研究者们正积极致力于寻找制备简单、性能稳定、特异性可与天然抗体相媲美的非生物抗体。
分子印迹技术常被用于研究及制备非生物抗体,它是在模拟自然界抗原-抗体、酶-底物相互作用以及仿生科学的基础上发展起来的一项技术,可以在聚合物中引入在空间和结合位点上与特定目标蛋白相匹配的分子识别孔穴及位点,因此可特异性识别目标蛋白。例如,公开号为cn1911975a的专利申请公开了一种蛋白质印迹两亲性聚合物及其制备方法,聚合物采用溶菌酶和牛血清白蛋白为模板分子、以n-[3-(二甲氨基)丙基]甲基丙烯酰胺和甲基丙烯酸为功能单体共聚而成,经模板洗脱后,具有印迹空穴,而且聚合物上的叔胺和羧基可以与模板蛋白上的基团发生静电作用,对模板蛋白溶菌酶和牛血清白蛋白具有专一识别能力。授权公告号为cn102532408b的专利是关于一种温敏性磁性蛋白质印迹纳米球的制备方法,该印迹纳米球既具有与模板蛋白相匹配的印迹空穴,又具有温敏性和在外界磁场下迅速分离的特性,可用于高丰度蛋白质成分的去除或富集。公开号为cn101173028a的专利申请公开了带阳离子识别基团的蛋白质印迹树脂的制备方法及应用,采用克隆的猪亲环素18蛋白质作为模板蛋白,克服了天然微量蛋白质作为模板分子的瓶颈,同时树脂成球与分子印迹技术是分步进行的,可以减少模板分子在洗脱过程中的破坏。公开号为cn104941602a的专利申请公开了一种蛋白质抗原决定基分子印迹材料及其制备和应用,该分子印迹材料采用目标蛋白所对应的一段特异性肽段为模板分子,可以克服天然蛋白质量微的瓶颈。但是,上述这些采用分子印迹技术制备具有印迹孔穴的聚合物,在制备过程中均必须采用模板蛋白、克隆蛋白或者特异性肽段作为模板分子,而这些价格昂贵、理化性质不稳定的模板蛋白分子在印迹过程中会因采用酸性、极性溶剂洗脱而引起结构变性,导致无法重复使用;而且模板洗脱往往存在洗脱不完全的现象,这会导致印迹孔穴的不均一,影响聚合物的吸附性,甚至会在聚合物吸附目标蛋白时发生泄露的现象,导致吸附量不准确等问题。此外,蛋白质本身结构复杂,作用位点多,制备的聚合物三维网络结构不稳定,容易造成识别位点的坍塌。
纳米聚合物,是制备非生物抗体的新方向。它在制备过程中不加模板分子,是由功能单体、引发剂、交联剂相互作用形成的高分子聚合物。
学者的研究结果显示,除印迹空穴外,功能单体在聚合物识别过程中也起到关键作用,因此,开发研究一种新的功能单体,使其聚合获得的纳米聚合物,能够克服现有技术存在的上述缺陷,是人们所十分期望的。
技术实现要素:
本发明为克服上述现有技术所述的缺陷,提供一种氨基酸纳米水凝胶,提供的氨基酸纳米水凝胶制备过程中不加模板分子,无需模板洗脱,结构稳定,呈现温度响应性,而且其氨基酸侧链可以与蛋白质之间发生天然蛋白-天然蛋白的相互作用,对人血清蛋白具有特异性识别能力。
本发明的另一目的在于提供上述氨基酸纳米水凝胶的制备方法。
本发明的又一目的在于提供上述氨基酸纳米水凝胶在吸附蛋白中的应用。
为解决上述技术问题,本发明采用的技术方案是:
氨基酸纳米水凝胶,为聚合物a或聚合物b;
所述聚合物a由式(ⅰ)、式(ⅱ)和式(ⅲ)所示的片段构成;
所述聚合物b由式(ⅳ)、式(ⅱ)、式(ⅴ)和式(ⅲ)所示的片段构成;
其中:r1代表c6h5,或ch(ch3)2;r2代表(ch2)2cn3h5+,或c3n2h3。
上述c6h5表示苯基。上述ch(ch3)表示异丙基。
上述(ch2)2cn3h5+表示
优选地,所述聚合物a的数均分子量为20kda~50kda,平均粒径为100~150nm;临界相变温度为30~32℃。
优选地,所述聚合物b的数均分子量为20kda~50kda,平均粒径为60~75nm,临界相变温度为13~14℃。
聚合物a为疏水性氨基酸纳米水凝胶。聚合物b为带正电荷氨基酸纳米水凝胶。
所述聚合物a的制备方法包括如下步骤:
s1.将n-丙烯酰基-l-疏水性氨基酸功能单体、功能单体n-异丙基丙烯酰胺、交联剂和引发剂,溶于阴离子表面活性剂水溶液中,得到反应液;
s2.将步骤s1.的反应液,在惰性氛围中,反应,获得聚合液,然后从反应体系中收集所述聚合物a。
步骤s2.所述惰性氛围可以为氮气氛围。步骤s2.的反应温度为50~70℃,反应温度为3~6h。
优选地,步骤s2.中所述收集方法为透析法。具体包括如下步骤:
得到的聚合液装入透析袋中(mw12000~14000)透析2~6天,优选4天,每天换水1~3次,优选2次;
收集透析膜内部的透析物,冷冻干燥,得到聚合物a,为疏水性氨基酸纳米水凝胶。
优选地,所述的n-丙烯酰基-l-疏水性氨基酸功能单体为n-丙烯酰基-l-苯丙氨酸或n-丙烯酰基-l-亮氨酸。
优选地,所述阴离子表面活性剂选自十二烷基硫酸钠、十二烷基磺酸钠、硬脂酸钠或歧化松香酸钠中的一种以上。
优选地,步骤s1.中所述的交联剂选自n,n’-亚甲基双丙烯酰胺、二甲基丙烯酸乙二醇酯、三羟甲基丙烷三甲基丙烯酸酯或二乙烯基苯中的一种以上。
优选地,步骤s1.中所述的引发剂选自过硫酸铵、过硫酸钠、偶氮二异丁腈或过氧化二苯甲酰中的一种以上。
优选地,各个组份的摩尔百分比为:
n-丙烯酰基-l-疏水性氨基酸功能单体2~47%;
功能单体n-异丙基丙烯酰胺50~97%;
交联剂1~3%;
其中,各单体和交联剂的摩尔百分比之和为100%;
步骤s1.中所述反应液中引发剂的质量百分比浓度为0.01~0.1%;
所述反应液中表面活性剂的质量百分比浓度为0.01~0.1%,所述反应液中,上述n-丙烯酰基-l-疏水性氨基酸功能单体、功能单体n-异丙基丙烯酰胺和交联剂的总摩尔数50~70毫摩尔/l。
所述聚合物b的制备方法包括如下步骤:
p1.将n-丙烯酰基-l-带正电荷氨基酸功能单体、功能单体n-异丙基丙烯酰胺、交联剂溶于含有阳离子表面活性剂的水溶液中,获得水溶液a;
将功能单体n-叔丁基丙烯酰胺溶于醇类溶剂中,引发剂溶于酮类溶剂中,然后与水溶液a混合,得到反应液;
p2.将步骤p1.的反应液在惰性氛围中,反应,获得聚合液,然后从反应体系中收集聚合物b。
步骤p2.所述惰性氛围可以为氮气氛围。步骤s2.的反应温度为50~70℃,反应温度为3~6h。
优选地,步骤p2.中所述收集方法为透析法。具体包括如下步骤:
得到的聚合液装入透析袋中(mw12000~14000)透析2~6天,优选4天,每天换水1~3次,优选2次;
收集透析膜内部的透析物,冷冻干燥,得到聚合物b,为带正电荷氨基酸纳米水凝胶。
优选地,所述的n-丙烯酰基-l-带正电荷氨基酸功能单体为n-丙烯酰基-l-精氨酸或n-丙烯酰基-l-组氨酸。
优选地,步骤p1.中所述的交联剂选自n,n’-亚甲基双丙烯酰胺、二甲基丙烯酸乙二醇酯、三羟甲基丙烷三甲基丙烯酸酯或二乙烯基苯中的一种或多种。
优选地,步骤p1.中所述的引发剂选自过硫酸铵、过硫酸钠、偶氮二异丁腈或过氧化二苯甲酰中的一种以上。
优选地,所述的阳离子表面活性剂选自十六烷基三甲基溴化铵、十八烷基三甲基氯化铵、十二烷基三甲基氯化铵或十二烷基二甲基苄基氯化铵中的一种或多种。
所述的醇类溶剂优选乙醇、甲醇、异丙醇或正丁醇。
所述的酮类溶剂优选丙酮、丁酮、乙酰丙酮或氯丙酮。
优选地,各个组份的摩尔百分比为:
其中,各单体和交联剂的摩尔百分比之和为100%;
含有阳离子表面活性剂的水溶液中,阳离子表面活性剂的质量百分比浓度为0.01~0.1%;
所述的水溶液a中,n-丙烯酰基-l-带正电荷氨基酸功能单体、功能单体n-异丙基丙烯酰胺、功能单体n-叔丁基丙烯酰胺和交联剂的总摩尔数为50~70毫摩尔/l;
所述的醇类溶剂中,功能单体n-叔丁基丙烯酰胺的摩尔数为1.0~1.3毫摩尔/ml;
所述的酮类溶剂中,引发剂的质量浓度为40~80毫克/ml;
含有功能单体n-叔丁基丙烯酰胺的醇类溶剂、含有引发剂的酮类溶剂与水溶液a的体积比为∶醇类溶剂∶酮类溶剂∶水溶液a=2~3:1~2:100。
本发明还保护上述的氨基酸纳米水凝胶在吸附蛋白中的应用,所述蛋白为人血清蛋白及生物标志物β-淀粉样蛋白、脑钠肽或胃泌素释放肽前体。
本发明所述的氨基酸纳米水凝胶,具有氨基酸侧链,可以与蛋白质之间发生类似天然蛋白-天然蛋白的相互作用,对人血清蛋白等均具有特异性识别能力,而且精氨酸纳米水凝胶对人血清蛋白的特异性,明显优于其他三种氨基酸纳米水凝胶,可用于吸附目标蛋白,如人血清蛋白及生物标志物β-淀粉样蛋白、脑钠肽、胃泌素释放肽前体等,具有发展为一种性能稳定的人工模拟抗体或蛋白质提纯高分子材料的潜力。
与现有技术相比,本发明的有益效果是:
通过改进功能单体,提高了聚合物的识别能力,所得的纳米聚合物具有氨基酸侧链,可以与目标蛋白质发挥类似天然蛋白-天然蛋白的相互作用。同时,为提高聚合物的生物相容性,发挥类似天然抗体的性能,可将纳米聚合物制备成纳米水凝胶:(1)其粒径通常为1~1000nm之间,比表面积大,表面的功能基团可偶联有特定作用的组分,可瞬时响应微环境中的刺激,如温度、光、ph值等;(2)稳定性好,内部的交联网状结构使其比纳米胶束、纳米囊泡更稳定;(3)含水量高,类似于生物组织,具有良好的生物相容性。
本发明制备方法简单,反应条件温和,可在水溶液中制备;采用温敏性的n-异丙基丙烯酰胺作为功能单体,因此所得的四种氨基酸纳米水凝胶呈现温度响应性,apa@nps和a-leu@nps,具有低临界相变温度(lcst)值,而a-arg@nps和a-his@nps具有高临界相变温度(ucst)值,而且其氨基酸侧链可以与蛋白质之间发生天然蛋白-天然蛋白的相互作用,对人血清蛋白具有特异性识别能力,尤其是精氨酸纳米聚合物对人血清蛋白的特异性,具有发展为一种性能稳定的人工模拟抗体或蛋白质提纯高分子材料的潜力。
附图说明
图1为本发明实施例1和实施例2的氨基酸纳米水凝胶的粒径随温度变化的情况。
图2为本发明实施例1的苯丙氨酸纳米水凝胶的核磁共振氢谱图。
图3为本发明实施例1的亮氨酸纳米水凝胶的核磁共振氢谱图。
图4为本发明实施例2的精氨酸纳米水凝胶的核磁共振氢谱图。
图5为本发明实施例2的组氨酸纳米水凝胶的核磁共振氢谱图。
图6为本发明实施例1和实施例2的氨基酸纳米水凝胶对五种蛋白质的结合率。
图7为本发明实施例1的苯丙氨酸纳米水凝胶对人血清蛋白、卵清蛋白、α-乳白蛋白的mst微量热泳动图。图7中,横坐标轴的刻度值依次为1×10-2,1×10-1,1×100,1×101,1×102,1×103,1×104,1×105,单位为nmol/l。
具体实施方式
下面结合具体实施方式对本发明作进一步的说明。
本发明实施例的附图中相同或相似的标号对应相同或相似的部件;在本发明的描述中,需要理解的是,若有术语“上”、“下”、“左”、“右”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此附图中描述位置关系的用语仅用于示例性说明,不能理解为对本专利的限制。
此外,若有“第一”、“第二”等术语仅用于描述目的,主要是用于区分不同的装置、元件或组成部分(具体的种类和构造可能相同也可能不同),并非用于表明或暗示所指示装置、元件或组成部分的相对重要性和数量,而不能理解为指示或者暗示相对重要性。
实施例1
制备聚合物a,即疏水性氨基酸纳米水凝胶,包括苯丙氨酸纳米水凝胶和亮氨酸纳米水凝胶。
1.制备功能单体n-丙烯酰基-l-苯丙氨酸
3.63g(0.020mol)l-苯丙氨酸(l-phe)和1.6g(0.04mol)氢氧化钠溶于20ml水中,在0℃以下,边搅拌边缓慢滴加1.75ml(0.022mol)丙烯酰氯,0.5h内滴完。滴加完毕后,室温继续搅拌6h。用浓盐酸调至ph2,抽滤,水洗至中性,50℃真空干燥24h,得白色粉末状固体,为n-丙烯酰基-l-苯丙氨酸(apa),产率为45.7%(2.74g)。
2.制备功能单体n-丙烯酰基-l-亮氨酸
2.6238g(0.02mol)l-亮氨酸和1.6g(0.04mol)氢氧化钠溶于30ml水中,在0℃以下,边搅拌边缓慢滴加1.625ml(0.02mol)丙烯酰氯,0.5h内滴完。滴加完毕后,室温下继续搅拌1.0h。用浓盐酸调节ph至2,乙酸乙酯4×30ml萃取。乙酸乙酯层经无水硫酸镁干燥,过滤,减压蒸去溶剂,得n-丙烯酰基-l-亮氨酸(a-leu),无色粘稠液体,产率53.78%。
3.制备疏水性氨基酸纳米水凝胶
n-丙烯酰基-l-苯丙氨酸(apa)(35.6mg,5mol%),n-异丙基丙烯酰胺(342mg,93mol%),n,n’-亚甲基双丙烯酰胺(10mg,2mol%),过硫酸铵(30mg)溶于含10mg十二烷基硫酸钠的50ml水中。
通氮气20min,于65℃油浴中加热反应3h。得到的聚合液装入透析袋中(mw12000~14000)透析4天,每天换水2次。收集透析膜内部的透析物,冷冻干燥,得到苯丙氨酸纳米水凝胶(apa@np)s。
术语“apa@nps”,指的是苯丙氨酸纳米水凝胶。
同法,制得亮氨酸纳米水凝胶(a-leu@nps),但功能单体n-丙烯酰基-l-亮氨酸(a-leu,30.1mg,5mol%)代替n-丙烯酰基-l-苯丙氨酸(apa)。
术语“a-leu@nps”,指的是亮氨酸纳米水凝胶。
实施例1-2
制备聚合物a,即疏水性氨基酸纳米水凝胶,包括苯丙氨酸纳米水凝胶和亮氨酸纳米水凝胶。本实施例制备苯丙氨酸纳米水凝胶的步骤如下:
n-丙烯酰基-l-苯丙氨酸(apa)(285mg,40mol%),n-异丙基丙烯酰胺(213.3mg,58mol%),n,n’-亚甲基双丙烯酰胺(10mg,2mol%),硫酸铵(30mg)溶于含10mg十二烷基硫酸钠的50ml水中。
通氮气20min,于65℃油浴中加热反应3h。得到的聚合液装入透析袋中(mw12000~14000)透析4天,每天换水2次。收集透析膜内部的透析物,冷冻干燥,得到苯丙氨酸纳米水凝胶(apa@nps)。
同法,制得亮氨酸纳米水凝胶(a-leu@nps),但功能单体n-丙烯酰基-l-亮氨酸(a-leu,240.7mg,40mol%)代替n-丙烯酰基-l-苯丙氨酸(apa)。
实施例2
制备聚合物b,即带正电荷氨基酸纳米水凝胶,包括精氨酸纳米水凝胶和组氨酸纳米水凝胶。
1、制备功能单体n-丙烯酰基-精氨酸
1.7420g(0.01mol)l-精氨酸和2.12g(0.02mol)碳酸钠溶于30ml水中,放置在0℃以下,边搅拌边缓慢滴加0.95ml(0.012mol)丙烯酰氯,0.5h内滴完。滴加完毕后,室温下继续搅拌3.0h。用浓盐酸调节ph至2,经氯化钠饱和溶液洗涤后,用乙酸乙酯:异丙醇(1:1)2×40ml萃取,有机层经无水硫酸镁干燥,过滤,减压蒸去溶剂。残留物经硅胶柱色谱[v(氯仿):v(甲醇)=1:1]分离,得到n-丙烯酰基-精氨酸(a-arg),黄色液体,产率15.00%。
2、制备功能单体n-丙烯酰基-组氨酸
3.1010g(0.02mol)l-组氨酸和1.605g(0.04mol)氢氧化钠溶于10ml水中,在0℃以下,边搅拌边缓慢滴加1.625ml(0.02mol)丙烯酰氯,0.5h内滴完。滴加完毕后,室温下继续搅拌4.0h。用浓盐酸调节ph至2,加入200ml丙酮,过滤,滤液减压蒸除丙酮。残留物与沉淀物经硅胶柱色谱[v(氯仿):v(甲醇)=4:1]分离,得到n-丙烯酰基-组氨酸(a-his),黄色液体,产率17.70%。
3、制备带正电荷氨基酸纳米水凝胶
n-丙烯酰基-l-精氨酸(a-arg)(37.1mg,5mol%),n-异丙基丙烯酰胺(194.9mg,53mol%),n,n’-亚甲基双丙烯酰胺(10mg,2mol%)溶于含20mg十六烷基三甲基溴化铵的50ml水中。n-叔丁基丙烯酰胺(165.3mg,40mol%)溶于1ml乙醇中,偶氮二异丁腈(30mg)溶于0.5ml丙酮中,与上述水溶液混合均匀,于65℃油浴中加热反应3h。得到的聚合液装入透析袋中(mw12000~14000)透析4天,每天换水2次。收集透析膜内部的透析物,冷冻干燥,得到精氨酸纳米水凝胶(a-arg@nps)。
术语“a-arg@nps”,指的是精氨酸纳米水凝胶。
同法,制得组氨酸纳米水凝胶(a-his@nps),但功能单体n-丙烯酰基-l-组氨酸(a-his,34mg,5mol%)代替n-丙烯酰基-l-精氨酸(a-arg)。
术语“a-his@nps”,指的是组氨酸纳米水凝胶。
实施例2-2
制备聚合物b,即带正电荷氨基酸纳米水凝胶,包括精氨酸纳米水凝胶和组氨酸纳米水凝胶。本实施例制备精氨酸纳米水凝胶的步骤如下:
n-丙烯酰基-l-精氨酸(a-arg)(296.7mg,40mol%),n-异丙基丙烯酰胺(66.19mg,18mol%),n,n’-亚甲基双丙烯酰胺(10mg,2mol%)溶于含20mg十六烷基三甲基溴化铵的50ml水中。n-叔丁基丙烯酰胺(165.3mg,40mol%)溶于1ml乙醇中,偶氮二异丁腈(30mg)溶于0.5ml丙酮中,与上述水溶液混合均匀,于65℃油浴中加热反应3h。得到的聚合液装入透析袋中(mw12000~14000)透析4天,每天换水2次。收集透析膜内部的透析物,冷冻干燥,得到精氨酸纳米水凝胶(a-arg@nps)。
同法,制得组氨酸纳米水凝胶(a-his@nps),但功能单体n-丙烯酰基-l-组氨酸(a-his,271.7mg,40mol%)代替n-丙烯酰基-l-精氨酸(a-arg)。
结构表征与性能测试
1.平均粒径
采用zetasizernanozs马尔文粒径测定仪进行粒径测定,测定结果显示,实施例1制备的苯丙氨酸纳米水凝胶(apa@nps)和亮氨酸纳米水凝胶(a-leu@nps)在水中(25℃)均能稳定分散,平均粒径分别为147.10nm和105.20nm;实施例2制备的精氨酸纳米水凝胶(a-arg@nps)和组氨酸纳米水凝胶(a-his@nps)在水中(18℃)均能稳定分散,平均粒径分别为65.32nm和73.44nm。
2.温度对纳米水凝胶粒径的影响
采用zetasizernanozs马尔文粒径测定仪通过改变温度测定纳米水凝胶的粒径变化情况。结果如图1所示,实施例1制备的apa@nps的粒径,随温度升高粒径缓慢减小,在30~34℃之间粒径的减小程度明显,随后随着温度升高,粒径平稳,具有低临界相变温度(lcst)值,其lcst值为32℃;实施例1制备的a-leu@nps的粒径随温度的变化趋势与apa@nps的类似,lcst值为30℃。实施例2制备的a-arg@nps在6~14℃之间粒径缓慢减小,在14℃~18℃间粒径明显增加,18℃以后粒子之间出现聚集,粒径突增,但发生聚集的粒子在降低温度后又转变为稳定分散状态,粒径减小,无lcst值,但具有高临界相变温度(ucst)值,其ucst为14℃;实施例2制备的a-his@nps的粒径随温度的变化趋势与a-arg@nps,在6~13℃之间粒径减小,在13℃~18℃间有明显增加,18℃以后出现聚集,同样无lcst值,但具有ucst值,为13℃。因此实施例1制备的apa@nps和a-leu@nps、实施例2制备的a-arg@nps和a-his@nps均具有温度响应特性。
3.核磁共振氢谱
采用600mhz傅立叶变换超导核磁共振谱仪(美国varian公司)对氨基酸纳米水凝胶进行结构测定。
图2为实施例1制备的apa@nps的核磁氢谱图。组成apa@nps纳米水凝胶的功能单体包括n-异丙基丙烯酰胺以及n-丙烯酰基-l-苯丙氨酸,4.7~4.2ppm为功能单体n-丙烯酰基-l-苯丙氨酸中与羧基相连的次甲基上的质子信号,3.8ppm为功能单体n-异丙基丙烯酰胺中与酰胺基相连的次甲基的质子信号。
图3为实施例1制备的a-leu@nps的核磁氢谱图。组成a-leu@nps纳米水凝胶的功能单体包括n-异丙基丙烯酰胺以及n-丙烯酰基-l-亮氨酸,4.25ppm为n-丙烯酰基-l-亮氨酸中与羧基相连的次甲基上的质子信号,3.65ppm为功能单体n-异丙基丙烯酰胺中与酰胺基相连的次甲基的质子信号。
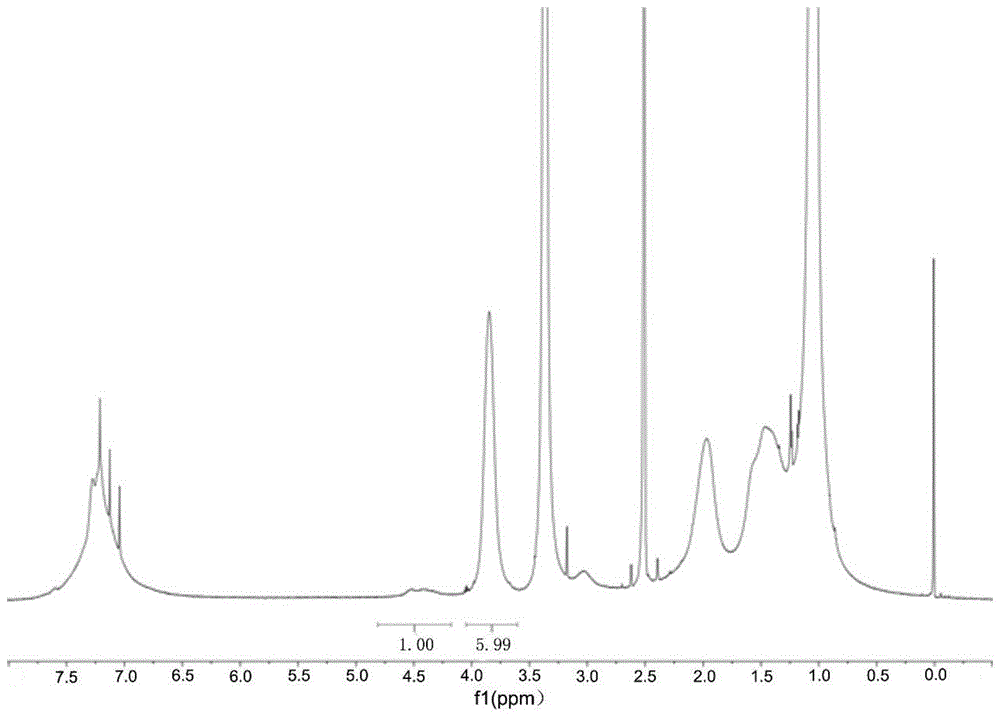
图4为实施例2制备的a-arg@nps的核磁氢谱图。组成a-arg@nps纳米水凝胶的功能单体包括n-异丙基丙烯酰胺、n-叔丁基丙烯酰胺以及n-丙烯酰基-l-精氨酸,4.1ppm为功能单体n-丙烯酰基-l-精氨酸中与羧基相连的次甲基上的质子信号,3.9ppm为功能单体n-异丙基丙烯酰胺中与酰胺基相连的次甲基的质子信号,1.3ppm处的信号归属于n-叔丁基丙烯酰胺的三个甲基质子。
图5为实施例2制备的a-his@nps的核磁氢谱图。组成a-his@nps纳米水凝胶的功能单体包括n-异丙基丙烯酰胺、n-叔丁基丙烯酰胺以及n-丙烯酰基-l-组氨酸,3.8ppm为功能单体n-异丙基丙烯酰胺中与酰胺基相连的次甲基的质子信号,3.1ppm为功能单体n-丙烯酰基-l-组氨酸中与羧基相连的次甲基上的质子信号,1.3ppm处的信号归属于n-叔丁基丙烯酰胺的三个甲基质子。
4.氨基酸纳米水凝胶对蛋白质的识别作用——紫外光谱法
人血清蛋白、卵清蛋白、α-乳白蛋白、肌红蛋白和溶菌酶分别溶于pbs(ph=7.4)溶液中,分别与实施例1和实施例2的四种氨基酸纳米水凝胶(apa@nps、a-leu@nps、a-arg@nps和a-his@nps)在4℃下孵育30min(蛋白浓度为2000μg/ml,纳米水凝胶浓度为1000μg/ml)。孵育30min后,样品超滤离心20min(mwco:100kda,10000r),移除纳米水凝胶和纳米水凝胶-蛋白复合物。用紫外光谱法于280nm测定滤液中游离蛋白质的浓度,按公式(1)计算纳米水凝胶和蛋白的结合率a(%)。
a=100×(1-c/c0)(1)
式中,c代表滤液中游离蛋白质的浓度(mg/ml),c0代表蛋白质的初始浓度(mg/ml)。
结果如图6所示,四种氨基酸纳米水凝胶(apa@nps、a-leu@nps、a-arg@nps和a-his@nps)对五种蛋白质的结合率均存在差异。四种氨基酸纳米水凝胶对来自人血浆的人血清蛋白的结合率均最高,分别为90.29%、90.13%、89.57%和79.76%;对来自鸡蛋清的卵清蛋白的结合率次之,分别为75.65%、74.63%、19.70%和39.54%,随后为来自牛奶的α-乳白蛋白、存在于肌肉组织的肌浆中的肌红蛋白和来自于鸡蛋清的溶菌酶。但a-arg@nps对人血清蛋白的特异性最强,明显强于其他三种氨基酸纳米水凝胶;a-arg@nps对人血清蛋白的结合率为89.57%,明显高于对卵清蛋白、α-乳白蛋白、肌红蛋白和溶菌酶的结合率低,分别为19.70%、-9.09%、11.12%和9.72%。因此四种氨基酸纳米水凝胶对人血浆蛋白中的人血清蛋白均具有特异性识别能力,但以n-丙烯酰基-精氨酸为功能单体的精氨酸纳米水凝胶对人血清蛋白的特异性,明显优于其他三种氨基酸纳米水凝胶,具有发展为一种性能稳定的人工模拟抗体或蛋白质提纯高分子材料的潜力。
5.苯丙氨酸纳米水凝胶对蛋白质的识别作用——微量热泳法
将人血清蛋白、卵清蛋白、α-乳白蛋白分别monolithnttm蛋白标记试剂盒通过氨基反应进行标记,标记后在45分钟内弃去多余染料(最终荧光标记浓度分别为20nm、50nm和20nm)。实施例1的苯丙氨酸纳米水凝胶(apa@nps)用缓冲溶液pbsbuffer(0.05%tween-20)在7.334mg/ml-0.22mg/ml之间梯度稀释。将10μlapa@nps分别和10μl标记荧光的人血清蛋白、卵清蛋白、α-乳白蛋白混合后静置反应5分钟,混合的样品装载到玻璃毛细管中,通过mst-nt.115设备进行分析。
结果如图7所示,apa@nps与蛋白结合的kd值大小为乳白蛋白>卵清蛋白>人血清蛋白。kd值越大,亲和力越低,因此苯丙氨酸纳米水凝胶对蛋白的亲和力趋势为人血清蛋白>卵清蛋白>乳白蛋白,结果与紫外光谱法分析结果一致,再次证明了苯丙氨酸纳米水凝胶对人血清蛋白的结合率最高。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!