一种由醇类化合物制备联芳烃类化合物的方法与流程
本发明涉及有机醇类化合物脱羟基偶联反应,具体涉及一种由醇类化合物脱羟基偶联构筑c-c键,制备联芳烃类化合物的方法。
背景技术:
联芳烃类化合物作为重要的骨架结构单元广泛存在于有机化合物中,也可作为天然产物、高分子聚合物和化学药物合成的起始原料,在有机合成化学中占有重要的地位。目前,工业上主要通过金属催化有机卤化物还原性偶联反应得到,而烷基卤化物一般由相应的醇类化合物合成,且醇类容易从商业来源购买。因此,发展一种有机合成中醇类化合物脱氧偶联方法直接构筑c-c键具有重要意义。迄今,由醇类化合物脱羟基偶联反应合成联芳烃类化合物的方法很少报道,主要涉及的催化剂有金属钛化合物、有机金属钒复合物、reo2i(pph3)2、以及铜促进的la/me3sicl反应体系。由于,钒、镧、铼等催化剂的价格昂贵,加之催化还原性偶联物的醇底物范围有限,这样,寻找更经济、活性更强的催化剂来实现这种新型转化,是利用富氧生物质原料生产高能量密度碳氢化合物的理想方法,具有重要的实用价值。
技术实现要素:
本发明的目的在于提供一种产率高、成本低、对环境友好的由醇类化合物脱羟基偶联构筑c-c键,制备联芳烃类化合物的方法制备方法。
本发明提供的一种由醇类化合物制备联芳烃类化合物的方法,反应方程式如下,其中,r为芳基;
制备联芳烃类化合物的方法,包括如下步骤:将醇类化合物、硼氢化钠、碘依次加入到盛有乙腈溶剂的反应管中,封管,加热到100摄氏度反应10-24小时,反应完备用水淬灭,有机相经无水硫酸镁干燥,旋转蒸出溶剂制得目标产物。
步骤中醇类化合物、硼氢化钠和碘的摩尔比为1:2-3:0.5-1;优选1:2:1。
与现有技术相比,本发明不需要贵金属催化剂,操作简便,产率高,产品易分离纯化,成本低、环境污染小等优点。
附图说明
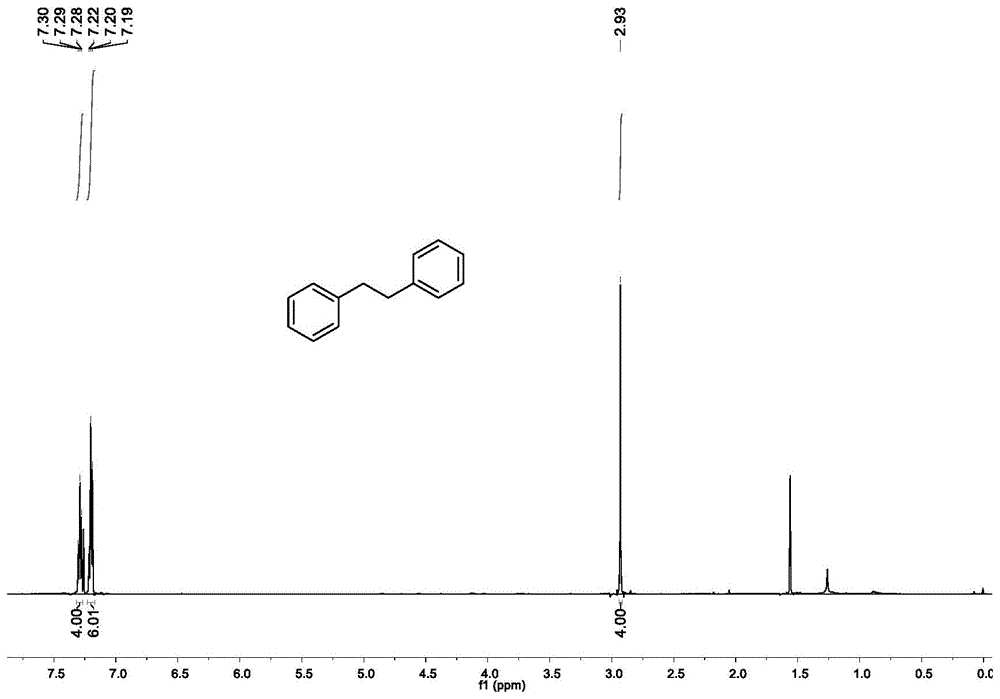
图1实施例1制备的1,2-二苯基乙烷的1hnmr图
图2实施例1制备的1,2-二苯基乙烷的13cnmr图
具体实施方式
以下仅仅为详细说明本发明而给出的具体实施例,这些实施例并非用于限制本发明的保护范围。
实施例1
在干燥的25ml反应管中,依次加入苄醇(0.5mmol),nabh4(1.0mmol),i2(0.5mmol),无水乙腈(2ml),封管,在100℃反应24小时,冷却到室温,加入10ml水淬灭反应,用乙酸乙酯萃取三次,合并有机相,用无水硫酸镁干燥,粗产物经过柱色谱分离纯化。得目标产物,产率:96%。1hnmr(600mhz,cdcl3)δ7.29(t,j=7.6hz,4h),7.20(t,j=7.8hz,6h),2.93(s,4h).13cnmr(151mhz,cdcl3)δ141.93(s),128.53(d,j=17.4hz),126.05(s),38.10(s).
实施例2
在干燥的25ml反应管中,依次加入对甲基苄醇(0.5mmol),nabh4(1.0mmol),i2(0.5mmol),无水乙腈(2ml),封管,反应物在100℃反应24小时,冷却到室温,加入10ml水淬灭反应,用乙酸乙酯萃取三次,合并有机相,无水硫酸镁干燥,粗产物经过柱色谱分离纯化。得目标产物,产率:95%。1hnmr(600mhz,cdcl3)δ7.11(s,8h),2.87(s,4h),2.34(s,6h).13cnmr(151mhz,cdcl3)δ139.00(s),135.43(s),129.14(s),128.43(s),37.79(s),21.17(s).
实施例3
在干燥的25ml反应管中,依次加入对2-氯苄醇(0.5mmol),nabh4(1.0mmol),i2(0.5mmol),无水乙腈(2ml),封管,反应物在100℃反应24小时,冷却到室温,加入10ml水淬灭反应,用乙酸乙酯萃取三次,合并有机相,无水硫酸镁干燥,粗产物经过柱色谱分离纯化。得目标产物,产率:89%。1hnmr(600mhz,cdcl3)δ7.36(d,j=4.9hz,2h),7.16(d,j=6.6hz,6h),3.04(s,4h).13cnmr(151mhz,cdcl3)δ139.08(s),134.14(s),130.75(s),129.61(s),127.70(s),126.91(s),33.96(s).
实施例4
在干燥的25ml反应管中,依次加入对3-氯苄醇(0.5mmol),nabh4(1.0mmol),i2(0.5mmol),无水乙腈(2ml),封管,反应物在100℃反应24小时,冷却到室温,加入10ml水淬灭反应,用乙酸乙酯萃取三次,合并有机相,无水硫酸镁干燥,粗产物经过柱色谱分离纯化。得目标产物,产率:89%。1hnmr(600mhz,cdcl3)δ7.25-7.12(m,6h),7.02(d,j=7.0hz,2h),2.88(s,4h).13cnmr(151mhz,cdcl3)δ143.31(s),134.27(s),129.78(s),128.70(s),126.80(s),126.45(s),37.39(s).
实施例5
在干燥的25ml反应管中,依次加入对4-氯苄醇(0.5mmol),nabh4(1.0mmol),i2(0.5mmol),无水乙腈(2ml),封管,反应物在100℃反应24小时,冷却到室温,加入10ml水淬灭反应,用乙酸乙酯萃取三次,合并有机相,无水硫酸镁干燥,粗产物经过柱色谱分离纯化。得目标产物,产率:89%。1hnmr(600mhz,cdcl3)δ7.22(d,j=7.2hz,4h),7.04(d,j=7.3hz,4h),2.85(s,4h).13cnmr(151mhz,dmso)δ141.25(s),129.10(s),128.59(s),126.20(s),77.37(s),77.16(s),76.95(s),42.07(s).
实施例6
在干燥的25ml反应管中,依次加入2,6-二氯苄醇(0.5mmol),nabh4(1.0mmol),i2(0.5mmol),无水乙腈(2ml),封管,反应物在100℃反应24小时,冷却到室温,加入10ml水淬灭反应,用乙酸乙酯萃取三次,合并有机相,无水硫酸镁干燥,粗产物经过柱色谱分离纯化。得目标产物,产率:81%。1hnmr(600mhz,cdcl3)δ7.26(d,j=8.0hz,4h),7.08(t,j=8.0hz,2h),3.24(s,4h).13cnmr(151mhz,cdcl3)δ136.78(s),136.03(s),128.29(s),128.02(s),29.82(s).
- 还没有人留言评论。精彩留言会获得点赞!