一种分离纯化脂肽类surfactin家族化合物的方法与流程
本发明涉及一种分离纯化脂肽类surfactin家族化合物的方法,属于发酵工程技术领域。
背景技术:
自1949年以来,已经超过30种结构不同的芽孢杆菌脂肽被陆续发现。这些脂肽化合物结构独特且高度相似,均是由非核糖体多肽途径(non-ribosomepeptidesynthases,nrps)合成的环七肽化合物。根据多肽中氨基酸序列和成环的方式不同,芽孢杆菌脂肽又分为四个家族:表面活性素(surfactin),丰原素(fengycin),伊枯草素(iturin),和kurstakin,且每个家族都包含有多种结构类似物。其中surfactin家族又可以进一步分为surfactin和地衣素,surfactin主要由枯草芽孢杆菌和解淀粉芽孢杆菌合成,而地衣素主要由地衣芽孢杆菌合成。脂肽类surfactin家族化合物因具有独特的生化、物化性质:如无毒或低毒,生物可降解,环境相容性好,耐受极端环境(温度,酸碱度,盐度),被认为在食品日化,环境工程,采油工业、化妆品及医药等领域具有广泛的应用前景,可以逐渐替代化学合成表面活性剂,契合当代绿色可持续发展的工业生产理念。
由于脂肽类surfactin家族化合物价格昂贵,且并未实现工业化生产,因此限制了surfactin家族的推广应用。而阻碍其实现工业化的主要原因是其下游分离纯化成本较高,目前surfactin分离纯化主要步骤为:(1)离心除菌(2)用盐酸调节ph至2使得surfactin家族沉淀;(3)有机溶剂提取沉淀中的surfactin家族化合物;(4)进一步通过柱层析、吸附树脂、超滤等进行精提;(5)旋蒸除去有机溶剂。其中(1-3)步为粗提过程,(4-5)为精提过程。在整个工艺流程中存在诸多问题,例如在粗提过程中存在的问题包括:(1)酸沉淀后蛋白质也会和surfactin家族化合物一同沉淀出来,且还会带入许多的小分子杂质,导致有机溶剂提取后纯度不高,文献报道一般在50%-70%之间。(2)有机溶剂提取后所得的surfactin产品溶于有机溶剂中,不利于后续产品的加工和储存。在精提过程中存在的问题包括:单元操作多,繁琐复杂,成本较高,不利于工业化应用的缺点,且过度依赖于昂贵的有机溶剂,例如甲醇、异丙醇、正丁醇、乙酸乙酯等,而这些有机溶剂通常价格昂贵且带有毒性,不仅提高了成本,而且还对环境造成污染,也不适用于食品及医药领域等产品的使用。
技术实现要素:
为了解决上述问题,本发明提供了一种分离纯化脂肽类surfactin家族化合物的方法。从发酵液中分离纯化surfactin家族化合物,需要通过一系列的操作去除掉杂质物质,而这里面主要包括一些蛋白质和小分子杂质(主要为培养基中的盐)。本发明采用有机溶剂沉淀法先去除蛋白质杂质,通过旋蒸回收有机溶剂,再采用酸沉淀的方式让surfactin家族化合物沉淀的同时去除小分子杂质,最后通过酸水洗的方式来去除掉surfactin家族化合物沉淀中剩余的杂质得到高纯度产品。利用本发明分离纯化surfactin家族化合物的方法,可以使得surfactin产品回收率最高可达96.3%,纯度可达94.2%;地衣素回收率可达到95.0%,纯度可达92.6%。
本发明的第一个目的是提供一种分离纯化脂肽类surfactin家族化合物的方法,所述方法的操作步骤如下:
(1)将发酵液离心除菌后得到上清,再向上清液中加入有机溶剂沉淀除蛋白,经抽滤除去蛋白质后旋蒸去除有机溶剂;
(2)在步骤(1)旋蒸除去有机溶剂后的发酵液中加入酸,利用酸沉淀和酸洗得到高纯度的脂肽类surfactin家族化合物产品。
在一种实施方式中,所述方法步骤(1)中的有机溶剂为乙醇。
在一种实施方式中,所述方法步骤(1)中在发酵液中加入有机溶剂乙醇,静置沉淀2-4h。
在一种实施方式中,所述方法步骤(1)采用有机溶剂沉淀蛋白质时,体系的ph值在6-9之间。
在一种实施方式中,所述方法步骤(1)中用0.48μm的滤膜抽滤除去蛋白质。
在一种实施方式中,所述方法步骤(1)中发酵液:有机溶剂体积比为1:1-1:2。
在一种实施方式中,所述方法步骤(1)中在40hpa,30℃旋蒸分离有机溶剂。
在一种实施方式中,所述方法步骤(2)中的酸是h2so4、hcl中任意一种。
在一种实施方式中,所述方法步骤(2)中在旋蒸除去有机溶剂后的发酵液中加入酸,直至体系的ph值为2-3。
在一种实施方式中,所述方法步骤(2)中离心收集沉淀时,转速为1200rpm,时间为5min。
在一种实施方式中,所述方法步骤(2)对沉淀物进行1-5次酸洗。
在一种实施方式中,所述方法步骤(2)对沉淀物进行两次酸洗。
在一种实施方式中,所述分离纯化脂肽类surfactin家族化合物的方法为:将发酵液离心除菌后得到上清,再向上清液中加入等体积的乙醇沉淀除蛋白,经抽滤除去蛋白质后旋蒸去除有机溶剂;向旋蒸除去有机溶剂后的发酵液中加入酸并调节ph为2,利用酸沉淀和酸洗得到高纯度的脂肽类surfactin家族化合物产品。
本发明的有益效果:
(1)本发明能够有效地分离纯化脂肽类surfactin家族化合物,在优选条件下,surfactin产品回收率可达96.3%,纯度可达94.2%;地衣素回收率可达到95.0%,纯度可达92.6%;
(2)本发明采用有机溶剂去除蛋白质再用酸性水溶液去除小分子杂质的方法分离纯化surfactin家族化合物,分离得到的产品纯度高,无需再进行精提,操作步骤简单,成本低,可应用于工业化的生产;
(3)本发明可以将酸洗后所得的脂肽类surfactin家族化合物沉淀直接冷冻干燥制成白色粉末状,且产品无需脱色,有利于产品的运输、储存和实际应用;
(4)本发明分离纯化脂肽类surfactin家族化合物的方法中所使用的试剂均无毒性,且用量少,还可回收利用,经济环保,符合环境友好的理念。
附图说明
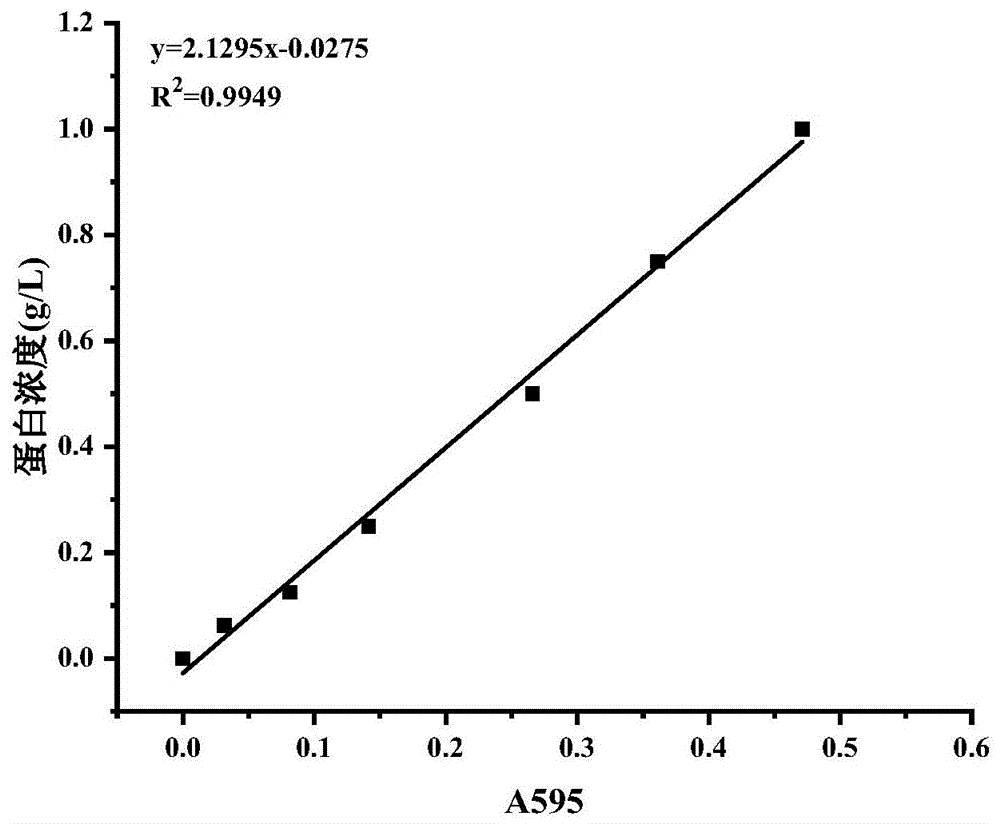
图1实施例2中的蛋白浓度标准曲线。
图2实施例4、实施例6中三种有机溶剂对除蛋白和产品回收的影响。
图3实施例5中不同浓度乙醇对除蛋白和产品回收的影响。
图4对比例1中不同硫酸铵浓度下对除蛋白和产品回收的影响。
图5对比例2中联用乙醇和硫酸铵除蛋白和产品回收的影响。
图6实施例7中不同ph对乙醇除蛋白和产品回收的影响。
图7实施例8中酸沉淀、实施例9中酸水洗对surfactin纯度和回收率的影响。
图8通过本发明方法和对比例3中的方法分离纯化的surfactin的外观比较;图8(a)为实施例9中的产品,图8(b)为对比例3中的产品。
具体实施方式
下面结合实施例与对比例,对本发明进行进一步的阐述。
实施例1制备发酵液
发酵菌种为bacillusamyloliquefaciensmt45,从中国茅台大曲中分离得到,并储存在中国普通微生物菌种保藏管理中心,保存编号为cgmcc:12593,已经在2017年5月10日公开在公开号为cn106635869a的专利中。
lb培养基的成分为:酵母粉5.0g/l、胰蛋白胨10.0g/l、nacl10.0g/l。
优化培养基成分:蔗糖65g/l,硝酸铵8g/l,蛋白胨3.73g/l,磷酸二氢钾4.08g/l,磷酸氢二钠10g/l,硫酸镁0.096g/l,氯化钙7μm,硫酸亚铁4μm,edta4μm。
将bacillusamyloliquefaciensmt45于lb培养基中活化,37℃,200rpm,培养12h后,按照2%的接种量接种于含50ml优化培养基的250ml烧瓶中,30℃,200rpm培养72h。收集发酵液,离心除菌后收集上清以备分离提取surfactin。
实施例2检测发酵液中蛋白质的含量
首先建立一条标准曲线,将牛血清清蛋白(bsa)配制成0、0.0625、0.125、0.25、0.5、0.75、1g/l的浓度,添加考马斯亮蓝g-250溶液后于595nm测不同牛血清蛋白溶液的吸光度。
将发酵液与考马斯亮蓝g-250反应后在595nm测吸光值,建立标曲计算出发酵液中蛋白质的含量。如图1所示,建立标曲为:y=2.1295x-0.0275,r2=0.9949。检测到初始发酵液中含有蛋白量0.129g/l。
实施例3计算surfactin的回收率和纯度、蛋白质去除率
回收率:
纯度:
蛋白去除率:
计算surfactin的含量:采用超高效液相色谱(uplc)对培养基中的surfactin浓度进行定量分析。采用watersbehc18色谱柱(100mm×2.1mm,1.7μmparticle)进行液相梯度分离;流动相a为0.1%甲酸水溶液,流动相b为hplc级甲醇;洗脱梯度:0.1min,70%b;0.1–2.0min,70%b;2.0–8.0min,70%–100%b;8.0–10min,100%b;10.1min,70%b,10.1–13min70%b;流速为0.3ml/min。紫外检测波长为205nm。配置不同浓度梯度的surfactin甲醇标准溶液,根据峰面积与浓度的变化,制作surfactin标准曲线。再根据插入法,由待测样品相应出峰时间的峰面积,计算surfactin含量。由于surfactin存在多种同系物,将其不同的同系物峰面积加和获得体系中的surfactin总量。
实施例4采用有机溶剂乙醇去除发酵液中的蛋白质
取25ml实施例1中制备的发酵液,向其中添加等体积比的有机溶剂乙醇,并采用hcl、naoh调节ph至6,静置沉淀2h后用0.48μm的滤膜抽滤除去蛋白质。所得发酵液和乙醇的混合物在40hpa,30℃旋蒸分离有机溶剂乙醇,将旋蒸得到的乙醇回收,以备二次利用。利用实施例2中检测蛋白质的含量的方法检测旋蒸除去有机溶剂后的发酵液中剩余蛋白质的含量,利用实施例3中计算surfactin的回收率和纯度的方法检测旋蒸除去有机溶剂后的发酵液中surfactin的回收率和纯度。从图2可以看出,利用乙醇去除蛋白质的效率约为84%,产品回收率大于99%,产品纯度为5.5%。
实施例5采用不同浓度乙醇去除发酵液中的蛋白质
进一步探究添加不同比例乙醇对除蛋白效率和产品纯度和回收率的影响。设置有机溶剂乙醇和发酵液的体积比分别为:1:0.2、1:0.5、1:0.8、1:1、1:1.5、1:2,其他实验条件与实施例4相同,测试不同浓度乙醇对除蛋白和产品回收的影响。由图3可以看出,随着乙醇的含量越高,蛋白去除率和产品纯度也随之提高,乙醇的添加量对产品的回收率没有影响。发酵液与乙醇的体积比为1:1时,蛋白去除率最高为84%左右,产品纯度为5.5%,而进一步增加乙醇浓度,对除蛋白效率和产品纯度均没有显著影响。
实施例6采用不同有机溶剂去除发酵液中的蛋白质
将实施例4中的有机溶剂乙醇替换为甲醇和戊二醇,其他实验条件不变,测试甲醇和戊二醇对除蛋白和产品回收的影响。从图2中可以看出,利用甲醇去除蛋白质的效率与乙醇差不多,约为84%,利用戊二醇去除蛋白质的效率略低,约为81%。添加这两种溶剂除蛋白对产品不会造成损失,产品回收率均大于99%,产品纯度与实施例4相比没有显著差异。
比较乙醇、甲醇、戊二醇这三种有机溶剂对除蛋白效率、产品回收率、纯度影响,乙醇和甲醇除蛋白效率都约为84%,戊二醇除蛋白质效率略低,产品回收率和纯度没有显著性差异,但甲醇具有一定毒性,戊二醇沸点较高,会降低后续旋蒸除有机溶剂操作的效率。
对比例1采用盐析法去除发酵液中的蛋白质
采用饱和硫酸铵溶液去除发酵液中的蛋白质,取25ml实施例1中制备的发酵液,向发酵液中加入不同浓度的饱和硫酸铵溶液,设置发酵液与饱和硫酸铵溶液体积比分别为1:0.5、1:0.8、1:1、1:1.5、1:2,静置沉淀2h后用0.48μm的滤膜抽滤除去蛋白质。所得发酵液和乙醇的混合物在40hpa,30℃旋蒸分离有机溶剂乙醇,将旋蒸得到的乙醇回收,以备二次利用。利用实施例2中检测蛋白质的含量的方法检测旋蒸除去有机溶剂后的发酵液中残余蛋白质的含量,利用实施例3中计算surfactin的回收率和纯度的方法检测旋蒸除去有机溶剂后的发酵液中surfactin的回收率和纯度。采用盐析法除去发酵液中蛋白质的效果如图4所示,发现随着盐溶液浓度升高,除蛋白效率降低,在v样品:v硫酸铵为1:0.5时效果最好,除蛋白效率为75%左右。但是在此条件下,大量的surfactin也发生了絮凝沉淀,从而使得产品的回收率大大降低。当硫酸铵浓度增高时虽然除蛋白效率降低,surfactin回收率增高,但由于引入了大量的硫酸铵,使得发酵液中产品纯度低至1%。由于采用盐析法除蛋白时,surfactin会与蛋白质一同沉淀出来,因此不能达到在发酵液中仅除蛋白而保留产品的效果。
对比例2联用乙醇和硫酸铵去除发酵液中的蛋白质
按照v样品:v乙醇=1:1比例添加乙醇的基础上,进一步探究添加0%、5%、10%、20%、30%、50%体积硫酸铵对除蛋白效率的影响,取25ml实施例1中制备的发酵液,向发酵液中加入不同浓度的饱和硫酸铵溶液,设置饱和硫酸铵溶液体积比分别为0%、5%、10%、20%、30%、50%,静置沉淀2h后用0.48μm的滤膜抽滤除去蛋白质。所得发酵液和乙醇的混合物在40hpa,30℃旋蒸分离有机溶剂乙醇,将旋蒸得到的乙醇回收,以备二次利用。利用实施例2中检测蛋白的含量的方法检测旋蒸除去有机溶剂后发酵液中残余蛋白质的含量,利用实施例3中计算surfactin的回收率和纯度的方法检测旋蒸除去有机溶剂后发酵液中surfactin的回收率和纯度。从图5中可以看出,硫酸铵浓度越高,蛋白去除率反而显著降低,且由于大量盐的添加使得产品的纯度也显著降低,但对产品回收率没有影响。硫酸铵的添加并不能提高除蛋白效率,反而降低产品纯度。因此,在采用乙醇除蛋白的方法中,不添加硫酸铵,效果最好。
实施例7不同ph值下采用有机溶剂乙醇去除发酵液中的蛋白质
在实施例4的基础上,进一步探究不同ph对除蛋白的影响。分别采用hcl、naoh调节ph至5、6、7、8、9、10,其他实验条件与实施例4相同,测试不同ph值下按照v样品:v乙醇=1:1比例添加乙醇对除蛋白和产品回收的影响。结果如图6所示,当ph值为6或7时,蛋白去除率最高,过酸或过碱都会降低蛋白去除率。因此采用乙醇除蛋白时,最佳ph值为6-7。
实施例8采用酸沉淀法去除小分子杂质
取实施例4中旋蒸除去有机溶剂乙醇后得到的发酵液25ml,添加少量h2so4溶液至ph为2,静置4-6h,待surfactin沉淀完全析出。以转速1200rpm,离心5min,离心后收集沉淀,用实施例3中检测surfactin的回收率和纯度的方法检测沉淀物中surfactin的回收率和纯度。由图7可以看出,调ph为2后沉淀中所得的surfactin纯度可以达到70%,酸沉淀surfactin的回收率为98.8%。
实施例9采用酸洗的方法除去surfactin中残留的发酵液杂质
取实施例8中离心后收集的沉淀,采用25mlph为2的h2so4水溶液多次进行酸洗。用实施例3中检测surfactin的回收率和纯度的方法检测沉淀物中surfactin的回收率和纯度。由图7可以看出,第一次酸洗就能显著提高产品纯度至91.1%,产品回收率为97.1%。随着酸洗次数增多,产品纯度逐渐升高,产品回收率略微降低。由于酸洗超过2次后,并不会显著提高surfactin的纯度,反而会进一步增加surfactin的损失,因此在酸沉淀得到surfactin后,采用ph为2的h2so4水溶液酸洗2次最佳,产品回收率为96.3%,纯度可达94.2%。
对比例3采用酸沉淀和甲醇沉淀的方法分离纯化
取25ml实施例1中制备的发酵液,将发酵液离心除菌后取上清,上清用6mol/l的hcl将ph调至2,至于4℃冰箱静置过夜;经过离心收集surfactin沉淀,再用纯甲醇溶剂提取surfactin,获得surfactin粗提取物。按照实施例3中的方法计算surfactin的产品回收率96%,纯度为60%。
实施例10:通过本发明方法和对比例3中的方法分离纯化的surfactin的外观比较
取实施例9中通过乙醇沉淀除蛋白、酸沉淀及酸水洗除小分子杂质后得到产物,通过真空冷冻干燥得到surfactin产品,产品外观如图8(a)所示。取对比例3中通过酸沉淀和甲醇提取得到的产物,通过旋蒸除甲醇和真空冷冻干燥得到surfactin产品,产品外观如图8(b)所示。从图中可以看出,通过酸沉淀和甲醇提取的方法分离纯化的surfactin产品呈黄色粉末,杂质较多,而经过本发明方法纯化得到的surfactin产品,颜色呈乳白色,产品纯度高。
实施例11计算地衣素的回收率和纯度、蛋白质去除率
回收率:
纯度:
蛋白去除率:
计算地衣素的含量:采用高效液相色谱(hplc)对培养基中的地衣素浓度进行定量分析。采用c18色谱柱进行液相梯度分离;流动相a为0.1%甲酸水溶液,流动相b为hplc级甲醇;洗脱梯度:0–10min,60%–75%b;10–50min,75%–95%b;50–55min,95%–100%b;流速为0.6ml/min。紫外检测波长为210nm。配置不同浓度梯度的地衣素的甲醇标准溶液,根据峰面积与浓度的变化,制作地衣素标准曲线。再根据插入法,由待测样品相应出峰时间的峰面积,计算地衣素含量。由于地衣素也存在多种同系物,将其不同的同系物峰面积加和获得体系中的地衣素总量。
实施例12:分离纯化地衣素
发酵菌株为bacilluslicheniformismt-6或mt-15,从高温大曲中分离得到,现保藏于中国普通微生物菌种保藏管理中心,保藏编号分别为cgmcc:3962和cgmcc:3963。这两株菌株于2011年1月26日公开在公开号为cn101955980a的专利中。按照实施例1中的方法培养菌株后取25ml发酵液,向其中添加等体积比的有机溶剂乙醇,静置沉淀2h后用0.48μm的滤膜抽滤除去蛋白质。所得发酵液和乙醇的混合物在40hpa,30℃旋蒸分离有机溶剂乙醇,将旋蒸得到的乙醇回收,以备二次利用。向旋蒸除去有机溶剂乙醇后得到的发酵液中添加少量h2so4溶液至ph为2,静置4-6h,待地衣素沉淀完全析出。以转速1200rpm,离心5min,离心后收集沉淀,采用25mlph为2的h2so4水溶液对沉淀进行两次酸洗,通过真空冷冻干燥得到地衣素产品,按照实施例11计算产品回收率为95.0%,纯度可达92.6%。因此分离纯化surfactin的最佳工艺条件同样对地衣素适用。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!