检测厌氧氨氧化菌的方法与流程
本发明属于污水检测技术领域,更具体地,涉及一种检测厌氧氨氧化菌的方法。
背景技术:
厌氧氨氧化指在生物反应过程中,在细胞质内,氨和nh2oh被某种膜包裹的联胺水解酶氧化成n2h4,联胺氧化酶把n2h4最终氧化成n2。厌氧氨氧化工艺具有以下特点:在反应的过程中不需要额外添加有机碳源作为电子供体,不仅节约了成本,而且还防止了由于投加碳源而产生的二次污染;反应过程中只需要将进水中大约50%的氨氮氧化成亚硝态氮,从而节省了供氧的动力消耗;并且在反应过程中几乎不产生no2,从而避免了在传统的硝化-反硝化工艺中有害气体的排放;微生物增值速度慢,产泥量少。基于以上特点,厌氧氨氧化过程在污水治理上受到了广泛关注。
参与厌氧氨氧化过程的微生物主要是厌氧氨氧化菌(anaerobicammoniumoxidation,anammox)菌,属于浮霉菌门,“红菌”是本领域对厌氧氨氧化菌的俗称,通过生物化学反应,它们可以将污水中所含有的氨氮转化为氮气去除。它们对全球氮循环具有重要意义,也是污水处理中重要的细菌。
因此,准确检测厌氧氨氧化菌的含量,对于厌氧氨氧化菌对于污水治理具有重要意义。
技术实现要素:
本发明的目的是提供一种检测厌氧氨氧化菌的方法,准确检测污染物中厌氧氨氧化菌的含量。
为了实现上述目的,本发明提供一种检测厌氧氨氧化菌的方法,该方法包括以下步骤:
ⅰ)构建含有厌氧氨氧化菌的dna片段的质粒;
ⅱ)将所述质粒导入感受态细胞中,并且对所述感受态细胞进行扩繁,提取扩繁后的感受态细胞中的质粒,对该质粒进行梯度稀释,获得不同浓度的质粒;
ⅲ)从污染物中提取厌氧氨氧化菌,提取该厌氧氨氧化菌的dna;
ⅳ)同时对步骤ⅱ)获得的不同浓度的质粒和步骤ⅲ)获得的dna进行荧光定量pcr,获得步骤ⅱ)获得的不同浓度的质粒分别对应的荧光强度和步骤ⅲ)获得的dna对应的荧光强度;
ⅴ)根据步骤ⅳ)获得的不同浓度的质粒以及每个浓度的质粒对应的荧光强度,绘制标准曲线;
ⅵ)根据所述标准曲线和步骤ⅴ)获得的dna对应的荧光强度,计算所述污染物中厌氧氨氧化菌的含量。
具体地,步骤ⅰ)包括以下步骤:
a)获取厌氧氨氧化菌;
b)提取所述厌氧氨氧化菌的dna,之后进行pcr,获得厌氧氨氧化菌的dna片段,即pcr产物;
c)将所述dna片段导入载体中,构建含有厌氧氨氧化菌的dna片段的质粒。
不难理解地,厌氧氨氧化菌可以从待检测的污染物中获得。
本领域技术人员可以根据现有的提取dna的方法提取所述厌氧氨氧化菌的dna,例如ctab法、trizol法、以及现有的市售可得的dna提取试剂盒。厌氧氨氧化菌的dna设计步骤b)中的pcr的上游引物和下游引物,优选地,所述dna片段由如seqidno:1所示的上游引物和如seqidno:2所示的下游引物扩增制得。seqidno:1的核苷酸序列为5′-ttcgcaatgcccgaaagg-3′。seqidno:2的核苷酸序列为5′-aaaacccctctacttagtgccc-3′。
在本发明中,pcr的反应条件为:94℃变性4min;94℃变性1min、55℃复性45s、72℃延伸90s;35个循环;72℃延伸10min;4℃保持。pcr的反应体系可以如表1所示。
表1pcr反应体系
将厌氧氨氧化菌的dna片段(pcr产物)与载体连接,形成的连接体系如表2所示。
表2连接体系
为了获得更加准确的检测结果,获得厌氧氨氧化菌的dna片段所使用的引物与荧光定量所使用的引物相同。具体为,在步骤ⅳ)中,所述荧光定量pcr的上游引物的核苷酸序列如seqidno:1所示;所述荧光定量pcr的下游引物的核苷酸序列如seqidno:2所示。
在本发明中,所述荧光定量pcr的扩增程序为:95℃变性30s;95℃变性10s、56℃复性30s,72℃延伸45s;40个循环;溶解曲线95℃15s,60℃1min,72℃45s。荧光定量pcr的反应体系可以如表3所示。
表3荧光定量pcr的反应体系
本发明所使用的所述感受态细胞为大肠杆菌,优选为大肠杆菌dh5α。
在本发明中,与厌氧氨氧化菌的dna片段(pcr产物)连接的载体可以为pgemz载体。pgemz载体市售可得。
质粒转化到大肠杆菌、筛选方法以及扩大培养的方法如下:
将pcr产物,即厌氧氨氧化菌的dna片段与特定载体结合,构成质粒,当质粒与大肠杆菌混合后,质粒粘附在大肠杆菌的表面,在42℃的温度时,大肠杆菌出现热休克,质粒可通过大肠杆菌细胞膜上形成的空隙进入菌体内。随后,加入soc培养液,于37℃振动培养可使细菌复苏,并且表达质粒编码的抗生素抗性基因,提高转化效率。转化成功的大肠杆菌可以在相应抗生素培养皿中传代,形成菌落。载体pgemz在β-半乳糖苷酶(lacz)的α-肽编码区内具有多克隆区域。在重组质粒中插入片段使α-肽失活,可在指示平板上通过颜色筛选鉴别。不带有插入片段的载体,表达有功能的β-半乳糖苷酶,所用的宿主菌在染色体或附加体上缺失掉laczm15基因,导致内源α-肽失活。载体pgemz或其它含lacz基因的α-肽互补细菌,具有β-半乳糖苷酶的ω片段,所得功能β-半乳糖苷酶(α-肽加ω片段)将底物x-gal转化为有颜色的产物,得到蓝色菌落。在载体pgemz的多克隆区域,克隆上插入片段导致α-肽编码区的破坏,使β-半乳糖苷酶失活,得到白色菌落。
在本发明中,所述标准曲线的检出限为108~1013拷贝数/μl。
本发明提供的检测厌氧氨氧化菌的方法可以对很多污染物中的厌氧氨氧化菌进行检测,例如污水、污泥等。
在检测污水中的厌氧氨氧化菌时,在步骤ⅲ)中,所述从污染物中提取厌氧氨氧化菌包括以下步骤:
将污水冷冻成固态,之后从固态升华成气态,从升华后的剩余物质中提取所述厌氧氨氧化菌。
所述将污水冷冻成固态,之后从固态升华成气态,从升华后的剩余物质中提取所述厌氧氨氧化菌包括以下步骤:
将污水冷冻成固态,之后在-20~-56℃的条件下,真空干燥,得到剩余物质,从所述剩余物质中提取所述厌氧氨氧化菌。
本发明提供的检测厌氧氨氧化菌的方法通过含有厌氧氨氧化菌的dna片段的质粒和荧光定量技术,准确检测污染物中厌氧氨氧化菌的含量。
本发明提供的检测厌氧氨氧化菌的方法具有重复性好、特异性强、灵敏度高、操作过程简便等优点,大幅度提高了检测效率。
本发明提供的检测厌氧氨氧化菌的方法,在提取厌氧氨氧化菌过程中,能够确保菌活性,从而为准确检测污染物中厌氧氨氧化菌的含量提供基础。
本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显。
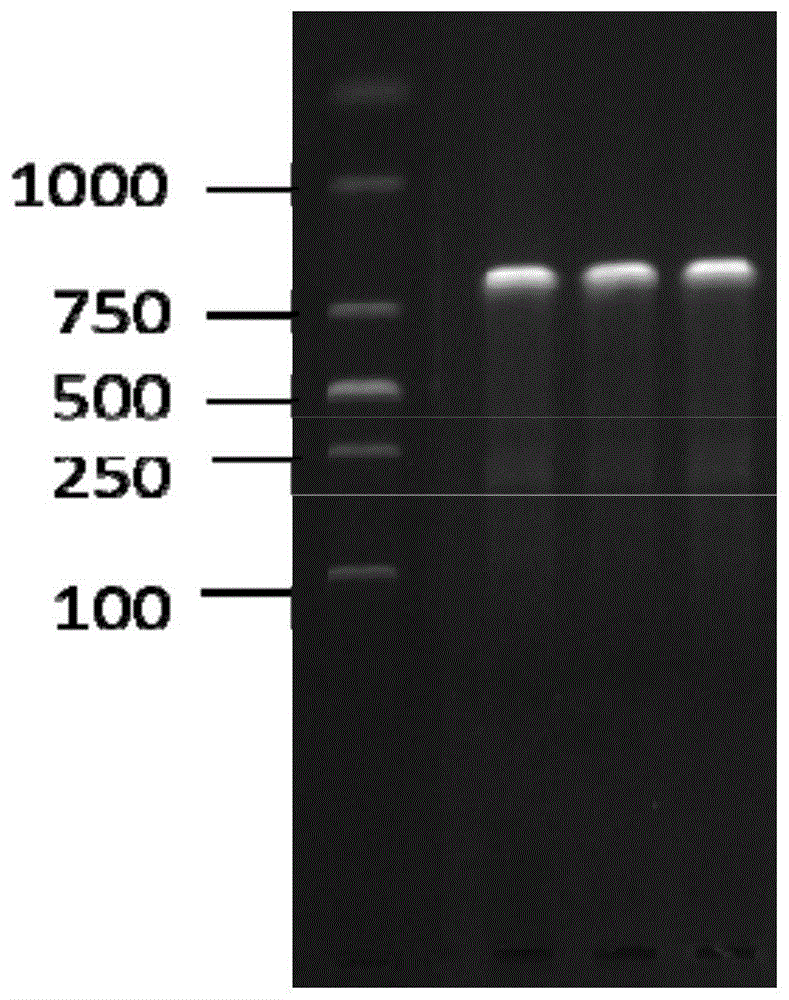
图1示出了实施例1中的pcr产物的琼脂糖凝胶电泳照片。
图2示出了不同浓度的质粒的荧光定量pcr结果的曲线图。
图3示出了质粒的溶解曲线图。
图4示出了根据不同质粒的浓度以及每个浓度的质粒对应的荧光强度绘制的标准曲线。
图5示出了第一次采样的活性污泥中厌氧氨氧化菌的dna扩增曲线图。
图6示出了第一次采样的活性污泥中厌氧氨氧化菌的dna溶解曲线图。
图7示出了第二次采样的活性污泥中厌氧氨氧化菌的dna扩增曲线图。
图8示出了第二次采样的活性污泥中厌氧氨氧化菌的dna溶解曲线图。
具体实施方式
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。
实施例1
a)从污水中获取厌氧氨氧化菌。
b)质粒制备:采用
5′-ggattaggcatgcaagtcgcacgagggagcgtcccgaaaggggcgcaaaccgagtggcgtaagggtgagtaatgcattgataacctacctttgagatgggaacaacaacgttccaagtaattggggctaccgaaagggttgctaattctcaataaaaatgctgacactttggtgtcggcagtcaaagaaatggatctgaaaaggtccatttgctcagagaggggtcaatgtcctatcagctagttggtagggtaatggcctaccaaggcgaagacgggtagccggcctgagagggtggtcggccacactgggactgagacactgcccagactcctacgggaggctgcagtcgagaatctttcgcaatgcccgaaagggtgacgaagcgacgccgcgtgtgggatgaaggccttcgggttgtaaaccactgtcgggagttaagaattgtaggaatgctaatagtatttctacttgactaaggctccggaggaagccacggcaaactctgtgccagcagccgcggtaatacagaggcggcaagcgttgttcggaattattgggcgtaaagagcatgtaggcggctatgtaagtcggttgtgaaagccttccgcttaacggaagaatggcggtcgaaactgcatggcttgagtgcgggaggggagagtggaacttctggtggagcggtgaaatgcgtagatatcagaaggaacgtcggcggcgaaagcgactctctagaccgtaactgacgctgagtgtgcgaaagctaggggagcaaacgggattagattccccggtagtcctagccgtaaacgatgggcactaagtagaggggtttt-3′。
c)将该pcr产物与pgemz载体结合,形成质粒。
d)将质粒转化至大肠杆菌dh5α、涂板、筛选、扩大培养,质粒提取及纯化。转化:(1)取感受态细胞(大肠杆菌细胞)冰浴化开;(2)取50μl感受态细胞于pcr产物与载体结合后的体系中,放入冰里20min,期间摇匀三次;(3)42℃水浴45-50s;(4)至冰上2min,快速降温至37℃;(5)加入950μlsoc培养基,37℃、150rpm水浴振荡2h。涂板:(1)5000rpm离心3min,弃去850μl上清液,将剩余部分重悬;(2)在培养基中加入感受态细胞,分散滴加,用三角玻璃推均匀涂抹于平板培养基上;(3)先将平板培养基正面放置于37℃烘箱中30min,之后反面放置平板培养基培养16-24h。筛选:将平板培养基从烘箱中拿出,放于4℃冰箱半小时,白色菌落即为连接成功菌落。扩大培养:在50ml离心管中加入20ml液体培养基,将白色菌落挑出放入液体培养基。37℃、150rpm水浴振荡16-24h。质粒提取及纯化采用
e)将纯化后的质粒作为标准样品,逐级按10倍梯度浓度稀释,分别为108~1013拷贝数/μl。配制实时荧光定量pcr体系,扩增程序为:95℃变性30s;95℃变性10s、56℃复性30s,72℃延伸45s;40个循环。不同浓度的质粒的扩增曲线如图2所示。质粒的溶解曲线分析条件为95℃15s,60℃1min,72℃45s。质粒的溶解曲线结果请参见图3。如图3所示,溶解曲线无杂峰,说明pcr产物为特异性扩增,无杂质。
f)根据不同质粒的浓度以及每个浓度的质粒对应的荧光强度,绘制标准曲线,请参见图4,经线性拟合得到标准曲线y=-3.4195x+40.993,r2=0.9967,式中,y代表荧光强度,x代表质粒浓度。
g)样品采集与预处理:确定污水处理厂生物处理阶段正常运行。在同一个采样点,分两次不同的时间采样,第一次采样与第二次采样间隔30天时间,每次采样设两个副孔。取两次采样的新鲜的活性污泥,将其冻结成固态,在-56℃、真空48小时条件下,从固态升华成气态,得到干污泥。
h)从干污泥中提取微生物,该微生物中含有厌氧氨氧化菌,采用
i)对dna进行荧光定量pcr,荧光定量pcr体系如表3所示,扩增程序与步骤e)中质粒的扩增程序相同。第一次采样的活性污泥中的厌氧氨氧化菌的dna扩增曲线如图5所示,溶解曲线如图6所示。第二次采样的活性污泥中的厌氧氨氧化菌的dna扩增曲线如图7所示,溶解曲线如图8所示。将第一次采样的活性污泥的荧光定量结果和第二次采样的活性污泥的荧光定量结果分别带入标准曲线中,获得第一次采样和第二次采样的活性污泥中厌氧氨氧化细菌的含量。第一次测定结果,活性污泥一中厌氧氨氧化细菌为2.9916×109拷贝数/g,活性污泥二中厌氧氨氧化细菌为3.0902×1011拷贝数/g。第二次测定结果,活性污泥一中厌氧氨氧化细菌为2.4815×109拷贝数/g,活性污泥二中厌氧氨氧化细菌为中厌氧氨氧化细菌为1.9027×1011拷贝数/g。拷贝数与浓度关系为拷贝数=(6.026×1023×浓度×10-9)/(mw),其中mw=dna碱基对数×660。
可见,第二次采样的测量结果略低于第一次采样的测量结果,两者差别不大,说明同一季节,不同时间段污水中厌氧氨氧化菌含量比较稳定。
本发明提供的检测厌氧氨氧化菌的方法,在采样后采用冻干预处理;测量相同采样点在不同时间厌氧氨氧化菌的浓度变化;并且对于同一样品测定时设置两个副孔,可以为污水处理厂水样中厌氧氨氧化细菌提供数据指导,做到污水处理厂达标排放。
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
序列表
<110>北京城市排水集团有限责任公司
<120>检测厌氧氨氧化菌的方法
<160>3
<170>siposequencelisting1.0
<210>1
<211>18
<212>dna
<213>artificialsequence
<400>1
ttcgcaatgcccgaaagg18
<210>2
<211>22
<212>dna
<213>artificialsequence
<400>2
aaaacccctctacttagtgccc22
<210>3
<211>836
<212>dna
<213>artificialsequence
<400>3
ggattaggcatgcaagtcgcacgagggagcgtcccgaaaggggcgcaaaccgagtggcgt60
aagggtgagtaatgcattgataacctacctttgagatgggaacaacaacgttccaagtaa120
ttggggctaccgaaagggttgctaattctcaataaaaatgctgacactttggtgtcggca180
gtcaaagaaatggatctgaaaaggtccatttgctcagagaggggtcaatgtcctatcagc240
tagttggtagggtaatggcctaccaaggcgaagacgggtagccggcctgagagggtggtc300
ggccacactgggactgagacactgcccagactcctacgggaggctgcagtcgagaatctt360
tcgcaatgcccgaaagggtgacgaagcgacgccgcgtgtgggatgaaggccttcgggttg420
taaaccactgtcgggagttaagaattgtaggaatgctaatagtatttctacttgactaag480
gctccggaggaagccacggcaaactctgtgccagcagccgcggtaatacagaggcggcaa540
gcgttgttcggaattattgggcgtaaagagcatgtaggcggctatgtaagtcggttgtga600
aagccttccgcttaacggaagaatggcggtcgaaactgcatggcttgagtgcgggagggg660
agagtggaacttctggtggagcggtgaaatgcgtagatatcagaaggaacgtcggcggcg720
aaagcgactctctagaccgtaactgacgctgagtgtgcgaaagctaggggagcaaacggg780
attagattccccggtagtcctagccgtaaacgatgggcactaagtagaggggtttt836
- 还没有人留言评论。精彩留言会获得点赞!