一种ω-转氨酶突变体及其在生产手性芳香胺中的应用的制作方法
本发明涉及一种ω-转氨酶突变体及其在生产手性芳香胺中的应用,属于酶工程和微生物工程
技术领域:
。
背景技术:
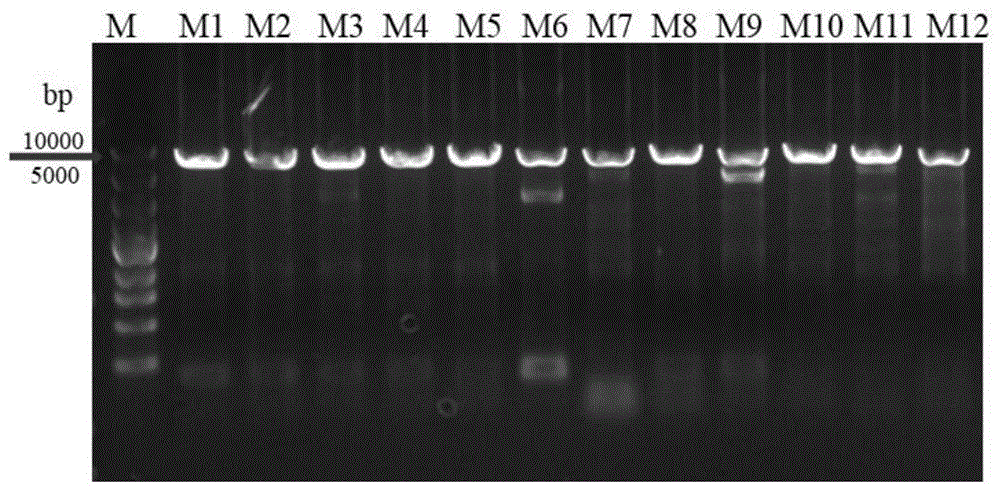
:手性芳香胺是合成拟钙剂盐酸西那卡塞、普瑞巴林等多种药物的重要手性中间体,也可用作马钱子碱、番木鳌碱等多种手性对映体的常用拆分剂和手性助剂,并且,很多手性芳香胺均具有特殊的药理活性,例如,(r)-1-(1-萘基)乙胺能够用于治疗进行透析的慢性肾病(ckd)患者的继发性甲状旁腺功能亢进症,因此,手性芳香胺在医药领域应用广泛。目前,常通过化学拆分法、化学不对称合成法以及酶不对称还原法三种方法生产手性芳香胺。其中,化学拆分法反应时间长、制备得到的产物的光学纯度低且会产生大量的化学废物,不利于大规模的工业化生产(具体可见参考文献:pallavicinim,bolchic,fumagallil,etal.highlyefficientresolutionswithisopropylideneglycerol3-carboxy-2-naphthoate[j].tetrahedronasymmetry,2002,13(20):2277-2282.);化学不对称合成法使用的催化剂价格昂贵,也不利于大规模的工业化生产(具体可见参考文献:kanaim,yasumotom,kuriyamay,etal.highlyregioselectivehydrogenolysisofbis(α-methylbenzyl)aminederivativesaffectedbythetrifluoromethylsubstituentonthearomaticring[j].organicletters,2003,5(7):1007-1010.);与化学拆分法和不对称合成法相比,酶不对称还原法具有反应时间短、制备得到的产物的光学纯度高、绿色以及成本低等优势,因此,利用酶不对称还原法生产手性芳香胺对实现手性芳香胺的大规模工业化生产具有重要意义。现有的可用于不对称还原前手性芳香酮生产手性芳香胺的酶包括ω-转氨酶、亚胺还原酶以及氨基酸脱氢酶等,但是,大部分的ω-转氨酶、亚胺还原酶以及氨基酸脱氢酶不对称还原前手性芳香酮生成手性芳香胺的转化率和催化效率都很低,其中,转化率仅有49%左右(具体可见参考文献:svedendahlm,brannebyc,lindbergl,etal.reversedenantiopreferenceofan-transaminasebyasingle-pointmutation[j].chemcatchem,2010,2(8):976-980.),这大大阻碍了利用酶不对称还原法生产手性芳香胺的工业化进程。因此,急需找到不对称还原前手性芳香酮生成手性芳香胺的转化率和催化效率更高的酶。技术实现要素:[技术问题]本发明要解决的技术问题是提供一种不对称还原前手性芳香酮生成手性芳香胺的转化率和催化效率高的ω-转氨酶(aminotransferase,transaminase,ec2.6.1.18)。[技术方案]为解决上述技术问题,本发明提供了一种ω-转氨酶突变体,所述ω-转氨酶突变体是通过将出发氨基酸序列如seqidno.2所示的ω-转氨酶的第136位甘氨酸、第155位谷氨酰胺、第225位苯丙氨酸、第281位半胱氨酸和/或第283酪氨酸进行突变得到的。所述ω-转氨酶记载于文献“iwasakia,yamaday,kizakin,etal.microbialsynthesisofchiralaminesby(r)-specifictransaminationwitharthrobactersp.knk168[j].appliedmicrobiologyandbiotechnology,2006,69(5):499-505.”中。在本发明的一种实施方式中,所述ω-转氨酶突变体是通过将出发氨基酸序列如seqidno.2所示的ω-转氨酶的第136位甘氨酸突变为异亮氨酸、第155位谷氨酰胺突变为亮氨酸、第225位苯丙氨酸突变为甲硫氨酸、第281位半胱氨酸突变为异亮氨酸和/或第283酪氨酸突变为脯氨酸得到的。在本发明的一种实施方式中,编码所述ω-转氨酶的核苷酸序列如seqidno.1所示。本发明还提供了编码上述ω-转氨酶突变体的基因。本发明还提供了携带上述基因的重组质粒。在本发明的一种实施方式中,所述重组质粒的载体为pet-28a(+)质粒或pet-20b(+)质粒。本发明还提供了携带上述基因或上述重组质粒的宿主细胞。在本发明的一种实施方式中,所述宿主细胞为细菌或真菌。在本发明的一种实施方式中,所述宿主细胞为大肠杆菌。本发明还提供了上述ω-转氨酶突变体的制备方法,所述方法为将上述宿主细胞接种至发酵培养基中进行发酵,获得发酵液;将发酵液进行离心,收集菌体;将菌体进行破碎后离心,获得细胞破碎上清液;将细胞破碎上清液进行提取,获得ω-转氨酶突变体。本发明还提供了一种生产手性芳香胺的方法,所述方法为将上述ω-转氨酶突变体添加至含有前手性芳香酮的反应体系中进行反应,得到反应液;将反应液进行提取,获得手性芳香胺。在本发明的一种实施方式中,所述反应体系中含有辅酶、葡萄糖脱氢酶、d-葡萄糖以及乳酸脱氢酶。在本发明的一种实施方式中,所述辅酶为nadh和/或nadph。在本发明的一种实施方式中,所述ω-转氨酶突变体在反应体系中的添加量为0.1~1ku/l。在本发明的一种实施方式中,所述反应体系中,前手性芳香酮的浓度为1~50mmol/l。在本发明的一种实施方式中,所述反应体系中,辅酶的浓度为0.1~1mmol/l。在本发明的一种实施方式中,所述反应体系中,葡萄糖脱氢酶的浓度为1~10ku/l。在本发明的一种实施方式中,所述反应体系中,d-葡萄糖的浓度为2~100mmol/l。在本发明的一种实施方式中,所述反应体系中,乳酸脱氢酶的浓度为1~10ku/l。在本发明的一种实施方式中,所述反应体系为含有前手性芳香酮、辅酶、葡萄糖脱氢酶、d-葡萄糖以及乳酸脱氢酶的缓冲液。在本发明的一种实施方式中,所述缓冲液为磷酸盐缓冲液。在本发明的一种实施方式中,所述磷酸盐缓冲液的浓度为0.1~0.2mol/l。在本发明的一种实施方式中,所述反应的温度为30~35℃、ph为6~8。在本发明的一种实施方式中,所述前手性芳香酮为1-萘乙酮、苯乙酮、对氯苯乙酮、间氯苯乙酮、邻氯苯乙酮或4-苯基-2-丁酮。在本发明的一种实施方式中,前手性芳香酮为1-萘乙酮时,所述手性芳香胺为(r)-1-(1-萘基)乙胺;前手性芳香酮为苯乙酮时,所述手性芳香胺为(r)-苯乙胺;前手性芳香酮为对氯苯乙酮时,所述手性芳香胺为(r)-对氯苯乙胺;前手性芳香酮为间氯苯乙酮时,所述手性芳香胺为(r)-间氯苯乙胺;前手性芳香酮为邻氯苯乙酮时,所述手性芳香胺为(r)-邻氯苯乙胺;前手性芳香酮为4-苯基-2-丁酮时,所述手性芳香胺为(r)-4-苯基-2-丁胺。本发明还提供了上述ω-转氨酶突变体或上述基因或上述重组质粒或上述宿主细胞或上述制备方法或上述方法在生产手性芳香胺中的应用。在本发明的一种实施方式中,所述手性芳香胺为(r)-1-(1-萘基)乙胺、(r)-苯乙胺、(r)-对氯苯乙胺、(r)-间氯苯乙胺、(r)-邻氯苯乙胺或(r)-4-苯基-2-丁胺。[有益效果](1)本发明的ω-转氨酶突变体催化前手性芳香酮的酶活高,其中,突变体m1催化前手性芳香酮的酶活高达7.33u·g–1,是野生型的1.42倍;突变体m2催化前手性芳香酮的酶活高达6.97u·g–1,是野生型的1.35倍;突变体m4催化前手性芳香酮的酶活高达6.81u·g–1,是野生型的1.32倍;突变体m19催化前手性芳香酮的酶活高达10.58u·g–1,是野生型的2.05倍;突变体m26催化前手性芳香酮的酶活高达8.93u·g–1,是野生型的1.73倍。(2)本发明的ω-转氨酶突变体不对称还原前手性芳香酮生成手性芳香胺的最大反应速度和催化效率高,其中,突变体m1不对称还原前手性芳香酮生成手性芳香胺的最大反应速度和催化效率分别为9.43±1.02μmol·min–1·g–1和1.28±0.02min–1·mm–1,是野生型的1.81倍和6.10倍;突变体m19不对称还原前手性芳香酮生成手性芳香胺的最大反应速度和催化效率分别为22.02±1.25μmol·min–1·g–1和2.78±0.09min–1·mm–1,是野生型的4.21倍和13.24倍;突变体m26不对称还原前手性芳香酮生成手性芳香胺的最大反应速度和催化效率分别为16.43±0.65μmol·min–1·g–1和2.92±0.12min–1·mm–1,是野生型的3.15倍和13.90倍。(3)本发明的ω-转氨酶突变体不对称还原前手性芳香酮生成手性芳香胺的转化率高,其中,突变体m19不对称还原前手性芳香酮生成手性芳香胺的转化率高达80.5%,是野生型的2.05倍;突变体m26不对称还原前手性芳香酮生成手性芳香胺的转化率高达69.4%,是野生型的1.77倍。(4)本发明的ω-转氨酶突变体催化前手性芳香酮的酶活高且本发明的ω-转氨酶突变体不对称还原前手性芳香酮生成手性芳香胺的最大反应速度、催化效率和转化率高,因此,本发明的ω-转氨酶突变体在生产手性芳香胺中具有极高的应用前景。附图说明图1~5:重组质粒的的pcr扩增电泳图谱;其中,m:marker,泳道1~31:重组质粒pet28a-arta-1~重组质粒pet28a-arta-35的酶切产物。图6~14:重组大肠杆菌摇瓶诱导发酵获得的表达产物的sds-page电泳分析结果;其中,m:maker,泳道1~70中的奇数泳道:重组大肠杆菌e.colibl21/pet28a-arta-1~重组大肠杆菌e.colibl21/pet28a-arta-35摇瓶诱导发酵获得的细胞破碎上清液,泳道1~70中的偶数泳道:突变体m1~m35的纯酶。图15:突变体m1~m31不对称还原1-萘乙酮所得产物的手性色谱图。具体实施方式下述实施例中涉及的大肠杆菌e.colibl21(de3)购自生工生物工程(上海)股份有限公司,pet-28a(+)质粒购自生工生物工程(上海)股份有限公司;下述实施例中涉及的nadh购自邦泰生物工程有限公司;下述实施例中涉及的葡萄糖脱氢酶(gdh)、乳酸脱氢酶(ldh)以及磷酸吡哆醛(plp)购自sigma公司;下述实施例中涉及的d-葡萄糖购自国药集团化学试剂有限公司;下述实施例中涉及的1-萘乙酮购自麦克林公司。(上述菌株大肠杆菌e.colibl21(de3)可以购买得到,不需要进行用于专利程序的保藏)下述实施例中涉及的培养基如下:lb液体培养基:酵母粉5.0g·l-1、胰蛋白胨10.0g·l-1、nacl10.0g·l-1、卡那霉素100mg·l-1。lb固体培养基:酵母粉5.0g·l-1、胰蛋白胨10.0g·l-1、nacl10.0g·l-1、琼脂粉15g/l、卡那霉素50mg·l-1。下述实施例中涉及的检测方法如下:ω-转氨酶酶活的检测方法如下:取50μl蛋白浓度为1mg/ml的纯酶液加入含有0.2mmnadh、2.0mm底物1-萘乙酮、10mm丙氨酸、2.0mmd-葡萄糖、0.1mmplp、1u/mlldh以及0.5u/mlgdh的pbs缓冲液(pbs,100mm,ph7.0)中,得到反应体系(共0.5ml);将反应体系于30℃振荡反应30min;反应结束后,沸水终止反应,取样进行hplc分析,取样进行hplc分析,同时以(r)-1-(1-萘基)-乙胺标准品做对照,确定产物出峰时间,并以此为依据进行酶活测定;hplc分析条件为:色谱柱chiralcelod-h(25cm×4.6mm,5μm),流动相为v(正己烷):v(异丙醇)=90:10,流速为0.8ml·min-1,检测波长为254nm,柱温为30℃;酶活的定义:在该条件下每分钟催化1-萘乙酮产生1μmol(s)-1-(1-萘基)乙胺所需酶量为一个酶活力单位(1u);比酶活的定义:单位重量(mg)蛋白质所具有的酶活力单位数。酶活和比酶活的计算公式如下:式中,ar为反应液中(r)-1-(1-萘基)-乙胺的摩尔浓度,v为反应液体积,t为转化时间(min),酶活的单位u=μmol·min-1(酶液中的蛋白浓度通过bradford法测定,bradford法记载于参考文献“bradford,m.m.1976.arapidandsensitivemethodforthequantitationofmicrogramquantitiesofproteinutilizingtheprincipleofprotein-dyebinding.anal.biochem.72:248–254.”中)。ω-转氨酶不对称还原前手性芳香酮生成手性芳香胺的立体选择性的检测方法如下:取50μl蛋白浓度为1mg/ml的纯酶液加入含有0.2mmnadh、2.0mm底物1-萘乙酮、10mm丙氨酸、2.0mmd-葡萄糖、0.1mmplp、1u/mlldh以及0.5u/mlgdh的pbs缓冲液(pbs,100mm,ph7.0)中,得到反应体系(共0.5ml);将反应体系于30℃振荡反应30min;反应结束后,沸水终止反应,取样进行hplc分析,同时以(r)-1-(1-萘基)-乙胺和(s)-1-(1-萘基)-乙胺标准品做对照,确定产物出峰时间,并以此为依据获得反应液中(r)-1-(1-萘基)-乙胺的摩尔浓度以及(s)-1-(1-萘基)-乙胺的摩尔浓度;色谱条件具体如下:色谱柱chiralcelod-h(25cm×4.6mm,5μm),流动相为v(正己烷):v(异丙醇)=90:10,流速为0.8ml·min-1,检测波长为254nm,柱温为30℃;ee值的计算方法如下:式中,as:反应液中(s)-1-(1-萘基)乙胺的摩尔浓度;ar:反应液中(r)-1-(1-萘基)乙胺的摩尔浓度。ω-转氨酶不对称还原前手性芳香酮生成手性芳香胺的转化率的检测方法如下:取50μl蛋白浓度为1mg/ml的纯酶液加入含有0.2mmnadh、2.0mm底物1-萘乙酮、10mm丙氨酸、2.0mmd-葡萄糖、0.1mmplp、1u/ml1u/mlldh以及0.5u/mlgdh的pbs缓冲液(pbs,100mm,ph7.0)中,得到反应体系(共2ml);将反应体系于30℃振荡反应30min;反应结束后,沸水终止反应,取样进行hplc分析,确定产物出峰时间,同时以1-萘乙酮和(r)-1-(1-萘基)-乙胺标准品做对照,确定底物和产物出峰时间,并以此为依据进行转化率测定;色谱条件具体如下:色谱柱chiralcelod-h(25cm×4.6mm,5μm),流动相为v(正己烷):v(异丙醇)=90:10,流速为0.8ml·min-1,检测波长为254nm,柱温为30℃;转化率的计算方法如下:式中,ad为反应液中1-萘乙酮的摩尔浓度;ar为反应液中(r)-1-(1-萘基)-乙胺的摩尔浓度。实施例1:ω-转氨酶突变体的制备、表达及纯化具体步骤如下:化学合成编码氨基酸序列如seqidno.2(具体可见表1)所示的ω-转氨酶的基因(基因的核苷酸序列如seqidno.1所示,具体可见表1);将获得的基因与pet-28a(+)质粒经双酶切(bamhi和xhoi)后进行连接,连接产物转化大肠杆菌e.colibl21(de3),转化产物涂布于lb固体培养基,于37℃培养8~10h,在lb固体培养基上挑取5个转化子,接入lb液体培养基培养,于37℃培养10h后提取质粒,将提取得到的质粒进行酶切验证以及测序验证,验证正确即获得含有编码野生型ω-转氨酶的基因的重组质粒pet28a-arta以及含有编码野生型ω-转氨酶的基因的重组菌e.colibl21/pet28a-arta。利用全质粒pcr技术,以获得的重组质粒pet28a-arta为模板进行定点突变,获得含有编码ω-转氨酶突变体g136i(第136位甘氨酸突变为异亮氨酸)、q155l(第155位谷氨酰胺突变为亮氨酸)、f225m(第225位苯丙氨酸突变为甲硫氨酸)、c281i(第281位半胱氨酸突变为异亮氨酸)、t283p(第283酪氨酸突变为脯氨酸)、g136i/q155l、g136i/f225m、g136i/c281i、g136i/t283p、q155l/f225m、q155l/c281i、q155l/t283p、f225m/c281i、f225m/t283p、c281i/t283p、g136i/q155l/f225m、g136i/q155l/c281i、g136i/q155l/t283p、g136i/f225m/c281i、g136i/f225m/t283p、g136i/c281i/t283p、q155l/f225m/c281i、q155l/f225m/t283p、q155l/c281i/t283p、f225m/c281i/t283p、g136i/q155l/f225m/c281i、g136i/q155l/f225m/t283p、g136i/q155l/c281i/t283p、g136i/f225m/c281i/t283p、q155l/f225m/c281i/t283p、g136i/q155l/f225m/c281i/t283p、g136p(第136位甘氨酸突变为脯氨酸)、g136l(第136位甘氨酸突变为亮氨酸)、q155a(第155位谷氨酰胺突变为丙氨酸)、f225k(第225位苯丙氨酸突变为赖氨酸)的基因的重组质粒,将上述ω-转氨酶突变体依次命名为m1~m35;其中,突变g136i的所用引物如下:g136i-f:agcagtaccccgattgaacgc(seqidno.3);g136i-r:aatgtcgcgttcaatcggggt(seqidno.4);突变q155l的所用引物如下:q155l-f:gccgttccgtacctgtggatt(seqidno.5);q155l-r:cggcacaatccacaggtacgg(seqidno.6);突变f225m的所用引物如下:f225m-f:gaaggcagtggcatgaacgtg(seqidno.7);f225m-r:cacaaccacgttcatgccact(seqidno.8);突变c281i的所用引物如下:c281i-f:gaggtgttaggcattac(seqidno.9);c281i-r:gctgtggtaatgcctaa(seqidno.10);突变t283p的所用引物如下:t283p-f:ttaggctgtaccccggccggt(seqidno.11);t283p-r:aacaccaccggccggggtaca(seqidno.12);突变c281i/t283p的所用引物如下:c281i/t283p-f:gaggtgttaggcattaccccggccggt(seqidno.13);c281i/t283p-r:aacaccaccggccggggtaatgcctaa(seqidno.14);突变g136p的所用引物如下:g136p-f:agcagtaccccgccggaacgc(seqidno.15);g136p-r:aatgtcgcgttccggcggggt(seqidno.16);突变g136l的所用引物如下:g136p-f:agcagtaccccgcttgaacgc(seqidno.17);g136p-r:aatgtcgcgttcaagcggggt(seqidno.18);突变q155a的所用引物如下:q155a-f:gccgttccgtacgcttggatt(seqidno.19);q155a-r:cggcacaatccaagcgtacgg(seqidno.20);突变f225k的所用引物如下:f225k-f:gaaggcagtggcaaaaacgtg(seqidno.21);f225k-r:cacaaccacgtttttgccact(seqidno.22),pcr反应体系(50μl)为:kod酶(2.5u/ml)1.0μl,模板(5~50ng)1.0μl,dntp4.0μl,10×reactionbuffer5.0μl,上下游引物各1.0μl,ddh2o补足至50μl;pcr产物扩增条件均为:(1)94℃变性3min,(2)94℃变性30sec,(3)54℃退火30sec,(4)72℃延伸150sec,重复步骤(2)~(4)进行10~15个循环,最后72℃延伸10min,4℃保存pcr扩增产物。pcr扩增产物用1%琼脂糖凝胶电泳进行检测,检测结束后,向10μl扩增产物中加入0.5μl甲基化模板消化酶(dpni),枪头吹吸进行混匀,于37℃条件下反应1h,将dpni处理后的扩增产物转化大肠杆菌e.colibl21(de3),转化产物涂布于lb固体培养基,于37℃培养8~10h,在lb固体培养基上挑取5个转化子,接入lb液体培养基培养,于37℃培养10h后提取质粒,将提取得到的质粒进行酶切验证(验证结果可见图1~5)以及测序验证,验证正确即获得含有编码ω-转氨酶突变体m1~m35的基因的重组质粒pet28a-arta-1~重组质粒pet28a-arta-35以及含有编码ω-转氨酶突变体m1~m35的基因的重组菌e.colibl21/pet28a-arta-1~重组菌e.colibl21/pet28a-arta-35。将获得的重组菌e.colibl21/pet28a-arta以及重组菌e.colibl21/pet28a-arta-1~重组菌e.colibl21/pet28a-arta-35涂布于lb固体培养基,于37℃培养8~10h,获得单菌落;挑取单菌落接入lb液体培养基,于37℃培养12~14h,获得种子液;将种子液按照2%(v/v)的接种量接入lb液体培养基,于37℃、200rpm培养至od600达到0.8后,在发酵液中加入终浓度为0.2mm的iptg,于25℃继续诱导培养8h,得到发酵液;将发酵液于4℃、8000rpm离心10min后,收集细胞;将收集得到的细胞悬浮于磷酸钾缓冲液(100mmol·l-1,ph6.0)中进行超声破碎,收集分别含有野生型ω-转氨酶以及ω-转氨酶突变体m1~m35的细胞破碎上清液。将获得的细胞破碎上清液使用亲和柱histrapffcrude(镍柱)进行纯化,纯化过程如下:先使用缓冲液a(20mmol·l-1磷酸钠,500mmol·l-1nacl,20mmol·l-1咪唑,ph7.4)平衡镍柱,并实施例1获得的细胞破碎上清液过镍柱,继续使用缓冲液a洗脱未与镍柱结合的蛋白,待穿透峰流尽后,从缓冲液a到缓冲液b(20mmol·l-1磷酸钠,500mmol·l-1nacl,500mmol·l-1咪唑,ph7.4)进行梯度洗脱,将结合到镍柱上的重组蛋白洗脱下来,获得野生型ω-转氨酶以及ω-转氨酶突变体m1~m35的纯酶液。将获得的细胞破碎上清液和纯酶液进行sds-page分析,分析结果见图6~14。由图6~14可知,细胞破碎上清液在36kda处有一条与理论分子量一致的条带,说明ω-转氨酶突变体m1~m35表达成功;ω-转氨酶突变体m1~m35的纯酶液在36kda左右显示单条带,且杂蛋白较少,说明镍柱纯化效果较好。表1野生型ω-转氨酶的氨基酸序列以及编码野生型ω-转氨酶的基因的核苷酸序列实施例2:ω-转氨酶突变体的酶活具体步骤如下:使用hitrapdesalting脱盐柱(gehealthcare)将实施例1获得的野生型ω-转氨酶以及ω-转氨酶突变体m1~m35的纯酶液中的酶蛋白置换到磷酸钠(100mm,ph7.0)缓冲液中,并检测野生型ω-转氨酶以及ω-转氨酶突变体m1~m35的比酶活,其中,野生型ω-转氨酶的比酶活为5.16u·g-1;以野生型ω-转氨酶的比酶活为100%,其余ω-转氨酶突变体的比酶活与之相比计算相对酶活,计算结果见表2。由表2可知,ω-转氨酶突变体m1~m35的比酶活均较野生型ω-转氨酶有了明显的提升,其中,ω-转氨酶突变体m19的比酶活最高,是野生型ω-转氨酶的2.05倍;ω-转氨酶突变体m32~m35的比酶活则较野生型ω-转氨酶有了明显的下降。表2野生型ω-转氨酶以及ω-转氨酶突变体m1~m35的相对酶活编号相对酶活编号相对酶活力编号相对酶活野生型100%m12120%m24149%m1142%m13173%m25172%m2135%m14116%m26173%m3171%m15150%m27156%m4132%m16164%m28153%m5129%m17152%m29173%m6136%m18146%m30150%m7173%m19205%m31171%m8152%m20173%m3239%m9150%m21154%m339%m10153%m22150%m3482%m11129%m23116%m355%实施例3:ω-转氨酶突变体的动力学参数具体步骤如下:选择实施例2获得的野生型ω-转氨酶以及ω-转氨酶突变体m1~m5、m7~m8、m13、m19、m26,分别以浓度为0.5~20mm底物1-萘乙酮为底物,测定实施例2获得的野生型ω-转氨酶以及ω-转氨酶突变体m1~m5、m7~m8、m13、m19、m26的初始水解活力,采用graphpadprism7.0软件中的非线性回归方法对数据进行拟合,分别得到米氏(michaelis-menten)方程的km和vmax值,再计算得到kcat和kcat/km值,计算结果见表3;其中,kcat值的计算公式为:kcat=vmax/[e],kcat/km值的计算公式为:kcat/km=kcat/km;其中,[e]为反应中加入的酶的摩尔浓度,单位为μmol·mg-1。由表3可知,ω-转氨酶突变体m1~m5、m7~m8、m13、m19、m26的最大反应速度和催化效率均较野生型ω-转氨酶有了明显的提升,其中,ω-转氨酶突变体m26的最大反应速度提高最多,是野生型ω-转氨酶的4.22倍;ω-转氨酶突变体m26的催化效率提高最多,是野生型ω-转氨酶的13.90倍。表3野生型ω-转氨酶以及ω-转氨酶突变体m1~m5、m7~m8、m13、m19、m26的动力学参数实施例4:ω-转氨酶突变体不对称还原前手性芳香酮生成手性芳香胺的立体选择性和转化率具体步骤如下:选择实施例2获得的野生型ω-转氨酶以及ω-转氨酶突变体m19、m26,将实施例2获得的野生型ω-转氨酶以及ω-转氨酶突变体m19、m26分别以5g/l的添加量添加至2ml的分别含有2mm、10mm、20mm1-萘乙酮的100mm磷酸钾缓冲液(ph7.0)中(除1-萘乙酮外,磷酸钾缓冲液中还含有浓度为100mm的丙氨酸、浓度为20mm的d-葡萄糖、浓度为2mm的nadh、浓度为10u/ml的乳酸脱氢酶ldh、浓度为5u/ml的葡萄糖脱氢酶gdh以及浓度为1mm的plp),在30℃、ph7.0、200rpm条件下反应24h,得到反应液(突变体m1~m31不对称还原1-萘乙酮所得产物的手性色谱分析结果见图15)。分别检测野生型ω-转氨酶以及ω-转氨酶突变体m19、m26不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的立体选择性和转化率,检测结果见表4~6。由表4~6可知,ω-转氨酶突变体m19、m26不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的转化率均较野生型ω-转氨酶有了明显的提升,其中,ω-转氨酶突变体m19不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的转化率是野生型ω-转氨酶的2.05倍,ω-转氨酶突变体m26不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的转化率是野生型ω-转氨酶的1.77倍;并且,野生型ω-转氨酶以及ω-转氨酶突变体m19、m26不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的ee值均为99.9%,可见,ω-转氨酶突变体m19、m26不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的立体选择性较野生型ω-转氨酶并没有下降。表4野生型ω-转氨酶不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的立体选择性和转化率表5ω-转氨酶突变体m19不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的立体选择性和转化率表6ω-转氨酶突变体m26不对称还原1-萘乙酮生成(r)-1-(1-萘基)乙胺的立体选择性和转化率虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。序列表<110>江南大学<120>一种ω-转氨酶突变体及其在生产手性芳香胺中的应用<160>22<170>patentinversion3.3<210>1<211>993<212>dna<213>人工序列<400>1atggcatttagtgccgataccagcgaaatcgtgtatacccacgacaccggtctggattac60atcacctacagcgactacgagctggatcccgctaatccgctggctggtggtgccgcatgg120attgaaggcgcatttgtgccgccgagcgaagcccgcattagtatctttgaccaaggttat180ttacacagcgacgtgacctataccgtgttccatgtgtggaatggcaatgccttccgttta240gacgaccatatcgaacgtttattcagcaatgccgagagcatgcgcattatcccgccgctg300acccaagatgaagtgaaagagatcgctttagagctggtggccaaaaccgaactgcgcgaa360gcctttgtgagcgtgagcattacccgtggctatagcagtaccccgggcgaacgcgacatt420accaaacatcgtccgcaagtgtacatgtacgccgttccgtaccagtggattgtgccgttc480gatcgtatccgcgacggtgtgcacgccatggtggcacagagtgttcgccgtaccccgcgt540agcagcattgacccgcaagttaagaactttcagtggggtgatctgattcgcgccgtgcaa600gaaacccatgatcgtggttttgaggcaccgctgctgctggatggcgatggtctgctggcc660gaaggcagtggctttaacgtggttgtgattaaggatggcgttgtgcgtagccccggtcgt720gcagcactgccgggtattacacgcaaaaccgtgctggagatcgcagaaagtttaggccat780gaggccattctggccgatattactttagccgaactgctggacgcagatgaggtgttaggc840tgtaccacagccggtggtgtttggccgtttgtgagcgttgacggcaacccgattagcgat900ggtgtgccgggtcccgttacccagagcattattcgccgctattgggagctgaacgtggaa960agcagcagtctgctgaccccggttcagtattaa993<210>2<211>330<212>prt<213>人工序列<400>2metalapheseralaaspthrsergluilevaltyrthrhisaspthr151015glyleuasptyrilethrtyrserasptyrgluleuaspproalaasn202530proleualaglyglyalaalatrpilegluglyalaphevalpropro354045serglualaargileserilepheaspglnglytyrleuhisserasp505560valthrtyrthrvalphehisvaltrpasnglyasnalapheargleu65707580aspasphisilegluargleupheserasnalaglusermetargile859095ileproproleuthrglnaspgluvallysgluilealaleugluleu100105110valalalysthrgluleuargglualaphevalservalserilethr115120125argglytyrserserthrproglygluargaspilethrlyshisarg130135140proglnvaltyrmettyralavalprotyrglntrpilevalprophe145150155160aspargileargaspglyvalhisalametvalalaglnservalarg165170175argthrproargserserileaspproglnvallysasnpheglntrp180185190glyaspleuileargalavalglngluthrhisaspargglypheglu195200205alaproleuleuleuaspglyaspglyleuleualagluglysergly210215220pheasnvalvalvalilelysaspglyvalvalargserproglyarg225230235240alaalaleuproglyilethrarglysthrvalleugluilealaglu245250255serleuglyhisglualaileleualaaspilethrleualagluleu260265270leuaspalaaspgluvalleuglycysthrthralaglyglyvaltrp275280285prophevalservalaspglyasnproileseraspglyvalprogly290295300provalthrglnserileileargargtyrtrpgluleuasnvalglu305310315320serserserleuleuthrprovalglntyr325330<210>3<211>21<212>dna<213>人工序列<400>3agcagtaccccgattgaacgc21<210>4<211>21<212>dna<213>人工序列<400>4aatgtcgcgttcaatcggggt21<210>5<211>21<212>dna<213>人工序列<400>5gccgttccgtacctgtggatt21<210>6<211>21<212>dna<213>人工序列<400>6cggcacaatccacaggtacgg21<210>7<211>21<212>dna<213>人工序列<400>7gaaggcagtggcatgaacgtg21<210>8<211>21<212>dna<213>人工序列<400>8cacaaccacgttcatgccact21<210>9<211>17<212>dna<213>人工序列<400>9gaggtgttaggcattac17<210>10<211>17<212>dna<213>人工序列<400>10gctgtggtaatgcctaa17<210>11<211>21<212>dna<213>人工序列<400>11ttaggctgtaccccggccggt21<210>12<211>21<212>dna<213>人工序列<400>12aacaccaccggccggggtaca21<210>13<211>27<212>dna<213>人工序列<400>13gaggtgttaggcattaccccggccggt27<210>14<211>27<212>dna<213>人工序列<400>14aacaccaccggccggggtaatgcctaa27<210>15<211>21<212>dna<213>人工序列<400>15agcagtaccccgccggaacgc21<210>16<211>21<212>dna<213>人工序列<400>16aatgtcgcgttccggcggggt21<210>17<211>21<212>dna<213>人工序列<400>17agcagtaccccgcttgaacgc21<210>18<211>21<212>dna<213>人工序列<400>18aatgtcgcgttcaagcggggt21<210>19<211>21<212>dna<213>人工序列<400>19gccgttccgtacgcttggatt21<210>20<211>21<212>dna<213>人工序列<400>20cggcacaatccaagcgtacgg21<210>21<211>21<212>dna<213>人工序列<400>21gaaggcagtggcaaaaacgtg21<210>22<211>21<212>dna<213>人工序列<400>22cacaaccacgtttttgccact21当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1