细胞外泌体优化培养系统的制作方法
本实用新型涉及生物技术领域,尤其涉及一种细胞外泌体优化培养系统。
背景技术:
外泌体是微小的膜结合囊泡(直径为40~200nm),在生理和病理条件下,许多不同类型的细胞将其释放到细胞外。外泌体还有信号蛋白,microrna,mrna,dna和脂质,在转运的时候能够调节受体细胞的各种生命活动。
外泌体作为药物载体进行药物运输具有独特的优势,主要体现在:(1)当使用自源外泌体时,外泌体引起的有害免疫反应极低;(2)外泌体在人体血液中的稳定性较好;(3)向细胞转运“货物”的效率很高;(4)外泌体运载药物时具有一定的靶向性;(5)外泌体直径在40~100nm之间,因此可以很好地利用增强渗透滞留(epr),有选择性地渗入到肿瘤或者炎症组织部位。
外泌体技术作为递送平台的临床前和临床开发需要大量的外泌体。外泌体的分离方法需要易于扩展以支持大规模生产。目前的方法产量低并且不可扩展,这阻碍了外泌体在临床前动物中功效评估。通常每只小鼠使用的剂量为109-1011,以实现生物学结果。分离这种外泌体量需要处理一升的条件培养基来处理一只动物。因此,顺利支持动物研究的外泌体生产可能需要数月时间。外泌体通常通过分子大小排阻或亲和层析,或通过密度梯度或差异超速离心(uc)来纯化。外泌体差速离心回收的金标准需要四到五个连续的离心步骤。这些方法都不可扩展。与永生肿瘤细胞系不同,间充质干细胞(msc)的扩增能力是有限的。外泌体的低产量阻碍了间充质干细胞用于外泌体的大规模生产。
与此同时,间充质干细胞生长的微环境也对外泌体的产量和质量有着最直接的关联,这些微环境包括了细胞生长的依附材料、受到的力学刺激、条件培养基的流动性等等。间充质干细胞在不同微环境下分泌的外泌体的生物学质量之间存在差异,因此如何采用更好的培养微环境也是外泌体在临床应用中的重要技术难题。
因此,基于上述外泌体的独特优势以及现有技术下细胞培养中分泌的外泌体产量和生物学质量有限的问题,通过在细胞的培养中提高细胞分泌的外泌体的产量和生物学质量成为亟待解决的技术难题。
实用新型
本实用新型的目的是提供一种细胞外泌体优化培养系统,以解决提高细胞在培养过程中外泌体分泌产量和生物学质量的技术问题。
本实用新型的细胞外泌体优化培养系统是这样实现的:
一种细胞外泌体优化培养系统,包括:
细胞承载组件,所述细胞承载组件包括采用pdms软刻蚀及不可逆封接形成的微流控芯片体,以及与所述微流控芯片体的底端面贴合相接的透明玻璃支承板;其中在微流控芯片体内预制形成的若干条阵列分布的且彼此贯通的微流通道;所述微流通道分别与预制在所述微流控芯片体内的一进液通道和出液通道连通;所述进液通道远离微流通道的一端设为进液口,以及与所述出液通道远离所述微流通道的一端设为出液口;
pdms形变膜,所述pdms形变膜与所述微流控芯片体背离所述透明玻璃支承板的顶端面相连;所述pdms形变膜适于向背离所述透明玻璃支承板一侧凸起变形;
透明盖板,所述透明盖板上预制有若干条阵列分布的遮光条,所述透明盖板适于从所述透明玻璃承载板的一侧使若干条遮光条中部分的遮光条覆盖部分的微流通道以阻挡光线穿透。
在本实用新型可选的实施例中,若干条所述微流通道采用同心圆结构;以及
若干条所述遮光条采用同心圆结构。
在本实用新型较佳的实施例中,若干条所述微流通道采用同心正多边形结构;以及
若干条所述遮光条采用同心正多边形结构。
在本实用新型较佳的实施例中,若干条所述遮光条适于对若干条微流通道进行间隔遮挡,即每相邻的三条微流通道中位于中间的微流通道被遮光条遮挡。
在本实用新型较佳的实施例中,所述pdms形变膜围绕所述微流通道的周向外侧部分与微流控芯片体之间固连。
在本实用新型较佳的实施例中,所述细胞外泌体优化培养系统还包括与进液口相连的进液管道,以及与所述出液口相连的出液管道。
在本实用新型较佳的实施例中,所述进液管道上且近进液口设有一进液电磁控制阀;
所述出液管道上近出液口设有一出液电磁控制阀。
采用了上述技术方案,本实用新型具有以下的有益效果:本实用新型的细胞外泌体优化培养系统,通过控制进液口和出液口的开闭状态以使pdms形变膜在变形和复位之间切换,从而使得支持细胞生长的水凝胶结合进液口和出液口的开闭状态的控制可以使得交联固定的凝胶中的细胞处于3d培养状态并受到周期性的应力刺激,由3d和应力实现细胞三维立体培养的状态下产生一系列的应变/拉伸刺激,从而明显提高细胞分泌的外泌体的产量和生物学质量。
附图说明
图1为使用本实用新型的细胞外泌体优化培养系统的示意图;
图2为本实用新型的细胞外泌体优化培养系统的微流控芯片体的结构示意图;
图3为本实用新型的细胞外泌体优化培养系统的透明盖板的结构示意图;
图4为本实用新型的细胞外泌体优化培养系统的从透明盖板一侧照射紫外光的状态示意图;
图5为本实用新型的细胞外泌体优化培养系统的pdms形变膜变形状态下的示意图;
图6为本实用新型的细胞外泌体优化培养系统的微流控芯片体在另一种实施方式下的示意图;
图7为本实用新型的细胞外泌体优化培养系统的pdms形变膜在未变形状态下的细胞的示意图;
图8为本实用新型的细胞外泌体优化培养系统的pdms形变膜在变形状态下的细胞的示意图;
图9为采用本实用新型的细胞外泌体优化培养系统进行细胞外泌体优化培养方法中pdms膜输注液体时鼓起的高度与细胞所受牵张力大小的关系图;
图10至图21为以软骨细胞为例通过实验来检验经采用本实用新型的细胞外泌体优化培养系统进行细胞外泌体优化培养方法下的细胞分泌的外泌体的具体情况。
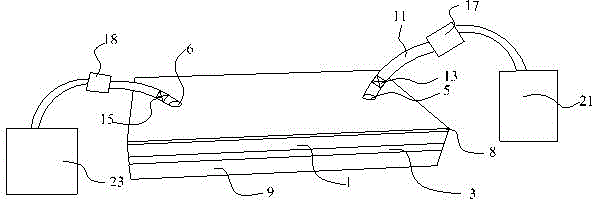
图中:微流控芯片体1、微流通道2、进液通道201、出液通道202、透明玻璃支承板3、进液口5、出液口6、pdms形变膜8、透明盖板9、遮光条10、进液管道11、出液管道12、进液电磁控制阀13、出液电磁控制阀15、进液控制泵17、出液控制泵18。
具体实施方式
为了使本实用新型的内容更容易被清楚地理解,下面根据具体实施例并结合附图,对本实用新型作进一步详细的说明。
请参阅图1至图8所示,本实施例提供了一种细胞外泌体优化培养系统,包括:细胞承载组件、设于细胞承载组件顶端面的pdms形变膜8,以及设于细胞承载组件底端面的透明盖板9。
细胞承载组件包括采用pdms软刻蚀及不可逆封接形成的微流控芯片体1,以及与微流控芯片体1的底端面贴合相接的透明玻璃支承板3;其中在微流控芯片体1内预制形成的若干条阵列分布的且彼此贯通的微流通道2;微流通道2分别与预制在微流控芯片体1内的一进液通道201和出液通道202连通;进液通道201远离微流通道2的一端设为进液口5,以及与出液通道202远离微流通道2的一端设为出液口6。此处设置的透明玻璃支承板3采用透明的玻璃制成,使得光线易于透过透明玻璃支承板3照射至微流通道2内。
pdms形变膜8与微流控芯片体1背离透明玻璃支承板3的顶端面相连;pdms形变膜8适于向背离透明玻璃支承板3一侧凸起变形。此处需要说明的是,pdms形变膜8围绕微流通道2的周向外侧部分与微流控芯片体1之间固连,此处的固连采用例如但不限于粘接固定的方式。也就是说,当pdms形变膜8向背离透明玻璃支承板3一侧凸起变形时,pdms形变膜8主要是正对微流通道2的部分凸起变形。
透明盖板9上预制有若干条阵列分布的遮光条10,透明盖板9适于从透明玻璃承载板的一侧使若干条遮光条10中部分的遮光条10覆盖部分的微流通道以阻挡光线穿透。对于透明盖板9来说,可以通过例如但不限于粘接固定的方式与透明玻璃承载板固定。
一种可选的情况下,若干条微流通道2采用同心圆结构;以及若干条遮光条10采用同心圆结构。
另一种可选的情况下,若干条微流通道2采用同心正多边形结构;以及若干条遮光条10采用同心正多边形结构。
具体的,若干条遮光条10适于对若干条微流通道2进行间隔遮挡,即每相邻的三条微流通道2中位于中间的微流通道2被遮光条10遮挡。这样的情况下,使得遮光条10对于若干条微流通道2中其中部分的微流通道2进行光线的遮盖。这样做的意义是,当从透明盖板9背离透明玻璃支承板3的一侧进行紫外光照射一定时间时,以使若干条微流通道2中没有被遮光条10遮挡的微流通道2可以接受紫外光的照射,此处需要加以说明的是,本实施例采用的凝胶中具有光敏基团,接受紫外光照射的微流通道2中的凝胶会交联凝固,而被透明盖板9的遮光条10遮挡的微流通道2由于被遮光条10遮挡了,凝胶没有接受到紫外光的照射,所以被遮光条10遮挡的微流通道2中的凝胶不会交联凝固。
为了便于对微流通道2中通入培养基或者凝胶,或者凝胶与培养基的混合物,本实施例的细胞外泌体优化培养系统还包括与进液口5相连的进液管道11,以及与出液口6相连的出液管道12。考虑到便于对进液口5智能化地控制进液量,以及对于出液口6智能化地控制出液量,在进液管道11上且近进液口5设有一进液电磁控制阀13,以及在出液管道12上近出液口6设有一出液电磁控制阀15。此处具体来说,可在进液管道11与储存有培养基的储液罐21之间设置一进液控制泵17,以及在出液管道12与用于储存废液的收液罐23之间设置一出液控制泵18。
采用实施例1的细胞外泌体优化培养系统对应的具体的细胞外泌体优化培养方法,包括:
步骤s1:出液口6关闭,打开进液口5以通过进液口5从进液通道201通入含有细胞的凝胶;
步骤s2:待凝胶充满微流通道2且使pdms形变膜8向背离透明玻璃支承板3一侧凸起变形至一定高度h后关闭进液口5;
步骤s3:从透明盖板9背离透明玻璃支承板3的一侧进行紫外光照射一定时间,以使若干条微流通道2中接受紫外光照射的微流通道2中的凝胶交联凝固,而被透明盖板9的遮光条10遮挡的微流通道2中的凝胶不会交联凝固;此处需要说明的是,本实施例采用的凝胶中具有光敏基团。
对于凝胶,需要说明的是,凝胶的学名为甲基丙烯酸酐化明胶(gelma),它是由甲基丙烯酸酐(ma)与明胶(gelatin)制备获得,是一种光敏性的生物水凝胶材料。该材料具有优异的生物相容性,且可由紫外光或可见光激发固化反应,形成适于细胞生长与分化且有一定强度的三维结构。其生物相容性远优于基质胶、纤维蛋白胶,而与胶原性能相近。
对于本实施例采用的具有光敏基团的凝胶的制备采用如下方式:将10g水凝胶粉末溶解在100ml的dpbs中,置于50°孵箱中,在磁力搅拌下完全溶解后,逐滴加入8ml甲基丙烯酸酐,在孵箱中继续反应3h后,加入400mldpbs稀释,后于透析膜(分子截留量:12-14kda)中进行透析,置于40℃中反应一周,最后搜集后冻干备用。
步骤s4:打开出液口6,使得若干条微流通道2中未交联凝固的凝胶从出液口6排出;
步骤s5:关闭出液口6,打开进液口5,对微流通道2内通入培养基,以使pdms形变膜8向背离透明玻璃支承板3一侧凸起变形至一定高度h后,关闭进液口5,打开出液口6,以使pdms形变膜8复位,形成对于交联凝固状态下的细胞的3d培养配合应力刺激的培养环境;
步骤s6:重复步骤s5通过控制进液口5和出液口6的开闭状态以使pdms形变膜8在变形和复位之间切换,从而使得支持细胞生长的水凝胶结合进液口5和出液口6的开闭状态的控制可以使得交联固定的凝胶中的细胞受到周期性的应力刺激,由应力实现细胞培养的状态下产生一系列的应变/拉伸刺激,从而明显提高细胞分泌的外泌体的产量和生物学质量。
需要说明的是,对于进液口5和出液口6的开闭状态的控制具体可以通过对于与进液电磁控制阀13、进液控制泵17以及出液电磁控制阀15和出液控制泵18电性连接的控制器来智能化调控,具体为调整进液电磁控制阀13和出液电磁控制阀15的开闭时间,由两者开闭时间的调控来实现微流通道2内液体的流通量,以此来实现对于pdms形变膜8受到微流通道2内的液体的压力而产生的相对于微流控芯片体1凸起的高度的调整,使得pdms形变膜8向背离透明玻璃支承板3一侧凸起变形的高度h控制在一定的范围内,以使该范围对应的pdms形变膜8的变形产生的对于细胞的应力刺激使得细胞分泌的外泌体的产量为最优情况。
优选的情况下,步骤s5中的pdms形变膜8向背离透明玻璃支承板3一侧凸起变形的高度h范围为0.2~0.4mm。在此高度基础上,产生的对于细胞的应力刺激使得细胞分泌的外泌体的产量为最优情况,具体参阅图9所示的pdms膜输注液体时鼓起的高度与细胞所受牵张力大小的关系图,参阅相关文献
([1]piffouxm,nicolás-boludaa,mulens-ariasv,etal.extracellularvesiclesforpersonalizedmedicine:theinputofphysicallytriggeredproduction,loadingandtheranosticproperties.advdrugdelivrev.2019.138:247-258;[2]pateldb,santorom,bornlj,fisherjp,jaysm.towardsrationallydesignedbiomanufacturingoftherapeuticextracellularvesicles:impactofthebioproductionmicroenvironment.biotechnoladv.2018.36(8):2051-2059.[3]letsioue,sammanis,zhangw,etal.pathologicmechanicalstressandendotoxinexposureincreaseslungendothelialmicroparticleshedding.amjrespircellmolbiol.2015.52(2):193-204.)报道,细胞受到10%-40%的牵张力时最合适。牵张力过小则效果不明显;牵张力过大,容易损伤细胞结构,本实施例根据实验确定当pdms形变膜8向背离透明玻璃支承板3一侧凸起变形的高度h范围为0.2~0.4mm时,细胞所受到的牵张力为10%-40%。
此处需要特别说明的是,不管微流通道2的形状和具体的规格大小如何设置,均可以通过调整进液电磁控制阀13和出液电磁控制阀15的开闭时间,由两者开闭时间的调控来实现微流通道2内液体的流通量,以此来实现对于pdms形变膜8受到微流通道2内的液体的压力而产生的相对于微流控芯片体1凸起的高度的调整,使得pdms形变膜8向背离透明玻璃支承板3一侧凸起变形的高度h范围控制在0.2~0.4mm。
需要加以说明的是,采用本实施例的细胞外泌体优化优化培养方法对于细胞分泌的外泌体具体的“优化”不仅表现在提高外泌体的产量,还表现在于提高外泌体的生物学质量。
以软骨细胞为例通过下列实验来检验经本实施例的细胞外泌体优化优化培养方法下的细胞分泌的外泌体的具体情况:
(1)请参阅图10所示的对外泌体的鉴定,分别检测在对应2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的细胞分泌的外泌体粒径图,具体为:三组外泌体粒径珠峰在120nm附近,正常外泌体直径范围为50-200nm,均符合国际标准,而且呈相对的正态分布,检测结果可信度高。2d培养组的外泌体直径略大于其他组。
(2)请参阅图11所示的对外泌体的鉴定,分别通过wb鉴定对应2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的细胞分泌的外泌体特征蛋白,具体的,westernblotting结果验证了外泌体内特异性标志蛋白的表达,可见此外泌体内明显表达cd9、cd63、tsg101蛋白。3d培养的外泌体组灰度值高于2d培养组,说明外泌体的蛋白富集度更高。
(3)请参阅图12所示的对外泌体的鉴定,tem电镜下对应2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的细胞分泌的外泌体的结构,具体的:透射电镜可见各组外泌体具有明显的膜结构,且呈圆盘形。
(4)请参阅图13所示的对不同环境下培养的细胞分泌的外泌体的数量的鉴定,分别对应2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的细胞分泌的外泌体产量对比,具体的:产量=以nanosighttrackinganalysis计算外泌体数量除以细胞数量。每组重复7次,单因素方差分析差异性。图解:与2d培养相比,3d状态下细胞分泌的外泌体数量更多,如果同时存在力学刺激,其产量比单纯3d培养更多,即3d配合应力刺激的培养组的产量大于单纯3d培养组的产量,而单纯3d培养组的产量大于2d培养组的产量。
(5)请参阅图14所示的对不同环境下培养的细胞分泌的外泌体的质量的鉴定,本鉴定过程采用对于外泌体的蛋白组分进行,分别对应2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的细胞分泌的外泌体蛋白质组含量图,具体的:2d培养组(浅蓝色)和3d培养组(灰色)以及3d配合应力刺激的培养组(蓝色)中检测到的蛋白维恩图。数字表示每一组中检测到的蛋白数量,蛋白含量用ibaq法测定。图解:三种培养方式中,有380种蛋白存在交集,其外泌体都具有类似的蛋白组成。但是3d+应力刺激组的蛋白种类最多,且含有87种独有的蛋白种类,由此可知,3d配合应力刺激的培养组的细胞分泌的外泌体的质量最佳。
(6)请参阅图15和图16所示的对不同环境下培养的细胞的迁移率鉴定,分别对应2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的细胞划痕实验,其中图15为光镜下采集划痕实验后细胞迁移距离的变化图,图16为统计分析细胞迁移率结果。实验证明表明3d配合应力刺激的培养组对促进软骨细胞迁移的能力最强,其次为3d培养组。
(7)请参阅图17所示的对不同环境下培养的细胞的活性鉴定,分别对空白组、2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的cck-8细胞增殖能力检测结果,在加入条件培养基3天后,各组明显大于对照组,在第四天时,3d配合应力刺激的培养组的细胞活性最强,与其他组比较时有统计学差异。
(8)请参阅图18和图19所示的对不同环境下培养的细胞分泌的外泌体迁移性鉴定,分别对空白组、2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的细胞分泌的外泌体迁移实验结果,利用transwell小室测定软骨细胞的迁移能力。其中穿过基质的细胞被染色为紫色,细胞数量可直接反应其侵袭能力。其中3d配合应力刺激的培养组的外泌体中穿过的细胞最多,迁移能力最强,其次为3d培养组。
(9)请参阅图20所示的对不同环境下培养的细胞分泌的外泌体蛋白表达结果鉴定,通过对空白组、2d培养组、3d培养组和本实施例的3d配合应力刺激的培养组的细胞分泌的外泌体对colii、sox-9、aggrecan这三个软骨标志蛋白能代表软骨表型的维持对比可知,其中3d配合应力刺激的培养组的三种蛋白表达最高,表明3d+应力刺激组外泌体的功能最好。
(10)请参阅图21所示的细胞在静力状态下和细胞受到牵张力状态下的电镜对比图,其中,左图为细胞在静力状态下的电镜图,右图为细胞受到牵张力状态下的电镜图。具体的,细胞受到了牵张力的作用而发生变形,变形幅度为30%。
综上,通过本实施例的细胞外泌体优化培养方法培养的细胞不仅可以提高细胞的外泌体分泌量,而且分泌的外泌体的生物学质量更强。
相比现有技术中的例如对于细胞进行的气压应力刺激的培养方法,本实施例的细胞外泌体优化培养方法拥有以下几点优势:
(1)本实施例的细胞外泌体优化培养方法无需额外的应力刺激系统,仅靠细胞培养生长的过程必需的培养基的循环供给即可产生循环的应力刺激,即对于本实施例中的培养基既是细胞生长的营养来源,又形成了拉伸凝胶产生细胞应力刺激的原动力。现有技术中例如气压产生的应力刺激,气压属于细胞培养生长的非必需的因素,本质意义上可以说,气压刺激属于外部的额外刺激因素。
(2)本实施例采用的细胞外泌体优化培养系统中的培养基时刻处于循环流动状态,这样可以及时将细胞产生并分泌道培养基中的外泌体排出并搜集,减少外泌体被其他细胞摄取的可能性,从而提高了外泌体的产量,并且时刻为细胞提供最充沛的营养物质,且及时带走各种细胞代谢废物,减少细胞代谢废物对于细胞活性的影响。对于细胞培养本身来说,也需要更新培养基,以使得细胞实时处于最佳的生长环境,因此,利用循环更新的培养基来产生对于细胞的应力刺激,相比创造提供额外的应力刺激原动力来说,本实施例在节约成本上有明显的优势。
(3)对于本实施例的细胞外泌体优化培养系统中,使用的是循环更新的培养基来对细胞产生应力刺激,相比现有技术中例如公告号为cn104099247公开的基于微流控芯片的加压细胞培养系统和方法中采用的由压力的调控来产生对于细胞的应力刺激,虽然压力可以产生对于细胞的应力刺激,可以用于实验环境下细胞受到应力刺激下的各种性能的检测,但是对于细胞分泌外泌体来说,压力相对于细胞培养来说毕竟形成了外部的刺激因素,这样的外部刺激因素对于细胞外泌体的分泌存在影响,这样的影响是正向影响还是反向影响需要验证才能确定,并且可以肯定的是是,压力对于细胞分泌外泌体来说不是必需的因素。而本实施例采用的培养基作为细胞应力刺激的原动力,对于细胞本身培养的过程来说培养基本来就是必需品,不是外部因素,因此可以有效避免例如压力等外部刺激可能存在的对于细胞培养产生的方向的不利的影响。
以上的具体实施例,对本实用新型的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上仅为本实用新型的具体实施例而已,并不用于限制本实用新型,凡在本实用新型的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本实用新型的保护范围之内。
在本实用新型的描述中,需要理解的是,指示方位或位置关系的术语为基于附图所示的方位或位置关系,仅是为了便于描述本实用新型和简化描述,而不是指示或暗示所指的设备或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本实用新型的限制。
在本实用新型中,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”、“固定”等术语应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本实用新型中的具体含义。
在本实用新型的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,或者是该实用新型产品使用时惯常摆放的方位或位置关系,仅是为了便于描述本实用新型和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本实用新型的限制。此外,术语“第一”、“第二”、“第三”等仅用于区分描述,而不能理解为指示或暗示相对重要性。
此外,术语“水平”、“竖直”、“悬垂”等术语并不表示要求部件绝对水平或悬垂,而是可以稍微倾斜。如“水平”仅仅是指其方向相对“竖直”而言更加水平,并不是表示该结构一定要完全水平,而是可以稍微倾斜。
在本实用新型中,除非另有明确的规定和限定,第一特征在第二特征之上或之下可以包括第一和第二特征直接接触,也可以包括第一和第二特征不是直接接触而是通过它们之间的另外的特征接触。而且,第一特征在第二特征之上、上方和上面包括第一特征在第二特征正上方和斜上方,或仅仅表示第一特征水平高度高于第二特征。第一特征在第二特征之下、下方和下面包括第一特征在第二特征正下方和斜下方,或仅仅表示第一特征水平高度小于第二特征。
- 还没有人留言评论。精彩留言会获得点赞!