神经细胞培养材料及神经损伤治疗剂的制作方法
本发明涉及包括培养神经细胞时的支架材料的培养材料以及使用该培养材料的神经损伤治疗剂。
背景技术:
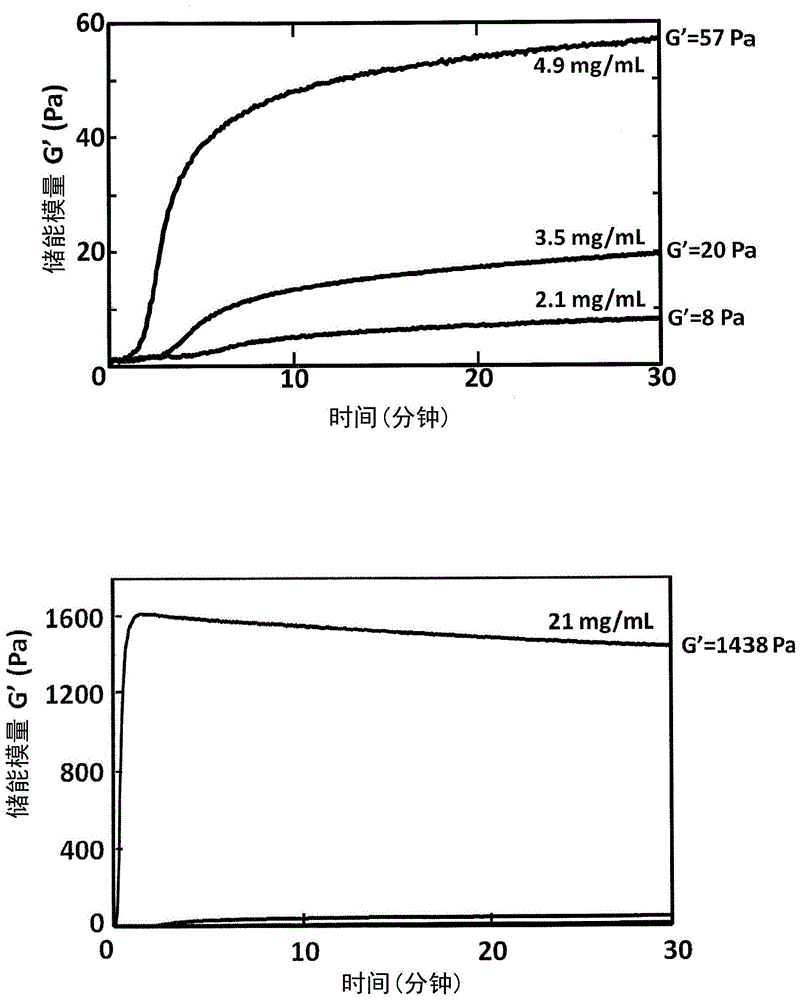
:现在,要求使受到损伤的中枢神经恢复。为了实现这一点,需要进行神经细胞的培养,维持机体内的神经细胞的存活,以及促进机体内的神经细胞的突起延伸,重建神经回路。在神经中,脑和脊髓这样的中枢神经系统受到损伤的情况下,不会自然修复。这是因为,中枢神经系统的神经细胞具有不易分裂增殖的性质,通过机体反应在损伤部位生成被称为胶质瘢痕的硬质而缺乏柔软性的纤维组织,神经纤维无法越过该胶质瘢痕而延伸。此外,也可例举如下原因:机体内存在阻碍神经突起延伸的因子(例如nogo、mag、omgp、sema3a等),在这些因子的作用下,神经突起的延伸受到阻碍。神经细胞与其它细胞不同,由细胞体和从细胞体延伸出的轴突以及它们的附带细胞构成。因此,神经细胞的培养中,除了维持神经细胞的生存以外,还需要促进轴突等的延伸。但是,以往的细胞培养中使用的含血清的培养基并不足以促进神经细胞、神经母细胞、神经干细胞之类的脆弱细胞的增殖,而且含血清的培养基显著促进非神经细胞的增殖,因此存在培养出的全部细胞中非神经细胞所占的比例极高这一不理想的问题。于是,提出了在每1升培养基中含有至少2mg库尼兹型蛋白酶抑制剂(日文:クニッツ型プロテアーゼ阻害剤)的神经细胞培养用培养基(专利文献1)。专利文献2公开了将含有聚乳酸等机体吸收性聚合物和胶原的组合物成形为板状、丝状、网状结构的神经再生导向器。专利文献2中,将其移植到大鼠的坐骨神经切断部,经过一定时间后取出神经,用肉眼确认坐骨神经的再生。此外,专利文献3公开了一种移植用支架材料,其是在由生物降解性高分子构成的纤维状结构体的一端结合针状磁性体而成的移植用支架材料,或者是在由生物降解性高分子构成的纤维状结构体的内腔中插入针状磁性体而成的移植用支架材料,所述生物降解性高分子选自聚乙醇酸、聚乳酸、乙醇酸/乳酸共聚物。专利文献3中,如bbb(bassobeattiebresnahan)评分(运动麻痹的评价分数)所示,在对脊髓损伤大鼠移植该支架结构体的情况下确认了大鼠的运动恢复。如这些文献所示,因为神经细胞需要轴突这一突起的延伸,所以在(包括体内的生长在内的)培养中需要具有机体亲和性或生物降解性的支架。如专利文献2中所介绍的,胶原是具有机体亲和性且容易获取的材料。已知胶原有多种类型。胶原具有α链的三螺旋结构。专利文献4中记载了通过用规定的酶将该α链的末端切断而制成的低粘合性胶原(lowadhesivescaffoldcollagen:以下也称为“lascol”)。lascol作为细胞培养用支架的材料是已知的(专利文献4)。与现有的使用胶原的支架相比,通过采用使用lascol的支架,欲培养的细胞形成凝集块(球状体),可在更接近于机体内的三维状态下对欲培养的细胞进行培养(专利文献4)。此外,该lascol对于干细胞的分化促进有效果(专利文献5)。另外,作为使用增殖因子tgf-β1的中枢神经损伤治疗剂,在专利文献6中有介绍。现有技术文献专利文献专利文献1:日本专利特开平07-046982号公报专利文献2:日本专利特开2007-177074号公报专利文献3:日本专利特开2014-014382号公报专利文献4:国际公开第2015/167003号专利文献5:国际公开第2015/167004号专利文献6:国际公开第2010/024432号非专利文献非专利文献1:k.morimoto等,bioscience,biotechnology,andbiochemistry,第68卷,第861-867页,2004技术实现要素:发明所要解决的技术问题但是,不清楚上述胶原、lascol等对于维持神经细胞的存活、突起延伸是否有效果。此外,为了使受到损伤的中枢神经恢复而能够简便地给药至患处(损伤的脊髓等)的形态也是未知的。解决技术问题所采用的技术方案于是,通过获得lascol对于维持神经细胞的存活和轴突的延伸有效果这一发现,从而完成了本发明。更具体而言,本发明的神经细胞培养材料包含lascol。此外,本发明的神经损伤治疗剂包含lascol。另外,本发明可提供使用上述神经细胞培养材料的神经细胞的培养方法,并且可提供使用上述神经损伤治疗剂的神经损伤治疗方法。发明效果本发明的神经细胞培养材料及神经损伤治疗剂中所含的成分(lascol)没有毒性,机体亲和性也高。此外,本发明的神经损伤治疗剂通过调整ph和提高温度,lascol的形态由液体状转变成凝胶状态。因此,能够以液体形式注入,因而可更简便地给药至患处(损伤的脊髓等),治疗时的侵袭性低。此外,注入体内后,容易滞留于患处。其结果是,在神经细胞生长过程中,可减少给药次数,患者的负担也小。认为能够进行这样的给药的原因在于,所含的成分(lascol)与现有的胶原相比,具有在高浓度下粘性也低的特性以及纤维形成速度慢的特性。认为这些特性的原因在于lascol的结构,即,通过规定的酶处理,在保持三螺旋结构的同时,α链的末端(容易引起变态反应的端肽区域)被切断。附图说明图1是表示不同浓度的lascol溶液的弹性模量的时间变化的图。图2是表示不同浓度的lascol下应变和应力的关系的图。图3是表示lascol涂布组(图中标记为lascol)、端胶原涂布组(图中标记为端胶原)、聚-l-赖氨酸涂布组(图中标记为pll)以及对照组(图中标记为未涂布)中将神经细胞培养48小时的结果的相差显微镜照片。图4是图3的lascol涂布组的神经细胞的sem放大照片。图5是图4的进一步sem放大照片。图6是图3的端胶原涂布组的神经细胞的sem放大照片。图7是图6的进一步sem放大照片。图8是图3的聚-l-赖氨酸涂布组的神经细胞的sem放大照片。图9是图8的进一步sem放大照片。图10是表示lascol涂布组(图中标记为lascol)、端胶原涂布组(图中标记为端胶原)以及对照组(图中标记为未涂布)中培养星形胶质细胞时的细胞数的测定结果的图。图11是表示lascol涂布组(图中标记为lascol)、端胶原涂布组(图中标记为端胶原)、聚-l-赖氨酸涂布组(图中标记为pll)以及对照组(图中标记为未涂布)中将骨髓基质细胞培养7天的结果的相差显微镜照片。图12是表示lascol涂布组(图中标记为lascol)以及对照组(图中标记为未涂布)中培养骨髓基质细胞时的细胞数的测定结果的图。图13是表示lascol涂布组(图中标记为lascol)以及端胶原涂布组(图中标记为端胶原)中将巨噬细胞培养48小时的结果的相差显微镜照片。图14是表示lascol涂布组(图中标记为lascol)以及对照组(图中标记为pbs)中的bbb运动评价尺度的评价结果的图。图15是表示将脊髓损伤部分的星形胶质细胞用抗gfap抗体染色的结果的荧光显微镜照片。图16是表示将再生的脊髓损伤部分的神经用抗磷酸化gap-43抗体染色的结果的荧光显微镜照片。图17是埋植端胶原的海绵样品2周后的脊髓截面的染色照片。图18是图17的放大照片。图19是埋植lascol海绵样品2周后的脊髓截面的染色照片。图20是图19的放大照片。图21是由截面照片求出海绵样品中神经轴突的量的图。具体实施方式以下,对本发明的神经细胞培养材料及神经损伤治疗剂,示出附图和实施例进行说明。另外,以下的说明是对本发明的一种实施方式和一个实施例进行例示,本发明并不限定于以下的说明。以下的说明可在不脱离本发明的思想的范围内进行改变。作为本发明的神经细胞培养材料及神经损伤治疗剂的材料使用的lascol包括胶原或端胶原的分解产物。此外,也可以仅为lascol。该分解产物具有胶原所具有的与细胞的粘合性减弱、变为低粘合性的性质。lascol是通过将胶原或端胶原用酶分解而得到的。并且根据分解时的条件不同,所包含的肽序列不同。即,lascol根据分解的条件不同,可获得不同种类的lascol。可用于本发明的lascol的特征是,由胶原或端胶原的三螺旋结构域的如下述(a)所示的氨基末端的氨基酸序列中y1和y2之间的化学键切断而成的α链的组合构成。(a)-y1-y2-y3-g-y4-y5-g-y6-y7-g-y8-y9-g-(序列编号1);(其中,g是甘氨酸,y1~y9是任意氨基酸)。已知胶原的三螺旋结构域是连续的序列-g-x-y-(g是甘氨酸,x和y是任意氨基酸)。上述序列中,“-y3-g-y4-y5-”中的“g”表示三螺旋结构域的n末端侧的甘氨酸。由上述序列可知,y1和y2之间的化学键切断是指在三螺旋结构域的外侧进行切断。如下所述,如果分解条件不同,则在三螺旋结构域的内侧发生切断。本发明中使用的lascol之一是在三螺旋结构域的外侧发生了切断的lascol。以下将其称为lascol-a。本发明的神经细胞培养材料及神经损伤治疗剂中使用的lascol尤其是在维持神经细胞的存活或使突起延伸时可以优选使用。如下述实施例中所示,lascol-a培养神经细胞以外的细胞的能力非常低。但是具有维持神经细胞的存活、促进神经纤维的延伸的能力。另外,已知根据分解的条件,可获得以下lascol。由胶原或端胶原的三螺旋结构域的如下述(b)所示的氨基末端的氨基酸序列中x1和x2之间的化学键、x2和g之间的化学键、g和x3之间的化学键、x4和g之间的化学键、或x6和g之间的化学键切断而成的α链的组合构成。(b)-g-x1-x2-g-x3-x4-g-x5-x6-g-(序列编号2);(其中,g是甘氨酸,x1~x6是任意氨基酸)。将其称为lascol-b。lascol-b是三螺旋结构域的内侧发生切断。序列编号2中,“-g-x1-x2-g-”的“g”是三螺旋结构域的n末端侧的甘氨酸。当然,也可以是包含其它肽的lascol。从维持神经细胞的存活和进行突起延伸的角度考虑,lascol-a是目前已知的lascol中最优选的。但是,不排除其它lascol。此外,神经细胞培养材料及神经损伤治疗剂中也可以包含神经细胞的生长因子。本发明的神经细胞培养材料及神经损伤治疗剂中使用的lascol可在酸性状态下以溶液形式保存。并且通过调整ph和浓度、将温度升至体温而变成凝胶状。通过变成凝胶状,lascol在体内的扩散得到抑制,长期在患处发挥出培养神经细胞的效果。另外,本发明中,神经细胞的培养也包括例如神经细胞能够以接近机体内的形态存活(能够良好地存活)、能够使轴突(神经突起)延伸。变成凝胶状时的弹性模量与溶液中的lascol的浓度、ph和温度成比例。在下述实施例中,示出调整ph和浓度、在液体状态下吸到注射器中、通过注射给药至患处、在患处内变成凝胶状的例子。但是,本发明的神经细胞培养材料及神经损伤治疗剂中使用的lascol也可以制成膜状或海绵状而埋入患处。另外,膜状、海绵状是指将lascol制成规定形状的产物(也称为形状体)。如下所述在本发明中使用的lascol的浓度如果在3.5mg/ml(以下述的“实用弹性模量”计为20pa)以上,则可以呈凝胶状。因此,作为神经细胞培养材料及神经损伤治疗剂使用的lascol的浓度如果在3.5mg/ml以上,则在给药至体内时能够停留、使神经细胞再生。作为有关lascol的制备方法的发现,lascol-b和lascol-a大致相同。于是,关于在两者中共通的发现,仅针对lascol进行说明。此外,以下说明中,“分解产物”是指lascol。<lascol的材料>作为lascol的材料的胶原或端胶原无特别限定,可以是公知的胶原和端胶原。作为胶原,可使用哺乳类(例如牛、猪、兔、人、兔或小鼠等)、鸟类(例如鸡等)、或者鱼类(例如鲨鱼、鲤鱼、鳗鱼、金枪鱼(例如黄肌金枪鱼)、罗非鱼、鲷鱼、鲑鱼等)或爬行类(例如鳖)的胶原。本发明中使用的胶原例如可使用来源于上述哺乳类或鸟类的真皮、肌腱、骨或筋膜等的胶原,来源于上述鱼类的皮肤或鳞等的胶原,来源于上述爬行类的真皮、肌腱、骨等的胶原。此外,作为lascol的制备中使用的端胶原,可使用将上述哺乳类、鸟类、鱼类或爬行类的胶原用蛋白酶(例如胃蛋白酶等)处理而得的、从胶原分子的氨基末端和/或羧基末端将端肽部分除去而成的端胶原。其中,可优选使用鸡、猪、牛、人或大鼠的胶原或端胶原。此外,可更优选使用猪、牛或人的胶原或端胶原作为lascol的材料。此外,作为lascol的材料,也可以使用鱼类的胶原或端胶原。如果使用鱼类,则可简便、安全地提供材料,并且可大量获取,可提供无病毒的对人而言更加安全的胶原或端胶原的分解产物(lascol)。另外,使用鱼类的胶原或端胶原作为lascol的材料的情况下,优选使用鲨鱼、鲤鱼、鳗鱼、金枪鱼(例如黄肌金枪鱼)、罗非鱼、鲷鱼或鲑鱼的胶原或端胶原,更优选使用金枪鱼、罗非鱼、鲷鱼或鲑鱼的胶原或端胶原。使用端胶原作为lascol的材料的情况下,优选使用热变性的温度优选在15℃以上、更优选在20℃以上的端胶原。例如,使用鱼类的端胶原作为分解产物的材料的情况下,金枪鱼(例如黄肌金枪鱼)或罗非鱼、鲤鱼等的端胶原的热变性温度在25℃以上,因此优选使用这些端胶原。如果是上述构成,则可将本实施方式的神经细胞培养材料及神经损伤治疗剂的变性温度(变成凝胶状的温度)调节至优选15℃以上、更优选20℃以上。其结果是,如果是上述构成,则可实现储藏时的稳定性、使用时的稳定性优良的神经细胞培养材料及神经损伤治疗剂。这些胶原或端胶原可通过公知的方法获取。例如,可通过将哺乳类、鸟类或鱼类的富含胶原的组织投入ph2~4左右的酸性溶液,使胶原溶出。然后,向该溶出液中添加胃蛋白酶等蛋白酶,将胶原分子的氨基末端和/或羧基末端的端肽部分除去。然后,向该溶出液中添加氯化钠等盐,可使端胶原沉淀。为获得lascol,要使酶与胶原或端胶原作用,将这些材料分解。但是,通过制备三螺旋结构域内的化学键已被切断的胶原或端胶原的分解产物(例如化学合成法、重组蛋白的表达),也可以获得lascol。以下,对如上所述通过酶(例如蛋白酶)将胶原或端胶原分解而获得lascol的方法进行说明。作为上述酶无特别限定,优选使用例如半胱氨酸蛋白酶。作为半胱氨酸蛋白酶,优选使用酸性氨基酸量比碱性氨基酸量更多的半胱氨酸蛋白酶、在酸性区域的氢离子浓度下有活性的半胱氨酸蛋白酶。作为这样的半胱氨酸蛋白酶,可例举猕猴桃蛋白酶[ec3.4.22.14]、木瓜蛋白酶[ec3.4.22.2]、无花果蛋白酶[ec3.4.22.3]、菠萝蛋白酶[ec3.4.22.32]、组织蛋白酶b[ec3.4.22.1]、组织蛋白酶l[ec3.4.22.15]、组织蛋白酶s[ec3.4.22.27]、组织蛋白酶k[ec3.4.22.38]、组织蛋白酶h[ec3.4.22.16]、芦荟蛋白酶、钙依赖性蛋白酶等。另外,方括号内为酶编号。其中,优选使用猕猴桃蛋白酶、木瓜蛋白酶、无花果蛋白酶、组织蛋白酶k、芦荟蛋白酶或菠萝蛋白酶,更优选使用猕猴桃蛋白酶、木瓜蛋白酶、无花果蛋白酶、组织蛋白酶k。上述酶可通过公知的方法获取。例如,可通过如下方式获取:通过化学合成制备酶;从细菌、真菌、各种动植物的细胞或组织提取酶;通过基因工程方式制备酶;等等。当然,也可以使用市售的酶。通过用酶(例如蛋白酶)分解胶原或端胶原来进行切断的情况下,可按照例如以下(i)~(iii)的方法进行切断工序。以下(i)~(iii)的方法只不过是切断工序的一例,lascol的制造方法不限于这些(i)~(iii)的方法。另外,通过以下(i)和(ii)的方法,可获得lascol-b。此外,通过以下(iii)的方法,可获得lascol-a和lascol-b。(i)在高浓度盐的存在下,使胶原或端胶原与酶接触的方法。(ii)使与高浓度盐接触后的酶与胶原或端胶原接触的方法。(iii)在低浓度盐的存在下,使胶原或端胶原与酶接触的方法。作为上述(i)的方法的具体例,可例举例如在含高浓度盐的水溶液中使胶原或端胶原与酶接触的方法。作为上述(ii)的方法的具体例,可例举例如事先使含高浓度盐的水溶液与酶接触,然后使该酶与胶原或端胶原接触的方法。作为上述(iii)的方法的具体例,可例举例如在含低浓度盐的水溶液中使胶原或端胶原与酶接触的方法。作为上述水溶液的具体构成无特别限定,例如可使用水。作为上述盐的具体构成无特别限定,优选使用氯化物。作为氯化物无特别限定,例如可使用nacl、kcl、licl或mgcl2。上述含高浓度盐的水溶液中的盐的浓度无特别限定,但可以说越高越好。例如,该浓度优选在200mm以上,更优选在500mm以上,更优选在1000mm以上,更优选在1500mm以上,最优选在2000mm以上。上述含低浓度盐的水溶液中的盐的浓度无特别限定,但可以说越低越好。例如,该浓度优选低于200mm,更优选在150mm以下,更优选在100mm以下,更优选在50mm以下,最优选为接近0mm。溶解于上述水溶液(例如水)的胶原或端胶原的量无特别限定,例如相对于1000重量份~10000重量份的水溶液,优选溶解1重量份的胶原或端胶原。如果是上述构成,则向水溶液中添加酶的情况下,可使该酶与胶原或端胶原高效地接触。于是,其结果是,可通过酶高效地分解胶原或端胶原。添加至上述水溶液中的酶的量无特别限定,例如相对于100重量份的胶原或端胶原,优选添加10重量份~20重量份的酶。如果是上述构成,则水溶液中的酶的浓度高,因此可通过酶(例如蛋白酶)高效地分解胶原或端胶原。在水溶液中使胶原或端胶原与酶接触时的其它条件(例如水溶液的ph、温度、接触时间等)也无特别限定,可以适当设定,但优选以下范围。另外,以下对这些条件的优选范围进行例示。1)水溶液的ph优选为ph2.0~7.0,更优选为ph3.0~6.5。为了将水溶液的ph保持在上述范围,可向水溶液中添加公知的缓冲剂。如果是上述ph,则可将胶原或端胶原均匀地溶解于水溶液中,其结果是,可高效地进行酶反应。2)温度无特别限定,可根据所用的酶选择温度。例如,该温度优选为15℃~40℃,更优选为20℃~35℃。3)接触时间无特别限定,可根据酶的量和/或胶原或端胶原的量选择接触时间。例如,该时间优选为1小时~60天,更优选为1天~7天,进一步优选为3天~7天。另外,也可以经过选自在水溶液中使胶原或端胶原与酶接触后、根据需要再调整ph的工序,使酶失活的工序以及除去杂质的工序中的至少一道工序。此外,上述除去杂质的工序可通过用于分离物质的常规方法来进行。上述除去杂质的工序可通过例如透析、盐析、凝胶渗透色谱、等电点沉淀、离子交换色谱或疏水相互作用色谱等来进行。本发明的神经细胞培养材料例如如下所述使用:首先将含lascol的溶液涂布在培养皿中,接着将d-mem(达尔伯克氏改良伊格尔培养基)等培养基加入培养皿中,接种神经细胞。本发明的神经损伤治疗剂在神经损伤经过一定时间后,确认损伤部位,给药至患处。例如为脊髓的情况下,不是在脊髓损伤后立即,而是在经过一定时间后,在通过x光等确认了脊髓损伤部位之后,通过注射等给药至患处。另外,此时希望神经损伤治疗剂中所含的lascol具有规定以上的弹性模量(下述的实用弹性模量)。这是因为,如果是弹性模量低的状态,则lascol可能不滞留于患处而流走。本发明的神经细胞培养材料或神经损伤治疗剂以干燥状态(包括粉末和形状体)或凝胶状态供应。此外,以规定的浓度使用本发明的神经细胞培养材料或神经损伤治疗剂也包括如下情况:附加或通知了向干燥状态的lascol中添加一定的溶剂的指令,其结果是,成为本发明的优选浓度的lascol。本说明书中,“给药”是指经由患处给予患者治疗剂。因此,本发明的治疗剂的给药不限于注射,例如也包括将治疗剂插入通过切割而切开的部位、将治疗剂涂布于患处等。此外,本发明的神经损伤治疗剂也可以说是使用本发明的神经损伤治疗剂的神经损伤的治疗方法。用本发明治疗的神经损伤是中枢神经和末梢神经领域,除了因交通事故、体育事故、跌倒等事故而导致的外伤之外,也包括由脊髓肿瘤和脱出症等疾病引起的损伤等。实施例<含lascol的溶液的制备>准备氯化钠浓度为0mm和1500mm的50mm柠檬酸缓冲液(ph3.0)。另外,使用水作为该水溶液的溶剂。为了使猕猴桃蛋白酶活化,将猕猴桃蛋白酶溶解于含10mm的二硫苏糖醇的50mm磷酸缓冲液(ph6.5)中,在25℃下静置90分钟。另外,作为猕猴桃蛋白酶,采用通过公知方法纯化的猕猴桃蛋白酶(例如参照非专利文献1)。接着,将来源于猪的i型胶原溶解于含盐的50mm柠檬酸缓冲液(ph3.0)中。使含猕猴桃蛋白酶的水溶液与含来源于猪的i型胶原的该溶液在20℃下接触10天以上,制成i型胶原的分解产物。另外,来源于猪的i型胶原基于公知方法纯化(例如参照非专利文献1)。将上述分解产物进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page),将i型胶原的分解产物分离。接着,将i型胶原的分解产物通过常规方法转印至pvdf(聚偏氟乙烯,polyvinylidenedifluoride)膜。然后,通过埃德曼降解法确定转印至pvdf膜的α1链的分解产物的氨基末端的氨基酸序列。另外,实际的埃德曼分析是委托阿普罗科技株式会社(アプロサイエンス株式会社)或近畿大学医学院分析仪器共同研究室按照公知方法进行的。表1所示为盐浓度为0mm和1500mm时的α1链的分解产物的氨基末端及其附近的氨基酸序列。如表1所示,如果盐浓度低(0mm),则在以“gpmgpsgprg…”表示的三螺旋结构域的外侧发生切断,如果盐浓度高(1500mm),则在三螺旋结构域的内侧发生切断。序列编号3中,从左起第3个甘氨酸(g)起开始出现三螺旋结构域。0mm时生成的是lascol-a的溶液,1500mm时生成的是lascol-b的溶液。在以下实施例中,使用lascol-a的溶液作为lascol的溶液。[表1]盐浓度[mm]来源于猪的α1链的分解产物的氨基末端序列序列编号0vpgpmgpsgprg…31500mgpsgprg…4另外,lascol-a的α2链也发生切断。表2中,序列编号5表示α2链的氨基末端部分。序列编号5中,从“··gpmglmg…”左端的甘氨酸(g)起开始出现三螺旋结构域。另外,作为lascol-a制备条件的盐浓度为0mm时的α2链的末端示于序列编号6。其相当于参照序列编号2将g和x3之间的化学键切断。即,lascol-a中,在α1链上在三螺旋结构域的外侧发生切断,而在α2链上在三螺旋结构域的内侧发生切断。lascol-a可以具有序列编号3或序列编号6的任一种切断。[表2]盐浓度[mm]来源于猪的α2链的分解产物的氨基末端序列序列编号-…gpgpmglmgprgpp…50lmgprgpp…6图l所示为含lascol的溶液的弹性特性(复数模量中的储能模量g’)。横轴为时间(分钟),纵轴为储能模量g’(pa)。图1(a)和图1(b)中,横轴相同,但纵轴不同。图1(b)的纵轴的标尺比图1(a)大。图1(a)和图1(b)各自的曲线表示lascol浓度的差异。不同浓度的lascol溶液用5mm的盐酸溶液配制,以使得终浓度为2.1mg/ml、3.5mg/ml、4.9mg/ml(以上图1(a))、21mg/ml(图1(b)。这些lascol在酸性溶液中在5℃~10℃保存。在该状态下,lascol以液态保存。图1是在lascol中添加ph调整剂和浓度调整液,将ph调整至大致为7.4后,安装于动态粘弹性测定装置(流变仪,haakemarsiii,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)),升温至37℃后测得的结果。测定条件为:频率1hz,振幅6°/秒,应变量1%。另外,升温在数秒内完成。参照图1(a),无论在何种浓度下,刚开始测定时的储能模量g’都较低。然后,无论在何种浓度下,储能模量g’都升高,在约10分钟后接近饱和值。另一方面,图1(b)中,在测定开始1分钟时,储能模量g’升至饱和值,然后缓慢下降并饱和。由图1和图2可见,通过提高浓度,到储能模量g’升高为止的时间也缩短。由此可知,如果调整ph和浓度、使温度升高,则含lascol的溶液的储能模量g’升至与浓度相对应的规定值。此外也可知,如果将lascol配制为规定浓度、在达到37℃之后经过30分钟,则储能模量大致达到稳定值。于是,将此时的储能模量称为lascol的“实用弹性模量”。这表明,通过暴露于合适的条件下,lascol的性状从无法测定弹性模量的溶胶变为能够对弹性模量进行定量的凝胶,特别是通过注入机体,可用作可注射凝胶。图2所示为在流变仪中在37℃下经过30分钟后的“应变(流变仪的驱动侧的旋转方向的位移)”和“应力(流变仪的被动侧所受的应力)”的关系。左纵轴为应变φ(弧度),右纵轴为应力m(μnm),横轴为仪器步数,无单位,500步相当于1秒。即,图2的各图是用1秒的时间测定从5×10-4弧度到-5×10-4弧度的往返而得的图。图2(a)是lascol浓度为2.1mg/ml的情况,图2(b)是lascol浓度为3.5mg/ml的情况,图2(c)是lascol浓度为5.6mg/ml的情况。实用弹性模量分别为8pa、20pa、70pa。lascol浓度为2.1mg/ml(图2(a))时,对于应变几乎没有应力响应性。即,lascol可以说是接近于液体的状态。如果lascol浓度升至3.5mg/ml(图2(b)),则可见与应变相当的应力反应性。如果lascol的濃度进一步升高(图2(c)),则应力与施加的应变同步。另外,应变与应力的相位有错位的原因在于,凝胶具有损耗模量。因此可以判断,在图2(b)的lascol浓度为3.5mg/ml的时候呈凝胶状。这以实用弹性模量计相当于20pa。此外,用于神经损伤治疗剂的情况下,认为变成凝胶状时的储能模量的下限为20pa。lascol也具有作为细胞支架的功能,因此需要一定程度上贮留在一处。这是因为,认为在弹性低于20pa的情况下,lascol没有作为凝胶的行为,因此难以停留在患处。<神经细胞的培养>使用如上所述制备的lascol溶液来确认维持神经细胞的存活的能力。在24孔板中涂布lascol、端胶原、聚-l-赖氨酸(以下也称为“pll”)。另外,也准备了没有涂布任何东西的未涂布孔作为对照。将来源于新生儿大鼠海马的神经细胞(并非间充质干细胞,而是分化完成的神经细胞,以下简称为“神经细胞”)悬浮于补充有b-27的neurobasal培养基(赛默飞世尔科技公司(thermofisherscientific社)制,以下称为“nb/b27”)中,接种在这些孔中。pll促进细胞膜和培养皿藉由电荷而粘附。因此,仅通过对市售的塑料板进行通常实施的亲水性的亢进处理,就能使粘附性不足的神经细胞粘附。pll常用于神经细胞培养时。培养48小时后的状态的显微镜观察结果示于图3。另外,在照片中,右下的比例尺相当于100μm。图3(a)是用lascol溶液涂布的组(lascol涂布组)的结果,图3(b)是用端胶原溶液涂布的组(端胶原涂布组:表示为“端胶原”)的结果,图3(c)是用pll溶液涂布的组(pll涂布组)的结果,图3(d)是没有涂布任何东西的组(未涂布组)的结果。图3(a)中,密集地存在圆形物,其间有长条状物延伸。圆形物是神经细胞的细胞体,长条状物是从神经细胞延伸出的突起(神经突起)。图3(b)中,虽然可见大量神经细胞的细胞体,但不如图3(a)多。图3(c)、图3(d)中,神经细胞的细胞体的数量依次减少。此外还确认,从神经细胞延伸出的神经突起的数量和长度也按从图3(a)到图3(d)的顺序依次减少。综上所述,可知神经细胞能够在lascol上良好地存活,可使神经突起延伸。接着,在20mm×20mm的载玻片上涂布lascol溶液、端胶原溶液、pll溶液,接种神经细胞。然后,在24小时后进行扫描型电子显微镜(sem)观察。具体而言,将培养标本用4%多聚甲醛(paraformaldehyde)固定,用醇脱水,浸渍于乙酸异戊酯(isoamylacetate),用液化二氧化碳临界点干燥(criticalpointdrying)。然后,涂上铂钯(platinumpalladium),用日立s5000sem观察。图4所示为lascol涂布组的神经细胞的sem观察图像。右下的比例尺为20μm。以密集成纤维状的lascol为背景,确认从神经细胞(图4中的符号“n”的部分)延伸出多条被称为神经轴突的突起(图中箭头)。在各轴突的突起途中,形成了对于神经细胞活动而言必不可少的生长锥(图中方块内)。图5是将图4的生长锥放大的sem图像。右下的比例尺为5μm。生长锥具有高运动能力,通过多条细长的神经突起的延伸而在其它神经细胞间建立网络,最终形成突触。从形成于lascol上的生长锥延伸出多条长长的丝状伪足(filopodia:箭头),因此表示该生长锥正在活跃地活动。此外,在从丝状伪足进一步延伸出的轴突上形成了新的生长锥(箭头)。并且,突起具有干净的表面,形成了作为突起的典型形状。如果神经突起在这样的状态下延伸,则可以说是良好地培养神经细胞的状态的一种形态。在生长锥的下层还密集地形成了lascol纤维,各丝状伪足与该lascol纤维明确地粘合。由此可以认为,来自lascol的信号参与了神经细胞的活跃的活动。图6所示为端胶原涂布组中接种神经细胞的结果。右下的比例尺为20μm。如所示,虽然从神经细胞(符号“n”的部分)延伸出神经突起(箭头),但其条数与lascol涂布组(图4)相比明显更少且更短。图7是将图6的生长锥放大的sem图像。右下的比例尺为5μm。在突起的前端形成的生长锥歪斜地变形。也未明确地形成丝状伪足(箭头),神经细胞不是具有活跃的运动能力的状态。此外,与lascol涂布组(图5)相比,与涂布于神经细胞下层的端胶原的粘合也不足。图8所示为pll涂布组的神经细胞的结果。右下的比例尺为20μm。虽然从神经细胞(符号“n”的部分)延伸出突起多达6条,但突起的形状与一般的突起不同,是异常形态(箭头)。从该神经突起还伸出无数的短突起。但是,该形态在原本的神经细胞的突起中未曾见过。图9是将图8的生长锥放大的sem图像。右下的比例尺为5μm。生长锥的形成不完全。整体上可以看出,神经细胞试图延伸出突起。但是,该延伸受到抑制,变短。在pll涂布组的神经细胞上,突起未彻底地延伸,可见异常的多条枝状突起。综上所述,可知lascol不仅在使神经细胞良好地存活方面是有效的,在从神经细胞的突起的延伸方面也起到效果。<lascol涂布组中的其它细胞的培养>(1)星形胶质细胞所示为尝试在lascol上进行星形胶质细胞培养的结果。在96孔板中涂布lascol和端胶原。也准备未涂布作为对照组。接着,以3×104、1×105个/ml接种来源于大鼠大脑的星形胶质细胞,48小时后用wst-1法测定细胞数。wst-1法是比色定量法mtt法之一。mtt法是测定将mtt或类似染料还原成甲臜染料(紫色)的酶活性的比色定量法。另外,wst-1法的基础是在活细胞中的线粒体脱氢酶的作用下将四唑盐(wst-1)转化为甲臜染料,甲臜染料溶液的吸光度和活细胞数之间有线性关系。因此,通过测定吸光度,可定量地测定细胞数。结果示于图10。参照图10,横轴表示每种接种细胞数的每种涂布材料上的细胞数,纵轴表示450nm的吸光度。与接种细胞数无关,在涂布lascol的培养皿中,与端胶原和未涂布相比,细胞数显著较少。星形胶质细胞是神经细胞以外的中枢系统的细胞(胶质细胞),因此根据图10的结果,可以说lascol抑制了胶质细胞的增殖。已知胶质细胞在神经组织的病变处增多。如果在脊髓这一神经聚集部分的损伤部位处胶质细胞增多,则神经纤维无法越过其延伸,其结果是,神经仍保持切断状态。可以认为,lascol抑制胶质细胞的增殖,因此可使神经纤维的延伸亢进。(2)骨髓基质细胞在涂布了lascol溶液、端胶原溶液、pll溶液、添加了间充质干细胞基础培养基/mscgmsinglequots(龙沙(lonza)公司制)的培养皿上以3×103个/ml的浓度接种骨髓基质细胞,7天后进行观察。结果示于图11。图11(a)是涂布lascol溶液的组(lascol涂布组),图11(b)是涂布端胶原溶液的组(端胶原涂布组),图11(c)是涂布pll溶液的组(聚-l-赖氨酸涂布组:pll涂布组),图11(d)是未涂布的组(未涂布,对照组)。另外,在照片中,右下的比例尺线相当于100μm。图11(a)的lascol涂布组中,四处可见从纤细的纺锤形的细胞体延伸出突起。这是骨髓基质细胞。细胞的密度为10%左右。图11(b)的端胶原涂布组、图11(c)的pll涂布组、图11(d)的未涂布组中,长长的纺锤形的骨髓基质细胞相互粘合而密集地存在。可知这些细胞从稀疏状态一直猛烈地增殖到将底面完全覆盖为止。综上所述,可以得出如下结论:lascol涂布组(图11(a))中,骨髓基质细胞未能充分地粘合,与端胶原涂布组、pll涂布组和未涂布组相比未见增殖。此外还确认,在lascol上有见不到骨髓基质细胞的增殖的趋势。在48孔板中涂布lascol溶液。以1×105、3×104、1×104、3×103个/孔接种骨髓基质细胞。24小时后,用luna自动细胞测定装置(logos生物系统(logosbiosystems)公司制)测定细胞数。另外,也准备未涂布作为对照组。此外,在96孔板中涂布lascol溶液,以1×105、5×104、2×104、1×104个/孔接种骨髓基质细胞。2天后,通过wst-1法进行检测。结果示于图12。图12(a)是细胞数测定的结果。横轴为接种的细胞数(个/孔),纵轴为24小时后的细胞数(×104个)。接种的细胞数多时,lascol涂布组(图中以“l”表示)中的培养与对照组(未涂布)相比,可见细胞数的显著下降。图12(b)是wst-1法的结果。横轴为接种的细胞数(个/孔),纵轴为450nm的吸光度。在此也可以确认,接种的细胞数多时,lascol涂布组(图中以“l”表示)中的培养与对照组(未涂布)相比,细胞数显著下降。综上所述,可知在lascol上有骨髓基质细胞的增殖低的趋势。(3)巨噬细胞所示为尝试在lascol上进行巨噬细胞培养的结果。在8孔板中涂布lascol或端胶原。接着,接种2×105个/ml的大鼠腹腔巨噬细胞。48小时后进行观察。结果示于图13。图13(a)所示为lascol涂布组的情况,图13(b)所示为端胶原涂布组的情况。各自的比例尺表示100μm。图13(a)中,箭头表示的球状的细胞(作为例示示出了3处)是巨噬细胞。图13(a)中只能确认到可计数的细胞。另一方面,图13(b)中可以确认到比图13(a)明显更多的细胞。另外,图13(b)中未示出箭头。综上所述,在lascol上,星形胶质细胞、骨髓基质细胞、巨噬细胞几乎无法增殖。由此可知,lascol对神经细胞发挥出细胞存活作用和神经突起延伸作用。因此可以说,lascol可以优选用作神经细胞培养材料。尤其是在lascol上,非神经细胞几乎无法培养,因此使用lascol的神经细胞培养材料即使混有其它细胞,也能够以接近实际的状态培养神经细胞。<体内的确认>如上所述,在体外,可以认为在lascol涂布组中可良好地培养神经细胞。如果该效果也能在机体内发挥,则可成为对神经细胞的再生有用的药剂。于是,考察了lascol在机体内的神经细胞培养能力。(1)脊髓损伤模型的制备使用9周龄的雌性斯普拉格-道利(sprague-dawley,sd)大鼠。下述各组分别由7只构成。挤压损伤使用标准的纽约大学的重量下落装置。装置的条件为10g、下落高度7.5cm。施加的冲击为1次。作为给药,自损伤起1周后,向脊髓的损伤处给予10μl的lascol溶液或磷酸盐缓冲生理盐水(phosphatebufferedsaline:后面也简称为“pbs”)。此时,lascol溶液的温度为室温。给药方法是,将大鼠放置在脑定位固定装置上,将固定好的胰岛素用注射器用螺纹式喷射器缓慢地挤出,从而给予试样。静置2分钟左右后将针拔出。这是与标准的细胞移植时进行的方法相同的方法。此时,注入脊髓损伤处的lascol溶液已预先测定实用弹性模量(流变仪,haakemarsiii,赛默飞世尔科技公司),调整至500pa~600pa(37℃、ph7.4)。如上所述,该值是用流变仪测得的、到达37℃后30分钟的值。此外,500pa这一实用弹性模量是近似蜂蜜的粘度。图14所示为根据bbb(bassobeattiebresnahan)运动评价尺度来评价给药后的大鼠状态的结果。bbb运动评价尺度的评价采用21级评价法(0:完全麻痹~21:正常)。此外,bbb评分特别着眼于后腿的状态。参照图13,横轴为给药后的时间(周),纵轴为bbb评分。白色圆为pbs给药组(给予上述pbs的组),黑色圆为lascol给药组(给予上述lascol溶液的组)。bbb评分中,零是症状最重,数值越大则越接近健康状态。大鼠到第3周为止急速地恢复,然后呈现出缓慢的恢复基调。5周以后,lascol给药组的bbb评分为11,pbs给药组的bbb评分为9。即,lascol给药组与pbs给药组相比,在bbb评分方面显示出差值约为2的良好的恢复。这里,评分9是指在静止状态下能够脚底着地来支撑体重、但在步行中无法支撑体重的水平。另一方面,如果评分达到11,则是进行高频率或连续的负重步行的水平。尤其是就第2周和第5周而言,lascol给药组与pbs给药组相比确认有显著的恢复。在测定bbb的实验之外,另行对6周龄的sd大鼠施加挤压损伤,然后立即给予lascol,进行第8天的脊髓的损伤部分的组织观察。图15所示为以抗gfap(胶质细胞原纤维酸性蛋白,glialfibrillaryacidicprotein)抗体(兔多克隆抗体)作为一抗对星形胶质细胞进行染色的结果。此外,图16所示为以抗磷酸化gap-43(pgap-43;磷酸化生长相关蛋白43)抗体(小鼠单克隆抗体)作为一抗对再生神经进行染色的结果。磷酸化gap-43是在轴突延伸时观察到的蛋白质。图15和图16是将同一切片用gfap和pgap-43双重染色的图,可以说看到的是同一部分。另外,染色是针对未标记的一抗,用荧光标记的二抗进行染色。更具体而言,对于对星形胶质细胞进行染色的抗gfap抗体,使用与波长488nm(绿色)的荧光染料结合的山羊的抗兔igg抗体(cf488a山羊抗兔igg)作为二抗。对于抗磷酸化gap-43抗体,使用与波长546nm(红)的荧光染料结合的山羊的抗小鼠igg抗体(alexafluor546山羊抗小鼠igg)作为二抗。此外,荧光显微镜是axioimagerm1显微镜,画像获取采用axiovision软件(均为卡尔·蔡司(carlzeiss,日本东京)公司制)。参照图15。比例尺表示500μm。图15(b)所示为施加挤压损伤后立即向损伤处给予10μl的lascol(7mg/ml)溶液,将第8天的脊髓用4%pfa(多聚甲醛)固定,对10μm厚的矢状切片进行免疫组织化学染色的图。用针对星形胶质细胞标志物gfap(胶质细胞原纤维酸性蛋白)的抗体进行染色。图15(b)中,被针对gfap的抗体染色的部分被染成亮绿色。未被该针对gfap的抗体染色的部分(阴性部分)是损伤处。损伤处的中心部用白色圆圈出。另一方面,图15(a)是进行了图像处理、使得被针对gfap的抗体染色的部分为黑色、其余部分为白色的图。因此,图15(a)中,损伤处是用黑色圆圈出的部分中的白色部分。参照图16。比例尺表示500μm。图16(b)所示为将图15(b)的连续切片用针对再生神经标志物磷酸化gap43(pgap43)的抗体染色而成的图像(gfap和pgap43的双重染色中只有pgap43的图像)。图16(b)中,被针对pgap43的抗体染色的部分被染成红色。图16(b)中的白色圆是与图15(b)的白色圆相同的部分。另一方面,图16(a)是进行了图像处理、使得被针对pgap43的抗体染色的部分为黑色、其余部分为白色的图。图16(b)的白色圆的部分在图16(a)中用黑色圆圈出。因此,图16(a)中用黑色圆圈出的部分是与图15(a)中的黑色圆相同的部分。参照图15(a)和图16(a)可知,图15(a)中的gfap阴性部分(白色部分)在图16(a)中为pgap43阳性(黑色部分)。即,可知在脊髓的损伤部分延伸出了再生轴突。星形胶质细胞消失、呈gfap阴性的部分(图15(a)的白色部分)是损伤处。pgap43是中枢神经的再生轴突中的特异性蛋白质。在图15(a)的没有星形胶质细胞的部分(损伤处:图15(a)的白色部分),在图16中确认有再生轴突的存在(图16(a)的黑色部分)。因此可以得出如下结论:脊髓损伤的大鼠通过给予lascol溶液,损伤部分有神经细胞再生,实现了恢复。接着,考察将lascol干燥制成一定形状的海绵状时的效果。所用的海绵样品是将不同浓度的lascol和端胶原干燥而成的。干燥前的lascol的浓度为30mg/ml、50mg/ml,干燥前的端胶原的浓度为20mg/ml。此外,将各海绵样品分别称为la30、la50、ac20。表3所示为各海绵样品在干燥之前的浓度。此外,各样品制备成直径2~3mm、长5mm的形状。[表3]海绵样品名使用物质干燥前浓度la30lascol30mg/mlla50lascol50mg/mlac20端胶原20mg/ml将9周龄的雌性sd大鼠的第8-9胸椎水平(与挤压损伤时相同的部位)的脊髓的一部分(在上下方向上约5mm,从中心在左右方向上约1mm)切除,立即在该部分用镊子埋植海绵样品。各海绵样品分别对3个个体进行埋植(以n=3进行实验)。埋植2周后,将所有个体通过pbs(磷酸盐缓冲生理盐水)灌流而脱血后,用4%pfa(全氟烷氧基烷烃)灌流固定。采集包括损伤处(埋植处)的脊髓,用4%pfa浸渍固定1天后,置换成30%蔗糖(sucrose),用surgipath(注册商标)fsc22包埋化合物(莱卡公司(leica社)制)包埋。将其用恒冷切片机(日文:クリオスタツト)以10μm的厚度水平地切出。将切片用pbs清洗后,用含3%tritonx-100的blockingonehisto(纳卡拉组织(nacalaitesque)公司)在室温下进行5分钟的通透处理和封闭处理。作为一抗,以1∶200的浓度使用兔抗-βiii-微管蛋白多克隆抗体(神经细胞标志物,艾博抗(abcam)公司,ab18207)和小鼠抗i型胶原单克隆抗体(用于埋植的lascol和端胶原的检出,西格玛(sigma)公司,c2456),在室温下反应过夜。作为二抗,以1∶200的浓度使用cf488a山羊抗兔igg(拜奥蒂乌姆(biotium)公司)和alexafluor555山羊抗小鼠igg(赛默飞世尔科技公司),在室温下反应30分钟。细胞核用0.3μmdapi染色。用fluoromount/plus(诊断生物系统(diagnosticbiosystems)公司)盖上盖玻片后,用带有axiovision软件的荧光显微镜axioimagerm1显微镜(卡尔·蔡司公司)观察,获取图像数据。图17所示为ac20埋植2周后的照片。图17(a)是β-微管蛋白(对轴突染色)、col1(对胶原染色)、dapi(对细胞核染色)的合成图。图17(b)是β-微管蛋白(对轴突染色)和col1(对胶原染色)的合成图。图17(c)是仅β-微管蛋白(对轴突染色)的照片,图17(d)是仅col1(对胶原染色)的照片。图17(d)中央呈黑色的部分是海绵样品ac20。即使在埋植2周后,也像这样保持明确的形状。此外,图17(c)中,在图17(d)中呈黑色的部分中完全没有被染色的部分。即,在端胶原的海绵样品ac20中,神经轴突没有延伸出来。图18是图17的各照片中用方块圈出的部分的放大图。图18(a)是β-微管蛋白(对轴突染色)和col1(对胶原染色)的合成图。图18(b)是仅β-微管蛋白(对轴突染色)的照片,图18(c)是仅col1(对胶原染色)的照片。图18(c)中呈黑色网状的端胶原的海绵样品和图18(b)中呈黑色的神经轴突之间没有重叠的部分。即,即使放大观察,在端胶原的海绵样品ac20中,未见神经轴突延伸的痕迹。图19和图20是埋植海绵样品la30时的照片。图19(a)是β-微管蛋白(对轴突染色)、col1(对胶原染色)、dapi(对细胞核染色)的合成图。图19(b)是β-微管蛋白(对轴突染色)和col1(对胶原染色)的合成图。图19(c)是仅β-微管蛋白(对轴突染色)的照片,图19(d)是仅col1(对胶原染色)的照片。此外,图20是图19中的方块部分的放大照片。图20(a)是β-微管蛋白(对轴突染色)和col1(对胶原染色)的合成图。图20(b)是仅β-微管蛋白(对轴突染色)的照片,图20(c)是仅col1(对胶原染色)的照片。图19(d)中央呈深色的是la30。即使在埋设后2周,也以能在染色照片中确认到的程度维持着形状。图19(c)和图20(b)是轴突神经的染色图,在la30的存在位置确认到轴突神经的染色。尤其是在图20(b)中,可以明显地在海绵样品中确认到黑色的染色部分。由此可以确认,在埋植的lascol的海绵样品中,神经轴突延伸。图21所示为作为col1的存在区域中β-微管蛋白所占的面积比例而求出的、埋植的海绵样品中的神经轴突的量(神经密度(面积%))。横轴为各海绵样品。端胶原的海绵样品ac20中,在col1中几乎没有β-微管蛋白。另一方面,lascol的海绵样品中,在海绵样品中发现了轴突。此外,在30mg/ml、50mg/ml的lascol浓度中,浓度为30mg/ml时(la30)轴突的面积最大。如果干燥前的lascol浓度高,则成为致密的海绵样品。因此,由图21的结果可以认为,对于再生的神经的轴突延伸来说,优选的是结构上具有适度的微细空间的海绵状lascol。综上所述,可知lascol(凝胶和干燥物)可适合用作神经损伤治疗剂。另外,神经细胞无论是哪个部位的神经细胞都具有同样的性质,因此lascol不仅可用作作为中枢神经的脊髓的损伤治疗剂,也可适合用作包含末梢神经在内的神经的损伤治疗剂。产业上利用的可能性本发明的神经细胞培养材料可适合用作培养神经细胞时的支架材料或添加剂。此外,本发明的神经损伤治疗剂可适合用于受到脊髓损伤时被切断的神经的损伤部分的再生治疗。还可以用作其它部位的神经细胞的再生治疗剂。序列表<110>学校法人近畿大学学校法人蓝野大学公益财团法人神户医疗产业都市推进机构<120>神经细胞培养材料及神经损伤治疗剂<130>kokuti21902<160>6<170>patentinversion3.5<210>1<211>13<212>prt<213>人工序列<220><223>蛋白质的部分序列<220><221>misc_feature<222>(1)..(3)<223>xaa可以是任意天然存在的氨基酸<220><221>misc_feature<222>(5)..(6)<223>xaa可以是任意天然存在的氨基酸<220><221>misc_feature<222>(8)..(9)<223>xaa可以是任意天然存在的氨基酸<220><221>misc_feature<222>(11)..(12)<223>xaa可以是任意天然存在的氨基酸<400>1xaaxaaxaaglyxaaxaaglyxaaxaaglyxaaxaagly1510<210>2<211>10<212>prt<213>人工序列<220><223>蛋白质的部分序列<220><221>misc_feature<222>(2)..(3)<223>xaa可以是任意天然存在的氨基酸<220><221>misc_feature<222>(5)..(6)<223>xaa可以是任意天然存在的氨基酸<220><221>misc_feature<222>(8)..(9)<223>xaa可以是任意天然存在的氨基酸<400>2glyxaaxaaglyxaaxaaglyxaaxaagly1510<210>3<211>12<212>prt<213>人工序列<220><223>蛋白质的部分序列<400>3valproglyprometglyproserglyproarggly1510<210>4<211>8<212>prt<213>人工序列<220><223>蛋白质的部分序列<400>4metglyproserglyproarggly15<210>5<211>14<212>prt<213>人工序列<220><223>蛋白质的部分序列<400>5glyproglyprometglyleumetglyproargglypropro1510<210>6<211>8<212>prt<213>人工序列<220><223>蛋白质的部分序列<400>6leumetglyproargglypropro15当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1