二胺化合物及其制造方法与流程
[0001]
本发明涉及高纯度的二胺化合物及其制造方法。并且,详细而言,涉及一种高纯度的具有苯并噁唑结构的二胺化合物及其制造方法。
背景技术:
[0002]
具有苯并噁唑结构的二胺化合物,是可以用于聚酰亚胺膜的单体及环氧化合物的固化剂的化合物。作为具有苯并噁唑结构的二胺化合物的制造方法,已知对对应的二硝基化合物进行还原的方法(专利文献1)。另一方面,该方法中,存在还原时生成着色物质,反应后得到的二胺化合物着色为黄色~茶色问题。作为抑制该着色的方法,提出有与还原剂一起使用活性炭等吸附剂的方法(专利文献2)。背景技术文献专利文献
[0003]
专利文献1:美国专利5739344号公报专利文献2:日本特开2010-37309号公报
技术实现要素:
发明所要解决的问题
[0004]
但是,在专利文献2的方法中,即使使用吸附剂,也不能完全除去着色物质。因此,即使可以暂时抑制着色,也存在二胺化合物随时间着色的问题。并且,还存在必须将可能着火的金属催化剂或氢气用作还原剂的问题。
[0005]
本发明鉴于上述情况,提供一种不仅在制造完成之时,而且即使进行长时间保存也不会着色的二胺化合物及其制造方法。进一步,通过使用含硫化合物作为还原剂,能够在工业上进行安全的制造。解决问题的技术方案
[0006]
本发明的发明人,为了解决上述技术问题进行了深入研究,结果,通过以下的方法完成本发明。即,本发明为以下的构成。
[0007]
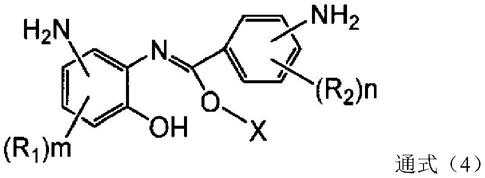
一种二胺化合物,其由通式(1)所示,其中,硫含量为1~100ppm,纯度为99质量%以上,并且由下述通式(2)所示的化合物和由下述通式(4)所示的化合物的总量为0.01~1质量%。[化学式1](通式(1)中,多个r
1
及r
2
分别独立地表示氢或碳原子数为1~3的烷基,m为1~3的整
数,n为1~4的整数)。[化学式2](通式(2)中,r
1
、r
2
、m及n与上述意义相同,r
3
及r
4
分别独立地表示no
2
、no或nhoh,其中,r
3
及r
4
均为no
2
的情况除外)。[化学式4](通式(4)中,r
1
、r
2
、m及n与上述意义相同,x表示氢或碳原子数为1~3的烷基)。
[0008]
一种由通式(1)所示的二胺化合物的制造方法,其包括:通过含硫化合物使由通式(3)所示的二硝基化合物进行还原反应。[化学式3](通式(3)中,r
1
、r
2
、m及n与上述意义相同)。
[0009]
优选含硫化合物为选自硫、硫化氢、碱金属硫化物及碱金属氢硫化物中的1种以上的化合物。发明的效果
[0010]
本发明的二胺化合物不仅在制造完成之时不会变色,而且即使在长时间保存时也不变色。因此,二胺化合物可以长期保存,并且即使是将其用作聚酰亚胺膜的单体或环氧化合物的固化剂时,聚酰亚胺膜和环氧固化物均不会着色。此外,通过使用含硫化合物作为还原剂,可以在工业上安全地生产。
具体实施方式
[0011]
通式(1)表示的二胺化合物(以下,也简称为通式(1)的化合物)具有苯并噁唑结构。在通式(1)中,多个r
1
和r
2
分别独立地表示氢或碳原子数为1-3的烷基。具体而言,为氢、甲基、乙基、正丙基或异丙基,优选为氢或甲基,更优选为氢。m为1~3的整数,优选为1或2,更优选为1。n为1~4的整数,优选1或2,进一步更优选1。
[0012]
在通式(1)的化合物中,苯并噁唑环上的nh
2
(氨基)的取代位置可以是4位、5位、6
位或7位中的任何一个,优选5位或6位,更优选为5位。另外,苯基的nh
2
(氨基)取代位置可以是2位,3位或4位中的任一个,优选为3位或4位,更优选为4位。
[0013]
作为通式(1)的化合物的具体例,没有特别限定,可列举:4-氨基-2-(2-氨基苯基)苯并噁唑、5-氨基-2-(2-氨基苯基)苯并噁唑、6-氨基-2-(2-氨基苯基)苯并噁唑、7-氨基-2-(2-氨基苯基)苯并噁唑、4-甲基-5-氨基-2-(2-氨基苯基)苯并噁唑或6-甲基-5-氨基-2-(2-氨基苯基)苯并噁唑或7-甲基-5-氨基-2-(2-氨基苯基)苯并噁唑、4-甲基-6-氨基-2-(2-氨基苯基)苯并噁唑或5-甲基-6-氨基-2-(2-氨基苯基)苯并噁唑或7-甲基-6-氨基-2-(2-氨基苯基)苯并噁唑、5-氨基-2-(2-氨基-3-甲基苯基)苯并噁唑、5-氨基-2-(2-氨基-4-甲基苯基)苯并噁唑、5-氨基-2-(2-氨基-5-甲基苯基)苯并噁唑、5-氨基-2-(2-氨基-6-甲基苯基)苯并噁唑、4-氨基-2-(3-氨基苯基)苯并噁唑、5-氨基-2-(3-氨基苯基)苯并噁唑、6-氨基-2-(3-氨基苯基)苯并噁唑、7-氨基-2-(3-氨基苯基)苯并噁唑、4-甲基-5-氨基-2-(3-氨基苯基)苯并噁唑或6-甲基-5-氨基-2-(3-氨基苯基)苯并噁唑或7-甲基-5-氨基-2-(3-氨基苯基)苯并噁唑、4-甲基-6-氨基-2-(3-氨基苯基)苯并噁唑或5-甲基-6-氨基-2-(3-氨基苯基)苯并噁唑或7-甲基-6-氨基-2-(3-氨基苯基)苯并噁唑、5-氨基-2-(3-氨基-2-甲基苯基)苯并噁唑、5-氨基-2-(3-氨基-4-甲基苯基)苯并噁唑、5-氨基-2-(3-氨基-5-甲基苯基)苯并噁唑、5-氨基-2-(3-氨基-6-甲基苯基)苯并噁唑、4-氨基-2-(4-氨基苯基)苯并噁唑、5-氨基-2-(4-氨基苯基)苯并噁唑、6-氨基-2-(4-氨基苯基)苯并噁唑、7-氨基-2-(4-氨基苯基)苯并噁唑、4-甲基-5-氨基-2-(4-氨基苯基)苯并噁唑或6-甲基-5-氨基-2-(4-氨基苯基)苯并噁唑或7-甲基-5-氨基-2-(4-氨基苯基)苯并噁唑、4-甲基-6-氨基-2-(4-氨基苯基)苯并噁唑或5-甲基-6-氨基-2-(4-氨基苯基)苯并噁唑或7-甲基-6-氨基-2-(4-氨基苯基)苯并噁唑、5-氨基-2-(4-氨基-2-甲基苯基)苯并噁唑、5-氨基-2-(4-氨基-3-甲基苯基)苯并噁唑、4-乙基-5-氨基-2-(4-氨基苯基)苯并噁唑或6-乙基-5-氨基-2-(4-氨基苯基)苯并噁唑或7-乙基-5-氨基-2-(4-氨基苯基)苯并噁唑、4-乙基-6-氨基-2-(4-氨基苯基)苯并噁唑或5-乙基-6-氨基-2-(4-氨基苯基)苯并噁唑或7-乙基-6-氨基-2-(4-氨基苯基)苯并噁唑等。其中,优选5-氨基-2-(4-氨基苯基)苯并噁唑。使用5-氨基-2-(4-氨基苯基)苯并噁唑制备得到的聚酰亚胺膜的耐热性及柔韧性优异,因此可适用于信息通信设备(广播设备、移动无线电、移动通信设备等)、雷达、高速信息处理设备等的柔性电子设备。
[0014]
通式(1)的化合物可以通过对通式(3)表示的二硝基化合物(以下,也简称为通式(3)的化合物)进行还原来制造。通式(3)的化合物是与通式(1)的化合物相对应的化合物,r
1
、r
2
、m和n与通式(1)的意义相同。在还原反应中,经由通式(2)表示的化合物(以下,也称为通式(2)的化合物或中间体),但是由于中间体没有被完全消耗(还原),因此微量的中间体会混入通式(1)的化合物中。
[0015]
此外,通式(3)的化合物如专利文献1中所述,可以通过对应的氨基硝基苯酚和硝基苯甲酰氯的反应,经由酰胺中间体来合成。将该反应通过反应式所示,如下式所示。[化学式6]
[0016]
在上述反应中,以多聚磷酸对酰胺中间体进行脱水缩合,合成通式(3)的化合物,但由于酰胺中间体没有完全消耗(脱水和缩合),因此残留了微量的酰胺中间体,并混入通式(3)的化合物中。然后,对含有微量的酰胺中间体的通式(3)的化合物进行还原时,酰胺中间体也同样被还原,成为通式(4)的化合物,因此,通式(1)的化合物中混入有通式(4)的化合物。
[0017]
另外,在还原反应中使用水或醇类溶剂的情况下,存在先生成的通式(1)的化合物进行溶剂分解(水解),而生成通式(4)的化合物(以下也称为溶剂分解物)的情况。此处,通式(4)中,x为氢时,通式(4)的化合物为酮-烯醇互变异构体。将此反应以反应式表示如下所示。[化学式7]
[0018]
本发明的发明人发现:通式(1)的化合物自身会随时间经过被氧化而着色,并且微量混入的通式(2)的化合物及通式(4)的化合物也随时间经过而着色并使其着色加速,并且非常微量的活性炭的混合会促进着色,以及即使在混入有通式(2)的化合物或通式(4)的化合物的情况下,通过含有指定量的含硫化合物可以抑制着色。
[0019]
作为通式(3)的化合物的还原剂,优选为含硫化合物。通过使用含硫化合物,可以有效地还原,并且可以防止通式(1)的化合物、通式(2)的化合物和通式(4)的化合物随时间经过而着色。作为含硫化合物,没有特别限制,优选为选自硫、硫化氢、碱金属硫化物及碱金属氢硫化物中的一种以上的化合物。作为碱金属硫化物或碱金属氢硫化物(也称为硫化碱金属盐或硫化氢碱金属盐)中的碱金属盐,可列举:锂盐、钠盐、钾盐等,并且优选钠盐。作为含硫化合物,优选硫化钠或硫化氢钠(氢硫化钠),更优选硫化氢钠(氢硫化钠)。
[0020]
相对于通式(3)的化合物1摩尔,还原剂优选为3摩尔以上,更优选为3.5摩尔以上,进一步优选为4摩尔以上。如果还原剂的量过少,则通式(3)的化合物不能进行充分地还原,中间体大量残留,通式(1)的化合物的硫含量较少时,有时不能抑制随时间经过的着色。另外,优选为10摩尔以下,更优选为8摩尔以下,进一步优选为6摩尔以下。如果还原剂过多,则通式(1)的化合物的硫含量过多,存在将聚酰亚胺膜用于柔性电子装置时,迁移现象变大的情况。
[0021]
通式(1)的化合物中的硫含量必须为1ppm以上,优选为5ppm以上,更优选为10ppm以上,进一步优选为20ppm以上。如果该量过少,则可能无法抑制随着时间经过而产生的通式(1)的化合物、通式(2)的化合物及通式(4)的化合物的着色。另外,需要为100ppm以下,优选为80ppm以下,更优选为60ppm以下,进一步优选为50ppm以下。如果该量过多,则将由通式(1)的化合物制成的聚酰亚胺膜用于柔性电子装置时,存在迁移现象变大的情况。
[0022]
通式(2)的化合物(中间体)是对应于通式(1)的化合物的化合物,r
1
、r
2
、m和n与通式(1)意义相同。r
3
和r
4
分别独立地表示no
2
、no或nhoh。但是,除r
3
和r
4
均为no
2
的情况除外。
[0023]
通式(2)的化合物只要是将通式(1)还原而得到的化合物即可,没有特别限定,例如,可举出:式(a)~(k)的化合物。此处,式(a)~(k)虽然示例的是苯并噁唑环的2-位和苯基的4-位被取代的化合物(5-氨基-2-(4-氨基苯基)苯并噁唑的中间体),但同样可以列举
其他取代位置的化合物。[化学式5]
[0024]
通式(1)的化合物中的通式(2)的化合物的量优选为1质量%以下,更优选为0.5质量%以下,进一步优选为0.1质量%以下。,更进一步优选为0.05质量%以下,特别优选为0.03质量%以下。如果过多,则通式(1)的化合物的纯度降低,并且可能随着时间经过而着色。下限没有特别限制,只要0.005质量%以上则为充分,可以为0.01质量%以上、或0.02质量%以上。
[0025]
通式(2)的化合物的含量是指被还原的全部化合物的总量。例如,若为上述苯并噁唑环的2位和苯基的4位进行了取代的化合物(5-氨基-2-(4-氨基苯基)苯并噁唑的中间体),则指式(a)~式(k)的总量。
[0026]
通式(4)的化合物是与通式(1)的化合物相对应的化合物,r
1
、r
2
、m和n与通式(1)意义相同。此外,nh
2
(氨基)、r
1
及r
2
的取代位置表示与通式(1)的化合物进行化学反应所容许的相同位置。
[0027]
通式(1)的化合物中通式(4)的化合物的量优选为1质量%以下,更优选为0.5质量%以下,进一步优选为0.1质量%以下,更优选为0.05质量%以下,特别优选为0.03质量%以下。如果该量过多,则通式(1)的化合物的纯度降低,有时随着时间经过而着色。下限没有特别限制,只要0.005质量%以上则为充分,可以为0.01质量%以上,也可以为0.02质量%以上。
[0028]
通式(1)的化合物中的通式(2)表示的化合物和下述通式(4)表示的化合物的总量必须为1质量%以下,优选为0.5质量%以下,更优选为0.1质量%以下,进一步优选为0.05质量%以下,特别优选为0.03质量%以下。如果过多,则通式(1)的化合物的纯度降低,并且可能随着时间经过而着色。下限没有特别限制,只要为0.01质量%以则充分,可以为0.02质量%以上。
[0029]
通式(1)的化合物的纯度必须为99质量%以上。优选为99.5质量%以上,更优选为99.9质量%以上,进一步优选为99.95质量%以上,特别优选为99.97质量%以上。上限优选
为100质量%,但在工业上只要为99.99质量%则为充分。
[0030]
还原反应中优选使用溶剂。作为可以用于还原反应的溶剂,可列举:水性溶剂;甲醇、乙醇、异丙醇等醇类溶剂;二乙醚、环己基甲基醚、二丁基醚、二甲氧基乙烷、二噁烷、四氢呋喃、二氧戊环等醚的溶剂;丙酮、2-丁酮、甲基异丁酮等酮类溶剂;甲苯、二甲苯、苯、己烷等烃基溶剂;氯仿、二氯甲烷、二氯乙烷、氯苯、二氯苯等氯类溶剂;n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、二甲基亚砜等。溶剂可以单独使用或组合使用两种以上。
[0031]
作为上述有机溶剂的使用量,没有特别限定,可以适当设定,例如,通式(3)的化合物的浓度优选为0.01~10mol/l左右,更优选为0.05~5mol/l左右,进一步优选为0.1~1mol/l左右。
[0032]
上述还原反应时的加热温度没有特别限制,优选为20℃以上且200℃以下,更优选为40℃以上且150℃以下,进一步优选为50℃以上且100℃以下。反应时间取决于加热温度等,通常为1小时以上且48小时以下,更优选为5小时以上且30小时以下。
[0033]
本发明的通式(1)的化合物中,作为着色原因的通式(2)的化合物及通式(4)的化合物的含量较低,并且纯度较高。并且,由于具有指定量的硫含量,因此即使长时间存储也不会随时间经过而变色。因此,不会使使用通式(1)的化合物制备得到的聚酰亚胺膜着色,可以优选用于信息通信设备(广播设备、移动无线电、移动通信设备等)、雷达、高速信息处理设备等柔性电子设备。[实施例]
[0034]
以下,列举实施例更详细地对本发明进行说明,但是本发明不受以下实施例的限制,也可以在适应上述和以下主旨的范围内进行适当变更而实施,这些都包括在本发明的技术范围内。并且,实施例和比较例中记载的各测量值通过以下方法测量。
[0035]
<硫含量>硫含量通过电感耦合等离子体(icp)发射光谱分析方法(型号sii sps3100)测量。精确称量约0.5g试料,加入2ml浓盐酸,然后用离子交换水稀释至50ml。另行制备硫含量为0~0.8ppm的标准溶液,并进行icp分析,通过与标准溶液的峰强度之比求出通式(1)的化合物中的硫含量。
[0036]
<通式(1)所示的二胺化合物的纯度及通式(2)所示的化合物的含量>通式(1)表示的二胺化合物的纯度通过高速液相色谱仪(hplc)在以下条件下测定。以通式(1)表示的二胺化合物(保留时间为约2.12分钟)为基准,对通式(2)表示的化合物的相对保留时间(rrt)为3.35~6.72峰位置的面积进行总计。在本发明中,将上述面积设为质量%。(高速液相色谱仪(hplc)测定条件)色谱柱:ymc j
’
sphere ods-m80(4.6mmid
×
250mm)流动相:0.1质量%磷酸水溶液/乙腈=45/55(体积比)流速:1ml/min检测器:uv(230nm)试料溶液:将试料10mg溶解在流动相10ml中,并注入10μl
[0037]
<通式(4)所示的化合物的含量>
通式(4)所示的化合物的含量在下述条件下通过
1
h-nmr进行测定。通式(4)所示的化合物由与在5.8ppm处具有吸收及在5.9ppm处具有吸收的通式(1)所示的二胺化合物的质子比求出。本发明中将从上述质子比求出的值作为通式(4)的化合物的含量(质量%)。(
1
h-nmr测定条件)装置:日本电子datachem jhm-al400溶剂:dmso-d6扫描次数:16次
[0038]
<色调>色调通过色差计(型号minolta株式会社cr300)进行了测定。在容量30ml的透明的瓶中,用20ml的n,n-二甲基乙酰胺将4g试料溶解并盖上白色的盖子,进行测定。(评价基准)
○
:l*=大于20
△
:l*=10~20
×
:l*=小于10
[0039]
<保存稳定性>在容量30ml的透明的瓶中,用n,n-二甲基乙酰胺20ml将试料4g溶解,并盖上白色的盖子,在25℃下,保存1天,然后使用色差计(型号minolta株式会社cr300)对色调进行测定。(评价基准)l*的变化=|(保存稳定性测定前的色调)-(保存稳定性测定后的色调)|
○
:l*的变化小于2
△
:l*的变化为2~5
×
:l*的变化大于5
[0040]
实施例1(5-氨基-2-(4-氨基苯基)苯并噁唑的制造)将2-氨基-4-硝基苯酚(10.17g,0.066mol)和乙酸丁酯(350ml)放入装有温度计、搅拌器和回流型冷却管的烧瓶中,并在室温搅拌下,滴加溶解在乙酸丁酯(60ml)中的4-硝基苯甲酰氯(12.61g,0.068mol)。加热至100℃并搅拌4小时后,加入多聚磷酸(15g),并在125℃下进一步搅拌10小时。冷却后,通过过滤收集析出的晶体,并在减压下干燥,获得17.3g(产率92%)的5-硝基-2-(4-硝基苯基)苯并噁唑。hplc纯度为98.9质量%,酰胺中间体含量为0.9质量%。将获得的5-硝基-2-(4-硝基苯基)苯并噁唑(14.26g,0.05mol)和甲醇(100ml)放入装有温度计、搅拌器和回流型冷却管的烧瓶中,一边搅拌,一边加热至60℃。滴加30质量%的氢硫化钠(37.38g,0.2mol),并在60~70℃下搅拌24小时。冷却至约0℃后,通过过滤收集晶体并进行干燥,得到9.74g(产率86.5%)的5-氨基-2-(4-氨基苯基)苯并噁唑粗产物。然后,将其在氮气氛下溶解于n,n-二甲基乙酰胺(31ml)中,并缓慢滴加水(39ml)进行再结晶。将晶体冷却至约0℃,通过过滤收集晶体并进行干燥,获得9.00g的提纯产物(提纯回收率:92.3%)。hplc纯度99.5%质量、硫含量55ppm、中间体(相当于通式(2)的化合物)0.06%质量、溶剂分解产物(相当于通式(4)的化合物)0.01质量%,色调为
○
(24.1)。储存稳定性评价为
○
(0.2)。
[0041]
比较例1(5-氨基-2-(4-氨基苯基)苯并噁唑的制造)将2-氨基-4-硝基苯酚(10.17g,0.066mol)和乙酸丁酯(350ml)放入装有温度计、搅拌
器、吹管和回流型冷却管的烧瓶中,并在室温下搅拌,同时滴加溶解于乙酸丁酯(60ml)中的4-硝基苯甲酰氯(12.61g,0.068mol)。加热至100℃并搅拌4小时后,加入多聚磷酸(15g),并在125℃下进一步搅拌10小时。冷却后,通过过滤收集析出的晶体,并在减压下进行干燥,获得17.3g(产率92%)的5-硝基-2-(4-硝基苯基)苯并噁唑。hplc纯度为98.9质量%,酰胺中间体含量为0.9质量%。将获得的5-硝基-2-(4-硝基苯基)苯并噁唑(14.26g,0.05mol)、阮来镍(1.43g)、活性炭(1.43g)和甲醇(490ml)放入装有温度计、搅拌机、吹管和回流型冷却管的烧瓶中,一边搅拌,一边加热至50~60℃。从滴定管将氢导入到烧瓶中,并进行反应直至吸收消失。在相同温度下,将在氮气氛下进行了过滤的溶液冷却至0℃附近,然后,通过过滤收集晶体并进行干燥,获得8.32g(产率73.9%)的5-氨基-2-(4-氨基苯基)苯并噁唑粗产物。然后,在氮气气氛下,用n,n-二甲基乙酰胺(25ml)溶解后,加入8.3g活性炭,搅拌30分钟后滤出活性炭。将水(33ml)缓慢滴加到滤液中进行再结晶。冷却至约0℃左右,通过过滤收集晶体进行干燥,获得7.61g的提纯产物(纯化回收率:91.4%)。hplc纯度99.6%质量,硫含量小于1ppm,中间体(相当于通式(2)的化合物)为0.04质量%,溶剂分解产物(相当于通式(4)的化合物)为0.01质量%,色调评价为
○
(l*24.4)。保存稳定性评价为
×
(l*的变化6.2)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1