用作TEAD调节剂的甲酰胺和磺酰胺衍生物的制作方法
用作tead调节剂的甲酰胺和磺酰胺衍生物
1.序列表
2.本申请含有序列表,所述序列表已经以ascii格式以电子方式提交并且以全文引用的方式并入本文中。所述ascii副本创建于2019年8月30日,命名为33988
‑
185_st25,大小为34kb。
3.相关专利申请的交叉引用
4.本申请要求于2018年9月3日提交的pct/cn2018/103789和于2018年11月22日提交的pct/cn2018/116897的优先权权益,两者通过引用整体合并于本文。
技术领域
5.本公开涉及式(i)和式(ii)有机化合物,其可用于治疗和/或预防哺乳动物,特别是作为可用于治疗癌症的tead的抑制剂。
背景技术:
6.hippo通路是调节细胞增殖和细胞死亡并决定器官大小的信号传导通路。据信,该通路在哺乳动物体内扮演肿瘤抑制子的角色,并且在人类癌症中常常检测到该通路的障碍。该通路参与和/或可能调节干细胞和祖细胞的自我更新和分化。此外,hippo通路可能参与伤口愈合和组织再生。此外,据信随着hippo通路与其他信号传导通路诸如wnt、notch、hedgehog和mapk/erk串扰(cross
‑
talk),它可能影响多种生物事件,并且其功能失调可能除了参与到癌症中之外,还参与到很多人类疾病中。对于综述,参见,例如,halder等人,2011,development 138:9
‑
22;zhao等人,2011,nature cell biology 13:877
‑
883;bao等人,2011,j.biochem.149:361
‑
379;zhao等人,2010,j.cell sci.123:4001
‑
4006。
7.hippo信号传导通路从果蝇到哺乳动物是保守的(vassilev等人,genes and development,2001,15,1229
‑
1241;zeng和hong,cancer cell,2008,13,188
‑
192)。该通路的核心由导致两个转录共激活因子yap(yes相关蛋白)和taz(具有pdz结合基序或tafazzin的转录共激活因子;zhao等人,cancer res.,2009,69,1089
‑
1098;lei等人,mol.cell.biol.,2008,28,2426
‑
2436)的磷酸化的激酶级联(hippo
‑
mst1
‑
2位于lats 1
‑
2和ndri
‑
2的上游)组成。
8.因为hippo信号传导通路是动物发育、器官大小控制和干细胞调节的调节因子,它已经牵涉到癌症的发展中(综述在harvey等人,nat.rev.cancer,2013,13,246
‑
257;zhao等人,genes dev.2010,24,862
‑
874)。在体外,yap或taz在哺乳动物上皮细胞中的过表达通过两种蛋白质与tead家族转录因子的相互作用来诱导细胞转化。增加的yap/taz转录活性诱导致癌特性诸如上皮间质转换,并且也发现其赋予乳腺癌细胞以干细胞特性。在体内,在小鼠肝脏内,yap的过表达或其上游调节因子mst1
‑
2的基因敲除触发了肝细胞癌的发展。此外,当将小鼠肝脏内的肿瘤抑制子nf2失活时,可通过yap的共失活完全阻断肝细胞癌的发展。
9.据信,hippo肿瘤抑制子通路的解除调节是多种恶性肿瘤发展中的重大事件,包括
但不限于肺癌(nsclc;zhou等人,oncogene,2011,30,2181
‑
2186;wang等人,cancer sci.,2010,101,1279
‑
1285)、乳腺癌(chan等人,cancer res.,2008,68,2592
‑
2598;lamar等人,proc.natl.acad.sci,usa,2012;109,e2441
‑
e2250;wang等人,eur.j.cancer,2012,48,1227
‑
1234)、头颈癌(gasparotto等人,oncotarget.,2011,2,1165
‑
1175;steinmann等人,oncol.rep.,2009,22,1519
‑
1526)、结肠癌(angela等人,hum.pathol.,2008,39,1582
‑
1589;yuen等人,plos one,2013,8,e54211;avruch等人,cell cycle,2012,11,1090
‑
1096)、卵巢癌(angela等人,hum.pathol.,2008,39,1582
‑
1589;chad等人,cancer res.,2010,70,8517
‑
8525;hall等人,cancer res.,2010,70,8517
‑
8525)、肝癌(jie等人,gastroenterol.res.pract.,2013,2013,187070;ahn等人,mol.cancer.res.,2013,11,748
‑
758;liu等人,expert.opin.ther.targets,2012,16,243
‑
247)、脑癌(orr等人,j neuropathol.exp.neurol.2011,70,568
‑
577;baia等人,mol.cancer res.,2012,10,904
‑
913;striedinger等人,neoplasia,2008,10,1204
‑
1212)和前列腺癌(zhao等人,genes dev.,2012,26,54
‑
68;zhao等人,genes dev.,2007,21,2747
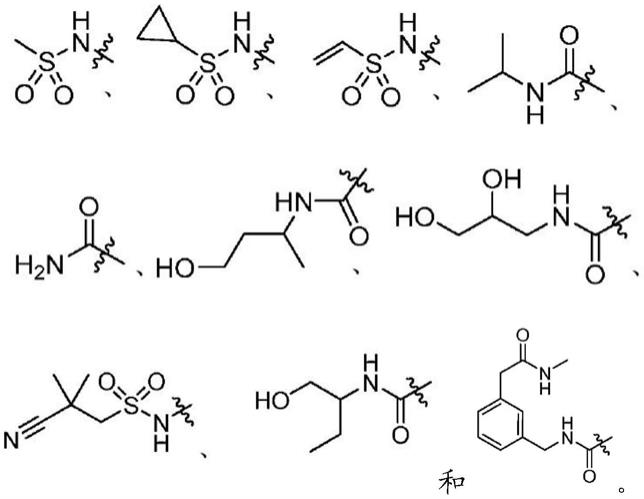
‑
2761)、间皮瘤(fujii等人,j.exp.med.,2012,209,479
‑
494;mizuno等人,oncogene,2012,31,5117
‑
5122;sekido y.,pathol.int.,2011,61,331
‑
344)、肉瘤(seidel等人,mol.carcinog.,2007,46,865
‑
871)和白血病(jimenez
‑
velasco等人,leukemia,2005,19,2347
‑
2350)。
10.哺乳动物hippo通路的两个核心组成部分是lats1和lats2,它们是与果蝇warts(wts)同源的核dbf2相关(ndr)家族蛋白激酶。lats1/2蛋白通过与和果蝇mats同源的支架蛋白mob1a/b(mps是一种结合激酶激活剂样1a和1b)结合而被激活。lats1/2蛋白也可以通过由与果蝇hippo同源的ste20家族蛋白激酶mst1和mst2磷酸化而激活。lats1/2激酶磷酸化与果蝇yorkie同源的下游效应子yap(yes相关蛋白质)和taz(具有pdz结合基序的转录共激活因子;wwtr1)。lats1/2对yap和taz的磷酸化是hippo信号传导通路内的关键事件。lats1/2在多个位点磷酸化yap,但是ser127的磷酸化对于yap抑制至关重要。yap的磷酸化产生蛋白质14
‑3‑
3家族的蛋白质结合基序,其在结合14
‑3‑
3蛋白质后,导致yap在细胞质中的保留和/或螯合。同样,lats1/2在多个位点磷酸化taz,但是ser89的磷酸化对于taz抑制至关重要。taz的磷酸化导致taz在细胞质中的保留和/或螯合。另外,据信yap和taz的磷酸化通过激活由yap或taz泛素化催化的磷酸化依赖性降解而使这些蛋白质不稳定。因此,当hippo通路“开启”时,yap和/或taz被磷酸化,失活并且通常被螯合在细胞质中;相反,当hippo通路“关闭”时,yap和/或taz是未被磷酸化,有活性并且通常存在于细胞核中。
11.非磷酸化的已激活yap被转运到细胞核中,在那里,其主要靶标转录因子是含tead结构域家族的四种蛋白质(tead1至tead4,统称“tead”)。已经发现,yap和tead(或其他转录因子诸如smad1、runx、erbb4和p73)一起诱导多种基因的表达,所述多种基因包括结缔组织生长因子(ctgf)、gli2、birc5、birc2、成纤维细胞生长因子1(fgf1)和双调蛋白(areg)。与yap类似,非磷酸化的taz被转运到细胞核内,在那里,它与多种dna结合转录因子诸如过氧化物酶体增殖物激活受体γ(pparγ)、甲状腺转录因子
‑
1(ttf
‑
1)、pax3、tbx5、runx、tead1和smad2/3/4相互作用。很多由yap/taz
‑
转录因子复合物激活的基因介导细胞存活和增殖。因此,在一些条件下,yap和/或taz发挥致癌基因作用,而hippo通路发挥肿瘤抑制子作用。
12.因此,hippo级联通过抑制tead而实现的药理学靶向,将会是用于治疗具备这一通路功能改变的癌症的一种有价值的方法。
技术实现要素:
13.在一些方面,提供了以下式(i)化合物或其药学上可接受的盐:
[0014][0015]
r1选自
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6卤代烷基、
‑
o
‑
c1‑6烷基、
‑
o
‑
c3‑8环烷基、
‑
o
‑
c1‑6烷基
‑
c3‑8环烷基和
‑
o
‑
c1‑6卤代烷基。
[0016]
r2选自
‑
c(o)
‑
n(r
a
)(r
b
)和
‑
n(r
c
)
‑
s(o)2(r
d
)。每个r
a
、r
b
、r
c
和r
d
独立地选自
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c5‑
20
芳基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c5‑
20
芳基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f)
、
‑
c1‑6烷基
‑
c(o)
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。每个r
a
、r
b
和r
c
进一步可以任选地独立地是氢。每个r
e
和r
f
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
o
‑
c
l
‑
12
烷基和
‑
oh中的至少一个取代。
[0017]
r3是
‑
(a)
n
‑
r5。a选自任选地取代的
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
。r5选自氢、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环,其中对于a和r5,每个
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
、
‑
c2‑
12
烯基
‑
、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环独立地任选地被氧代,
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。n是0或1。
[0018]
每个x和y独立地选自cr4和n。r4和r6独立地选自氢、卤素、
‑
c1‑6卤代烷基和cn。
[0019]
当x和y各自是cr4并且当r2是
‑
c(o)
‑
n(r
a
)(r
b
)时,a选自任选地取代的
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c3‑
12
烯基
‑
并且r5选自氢、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环。对于a和r5,每个
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
、
‑
c3‑
12
烯基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。
[0020]
在一些方面,式(i)化合物或其药学上可接受的盐选自化合物1至21、25至52和54至58:
[0021]
[0022]
[0023]
[0024]
[0025]
[0026][0027]
在一些方面,提供了以下式(ii)化合物或其药学上可接受的盐:
[0028][0029]
r
11
选自氢、
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基和
‑
c1‑6卤代烷基。
[0030]
r
15
是
‑
c(o)
‑
n(r
g
)(r
h
)或
‑
n(r
i
)
‑
s(o)2(r
j
)。每个r
g
、r
h
、r
i
和r
j
独立地选自
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,并且其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
n(r
k
)(r
l
)和
‑
or
k
中的至少一个取代。r
g
、r
h
和r
i
各自进一步可以任选地被h取代。每个r
k
和r
l
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
o
‑
c
l
‑
12
烷基和
‑
oh中的至少一个取代。
[0031]
r
13
是
‑
(a)
n
‑
r
18
。a选自
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
。r
18
选自氢、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环,其中对于a和r
18
,每个
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
、
‑
c2‑
12
烯基
‑
、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环独立地任选地被氧代,
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
k
)(r
l
)和
‑
or
k
中的至少一个取代。n是0或1。
[0032]
虚线表示任选的双键,其中(a)x是c,y是n,x与带有r
12
的环碳原子之间的键为双键,并且y与带有r
12
的环碳原子之间的键是单键,或(b)x是n并且y是c,x与带有r
12
的环碳原子之间的键为单键,并且y与带有r
12
的环碳原子之间的键为双键。
[0033]
每个r
12
、r
14
、r
16
和r
17
独立地选自氢、卤素、
‑
c1‑6烷基和
‑
c1‑6卤代烷基。
[0034]
在一些方面,式(ii)化合物或其药学上可接受的盐选自化合物22
‑
24:
[0035][0036]
在一些方面,式(i)化合物或其药学上可接受的盐选自以下立体异构体:
[0037]
[0038][0039]
在一些方面,提供一种药物组合物,其包含式(i)或式(ii)化合物或其药学上可接受的盐,以及药学上可接受的载体、稀释剂或赋形剂。
[0040]
在一些方面,提供式(i)或式(ii)化合物或其药学上可接受的盐用于药物疗法。
[0041]
在一些方面,提供式(i)或式(ii)化合物或其药学上可接受的盐用于治疗或预防
癌症、间皮瘤、肉瘤或白血病。
[0042]
在一些方面,提供式(i)、式(ii)化合物或其药学上可接受的盐用于制备治疗或预防癌症、间皮瘤、肉瘤或白血病的药物。
[0043]
在一些方面,提供一种用于治疗哺乳动物的癌症、间皮瘤、肉瘤或白血病的方法,所述方法包括向哺乳动物施用式(i)或式(ii)化合物或其药学上可接受的盐。
[0044]
在一些方面,提供式(i)或式(ii)化合物或其药学上可接受的盐用于调节tead活性。
[0045]
在一些方面,提供式(i)或式(ii)化合物或其药学上可接受的盐用于治疗或预防由tead活性介导的疾病或病症。
[0046]
在一些方面,提供式(i)或式(ii)化合物或其药学上可接受的盐用于制备治疗或预防由tead活性介导的疾病或病症的药物。
[0047]
在一些方面,提供一种用于调节tead活性的方法,所述方法包括使tead接触式(i)或式(ii)化合物或其药学上可接受的盐。
[0048]
在一些方面,提供一种用于治疗哺乳动物由tead活性介导的疾病或病症的方法,所述方法包括向哺乳动物施用式(i)或式(ii)化合物或其药学上可接受的盐。
具体实施方式
[0049]
定义
[0050]
除非另做指示,否则说明书和权利要求书中使用的下列特定术语和短语定义如下。
[0051]
术语“部分”是指原子或经化学键合的原子的基团,其通过一个或多个化学键附接至另一个原子或分子以形成分子的一部分。
[0052]
术语“取代的”是指该部分的至少一个氢原子被另一取代基或部分取代的事实。
[0053]
术语“烷基”是指具有1至20个碳原子,诸如1个至12个碳原子或1个至6个碳原子的脂肪族直链或支链饱和烃部分。烷基基团可任选地被取代。
[0054]
术语“环烷基”意为饱和或部分不饱和的碳环部分,其具有单环或双环(包括桥双环)和环内的3个至10个碳原子。在特定方面,环烷基可以含有3个至8个碳原子(即,(c3‑
c8)环烷基)。在其他特定方面,环烷基可以含有3个至6个碳原子(即,(c3‑
c6)环烷基)。环烷基部分的实例包括但不限于,环丙基、环丁基、环戊基、环己基、环庚基及其部分不饱和的衍生物(环烯基)(例如,环戊烯基、环己烯基和环庚烯基)。环烷基部分可以螺环方式附接,例如螺环丙基:
[0055]
术语“卤代烷基”是指一种烷基基团,其中该烷基的一个或多个氢原子已经被替换为相同或不同的卤素原子,诸如氟原子。卤代烷基的实例包括单氟
‑
、二氟
‑
或三氟
‑
甲基、
‑
乙基或
‑
丙基,例如3,3,3
‑
三氟丙基、2
‑
氟乙基、2,2,2
‑
三氟乙基、氟甲基或三氟甲基。卤代烷基基团可以任选地被取代。
[0056]
术语“烯基”是指具有至少一个碳
‑
碳双键的如本文其他地方所定义的直链或支链烷基或取代的烷基基团。烯基基团可以任选地被取代。
[0057]
术语“炔基”是指具有至少一个碳
‑
碳三键的如本文其他地方所定义的直链或支链
烷基或取代的烷基基团。炔基基团可任选地被取代。
[0058]
术语“杂环基”和“杂环”是指4、5、6和7元单环的或7、8、9和10元双环的(包括桥双环)的杂环部分,其是饱和的或部分不饱和的,并且具有位于环中的一个或多个(例如,1、2、3或4个)选自氧、氮和硫的杂原子,且剩余的环原子是碳。当用于指代杂环的环原子时,氮或硫也可以是氧化形式,并且氮可以被取代。杂环可在任何杂原子或碳原子处附接至其侧基,导致稳定的结构,并且任何环原子可以任选地被取代。此类饱和或部分不饱和杂环的实例包括而不限于,四氢呋喃基、四氢噻吩基、吡咯烷基、吡咯烷酮基、哌啶基、吡咯啉基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、噁唑烷基、哌嗪基、二氧杂环己基、二氧杂环戊基、二氮杂环庚三烯基、氧杂环庚三烯基、硫杂环庚三烯基、吗啉基和奎宁环基。术语杂环也包括其中杂环与一个或多个芳基、杂芳基或环烷基环稠合的基团,诸如吲哚啉基、3h
‑
吲哚基、苯并二氢吡喃基、2
‑
氮杂双环[2.2.1]庚烷基、八氢吲哚基或四氢喹啉基。杂环基基团可任选地被取代。
[0059]
术语“芳基”是指具有5个至20个碳环原子的单环、双环或三环芳香族环的环状芳香族烃部分。芳基部分的实例包括但不限于,苯基、萘基、苄基等。术语“芳基”也包括环状芳香族烃部分的部分氢化衍生物,前提是该环状芳香族烃部分的至少一个环是芳香族的,每个是任选地取代的。在一些方面,单环芳环可具有5个或6个碳环原子。芳基基团可任选地被取代。
[0060]
术语“杂芳基”是指1个至20个环原子的芳族杂环的单环或双环体系,其包含1、2、3或4个选自n、o和s的杂原子,剩余的环原子是碳。杂芳基部分的实例包括吡咯基、呋喃基、噻吩基、咪唑基、噁唑基、噻唑基、三唑基、噁二唑基、噻二唑基、四唑基、吡啶基、吡嗪基、吡唑基、哒嗪基、嘧啶基、三嗪基、异噁唑基、苯并呋喃基、异噻唑基、苯并噻吩基、吲哚基、异吲哚基、异苯并呋喃基、苯并咪唑基、苯并噁唑基、苯并异噁唑基、苯并噻唑基、苯并异噻唑基、苯并噁二唑基、苯并噻二唑基、苯并三唑基、嘌呤基、喹啉基、异喹啉基、喹唑啉基或喹噁啉基。杂芳基基团可任选地被取代。
[0061]
术语“卤代(halo)”和“卤素(halogen)”是指氟代、氯代、溴代和碘代。在一些方面,卤代是氟代或氯代。
[0062]
术语“氧代”是指=o部分。
[0063]
术语“螺环”是指包含5个至15个碳原子且两个环均通过单个原子连接的产碳双环环系统。环的大小和性质可以不同,或可以大小和性质相同。实例包括螺戊烷、螺己烷、螺庚烷、螺辛烷、螺酮或螺癸烷。螺环中的一个或多个碳原子可以被杂原子(例如,o、n、s或p)取代,其中在这些方面,螺环可以包含3个至14个碳原子。螺环基团可任选地被取代。
[0064]
术语“药学上可接受的盐”意指保有生物学有效性及游离碱或游离酸特性,并且并非在生物学上或在其他方面有不利之处的盐。盐可与无机酸诸如盐酸、氢溴酸、硫酸、硝酸、磷酸等,优选盐酸,以及有机酸诸如醋酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、水杨酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、n
‑
乙酰半胱氨酸等形成。此外,可通过无机碱或有机碱与游离酸的加成制备盐。衍生自无机碱的盐包括但不限于,钠盐、钾盐、锂盐、铵盐、钙盐和镁盐等。衍生自有机碱的盐包括但不限于,包括下列的盐:伯胺、仲胺和叔胺,天然出现的取代胺,环状胺和碱性离子交换树脂,诸如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、赖氨酸、精氨酸、n
‑
乙基哌啶、哌啶、
聚胺树脂等。
[0065]
术语“前药”是指在生理学条件下容易地经历化学变化以提供本公开的化合物的那些化合物。此外,前药可通过化学或生物化学方法在间接体内环境中转化为本公开的化合物。例如,当将前药放置在具有合适的酶或化学试剂的透皮贴剂储药器中时,前药可缓慢地转化为本公开的化合物。
[0066]
在一些前药方面,前药包括这样的化合物,其中氨基酸残基或两个或多个(例如,两个,三个或四个)氨基酸残基的多肽链通过酰胺或酯键与本公开的化合物的游离氨基、羟基或甲酸基团共价连接。氨基酸残基包括但不限于通常由三个字母符号表示的20种天然氨基酸,还包括磷酸丝氨酸、磷酸苏氨酸、磷酸酪氨酸、4
‑
羟基脯氨酸、羟赖氨酸、脱氢葡萄糖、异十二烷、γ
‑
羧基谷氨酸、马尿酸、八氢吲哚
‑2‑
甲酸、他汀、1,2,3,4
‑
四氢异喹啉
‑3‑
甲酸、青霉胺、鸟氨酸、3
‑
甲基组氨酸、正缬氨酸、β
‑
丙氨酸、γ
‑
氨基丁酸、瓜氨酸、高半胱氨酸、高丝氨酸、甲基丙氨酸、对苯甲酰基苯丙氨酸、苯甘氨酸、炔丙基甘氨酸、肌氨酸、蛋氨酸砜和叔丁基甘氨酸。
[0067]
在一些其他前药方面,本公开的化合物的游离羧基基团可以被衍生为酰胺或烷基酯。在其他前药方面,包含游离羟基基团的前药可以通过使羟基基团转化为诸如但不限于磷酸酯、半琥珀酸酯、二甲氨基乙酸酯或磷酰氧基甲氧基羰的基团而衍生为前药,如fleisher,d.等人,(1996)improved oral drug delivery:solubility limitations overcome by the use of prodrugs advanced drug delivery reviews,19:115所概述。还包括羟基和氨基基团的氨基甲酸酯前药,如羟基基团的碳酸酯前药、磺酸酯和硫酸酯。还涵盖羟基基团衍生为(酰氧基)甲基和(酰氧基)乙基醚,其中酰基基团可以是任选地被一些基团取代的烷基酯,这些基团包括但不限于醚、胺和甲酸官能团,或者其中酰基基团是如上所述的氨基酸酯。这类前药如j.med.chem.,(1996),39:10所述。更具体的实例包括用诸如以下项的基团取代醇基基团的氢原子:(c1‑6)烷酰氧基甲基、1
‑
((c1‑6)烷酰氧基)乙基、1
‑
甲基
‑1‑
((c1‑6)烷酰氧基)乙基、(c1‑6)烷氧基羰氧基甲基、n
‑
(c1‑6)烷氧基羰基氨基甲基、琥珀酰基、(c1‑6)烷酰基、α
‑
氨基(c1‑4)烷酰基、芳基和α
‑
氨基酰基、或α
‑
氨基酰基
‑
α
‑
氨基酰基,其中α
‑
氨基酰基基团各自独立地选自天然存在的l
‑
氨基酸、p(o)(oh)2、
‑
p(o)(o(c1‑6)烷基)2或糖基(由去除碳水化合物的半缩醛形式的羟基产生的自由基)。
[0068]
对于前药衍生物的其他实例,参见,例如,a)design of prodrugs,由h.bundgaard编辑(elsevier,1985)和methods in enzymology,第42卷,第309
‑
396页,由k.widder等编辑(academic press,1985);b)a textbook of drug design and development,由krogsgaard
‑
larsen和h.bundgaard编辑,h.bundgaard,第5章"design and application of prodrugs"第113
‑
191页(1991);c)h.bundgaard,advanced drug delivery reviews,8:1
‑
38(1992);d)h.bundgaard等人,journal of pharmaceutical sciences,77:285(1988);以及e)n.kakeya等人,chem.pharm.bull.,32:692(1984),通过引用将它们各自具体地并入本文。
[0069]
此外,本公开提供本公开化合物的代谢物。如本文所用,“代谢物”是指通过特定化合物或其盐在体内代谢产生的产物。此类产物可以例如由所施用的化合物的氧化、还原、水解、酰胺化、脱酰胺、酯化、脱酯、酶促裂解等产生。
[0070]
代谢产物通常通过制备本公开的化合物具有放射性标记(例如,
14
c或3h)的同位素
进行鉴定,并以可检测的剂量(例如,大于约0.5mg/kg)肠胃外施用于动物(诸如大鼠、小鼠、豚鼠、猴或人),使其有足够的时间新陈代谢(通常约30秒至30小时),并从尿液、血液或其他生物样品中分离出其转化产物。由于这些产物已被标记,因此很容易分离(通过使用能够结合在代谢物中存活的表位的抗体来分离其他产物)。以常规方式,例如,通过ms、lc/ms或nmr分析,来确定代谢物的结构。通常,代谢物的分析以与本领域技术人员熟知的常规药物代谢研究相同的方式进行。只要在体内未发现代谢产物,就可用于公开化合物治疗剂量的诊断测定。
[0071]
本公开的某些化合物可以非溶剂化物形式以及溶剂化物形式存在,包括水合形式。通常,溶剂化的形式等同于未溶剂化的形式,并且旨在为本公开的范围所涵盖在内。本公开的某些化合物可以多种结晶或无定形形态存在。通常,对于本公开考虑的用途而言,全部物理形式是等效的,并且旨在为本公开的范围所涵盖在内。
[0072]
具有相同分子式但在其原子的键合属性或次序上或在其原子的空间排列上有所区别的化合物称为“异构体”。在其原子的空间排列上有所区别的异构体称为“立体异构体”。非对映异构体是在一个或多个手性中心处具有相反构型但不是对映异构体的立体异构体。承载一个或多个作为彼此的不可重叠镜像的不对称中心的立体异构体称为“对映异构体”。当化合物具有不对称中心时,例如,如果一个碳原子键合四个不同的基团,则可能有一对对映异构体。一个对映异构体可通过其一个或多个不对称中心的绝对构型表征,并且通过cahn、ingold和prelog的r
‑
排序规则和s
‑
排序规则描述,或通过该分子借以旋转偏振光平面且被指定为右旋或左旋的模式描述(即,分别为(+)
‑
异构体或(
‑
)
‑
异构体)。手性化合物可作为个体对映异构体存在或作为个体对映异构体的混合物存在。含有等比例对映异构体的混合物称为“外消旋混合物”。在某些方面,将该化合物富集为按重量计至少约90%的单个非对映异构体或对映异构体。在其他方面,将该化合物富集为按重量计至少约95%、98%或99%的单个非对映异构体或对映异构体。
[0073]
本公开的某些化合物具备不对称碳原子(手性中心)或双键;外消旋体、非对映异构体、几何异构体、位置异构体和个体异构体(例如,分离的对映异构体)全部旨在为本公开范围所涵盖在内。
[0074]
本公开的化合物也可以以不同的互变异构形式存在,并且所有这样的形式都包括在本公开的范围内。术语“互变异构体”或“互变异构形式”是指通过低能垒相互转化的具有不同能量的结构异构体。例如,质子互变异构体(也称为质子异变的互变异构体)包括经由质子迁移的相互转化,诸如酮
‑
烯醇和亚胺
‑
烯胺异构化。价互变异构体包括通过一些键合电子的重组而进行的相互转化。
[0075]
除非另做指示,否则术语“该式...化合物”或“式...化合物”或“该式...多个化合物”或“式...多个化合物”是指选自由该式限定的一组化合物中的任何化合物(如果没有另做标注,则包括任何其实施例或方面,诸如任何此类化合物的药学上可接受的盐或酯、立体异构体、几何异构体、互变异构体、溶剂化物、代谢产物、同位素,药学上可接受的盐,或前药)。
[0076]
术语“治疗有效量”的化合物意为,有效预防、缓解或减轻疾病症状或延长被治疗受试者存活期的化合物的量。治疗有效量的确定在该领域技能范围内。根据本公开的化合物的治疗有效量或剂量可在宽范围内变动,并且可以以该领域中已知的方式确定。此剂量
将根据每种具体情况下的个体需求调节,该需求包括施用的特定化合物、施用路径、被治疗的病症以及被治疗的患者。通常,在口服或肠胃外施用到体重大约70kg成年人的情况下,约0.1mg至5,000mg、1mg至约1,000mg、或1mg至100mg的日剂量可能是适宜的,但当指示时可超出下限和上限。日剂量可作为单一剂量或分割剂量施用,或对于肠胃外施用,其可作为连续输注给出。
[0077]
术语“药学上可接受的载体”旨在包括与药物施用相容的任何和全部材料,包括溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂、以及与药物施用相容的其他材料和化合物。除了在任何传统介质或药剂与本公开的化合物不相容的情况之外,都考虑将其用于本公开的组合物中。补充活性化合物也可并入该组合物中。
[0078]
化合物
[0079]
在本公开的一些方面,化合物或其药学上可接受的盐具有下式(i):
[0080][0081]
r1选自
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6卤代烷基、
‑
o
‑
c1‑6烷基、
‑
o
‑
c3‑8环烷基、
‑
o
‑
c1‑6烷基
‑
c3‑8环烷基和
‑
o
‑
c1‑6卤代烷基。在一些方面,r1是
‑
o
‑
c1‑6烷基,诸如
‑
o
‑
c1‑4烷基、
‑
o
‑
c1‑2烷基或
‑
o
‑
ch3。
[0082]
r2选自
‑
c(o)
‑
n(r
a
)(r
b
)和
‑
n(r
c
)
‑
s(o)2(r
d
)。
[0083]
每个r
a
、r
b
、r
c
和r
d
独立地选自
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c5‑
20
芳基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c5‑
20
芳基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f)
、
‑
c1‑6烷基
‑
c(o)
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。每个r
a
、r
b
和r
c
进一步可以任选地独立地是氢。每个r
e
和r
f
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
o
‑
c
l
‑
12
烷基和
‑
oh中的至少一个取代。在一些方面,r
c
是氢并且r
d
选自
‑
c1‑
12
烷基、
‑
c2‑
12
烯基和
‑
c3‑8环烷基,其中
‑
c1‑
12
烷基任选地被
‑
cn取代。在一些方面,r
a
和r
b
独立地选自氢和
‑
c1‑
12
烷基,其中
‑
c1‑
12
烷基任选地被至少一个
‑
oh取代。在一些方面,r2是
‑
c(o)
‑
n(r
a
)(r
b
),r
a
是氢,并且r
b
选自氢、
‑
c1‑6烷基、
‑
c1‑4烷基和
‑
c2‑4烷基,其中所述烷基任选地被至少一个
‑
oh取代。在一些此类方面,r
a
是氢并且r
b
是
‑
ch3。在一些方面,r2是
‑
c(o)
‑
n(r
a
)(r
b
),r
a
是氢,并且r
b
是c1‑3‑
烷基
‑
c5‑6芳基,其中所述c5‑6芳基被
‑
c1‑3烷基
‑
c(o)
‑
n(r
e
)(r
f
)取代,其中r
e
是h并且r
f
是c1‑3烷基。在一些方面,r2是
‑
n(r
c
)
‑
s(o)2(r
d
),r
c
是氢,并且r
d
选自:(1)
‑
c1‑4烷基、
‑
c1‑2烷基、
‑
c3‑6环烷基或
‑
ch3,(2)
‑
c2‑4烯基或
‑
c2烯基,(3)
‑
c1‑6烷基
‑
cn或
‑
c1‑4烷基
‑
cn,和(4)
‑
c3‑8环烷基、
‑
c3‑6环烷基或
‑
c3环烷基。在一些此类方面,r
c
是氢并且r
d
是
‑
ch3。
[0084]
在一些方面,r2选自:
[0085][0086]
r3是
‑
(a)
n
‑
r5。n是0或1。
[0087]
a选自键、
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
,其中每个
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。在一些方面,a选自(1)
‑
c1‑6烷基
‑
、
‑
c1‑4烷基
‑
、
‑
c1‑2烷基
‑
或
‑
ch2‑
,(2)
‑
c3‑8环烷基
‑
、
‑
c3‑5环烷基
‑
或
‑
c3‑4环烷基
‑
和(3)
‑
c2‑6烯基
‑
、
‑
c2‑4烯基
‑
或
‑
c2‑3烯基
‑
。在一些方面,a选自(1)
‑
c3‑8环烷基
‑
、
‑
c3‑5环烷基
‑
或
‑
c3‑4环烷基
‑
并且(2)
‑
c2‑6烯基
‑
、
‑
c2‑4烯基
‑
或
‑
c2‑3烯基
‑
。在一些特定方面,a是c2烯基。
[0088]
r5选自氢、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。在一些方面,r5选自氢、
‑
c3‑8环烷基、
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基、
‑
c6‑
20
芳基和
‑
c5‑
13
螺环独立地任选地被c1‑
12
烷基、c1‑
12
卤代烷基、卤代和
‑
c3‑8环烷基中的至少一个取代。在一些方面,r5选自(1)氢,(2)
‑
c3‑8环烷基、
‑
c3‑6环烷基或
‑
c4‑6环烷基,其中每个所述环烷基任选地被一个或多个卤代、
‑
c1‑4烷基、
‑
c1‑3烷基、
‑
ch3、
‑
c1‑4卤代烷基、
‑
c1‑2卤代烷基或
‑
c1卤代烷基取代,(3)c5‑6芳基或c6芳基,其中每个所述芳基任选地被一个或多个卤代、
‑
c1‑4烷基、
‑
c3烷基、
‑
ch3、
‑
c3‑6环烷基或
‑
c3环烷基取代,和(4)c5‑
12
螺环、c5‑8螺环或c6螺环。在一些特定方面,r5是被至少一个卤代和/或
‑
c1卤代烷基取代的c6环烷基。
[0089]
在一些方面,
‑
(a)
n
‑
r5选自:
[0090][0091][0092]
在一些此类方面,
‑
(a)
n
‑
r5选自:
[0093][0094]
每个x和y独立地选自cr4和n。每个r4和r6独立地选自氢、卤素、
‑
c1‑6卤代烷基和cn。在一些方面,每个r4独立地选自氢和卤代。在一些方面,r6是氢。在一些方面,x是ch。在一些方面,x是n。在一些方面,y是ch。在一些方面,y是cf。在一些方面,y是n。
[0095]
在一些式(i)方面,卤代选自f和cl。在一些方面,卤代烷基选自
‑
chf2和
‑
cf3。
[0096]
在任何各种式(i)方面,当x和y各自是cr4并且当r2是
‑
c(o)
‑
n(r
a
)(r
b
)时,a选自任
选地取代的
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c3‑
12
烯基
‑
并且r5选自氢、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环。对于a和r5,每个
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
、
‑
c3‑
12
烯基
‑
、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。
[0097]
在一些方面,r1是c1‑4烷氧基、c1‑4烷基或c3‑6环烷基。在一些方面,r2是:(1)被
‑
c1‑6烷基、
‑
c3‑6环烷基、
‑
c1‑6烯基或
‑
c1‑6烷基
‑
cn取代的磺酰胺;或(2)被c1‑6烷基取代的酰胺,或被一个或多个
‑
oh取代的c1‑6烷基取代的酰胺。在一些方面,a是键(即,n=0)、
‑
c3‑6环烷基
‑
或
‑
c2‑6烯基
‑
。在一些方面,r5是c4‑6环烷基、c6芳基、c1‑6烷基或c5‑7螺环,其中每个c4‑6环烷基和c6芳基任选地被一个或多个卤代、c1‑4烷基、c1‑4卤代烷基或c3‑6环烷基取代。在一些方面,r6是氢。在一些方面,y是ch、cf或n。在一些方面,x是ch或n。
[0098]
本公开涉及具有式ia结构的化合物:
[0099][0100]
和其药学上可接受的盐。
[0101]
每个x和y独立地选自cr4和n。每个r4独立地选自氢、卤素、
‑
c1‑6卤代烷基和cn。在一些方面,每个r4独立地选自氢和卤代。在一些方面,r4是氢。在一些方面,x是ch。在一些方面,x是n。在一些方面,y是ch。在一些方面,y是cf。在一些方面,y是n。
[0102]
r1选自
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6卤代烷基、
‑
o
‑
c1‑6烷基、
‑
o
‑
c3‑8环烷基、
‑
o
‑
c1‑6烷基
‑
c3‑8环烷基和
‑
o
‑
c1‑6卤代烷基。在一些方面,r1是
‑
o
‑
c1‑6烷基,诸如
‑
o
‑
c1‑4烷基、
‑
o
‑
c1‑2烷基或
‑
o
‑
ch3。
[0103]
每个r
c
和r
d
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c5‑
20
芳基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c5‑
20
芳基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)、
‑
c1‑6烷基
‑
c(o)
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。
[0104]
每个r
e
和r
f
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
o
‑
c
l
‑
12
烷基和
‑
oh中的至少一个取代。在一些方面,r
c
是氢并且r
d
选自
‑
c1‑
12
烷基、
‑
c2‑
12
烯基和
‑
c3‑8环烷基,其中
‑
c1‑
12
烷基任选地被
‑
cn取代。在一些方面,r
c
是氢,并且r
d
选自:(1)
‑
c1‑4烷基、
‑
c1‑2烷基、
‑
c3‑6环烷基或
‑
ch3,(2)
‑
c2‑4烯基或
‑
c2烯基,(3)
‑
c1‑6烷基
‑
cn或
‑
c1‑4烷基
‑
cn,和(4)
‑
c3‑8环烷基、
‑
c3‑6环烷基或
‑
c3环烷基。在一些此类方面,r
c
是氢并且r
d
是
‑
ch3。
[0105]
a选自键、
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
,其中每个
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷
基
‑
和
‑
c2‑
12
烯基
‑
独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。在一些方面,a选自(1)
‑
c1‑6烷基
‑
、
‑
c1‑4烷基
‑
、
‑
c1‑2烷基
‑
或
‑
ch2‑
,(2)
‑
c3‑8环烷基
‑
、
‑
c3‑5环烷基
‑
或
‑
c3‑4环烷基
‑
和(3)
‑
c2‑6烯基
‑
、
‑
c2‑4烯基
‑
或
‑
c2‑3烯基
‑
。在一些方面,a选自(1)
‑
c3‑8环烷基
‑
、
‑
c3‑5环烷基
‑
或
‑
c3‑4环烷基
‑
并且(2)
‑
c2‑6烯基
‑
、
‑
c2‑4烯基
‑
或
‑
c2‑3烯基
‑
。在一些特定方面,a是c2烯基。
[0106]
r5选自氢、
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。
[0107]
在一些方面,r5选自氢、
‑
c3‑8环烷基、
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基、
‑
c6‑
20
芳基和
‑
c5‑
13
螺环独立地任选地被c1‑
12
烷基、c1‑
12
卤代烷基、卤代和
‑
c3‑8环烷基中的至少一个取代。在一些方面,r5选自(1)氢,(2)
‑
c3‑8环烷基、
‑
c3‑6环烷基或
‑
c4‑6环烷基,其中每个所述环烷基任选地被一个或多个卤代、
‑
c1‑4烷基、
‑
c1‑3烷基、
‑
ch3、
‑
c1‑4卤代烷基、
‑
c1‑2卤代烷基或
‑
c1卤代烷基取代,(3)c5‑6芳基或c6芳基,其中每个所述芳基任选地被一个或多个卤代、
‑
c1‑4烷基、
‑
c3烷基、
‑
ch3、
‑
c3‑6环烷基或
‑
c3环烷基取代,和(4)c5‑
12
螺环、c5‑8螺环或c6螺环。在一些特定方面,r5是被至少一个卤代和/或
‑
c1卤代烷基取代的c6环烷基。
[0108]
在实施例中,每个x和y独立地选自cr4和n,r4是氢。在实施例中,x和y各自是cr4并且r4是氢。在实施例中,x是n并且y是cr4并且r4是氢。在实施例中,x是cr4并且r4是氢,并且y是n。在实施例中,x和y各自是n。
[0109]
在实施例中,r1是
‑
o
‑
c1‑6烷基。在实施例中,r1是
‑
o
‑
ch3。在实施例中,r1是
‑
c3‑8环烷基。在实施例中,r1是环丙基。
[0110]
在实施例中,每个r
c
和r
d
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基和
‑
c3‑8环烷基,其中每个
‑
c1‑
12
烷基独立地任选地被至少一个
‑
cn取代。在实施例中,r
c
是氢。在实施例中,r
d
是
‑
c1‑
12
烷基,并且r
c
是氢。在实施例中,r
d
是甲基,并且r
c
是氢。在实施例中,r
d
是被一个cn取代的
‑
c1‑
12
烷基,并且r
c
是氢。在实施例中,r
d
是
‑
c2‑
12
烯基,并且r
c
是氢。在实施例中,r
d
是乙烯,并且r
c
是氢。在实施例中,r
d
是
‑
c3‑8环烷基,并且r
c
是氢。在实施例中,r
d
是环丙基,并且r
c
是氢。
[0111]
在实施例中,a选自键、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
;并且r5选自
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基和
‑
c6‑
20
芳基独立地任选地被
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基和卤代中的至少一个取代。在实施例中,卤代是氯代或氟代。在实施例中,a是键,并且r5是被至少一个
‑
c1‑
12
烷基取代的
‑
c6‑
20
芳基。在实施例中,a是键,并且r5是被至少一个
‑
c1‑
12
烷基取代的苯基。在实施例中,a是
‑
c3‑8环烷基
‑
,并且r5是被一个卤代取代的
‑
c3‑8环烷基或
‑
c6‑
20
芳基。在实施例中,a是
‑
c3‑4环烷基
‑
,并且r5是被一个卤代取代的
‑
c4‑6环烷基或苯基。在实施例中,a是
‑
c3‑4环烷基
‑
,并且r5是被一个卤代取代的苯基。在实施例中,a是
‑
c2‑
12
烯基
‑
,并且r5选自
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基独立地任选地被
‑
c1‑6烷基、
‑
c1‑
12
卤代烷基和卤代中的至少一个取代,并且每个
‑
c6‑
20
芳基任选地被至少一个卤代取代。在实施例中,a是乙烯。在实施例中,a是乙烯,并且r5是
‑
c1‑6烷基。在实施例中,a是乙烯,并且r5是任选地被
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基和卤代中的至少
一个取代的
‑
c3‑8环烷基。在实施例中,a是乙烯,并且r5是任选地被
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基和卤代中的至少一个取代的
‑
c4‑6环烷基。在实施例中,a是乙烯,并且r5是
‑
c1‑6烷基
‑
c3‑8环烷基。在实施例中,a是乙烯,并且r5是被一个卤代取代的苯基。在实施例中,a是乙烯,并且r5是
‑
c5‑
13
螺环。
[0112]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;并且r
c
是氢。
[0113]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;并且r
d
是
‑
c1‑
12
烷基,并且r
c
是氢。
[0114]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;并且r
d
是环丙基,并且r
c
是氢。
[0115]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;并且r
d
是乙烯,并且r
c
是氢。
[0116]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是
‑
c3‑4环烷基
‑
。
[0117]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是乙烯。
[0118]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是键。
[0119]
在实施例中,x和y中的至少一个是n;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是乙烯。
[0120]
在实施例中,x是n并且y是cr4并且r4是氢;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是乙烯。
[0121]
在实施例中,x是cr4并且r4是氢,并且y是n;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是乙烯。
[0122]
在实施例中,x和y各自是n;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是乙烯。
[0123]
在实施例中,每个x和y独立地选自cr4和n,并且r4是氢;r1是
‑
o
‑
ch3;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;a是键;并且r5是被至少一个
‑
c1‑
12
烷基取代的
‑
c6‑
20
芳基。
[0124]
在实施例中,每个x和y独立地选自cr4和n,并且r4是氢;r1是
‑
o
‑
ch3;r
d
是甲基,并且r
c
是氢;a是
‑
c3‑4环烷基
‑
,并且r5是被至少一个卤代取代的
‑
c4‑6环烷基或苯基。
[0125]
在实施例中,每个x和y独立地选自cr4和n,并且r4是氢;r1是
‑
o
‑
ch3;r
d
是甲基,并且r
c
是氢;a是
‑
c2‑
12
烯基
‑
,并且r5选自
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基独立地任选地被
‑
c1‑6烷基、
‑
c1‑
12
卤代烷基和卤代中的至少一个取代,并且每个
‑
c6‑
20
芳基任选地被至少一个卤代取代。
[0126]
在实施例中,每个x和y独立地选自cr4和n,并且r4是氢;r1是
‑
o
‑
ch3;r
d
是甲基,并且r
c
是氢;a是
‑
c2‑
12
烯基
‑
,并且r5是任选地被
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基和卤代中的至少一个取代的
‑
c4‑6环烷基。
[0127]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
ch3;r
d
是甲基,并且r
c
是氢;a是乙烯,并且r5是任选地被至少一个卤代取代的
‑
c4‑6环烷基。
[0128]
在实施例中,x是n并且y是cr4并且r4是氢;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是乙烯;并且r5是任选地被至少一个卤代取代的
‑
c4‑6环烷基。
[0129]
在实施例中,x是cr4并且r4是氢,并且y是n;r1是
‑
o
‑
c1‑6烷基;r
d
是
‑
c1‑
12
烷基,并且r
c
是氢;并且a是乙烯;并且r5是任选地被至少一个卤代取代的
‑
c4‑6环烷基。
[0130]
在实施例中,每个x和y独立地选自cr4和n,并且r4是氢;r1是
‑
o
‑
ch3;r
d
是甲基,并且r
c
是氢;a是
‑
c2‑
12
烯基
‑
;并且r5是被一个卤代取代的苯基。
[0131]
在实施例中,每个x和y独立地选自cr4和n,并且r4是氢;r1是
‑
o
‑
ch3;r
d
是甲基,并且r
c
是氢;a是
‑
c2‑
12
烯基
‑
;并且r5是
‑
c5‑
13
螺环。
[0132]
在实施例中,每个x和y独立地选自cr4和n,每个r4独立地选自氢和卤素;r1是
‑
o
‑
c1‑6烷基;每个r
c
和r
d
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基和
‑
c3‑8环烷基,其中每个
‑
c1‑
12
烷基独立地任选地被至少一个
‑
cn取代;a选自键、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
;并且r5选自
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中
‑
c3‑8环烷基和
‑
c6‑
20
芳基独立地任选地被
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基和卤代中的至少一个取代。
[0133]
在一些方面,式(ia)化合物选自下表1中所列的化合物,包括外消旋混合物和分离的异构体:
[0134]
表1
[0135]
[0136]
[0137]
[0138]
[0139]
[0140][0141]
本公开涉及具有式ib结构的化合物:
[0142][0143]
和其药学上可接受的盐。
[0144]
每个x和y独立地选自cr4和n。每个r4独立地选自氢、卤素、
‑
c1‑6卤代烷基和cn。在一些方面,每个r4独立地选自氢和卤代。在一些方面,r4是氢。在一些方面,x是ch。在一些方面,x是n。在一些方面,y是ch。在一些方面,y是cf。在一些方面,y是n。
[0145]
r1选自
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6卤代烷基、
‑
o
‑
c1‑6烷基、
‑
o
‑
c3‑8环烷基、
‑
o
‑
c1‑6烷基
‑
c3‑8环烷基和
‑
o
‑
c1‑6卤代烷基。在一些方面,r1是
‑
o
‑
c1‑6烷基,诸如
‑
o
‑
c1‑4烷基、
‑
o
‑
c1‑2烷基或
‑
o
‑
ch3。
[0146]
每个r
a
和r
b
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c5‑
20
芳基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c5‑
20
芳基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)、
‑
c1‑6烷基
‑
c(o)
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。
[0147]
每个r
e
和r
f
独立地选自氢、
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
o
‑
c
l
‑
12
烷基和
‑
oh中的至少一个取代。
[0148]
在一些方面,r
a
和r
b
独立地选自氢和
‑
c1‑
12
烷基,其中
‑
c1‑
12
烷基任选地被至少一个
‑
oh取代。在一些方面,r
a
是氢,并且r
b
选自氢、
‑
c1‑6烷基、
‑
c1‑4烷基和
‑
c2‑4烷基,其中所述烷基任选地被至少一个
‑
oh取代。在一些此类方面,r
a
是氢并且r
b
是
‑
ch3。在一些方面,r
a
是氢,并且r
b
是c1‑3‑
烷基
‑
c5‑6芳基,其中所述c5‑6芳基被
‑
c1‑3烷基
‑
c(o)
‑
n(r
e
)(r
f
)取代,其中r
e
是h并且r
f
是c1‑3烷基。
[0149]
a选自键、
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
,其中每个
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。在一些方面,a选自(1)
‑
c1‑6烷基
‑
、
‑
c1‑4烷基
‑
、
‑
c1‑2烷基
‑
或
‑
ch2‑
,(2)
‑
c3‑8环烷基
‑
、
‑
c3‑5环烷基
‑
或
‑
c3‑4环烷基
‑
和(3)
‑
c2‑6烯基
‑
、
‑
c2‑4烯基
‑
或
‑
c2‑3烯基
‑
。在一些方面,a选自(1)
‑
c3‑8环烷基
‑
、
‑
c3‑5环烷基
‑
或
‑
c3‑4环烷基
‑
并且(2)
‑
c2‑6烯基
‑
、
‑
c2‑4烯基
‑
或
‑
c2‑3烯基
‑
。在一些特定方面,a是c2烯基。
[0150]
r5选自氢、
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
e
)(r
f
)和
‑
or
e
中的至少一个取代。
[0151]
在一些方面,r5选自氢、
‑
c3‑8环烷基、
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷
基、
‑
c6‑
20
芳基和
‑
c5‑
13
螺环独立地任选地被c1‑
12
烷基、c1‑
12
卤代烷基、卤代和
‑
c3‑8环烷基中的至少一个取代。在一些方面,r5选自(1)氢,(2)
‑
c3‑8环烷基、
‑
c3‑6环烷基或
‑
c4‑6环烷基,其中每个所述环烷基任选地被一个或多个卤代、
‑
c1‑4烷基、
‑
c1‑3烷基、
‑
ch3、
‑
c1‑4卤代烷基、
‑
c1‑2卤代烷基或
‑
c1卤代烷基取代,(3)c5‑6芳基或c6芳基,其中每个所述芳基任选地被一个或多个卤代、
‑
c1‑4烷基、
‑
c3烷基、
‑
ch3、
‑
c3‑6环烷基或
‑
c3环烷基取代,和(4)c5‑
12
螺环、c5‑8螺环或c6螺环。在一些特定方面,r5是被至少一个卤代和/或
‑
c1卤代烷基取代的c6环烷基。
[0152]
在实施例中,每个x和y独立地选自cr4和n,r4是氢。在实施例中,x和y各自是cr4并且r4是氢。在实施例中,x是n并且y是cr4并且r4是氢。在实施例中,x是cr4并且r4是氢,并且y是n。在实施例中,x和y各自是n。
[0153]
在实施例中,r1是
‑
o
‑
c1‑6烷基。在实施例中,r1是
‑
o
‑
ch3。
[0154]
在实施例中,每个r
a
和r
b
独立地选自氢、
‑
c1‑
12
烷基和
‑
c1‑6烷基
‑
c5‑
20
芳基,其中每个
‑
c1‑
12
烷基和
‑
c1‑6烷基
‑
c5‑
20
芳基独立地任选地被羟基和
‑
c1‑6烷基
‑
c(o)
‑
n(r
e
)(r
f
)中的至少一个取代,并且每个r
e
和r
f
独立地选自氢和
‑
c1‑
12
烷基。在实施例中,r
b
是氢。在实施例中,r
a
是
‑
c1‑
12
烷基,并且r
b
是氢。在实施例中,r
a
是被一个
‑
or
e
取代的
‑
c1‑
12
烷基,其中r
e
是氢,并且r
b
是氢。在实施例中,r
a
是被两个
‑
or
e
取代的
‑
c1‑
12
烷基,其中每个r
e
是氢,并且r
b
是氢。在实施例中,r
a
是被
‑
c1‑6烷基
‑
c(o)
‑
n(r
e
)(r
f
)取代的
‑
c1‑6烷基
‑
c5‑
20
芳基,并且每个r
e
和r
f
独立地选自氢和
‑
c1‑
12
烷基,并且r
b
是氢。
[0155]
在实施例中,a选自键、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
;并且r5选自
‑
c3‑8环烷基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基和
‑
c6‑
20
芳基独立地任选地被
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基和卤代中的至少一个取代。在实施例中,a是键,并且r5是被至少一个
‑
c3‑8环烷基取代的
‑
c6‑
20
芳基。在实施例中,a是
‑
c3‑8环烷基
‑
;并且r5是被一个卤代取代的
‑
c6‑
20
芳基。在实施例中,a是
‑
c2‑
12
烯基
‑
;并且r5选自
‑
c3‑8环烷基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基独立地任选地被
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基和卤代中的至少一个取代。在实施例中,a是
‑
c2‑
12
烯基
‑
;并且r5是任选地被
‑
c1‑
12
卤代烷基和卤代中的至少一个取代地
‑
c3‑8环烷基。在实施例中,a是
‑
c2‑
12
烯基
‑
;并且r5是
‑
c1‑6烷基
‑
c6‑
20
芳基。
[0156]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;r
a
是
‑
c1‑
12
烷基,并且r
b
是氢;a是
‑
c3‑8环烷基
‑
;并且r5是被一个卤代取代的
‑
c6‑
20
芳基。
[0157]
在实施例中,x和y各自是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;每个r
a
和r
b
独立地选自氢和
‑
c1‑
12
烷基;a是键或
‑
c2‑
12
烯基
‑
;并且r5选自
‑
c3‑8环烷基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基,其中每个
‑
c3‑8环烷基和
‑
c6‑
20
芳基独立地任选地被
‑
c1‑
12
卤代烷基和卤代中的至少一个取代。
[0158]
在实施例中,x和y中的至少一个是n,并且x和y中的至少一个是cr4,并且r4是氢,或x和y各自均是n;r1是
‑
o
‑
c1‑6烷基;每个r
a
是被至少一个
‑
or
e
取代的
‑
c1‑
12
烷基,其中每个r
e
是氢,并且r
b
是氢;a是
‑
c2‑
12
烯基
‑
;并且r5是
‑
c3‑8环烷基或
‑
c5‑
13
螺环,其中
‑
c3‑8环烷基被
‑
c1‑
12
卤代烷基和卤代中的至少一个取代。
[0159]
在实施例中,x和y中的至少一个是n,并且x和y中的至少一个是cr4,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;每个r
a
和r
b
独立地选自氢和被
‑
c1‑6烷基
‑
c(o)
‑
n(r
e
)(r
f
)取代的
‑
c1‑6烷基
‑
c5‑
20
芳基,每个r
e
和r
f
独立地选自氢和
‑
c1‑
12
烷基;a是
‑
c2‑
12
烯基
‑
;并且r5是被一个
‑
c1‑
12
卤
代烷基或两个卤代取代的
‑
c3‑8环烷基。
[0160]
在实施例中,每个x和y独立地选自cr4和n,并且r4是氢;r1是
‑
o
‑
c1‑6烷基;每个r
a
和r
b
独立地选自氢、c1‑
12
烷基和
‑
c1‑6烷基
‑
c5‑
20
芳基,其中每个c1‑
12
烷基和
‑
c1‑6烷基
‑
c5‑
20
芳基独立地任选地被至少一个
‑
or
e
取代,其中r
e
是氢和
‑
c1‑6烷基
‑
c(o)
‑
n(r
e
)(r
f
),并且每个r
e
和r
f
独立地选自氢和
‑
c1‑
12
烷基;a选自键、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
;并且r5选自
‑
c3‑8环烷基、
‑
c6‑
20
芳基、
‑
c1‑6烷基
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基和
‑
c6‑
20
芳基独立地任选地被
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基和卤代中的至少一个取代。
[0161]
在一些方面,式(ib)化合物选自下表2中所列的化合物,包括外消旋混合物和分离的异构体:
[0162]
表2
[0163]
[0164]
[0165]
[0166]
[0167][0168]
在本公开的一些方面,化合物或其药学上可接受的盐具有以下式(ii):
[0169][0170]
r
11
选自氢、
‑
c1‑6烷基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基和
‑
c1‑6卤代烷基。在一些方面,r
11
是
‑
c1‑6烷基。在一些方面,r
11
选自
‑
c1‑4烷基、
‑
c1‑2烷基和
‑
ch3。
[0171]
r
15
是
‑
c(o)
‑
n(r
g
)(r
h
)或
‑
n(r
i
)
‑
s(o)2(r
j
)。
[0172]
每个r
g
、r
h
、r
i
、r
j
、r
k
和r
l
独立地选自
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基,并且其中每个
‑
c1‑
12
烷基、
‑
c2‑
12
烯基、
‑
c2‑
12
炔基、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基和
‑
c1‑
20
杂芳基独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代、
‑
no2、
‑
n(r
k
)(r
l
)和
‑
or
k
中的至少一个取代。每个r
g
、r
h
、r
i
、r
k
和r
l
进一步可以任选地是h。在一些方面,r
g
和r
h
独立地选自氢、
‑
c1‑
12
烷基和
‑
c3‑8环烷基,其中所述
‑
c1‑
12
烷基和
‑
c3‑8环烷基独立地任选地被至少一个
‑
oh取代。在一些方面,r
i
是氢并且r
j
选自
‑
c1‑
12
烷基、
‑
c2‑
12
烯基和
‑
c3‑8环烷基,其中
‑
c1‑
12
烷基任选地被
‑
cn取代。
[0173]
在一些方面,r
15
是
‑
n(r
i
)
‑
s(o)2(r
j
),r
i
是氢,并且r
j
选自
‑
c1‑4烷基、
‑
c1‑2烷基和
‑
ch3。在一些方面,r
15
选自:
[0174][0175]
r
13
是
‑
(a)
n
‑
r
18
。n是0或1。在一些方面,r
13
选自氢和c1‑6烷基。
[0176]
a选自
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
和
‑
c2‑
12
烯基
‑
。在一些方面,a选自(1)
‑
c1‑6烷基
‑
、
‑
c1‑4烷基
‑
、
‑
c1‑2烷基
‑
或
‑
ch2‑
,(2)
‑
c3‑8环烷基
‑
、
‑
c3‑5环烷基
‑
或
‑
c3‑4环烷基
‑
和(3)
‑
c2‑6烯基
‑
、
‑
c2‑4烯基
‑
或
‑
c2‑3烯基
‑
。在一些方面,a选自(1)
‑
c1‑6烷基
‑
、
‑
c1‑4烷基
‑
、
‑
c1‑2烷基
‑
和
‑
ch2‑
。在一些特定方面,a是
‑
ch2‑
。
[0177]
r
18
选自氢、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环。对于a和r
18
,每个
‑
c1‑
12
烷基
‑
、
‑
c3‑8环烷基
‑
、
‑
c2‑
12
烯基
‑
、
‑
c3‑8环烷基、
‑
c1‑6烷基
‑
c3‑8环烷基、
‑
c3‑8杂环基、
‑
c6‑
20
芳基、
‑
c1‑
20
杂芳基和
‑
c5‑
13
螺环独立地任选地被氧代、
‑
cn、
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、
‑
c3‑8环烷基、卤代、
‑
no2、
‑
n(r
k
)(r
l)
和
‑
or
k
中的至少一个取代。在一些方面,r
18
选自氢、
‑
c3‑8环烷基、
‑
c6‑
20
芳基和
‑
c5‑
13
螺环,其中每个
‑
c3‑8环烷基、
‑
c6‑
20
芳基和
‑
c5‑
13
螺环独立地任选地被
‑
c1‑
12
烷基、
‑
c1‑
12
卤代烷基、卤代和
‑
c3‑8环烷基中的至少一个取代。在一些方面,r
18
是
‑
c5‑6芳基或
‑
c6芳基,其中所述芳基任选地被一个或多个卤代取代。
[0178]
在一些方面,
‑
(a)
n
‑
r
18
是
[0179][0180]
虚线表示任选的双键。在一些方面,x是c,y是n,x与带有r
12
的环碳原子之间的键为双键,并且y与带有r
12
的环碳原子之间的键为单键。在一些方面,x是n,y是c,x与带有r
12
的环碳原子之间的键为单键,并且y与带有r
12
的环碳原子之间的键为双键。
[0181]
每个r
12
、r
14
、r
16
和r
17
独立地选自氢、卤素、
‑
c1‑6烷基和
‑
c1‑6卤代烷基。在一些方面,r
12
、r
14
、r
16
和r
17
各自是氢。
[0182]
在一些式(ii)方面,卤代是cl。
[0183]
在一些方面,r
11
是c1‑4烷基。在一些方面,r
12
、r
14
、r
16
和r
17
是氢。在一些方面,r
15
是被c1‑4烷基或c3‑6环烷基取代的磺酰胺。在一些方面,a是
‑
c1‑4烷基
‑
并且n是1。在一些方面,r
15
是c6芳基或c4‑6环烷基,并且每个c6芳基和c4‑6环烷基任选地被一个或多个卤代或c1‑4卤代烷基取代。在一些方面:(a)x是c,y是n,x与带有r
12
的环碳原子之间的键为双键,并且y与带有r
12
的环碳原子之间的键是单键,或(b)x是n并且y是ch,x与带有r
12
的环碳原子之间的键为单键,并且y与带有r
12
的环碳原子之间的键为双键。
[0184]
在一些方面,式(ii)化合物选自下表3中所列的化合物,包括外消旋混合物和分离的异构体:
[0185]
表3
[0186][0187]
在一些方面,本公开的化合物通过具有不同原子质量或质量数的原子取代其中的一个或多个原子进行同位素标记。此类同位素标记的(即,放射标记的)的式(i)和/或式(ii)化合物被视为在本公开的范围内。可掺入式(i)和/或式(ii)化合物的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、氯和碘的同位素,分别诸如但不限于2h、3h、
11
c、
13
c、
14
c、
13
n、
15
n、
15
o、
17
o、
18
o、
31
p、
32
p、
35
s、
18
f、
36
cl、
123
i和
125
i。这些同位素标记的化合物通过表征例如作用位点或模式,或tead的结合亲和力,将有助于确定或测量化合物的有效性。某些同位素标记的式(i)和/或式(ii)化合物,例如,那些掺入有放射性同位素的,可用于药物和/或底物组织分布研究。就易于并入和易于检测而言,放射性同位素氚(即,3h)和碳
‑
14(即,
14
c)特别用于这一目的。例如,式(i)和/或式(ii)化合物可富集为具有1%、2%、5%、10%、25%、50%、75%、90%、95%或99%的给定同位素。
[0188]
用较重的同位素诸如氘(即,2h)取代可以提供由于更高的代谢稳定性(例如,体内半衰期增加或剂量需求减少)而带来的某些治疗优势。
[0189]
以正电子发射同位素(诸如
11
c、
18
f、
15
o和
13
n)进行的取代可用于正电子发射断层扫描(pet)研究,以检查底物受体的占有率。同位素标记的式(i)和/或式(ii)化合物的制备通常可通过本领域技术人员已知的传统技术,或通过类似于下文阐述的实例中描述的那些过程,使用适宜的同位素标记的试剂替代先前采用的非标记试剂。
[0190]
药物组合物和施用
[0191]
除了以上提供的一种或多种化合物(包括其立体异构体、几何异构体、互变异构体、溶剂化物、代谢产物、同位素,药学上可接受的盐或其前药),本公开还提供包含本公开的化合物或其实施例或方面和至少一种药学上可接受的载体的组合物和药物。本公开的组合物可用于选择性抑制患者(例如,人)中的tead。
[0192]
在一个方面,本公开提供了包含本公开的化合物(或其实施例和方面包括立体异构体、几何异构体、互变异构体、溶剂化物、代谢物、同位素、药学上可接受的盐和前药)和药学上可接受的载体、稀释剂或赋形剂的药物组合物或药物。在另一个方面,本公开提供了用于制备包含本公开的化合物的组合物(或药物)。在另一个方面,本公开提供了用于将本公
开的化合物或包含本公开的化合物的组合物向有此需要的患者(例如,人患者)施用的方法。
[0193]
载体可选自各种油,包括石油、动物、植物或合成来源的油,例如,花生油、大豆油、矿物油、芝麻油等。水、盐水、葡聚糖水溶液和二醇是优选的液体载体,特别是(当与血液等渗时)用于可注射溶液。例如,用于静脉内施用的制剂包含本公开的化合物的无菌水溶液,其通过将本公开的固体化合物溶解在水中以产生水溶液并使该溶液无菌而制备。合适的药物赋形剂包括淀粉、纤维素、滑石、葡萄糖、乳糖、滑石、明胶、麦芽、大米、面粉、白垩、二氧化硅、硬脂酸镁、硬脂酸钠、甘油单硬脂酸酯、氯化钠、脱脂乳、甘油、丙二醇、水、乙醇等。组合物可经受传统的药物添加剂诸如防腐剂、稳定剂、润湿剂或乳化剂、用于调节渗透压的盐、缓冲剂等。合适的药物载体和它们的制剂在e.w.martin的remington's pharmaceutical sciences中描述。无论如何,此类组合物将包含有效量的本公开的化合物连同合适的载体一起,以制备用于适当施用于受试者的合适剂型。
[0194]
以与良好医学实践一致的方式配制、计量和施用组合物。在这种情况下需要考虑的因素包括所治疗的特定疾患、所治疗的特定哺乳动物、个体患者的临床病症、疾患的原因、药剂的递送部位、施用方法、施用的时间安排,以及执业医师已知的其他因素。要施用的化合物的有效量将由这些注意事项决定,并且是抑制tead活性所需的最小量,以预防或治疗不期望的疾病或疾患,例如疼痛。例如,该量可以低于对正常细胞或哺乳动物整体有毒的量。
[0195]
在一个实例中,每剂量肠胃外施用的本公开的化合物的治疗有效量将在每天约0.01
‑
100mg/kg患者体重的范围内,另选地约例如0.1至20mg/kg患者体重的范围内,通常所用化合物的初始范围为0.3至15mg/kg/天。在某些方面,每日剂量以单日剂量或每天分两次至六次给药,或以缓释形式给药。对于70kg的成年人,每日总剂量通常是从约7mg至约1,400mg。可以调整该剂量方案以提供最佳的治疗应答。化合物可以每天1次至4次,优选每天一次或两次的方案施用。
[0196]
本公开的化合物可以任何方便的施用形式施用,例如,片剂、粉剂、胶囊剂、溶液剂、分散剂、混悬剂、糖浆剂、喷雾剂、栓剂、凝胶剂、乳剂、贴剂等。此类组合物可以包含药物制剂中常规的组分,例如,稀释剂、载体、ph调节剂、甜味剂、填充剂和其他活性剂。
[0197]
通常根据标准药学实践将包含本公开的化合物(或其实施例或方面包括其立体异构体、几何异构体、互变异构体、溶剂化物、代谢物、同位素、药学上可接受的盐和前药)的组合物配制为药物组合物。通过混合本公开的化合物和稀释剂、载体或赋形剂来制备通常的制剂。适合的稀释剂、载体和赋形剂是本领域技术人员熟知的,并且在例如ansel,howard c.等人,ansel’spharmaceutical dosage forms and drug delivery systems.philadelphia:lippincott,williams和wilkins,2004;gennaro,alfonso r.等人remington:the science and practice of pharmacy.philadelphia:lippincott,williams&wilkins,2000;以及rowe,raymond c.handbook of pharmaceutical excipients.chicago,pharmaceutical press,2005中有详细描述。制剂还可以包含一种或多种缓冲剂、稳定剂、表面活性剂、湿润剂、润滑剂、乳化剂、悬浮剂、防腐剂、抗氧化剂、不透明剂、助流剂、加工助剂、着色剂、甜味剂、加香剂、调味剂、稀释剂和其他已知的添加剂,以提供美观的药物(即,本公开的化合物或其药物组合物)展示或有助于药物产品(即,药物)
的制备。合适的载体、稀释剂和赋形剂是本领域技术人员众所周知的,其包括缓冲液,诸如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(诸如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3
‑
戊醇;间甲酚);低分子量(少于约10个残基)多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,诸如edta;糖,诸如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐抗衡离子,诸如钠;金属络合物(例如,锌蛋白络合物);和/或非离子表面活性剂,诸如tween
tm
、pluronics
tm
或聚乙二醇(peg)。本公开的活性药物成分(例如,式(i)或式(ii)化合物或其实施例或方面)也可以包埋在例如通过凝聚技术或通过界面聚合制备的微胶囊(例如,分别为羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)中,被包埋在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米粒子和纳米胶囊)中或粗滴乳液中。此类技术披露在remington:the science and practice of pharmacy:remington the science and practice of pharmacy(2005)第21版,lippincott williams&wilkins,philadelphia,pa。所使用的特定载体、稀释剂或赋形剂将取决于本公开的化合物被施用的方式和目的。通常基于本领域技术人员公认的可安全地施用于哺乳动物的溶剂(gras)来选择溶剂。通常,安全溶剂是无毒的水性溶剂,诸如水和其他可溶于水或与水混溶的无毒溶剂。合适的水性溶剂包括水、乙醇、丙二醇、聚乙二醇(例如peg 400、peg 300)等及其混合物。
[0198]
可以制备本公开的化合物的缓释制剂(例如,式(i)或式(ii)化合物或其实施例或方面)。缓释制备物的合适实例包括含有式(i)或式(ii)化合物或其实施例或方面的固态疏水聚合物的半透性基质,所述基质是例如膜或微胶囊等成型制品的形式。缓释基质的实例包括聚酯、水凝胶(例如,聚(2
‑
甲基丙烯酸羟乙酯),或聚(乙烯醇))、聚乳酸(美国专利第3,773,919号)、l
‑
谷氨酸与γ
‑
乙基
‑
l
‑
谷氨酸盐的共聚物(sidman等人,biopolymers 22:547,1983)、不可降解的乙烯
‑
乙酸乙烯酯(langer等人,j.biomed.mater.res.15:167,1981)、可降解的乳酸
‑
乙醇酸共聚物诸如lupron depot
tm
(由乳酸
‑
乙醇酸共聚物和醋酸亮丙瑞林组成的可注射微球)和聚
‑
d
‑
(
‑
)
‑3‑
羟丁酸(ep 133,988a)。缓释组合物还包括脂质体包裹的化合物,其可以通过本身已知的方法制备(epstein等人,proc.natl.acad.sci.u.s.a.82:3688,1985;hwang等人,proc.natl.acad.sci.u.s.a.77:4030,1980;美国专利号4,485,045和4,544,545;和ep 102,324a)。通常,脂质体是小的(约200
‑
800埃)单层脂质体,其中脂质含量大于约30mol%胆固醇,为最佳治疗调整了选择的比例。
[0199]
在一个实例中,本公开的化合物或其实施例或方面可通过在环境温度在适当的ph值和以期望的纯度与生理学上可接受的载体(即在所用剂量和浓度下对受试者无毒的载体)混合而配制为盖伦(galenical)施用形式。制剂的ph值主要取决于化合物的具体用途和浓度,但是优选在约3至约8的范围内。在一个实例中,将本公开的化合物(或其实施例或方面)在ph 5的乙酸盐缓冲液中配制。在另一方面,本公开的化合物或其实施例是无菌的。化合物可以例如作为固体或无定形组合物、作为冻干制剂或作为水溶液储存
[0200]
本公开的适合口服施用的化合物的制剂可以制备成离散的单位,例如丸剂、胶囊
剂、扁囊剂或片剂,每个均包含预定量的本公开的化合物。
[0201]
可以通过在合适的机器中将自由流动形式(例如粉末或颗粒,任选地与粘结剂、润滑剂、惰性稀释剂、防腐剂、表面活性剂或分散剂混合)的本公开的化合物压缩来制备压制的片剂。模制片剂可以通过在合适的机器中模制用惰性液体稀释剂润湿的粉状本公开的化合物的混合物来制备。片剂可以任选地被包衣或刻痕,并且可以任选地被配制以提供本公开的化合物从其中的缓慢或受控释放。
[0202]
可制备供口服使用的片剂、含片、水性或油性悬浮剂、可分散的粉剂或颗粒剂、乳剂、硬胶囊或软胶囊,例如明胶胶囊、糖浆或酏剂。用于口服的本公开的化合物的制剂可以根据本领域已知的用于制备药物组合物的任何方法来制备,并且这种组合物可以包含一种或多种制剂,包括甜味剂、调味剂、着色剂和防腐剂以提供可口的制剂。包含本公开的化合物与适合于制备片剂的无毒药用的赋形剂混合的片剂是可接受的。这些赋形剂可以是例如惰性稀释剂,诸如碳酸钙或碳酸钠、乳糖、磷酸钙或磷酸钠;制粒剂和崩解剂,诸如玉米淀粉或海藻酸;粘合剂,诸如淀粉、明胶或阿拉伯树胶;以及润滑剂,诸如硬脂酸镁、硬脂酸或滑石粉。片剂可以是未包衣的,或者可以通过包括微胶囊化在内的已知技术包衣,以延迟在胃肠道中的崩解和吸附,从而在较长时段内提供持续作用。例如,可采用延时材料,诸如单硬脂酸甘油酯或甘油二硬脂酸酯单独使用或与蜡一起使用。
[0203]
合适的口服施用形式的实例是含有约0.1mg、约1mg、约5mg、约10mg,约25mg、约30mg、约50mg,约80mg、约100mg、约150mg、约250mg、约300mg和约500mg本公开的化合物(或其实施例或方面)与填充剂(例如,乳糖,诸如约90
‑
30mg无水乳糖)、崩解剂(例如,交联羧甲基纤维素,诸如约5
‑
40mg交联羧甲基纤维素钠)、聚合物(例如,聚乙烯吡咯烷酮(pvp)、纤维素(例如,羟丙基甲基纤维素(hpmc))和/或共聚维酮,诸如约5
‑
30mg pvp、hpmc或共聚维酮)和润滑剂(例如,硬脂酸镁,诸如约1
‑
10mg)复配的片剂。可以使用湿法制粒、干法制粒或干法共混。在一个湿法制粒方面,首先将粉状成分混合在一起,并且然后与聚合物(例如,pvp)的溶液或悬浮液混合。所得组合物可使用传统设备干燥、制粒、与润滑剂混合并压制成片剂形式。可以通过将本公开的化合物(例如5
‑
400mg)溶解在合适的缓冲溶液(例如,磷酸盐缓冲液)中,如果需要的话添加增渗剂(例如,诸如氯化钠的盐)来制备气雾剂制剂的实例。可以例如使用0.2微米的过滤器过滤溶液,以去除杂质和污染物。
[0204]
对于眼睛或其他外部组织(例如口腔和皮肤)的治疗,该制剂优选以局部软膏剂或乳膏剂的形式施用,其含有例如0.075%w/w至20%w/w含量的本公开的化合物。当配制成软膏剂时,本公开的化合物可以与石蜡或与水混溶的软膏剂基质一起使用。另选地,可以将本公开的化合物与水包油乳膏基质一起配制成乳膏剂。如果需要,乳膏基质的水相可包括多元醇,即具有两个或更多个羟基基团的醇,诸如丙二醇、1,3
‑
丁二醇、甘露醇、山梨糖醇、甘油和聚乙二醇(包括peg 400)及其混合物。局部制剂可以期望地包括增强本公开的化合物通过皮肤或其他受影响区域的吸收或渗透的化合物。此类皮肤渗透增强剂的实例包括二甲基亚砜和相关类似物。
[0205]
对于局部制剂,期望将有效量的根据本公开的药物组合物施用于与要治疗的周围神经元相邻的目标区域,例如皮肤表面、粘膜等。根据要治疗的区域,用途是诊断性的、预防性的还是治疗性的,症状的严重程度以及所用局部用载体的性质,该量通常为每次应用约0.0001mg至约1g本公开的化合物(或其实施例或方面)。优选的局部制剂是软膏剂,其中每
立方厘米软膏基质使用约0.001mg至约50mg本公开的化合物。药物组合物可以配制成透皮组合物或透皮递送装置(“贴剂”)。这样的组合物包括例如背衬、本公开的化合物储库、控制膜、衬里和接触粘合剂。此类透皮贴剂可用于提供所需的本公开的化合物的连续脉冲或按需递送。
[0206]
制剂可以包装在单位剂量或多剂量容器中,例如密封的安瓿瓶和小瓶中,并且可以在冷冻干燥(冻干)条件下储存,仅需要在使用前添加无菌液体载体,例如水,以用于注射。临时注射液和悬浮液由前述类型的无菌粉末、颗粒和片剂制备。优选的单位剂量制剂是那些含有如本文上文所述的本公开的化合物的每日剂量或单位每日亚剂量,或其适当分量的制剂。
[0207]
当结合靶位于脑中时,本公开的某些方面提供本公开的化合物(或其实施例或方面)以穿过血脑屏障。某些神经退行性疾病与血脑屏障的渗透性增加有关,使得本公开的化合物(或其实施例或方面)可以容易地引入脑中。当血脑屏障保持完整时,存在几种本领域已知的用于跨该血脑屏障与运输分子的方法,包括但不限于物理方法、基于脂质的方法以及基于受体和通道的方法。
[0208]
跨血脑屏障运输本公开的化合物(或其实施例或方面)的物理方法包括但不限于完全规避血脑屏障,或通过在血脑屏障中形成开口。
[0209]
规避方法包括但不限于直接注射入大脑(参见,例如,papanastassiou等人,gene therapy 9:398
‑
406,2002),间质输注/对流增强递送(参见,例如,bobo等人,proc.natl.acad.sci.u.s.a.91:2076
‑
2080,1994),以及将递送装置植入脑中(参见,例如,gill等人,nature med.9:589
‑
595,2003;以及gliadel wafers
tm
,guildford pharmaceutical)。
[0210]
在屏障中形成开口的方法包括但不限于超声波(参见,例如,美国专利公开号2002/0038086),渗透压(例如,通过高渗甘露醇施用(neuwelt,e.a.,implication of the blood
‑
brain barrier and its manipulation,第1卷和第2卷,plenum press,n.y.,1989)),以及通过例如缓激肽或透化剂a
‑
7进行透化(参见,例如,美国专利号5,112,596、5,268,164、5,506,206和5,686,416)。
[0211]
跨血脑屏障输送本公开的式的化合物(或其实施例或方面)的基于脂质的方法包括但不限于将本公开的化合物(或其实施例或方面)包囊在脂质体中,所述脂质体与结合至血脑屏障的血管内皮上受体的抗体结合片段偶联(参见,例如,美国专利申请公开号2002/0025313),以及在低密度脂蛋白颗粒中涂覆本公开的化合物(或其实施例或方面)(参见,例如,美国专利申请公开号2004/0204354)或载脂蛋白e(参见,例如,美国专利申请公开号2004/0131692)。
[0212]
跨血脑屏障输送本公开的化合物(或其实施例或方面)的基于受体和通道的方法包括但不限于使用糖皮质激素阻断剂增加血脑屏障的渗透性(参见,例如,美国专利申请公开号2002/0065259、2003/0162695和2005/0124533);激活钾通道(参见,例如,美国专利申请公开号2005/0089473),抑制abc药物转运蛋白(参见,例如,美国专利申请公开号2003/0073713);用运铁蛋白包被本公开的化合物(或其实施例或方面)并调节一种或多种运铁蛋白受体的活性(参见,例如,美国专利申请公开号2003/0129186),以及阳离子化抗体(参见,例如,美国专利号5,004,697)。
[0213]
对于脑内使用,在某些方面,化合物可以通过输注到cns的储库中而连续施用,尽管推注可以接受。可以将抑制剂施用至脑室或以其他方式引入cns或脊髓液中。可以通过使用留置导管和诸如泵的连续施用方式来进行施用,或者可以通过植入例如缓释载体的脑内植入来施用。更具体地,可以通过长期植入的插管注射抑制剂,或者在渗透微型泵的帮助下长期输注抑制剂。可获得通过小管将蛋白质输送到脑室的皮下泵。可以通过皮肤重新填充高度复杂的泵,并且无需外科干预即可设置其递送速率。涉及皮下泵装置或通过完全植入的药物递送系统进行连续脑室内输注的合适施用方案和施用系统的实例是用于向阿尔茨海默氏病患者和帕金森氏病动物模型施用多巴胺、多巴胺激动剂和胆碱能激动剂的给药方案和给药系统,如harbaugh,j.neural transm.suppl.24:271,1987;以及deyebenes等人,mov.disord.2:143,1987所述。
[0214]
适应症和治疗方法
[0215]
本公开的代表性化合物已经显示以调节tead活性。因此,本公开的化合物(或其实施例或方面)可用作治疗由tead活性介导的疾病和病症的药物疗法。此类疾病和病症包括但不限于癌症,其包括听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤。
[0216]
在特定实施例中,本公开的化合物(或其实施例或方面)可作为药物疗法用于治疗增殖性疾患,其包括听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝
细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤。
[0217]
在一个特定实施例中,本公开的化合物(或其实施例或方面)可作为药物疗法用于治疗听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤。
[0218]
在另一方面,本公开提供了一种用于治疗听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性
骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤的方法,其包括向有此需要的受试者施用治疗有效量的根据如本文别处所述的式(i)或式(ii)化合物(或其实施例或方面)。
[0219]
在另一方面,本公开提供用于调节tead活性的如本文别处所述的式(i)或式(ii)化合物(或其实施例或方面)。在一些实施例中,本公开提供用于调节tead活性的式(i)或式(ii)化合物的药学上可接受的盐。
[0220]
在另一方面,本公开提供用于药物疗法的如本文别处所述的式(i)或式(ii)化合物,或其实施例或方面(诸如其药学上可接受的盐)。
[0221]
在另一方面,本公开提供一种用于治疗或预防听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤的方法,其包括向有此需要的受试者施用治疗有效量的根据如本文别处所述的式(i)或式(ii)化合物(或其实施例或方面)。
[0222]
在另一方面,本公开提供了如本文别处所述的式(i)或式(ii)化合物,或其实施例或方面(诸如其药学上可接受的盐)用于治疗或预防听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤
因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤。
[0223]
在另一方面,本公开提供了如本文别处所述的式(i)或式(ii)化合物,或其实施例或方面(诸如其药学上可接受的盐)在制备用于治疗或预防听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤的药物中的用途。
[0224]
在另一方面,本公开提供了一种用于治疗哺乳动物(例如,人类)的听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、
淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤的方法,其包括向哺乳动物施用如本文别处所述的式(i)或式(ii)化合物,或其实施例或方面(诸如其药学上可接受的盐)。
[0225]
在另一方面,本公开提供一种用于调节tead活性的方法,其包括使tead与如本文别处所述的式(i)或式(ii)化合物,或其实施例或方面(诸如其药学上可接受的盐)接触。
[0226]
在另一方面,本公开提供一种用于治疗或预防由tead介导的疾病或病症的如本文别处所述的式(i)或式(ii)化合物,或其实施例或方面(诸如其药学上可接受的盐)。在该实施例的各个方面中,该疾病或病症是听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤。
[0227]
在另一方面,本公开提供如本文别处所述的式(i)或式(ii)化合物,或其实施例或方面(诸如其药学上可接受的盐)在制备用于治疗或预防由tead活性介导的疾病或病症的药物中的用途。在该实施例的各个方面中,该疾病或病症是听力神经瘤、急性白血病、急性淋巴细胞性白血病、急性骨髓性白血病(单核细胞性、粒细胞性、腺癌、血管肉瘤、星形细胞瘤、髓单核细胞和早幼粒细胞性)、急性t细胞白血病、基底细胞癌、胆管癌、膀胱癌、脑癌、乳腺癌、支气管癌、宫颈癌、软骨肉瘤、脊索瘤、绒毛膜癌、慢性白血病、慢性淋巴细胞性白血病、慢性骨髓细胞性(粒细胞性)白血病、慢性粒细胞性白血病、结肠癌、结直肠癌、颅咽管瘤、囊腺癌、弥漫性大b细胞淋巴瘤、不良增殖变化(发育异常和化生)、胚胎性癌、子宫内膜癌、内皮肉瘤、室管膜瘤、上皮癌、红白血病、食道癌、雌激素受体阳性乳腺癌、原发性血小板
增多症、尤因氏肿瘤、纤维肉瘤、滤泡性淋巴瘤、生殖细胞睾丸癌、胶质瘤、成胶质细胞瘤、胶质肉瘤、重链疾病、血管母细胞瘤、肝癌、肝细胞癌、激素不敏感性前列腺癌、平滑肌肉肉瘤、白血病、脂肪肉瘤、肺癌、淋巴管内皮肉瘤、淋巴管肉瘤、淋巴母细胞白血病、淋巴瘤(霍奇金氏和非霍奇金氏病)、膀胱、结肠、肺、卵巢、胰腺、前列腺、皮肤和子宫的恶性肿瘤和过度增殖性疾病、t细胞或b细胞起源的淋巴样恶性肿瘤、髓样癌、髓母细胞瘤、黑素瘤、脑膜瘤、间皮瘤、多发性骨髓瘤、骨髓性白血病、骨髓瘤、粘液肉瘤、神经母细胞瘤、nut中线癌(nmc)、非小细胞肺癌、少突胶质细胞瘤、口腔癌、成骨肉瘤、卵巢癌、胰腺癌、乳头状腺癌、乳头状癌、松果体瘤、真性红细胞增多症、前列腺癌、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮脂腺癌、精原细胞瘤、皮肤癌、小细胞肺癌,实体瘤(癌和肉瘤)、小细胞肺癌、胃癌、鳞状细胞癌、滑膜瘤、汗腺癌、甲状腺癌、巨球蛋白血症、睾丸肿瘤、子宫癌和威尔姆斯瘤。
[0228]
在一方面,本公开的化合物与其他类似物相比显示出更高的效力。表4中示出了与本发明范围相当的此类代表性化合物。
[0229]
组合疗法
[0230]
式(i)或式(ii)化合物或其盐可以单独使用或与其他药剂组合使用以用于治疗。例如,药物组合制剂或给药方案的第二药剂可以具有与式(i)或式(ii)化合物互补的活性,使得它们不会彼此产生不良影响。化合物可以在单一药物组合物中一起施用或分开施用。在一个实施例中,化合物或药学上可接受的盐可以与细胞毒性剂共同施用以治疗增殖性疾病和癌症。
[0231]
术语“共同施用”是指式(i)或式(ii)化合物或其盐与其他一种或多种活性药物成分(包括细胞毒性剂和放射治疗)的同时施用或以任何方式分别依次施用。如果施用不是同时进行的,则化合物应在彼此接近的时间内施用。此外,化合物是否以相同的剂型施用是无关紧要的,例如一种化合物可以局部施用,而另一种化合物可以口服施用。
[0232]
那些其他试剂可以与含有本发明的化合物的组合物分开施用,作为多剂量方案的一部分。替代地,那些药剂可以是单一剂型的一部分,与本发明化合物一起在单一组合物中混合。如果作为多剂量方案的一部分施用,则两种活性剂可以同时、依次或彼此间隔一段时间(通常彼此间隔五小时之内)施用。
[0233]
如本文所用,术语“组合”,“组合的”和相关术语是指根据本发明的治疗剂的同时或依次施用。例如,本发明的化合物可以与另一种治疗剂同时或依次以分开的单位剂型或以单一单位剂型一起施用。因此,本发明提供了一种包含式i或式ii化合物、其他治疗剂和药学上可接受的载体、佐剂或媒介物的单一单位剂型。
[0234]
可以与载体材料组合以产生单一剂型的本发明的化合物和其他治疗剂(在包含如上所述的其他治疗剂的那些组合物中)的量将根据所治疗的宿主和特定施用方式而变化。在某些实施例中,配制本发明的组合物,使得可以施用0.01
‑
100mg/kg体重/天本发明的剂量。
[0235]
通常,可以共同施用对被治疗的疾病或病症具有活性的任何药剂。此类药剂的实例可以在v.t.devita和s.hellman(编辑)的cancer principles and practice of oncology,第六版(2001年2月15日),lippincott williams&wilkins出版商中找到。基于所涉及的药物和疾病的特定特征,本领域普通技术人员将能够辨别哪种药剂组合将是有用的。
[0236]
在一个实施例中,治疗方法包括式(i)或式(ii)化合物或其药学上可接受的盐与至少一种细胞毒性剂的共同施用。如本文所用,术语“细胞毒性剂”是指抑制或阻止细胞功能和/或引起细胞死亡或破坏的物质。细胞毒性剂包括但不限于放射性同位素(例如,at
211
、i
131
、i
125
、y
90
、re
186
、re
188
、sm
153
、bi
212
、p
32
、pb
212
和lu的放射性同位素);化疗剂;生长抑制剂;酶及其片段,诸如溶核酶;以及毒素,诸如细菌、真菌、植物或动物来源的小分子毒素或酶活性毒素,包括其片段和/或变体。
[0237]
示例性细胞毒性剂可以选自抗微管剂、铂配位络合物、烷基化剂、抗生素剂、拓扑异构酶ii抑制剂、抗代谢物、拓扑异构酶i抑制剂、激素和激素类似物、信号转导通路抑制剂、非受体酪氨酸激酶血管生成抑制剂、免疫治疗剂、促凋亡剂、ldh
‑
a抑制剂;脂肪酸生物合成抑制剂;细胞周期信号传导抑制剂;hdac抑制剂、蛋白酶体抑制剂;和癌症代谢抑制剂。
[0238]“化疗剂”包括可用于治疗癌症的化学化合物。化疗剂的实例包括厄洛替尼(genentech/osi pharm.)、硼替佐米(millennium pharm.)、双硫仑、表没食子儿茶素没食子酸酯、盐孢子酰胺a、卡非佐米、17
‑
aag(格尔德霉素)、根赤壳菌素、乳酸脱氢酶a(ldh
‑
a)、氟维司群(阿斯利康(astrazeneca))、舒尼替布(辉瑞(pfizer)/sugen)、来曲唑(诺华(novartis))、甲磺酸伊马替尼(诺华)、非那沙酯(诺华)、奥沙利铂(赛诺菲(sanofi))、5
‑
fu(5
‑
氟尿嘧啶)、亚叶酸、雷帕霉素(西罗莫司,惠氏(wyeth))、拉帕替尼(gsk572016,葛兰素史克(glaxo smith kline))、罗纳法米(lonafamib)(sch 66336)、索拉非尼(拜耳实验室(bayer labs))、吉非替尼(阿斯利康)、ag1478;烷基化剂诸如噻替派和环磷酰胺;烷基磺酸盐,诸如白消安、英丙舒凡和哌泊舒凡;氮杂环丙烷类,诸如苯佐替派(benzodopa)、卡波醌、美妥替哌(meturedopa)和乌瑞替哌(uredopa);乙亚胺类和甲基蜜胺类,包括六甲蜜胺、三亚乙基蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲基蜜胺;番荔枝内酯类(尤其是布拉他辛(bullatacin)和布拉他辛酮(bullatacinone));喜树碱(包括拓扑替康和伊立替康);苔藓抑素;卡利他汀(callystatin);cc
‑
1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);念珠藻素(cryptophycin)(特别是念珠藻素1和念珠藻素8);肾上腺皮质类固醇(包括泼尼松和泼尼松龙);醋酸环丙孕酮;5α
‑
还原酶(包括非那雄胺和度他雄胺);伏立诺他、罗米地辛、泛比司他、丙戊酸、莫西司他(mocetinostat)、多拉他汀(dolastatin);阿地白介素、滑石、杜卡霉素(包括合成类似kw
‑
2189和cb1
‑
tm1);五加苷素(eleutherobin);水鬼蕉碱;匍枝珊瑚醇(sarcodictyin);海绵抑素;氮芥类,诸如苯丁酸氮芥、氯苯哌嗪、氯磷酰胺、雌莫司汀、异环磷酰胺、甲氮芥、盐酸甲氧氮芥、美法仑、新氮芥(novembichin)、苯芥胆甾醇、泼尼氮芥、曲洛磷胺(trofosfamide)、乌拉莫司汀(uracil mustard);亚硝基脲,诸如卡莫司汀、氯脲霉素、福莫司汀、洛莫斯汀、尼莫斯汀和拉尼莫斯汀;抗生素,诸如烯二炔抗生素(例如加利车霉素(calicheamicin),尤其是加利车霉素γ1i和加利车霉素ω1i(angew chem.intl.ed.engl.1994 33:183
‑
186);达内霉素
(dynemicin),包括达内霉素a;双膦酸盐,诸如氯膦酸盐;艾司米星;以及新抑癌菌素(neocarzinostatin)发色团和相关的发色蛋白烯二炔类抗生素发色团;阿克拉霉素(aclacinomysin)、放线菌素(actinomycin)、氨茴霉素(authramycin)、偶氮丝氨酸(azaserine)、博来霉素、放线菌素(cactinomycin)、卡柔比星(carabicin)、洋红霉素(caminomycin)、嗜癌素(carzinophilin)、色霉素(chromomycinis)、更生霉素、道诺霉素、地托比星(detorubicin)、6
‑
叠氮
‑5‑
氧代
‑
l
‑
正亮氨酸、(阿霉素)、吗啉代
‑
阿霉素、氰基吗啉代
‑
阿霉素、2
‑
吡咯啉合
‑
阿霉素和脱氧阿霉素、表柔比星、伊索比星、伊达比星、马塞罗霉素(marcellomycin);丝裂霉素,诸如丝裂霉素c、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、甲基丝裂霉素、嘌呤霉素、三铁阿霉素(quelamycin)、罗多比星(rodorubicin)、链黑菌素、链脲佐菌素、杀结核菌素、乌苯美司、净司他汀、佐柔比星;抗代谢物,诸如甲氨蝶呤和5
‑
氟尿嘧啶(5
‑
fu);叶酸类似物,诸如二甲叶酸(denopterin)、甲氨蝶呤、喋罗呤(pteropterin)、三甲蝶呤;嘌呤类似物,诸如氟达拉滨、6
‑
巯基嘌呤、硫咪嘌呤(thiamiprine)、硫鸟嘌呤;嘧啶类似物,诸如安西他滨、阿扎胞苷、6
‑‑
氮杂尿苷、卡莫氟、阿糖胞苷、双脱氧尿苷、多西氟啶、依诺他宾、氟尿苷;雄激素,诸如卡普睾酮、丙酸屈他雄酮、环硫雄醇、美雄烷、睾内酯;抗肾上腺素类药物,诸如氨鲁米特、米托坦、曲洛斯坦;叶酸补充剂,诸如亚叶酸;醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶;安吖啶;倍曲布西(bestrabucil);比生群;依达曲沙(edatraxate);地磷酰胺(defofamine);秋水仙胺;亚胺醌;依洛尼塞(elfomithine);依利醋铵;埃博霉素;乙环氧啶;硝酸镓;羟基脲;香菇多糖;氯尼达明(lonidainine);美登木素生物碱,诸如美登素和安丝菌素;米托胍腙;米托蒽醌;莫哌达醇(mopidamnol);二胺硝吖啶(nitraerine);喷司他丁;蛋氨氮芥(phenamet);吡柔比星;洛索蒽醌(losoxantrone);鬼臼酸;2
‑
乙基肼;甲基苄肼;多糖复合物(美国俄勒冈州尤金市的jhs天然产物公司(jhs natural products,eugene,oreg.));雷佐生;根霉素(rhizoxin);裂裥菌素(sizofuran);锗螺胺;细交链孢菌酮酸;三亚胺醌;2,2',2
”‑
三氯三乙胺;单端孢霉烯族毒素(尤其是t
‑
2毒素、维拉库林a(verracurin a)、漆斑菌素a和蛇形菌素(anguidine));尿烷;长春地辛;达卡巴嗪;甘露醇氮芥;二溴甘露醇;二溴卫矛醇;哌泊溴烷;加西托星(gacytosine);阿拉伯糖苷(“ara
‑
c”);环磷酰胺;噻替派;紫杉烷类,例如taxol(紫杉醇;新泽西州普林斯顿的百时美施贵宝癌症专科(bristol
‑
myers squibb oncology,princeton,n.j.))、(不含氢化蓖麻油(cremophor))、紫杉醇的白蛋白工程化纳米颗粒制剂(伊利诺伊州邵伯克的美国制药伙伴公司(american pharmaceutical partners,schaumberg,ill.))和(多西紫杉醇、多西他赛;赛诺菲
‑
安万特(sanofi
‑
aventis));苯丁酸氮芥;(吉西他滨);6
‑
硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂类似物,诸如顺铂和卡铂;长春碱;依托泊苷(vp
‑
16);异环磷酰胺;米托蒽醌;长春新碱;(长春瑞滨);诺万隆(novantrone);替尼泊苷;依达曲塞;道诺霉素;氨基蝶呤;卡培他滨伊班膦酸盐;cpt
‑
11;拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dmfo);维甲酸类,诸如视黄酸;以及以上任一项的药学上可接受的盐、酸和衍生物。
[0239]
化疗剂还包括(i)起到调节或抑制激素作用于肿瘤作用的抗激素剂,诸如抗雌激
素剂和选择性雌激素受体调节剂(serm),包括例如他莫昔芬(包括枸橼酸他莫昔芬)、雷洛昔芬、屈洛昔芬、碘氧芬(iodoxyfene)、4
‑
羟基他莫昔芬、曲沃昔芬、雷洛昔芬(keoxifene)、ly117018、奥那司酮和(枸橼酸托瑞米芬);(ii)抑制酶芳香化酶的芳香化酶抑制剂,其可调节肾上腺的雌激素产生,例如4(5)
‑
咪唑类、氨基戊二酰亚胺、(醋酸甲地孕酮)、(依西美坦;辉瑞)、福美他尼(formestanie)、法曲唑、(伏罗唑)、(来曲唑;诺华)和(阿那曲唑;阿斯利康);(iii)抗雄激素类,诸如氟他米特、尼鲁米特、比卡鲁胺、亮丙瑞林和戈舍瑞林;布舍瑞林、曲普瑞林、醋酸甲羟孕酮、己烯雌酚、倍美力、氟甲睾酮、所有反式维甲酸、芬维a胺以及曲沙他滨(1,3
‑
二氧戊环核苷胞嘧啶类似物);(iv)蛋白激酶抑制剂;(v)脂质激酶抑制剂;(vi)反义寡核苷酸,特别是那些抑制受异常细胞增殖牵连的信号传导通路中的基因表达的寡核苷酸,诸如,例如pkc
‑
α、ralf和h
‑
ras;(vii)核酶,诸如vegf表达抑制剂(例如,)和her2表达抑制剂;(viii)疫苗,诸如基因疗法疫苗,例如和ril
‑
2;拓扑异构酶1抑制剂,诸如rmrh;和(ix)以上任一项的药学上可接受的盐、酸和衍生物。
[0240]
化疗剂还包括抗体,诸如阿仑单抗(campath)、贝伐单抗(genentech);西妥昔单抗(imclone);帕尼单抗(amgen)、利妥昔单抗(rituximab)(genentech/biogen idec)、帕妥珠单抗(2c4,genentech)、曲妥珠单抗(trastuzumab)(genentech)、托西莫单抗(tositumomab)(bexxar,corixia)和抗体药缀合物、吉妥珠单抗奥佐米星(wyeth)。与本发明的化合物组合的具有治疗潜力的其他人源化单克隆抗体包括:阿泊珠单抗(apolizumab)、阿塞珠单抗、阿利珠单抗、巴比妥珠单抗、莫比伐珠单抗(bivatuzumab mertansine)、莫坎妥珠单抗(cantuzumab mertansine)、西利珠单抗(cedelizumab)、塞妥珠单抗(certolizumab pegol)、西孚昔珠单抗(cidfusituzumab)、西土珠单抗(cidtuzumab)、达利珠单抗、依库珠单抗(eculizumab)、依法珠单抗(efalizumab)、依帕珠单抗(epratuzumab)、厄利珠单抗(erlizumab)、泛维珠单抗(felvizumab)、芳妥珠单抗(fontolizumab)、吉妥珠单抗奥唑米星、奥英妥珠单抗(inotuzumab ozogamicin)、伊匹单抗、拉贝珠单抗(labetuzumab)、林妥珠单抗、马妥珠单抗、美泊利单抗、莫维珠单抗、莫妥维珠单抗(motovizumab)、那他珠单抗、尼妥珠单抗、诺罗维珠单抗(nolovizumab)、奴马维珠单抗(numavizumab)、奥瑞珠单抗(ocrelizumab)、奥玛珠单抗、帕丽珠单抗、帕考珠单抗(pascolizumab)、培孚昔单抗(pecfusituzumab)、培土珠单抗(pectuzumab)、培克珠单抗(pexelizumab)、拉利维珠单抗(ralivizumab)、兰尼单抗、瑞丽维珠单抗(reslivizumab)、瑞利珠单抗(reslizumab)、瑞希维珠单抗(resyvizumab)、罗维珠单抗(rovelizumab)、卢丽珠单抗(ruplizumab)、西罗珠单抗、西利珠单抗、松妥珠单抗(sontuzumab)、替珠单抗(tacatuzumab tetraxetan)、他度珠单抗(tadocizumab)、他利
珠单抗、替非珠单抗(tefibazumab)、托珠单抗、托利珠单抗(toralizumab)、西莫白介素单抗(tucotuzumab celmoleukin)、土库昔珠单抗(tucusituzumab)、乌马维珠单抗(umavizumab)、乌珠单抗、尤特克单抗(ustekinumab)、维西珠单抗和抗白介素
‑
12(abt
‑
874/j695,惠氏研究和雅培实验室)(抗白介素
‑
12是一种重组的人特有序列全长igg1λ抗体,经基因修饰以识别白介素
‑
12p40蛋白)。
[0241]
化疗剂还包括“egfr抑制剂”,是指与egfr结合或直接相互作用并且阻止或降低其信号传导活性的化合物,并且替代地称为“egfr拮抗剂”。此类试剂的实例包括与egfr结合的抗体和小分子。与egfr结合的抗体的实例包括mab 579(atcc crl hb 8506)、mab 455(atcc crl hb8507)、mab 225(atcc crl 8508)、mab 528(atcc crl 8509)(参见,美国专利号4,943,533,mendelsohn等人)及其变体,诸如嵌合的225(c225或西妥昔单抗;)和重塑的人225(h225)(参见,wo 96/40210,imclone systems inc.);imc
‑
11f8,一种靶向egfr的完全人抗体(imclone);结合ii型突变egfr的抗体(美国专利号5,212,290);如美国专利号5,891,996中所述结合egfr的人源化和嵌合抗体;以及结合egfr的人抗体,诸如abx
‑
egf或帕尼单抗(参见wo98/50433,安尼克斯(abgenix)/amgen);emd 55900(stragliotto等人eur.j.cancer 32a:636
‑
640(1996));emd7200(马妥珠单抗),一种针对egfr的人源化egfr抗体,与egf和tgf
‑
α竞争而与egfr结合(emd/默克公司(merck));人egfr抗体,humax
‑
egfr(genmab);完全人抗体,称为e1.1、e2.4、e2.5、e6.2、e6.4、e2.11、e6.3和e7.6.3,并在us 6,235,883中进行了描述;mdx
‑
447(梅达雷克斯公司(medarex inc));以及mab 806或人源化mab 806(johns等人,j.biol.chem.279(29):30375
‑
30384(2004))。可以将抗egfr抗体与细胞毒性剂缀合,从而产生免疫缀合物(参见,例如,ep659,439a2,默克专利公司(merck patent gmbh))。egfr拮抗剂包括小分子,诸如美国专利号5,616,582、5,457,105、5,475,001、5,654,307、5,679,683、6,084,095、6,265,410、6,455,534、6,521,620、6,596,726、6,713,484、5,770,599、6,140,332、5,866,572、6,399,602、6,344,459、6,602,863、6,391,874、6,344,455、5,760,041、6,002,008和5,747,498,以及以下pct出版物:wo98/14451、wo98/50038、wo99/09016和wo99/24037中所述的化合物。特定的小分子egfr拮抗剂包括osi
‑
774(cp
‑
358774,厄洛替尼,genentech/osi pharmaceuticals);pd 183805(ci 1033,2
‑
丙烯酰胺,n
‑
[4
‑
[(3
‑
氯
‑4‑
氟苯基)氨基]
‑7‑
[3
‑
(4
‑
吗啉基)丙氧基]
‑6‑
喹唑啉基]
‑
,二盐酸盐,辉瑞公司);zd1839,吉非替尼4
‑
(3'
‑
氯
‑
4'
‑
氟苯胺基)
‑7‑
甲氧基
‑6‑
(3
‑
吗啉代丙氧基)喹唑啉,阿斯利康);zm 105180((6
‑
氨基
‑4‑
(3
‑
甲基苯基
‑
氨基)
‑
喹唑啉,捷利康公司(zeneca));bibx
‑
1382(n8
‑
(3
‑
氯
‑4‑
氟
‑
苯基)
‑
n2
‑
(1
‑
甲基
‑
哌啶
‑4‑
基)
‑
嘧啶并[5,4
‑
d]嘧啶
‑
2,8
‑
二胺,勃林格殷格翰(boehringer ingelheim));pki
‑
166((r)
‑4‑
[4
‑
[(1
‑
苯乙基)氨基]
‑
1h
‑
吡咯并[2,3
‑
d]嘧啶
‑6‑
基]
‑
苯酚);(r)
‑6‑
(4
‑
羟苯基)
‑4‑
[(1
‑
苯乙基)氨基]
‑
7h
‑
吡咯并[2,3
‑
d]嘧啶);cl
‑
387785(n
‑
[4
‑
[(3
‑
溴苯基)氨基]
‑6‑
喹唑啉基]
‑2‑
丁炔酰胺);ekb
‑
569(n
‑
[4
‑
[(3
‑
氯
‑4‑
氟苯基)氨基]
‑3‑
氰基
‑7‑
乙氧基
‑6‑
喹啉基]
‑4‑
(二甲基氨基)
‑2‑
丁烯酰胺)(惠氏);ag1478(辉瑞);ag1571(su 5271;辉瑞);双重egfr/her2酪氨酸激酶抑制剂,诸如拉帕替尼(gsk572016或n
‑
[3
‑
氯
‑4‑
[(3氟苯基)甲氧基]苯基]
‑
6[5[[[(2甲基磺酰基)乙基]氨基]甲基]
‑2‑
呋喃基]
‑4‑
喹唑啉胺)。
[0242]
化疗剂还包括“酪氨酸激酶抑制剂”,包括上段所述的egfr靶向药物;小分子her2酪氨酸激酶抑制剂,诸如可从武田制药公司(takeda)获得的tak165;cp
‑
724,714,一种erbb2受体酪氨酸激酶的口服选择性抑制剂(辉瑞和osi);双重her抑制剂,诸如ekb
‑
569(可从惠氏获得),其可优先结合egfr但同时抑制过表达her2和egfr的细胞;拉帕替尼(gsk572016;可从葛兰素史克公司获得),一种口服her2和egfr酪氨酸激酶抑制剂;pki
‑
166(可从诺华公司获得);泛her抑制剂,诸如卡那替尼(ci
‑
1033;法玛西亚公司(pharmacia));raf
‑
1抑制剂,诸如可从isis制药公司获得的抑制raf
‑
1信号传导的反义剂isis
‑
5132;非her靶向的tk抑制剂,诸如甲磺酸伊马替尼(可从葛兰素史克公司获得);多靶向酪氨酸激酶抑制剂,诸如舒尼替尼(可从辉瑞获得);vegf受体酪氨酸激酶抑制剂,诸如瓦他拉尼(ptk787/zk222584,可从诺华/先灵公司(schering ag)获得);mapk细胞外调节的激酶i抑制剂ci
‑
1040(可从法玛西亚公司获得);喹唑啉类,诸如pd 153035,4
‑
(3
‑
氯苯胺基)喹唑啉;吡啶并嘧啶类;嘧啶并嘧啶类;吡咯并嘧啶类,诸如cgp 59326、cgp 60261和cgp 62706;吡唑并嘧啶类,4
‑
(苯氨基)
‑
7h
‑
吡咯并[2,3
‑
d]嘧啶;姜黄素(二氟甲酰甲烷,4,5
‑
双(4
‑
氟苯胺基)邻苯二甲酰亚胺);含有硝基噻吩部分的酪氨酸酪氨酸;pd
‑
0183805(华纳
‑
兰伯特公司(warner
‑
lamber));反义分子(例如与her编码核酸结合的分子);喹噁啉类(美国专利号5,804,396);酪氨酸磷酸化抑制剂(美国专利号5,804,396);zd6474(阿斯利康);ptk
‑
787(诺华/先灵公司);泛her抑制剂,诸如ci
‑
1033(辉瑞);affinitac(isis 3521;isis/礼来制药公司(lilly));甲磺酸伊马替尼pki 166(诺华公司);gw2016(葛兰素史克公司);ci
‑
1033(辉瑞);ekb
‑
569(惠氏);塞马替尼(辉瑞);zd6474(阿斯利康);ptk
‑
787(诺华/先灵公司);inc
‑
1c11(imclone),雷帕霉素(西罗莫司,);或以下任何专利出版物中所述:美国专利号5,804,396、wo 1999/09016(american cyanamid)、wo 1998/43960(american cyanamid)、wo 1997/38983(warner lambert)、wo 1999/06378(warner lambert)、wo 1999/06396(warner lambert)、wo 1996/30347(pfizer,inc)、wo 1996/33978(zeneca)、wo 1996/3397(zeneca)和wo 1996/33980(zeneca)。
[0243]
化疗剂还包括地塞米松、干扰素、秋水仙碱、氯苯氨啶(metoprine)、环孢菌素、两性霉素、甲硝唑、阿仑单抗(alemtuzumab)、阿利维甲酸(alitretinoin)、别嘌醇(allopurinol)、氨磷汀(amifostine)、三氧化二砷、天冬酰胺酶、活bcg、贝伐珠单抗、贝沙罗汀(bexarotene)、克拉屈滨(cladribine)、克罗拉滨(clofarabine)、达依泊汀α(darbepoetin alfa)、地尼白介素(denileukin)、右雷佐生(dexrazoxane)、依泊汀α(epoetin alfa)、厄洛替尼(elotinib)、非格司亭(filgrastim)、醋酸组氨瑞林(histrelin acetate)、替伊莫单抗(ibritumomab)、干扰素α
‑
2a、干扰素α
‑
2b、来那度胺(lenalidomide)、左旋咪唑、美司钠(mesna)、甲氧沙林、诺龙(nandrolone)、奈拉滨(nelarabine)、诺非妥莫单抗(nofetumomab)、奥普瑞白介素(oprelvekin)、帕利夫明(palifermin)、帕米膦酸钠(pamidronate)、培加酶(pegademase)、培门冬酶(pegaspargase)、培非格司亭(pegfilgrastim)、培美曲塞二钠(pemetrexed disodium)、光辉霉素(plicamycin)、卟吩姆钠(porfimer sodium)、奎纳克林(quinacrine)、拉布立酶(rasburicase)、沙格司亭(sargramostim)、替莫唑胺(temozolomide)、vm
‑
26、6
‑
tg、托瑞米
芬(toremifene)、维甲酸(tretinoin)、atra、戊柔比星(valrubicin)、唑来膦酸盐(zoledronate)和唑来膦酸(zoledronic acid)及其药学上可接受的盐。
[0244]
化疗剂还包括氢化可的松、醋酸氢化可的松、醋酸可的松、特戊酸硫氢可的松、曲安奈德、曲安奈德醇、莫米松、安西奈德、布地奈德、地奈德、醋酸氟氢松、肤轻松、倍他米松、磷酸倍他米松钠、地塞米松、磷酸地塞米松钠、氟可龙、氢化可的松
‑
17
‑
丁酸酯、氢化可的松
‑
17
‑
戊酸酯、二丙酸阿氯米松(aclometasone dipropionate)、戊酸倍他米松、二丙酸倍他米松、泼尼卡酯、氯倍他松
‑
17
‑
丁酸酯、氯倍他索
‑
17
‑
丙酸酯、氟可龙己酸酯、氟可龙戊酸酯和醋酸氟泼尼定;免疫选择性抗炎肽(imsaid),诸如苯丙氨酸
‑
谷氨酰胺
‑
甘氨酸(feg)及其d
‑
异构体形式(feg)(伊姆兰生物治疗剂有限公司(imulan biotherapeutics,llc));抗风湿药物,诸如硫唑嘌呤、环孢素(环孢霉素a)、d
‑
青霉胺、金盐、羟氯喹、来氟米特、米诺环素、柳氮磺吡啶;肿瘤坏死因子α(tnfα)阻断剂,诸如依那西普(enbrel)、英夫利昔单抗(remicade)、阿达木单抗(humira)、赛妥珠单抗(cimzia)、戈利木单抗(simponi);白介素1(il
‑
1)阻断剂,诸如阿那白滞素(kineret);t细胞共刺激阻断剂,诸如阿巴西普(orencia);白介素6(il
‑
6)阻断剂,诸如托珠单抗白介素13(il
‑
13)阻断剂,诸如来瑞珠单抗(lebrikizumab);干扰素α(ifn)阻断剂,诸如罗那珠单抗;β7整联蛋白阻断剂,诸如rhumabβ7;ige通路阻断剂,诸如抗m1引物;分泌的同源三聚体lta3和膜结合异源三聚体lta1/β2阻断剂,诸如抗淋巴毒素α(lta);放射性同位素(例如at
211
、i
131
、i
125
、y
90
、re
186
、re
188
、sm
153
、bi
212
、p
32
、pb
212
和lu的放射性同位素);各种各样的试验药剂,诸如硫铂、ps
‑
341、苯基丁酸酯、et
‑
18
‑
och3或法呢基转移酶抑制剂(l
‑
739749,l
‑
744832);多酚类物质,诸如槲皮素、白藜芦醇、苦味酚、表没食子儿茶素没食子酸酯、茶黄素、黄烷醇、原花青素、桦木酸及其衍生物;自噬抑制剂,诸如氯喹;δ
‑9‑
四氢大麻酚(屈大麻酚,);β
‑
拉帕酮;拉帕酚;秋水仙碱;桦木酸;乙酰喜树碱、莨菪亭(scopolectin)和9
‑
氨基喜树碱);鬼臼毒素;替加氟贝沙罗汀双膦酸盐,诸如氯膦酸盐(例如,或)、依替膦酸盐ne
‑
58095、唑来膦酸/唑来膦酸盐阿仑膦酸盐帕米膦酸盐替罗膦酸盐或利塞膦酸盐和表皮生长因子受体(egf
‑
r);疫苗,诸如疫苗;哌立福辛;cox
‑
2抑制剂(例如,塞来昔布或依托昔布);蛋白体抑制剂(例如,ps341);cci
‑
779;替吡法尼(r11577);奥拉非尼,abt510;bcl
‑
2抑制剂,诸如奥利美森钠(oblimersen sodium)匹杉琼(pixantrone);法呢基转移酶抑制剂,诸如洛那法尼(lonafarnib)(sch 6636,sarasar
tm
);以及以上任一项的药学上可接受的盐、酸或衍生物;以及上述两种或多种的组合,诸如chop(环磷酰胺、阿霉素、长春新碱和泼尼松龙的组合疗法的缩写);以及folfox(奥沙利铂(eloxatin
tm
)与5
‑
fu和亚叶酸钙组合治疗方案的缩写)。
[0245]
化疗剂还包括具有镇痛、解热和抗炎作用的非甾体抗炎药。nsaid包括环氧化酶的非选择性抑制剂。nsaid的具体实例包括阿司匹林、丙酸衍生物(诸如布洛芬、非诺洛芬、酮洛芬、氟比洛芬、恶丙嗪(oxaprozin)和萘普生)、乙酸衍生物(诸如吲哚美辛、舒林酸、依托度酸、双氯芬酸)、烯醇酸衍生物(诸如吡罗昔康、美洛昔康、替诺昔康、屈昔康(droxicam)、
氯诺昔康和伊索昔康)、芬那酸(fenamic acid)衍生物(诸如甲芬那酸、甲氯芬那酸、氟芬那酸、托芬那酸)和cox
‑
2抑制剂(诸如塞来昔布、依托考昔(etoricoxib)、鲁美昔布(lumiracoxib)、帕瑞昔布、罗非考昔(rofecoxib)、罗非考昔和戊地昔布(valdecoxib))。nsaid可适用于减轻病症的症状,诸如类风湿性关节炎、骨关节炎、炎性关节炎、强直性脊柱炎、银屑病关节炎、莱特综合征、急性痛风、痛经、转移性骨痛、头痛和偏头痛、术后疼痛、由于炎症和组织损伤、发热、肠梗阻和肾绞痛引起的轻度至中度疼痛。
[0246]
在某些实施例中,化疗剂包括但不限于多柔比星、地塞米松、长春新碱、环磷酰胺、氟尿嘧啶、托泊替康、干扰素、铂衍生物、紫杉烷类(例如,紫杉醇、多西他赛)、长春花生物碱(例如,长春碱)、蒽环类(例如,多柔比星)、鬼臼素(例如,依托泊苷)、顺铂、mtor抑制剂(例如,雷帕霉素)、甲氨蝶呤、放线菌素d、多拉司他汀10、秋水仙碱、三甲曲沙、美托品、环孢霉素、柔红霉素、替尼泊苷、两性霉素、烷化剂(例如,苯丁酸氮芥)、5
‑
氟尿嘧啶、喜树碱(campthothecin)、顺铂、甲硝唑和甲磺酸伊马替尼等。在其他实施例中,本发明的化合物与生物制剂(诸如贝伐珠单抗或帕尼单抗)组合施用。
[0247]
在某些实施例中,将本发明的化合物或其药用组合物与抗增殖剂或化疗剂组合施用,所述化疗剂选自以下项任何的一种或多种:阿巴瑞克、阿地白介素、阿仑单抗、阿利维甲酸、别嘌呤醇、六甲密胺、氨磷汀、阿那曲唑、三氧化二砷、天冬酰胺酶、阿扎胞苷、活bcg、贝伐单抗、氟尿嘧啶、贝沙罗汀、博来霉素、硼替佐单抗、白消安、卡普睾酮、卡培他滨、喜树碱、卡铂、卡莫司汀、西妥昔单抗、苯丁酸氮芥、克拉屈滨、氯法拉滨、环磷酰胺、阿糖胞苷、放线菌素、达依泊汀α、柔红霉素、地尼白介素、右雷佐生、多西紫杉醇、多柔比星(中性)、盐酸多柔比星、丙酸屈膜斯酮、表柔比星、阿法依泊汀、依洛替尼、雌莫司汀、依托泊苷磷酸酯、依托泊苷、依西美坦、非格司亭、氟尿苷、氟达拉滨、氟维司群、吉非替尼、吉西他滨、吉妥珠单抗、醋酸戈舍瑞林、醋酸组氨酸、羟基脲、替伊莫单抗、伊达比星、异环磷酰胺、甲磺酸伊马替尼、干扰素α
‑
2a、干扰素α
‑
2b、伊立替康、来那度胺、来曲唑、亚叶酸、乙酸甲地孕酮、左旋咪唑、洛莫司汀、乙酸孕甾酮、美法仑、巯基嘌呤、6
‑
mp、甲磺酸、甲氨蝶呤、甲氧沙林、丝裂霉素c、米托烷、米托蒽醌、诺龙、奈拉滨、若莫单抗、奥普瑞白介素、奥沙利铂、紫杉醇、帕利夫明、帕米膦酸、培加酶、培门冬酶、非格司亭、培美曲塞二钠、喷司他丁、哌泊溴烷、普卡霉素、卟吩姆钠、甲基苄肼、奎纳克林、拉布立酶、利妥昔单抗、沙格司亭、索拉非尼、链佐星、马来酸舒尼替尼、滑石粉、他莫昔芬、替莫唑胺、替尼泊苷、vm
‑
26、睾丸内酯、硫鸟嘌呤、6
‑
tg、噻替派、托泊替康、托瑞米芬、托西妥单抗、曲妥珠单抗、维甲酸、atra、尿嘧啶氮芥、戊柔比星、长春碱、长春新碱、长春瑞滨、唑来膦酸盐或唑来膦酸。
[0248]
化疗剂还包括用于阿尔茨海默氏病的治疗,诸如盐酸多奈哌齐和卡巴拉汀;用于帕金森氏病的治疗,诸如l
‑
dopa/卡比多巴、恩他卡朋、罗平洛尔、普拉克索、溴隐亭、培高利特、三苯哌啶和金刚烷胺;用于治疗多发性硬化症(ms)的药剂,诸如β干扰素(例如,和),醋酸格拉替雷和米托蒽醌;用于治疗哮喘,诸如沙丁胺醇和孟鲁司特钠;用于治疗精神分裂症的药剂,诸如再普乐、维思通、思瑞康和氟哌啶醇;抗炎药剂,诸如皮质类固醇、tnf阻滞剂、il
‑
1ra、硫唑嘌呤、环磷酰胺和柳氮磺胺吡啶;免疫调节剂和免疫抑制剂,诸如环孢菌素、他克莫司、雷帕霉素、霉酚酸酯、干扰素、皮质类固醇、环磷酰胺、硫唑嘌呤和柳氮磺吡啶;神经营养因子,诸如乙酰胆碱酯酶抑制剂、mao抑制剂、干扰素、抗惊厥药、离子通道阻滞剂、利鲁唑和抗帕金森氏病药剂;用于治疗心血管疾病的药剂,诸如
β
‑
阻滞剂、ace抑制剂、利尿剂、硝酸盐、钙通道阻滞剂和他汀类药物;用于治疗肝脏疾病的药剂,诸如皮质类固醇、消胆胺、干扰素和抗病毒药剂;用于治疗血液疾患的药剂,诸如皮质类固醇、抗白血病药剂和生长因子;以及用于治疗免疫缺陷疾患的药剂,诸如丙种球蛋白。
[0249]
另外,化疗剂包括本文所述的任何化疗剂的药学上可接受的盐、酸或衍生物,以及它们中的两种或更多种的组合。
[0250]
在另一实施例中,提供使用如本文别处所述的式(i)或式(ii)化合物或其药学上可接受的盐,或其实施例或方面与pd
‑
1轴结合拮抗剂组合治疗癌症的方法。
[0251]
术语“pd
‑
1轴结合拮抗剂”是指抑制pd
‑
1轴结合配偶体与其一个或多个结合配偶体的相互作用的分子,以消除由pd
‑
1信号传导轴上的信号传导引起的t细胞功能障碍,其结果是恢复或增强t细胞功能(例如,增殖、细胞因子产生、靶细胞杀伤)。如本文所用,pd
‑
1轴结合拮抗剂包括pd
‑
1结合拮抗剂、pd
‑
l1结合拮抗剂和pd
‑
l2结合拮抗剂。
[0252]
术语“pd
‑
1结合拮抗剂”是指减少、阻断、抑制、消除或干扰由pd
‑
1与其一种或多种结合配偶体(诸如pd
‑
l1、pd
‑
l2)相互作用产生的信号传导的分子。在一些实施例中,pd
‑
1结合拮抗剂为抑制pd
‑
1与其一个或多个结合配偶体结合的分子。在具体方面,pd
‑
1结合拮抗剂抑制pd
‑
1与pd
‑
l1和/或pd
‑
l2的结合。例如,pd
‑
1结合拮抗剂包括抗pd
‑
1抗体,其抗原结合片段、免疫粘附素、融合蛋白、寡肽以及其他减少、阻断、抑制、消除或干扰由pd
‑
1与pd
‑
l1和/或pd
‑
l2相互作用产生的信号传导。在一个实施例中,pd
‑
1结合拮抗剂可减少由t淋巴细胞上表达的细胞表面蛋白介导的通过pd
‑
1的信号传导所介导的或通过其的负共刺激信号,从而使功能障碍的t细胞功能障碍较少(例如,提高效应子对抗原识别的应答)。在一些实施例中,pd
‑
1结合拮抗剂是抗pd
‑
1抗体。下文提供了pd
‑
1结合拮抗剂的具体实例。
[0253]
术语“pd
‑
l1结合拮抗剂”是指减少、阻断、抑制、消除或干扰由pd
‑
l1与其一种或多种结合配偶体(诸如pd
‑
1、b7
‑
1)相互作用产生的信号传导的分子。在一些实施例中,pd
‑
l1结合拮抗剂是抑制pd
‑
l1与其结合配偶体结合的分子。在具体方面,pd
‑
l1结合拮抗剂抑制pd
‑
l1至pd
‑
1和/或b7
‑
1的结合。在一些实施例中,pd
‑
l1结合拮抗剂包括抗pd
‑
l1抗体,其抗原结合片段、免疫粘附素、融合蛋白、寡肽和其他减少、阻断、抑制、消除或干扰由pd
‑
l1与其一个或多个结合配偶体(诸如pd
‑
1、b7
‑
1)相互作用产生的信号传导。在一个实施例中,pd
‑
l1结合拮抗剂可减少由t淋巴细胞上表达的细胞表面蛋白介导的通过pd
‑
l1的信号传导所介导的或通过其的负共刺激信号,从而使功能障碍的t细胞功能障碍较少(例如,提高效应子对抗原识别的应答)。在一些实施例中,pd
‑
l1结合拮抗剂是抗pd
‑
l1抗体。下文提供了pd
‑
l1结合拮抗剂的具体实例。
[0254]
术语“pd
‑
l2结合拮抗剂”是指减少、阻断、抑制、消除或干扰由pd
‑
l2与其一种或多种结合配偶体(诸如pd
‑
1)的相互作用产生的信号传导的分子。在一些实施例中,pd
‑
l2结合拮抗剂是抑制pd
‑
l2与其一个或多个结合配偶体结合的分子。在具体方面,pd
‑
l2结合拮抗剂抑制pd
‑
l2与pd
‑
1的结合。在一些实施例中,pd
‑
l2拮抗剂包括抗pd
‑
l2抗体,其抗原结合片段、免疫粘附素、融合蛋白、寡肽和其他减少、阻断、抑制、消除或干扰由pd
‑
l2与其一个或多个结合配偶体(诸如pd
‑
1)相互作用产生的信号传导。在一个实施例中,pd
‑
l2结合拮抗剂可减少由t淋巴细胞上表达的细胞表面蛋白介导的通过pd
‑
l2的信号传导所介导的或通过其的负共刺激信号,从而使功能障碍的t细胞功能障碍较少(例如,提高效应子对抗原识别的应答)。在一些实施例中,pd
‑
l2结合拮抗剂是免疫粘附素。
[0255]
pd
‑
1轴结合拮抗剂
[0256]
本文提供了用于治疗个体癌症的方法,其包括向所述个体施用有效量的pd
‑
1轴结合拮抗剂和如本文别处所述的式(i)或式(ii)化合物或其药学上可接受的盐。本文还提供增强个体(例如,患有癌症的个体)免疫功能或应答的方法,其包括向所述个体施用有效量的pd
‑
1轴结合拮抗剂和如本文别处所述的式(i)或式(ii)化合物或其药学上可接受的盐。
[0257]
在此类方法中,pd
‑
1轴结合拮抗剂包括pd
‑
1结合拮抗剂、pdl1结合拮抗剂和/或pdl2结合拮抗剂。“pd
‑
1”的别名包括cd279和sleb2。“pdl1”的别名包括b7
‑
h1、b7
‑
4、cd274和b7
‑
h。“pdl2”的别名包括b7
‑
dc、btdc和cd273。在一些实施例中,pd
‑
1、pdl1和pdl2是人pd
‑
1、pdl1和pdl2。
[0258]
在一些实施例中,pd
‑
1结合拮抗剂是抑制pd
‑
1与其配体结合配偶体结合的分子。在具体方面,pd
‑
1配体结合配偶体是pdl1和/或pdl2。在另一实施例中,pdl1结合拮抗剂是抑制pdl1与其结合配偶体结合的分子。在具体方面,pdl1结合配偶体是pd
‑
1和/或b7
‑
1。在另一实施例中,pdl2结合拮抗剂是抑制pdl2与其结合配偶体结合的分子。在具体方面,pdl2结合配偶体是pd
‑
1。拮抗剂可以是抗体、其抗原结合片段、免疫粘附素、融合蛋白、寡肽或小分子。如果拮抗剂是抗体,则在一些实施例中,抗体包含选自由igg1、igg2、igg3和igg4组成的组的人恒定区
[0259]
抗pd
‑
1抗体
[0260]
在一些实施例中,pd
‑
1结合拮抗剂是抗pd
‑
1抗体。在本文公开的方法中可以利用多种抗pdl1抗体。在本文的任何实施例中,pd
‑
1抗体可以结合人pd
‑
1或其变体。在一些实施例中,抗pd
‑
1抗体是单克隆抗体。在一些实施例中,抗pd
‑
1抗体是选自由fab、fab'、fab'
‑
sh、fv、scfv和(fab')2片段组成的组的抗体片段。在一些实施例中,抗pd
‑
1抗体是嵌合或人源化抗体。在其他实施例中,抗pd
‑
1抗体是人抗体。
[0261]
在一些实施例中,抗pd
‑
1抗体是纳武单抗(nivolumab)(cas登记号:946414
‑
94
‑
4)。纳武单抗(bristol
‑
myers squibb/ono),也称为mdx
‑
1106
‑
04、mdx
‑
1106、ono
‑
4538、bms
‑
936558和是wo2006/121168中所述的抗pd
‑
1抗体。纳武单抗包含重链和轻链序列,其中:
[0262]
(a)重链包含以下氨基酸序列。
[0263]
qvqlvesgggvvqpgrslrldckasgitfsnsgmhwvrqapgkglewvaviwy dgskryyadsvkgrftisrdnskntlflqmnslraedtavyycatnddywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk(seq id no:1),和
[0264]
(b)轻链包含以下氨基酸序列:
[0265]
eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasnrat giparfsgsgsgtdftltisslepedfavyycqqssnwprtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:2).
[0266]
在一些实施例中,抗pd
‑
1抗体包含来自seq id no:1和seq id no:2的六个hvr序列(例如,来自seq id no:1的三个重链hvr和来自seq id no:2的三个轻链hvr)。在一些实施例中,抗pd
‑
1抗体包含来自seq id no:1的重链可变结构域和来自seq id no:2的轻链可变结构域。
[0267]
在一些实施例中,抗pd
‑
1抗体是派姆单抗(pembrolizumab)(cas登记号:1374853
‑
91
‑
4)。派姆单抗(merck),也称为mk
‑
3475、merck 3475、帕博利珠单抗、sch
‑
900475,并且是wo2009/114335中所述的抗pd
‑
1抗体。派姆单抗包含重链和轻链序列,其中:
[0268]
(a)重链包含以下氨基酸序列:
[0269]
qvqlvqsgvevkkpgasvkvsckasgytftnyymywvrqapgqglewmgg inpsnggtnfnekfknrvtlttdsstttaymelkslqfddtavyycarrdyrfdmgfdyw gqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgv htfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcp apeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktk preeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskak gqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpenn ykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk(seq id no:3),和
[0270]
(b)轻链包含以下氨基酸序列:
[0271]
eivltqspat lslspgeratlscraskgvstsgysylhwyqqkpgqaprlliylasyles gvparfsgsgsgtdftltisslepedfavyycqhsrdlpltfgggtkveikrtvaapsvf ifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteq dskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:4).
[0272]
在一些实施例中,抗pd
‑
1抗体包含来自seq id no:3和seq id no:4的六个hvr序列(例如,来自seq id no:3的三个重链hvr和来自seq id no:4的三个轻链hvr)。在一些实施例中,抗pd
‑
1抗体包含来自seq id no:3的重链可变结构域和来自seq id no:4的轻链可变结构域。
[0273]
在一些实施例中,抗pd
‑
1抗体是medi
‑
0680(amp
‑
514;astrazeneca)。medi
‑
0680是人源化igg4抗pd
‑
1抗体。
[0274]
在一些实施例中,抗pd
‑
1抗体是pdr001(cas登记号1859072
‑
53
‑
9;novartis)。pdr001是人源化igg4抗pd1抗体,可阻断pdl1和pdl2与pd
‑
1的结合。
[0275]
在一些实施例中,抗pd
‑
1抗体是regn2810(regeneron)。regn2810是人抗pd1抗体。
[0276]
在一些实施例中,抗pd
‑
1抗体是bgb
‑
108(beigene)。在一些实施例中,抗pd
‑
1抗体是bgb
‑
a317(beigene)。
[0277]
在一些实施例中,抗pd
‑
1抗体是js
‑
001(shanghai junshi)。js
‑
001是人源化抗pd1抗体。
[0278]
在一些实施例中,抗pd
‑
1抗体是sti
‑
a1110(sorrento)。sti
‑
a1110是人抗pd1抗体。
[0279]
在一些实施例中,抗pd
‑
1抗体是incshr
‑
1210(incyte)。incshr
‑
1210是人igg4抗pd1抗体。
[0280]
在一些实施例中,抗pd
‑
1抗体是pf
‑
06801591(pfizer)。
[0281]
在一些实施例中,抗pd
‑
1抗体是tsr
‑
042(也称为anb011;tesaro/anaptysbio)。
[0282]
在一些实施例中,抗pd
‑
1抗体是am0001(armo biosciences)。
[0283]
在一些实施例中,抗pd
‑
1抗体是enum 244c8(enumeral biomedical holdings)。enum 244c8是抗pd1抗体,可抑制pd
‑
1的功能而不阻止pdl1与pd
‑
1的结合。
[0284]
在一些实施例中,抗pd
‑
1抗体是enum 388d4(enumeral biomedical holdings)。enum 388d4是抗pd1抗体,可竞争性抑制pdl1与pd
‑
1的结合。
[0285]
在一些实施例中,pd
‑
1抗体包含来自下述文献中描述的pd
‑
1抗体的六个hvr序列(例如三个重链hvr和三个轻链hvr)和/或重链可变结构域和轻链可变结构域:wo2015/112800(申请人:regeneron)、wo2015/112805(申请人:regeneron)、wo2015/112900(申请人:novartis)、us20150210769(转让给novartis)、wo2016/089873(申请人:celgene)、wo2015/035606(申请人:beigene)、wo2015/085847(申请人:shanghai hengrui pharmaceutical/jiangsu hengrui medicine)、wo2014/206107(申请人:shanghai junshi biosciences/junmeng biosciences)、wo2012/145493(申请人:amplimmune)、us9205148(转让给medimmune)、wo2015/119930(申请人:pfizer/merck)、wo2015/119923(申请人:pfizer/merck)、wo2016/032927(申请人:pfizer/merck)、wo2014/179664(申请人:anaptysbio)、wo2016/106160(申请人:enumeral)和wo2014/194302(申请人:sorrento)。
[0286]
抗pdl1抗体
[0287]
在一些实施例中,pd
‑
1轴结合拮抗剂是抗pdl1抗体。本文考虑并描述了多种抗pdl1抗体。在本文的任何实施例中,分离的抗pdl1抗体可以结合人pdl1,例如uniprotkb/swiss
‑
prot登录号q9nzq7.1中所示的人pdl1,或其变体。在一些实施例中,抗pdl1抗体能够抑制pdl1和pd
‑
1之间和/或pdl1和b7
‑
1之间的结合。在一些实施例中,抗pdl1抗体是单克隆抗体。在一些实施例中,抗pdl1抗体是选自由fab、fab'
‑
sh、fv、scfv和(fab')2片段组成的组的抗体片段。在一些实施例中,抗pdl1抗体是嵌合或人源化抗体。在一些实施例中,抗pdl1抗体是人抗体。可用于本发明方法的抗pdl1抗体的实例及其制备方法在pct专利申请wo 2010/077634和美国专利号8,217,149中描述,两者通过引用并入本文。
[0288]
在一些实施例中,抗pdl1抗体是阿特朱单抗(cas登记号:1422185
‑
06
‑
5)。阿特朱单抗(genentech),也称为mpdl3280a,是抗pdl1抗体。
[0289]
阿特朱单抗包含:
[0290]
(a)分别是gftfsdswih(seq id no:5)、awispyggstyyadsvkg(seq id no:6)和rhwpggfdy(seq id no:7)的hvr
‑
h1、hvr
‑
h2和hvr
‑
h3序列,并且
[0291]
(b)分别是rasqdvstava(seq id no:8)、sasflys(seq id no:9)和qqylyhpat(seq id no:10)的hvr
‑
l1、hvr
‑
l2和hvr
‑
l3序列。
[0292]
阿特朱单抗包含重链和轻链序列,其中:
[0293]
(a)重链可变区序列包含以下氨基酸序列:
[0294]
evqlvesggglvqpggslrlscaasgftfsdswihwvrqapgkglewvawispyggstyyadsvkgrftisadtskntaylqmnslraedtavyycarrhwpggfdywgqgtlvtvss(seq id no:11),和
[0295]
(b)轻链可变区序列包含以下氨基酸序列:
[0296]
diqmtqspsslsasvgdrvtitcrasqdvstavawyqqkpgkapklliy sasflysgvpsrfsgsgsgtdftltisslqpedfatyycqqylyhpatfgqgtkveikr(seq id no:12).
[0297]
阿特朱单抗包含重链和轻链序列,其中:
[0298]
(a)重链包含以下氨基酸序列:
[0299]
evqlvesggglvqpggslrlscaasgftfsdswihwvrqapgkglewvawispyggstyyadsvkgrftisadtskntaylqmnslraedtavyycarrhwpggfdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:13),和
[0300]
(b)轻链包含以下氨基酸序列:
[0301]
diqmtqspsslsasvgdrvtitcrasqdvstavawyqqkpgkapklliysasflysgvpsrfsgsgsgtdftltisslqpedfatyycqqylyhpatfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:14).
[0302]
在一些实施例中,抗pdl1抗体是阿维鲁单抗(avelumab)(cas登记号:1537032
‑
82
‑
8)。阿维鲁单抗,也称为msb0010718c,是人单克隆igg1抗pdl1抗体(merck kgaa,pfizer)。阿维鲁单抗包含重链和轻链序列,其中:
[0303]
(a)重链包含以下氨基酸序列:
[0304]
evqllesggglvqpggslrlscaasgftfssyimmwvrqapgkglewvssiypsggitfyadtvkgrftisrdnskntlylqmnslraedtavyycariklgtvttvdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:15),和
[0305]
(b)轻链包含以下氨基酸序列:
[0306]
qsaltqpasvsgspgqsitisctgtssdvggynyvswyqqhpgkapklmiydvsnrpsgvsnrfsgsksgntasltisglqaedeadyycssytssstrvfgtgtkvtvlgqpkanptvtlfppsseelqankatlvclisdfypgavtvawkadgspvkagvettkpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs(seq id no:16).
[0307]
在一些实施例中,抗pdl1抗体包含来自seq id no:15和seq id no:16的六个hvr序列(例如,来自seq id no:15的三个重链hvr和来自seq id no:16的三个轻链hvr)。在一些实施例中,抗pdl1抗体包含来自seq id no:15的重链可变结构域和来自seq id no:16的轻链可变结构域。
[0308]
在一些实施例中,抗pdl1抗体是德瓦鲁单抗(durvalumab)(cas登记号:1428935
‑
60
‑
7)。德瓦鲁单抗,也称为medi4736,是wo2011/066389和us2013/034559中所述的fc优化的人单克隆igg1κ抗pdl1抗体(medimmune,astrazeneca)。德瓦鲁单抗包含重链和轻链序列,其中:
[0309]
(a)重链包含以下氨基酸序列:
[0310]
evqlvesggglvqpggslrlscaasgftfsrywmswvrqapgkglewvanikqdgsekyyvdsvkgrftisrdnaknslylqmnslraedtavyycareggwfgelafdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapefeggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpasiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:17),和
[0311]
(b)轻链包含以下氨基酸序列:
[0312]
eivltqspgtlslspgeratlscrasqrvsssylawyqqkpgqaprlliydassratgipdrfsgsgsgtdftltisrlepedfavyycqqygslpwtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:18).
[0313]
在一些实施例中,抗pdl1抗体包含来自seq id no:17和seq id no:18的六个hvr序列(例如,来自seq id no:17的三个重链hvr和来自seq id no:18的三个轻链hvr)。在一些实施例中,抗pdl1抗体包含来自seq id no:17的重链可变结构域和来自seq id no:18的轻链可变结构域。
[0314]
在一些实施例中,抗pdl1抗体是mdx
‑
1105(bristol myers squibb)。mdx
‑
1105,也称为bms
‑
936559,是wo2007/005874中所述的抗pdl1抗体。
[0315]
在一些实施例中,抗pdl1抗体是ly3300054(eli lilly)。
[0316]
在一些实施例中,抗pdl1抗体是sti
‑
a1014(sorrento)。sti
‑
a1014是人抗pdl1抗体。
[0317]
在一些实施例中,抗pdl1抗体是kn035(suzhou alphamab)。kn035是从骆驼噬菌体展示文库生成的单结构域抗体(dab)。
[0318]
在一些实施例中,抗pdl1抗体包含可裂解的部分或连接基,当被裂解时(例如,通过肿瘤微环境中的蛋白酶),该部分或连接基激活抗体抗原结合结构域(例如,通过去除非结合的空间部分)以使其结合其抗原。在一些实施例中,抗pdl1抗体是cx
‑
072(cytomx therapeutics)。
[0319]
在一些实施例中,pdl1抗体包含来自以下文献所述的pdl1抗体的六个hvr序列(例如,三个重链hvr和三个轻链hvr)和/或重链可变结构域和轻链可变结构域:us20160108123(转让给novartis)、wo2016/000619(申请人:beigene)、wo2012/145493(申请人:amplimmune)、us9205148(转让给medimmune)、wo2013/181634(申请人:sorrento)和wo2016/061142(申请人:novartis)。
[0320]
在又一特定方面,pd
‑
1或pdl1抗体具有降低的或最小的效应子功能。在又一个具体方面,最小的效应子功能来自“无效应子的fc突变”或无糖基化突变。在另一实施例中,无效应子fc突变是恒定区中的n297a或d265a/n297a取代。在一些实施例中,分离的抗pdl1抗体是去糖基化的。抗体的糖基化通常是n
‑
连接或o
‑
连接的。n
‑
连接是指碳水化合物部分连接至天冬酰胺残基的侧链。三肽序列天冬酰胺
‑
x
‑
丝氨酸和天冬酰胺
‑
x
‑
苏氨酸,其中x是除脯氨酸以外的任何氨基酸,是将碳水化合物部分酶促连接至天冬酰胺侧链的识别序列。因此,多肽中这些三肽序列中任一个的存在产生潜在的糖基化位点。o
‑
连接的糖基化是指糖
n
‑
乙酰半乳糖胺、半乳糖或木糖中的一种附接至羟基氨基酸,该羟基氨基酸最通常为丝氨酸或苏氨酸,但也可以使用5
‑
羟脯氨酸或5
‑
羟基赖氨酸。通过改变氨基酸序列以除去上述三肽序列之一(对于n
‑
连接的糖基化位点),可以方便地从抗体上去除糖基化位点。可以通过将糖基化位点内的天冬酰胺、丝氨酸或苏氨酸残基取代为另一个氨基酸残基(例如,甘氨酸、丙氨酸或保守取代)来进行改变。
[0321]
其他pd
‑
1拮抗剂
[0322]
在一些实施例中,pd
‑
1结合拮抗剂是免疫粘附素(例如,包含与恒定区(例如,免疫球蛋白序列的fc区)融合的pdl1或pdl2的细胞外或pd
‑
1结合部分的免疫粘附素)。在一些实施例中,pd
‑
1结合拮抗剂是amp
‑
224。amp
‑
224(cas登记号:1422184
‑
00
‑
6;glaxosmithkline/medimmune),也称为b7
‑
dcig,是wo2010/027827和wo2011/066342中所述的pdl2
‑
fc融合可溶性受体。
[0323]
在一些实施例中,pd
‑
1结合拮抗剂是肽或小分子化合物。在一些实施例中,pd
‑
1结合拮抗剂是aunp
‑
12(pierrefabre/aurigene)。参见,例如wo2012/168944、wo2015/036927、wo2015/044900、wo2015/033303、wo2013/144704、wo2013/132317和wo2011/161699。
[0324]
在一些实施例中,pdl1结合拮抗剂是抑制pd
‑
1的小分子。在一些实施例中,pdl1结合拮抗剂是抑制pdl1的小分子。在一些实施例中,pdl1结合拮抗剂是抑制pdl1和vista的小分子。在一些实施例中,pdl1结合拮抗剂是ca
‑
170(也称为aupm
‑
170)。在一些实施例中,pdl1结合拮抗剂是抑制pdl1和tim3的小分子。在一些实施例中,小分子是在wo2015/033301和wo2015/033299中描述的化合物。
[0325]
如本文所用,“组合”是指一种或多种本公开的化合物(其实施例或方面)与一种或多种本公开的其他化合物,或一种或多种其他治疗剂的任何混合物或排列。除非上下文另有明确说明,否则“组合”可以包括本发明的化合物与一种或多种治疗剂的同时或依次递送。除非上下文另有明确说明,否则“组合”可以包括本公开的化合物与另一种治疗剂的剂型。除非上下文另有明确说明,否则“组合”可以包括本公开的化合物与另一种治疗剂的施用途径。除非上下文另有明确说明,否则“组合”可以包括本公开的化合物与另一种治疗剂的制剂。剂型、施用途径和药物组合物包括但不限于本文所述的那些。
[0326]
双功能降解剂化合物
[0327]
在一些方面,本公开涉及可用于降解靶蛋白的双功能降解剂化合物,该双功能化合物包含作为蛋白质结合部分(“pb”)的本公开的化合物与包含连接酶或蛋白酶的配体部分(“配体”)组合。在一些此类方面,本公开涉及双功能降解剂化合物,该化合物的一端含有与vhl e3泛素连接酶结合的von hippel
‑
lindau(vhl)肿瘤抑制配体部分,而另一端含有本公开的化合物,其为蛋白质结合部分,从而实现靶蛋白质/多肽的降解。
[0328]
在一些此类方面,双功能降解剂化合物可以具有pb
‑
配体、pb
‑
l
‑
配体或pb
‑
l
‑
y
‑
配体结构,其中pb是指是蛋白粘结剂的本公开的组合物,“l”是指连接基(或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物或多晶型物),“配体”是指包含连接酶或蛋白酶的部分,而“y”是指任选的部分。在涉及pb
‑
连接基的方面,pb和连接基通过键连接。
[0329]
如本文所用,pb是指蛋白质结合部分,并且用于描述本公开的化合物,其与靶标蛋白或其他目的蛋白或多肽结合并且将该蛋白质或多肽放置/呈现在双功能降解剂的蛋白酶或连接酶末端附近,从而可以发生蛋白质或多肽的降解。通常,当在降解剂中用作pb部分
时,本公开的化合物表现出对tead的结合亲和力。在一些方面,连接酶是泛素连接酶。通过将vhl配体与蛋白质结合部分(pb)偶联,靶标蛋白或多肽被蛋白酶体泛素化和/或降解。
[0330]
在本公开的范围内,pb部分可以偶联至l或偶联至pb上任何位点的配体或其上的取代基,这些偶联不会实质性地影响pb与靶标蛋白或其他目的蛋白或多肽的结合。在一些方面,偶联可以在pb上或其上的取代基上的碳原子、氮原子或氧原子处。
[0331]
已获得具有配体的vhl的晶体结构,证实了小化合物可以模仿vhl的主要底物转录因子hif
‑
1α的结合模式。使用合理的设计,产生von hippel lindau(vhl)的第一个小分子配体,该配体是e3连接酶vcb(癌症、慢性贫血和局部缺血的靶标)的底物识别亚基。
[0332]
e3泛素连接酶(在人类中已知有600多种)赋予泛素化底物特异性。存在与这些连接酶结合的已知配体。e3泛素连接酶结合基团(e3lb)是可以结合e3泛素连接酶的肽或小分子。
[0333]
一种具有治疗潜力的e3连接酶是von hippel
‑
lindau(vhl)肿瘤抑制剂,该抑制剂是e3连接酶复合物vcb的底物识别亚基,其也由延伸蛋白b和c,cul2和rbx1组成。vhl的主要底物是低氧诱导因子1α(hif
‑
1α),该诱导因子是一种转录因子,可在低氧水平下上调基因,诸如促血管生成生长因子vegf和诱导细胞因子促红细胞生成素的红细胞。虽然hif
‑
1α组成性表达,但在常氧条件下,通过脯氨酰羟化酶结构域(phd)蛋白的羟基化作用以及随后的vhl介导的泛素化作用,其细胞内水平保持在非常低的水平。
[0334]
除非上下文另有说明,否则术语“vcb e3泛素连接酶”,“von hippel
‑
lindau(或vhl)e3泛素连接酶”,“vhl”或“泛素连接酶”通常可以互换使用,用于描述如本文所述,例如在如本文所述的双功能(嵌合)化合物中的泛素连接酶部分的靶标酶结合位点。“vcb”是指e3泛素连接酶家族vhl
‑
延伸蛋白c/延伸蛋白b。vcb e3是一种与e2泛素结合酶组合可引起泛素与靶标蛋白上的赖氨酸结合的蛋白质;e3泛素连接酶靶向特定的蛋白质底物,以被蛋白酶体降解。因此,单独的e3泛素连接酶或与e2泛素结合酶复合的e3泛素连接酶负责将泛素转移至靶标蛋白。通常,泛素连接酶参与多泛素化作用,使得第二泛素与第一泛素附接;第三泛素与第二泛素附接,依此类推。多泛素化标记蛋白质以被蛋白酶体降解。但是,有些泛素化事件仅限于单泛素化,在这种情况下,泛素连接酶仅将单个泛素添加到底物分子上。单泛素化的蛋白质不靶向蛋白酶体进行降解,而是可以例如,通过结合具有能够结合泛素的结构域的其他蛋白质改变其细胞位置或功能。更为复杂的是,e3可以靶向泛素上的不同赖氨酸来制造链。最普遍的赖氨酸是在泛素链上的lys48。这是用于制造多泛素的赖氨酸,其被蛋白酶体识别。
[0335]
在一些方面,vhl配体部分是小分子(即,不是基于肽的)。如本文所用,“小分子”通常是指尺寸小于5千道尔顿(kd),诸如小于4kd、小于3kd、小于2kd、小于1kd、小于800道尔顿(d)、小于600d、小于500d、小于400d、小于300d、小于200d、小于100d、小于2000g/mol、小于1500g/mol、小于1000g/mol、小于800g/mol或小于500g/mol的有机分子。在一些方面,小分子是非聚合的。小分子不是蛋白质、多肽、寡肽、肽、多核苷酸、寡核苷酸、多糖、糖蛋白、蛋白聚糖等。小分子的衍生物是指与原始小分子共享相同结构核心的分子,但可以通过原始小分子的一系列化学反应制备而成。
[0336]
如本文所述的双功能降解剂化合物的vhl配体部分和pb部分可与l连接。在某些实施例中,l为包含一个或多个a的共价连接的结构单元的基团,其中每个a单元是与vhl配体
部分、pb部分、另一个a单元或其组合中的至少一个偶联的基团。在某些实施例中,a单元将vhl配体部分、pb部分或其组合直接连接至另一个vhl配体、pb部分或其组合。在其他实施例中,a单元通过一个或多个不同的a单元将vhl配体部分、pb部分或其组合间接连接至另一个vhl配体、pb部分或其组合。在本文公开的任何实施例中,a的一个或多个共价连接的结构单元可以在取代基y处偶联至本公开的双功能降解剂化合物的vhl配体部分。因此,在某些实施例中,l可以偶联至y、pb或其组合。
[0337]
在某些实施例中,l是(a)
q
,并且每个a独立地选自由以下各项组成的组:键、cr
la
r
lb
、o、s、so、so2、nrlc、so2nr
lc
、sonr
lc
、conr
lc
、nr
lc
conr
ld
、nr
lc
so2nr
ld
、co、cr
la
═
cr
lb
、c≡c、sir
la
r
lb
、p(o)r
la
、p(o)or
la
、nr
lc
c(
═
ncn)nr
ld
、nr
lc
c(
═
ncn)、nr
lc
c(
═
cno2)nr
ld
、c3‑
11
亚环烷基、c3‑
11
亚杂环基、亚芳基和杂亚芳基,其中c3‑
11
亚环烷基、c3‑
11
亚杂环基、亚芳基和杂亚芳基独立地未被取代或被1、2、3、4、5或6个取代基取代,所述取代基选自由r
la
、r
lb
和其组合组成的组,其中每个r
la
或r
lb
独立地可以连接至其他a基团以形成亚环烷基和/或亚杂环基部分,其中亚环烷基和亚杂环基部分独立地未被取代或被1、2、3或4个r
le
基团取代;其中每个r
la
、r
lb
、r
lc
、r
ld
和r
le
独立地选自由以下各项组成的组:h、卤素、r
lf
、
‑
or
lh
、
‑
sr
lh
、
‑
nhr
lh
、
‑
n(r
lh
)2、c3‑
11
环烷基、芳基、杂芳基、c3‑
11
杂环基、
‑
n(r
lg
)(r
lf
)、
‑
oh、
‑
nh2、
‑
sh、
‑
so2r
lf
、
‑
p(o)(or
lf
)(r
lf
)、
‑
p(o)(or
lf
)2、
‑
c≡c—r
lf
、
‑
c≡ch、
‑
ch
═
ch(r
lf
)、
‑
c(r
lf
)
═
ch(r
lf
)、
‑
c(r
lf
)
═
c(r
lf
)2、
‑
si(oh)3、
‑
si(r
lf
)3、
‑
si(oh)(r
lf
)2、
‑
cor
lf
、
‑
co2h、
‑
cn、
‑
cf3、
‑
chf2、
‑
ch2f、
‑
no2、
‑
sf5、
‑
so2nhr
lf
、
‑
so2n(r
lf
)2、
‑
sonhr
lf
、
‑
son(r
lf
)2、
‑
conhr
lf
、
‑
con(r
lf
)2、
‑
n(r
lf
)conh(r
lf
)、
‑
n(r
lf
)con(r
lf
)2、
‑
nhconh(r
lf
)、
‑
nhcon(r
lf
)2、
‑
nhconh2、
‑
n(r
lf
)so2nh(r
lf
)、
‑
n(r
lf
)so2n(r
lf
)2、
‑
nhso2nh(r
lf
)、
‑
nhso2n(r
lf
)2和
‑
nhso2nh2,其中r
lf
是取代或未取代的c1‑8烷基;r
lg
是取代或未取代的c1‑8‑
环烷基;并且r
lh
是r
lf
或r
lg
。
[0338]
当存在时,y可以合适地选自由以下项组成的组:取代或未取代的亚杂芳基、取代或未取代的亚杂环基、o、s、
‑
n(r
11
)
‑
、
–
n(r
11
)
‑
c(o)
‑
和
–
n(r
11
)
‑
so2‑
。r
11
可以选自由h和取代或未取代的烷基组成的组。
[0339]
尽管vhl配体部分和pb部分可以通过任何合适且对连接基化学稳定的基团与连接基基团共价连接,但在一些方面,连接基可以通过酰胺、酯、硫代酸酯、酮基团、氨基甲酸酯(氨基甲酸乙脂)、碳或醚独立地共价键合到vhl配体部分和pb部分,基团各自可插入vhl配体部分和pb部分的任何位置,以提供vhl泛素连接酶上的vhl配体部分和要降解的靶标蛋白上的pb部分的最大结合。(注意,在某些方面,其中pb基团是vhl配体部分,降解的靶标蛋白可以是泛素连接酶连接酶本身)。在某些方面,连接基可以连接至vhl配体部分和/或pb部分上的任选地取代的烷基、亚烷基、烯基或炔基基团、芳基基团或杂环基基团。
[0340]
在其他降解剂方面,本公开提供一种降解(泛素化)细胞中靶标蛋白的方法。该方法包括施用双功能化合物或包含本公开的双功能化合物(诸如包含本公开的vhl配体部分和蛋白质结合部分组合物)的药物组合物,其如本文另外所述任选地通过连接基部分连接,其中vhl配体部分与蛋白质结合部分偶联,并且其中vhl配体部分识别泛素通路蛋白(例如,泛素连接酶,优选地vhl泛素连接酶(e3)),蛋白质结合部分识别靶标蛋白,从而当将靶标蛋白置于泛素连接酶附近时,靶标蛋白将发生降解,从而导致靶标蛋白作用的降解/抑制和蛋白质水平的控制。本公开提供的蛋白质水平的控制提供了疾病状态或病症的治疗,该疾病状态或病症通过降低患者细胞中靶标蛋白的水平进行调节。
[0341]
式(i)和式(ii)化合物的通用制备
[0342]
通用方案和实例中详述的以下合成反应方案和某些公开的中间体仅说明可用于合成本公开的化合物(或其实施例或方面)的一些方法。参照本申请中包含的公开内容,可以对这些合成反应方案进行各种修改,并且将建议给本领域技术人员。
[0343]
用于制备这些化合物的起始材料和试剂通常可以从商业供应商(诸如aldrich chemical co.)获得,或者通过本领域技术人员已知的方法,按照参考文献中所述的方法制备,诸如fieser and fieser’s reagents for organic synthesis;wiley&sons:new york,1991,第1
‑
15卷;rodd’s chemistry of carbon compounds,elsevier science publishers,1989,第1
‑
5卷和增刊;和organic reactions,wiley&sons:new york,1991,第1
‑
40卷。
[0344]
如有需要,可以使用常规技术分离和纯化合成反应方案的起始材料和中间体,包括但不限于过滤、蒸馏、结晶、色谱法等。可以使用常规手段来表征此类材料,包括物理常数和光谱数据。
[0345]
除非有相反的说明,否则本文所述的反应优选地在惰性气氛下,在大气压下,于约
‑
78℃至约150℃的反应温度范围,更优选地于约0℃至约125℃的反应温度范围,并且最优选地且方便的是在约室温(或环境温度),例如约20℃进行。
[0346]
尽管本文描绘和描述了某些示例性实施例,但是可以根据本文中通常描述的方法和/或通过本领域普通技术人员可利用的方法,使用适当的起始材料来制备本公开的化合物(或其实施例或方面)。
[0347]
中间体和最终化合物通过快速色谱和/或通过反相制备型hplc(高效液相色谱)和/或通过超临界流体色谱进行纯化。除非另做标注,否则快速色谱使用来自isco或silicycle的预填充硅胶色谱柱在isco色谱仪(来自teledyne isco,inc.)上完成。
[0348]
使用以下项实施质谱(ms):(1)sciex 15质谱仪,es+模式;或(2)岛津液相色谱仪
‑
质谱(lcms)2020型质谱仪,esi+模式。除非另做指明,否则质谱数据通常仅指示母离子。如有指示,则提供具体中间体或化合物的ms或hrms数据。
[0349]
使用以下项实施核磁共振光谱分析(nmr):(1)bruker av iii 300nmr光谱仪,(2)bruker av iii 400nmr光谱仪,或(3)bruker av iii 500nmr光谱仪,并且内标是四甲基硅烷。如有指示,则提供具体中间体或化合物的nmr数据。
[0350]
所有涉及空气敏感试剂的反应均在惰性气氛下进行。除非另有说明,否则试剂按原样购自商业供应商。
[0351]
通用方案
[0352]
以下通用方案用于制备公开的化合物、中间体及其药学上可接受的盐。公开的化合物和中间体可以使用标准的有机合成技术和从可商购的起始材料和试剂制备。应当理解,用于制备公开的化合物和中间体的合成工艺将取决于化合物或中间体中存在的特定取代基,并且可能需要有机合成中标准的各种保护、脱保护和转化步骤,但是可能在以下通用方案中未进行说明。还应理解,可以以化学上可行的任何组合和顺序使用以下任何通用方案中所示的任何步骤,以获得所需的中间体或公开的化合物。
[0353]
以下方案1
‑
12描述中间体和具有式ia结构的公开的化合物及其药学上可接受的
盐。
[0354]
方案1
[0355][0356]
方案1描述使用磺酰氯化合物将氨基基团转化为磺酰胺基基团的通用合成路线。r1、r
c
、r
d
、x和y如上对于式ia所定义。r'可以是任何合适的原子或基团,包括例如氢。部分可以是任何合适的原子或基团,包括例如卤素;或如上对于式ia所定义的
‑
a
‑
r5部分。在一些实施例中,卤素是氯、碘或溴。
[0357]
方案2
[0358][0359]
方案2描述使用磺酰胺化合物将卤素(卤代)基团转化为磺酰胺基基团的通用合成路线。卤代是指任何卤素。在一些实施例中,卤素是氯、溴或碘。r1、r
c
、r
d
、x和y如上对于式ia所定义。r'可以是任何合适的原子或基团,包括例如:氢或
‑
c(o)oc(ch3)3。部分可以是任何合适的原子或基团,包括例如:卤素,诸如氯、溴或碘;如上对于式ia所定义的
‑
a
‑
r5部分;
‑
ch2p(o)(or
y
)2,其中r
y
是任何合适的原子或基团,包括例如c1‑8烷基;或
‑
ch2or
x
,其中r
x
是任何合适的保护基,包括例如tbdps(叔丁基二苯基甲硅烷基)。
[0360]
方案3
[0361][0362]
方案3描述了使用硼酸或硼酸酯化合物将卤素(卤代)基团转化为如上对于式ia所定义的
‑
a
‑
r5部分的通用合成路线。卤代是指任何卤素。在一些实施例中,卤素基团是氯、溴或碘。r1、r5、a、x和y如上对于式ia所定义。r"可以是任何合适的原子或基团,包括例如氢。在一些实施例中,式的化合物是部分可以是任何合适的原子或基团,包括例如卤素诸如氯、溴或碘。
[0363]
方案4
[0364][0365]
方案4描述了使用卤代化合物将卤素(卤代)基团转化为如上对于式ia所定义的
‑
a
‑
r5部分的通用合成路线。卤代是指任何卤素。在一些实施例中,卤素是氯、溴或碘。r1、r5、a、x和y如上对于式ia所定义。部分可以是任何合适的原子或基团,包括例如如上对于式ia所定义的
‑
nr
c
so2r
d
部分。
[0366]
方案5
[0367][0368]
方案5描述了使用磷酸化合物和醛化合物将
‑
ch2‑
卤代基团转化为
‑
ch=chr5部分的通用合成路线。r1、r5、x和y如上对于式ia所定义。卤代是指任何卤素。在一些实施例中,卤素是氯、溴或碘。在一些实施例中,磷酸化合物是p(or
y
)3,其中r
y
是任何合适的原子或基团,包括例如c1‑8烷基。在某些变体中,磷酸化合物是p(oet)3。部分可以是任何合适的原子或基团,包括例如:卤素,诸如氯、溴或碘;或
‑
nr
s
r
t
,其中每个r
s
和r
t
独立地是任何合适的原子或基团,包括例如保护基。在一些变体中,r
s
和r
t
不同。在其他变体中,r
s
和r
t
相同。在一个实施例中,
‑
nr
s
r
t
是
‑
no2。
[0369]
方案6
[0370][0371]
方案6描述了使用磷酸化合物和醛化合物将
‑
ch2‑
oh基团转化为
‑
ch=chr5部分的通用合成路线。r1、r5、x和y如上对于式ia所定义。在一些实施例中,磷酸化合物是p(or
y
)3,其中r
y
是任何合适的原子或基团,包括例如c1‑8烷基。在某些变体中,磷酸化合物是p(oet)3。部分可以是任何合适的原子或基团,包括例如:卤素,诸如氯、溴或碘;或
‑
nr
s
r
t
,其中每个r
s
和r
t
独立地是任何合适的原子或基团,包括例如保护基。在一些变体中,r
s
和r
t
不同。在其他变体中,r
s
和r
t
相同。在一个实施例中,
‑
nr
s
r
t
是
‑
no2。
[0372]
方案7
[0373][0374]
方案7描述了顺序地组合上述方案2和方案3中概述的通用合成路线的通用合成路线。
[0375]
方案8
[0376][0377]
方案8描述了顺序地组合方案3和方案1中概述的通用合成路线的通用合成路线。
[0378]
方案9
[0379][0380]
方案9描述了顺序地组合方案1和方案4中概述的通用合成路线的通用合成路线。
[0381]
方案10
[0382][0383]
方案10描述了顺序地组合方案5和方案1中概述的通用合成路线的通用合成路线。应当理解,可以使用任何标准合成技术和任何可商购的试剂实现方案5和方案1之间的卤素(卤代)基团向氨基(
‑
nr
c
r')基团的转化。
[0384]
方案11
[0385][0386]
方案11描述了顺序地组合方案6和方案2中概述的通用合成路线的通用合成路线。
[0387]
方案12
[0388][0389]
方案12描述了顺序地组合方案5和方案1中概述的通用合成路线的通用合成路线。应当理解,可以使用任何标准合成技术和任何可商购的试剂实现方案5和方案1之间的硝基基团(
‑
no2)向氨基基团(
‑
nh2)的转化。
[0390]
以下方案13
‑
19描述中间体和具有式ib结构的公开的化合物及其药学上可接受的盐。
[0391]
方案13
[0392][0393]
方案13描述使用胺将
‑
cooh基团转化为酰胺基团的通用合成路线。r1、r
a
、r
b
、x和y
如上对于式ib所定义。部分可以是任何合适的原子或基团,包括例如如上对于式ib所定义的
‑
a
‑
r5部分。
[0394]
方案14
[0395][0396]
方案14描述了使用硼酸或硼酸酯化合物将卤素(卤代)基团转化为如上对于式ib所定义的
‑
a
‑
r5部分的通用合成路线。卤代是指任何卤素。在一些实施例中,卤素基团是氯、溴或碘。r1、r5、a、x和y如上对于式ib所定义。r"可以是任何合适的原子或基团,包括例如氢。在一些实施例中,式的化合物是部分可以是任何合适的原子或基团,包括例如卤素诸如氯、溴或碘。
[0397]
方案15
[0398][0399]
方案15描述了使用卤代化合物将卤素(卤代)基团转化为如上对于式ib所定义的
‑
a
‑
r5部分的通用合成路线。卤代是指任何卤素。在一些实施例中,卤素是氯、溴或碘。r1、r5、a、x和y如上对于式ia所定义。部分可以是任何合适的原子或基团,包括例如如上对于式ib所定义的
‑
nr
c
so2r
d
部分。
[0400]
方案16
[0401][0402]
方案16描述了使用磷酸化合物和醛化合物将
‑
ch2‑
卤代基团转化为
‑
ch=chr5部分的通用合成路线。r1、r5、x和y如上对于式ib所定义。卤代是指任何卤素。在一些实施例中,卤素是氯、溴或碘。在一些实施例中,磷酸化合物是p(or
y
)3,其中r
y
是任何合适的原子或基团,包括例如c1‑8烷基。在某些变体中,磷酸化合物是p(oet)3。部分可以是任何合适的原子或基团,包括例如:卤素,诸如氯、溴或碘;或
‑
nr
s
r
t
,其中每个r
s
和r
t
独立地是任何合适的原子或基团,包括例如保护基。在一些变体中,r
s
和r
t
不同。在其他变体中,r
s
和r
t
相同。在一个实施例中,
‑
nr
s
r
t
是
‑
no2。
[0403]
方案17
[0404]
[0405]
方案17描述了使用磷酸化合物和醛化合物将
‑
ch2‑
oh基团转化为
‑
ch=chr5部分的通用合成路线。r1、r5、x和y如上对于式ib所定义。在一些实施例中,磷酸化合物是p(or
y
)3,其中r
y
是任何合适的原子或基团,包括例如c1‑8烷基。在某些变体中,磷酸化合物是p(oet)3。部分可以是任何合适的原子或基团,包括例如:卤素;或
‑
nr
s
r
t
,其中每个r
s
和r
t
独立地是任何合适的原子或基团,包括例如保护基。在一些变体中,r
s
和r
t
不同。在其他变体中,r
s
和r
t
相同。在一个实施例中,
‑
nr
s
r
t
是
‑
no2。在一些实施例中,卤素是碘。
[0406]
方案18
[0407][0408]
方案18描述了顺序地组合方案14和方案13中概述的通用合成路线的通用合成路线。r”'可以是任何合适的原子或基团,例如c1‑6烷基。在一些实施例中,r”'是甲基。应当理解,可以使用任何标准合成技术和任何可商购的试剂实现方案14和方案13之间的
‑
coor”'基团向
‑
cooh基团的转化。
[0409]
方案19
[0410][0411]
方案19描述了组合方案16和方案13中概述的通用合成路线的通用合成路线。r”'可以是任何合适的原子或基团,包括例如c1‑6烷基或c6‑
20
芳基。在一些实施例中,r”'是甲基。应当理解,可以使用任何标准合成技术和任何可商购的试剂实现
‑
卤代基团向
‑
coor”'基团的转化和
‑
coor”'基团向
‑
cooh基团的转化。
[0412]
以下方案20描述中间体和具有式(ii)结构的公开的化合物及其药学上可接受的盐。
[0413]
方案20
[0414][0415]
方案20描述了由胺和羰基化合物制备式(ii)化合物的通用合成路线。r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、x和y如上对于式(ii)化合物所定义。在一些实施例中,y是氮,使得胺为肼。在某些变体中,方案20的第二步中的酸是磷(v)酸,h3po4。
[0416]
本文公开了某些中间体,包括具有式(iii)结构的化合物:
[0417][0418]
或其药学上可接受的盐。x、y和r1如上式ia或式ib中所定义。r
y
是任何合适的原子或基团,包括例如c1‑8烷基。部分可以是任何合适的原子或基团,包括例如:卤素或
‑
nr
s
r
t
,其中每个r
s
和r
t
独立地是任何合适的原子或基团,包括例如保护基。在一些变体中,r
s
和r
t
不同。在其他变体中,r
s
和r
t
相同。在一个实施例中,
‑
nr
s
r
t
是
‑
no2。在一些实施例中,卤素是氯、溴或碘。
[0419]
提供了制备本文所述的化合物或其药学上可接受的盐的方法。仅用于说明的目的,应当理解,在一个实施例中,提供了一种制备式ia化合物或其药学上可接受的盐的方法,其中各种取代基如上所定义。该方法包括以下步骤:将式化合物与式化合物组合以产生式ia化合物。在一个这样的实施例中,该方法进一步包括将式化合物与式化合物组合以产生式化合物。注意,对于本文公开的所有化合物,a、x、y、r1、r5、r
c
、r
d
和卤代如上文通用方案中所定义。
[0420]
进一步说明性的实施例是制备式ia化合物或其药学上可接受的盐的方法,其中
‑
a
‑
r5部分是
‑
ch=chr5,使得该化合物具有式该方法包括以下步骤:将式化合物与式化合物组合以产生式化合物。在一个这样的实施例中,该方法进一步包括将式化合物与式
化合物组合以产生式化合物。在所述实施例中,然后使用标准合成技术和可商购的试剂将化合物转化成式化合物。在这样的实施例中,该方法进一步包括将式化合物与式p(or
y
)3化合物组合以产生式化合物。注意,对于本文公开的所有化合物,a、x、y、r1、r5、r
c
、r
d
、r
y
、r'和卤代如上文通用方案中所定义。
[0421]
本文包括并描述了其他这样的方法,并且在通用方案和特定实例中找到基础,就像对每种通用方案和实例分别具体地列出每种方法一样。
[0422]
实例
[0423]
实例1
[0424]
制备n
‑
(3
‑
(2
‑
环己基环丙基)
‑4‑
甲氧基苯基)甲磺酰胺(对映体a和对映体b)
[0425]
反应方案如下:
[0426][0427]
步骤1:n
‑
(3
‑
溴
‑4‑
甲氧基苯基)甲磺酰胺
[0428]
向烧瓶中装入2
‑
溴
‑4‑
碘苯甲醚(1.0g,3.0mmol),甲磺酰胺(1.4g,15mmol),碘化亚铜(590mg,3.03mmol),n,n
‑
二甲基甘氨酸(319mg,3.03mmol)和磷酸氢三钾(1.3g,6.1mmol),并用氮气吹扫烧瓶。然后加入n,n
‑
二甲基甘氨酸(10ml),并且将反应在100℃搅拌2小时。将反应混合物用水(10ml)和10%甘氨酸水溶液(10ml)稀释,并用1n hcl酸化至ph=1,用i
‑
proac(3x10ml)萃取,用无水mgso4干燥,浓缩并通过硅胶柱色谱(在庚烷中0%至100%的i
‑
proac)纯化得到标题化合物,为白色固体(598mg,70%产率)。lcms(esi+)m/z 280(m+h)
+
。
[0429]
步骤2:(e)
‑
n
‑
(3
‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯基)甲磺酰胺
[0430]
在小瓶中装入n
‑
(3
‑
溴
‑4‑
甲氧基苯基)甲磺酰胺(150mg,0.508mmol),2
‑
环己基乙烯基硼酸(206mg,1.27mmol),氯(2
‑
二环己基膦基
‑
2',6'
‑
二甲氧基
‑
1,1'
‑
联苯)(2'
‑
氨基
‑
1,1'
‑
联苯
‑2‑
基)钯(ii)(19mg,0.025mmol),2
‑
二环己基膦基
‑
2',6'
‑
二甲氧基联苯(11mg,
0.025mmol)和磷酸氢三钾(551mg,2.54mmol),然后用氮气吹扫小瓶。加入甲苯(1ml)和水(0.1ml),并将反应在100℃搅拌2小时。然后将反应物在1n hcl(5ml)和二氯甲烷(5ml)之间分配,将产物用二氯甲烷萃取并通过硅胶柱色谱(在庚烷中0%至100%的i
‑
proac)纯化得到标题化合物,为白色固体(157mg,>99%产率)。lcms(esi+)m/z 308(m
‑
h)
‑
。
[0431]
步骤3:n
‑
(3
‑
(2
‑
环己基环丙基)
‑4‑
甲氧基苯基)甲磺酰胺
[0432]
将二乙基锌(在己烷中的1.0mol/l,2.7ml,2.7mmol)加入到无水二氯甲烷(3ml)中,并将溶液冷却至0℃。将二氟乙酸(0.2ml,2.7mmol)在二氯甲烷(1ml)中的溶液滴加到二乙基锌溶液中,并将得到的混合物在0℃搅拌20分钟。然后加入二碘甲烷(0.2ml,2.7mmol)在二氯甲烷(1ml)中的溶液,并将反应在0℃再搅拌20分钟。然后将(e)
‑
n
‑
(3
‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯基)甲磺酰胺(168mg,0.543mmol)溶解于二氯甲烷(1ml)中,并加入到cf3co2znch2i溶液中。将所得溶液在室温搅拌30分钟,然后用饱和氯化铵水溶液(25ml)淬灭,用1n hcl酸化至ph=1,用二氯甲烷(3x10ml)萃取,用无水mgso4干燥,减压浓缩并通过反相制备型hplc纯化。然后通过手性超临界流体色谱(chiralpak as,等度15%meoh w/0.1%nh4oh,40℃,2.5min)分离对映体,得到标题化合物对映体a(2.8mg)和对映体b(2.6mg),为白色固体。
[0433]
n
‑
(3
‑
(2
‑
环己基环丙基)
‑4‑
甲氧基苯基)甲磺酰胺(对映体a):手性sfc峰1(rt=0.463min);1h nmr(400mhz,dmso
‑
d6)δ9.18(s,1h),6.96(dd,j=8.7,2.6hz,1h),6.88(d,j=8.7hz,1h),6.64(d,j=2.6hz,1h),3.78(s,3h),2.84(s,3h),1.90
–
1.53(m,6h),1.29
–
0.98(m,5h),0.82
–
0.63(m,4h);lcms(esi+)m/z 324.1(m+h)
+
。
[0434]
n
‑
(3
‑
(2
‑
环己基环丙基)
‑4‑
甲氧基苯基)甲磺酰胺(对映体b):手性sfc峰2(rt=0.510min);1h nmr(400mhz,dmso
‑
d6)δ9.18(s,1h),6.96(dd,j=8.6,2.6hz,1h),6.88(d,j=8.7hz,1h),6.64(d,j=2.6hz,1h),3.78(s,3h),2.84(s,3h),1.91
–
1.53(m,6h),1.26
–
0.99(m,5h),0.84
–
0.61(m,4h);lcms(esi+)m/z 324.1(m+h)
+
。
[0435]
实例2
[0436]
(e)
‑
n
‑
(3
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑4‑
甲氧基苯基)甲磺酰胺)
[0437]
反应方案如下:
[0438][0439]
步骤1:(2
‑
甲氧基
‑5‑
(甲基磺酰胺基)苄基)膦酸二乙酯
[0440]
向1l烧瓶中装入2
‑
(二乙氧基磷酰基甲基)
‑4‑
碘
‑1‑
甲氧基苯(5.0g,13mmol),正甲基磺酰基氨基甲酸叔丁酯(7.1g,36mmol),碘化亚铜(2.5g,13mmol),n,n
‑
二甲基甘氨酸
(1.4g,13mmol)和磷酸氢三钾(11.4g,52.1mmol),并用氮气吹扫烧瓶。然后加入n,n
‑
二甲基乙酰胺(43ml),并再次用氮气吹扫烧瓶,并将空气球放置在反应容器的顶部以留出气体产生的空间。在110℃,将该反应混合物搅拌16小时。将所得混合物用10%甘氨酸水溶液稀释并用1n hcl酸化至ph 1,用二氯甲烷(3x50ml)萃取,用无水mgso4干燥,在减压下浓缩并通过硅胶柱色谱(在二氯甲烷中0%至10%的甲醇)纯化得到标题化合物,为白色固体(922mg,20%产率)。lcms(esi+)m/z 352(m+h)
+
。
[0441]
步骤2:(e)
‑
n
‑
(3
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑4‑
甲氧基苯基)甲磺酰胺)
[0442]
向(2
‑
甲氧基
‑5‑
(甲基磺酰胺基)苄基)膦酸二乙酯(70mg,0.20mmol)和4,4
‑
二氟环己烷
‑1‑
甲醛(44mg,0.30mmol)在无水四氢呋喃(1ml)中的混合物加入叔丁醇钾(56mg,0.50mmol),并将反应混合物在氮气下搅拌16小时。然后将所得混合物在1n hcl(5ml)和二氯甲烷(5ml)之间分配,将产物用二氯甲烷(5ml)萃取,在减压下浓缩并通过反相制备型hplc纯化(在水中的0.1%甲酸/乙腈30
‑
70,gemini
‑
nx c18 5um,110a)得到标题化合物,为白色固体(27mg,41%产率)。1h nmr(400mhz,dmso
‑
d6)δ9.28(s,1h),7.26(d,j=2.7hz,1h),7.07(dd,j=8.7,2.7hz,1h),6.95(d,j=8.8hz,1h),6.68
–
6.61(m,1h),6.13(dd,j=16.1,7.0hz,1h),3.77(s,3h),2.88(s,3h),2.35
–
2.28(m,1h),2.12
–
1.96(m,2h),1.98
–
1.88(m,1h),1.88
–
1.73(m,3h),1.51
–
1.34(m,2h);lcms(esi+)m/z 346.1(m+h)
+
。
[0443]
实例3
[0444]
(e)
‑
n
‑
(3
‑
(2
‑
环戊基乙烯基)
‑4‑
甲氧基苯基)甲磺酰胺
[0445][0446]
根据实例2的过程,使用环戊甲醛制备标题化合物(14mg,38%产率)。1h nmr(400mhz,dmso
‑
d6)δ9.27(s,1h),7.26(d,j=2.6hz,1h),7.06(dd,j=8.8,2.6hz,1h),6.95(d,j=8.8hz,1h),6.57(dd,j=16.0,1.1hz,1h),6.14(dd,j=16.0,7.9hz,1h),3.77(s,3h),2.88(s,3h),2.64
–
2.54(m,1h),1.89
–
1.75(m,2h),1.75
–
1.50(m,4h),1.43
–
1.27(m,2h);lcms(esi+)m/z 296.1(m+h)
+
。
[0447]
实例4
[0448]
(e)
‑
n
‑
(3
‑
(3
‑
环己基丙
‑1‑
烯
‑1‑
基)
‑4‑
甲氧基苯基)甲磺酰胺
[0449][0450]
根据实例2的过程,使用2
‑
环己基乙醛制备标题化合物(2.6mg,7%产率)。lcms(esi+)m/z 324.1(m+h)
+
。
[0451]
实例5
[0452]
(e)
‑
n
‑
(3
‑
(2
‑
(4,4
‑
二甲基环己基)乙烯基)
‑4‑
甲氧基苯基)甲磺酰胺
[0453][0454]
根据实例2的过程,使用4,4
‑
二甲基环己烷
‑1‑
甲醛制备标题化合物(4.5mg,11%产率)。lcms(esi+)m/z 338.1(m+h)
+
。
[0455]
实例6
[0456]
(e)
‑
n
‑
(4
‑
甲氧基
‑3‑
(2
‑
(4
‑
甲基环己基)乙烯基)苯基)甲磺酰胺(非对映体a和非对映体b)
[0457][0458]
根据实例2的过程,使用4
‑
甲基环己烷
‑1‑
甲醛制备标题化合物。使用手性超临界流体色谱(chiralpak ad,等度20%meoh,40℃,2.5min)分离非对映异构体,得到非对映异构体a(4.0mg)和非对映异构体b(0.4mg)。
[0459]
(e)
‑
n
‑
(4
‑
甲氧基
‑3‑
(2
‑
(4
‑
甲基环己基)乙烯基)苯基)甲磺酰胺(非对映体a):手性sfc峰2(rt=0.846min);1h nmr(400mhz,dmso
‑
d6)δ9.28(s,1h),7.25(d,j=2.6hz,1h),7.06(dd,j=8.8,2.6hz,1h),6.95(d,j=8.8hz,1h),6.55(dd,j=16.3,1.3hz,1h),6.10(dd,j=16.1,7.0hz,1h),3.76(s,3h),2.88(s,3h),2.17
–
1.97(m,1h),1.84
–
1.63(m,4h),1.47
–
1.23(m,1h),1.23
–
1.07(m,2h),1.06
–
0.89(m,2h),0.88(d,j=6.5hz,3h);lcms(esi+)m/z 324.1(m+h)
+
。
[0460]
(e)
‑
n
‑
(4
‑
甲氧基
‑3‑
(2
‑
(4
‑
甲基环己基)乙烯基)苯基)甲磺酰胺(非对映体b):手性sfc峰1(rt=0.737min);lcms(esi+)m/z 324.1(m+h)
+
。
[0461]
实例7
[0462]
n
‑
(3
‑
(3
‑
(4
‑
氯苯基)环丁基)
‑4‑
甲氧基苯基)甲磺酰胺(非对映体a和非对映体b)
[0463]
反应方案如下:
[0464][0465]
步骤1:1
‑
(3
‑
溴环丁基)
‑4‑
氯苯
[0466]
在火焰干燥的烧瓶中装入[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
n1,n1
′
]双[3,5
‑
二氟
‑2‑
[5
‑
(三氟甲基)
‑2‑
吡啶基
‑
n]苯基
‑
c]六氟磷酸铱(iii)(256mg,0.228mmol)和碳酸铯(1.5g,4.6mmol)和3
‑
(4
‑
氯苯基)环丁烷
‑1‑
甲酸(1.0g,4.6mmol),并将烧瓶用氩气吹扫。然后加入氯苯(100ml)和溴代丙二酸二乙酯(8.5ml,46mmol),并且在超声处理下将氩气鼓泡通入反应混合物5分钟。然后用石蜡膜密封烧瓶,并用34w蓝色led和冷却风扇照射混合物4小时。然后将粗混合物通过硅胶短垫过滤,用二氯甲烷冲洗,减压浓缩,并通过硅胶柱色谱(100%庚烷)纯化,得到标题化合物(240mg,21%产率)。1h nmr(400mhz,氯仿
‑
d)δ7.42
–
7.24(m,2h),7.24
–
7.09(m,2h),4.74
–
4.40(m,1h),4.13
–
3.25(m,1h),3.24
–
2.99(m,1h),2.99
–
2.73(m,2h),2.73
–
2.47(m,1h)。
[0467]
步骤2:n
‑
(3
‑
(3
‑
(4
‑
氯苯基)环丁基)
‑4‑
甲氧基苯基)甲磺酰胺。
[0468]
在小瓶中装入n
‑
(3
‑
溴
‑4‑
甲氧基苯基)甲磺酰胺(100mg,0.34mmol),[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
n1,n1
′
]双[3,5
‑
二氟
‑2‑
[5
‑
(三氟甲基)
‑2‑
吡啶基
‑
n]苯基
‑
c]六氟磷酸铱(iii)(19mg,0.017mmol)和无水碳酸钠(72mg,0.68mmol),然后用氮气吹扫小瓶2分钟。然后加入1
‑
(3
‑
溴环丁基)
‑4‑
氯
‑
苯(92mg,0.37mmol)在无水1,2
‑
二甲氧基乙烷(2ml)中的溶液,然后加入三(三甲基甲硅基)硅烷(0.11ml,0.34mmol),并使氮气鼓泡通入所得混合物5分钟。在另一个小瓶中装入氯化镍(ii)乙二醇二甲醚复合物(3.8mg,0.017mmol)和4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶(4.6mg,0.017mmol),并用氮气吹扫小瓶5分钟。然后加入1,2
‑
二甲氧基乙烷(2ml),并在超声处理下将氮气鼓泡通入混合物5分钟。这导致形成绿色溶液。使用注射器将绿色溶液转移至第一小瓶中,并将所得混合物在氮气下进一步超声处理1分钟,并用石蜡膜密封。然后在室温搅拌反应混合物,并用34w蓝色led和冷却风扇照射16小时。通过暴露于空气淬灭反应,并在硅胶上浓缩。然后将其通过硅胶柱色谱纯化,并使用手性超临界流体色谱(chiralpak id,等度15%meoh w/0.1%nh4oh,40℃,2.5min)分离非对映异构体,得到非对映异构体a(9.3mg)和非对映异构体b(16.8mg)。
[0469]
n
‑
(3
‑
(3
‑
(4
‑
氯苯基)环丁基)
‑4‑
甲氧基苯基)甲磺酰胺(非对映异构体a):手性sfc峰2(rt=1.166min);1h nmr(400mhz,dmso
‑
d6)δ9.30(s,1h),7.39(s,4h),7.25(dd,j=2.7,0.8hz,1h),7.07(dd,j=8.6,2.6hz,1h),6.92(d,j=8.8hz,1h),3.74(s,3h),3.73
–
3.69(m,1h),3.60
–
3.50(m,1h),2.90(s,3h),2.49
–
2.43(m,4h);lcms(esi+)m/z 365.1(m+h)
+
。
[0470]
n
‑
(3
‑
(3
‑
(4
‑
氯苯基)环丁基)
‑4‑
甲氧基苯基)甲磺酰胺(非对映异构体b):手性sfc峰1(rt=0.946min);1h nmr(400mhz,dmso
‑
d6)δ9.27(s,1h),7.38
–
7.31(m,2h),7.31
–
7.22(m,2h),7.13
–
7.02(m,2h),6.91(d,j=8.6hz,1h),3.76(s,3h),3.66
–
3.53(m,1h),3.53
–
3.43(m,1h),2.88(s,3h),2.77
–
2.62(m,2h),2.11
–
1.94(m,2h);lcms(esi+)m/z 365.1(m+h)
+
。
[0471]
实例8
[0472]
n
‑
(3
‑
(3
‑
(3
‑
氟苯基)环丁基)
‑4‑
甲氧基苯基)甲磺酰胺(非对映体a和非对映体b)
[0473]
反应方案如下:
[0474][0475]
步骤1:1
‑
(3
‑
溴环丁基)
‑3‑
氟苯
[0476]
根据实例7的过程,使用3
‑
(3
‑
氟苯基)环丁烷
‑1‑
甲酸制备标题化合物(16%产率,挥发性化合物)。1h nmr(400mhz,氯仿
‑
d)δ7.31
–
7.23(m,1h),7.01
–
6.95(m,1h),6.95
–
6.87(m,2h),4.66
–
4.40(m,1h),4.12
–
3.23(m,1h),3.12
–
3.00(m,1h),2.92
–
2.75(m,2h),2.70
–
2.53(m,1h)。
[0477]
步骤2:n
‑
(3
‑
(3
‑
(3
‑
氟苯基)环丁基)
‑4‑
甲氧基苯基)甲磺酰胺
[0478]
根据实例7的过程,使用1
‑
(3
‑
溴环丁基)
‑3‑
氟苯制备标题化合物,得到非对映体a(6.7mg)和非对映体b(7.2mg)。
[0479]
n
‑
(3
‑
(3
‑
(3
‑
氟苯基)环丁基)
‑4‑
甲氧基苯基)甲磺酰胺(非对映异构体a):手性sfc峰2(rt=1.373min);lcms(esi+)m/z 350.1(m+h)
+
。
[0480]
n
‑
(3
‑
(3
‑
(4
‑
氯苯基)环丁基)
‑4‑
甲氧基苯基)甲磺酰胺(非对映异构体b):手性sfc峰1(rt=1.116min);1h nmr(400mhz,dmso
‑
d6)δ9.27(s,1h),7.35(m,j=7.9,6.2hz,1h),7.13
–
6.97(m,5h),6.91(d,j=8.6hz,1h),3.76(s,3h),3.66
–
3.45(m,2h),2.88(s,3h),2.70(qd,j=7.8,2.7hz,2h),2.12
–
2.01(m,2h);lcms(esi+)m/z 350.1(m+h)
+
。
[0481]
实例9
[0482]3‑
(3
‑
(4
‑
氯苯基)环丁基)
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺(非对映体a和非对映体b)
[0483]
总体反应方案如下:
[0484][0485]
步骤1:3
‑
溴
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺
[0486]
向烧瓶中装入3
‑
溴
‑4‑
甲氧基苯甲酸(250mg,1.1mmol),n,n
‑
二甲基甲酰胺(4ml)和n,n
‑
二异丙基乙胺(0.57ml,3.24mmol),然后加入1
‑
[双(二甲基氨基)亚甲基]
‑
1h
‑
1,2,3
‑
三唑并[4,5
‑
b]吡啶鎓3
‑
氧化六氟磷酸盐(636mg,1.62mmol),并将溶液搅拌1分钟直至溶解。然后加入异丙胺(0.23ml,2.7mmol),并将反应在室温搅拌1小时。将反应物在饱和nahco3水溶液(10ml)和i
‑
proac(10ml)之间分配,用i
‑
proac(10ml)萃取,用水和盐水洗涤,用无水mgso4干燥,减压浓缩并通过硅胶柱色谱(在庚烷中0%至100%的i
‑
proac)纯化得到标题化合物,为白色固体(253mg,86%产率)。lcms(esi+)m/z 272(m+h)
+
。
[0487]
步骤2:3
‑
(3
‑
(4
‑
氯苯基)环丁基)
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺
[0488]
根据实例7的过程,使用3
‑
溴
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺制备标题化合物,得到非对映体a(23.4mg)和非对映体b(14.4mg)。3
‑
(3
‑
(4
‑
氯苯基)环丁基)
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺(非对映体a):手性sfc峰2(rt=1.134min);1h nmr(400mhz,dmso
‑
d6)δ8.04(d,j=7.8hz,1h),7.73(dd,j=8.5,2.2hz,1h),7.66(dd,j=2.3,0.8hz,1h),7.40
–
7.33(m,2h),7.33
–
7.24(m,2h),6.98(d,j=8.5hz,1h),4.16
–
4.02(m,1h),3.83(s,3h),3.67
–
3.54(m,1h),3.54
–
3.43(m,1h),2.78
–
2.62(m,2h),2.20
–
2.04(m,2h),1.15(d,j=6.6hz,6h);lcms(esi+)m/z 358.1(m+h)
+
。
[0489]3‑
(3
‑
(4
‑
氯苯基)环丁基)
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺
[0490]
(非对映异构体b):手性sfc峰1(rt=0.889min);1h nmr(400mhz,dmso
‑
d6)δ8.09(d,j=7.8hz,1h),7.87(dd,j=2.3,0.8hz,1h),7.76(dd,j=8.5,2.3hz,1h),7.40(s,4h),7.00(d,j=8.6hz,1h),4.18
–
4.07(m,1h),3.81(s,3h),3.80
–
3.72(m,1h),3.67
–
3.51(m,1h),3.29
–
3.24(m,2h),2.63
–
2.53(m,2h),1.18(d,j=6.6hz,6h);lcms(esi+)m/z 358.1(m+h)
+
。
[0491]
实例10至12
[0492]
实例10至12的总体反应方案如下:
[0493]
实例10
‑
12
[0494][0495]
实例10
[0496]
(e)
‑
n
‑
(5
‑
(4
‑
氯苯乙烯基)
‑2‑
氟
‑4‑
甲氧基苯基)环丙磺酰胺
[0497][0498]
步骤1:1
‑
溴
‑4‑
氟
‑2‑
甲氧基
‑5‑
硝基苯和1
‑
溴
‑2‑
氟
‑4‑
甲氧基
‑5‑
硝基
‑
苯
[0499]
在0℃下,向1
‑
溴
‑
2,4
‑
二氟
‑5‑
硝基苯(12.1g,50.8mmol)在meoh(100ml)中的搅拌溶液加入在meoh(12ml,53.4mmol,12ml)中的25%甲醇钠,并且然后将反应混合物在0℃搅拌2h,然后在rt搅拌20h。减压去除挥发性溶剂,并将所得残余物在
i
proac和水之间分配。将有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,得到10.9g(86%产率)的1
‑
溴
‑4‑
氟
‑2‑
甲氧基
‑5‑
硝基
‑
苯和1
‑
溴
‑2‑
氟
‑4‑
甲氧基
‑5‑
硝基
‑
苯的混合物(约2:1比例)。1
‑
溴
‑4‑
氟
‑2‑
甲氧基
‑5‑
硝基苯:1h nmr(400mhz,cdcl3)δ8.36(d,j=8.0hz,1h),6.77(d,j=12.3hz,1h),4.00(s,3h);1
‑
溴
‑2‑
氟
‑4‑
甲氧基
‑5‑
硝基
‑
苯:1hnmr(400mhz,cdcl3)δ8.16(d,j=7.1hz,1h),6.89(d,j=9.8hz,1h),3.97(s,3h)。
[0500]
步骤2:5
‑
溴
‑2‑
氟
‑4‑
甲氧基苯胺和5
‑
溴
‑4‑
氟
‑2‑
甲氧基苯胺
[0501]
向1
‑
溴
‑4‑
氟
‑2‑
甲氧基
‑5‑
硝基
‑
苯和1
‑
溴
‑2‑
氟
‑4‑
甲氧基
‑5‑
硝基
‑
苯(约2:1比例)(6.1g,24.3mmol)溶于etoh(162ml)中的混合物加入在水(49ml)中的氯化铵(13.0g,243.2mmol),然后加入铁粉(6.8g,121.6mmol)。将反应混合物在回流下搅拌20h。将反应冷却至rt,并将反应通过垫过滤。用dcm和etoh充分冲洗垫,并将滤液用饱和nahco3水溶液碱化直到ph约为7,然后用
i
proac(3x)萃取。将合并的有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/己烷)纯化,以回收3.3g(61%产率)的5
‑
溴
‑2‑
氟
‑4‑
甲氧基苯胺,然后回收2.0g(36%产率)的5
‑
溴
‑4‑
氟
‑2‑
甲氧基苯胺。5
‑
溴
‑2‑
氟
‑4‑
甲氧基苯胺:1h nmr(400mhz,cdcl3)δ7.00(d,j=9.3hz,1h),6.66(d,j=12.1hz,1h),3.80(s,3h),3.47(s,2h);ms(esi+)m/z 220/222(m+h)
+
。5
‑
溴
‑4‑
氟
‑2‑
甲氧基苯胺:1h nmr(400mhz,cdcl3)δ6.82(d,j=6.9hz,1h),6.61(d,j=10.0hz,1h),3.83(s,3h),3.68(s,2h);ms(esi+)m/z 220/222(m+h)
+
。
[0502]
步骤3:(e)
‑5‑
(4
‑
氯苯乙烯基)
‑2‑
氟
‑4‑
甲氧基苯胺
[0503]
在螺口烧瓶中装入5
‑
溴
‑2‑
氟
‑4‑
甲氧基苯胺(1.02g,4.6mmol),2
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷(1.6g,6.0mmol),磷酸钾(2.0g,9.2mmol,2022.4mg),sphos预催化剂g3(0.36g,0.46mmol),sphos(0.34g,0.79mmol),甲苯(15ml)和水(1.5ml)。将反应混合物用真空吹扫/用n2(3x)回填。将烧瓶用盖拧紧,并将反应混合物在95℃搅拌18h。冷却的反应混合物用
i
proac稀释,并通过垫过滤。用另外的
i
proac冲洗垫。将滤液用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化以回收(e)
‑5‑
(4
‑
氯苯乙烯基)
‑2‑
氟
‑4‑
甲氧基苯胺(1.14g,89%产率)。ms(esi+)m/z278(m+h)
+
。
[0504]
步骤4:(e)
‑
n
‑
(5
‑
(4
‑
氯苯乙烯基)
‑2‑
氟
‑4‑
甲氧基苯基)环丙磺酰胺
[0505]
向5
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑2‑
氟
‑4‑
甲氧基
‑
苯胺(181mg,0.46mmol)在dcm(11ml)中的搅拌溶液加入吡啶(0.18ml,2.3mmol),然后加入环丙磺酰氯(70mg,0.50mmol),
并将反应混合物在rt搅拌4天。反应用1n hcl淬灭,并且然后用iproac稀释。将得到的白色沉淀物过滤,并将滤液用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,然后通过反相制备型hplc纯化,得到47mg(27%收率)的标题化合物,为白色固体。1h nmr(400mhz,dmso
‑
d6)δ9.35(s,1h),7.63
–
7.56(m,3h),7.45
–
7.39(m,2h),7.32(d,j=16.5hz,1h),7.16(d,j=16.6hz,1h),7.05(d,j=12.1hz,1h),3.88(s,3h),2.66
–
2.56(m,1h),1.00
–
0.91(m,2h),0.88
–
0.79(m,2h);ms(esi+)m/z399(m+h)
+
。
[0506]
实例11
[0507]
n
‑
(4
‑
氟
‑
4'
‑
异丙基
‑6‑
甲氧基
‑
[1,1'
‑
联苯]
‑3‑
基)环丙磺酰胺
[0508][0509]
根据实施例10的过程,用(4
‑
异丙基苯基)硼酸代替2
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷)制备标题化合物,制备实例11(84mg,23%)。1h nmr(400mhz,dmso
‑
d6)δ9.34(s,1h),7.39
–
7.32(m,2h),7.31
–
7.25(m,2h),7.23(d,j=9.0hz,1h),7.09(d,j=12.2hz,1h),3.78(s,3h),2.97
–
2.85(m,1h),2.65
–
2.57(m,1h),1.23(d,j=6.8hz,6h),0.97
–
0.91(m,2h),0.87
–
0.81(m,2h);ms(esi+)m/z 381(m+nh4)
+
。hrms(esi
‑
):c
19
h
21
fno3s[m
‑
h]
‑
的m/z计算值362.1226;实测值362.0941。
[0510]
实例12
[0511]
n
‑
(4
‑
氟
‑
4'
‑
异丙基
‑6‑
甲氧基
‑
[1,1'
‑
联苯]
‑3‑
基)甲磺酰胺。
[0512][0513]
根据实例10的过程,用甲磺酸酐代替环丙烷磺酰氯制备标题化合物,制备实例12(71mg,42%)。1h nmr(400mhz,dmso
‑
d6)δ9.35(s,1h),7.40
–
7.18(m,5h),7.11(d,j=12.3hz,1h),3.78(s,3h),2.98(s,3h),2.97
–
2.85(m,1h),1.23(d,j=6.9hz,6h);ms(esi+)m/z 355.1(m+nh4)
+
。hrms(esi
‑
):c
17
h
19
fno3s[m
‑
h]
‑
的m/z计算值336.1070;实测值336.0805。
[0514]
实例13
[0515]
n
‑
(5
‑
((1r,3s)
‑3‑
(4
‑
氯苯基)环丁基)6
‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0516]
实例13的总体反应方案如下:
[0517][0518]
步骤1:3
‑
(4
‑
氯苯基)环丁
‑1‑
酮
[0519]
2l,4颈圆底烧瓶配有氩气入口适配器、热电偶、顶置式搅拌器、装有干燥管的冷凝器和加料漏斗。将二甲基乙酰胺(72.5ml,779mmol,1.2eq)加入到烧瓶中,并溶解在dcm(1.21l)中。将混合物在冰水浴中冷却。通过加料漏斗缓慢加入三氟甲磺酸酐(153ml,909mmol,1.4eq),同时保持内部温度低于8℃。该添加花费约1.5小时,并导致形成浆液。将4
‑
氯苯乙烯(90.0g,649mmol,1eq)和2,4,6
‑
三甲基吡啶(120ml,909mmol,1.4eq)溶于dcm(180ml)中。然后将所得溶液通过加料漏斗在约2小时内滴加到反应混合物中,同时保持温度低于10℃。添加完成后,反应混合物更容易搅拌。然后用罩式电热器将反应混合物加热至温和回流14小时,得到的内部温度为约87℃。浓缩反应混合物,并将残余物与ccl4(405ml)和水(405ml)一起加热回流18小时。所产生的包含棕色浆状油状物质的多相混合物通过过滤,但油状物质仍通过过滤介质。加入环己烷(500ml),并将混合物转移至分液漏斗中。底部相为深棕色,并且也包含糖浆成分,并且顶部有机相为浅黄色。使各层分离,并且水相用环己烷(3x)萃取。合并有机萃取物,并通过硅胶垫过滤。将得到的滤液浓缩,得到3
‑
(4
‑
氯苯基)环丁
‑1‑
酮(38.3g,32.7%产率),为浅琥珀色油状物。1h nmr(400mhz,cd2cl2)δ7.36
–
7.31(m,2h),7.29
–
7.24(m,2h),3.74
–
3.59(m,1h),3.54
–
3.41(m,2h),3.25
–
3.13(m,2h)。
[0520]
步骤2:(1s,3s)
‑3‑
(4
‑
氯苯基)环丁
‑1‑
醇
[0521]
将3
‑
(4
‑
氯苯基)环丁
‑1‑
酮(38.3g,212mmol,1eq)溶于meoh(383ml)。逐份添加硼氢化钠(2.65g,70mmol,0.33eq),同时在添加期间将温度保持在20℃至25℃之间。对反应混合物浓缩。加入水(200ml)和乙醚(300ml),并将混合物转移至分液漏斗中。弃去水层,有机层用盐水洗涤,经硫酸钠干燥、过滤并浓缩,得到(1s,3s)
‑3‑
(4
‑
氯苯基)环丁
‑1‑
醇(36g,93%产率),为浅黄色油状物。1h nmr表明纯度很高,如先前文献报道dr约为9:1。1h nmr(400mhz,dmso
‑
d6)δ7.34(d,j=8.4hz,2h),7.27
–
7.21(m,2h),5.09(d,j=7.2hz,1h),4.02(sxt,j=7.4hz,1h),2.94
–
2.79(m,1h),2.64
–
2.54(m,2h),1.90
–
1.79(m,2h).
[0522]
步骤3:1
‑
((1r,3r)
‑3‑
溴环丁基)
‑4‑
氯苯(95:5反式:顺式)
[0523]
将(1s,3s)
‑3‑
(4
‑
氯苯基)环丁
‑1‑
醇(10.0g,54.7mmol,1eq)溶于无水thf(400ml)。加入三苯膦(53.0g,202mmol,3.69eq),然后加入无水溴化锌(15.2g,67.3mmol,1.23eq)在无水thf(100ml)中的溶液。最后,将溶于无水thf(100ml)中的diad(39.8ml,3.69当量)加入到反应混合物中。在完成添加后的几分钟内,开始形成白色固体。将反应混合物
在室温搅拌过夜。将所得白色固体在硅胶塞上过滤。将滤液浓缩并用己烷处理以沉淀三苯基膦氧化物,将其通过过滤去除。浓缩所得滤液,并在硅胶柱(120g)上用100%己烷进行色谱分离。合并不纯的级分,并在相同条件下通过柱色谱纯化。合并所有纯级分并浓缩,得到油状的1
‑
((1r,3r)
‑3‑
溴环丁基)
‑4‑
氯苯(95:5反式:顺式),其在冷却后结晶(6.8g,50.6%,95:5反式:顺式)。
[0524]
步骤4:n
‑
(5
‑
溴
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0525]
在0℃,向5
‑
溴
‑6‑
甲氧基
‑
吡啶
‑3‑
胺(20.0g,98.5mmol)在dcm(100ml)中的搅拌溶液加入吡啶(14.3ml,177mmol),然后加入甲磺酰氯(8.4ml,108.4mmol),并将反应混合物在室温搅拌19h。反应用
i
proac稀释。将有机相用10%hcl水溶液、水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,并且然后在乙醚中研磨,得到n
‑
(5
‑
溴
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺(23.8g,86%),为粉红色固体。1h nmr(400mhz,cdcl3)δ8.02(d,j=2.5hz,1h),7.87(d,j=2.5hz,1h),6.43(s,1h),4.01(s,3h),3.02(s,3h);ms(esi+)m/z 282/283(m+h)
+
。
[0526]
步骤5:n
‑
(5
‑
((1r,3r)
‑3‑
(4
‑
氯苯基)环丁基)
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0527]
在烘箱干燥的小瓶中装入n
‑
(5
‑
溴
‑6‑
甲氧基吡啶基)甲磺酰胺(300.0mg,1.07mmol),(ir[df(cf3)ppy]2(dtbpy))pf6(18.0mg,0.016mmol)和无水碳酸钠(226.2mg,2.13mmol),并用氮气吹扫2分钟。然后将1
‑
((1r,3r)
‑3‑
溴环丁基)
‑4‑
氯苯(95:5反式:顺式)(340.6mg,1.39mmol)在无水dme(7.1ml)中的溶液添加到上述小瓶中,然后加入三(三甲基甲硅基)硅烷(0.34ml,1.07mmol)。然后将氮气鼓泡通入所得混合物5分钟。在另一个干燥的小瓶中装入氯化镍(ii)乙二醇二甲醚复合物(12.1mg,0.053mmol)和4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶(14.3mg,0.053mmol),并用氮气吹扫固体5分钟。加入无水dme(7.1ml),并在超声处理下将氮气鼓泡通入反应混合物5分钟,直到形成绿色的活性ni
‑
络合的催化溶液。将溶液注射出并转移至第一小瓶中,并将所得混合物在氮气下进一步超声处理1分钟。然后将反应混合物在室温搅拌,并用34w led和冷却风扇照射6h。将反应混合物通过垫过滤,并用dcm充分冲洗。在减压条件下浓缩滤液。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,然后进行sfc手性分离(chiralpak ad,等度25%meoh w/0.1%nh4oh,40℃,2.5min)。收集第二个峰,得到标题化合物(81.3mg,20.8%),为白色固体。手性sfc峰2(rt=0.902min),%ee=100;1nmr(400mhz,dmso
‑
d6)δ9.47(s,1h),7.91(d,j=2.5hz,1h),7.61(dd,j=2.7,0.9hz,1h),7.38(s,4h),3.85(s,3h),3.69
–
3.59(m,1h),3.59
–
3.49(m,1h),2.97(s,3h),2.49
–
2.46(m,4h);ms(esi+)m/z 367(m+h)
+
。
[0528]
实例14至17
[0529]
实例14至17的总体反应方案如下:
[0530][0531]
实例14
[0532]
(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0533][0534]
步骤1:5
‑
溴
‑2‑
甲氧基
‑3‑
甲基吡啶
[0535]
向5
‑
溴
‑2‑
氯
‑3‑
甲基吡啶(300g,1.45mol)在meoh(3l)中的溶液加入新鲜制备的甲醇钠(156g,2.9mol),并将反应混合物加热至回流并搅拌过夜。将反应混合物用乙酸(600ml)淬灭并减压浓缩。将粗混合物用乙酸乙酯(3l)稀释,并用水(3l)洗涤。将水层用乙酸乙酯(3l)萃取,并将合并的有机层用盐水(3l)洗涤,用无水mgso4干燥并且在减压下蒸发,得到粗制的5
‑
溴
‑2‑
甲氧基
‑3‑
甲基吡啶(220g,75%)。1h nmr(300mhz,cdcl3)δ(s,1h),7.47(s,1h),3.93(s,3h),2.05(s,3h)。
[0536]
步骤2:5
‑
溴
‑3‑
(溴甲基)
‑2‑
甲氧基吡啶
[0537]
向5
‑
溴
‑2‑
甲氧基
‑3‑
甲基吡啶(40g,198mmol)在ccl4(400ml)中的溶液加入nbs(38.7g,217.4mmol)和aibn(1.62g,6.1mmol),并将反应混合物加热至回流并搅拌2小时。减压浓缩反应混合物,得到粗残余物。加入石油醚(800ml),并将反应混合物过滤以去除固体。减压浓缩滤液,得到粗残余物,将其在石油醚中研磨,得到5
‑
溴
‑3‑
(溴甲基)
‑2‑
甲氧基吡啶(22g,40%),为灰白色固体。1h nmr(300mhz,cdcl3)δ(s,1h),7.73(s,1h),4.43(s,2h),4.00(s,3h)。
[0538]
步骤3:((5
‑
溴
‑2‑
甲氧基吡啶
‑3‑
基)甲基)膦酸二乙酯
[0539]
向5
‑
溴
‑3‑
(溴甲基)
‑2‑
甲氧基吡啶(22g,78.5mmol)在1,4
‑
二噁烷(110ml)中的溶液加入亚磷酸三乙酯(26g,217.4mmol),并将反应混合物加热至回流并搅拌过夜。将反应混合物减压浓缩以去除挥发性溶剂,并将产物蒸馏以提供((5
‑
溴
‑2‑
甲氧基吡啶
‑3‑
基)甲基)膦酸二乙酯(25g,94%),为无色油状物。1h nmr(300mhz,dmso
‑
d6)δ(s,1h),7.70(s,1h),4.09(q,j=7.2hz,4h),3.94(s,3h),3.15(d,j=21.9hz,2h),1.27(t,j=7.2hz,6h));ms
(esi+)m/z 337.8(m+h)
+
。
[0540]
步骤4:(e)
‑5‑
溴
‑3‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑2‑
甲氧基吡啶
[0541]
向4,4
‑
二氟环己烷甲醛(1070mg,7.23mmol)和5
‑
溴
‑3‑
(二乙氧基磷酰基甲基)
‑2‑
甲氧基吡啶(820mg,2.41mmol)在无水thf(13.4ml)中的混合物中加入叔丁醇钾(1910mg,16.9mmol),并将反应混合物在氮气下搅拌2h。将反应混合物用
i
proac和水稀释。将有机相用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,得到(e)
‑5‑
溴
‑3‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑2‑
甲氧基吡啶(258mg,32.2%)。ms(esi+)m/z 332/334(m+h)
+
。
[0542]
步骤5:(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)
‑
1,1
‑
二苯基甲亚胺
[0543]
在20ml小瓶中放入5
‑
溴
‑3‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑2‑
甲氧基吡啶(257.0mg,0.77mmol),二苯甲胺(0.18ml,1.08mmol),叔丁醇钠(148.7mg,1.55mmol),双(2
‑
二苯基膦基苯基)醚(41.7mg,0.077mmol,41.66mg)和三(二苄基内酯)二钯(0)(35.4mg,0.039mmol)。加入脱气的甲苯(5.2ml)。将小瓶真空吹扫/用n2(3x)回填并加盖。将反应混合物在120℃搅拌40h。反应混合物用
i
proac和水稀释,并且然后通过垫过滤。分离两相层。将有机相用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗品通过柱色谱(sio2:iproac/庚烷)纯化,得到(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)
‑
1,1
‑
二苯基甲亚胺(165mg,49.3%产率),为黄色油状物。ms(esi+)m/z 433(m+h)
+
。
[0544]
步骤6:(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
胺
[0545]
向溶于thf(7.7ml)中的(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)
‑
1,1
‑
二苯基甲亚胺(165mg,0.382mmol)加入1n hcl(3.8ml,3.87mmol),并将反应混合物在rt搅拌2h。减压去除挥发性溶剂,并将所得粗产物用dcm稀释并用1n naoh碱化直至ph约为8。反应混合物用dcm(3x)萃取。将合并的有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗品通过柱色谱(sio2:iproac/庚烷)纯化,得到(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)
‑
1,1
‑
二苯基甲亚胺(88.4mg,86.1%),为白色固体。ms(esi+)m/z 269(m+h)
+
。
[0546]
步骤7:(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0547]
在0℃,向5
‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑6‑
甲氧基
‑
吡啶
‑3‑
胺(88.4mg,0.33mmol)在dcm(0.33ml)中的搅拌溶液加入吡啶(0.05ml,0.59mmol),然后加入在dcm(1ml)中的甲磺酰氯(1.100equiv,0.3624mmol,41.52mg,0.0281ml),并将反应混合物在室温搅拌19h。反应用iproac稀释。将有机相用10%hcl水溶液、水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:iproac/庚烷)纯化,并且然后在乙醚和己烷中研磨直至白色固体沉淀。过滤固体,并在高真空下抽干,得到标题化合物(48.7mg,42.7%)。1h nmr(400mhz,dmso
‑
d6)δ9.47(s,1h),7.91(d,j=2.6hz,1h),7.64(d,j=2.5hz,1h),6.50(dd,j=16.3,1.2hz,1h),6.33(dd,j=16.2,6.9hz,1h),3.88(s,3h),2.96(s,3h),2.40
–
2.29(m,1h),2.11
–
1.98(m,2h),1.97
–
1.90(m,1h),1.90
–
1.77(m,3h),1.50
–
1.36(m,2h);ms(esi+)m/z 347.1(m+h)
+
。
[0548]
实例15
[0549]
(e)
‑
n
‑
(6
‑
甲氧基
‑5‑
(4
‑
甲基戊
‑1‑
烯
‑1‑
基)吡啶
‑3‑
基)甲磺酰胺
[0550][0551]
按照实例14的过程,用3
‑
甲基丁醛代替4,4
‑
二氟环己烷
‑
甲醛,制备实例15(68mg,35.2%)。1h nmr(400mhz,dmso
‑
d6)δ9.46(s,1h),7.90(d,j=2.6hz,1h),7.64(d,j=2.6hz,1h),6.50
–
6.41(m,1h),6.33(dt,j=15.8,7.1hz,1h),3.88(s,3h),2.96(s,3h),2.13
–
2.07(m,2h),1.77
–
1.65(m,1h),0.91(d,j=6.6hz,6h);ms(esi+)m/z 285.1(m+h)
+
。
[0552]
实例16
[0553]
n
‑
(6
‑
甲氧基
‑5‑
((e)
‑2‑
((1r,4r)
‑4‑
(三氟甲基)环己基)乙烯基)吡啶
‑3‑
基)甲磺酰胺
[0554][0555]
步骤1:5
‑
溴
‑2‑
甲氧基
‑3‑
((e)
‑2‑
((1r,4r)
‑
4(三氟甲基)环己基)乙烯基)吡啶
[0556]
向5
‑
溴
‑3‑
(二乙氧基磷酰基甲基)
‑2‑
甲氧基吡啶(750mg,2.22mmol)在thf(12.3ml)中的混合物中加入氢化钠(在矿物油中60质量%)(310mg,7.76mmol),并将反应混合物在rt在氮气下搅拌30min。然后加入溶解在thf(5ml)中的4
‑
(三氟甲基)环己烷甲醛(799mg,4.43mmol)的溶液,并将反应混合物在rt搅拌16h。用水淬灭反应混合物,倒入
i
proac中。将有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,得到5
‑
溴
‑2‑
甲氧基
‑3‑
((e)
‑2‑
((1r,4r)
‑4‑
(三氟甲基)环己基)乙烯基)吡啶(694mg,85.9%)。1hnmr(400mhz,cdcl3)δ8.04(d,j=2.5hz,1h),7.71(d,j=2.3hz,1h),6.47(dd,j=16.1,1.3hz,1h),6.18(dd,j=16.1,7.0hz,1h),3.94(s,3h),2.20
–
2.08(m,1h),2.05
–
1.90(m,5h),1.46
–
1.32(m,2h),1.28
–
1.14(m,2h);ms(esi+)m/z 364/365(m+h)
+
。
[0557]
步骤2至4
[0558]
按照实例14的过程,制备5
‑
溴
‑2‑
甲氧基
‑3‑
((e)
‑2‑
((1r,4r)
‑
4(三氟甲基)环己基)乙烯基)吡啶(64mg,55%)。1h nmr(400mhz,dmso
‑
d6)δ9.47(s,1h),7.90(d,j=2.6hz,1h),7.63(d,j=2.6hz,1h),6.46(dd,j=16.2,1.2hz,1h),6.28(dd,j=16.2,6.8hz,1h),3.88(s,3h),2.95(s,3h),2.31
–
2.10(m,2h),1.96
–
1.92(m,4h),1.41
–
1.18(m,4h);ms(esi+)m/z 379.1(m+h)
+
。
[0559]
实例17
[0560]
(e)
‑
n
‑
(6
‑
甲氧基
‑5‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶
‑3‑
基)甲磺酰胺
[0561][0562]
按照实例14的过程,用螺[2.3]己烷
‑5‑
甲醛代替4
‑
(三氟甲基)环己烷甲醛,制备实例17(3.5mg,5%)。1h nmr(400mhz,dmso
‑
d6)δ9.49(s,1h),7.90(d,j=2.5hz,1h),7.66(d,j=2.6hz,1h),6.55(dd,j=16.0,7.3hz,1h),6.43(dd,j=16.0,1.0hz,1h),3.88(s,3h),3.32
–
3.21(m,1h),2.96(s,3h),2.27
–
2.11(m,4h),0.50
–
0.43(m,2h),0.42
–
0.35(m,2h);ms(esi+)m/z 309.1(m+h)
+
。
[0563]
实例18
[0564]
实例18的总体反应方案如下:
[0565][0566]
步骤1:2
‑
乙氧基
‑5‑
碘烟酸异丁酯
[0567]
在0℃在氮气下,向2
‑
乙氧基
‑5‑
碘
‑
吡啶
‑3‑
甲酸(1000mg,3.41mmol),三乙胺(071ml,5.11mmol)和dmap(41.7mg,0.34mmol)在无水thf(13.6ml)中的搅拌溶液滴加氯甲酸异丁酯(536mg,3.92mmol)。将反应混合物在rt搅拌3h。用水淬灭反应混合物,并用
i
proac稀释。将有机层用饱和nh4cl水溶液、饱和nahco3水溶液、水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,得到2
‑
乙氧基
‑5‑
碘烟酸异丁酯(710mg,59.6%),为白色固体。1h nmr(400mhz,cdcl3)δ8.43(d,j=2.5hz,1h),8.34(d,j=2.4hz,1h),4.43(q,j=7.1hz,2h),4.08(d,j=6.6hz,2h),2.04(dq,j=13.3,6.7hz,1h),1.41(t,j=7.1hz,3h),1.01(d,j=6.8hz,6h)。
[0568]
步骤2:(2
‑
乙氧基
‑5‑
碘吡啶
‑3‑
基)甲醇
[0569]
在
‑
78℃,向在无水dcm(20.3ml)中的2
‑
乙氧基
‑5‑
碘
‑
吡啶
‑3‑
甲酸异丁酯(710mg,2.03mmol),滴加在庚烷(4.1ml,4.06mmol)中的dibal(1.0mol/l)。将反应混合物在
‑
78℃搅拌1h,并且然后在rt搅拌过夜。通过fieser方法对反应混合物进行后处理,得到(2
‑
乙氧基
‑
5
‑
碘吡啶
‑3‑
基)甲醇(514.2,90.6%),为白色固体。1h nmr(400mhz,cdcl3)δ8.24(d,j=2.3hz,1h),7.84(dd,j=2.1,1.1hz,1h),4.60(dd,j=6.3,0.7hz,2h),4.39(q,j=7.1hz,2h),2.18(t,j=6.4hz,1h),1.39(t,j=7.1hz,3h)。
[0570]
步骤3:((2
‑
乙氧基
‑5‑
碘吡啶
‑3‑
基)甲基)膦酸二乙酯
[0571]
在烘箱干燥的烧瓶中装入无水碘化锌(671mg,2.10mmol),并用氮气吹扫。加入无水甲苯(8.7ml),然后加入亚磷酸三乙酯(0.51ml,2.98mmol),并将得到的混合物在室温搅拌5分钟。然后加入溶于甲苯(8.7ml)和thf(用于溶解目的1ml)中的3(2
‑
乙氧基
‑5‑
碘吡啶
‑3‑
基)甲醇(489mg,1.75mmol),并将反应混合物在回流条件(120℃)下搅拌18h。将冷却的反应混合物用
i
proac/水稀释,并通过垫过滤,去除白色沉淀物。将滤液的有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷,然后用meoh/
i
proac)纯化,得到((2
‑
乙氧基
‑5‑
碘吡啶
‑3‑
基)甲基)膦酸二乙酯(492mg,70.4%),为油状物。1h nmr(400mhz,cdcl3)δ8.18(t,j=2.4hz,1h),7.80(t,j=2.6hz,1h),4.32(q,j=7.1hz,2h),4.09
–
4.01(m,4h),3.13(s,1h),3.07(s,1h)1.36(t,j=7.0hz,3h),1.25(t,j=7.1hz,6h)。
[0572]
步骤4:(e)
‑3‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑2‑
乙氧基
‑5‑
碘吡啶
[0573]
向3
‑
(二乙氧基磷酰基甲基)
‑2‑
乙氧基
‑5‑
碘
‑
吡啶(315mg,0.79mmol)在thf(5ml)中的混合物中加入氢化钠(在矿物油中60质量%)(111mg,2.76mmol),并将反应混合物在rt在氮气下搅拌30min。然后加入溶解在thf(5ml)中的4,4
‑
二氟环己烷甲醛(234mg,1.58mmol)的溶液,并将反应混合物在rt搅拌4h。用饱和nh4cl水溶液淬灭反应混合物,倒入
i
proac中。将有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,得到(e)
‑3‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑2‑
乙氧基
‑5‑
碘吡啶(304mg,98%)。ms(esi+)m/z 394(m+h)
+
。
[0574]
步骤5:(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
乙氧基吡啶
‑3‑
基)甲磺酰胺
[0575]
在小瓶中放入(e)
‑3‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑2‑
乙氧基
‑5‑
碘吡啶(150mg,0.38mmol),甲磺酰胺(181mg,1.91mmol),碘化亚铜(72.6mg,0.38mmol),磷酸钾(133mg,0.76mmol)和n,n
‑
二甲基甘氨酸(39.7mg,0.38mmol)。加入脱气的dma(5.5ml),并将反应混合物用真空吹扫/用氮气(3x)回填并加盖。将反应混合物在100℃搅拌3h,用
i
proac/水稀释,并通过垫过滤。将滤液的有机相用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷)纯化,然后通过反相制备型hplc纯化,得到13mg(9.5%)的标题化合物,为白色固体。1h nmr(400mhz,dmso
‑
d6)δ9.45(s,1h),7.89(d,j=2.6hz,1h),7.64(d,j=2.7hz,1h),6.50(dd,j=16.2,1.1hz,1h),6.34(dd,j=16.2,7.0hz,1h),4.32(q,j=7.0hz,2h),2.95(s,3h),2.35(d,j=9.5hz,1h),2.04(d,j=9.6hz,2h),1.99
–
1.77(m,4h),1.51
–
1.36(m,2h),1.33(t,j=7.0hz,3h);ms(esi+)m/z 361.1(m+h)
+
。
[0576]
实例19
[0577]
(e)
‑5‑
(4
‑
氯苯乙烯基)
‑
n
‑
(4
‑
羟丁
‑2‑
基)
‑6‑
甲氧基烟酰胺
[0578]
实例19的总体反应方案如下:
[0579][0580]
步骤1:(e)
‑5‑
(4
‑
氯苯乙烯基)
‑6‑
甲氧基烟酸甲酯
[0581]
在微波小瓶中装入5
‑
溴
‑6‑
甲氧基
‑
吡啶
‑3‑
甲酸甲酯(600mg,2.44mmol),2
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷(968mg,3.66mmol),与dcm络合的pd(dppf)cl2(62mg,0.073mmol),碳酸钠(440mg,4.14mmol),乙酸钾(440mg,4.47mmol),acn(16ml)和水(4ml)。将反应混合物用真空吹扫/用氮气(3x)回填并将小瓶加盖。将反应混合物在120℃微波处理40min,用iproac稀释,并通过垫过滤。将滤液的有机相用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷,然后用meoh/
i
proac)纯化,得到350mg(47.3%)(e)
‑5‑
(4
‑
氯苯乙烯基)
‑6‑
甲氧基烟酸甲酯。1h nmr(400mhz,cdcl3)δ8.72(d,j=2.2hz,1h),8.37(d,j=2.3hz,1h),7.49
–
7.44(m,2h),7.36
–
7.32(m,2h),7.21(d,j=6.2hz,2h),4.09(s,3h),3.94(s,3h)。
[0582]
步骤2:(e)
‑5‑
(4
‑
氯苯乙烯基)
‑6‑
甲氧基烟酸
[0583]
将(e)
‑5‑
(4
‑
氯苯乙烯基)
‑6‑
甲氧基烟酸甲酯(350mg,1.15mmol)和氢氧化锂(83mg,3.46mmol)在thf(10.5ml)和水(7.7ml)中的混合物在40℃搅拌2h,然后在rt搅拌过夜。用1n hcl酸化反应直到ph约为5,并将混合物用etoac(3x)萃取。将合并的有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩,得到224mg(67.1%)的(e)
‑5‑
(4
‑
氯苯乙烯基)
‑6‑
甲氧基烟酸,为白色固体。1h nmr(400mhz,dmso
‑
d6)δ13.10(s,1h),8.64(d,j=2.1hz,1h),8.44(d,j=2.2hz,1h),7.70
–
7.62(m,2h),7.50
–
7.40(m,3h),7.32(d,j=16.6hz,1h),4.04(s,3h)。
[0584]
步骤3:(e)
‑5‑
(4
‑
氯苯乙烯基)
‑
n
‑
(4
‑
羟丁
‑2‑
基)
‑6‑
甲氧基烟酰胺
[0585]
将(e)
‑5‑
(4
‑
氯苯乙烯基)
‑6‑
甲氧基烟酸(200mg,0.69mmol),3
‑
氨基
‑
丁
‑1‑
醇(92.3mg,1.04mmol),hatu(472.4mg,1.24mmol)和dipea(0.24ml,1.38mmol)在无水dmf(3.5ml)中的混合物在rt搅拌18h。反应混合物用
i
proac稀释。将有机相用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷和meoh/
i
proac)纯化,然后进行sfc手性分离(chiralcel ox,等度30%meoh w/0.1%nh4oh,40℃,2.5min)。收集第一个峰,得到标题化合物(101mg,39.4%),为白色固体。手性sfc峰1(rt=0.695min),%ee=100;1h nmr(400mhz,dmso
‑
d6)δ8.55(d,j=2.3hz,1h),8.41(d,j=2.4hz,1h),8.24(d,j=8.1hz,1h),7.69
–
7.62(m,2h),7.50
–
7.43(m,2h),7.40(d,j=16.6hz,1h),7.31(d,j=16.6hz,1h),4.43(t,j=5.1hz,1h),4.20
–
4.07(m,1h),4.01(s,3h),3.51
–
3.42(m,2h),1.79
–
1.58(m,2h),1.17(d,j=6.6hz,3h);ms(esi+)m/z 361.1(m+h)
+
。
[0586]
实例20
[0587]
(e)
‑
n
‑
(5
‑
甲氧基
‑4‑
(2
‑
(1,4,4
‑
三氟环己基)乙烯基)吡啶
‑2‑
基)甲磺酰胺
[0588]
实例20的总体反应方案如下:
[0589][0590]
步骤1:1,4,4
‑
三氟环己烷
‑1‑
甲酸乙酯
[0591]
在0℃,向溶于无水thf(19ml)中的4,4
‑
二氟环己烷甲酸乙酯(1.80g,9.37mmol)加入在thf(14ml)中的双(三甲基甲硅基)酰胺锂(1mol/l)。将得到的浅黄色反应混合物在0℃和氮气下搅拌1h。然后加入溶解在thf(10ml)中的n
‑
氟苯磺酰亚胺(5.02g,15.9mmol),并将反应混合物在rt搅拌3h。将反应混合物用10%hcl水溶液淬灭,然后在rt搅拌至少1h。反应混合物用
i
proac稀释。将有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:iproac/庚烷)纯化,收集1,4,4
‑
三氟环己烷
‑1‑
甲酸乙酯(1.45g,73.5%),为黄色油状物。1h nmr(400mhz,cdcl3)δ4.26(q,j=7.2hz,2h),2.26
–
1.98(m,8h),1.32(t,j=7.1hz,3h)。
[0592]
步骤2:1,4,4
‑
三氟环己烷
‑1‑
甲醛
[0593]
在
‑
78℃,向在无水dcm(20ml)中的1,4,4
‑
三氟环己烷甲酸乙酯(500mg,2.38mmol),滴加在庚烷(2.3ml,2.30mmol)中的dibal(1.0mol/l)。将反应混合物在
‑
78℃搅拌2h。反应通过fieser方法进行后处理。过滤白色沉淀物,并在减压下蒸发滤液直至剩下约20ml的溶剂。假定定量收率,并且无需进一步纯化即可用于下一反应步骤。
[0594]
步骤3:2
‑
氯
‑5‑
甲氧基吡啶
[0595]
将2
‑
氯
‑5‑
羟基吡啶(25g,193mmol),碳酸钾(53.3g,386mmol)和甲基碘(14.5ml,223mmol)在氮气下于乙腈(500ml,0.2m)的烧瓶中合并。将反应混合物在室温搅拌过夜,然后用水(1l)稀释。将反应混合物用己烷(3x500ml)萃取。合并的有机层用盐水洗涤,经硫酸钠干燥,并减压浓缩。将该粗残余物通过用己烷(400ml)洗脱的硅垫纯化,并将滤液减压浓缩,得到2
‑
氯
‑5‑
甲氧基吡啶(21.7g,78.3%),为黄色油状物。1h nmr(400mhz,dmso
‑
d6)δ
8.13(d,j=2.9hz,1h),7.51
–
7.47(m,1h),7.45
–
7.42(m,1h),3.84(s,3h);ms(esi+)m/z 144.1(m+h)
+
。
[0596]
步骤4:2
‑
氯
‑5‑
甲氧基异烟酰胺
[0597]
在
‑
78℃,向溶于无水thf(150ml,0.2m)的2
‑
氯
‑5‑
甲氧基吡啶(10g,57.6mmol)在氮气下滴加在己烷(42.8ml,108mmol)中的2.5mn
‑
buli,注意保持温度恒定。将反应混合物在
‑
78℃搅拌30分钟,保持温度在
‑
78℃并滴加dmf(10.5ml,135mmol)。将所得溶液在
‑
78℃再搅拌30分钟,然后缓慢倒入饱和氯化铵溶液中。将含水混合物置于分液漏斗中,并将有机物用乙酸乙酯(3x300ml)萃取。合并的有机层用盐水洗涤,经硫酸钠干燥,并减压浓缩,得到深棕色油状物。粗产物通过柱色谱(sio2:etoac/己烷)纯化,得到米色结晶固体(2.77g,22.6%)。1h nmr(400mhz,dmso
‑
d6)δ10.29(s,1h),8.55(s,1h),7.58(s,1h),4.05(s,3h);ms(esi+)m/z 172.2(m+h)
+
。
[0598]
步骤5:(2
‑
氯
‑5‑
甲氧基吡啶
‑4‑
基)甲醇
[0599]
向在thf(585ml,0.2m)中的2
‑
氯
‑5‑
甲氧基异烟酰胺醛(20.1g.117.2mmol)加入硼氢化钠(4.43g,117.2mmol),并将所得混合物搅拌2h。将粗混合物用100ml甲醇,然后用1m hcl溶液淬灭。然后将反应混合物用饱和碳酸氢钠水溶液中和。将含水混合物置于分液漏斗中,并将有机物用etoac(3x600ml)萃取。合并的有机相用盐水洗涤,经硫酸钠干燥,并减压浓缩,得到黄色粘性固体,将其用50%dcm/己烷(10ml)研磨,并过滤。将滤液浓缩,并通过柱色谱(sio2:etoac/己烷)纯化,得到2
‑
氯
‑5‑
甲氧基吡啶
‑4‑
基)甲醇(8.01g,39.4%)。1h nmr(400mhz,dmso
‑
d6)δ8.07(s,1h),7.38(s,1h),5.46(t,j=5.7hz,1h),4.50(d,j=5.5hz,2h),3.89(s,3h);ms(esi+)m/z 174.0(m+h)
+
。
[0600]
步骤6:4
‑
(((叔丁基二苯基甲硅基)氧基)甲基)
‑2‑
氯
‑5‑
甲氧基吡啶
[0601]
在0℃,向(2
‑
氯
‑5‑
甲氧基吡啶
‑4‑
基)甲醇(1.34g,7.72mmol)在dcm(40.5ml,0.2m)中的搅拌溶液加入咪唑(1.05g,15.4mmol)和tbdpscl(2.76g,10.0mmol),并将反应混合物搅拌过夜。用水(20ml)稀释反应混合物,然后用dcm(3x40ml)萃取。合并的有机层用盐水洗涤,经硫酸钠干燥,并减压浓缩。粗产物通过柱色谱(sio2:etoac/己烷)纯化,得到4
‑
(((叔丁基二苯基甲硅基)氧基)甲基)
‑2‑
氯
‑5‑
甲氧基吡啶(2.52g,79.4%),为白色固体。1h nmr(400mhz,dmso
‑
d6)δ8.09(s,1h),7.63(d,j=6.9hz,4h),7.52
–
7.43(m,7h),4.71(s,2h),3.80(s,3h),1.06(s,9h);ms(esi+)m/z412.0(m+h)
+
。
[0602]
步骤7:n
‑
(4
‑
(((叔丁基二苯基甲硅烷基)氧基)甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺
[0603]
在充满氩气的火焰干燥的烧瓶中装入4
‑
(((叔丁基二苯基甲硅烷基)氧基)甲基)
‑2‑
氯
‑5‑
甲氧基吡啶(4.50g,10.9mmol)和2
‑
甲基
‑2‑
丁醇(90ml,0.12m)。然后将烧瓶真空吹扫并用氩气填充两次。在氩气下加入甲磺酰胺(2.08g,21.8mmol),磷酸钾(4.64g,21.8mmol)和[pd(allyl)(t
‑
buxphos)]otf(0.24g,0.328mmol)。将烧瓶真空吹扫并充入两次氩气,并将氩气气球插入隔垫中。然后将该混合物浸入110℃的预热油浴中24h,用lcms监测。将反应冷却至室温,并用饱和氯化铵水溶液(30ml)淬灭。将反应混合物用etoac(3x150ml)萃取,经硫酸钠干燥,并减压浓缩。粗产物通过柱色谱(sio2:etoac/己烷)纯化,得到n
‑
(4
‑
(((叔丁基二苯基甲硅烷基)氧基)甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺(3.46g,67.3%),为粉红色白垩状固体。1h nmr(400mhz,dmso
‑
d6)δ10.52
–
10.39(m,1h),7.93(s,
1h),7.68
–
7.63(m,4h),7.51
–
7.43(m,6h),7.40(s,1h),4.68(s,2h),3.76(s,3h),3.26(s,3h),1.07(s,9h);ms(esi+)m/z 471.0(m+h)
+
。
[0604]
步骤8:n
‑
(4
‑
(羟甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺
[0605]
向溶于thf(23ml)的n
‑
(4
‑
(((叔丁基二苯基甲硅烷基)氧基)甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺(2.3g,4.89mmol)加入氟化四丁基铵(9.77ml,9.77mmol,在thf中1m),将反应混合物在室温搅拌4h。将反应混合物在etoac(100ml)和水(100ml)之间分配并分离。用etoac(8x50ml)萃取水相。合并的有机层经无水na2so4干燥,过滤并在真空下蒸发,得到灰白色固体。将粗固体用乙醚(5ml)研磨,得到n
‑
(4
‑
(羟甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺(1g,88.1%),为白色固体。1h nmr(400mhz,meod
‑
d4)δ7.87(s,1h),7.24(s,1h),4.64(s,2h),3.90(s,3h),3.21(s,3h);ms(esi+)m/z 233.1(m+h)
+
。
[0606]
步骤9:n
‑
(4
‑
(氯甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺盐酸盐
[0607]
向在dcm(3.0ml)中的n
‑
(4
‑
(羟甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺(300mg,1.29mmol)加入亚硫酰氯(0.38ml,5.17mmol),并将反应混合物在室温下搅拌1小时。沉淀出产物,并将混合物浓缩,用乙醚处理和浓缩,用乙醚处理并再次浓缩,得到n
‑
(4
‑
(氯甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺盐酸盐(371mg,定量产率)。1h nmr(400mhz,meod
‑
d4)δ8.03(s,1h),7.41(s,1h),4.74(s,2h),4.00(s,3h),3.28(s,3h)。
[0608]
步骤10:n
‑
[4
‑
(二乙氧基磷酰基甲基)
‑5‑
甲氧基
‑2‑
吡啶基]甲磺酰胺
[0609]
合并n
‑
(4
‑
(氯甲基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺盐酸盐(0.3g,1.20mmol)和亚磷酸三乙酯(1.03ml,5.98mmol),并在140℃加热6h。减压蒸发反应混合物,得到浅黄色油状物。粗油通过柱色谱(sio2:meoh/etoac)纯化得到n
‑
[4
‑
(二乙氧基磷酰基甲基)
‑5‑
甲氧基
‑2‑
吡啶基]甲磺酰胺,为灰白色固体(0.28g,66.4%)。1h nmr(400mhz,cdcl3)δ10.03(br s,1h),8.05(s,1h),7.38(d,j=2.8hz,1h),4.17
–
4.06(m,4h),3.92(s,3h),3.29(s,1h),3.23(s,1h),3.11(s,3h),1.30(t,j=7.0hz,6h);ms(esi+)m/z 353.0(m+h)
+
。
[0610]
步骤11:(e)
‑
n
‑
(5
‑
甲氧基
‑4‑
(2
‑
(1,4,4
‑
三氟环己基)乙烯基)吡啶
‑2‑
基)甲磺酰胺
[0611]
向n
‑
[4
‑
(二乙氧基磷酰基甲基)
‑5‑
甲氧基
‑2‑
吡啶基]甲磺酰胺(295mg,0.84mmol)在thf(16.7ml)中的混合物中加入氢化钠(在矿物油中60质量%)(168mg,4.18mmol),并将反应混合物在rt在氮气下搅拌30min。然后加入来自步骤2的1,4,4
‑
三氟环己烷
‑1‑
甲醛在乙醚/dcm中的溶液(395mg,2.38mmol),并将反应混合物在rt搅拌4h。用饱和nh4cl水溶液淬灭反应混合物,倒入
i
proac中。将有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。粗产物通过柱色谱(sio2:
i
proac/庚烷和meoh/
i
proac)纯化,然后通过反相制备型hplc纯化,得到49.7mg(16.3%)的标题化合物,为白色固体。1h nmr(400mhz,dmso
‑
d6)δ10.19(s,1h),8.08(s,1h),7.07(s,1h),6.81(d,j=16.5hz,1h),6.74
–
6.62(m,1h),3.88(s,3h),3.22(s,3h),2.13
–
1.94(m,8h);ms(esi+)m/z 365.1(m+h)
+
。
[0612]
实例21
[0613]
n
‑
(4
‑
((e)
‑2‑
((1s,4s)
‑1‑
氟
‑4‑
(三氟甲基)环己基)乙烯基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺
[0614]
实例21的总体反应方案如下:
[0615][0616]
按照实例20的过程,用4
‑
(三氟甲基)环己烷
‑1‑
甲酸甲酯代替4,4
‑
二氟环己烷甲酸乙酯,得到外消旋体21。手性sfc分离(chiralpak 1a,等度10%meoh w/0.1%nh4oh,40℃,2.5min)外消旋n
‑
(4
‑
((e)
‑2‑
(1
‑
氟
‑4‑
(三氟甲基)环己基)乙烯基)
‑5‑
甲氧基吡啶
‑2‑
基)甲磺酰胺,得到标题化合物(6.4mg,1.4%),为白色固体。手性sfc峰2(rt=1.189min),%ee=98.4;1hnmr(400mhz,dmso
‑
d6)δ10.12(s,1h),8.09(s,1h),7.14(s,1h),6.87(dd,j=16.4,2.1hz,1h),6.74(dd,j=16.4,15.3hz,1h),3.89(s,3h),3.23(s,3h),2.13
–
1.67(m,7h),1.61
–
1.41(m,2h);ms(esi+)m/z 397.1(m+h)
+
。
[0617]
实例22
[0618]
n
‑
(1
‑
(4
‑
氯苄基)
‑3‑
甲基
‑
1h
‑
吲哚
‑6‑
基)甲磺酰胺
[0619]
实例22的总体反应方案如下:
[0620][0621]
步骤1:1
‑
(3
‑
硝基苯基)
‑2‑
亚丙基肼
[0622]
向1
‑
(3
‑
硝基苯基)肼盐酸盐(10.0g,52.74mmol)在etoh(100ml)中的溶液中添加15%naoh水溶液(50ml)以将ph调节至6。然后将acoh(24.36ml,421.94mmol)和丙醛(3.68g,63.29mmol)加入上述混合物中。将反应混合物在25℃搅拌3小时。然后将混合物倒入冰水中,并将沉淀物过滤,用水洗涤并真空干燥,得到标题化合物(11.5g粗品),为黄色固体。1h nmr(400mhz,cd3od)δ7.78
‑
7.77(m,1h),7.53
‑
7.50(m,1h),7.36(t,j=8.0hz,1h),7.26
‑
7.21(m,2h),2.35
‑
2.28(m,2h),1.15(t,j=7.6hz,3h)。
[0623]
步骤2:3
‑
甲基
‑6‑
硝基
‑
1h
‑
吲哚
[0624]
将1
‑
(3
‑
硝基苯基)
‑2‑
亚丙基肼(来自步骤1,11.5g,59.5mmol)在h3po4(100ml)和甲苯(100ml)中的混合物在100℃下搅拌3小时。用水(300ml)稀释反应混合物,用etoac(300ml
×
2)萃取。将合并的有机层用10%naoh水溶液(300ml)洗涤,经无水na2so4干燥、过滤并浓缩。粗残余物通过硅胶柱色谱(在石油醚中30%etoac)纯化,得到标题化合物(3.5g,33%),为黄色固体。1h nmr(400mhz,cd3od)δ8.28(s,1h),7.90(d,j=8.8hz,1h),7.57(d,j=8.8hz,1h),7.35(s,1h),2.32(s,3h)。
[0625]
步骤3:1
‑
(4
‑
氯苄基)
‑3‑
甲基
‑6‑
硝基
‑
1h
‑
吲哚
[0626]
在冰浴中,向3
‑
甲基
‑6‑
硝基
‑
1h
‑
吲哚(来自步骤2,3.5g,19.9mmol)在thf(50ml)中的搅拌溶液中加入nah(在矿物油中60%的,1.19g,29.8mmol)。将反应混合物搅拌30分钟,并将1
‑
(溴甲基)
‑4‑
氯苯(6.12g,29.8mmol)加入到混合物中。将反应混合物进一步在25℃搅拌3小时。将水(100ml)加入到反应混合物中。将混合物用etoac(100ml
×
2)萃取。将合并的有机层经无水na2so4干燥、过滤并且浓缩。粗残余物通过硅胶柱色谱(在石油醚中20%etoac)纯化,得到标题化合物(4.5g,75%),为黄色固体。lcms(esi
+
)m/z 300.9(m+h)
+
。
[0627]
步骤4:1
‑
(4
‑
氯苄基)
‑3‑
甲基
‑
1h
‑
吲哚
‑6‑
胺
[0628]
将1
‑
(4
‑
氯苄基)
‑3‑
甲基
‑6‑
硝基
‑
1h
‑
吲哚(来自步骤3,4.5g,14.96mmol),铁粉(4.18g,74.82mmol)和nh4cl(4.8g,89.78mmol)在etoh(100ml)和水(20ml)中的混合物在80℃搅拌3小时。冷却至25℃后,将反应混合物通过垫过滤,用meoh(100ml)洗涤。将滤液浓缩至干。粗残余物通过硅胶柱色谱(在石油醚中40%etoac)纯化,得到标题化合物(3.4g,84%),为黄色油状物。1h nmr(400mhz,cdcl3)δ7.35(d,j=8.4hz,1h),7.25(d,j=8.0hz,2h),7.02(d,j=8.0hz,2h),6.67(s,1h),6.58(dd,j=8.0hz,2.0hz,1h),6.46(s,1h),5.10(s,2h),3.60(br s,2h),2.28(s,3h)。
[0629]
步骤5:n
‑
(1
‑
(4
‑
氯苄基)
‑3‑
甲基
‑
1h
‑
吲哚
‑6‑
基)甲磺酰胺
[0630]
向1
‑
(4
‑
氯苄基)
‑3‑
甲基
‑
1h
‑
吲哚
‑6‑
胺(来自步骤4,150mg,0.55mmol)在吡啶(3ml)中的混合物加入甲磺酰氯(0.06ml,0.83mmol)。将反应混合物在25℃搅拌2小时。用水(20ml)稀释反应混合物,用etoac(20ml
×
2)萃取。将合并的有机层经无水na2so4干燥、过滤并且浓缩。所得残余物通过反相色谱(乙腈50
‑
80/在水中0.05%nh4oh)纯化以得到标题化合物(139mg,72%),为白色固体。1h nmr(400mhz,cd3od)δ7.49(d,j=8.0hz,1h),7.29(d,j=8.4hz,2h),7.21(s,1h),7.12(d,j=8.4hz,2h),7.05(s,1h),6.98
‑
6.95(m,1h),5.28(s,2h),2.84(s,3h),2.31(s,3h)。lcms(esi
+
)m/z 348.9(m+h)
+
。
[0631]
实例23
[0632]
n
‑
(1
‑
(4
‑
氯苄基)
‑3‑
甲基
‑
1h
‑
吲哚
‑6‑
基)环丙磺酰胺
[0633][0634]
按照与实例22的步骤5类似的过程,由1
‑
(4
‑
氯苄基)
‑3‑
甲基
‑
1h
‑
吲哚
‑6‑
胺和环丙烷磺酰氯制备标题化合物,为白色固体(105mg,50%)。1hnmr(400mhz,dmso
‑
d6)δ9.37(s,1h),7.41(d,j=8.4hz,1h),7.34(d,j=8.4hz,2h),7.19
‑
7.17(m,2h),7.12(d,j=8.4hz,
2h),6.93
‑
6.90(m,1h),5.27(s,2h),2.42
‑
2.36(m,1h),2.22(s,3h),0.77
‑
0.75(m,4h)。lcms(esi
+
)m/z 375.0(m+h)
+
。
[0635]
实例24
[0636]
n
‑
(3
‑
(4
‑
氯苄基)
‑1‑
甲基
‑
1h
‑
吲哚
‑5‑
基)甲磺酰胺
[0637][0638]
步骤1:3
‑
(4
‑
氯苄基)
‑1‑
甲基
‑5‑
硝基
‑
1h
‑
吲哚
[0639]
将1
‑
甲基
‑5‑
硝基
‑
吲哚(1.0g,5.7mmol),cu2o(2.4g,17mmol),1
‑
(溴甲基)
‑4‑
氯苯(1.5g,7.4mmol)在乙腈(30ml,287mmol)中的混合物在138℃搅拌16小时。过滤反应混合物并浓缩。将残余物通过制备型hplc(乙腈0
‑
55/0.225%fa在水中)纯化,得到标题化合物(300mg,18%),为黄色固体。1h nmr(400mhz,cdcl3)δ8.47(d,j=2.0hz,1h),8.14(dd,j=9.2,2.0hz,1h),7.34
‑
7.28(m,2h),7.27
‑
7.16(m,3h),6.89(s,1h),4.10(s,2h),3.81(s,3h)。
[0640]
步骤2:3
‑
(4
‑
氯苄基)
‑1‑
甲基
‑
1h
‑
吲哚
‑5‑
胺
[0641]
按照与实例22的步骤4类似的过程,由3
‑
(4
‑
氯苄基)
‑1‑
甲基
‑5‑
硝基
‑
1h
‑
吲哚制备标题化合物,为棕色固体(400mg,98%)。1h nmr(400mhz,cdcl3)δ7.26
‑
7.17(m,4h),7.11(d,j=8.4hz,1h),6.78
‑
6.67(m,3h),3.99(s,2h),3.69(s,3h)。
[0642]
步骤3:n
‑
(3
‑
(4
‑
氯苄基)
‑1‑
甲基
‑
1h
‑
吲哚
‑5‑
基)甲磺酰胺
[0643]
按照与实例22的步骤5类似的过程,由3
‑
(4
‑
氯苄基)
‑1‑
甲基
‑
1h
‑
吲哚
‑5‑
胺(来自步骤2)和甲磺酰氯制备标题化合物,为黄色固体(63.9mg,50%)。1h nmr(400mhz,dmso
‑
d6)δ8.02(br s,1h),7.39
‑
7.24(m,6h),7.14(s,1h),7.06
‑
7.00(m,1h),3.99(s,2h),3.72(s,3h),2.81(s,3h)。lcms(esi
+
)m/z 348.9(m+h)
+
。
[0644]
实例25
[0645]
n
‑
(4'
‑
异丙基
‑6‑
甲氧基
‑
[1,1'
‑
联苯]
‑3‑
基)环丙磺酰胺
[0646][0647]
步骤1:4'
‑
异丙基
‑6‑
甲氧基
‑
[1,1'
‑
联苯]
‑3‑
胺
[0648]
将3
‑
溴
‑4‑
甲氧基苯胺(500mg,2.47mmol),4
‑
异丙基苯基硼酸(487mg,2.97mmol),pd(dppf)cl2(181mg,0.25mmol)和na2co3(787mg,7.42mmol)在1,4
‑
二噁烷(10ml)和水(1ml)中的混合物在100℃和氮气气氛下搅拌8小时。冷却至25℃后,将反应混合物用水(50ml)稀释,用etoac(50ml
×
2)萃取。将合并的有机层经无水na2so4干燥、过滤并且浓缩。粗残余物通过硅胶柱色谱(在石油醚中40%etoac)纯化,得到标题化合物(510mg,85%),为黄色油状物。1h nmr(400mhz,cdcl3)δ7.45(d,j=8.0hz,1h),7.26(d,j=8.0hz,1h),6.82(d,j=8.4hz,1h),6.71(d,j=2.8hz,1h),6.67
‑
6.64(m,1h),3.72(s,3h),2.97
‑
2.90(m,1h),1.28
(d,j=7.2hz,6h)。
[0649]
步骤2:n
‑
(4'
‑
异丙基
‑6‑
甲氧基
‑
[1,1'
‑
联苯]
‑3‑
基)环丙磺酰胺
[0650]
按照与实例22的步骤5类似的过程,由4'
‑
异丙基
‑6‑
甲氧基
‑
[1,1'
‑
联苯]
‑3‑
胺和环丙烷磺酰氯制备标题化合物,为白色固体(52mg,30%)。1hnmr(400mhz,cd3od)δ7.39(d,j=8.0hz,2h),7.26
‑
7.18(m,4h),7.04(d,j=8.0hz,1h),3.78(s,3h),2.96
‑
2.89(m,1h),2.52
‑
2.46(m,1h),1.28(d,j=6.8hz,6h),0.99
‑
0.92(m,4h)。lcms(esi
+
)m/z 346.0(m+h)
+
。
[0651]
实例26
[0652]
4'
‑
环丙基
‑
n
‑
异丙基
‑6‑
甲氧基
‑
[1,1'
‑
联苯]
‑3‑
甲酰胺
[0653][0654]
步骤1:3
‑
溴
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺
[0655]
将3
‑
溴
‑4‑
甲氧基苯甲酸(500mg,2.16mmol),草酰氯(0.27ml,3.25mmol)和dmf(0.5ml)在dcm(20ml)中的混合物在0℃搅拌2小时。浓缩反应混合物,得到粗3
‑
溴
‑4‑
甲氧基
‑
苯甲酰氯(500mg,93%),为白色固体。将所得的3
‑
溴
‑4‑
甲氧基
‑
苯甲酰氯和异丙胺(118mg,2mmol),三乙胺(202mg,2mmol)的dcm(20ml)中混合物在25℃搅拌2小时。将水(40ml)加入到反应混合物中,并将混合物用dcm(40ml)萃取。有机层用水(50ml
×
2)洗涤,经无水na2so4干燥并浓缩。残余物通过硅胶色谱(在石油醚中的0
‑
50%etoac)纯化,得到标题化合物(540mg,99%),为白色固体。1h nmr(400mhz,cdcl3)δ7.93(d,j=2.4hz,1h),7.74(dd,j=8.4,2.4hz,1h),6.91(d,j=8.8hz,1h),5.87(d,j=5.2hz,1h),4.30
‑
4.22(m,1h),3.94(s,3h),1.26(d,j=6.4hz,6h)。
[0656]
步骤2:n
‑
异丙基
‑4‑
甲氧基
‑3‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)苯甲酰胺
[0657]
将3
‑
溴
‑
n
‑
异丙基
‑4‑
甲氧基
‑
苯甲酰胺(7.2g,26mmol),双(联频哪醇)硼酸酯(8.0g,31mmol),1,1'
‑
双(二苯基膦基)二茂铁二氯化钯(2.0g,2.65mmol)和乙酸钾(7.8g,79mmol)在1,4
‑
二噁烷(100ml)中的溶液在氮气下在100℃搅拌16小时。冷却至25℃后,将反应混合物用水(200ml)稀释,用etoac(200ml
×
2)萃取。将合并的有机层经无水na2so4干燥、过滤并且浓缩。粗残余物通过硅胶柱色谱(在石油醚中60%etoac)纯化,得到标题化合物(5.8g,69%),为白色固体。1h nmr(400mhz,cdcl3)δ7.95
‑
7.93(m,2h),6.88(d,j=8.8hz,1h),5.96(d,j=7.6hz,1h),4.31
‑
4.23(m,1h),3.86(s,3h),1.36(s,12h),1.25(d,j=6.4hz,6h)。
[0658]
步骤3:4'
‑
环丙基
‑
n
‑
异丙基
‑6‑
甲氧基
‑
[1,1'
‑
联苯]
‑3‑
甲酰胺
[0659]
将n
‑
异丙基
‑4‑
甲氧基
‑3‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)苯甲酰胺(150.0mg,0.47mmol),1
‑
溴
‑4‑
环丙基
‑
苯(111.1mg,0.56mmol),1,1'
‑
双(二苯基膦基)二茂铁二氯化钯(34.4mg,0.05mmol)和碳酸钠(149.4mg,1.41mmol)在1,4
‑
二噁烷(5ml)和水(1ml)中的混合物在氮气下在100℃搅拌3小时。冷却至25℃后,将反应混合物用水(20ml)稀释,用etoac(20ml
×
2)萃取。浓缩合并的有机层。利用制备型hplc(碱)纯化所得残余物,以得到标题化合物(55.5mg,38%),为白色固体。1h nmr(400mhz,dmso
‑
d6)δ8.14(d,j=7.6hz,
1h),7.84(d,j=8.0hz,1h),7.79(s,1h),7.38(d,j=8.0hz,2h),7.18
‑
7.07(m,3h),4.17
‑
4.00(m,1h),3.80(s,3h),1.97
‑
1.91(m,1h),1.15(d,j=6.4hz,6h),0.98
‑
0.96(m,2h),0.72
‑
0.68(m,2h);lcms(esi
+
)m/z 310.1(m+h)
+
。
[0660]
实例27
[0661]
(e)
‑
n
‑
(3
‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯基)甲磺酰胺
[0662][0663]
步骤1:(e)
‑3‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯胺
[0664]
向3
‑
溴
‑4‑
甲氧基苯胺(150mg,0.74mmol)在1,4
‑
二噁烷(10ml)和水(1ml)中的溶液,加入1,1'
‑
双(二苯基膦基)二茂铁二氯化钯(54mg,0.07mmol),2
‑
环己基乙烯基硼酸(137mg,0.89mmol),碳酸钠(236mg,2.23mmol)。将反应混合物在100℃搅拌2小时。浓缩混合物,并且粗残余物通过硅胶柱色谱(在石油醚中0
‑
10%etoac)纯化,得到标题化合物(140mg,68%),为黄色固体。1h nmr(400mhz,cdcl3)δ6.83(d,j=2.4hz,1h),6.70(d,j=8.4hz,1h),6.63(d,j=16.0hz,1h),6.55(dd,j=8.4,2.4hz,1h),6.11(dd,j=16.0,7.2hz,1h),3.78(s,3h),2.15
‑
2.13(m,1h),1.86
‑
1.72(m,5h),1.32
‑
1.14(m,5h)。
[0665]
步骤2:(e)
‑
n
‑
(3
‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯基)甲磺酰胺
[0666]
按照与实例22类似的过程,由(e)
‑3‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯胺和甲磺酰氯制备标题化合物,为白色固体(126.6mg,79%)。1h nmr(400mhz,cdcl3)δ7.30(s,1h),7.11(d,j=8.4hz,1h),6.82(d,j=8.8hz,1h),6.63(d,j=16.4hz,1h),6.18(dd,j=16.0,7.2hz,1h),3.84(s,3h),2.97(s,3h),2.16
‑
2.13(m,1h),1.83
‑
1.67(m,5h),1.35
‑
1.13(m,5h)。
[0667]
实例28
[0668]
(e)
‑
n
‑
(3
‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯基)环丙磺酰胺
[0669][0670]
按照与实例22类似的过程,由(e)
‑3‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯胺和环丙磺酰氯制备标题化合物,为白色固体(117.9mg,68%)。1h nmr(400mhz,cdcl3)δ7.33(d,j=2.4hz,1h),7.12(dd,j=8.8,2.4hz,1h),6.80(d,j=8.8hz,1h),6.63(d,j=16.0hz,1h),6.17(dd,j=16.0,6.8hz,1h),3.84(s,3h),2.49
‑
2.38(m,1h),2.20
‑
2.09(m,1h),1.85
‑
1.70(m,5h),1.35
‑
1.17(m,5h),1.15
‑
1.10(m,2h),0.99
‑
0.90(m,2h)。
[0671]
实例29
[0672]
(e)
‑3‑
(2
‑
环己基乙烯基)
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺
[0673][0674]
按照与实例28类似的过程,由3
‑
溴
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺和2
‑
环己基乙烯基硼酸制备标题化合物,为黄色固体(82.3mg,74%)。1h nmr(400mhz,cdcl3)δ7.82(d,j=2.4hz,1h),7.58(dd,j=8.4,2.4hz,1h),6.85(d,j=8.4hz,1h),6.68(d,j=16.4hz,1h),6.26(dd,j=16.0,6.8hz,1h),5.85(d,j=7.2hz,1h),4.35
‑
4.23(m,1h),3.88(s,3h),2.17
‑
2.14(m,1h),1.84
‑
1.60(m,5h),1.31
‑
1.18(m,11h)。lcms(esi
+
)m/z 302.0(m+h)
+
。
[0675]
实例30
[0676]
(e)
‑
n
‑
异丙基
‑4‑
甲氧基
‑3‑
(3
‑
苯基丙
‑1‑
烯
‑1‑
基)苯甲酰胺
[0677][0678]
按照与实例28类似的过程,由3
‑
溴
‑
n
‑
异丙基
‑4‑
甲氧基苯甲酰胺和(e)
‑
(3
‑
苯基丙
‑1‑
烯
‑1‑
基)硼酸制备标题化合物,为白色固体(69.7mg,72%)。1h nmr(400mhz,cdcl3)δ7.77(d,j=2.0hz,1h),7.62(dd,j=8.4,2.4hz,1h),7.33
‑
7.20(m,5h),6.86(d,j=8.4hz,1h),6.78(d,j=16.0hz,1h),6.47
‑
6.39(m,1h),5.83(s,1h),4.30
‑
4.22(m,1h),3.88(s,3h),3.58(d,j=6.8hz,2h),1.24(d,j=6.4hz,6h);lcms(esi
+
)m/z 310.0(m+h)
+
。
[0679]
实例31
[0680]
(e)
‑3‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯甲酰胺
[0681][0682]
步骤1:3
‑
溴
‑4‑
甲氧基苯甲酰胺
[0683]
按照与实例26类似的过程,由thf中的3
‑
溴
‑4‑
甲氧基苯甲酸和氨制备标题化合物,为白色固体(3.6g,98%)。1h nmr(400mhz,dmso
‑
d6)δ8.10(d,j=2.0hz,1h),7.97(s,1h),7.89(dd,j=8.8,2.0hz,1h),7.35(s,1h),7.17(d,j=8.8hz,1h),3.89(s,3h)。lcms(esi
+
)m/z 229.9(m+h)
+
。
[0684]
步骤2:(e)
‑3‑
(2
‑
环己基乙烯基)
‑4‑
甲氧基苯甲酰胺
[0685]
按照与实例27类似的过程,由3
‑
溴
‑4‑
甲氧基苯甲酰胺(来自步骤1)和2
‑
环己基乙烯基硼酸制备标题化合物,为白色固体(55.6mg,49%)。1hnmr(400mhz,cdcl3)δ7.91(d,j=2.0hz,1h),7.65(dd,j=8.4,2.0hz,1h),6.87(d,j=8.4hz,1h),6.66(d,j=16.0hz,1h),6.25(dd,j=16.4,7.2hz,1h),6.17
‑
5.47(m,2h),3.89(s,3h),2.16(d,j=7.4hz,1h),1.84
‑
1.69(m,5h),1.38
‑
1.14(m,5h)。lcms(esi
+
)m/z 260.0(m+h)
+
。
[0686]
实例32
[0687]
(e)
‑4‑
甲氧基
‑3‑
(3
‑
苯基丙
‑1‑
烯
‑1‑
基)苯甲酰胺
[0688][0689]
按照与实例27类似的过程,由3
‑
溴
‑4‑
甲氧基苯甲酰胺和(e)
‑
(3
‑
苯基丙
‑1‑
烯
‑1‑
基)硼酸制备标题化合物,为白色固体(67.4mg,58%)。1h nmr(400mhz,cdcl3)δ7.88(d,j=2.0hz,1h),7.68(dd,j=8.4,2.0hz,1h),7.36
‑
7.19(m,5h),6.89(d,j=8.8hz,1h),6.79(d,j=16.0hz,1h),6.48
‑
6.40(m,1h),6.20
‑
5.60(br s,2h),3.91(s,3h),3.59(d,j=7.2hz,2h)。lcms(esi
+
)m/z 267.9(m+h)
+
。
[0690]
实例33
[0691]
(e)
‑
n
‑
(4
‑
甲氧基
‑3‑
(3
‑
苯基丙
‑1‑
烯
‑1‑
基)苯基)环丙磺酰胺
[0692][0693]
步骤1:(e)
‑4‑
甲氧基
‑3‑
(3
‑
苯基丙
‑1‑
烯
‑1‑
基)苯胺
[0694]
按照与实例27类似的过程,由3
‑
溴
‑4‑
甲氧基苯胺和反式
‑3‑
苯基丙
‑1‑
基硼酸制备标题化合物,为黄色油状物。1h nmr(400mhz,cdcl3)δ7.33
‑
7.21(m,5h),6.81
‑
6.70(m,3h),6.58(dd,j=8.4,2.4hz,1h),6.33
‑
6.27(m,1h),3.78(s,3h),3.57(d,j=7.2hz,2h)。
[0695]
步骤2:(e)
‑
n
‑
(4
‑
甲氧基
‑3‑
(3
‑
苯基丙
‑1‑
烯
‑1‑
基)苯基)环丙磺酰胺
[0696]
按照与实例22类似的过程,由(e)
‑4‑
甲氧基
‑3‑
(3
‑
苯基丙
‑1‑
烯
‑1‑
基)苯胺获得标题化合物,为白色固体(131mg,76%)。1hnmr(400mhz,dmso
‑
d6)δ9.32(s,1h),7.32
‑
7.21(m,6h),7.11
‑
7.08(m,1h),6.95(d,j=8.0hz,1h),6.67(d,j=16.0hz,1h),6.31
‑
6.27(m,1h),3.77(s,3h),3.53(d,j=7.2hz,2h),2.52
‑
2.50(m,1h),0.88
‑
0.82(m,4h)。
[0697]
实例34
[0698]
(e)
‑
n
‑
(3
‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯基)乙磺酰胺
[0699][0700]
步骤1:(e)
‑3‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯胺
[0701]
按照与实例27类似的过程,由3
‑
溴
‑4‑
甲氧基苯胺和e
‑2‑
(4
‑
氯苯基)乙烯基硼酸制备标题化合物,为白色固体(6.3g,98%)。1h nmr(400mhz,dmso
‑
d6)δ7.55(d,j=8.4hz,2h),7.46
‑
7.31(m,3h),7.02(d,j=16.4hz,1h),6.89(d,j=2.8hz,1h),6.77(d,j=8.8hz,1h),6.55(dd,j=8.8,2.4hz,1h),4.68(s,2h),3.72(s,3h)。
[0702]
步骤2:(e)
‑
n
‑
(3
‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯基)乙磺酰胺
[0703]
按照与实例22类似的过程,由(e)
‑3‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯胺(来自步骤1)和乙磺酰氯制备标题化合物,为黄色固体(50.6mg,38%)。1hnmr(400mhz,dmso
‑
d6)δ9.65(s,1h),7.60(d,j=8.4hz,2h),7.46
‑
7.31(m,4h),7.13
‑
7.05(m,2h),7.02
‑
6.96(m,1h),6.78
‑
6.71(m,1h),6.08
‑
5.94(m,2h),3.82(s,3h)。
[0704]
实例35
[0705]
实例35的总体反应方案如下:
[0706][0707]
步骤1:6
‑
甲氧基
‑5‑
乙烯基烟酸甲酯
[0708]
将5
‑
溴
‑6‑
甲氧基
‑
吡啶
‑3‑
甲酸甲酯(0.5g,2.03mmol)和1,1'
‑
双(二苯基膦基)二茂铁二氯化钯(0.07g,0.10mmol),乙烯基硼酸频哪醇酯(344mg,2.24mmol),碳酸钠(0.65g,6.1mmol)在1,4
‑
二噁烷(5ml)和水(1ml)中的混合物在氮气下在100℃搅拌3小时。浓缩反应混合物,并且残余物通过硅胶柱色谱(在石油醚中0
‑
33%etoac)纯化,得到标题化合物(220mg,56%),为白色固体。lcms(esi
+
)m/z 194.0(m+h)
+
。
[0709]
步骤2:(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基烟酸甲酯
[0710]
将1,1'
‑
双(二苯基膦基)二茂铁(57mg,0.10mmol),n,n二环己基甲胺(606mg,3.11mmol),4
‑
溴
‑
1,1
‑
二氟
‑
环己烷(412mg,2.07mmol),pd(pph3)4(119mg,0.10mmol)和6
‑
甲氧基
‑5‑
乙烯基
‑
吡啶
‑3‑
甲酸甲酯(200mg,1.04mmol)在(三氟甲基)苯(5ml)中的混合物在氮气氛围下在120℃搅拌12小时。将反应混合物浓缩,并通过制备型tlc(在石油中20%etoac)纯化,得到标题化合物(60mg,19%),为白色固体。1h nmr(400mhz,cdcl3)δ8.68(d,j=2.0hz,1h),8.21(d,j=2.0hz,1h),6.57(d,j=16.0hz,1h),6.29(dd,j=16.0,7.2hz,1h),4.04(s,3h),3.92(s,3h),2.28
‑
2.26(m,1h),2.20
‑
2.08(m,2h),1.94
‑
1.86(m,2h),1.85
‑
1.70(m,2h),1.64
‑
1.54(m,2h)。
[0711]
步骤3:(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基烟酸
[0712]
向(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基烟酸甲酯(60mg,0.19mmol)在水(1ml),甲醇(1ml)和thf(1ml)的溶液加入氢氧化锂(23mg,0.96mmol)。将混合物在25℃搅拌5小时。用2n盐酸水溶液酸化反应混合物至ph=5,并将混合物用etoac(50ml
×
3)萃取。合并的有机层经无水na2so4干燥并浓缩,得到标题化合物(50mg,87%),为棕色固体。lcms(esi
+
)m/z 298.0(m+h)
+
。
[0713]
步骤4:(r,e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑
n
‑
(1
‑
羟丁
‑2‑
基)
‑6‑
甲氧基烟酰胺
[0714]
向(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基烟酸(50mg,0.17mmol),(r)
‑2‑
氨基
‑1‑
丁醇(18mg,0.20mmol)和hatu(77mg,0.20mmol)在dmf(0.50ml)中的溶液,加入n,n
‑
二异丙基乙胺(0.08ml,0.50mmol),并将反应混合物在15℃搅拌2小时。将反应混合物用水(20ml)稀释,用dcm(20ml
×
2)萃取。将合并的有机层经无水na2so4干燥、过滤并且浓缩。粗残余物通过制备型hplc(乙腈30
‑
60/在水中的0.1%nh4hco3)纯化,得到标题化合物(12.1mg,
20%),为白色固体。1h nmr(400mhz,cdcl3)δ8.42(d,j=2.4hz,1h),8.06(d,j=2.4hz,1h),6.57(d,j=16.0hz,1h),6.31(dd,j=16.0,6.8hz,1h),6.24(d,j=8.0hz,1h),4.15
‑
4.05(m,1h),4.02(s,3h),3.87
‑
3.68(m,2h),2.60
‑
2.58(m,1h),2.28
‑
2.27(m,1h),2.21
‑
2.08(m,2h),1.94
‑
1.64(m,6h),1.61
‑
1.49(m,2h),1.03(t,j=7.2hz,3h)。lcms(esi
+
)m/z 369.1(m+h)
+
。
[0715]
实例36
[0716]
(e)
‑
n
‑
(5
‑
(2
‑
(3,3
‑
二甲基环丁基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0717][0718]
步骤1:3,3
‑
二甲基环丁烷甲醛
[0719]
在
‑
78℃,向3,3
‑
二甲基环丁烷甲酸甲酯(250mg,1.76mmol)在dcm(2ml)中的搅拌溶液加入dibal(在甲苯中1.0m,1.6ml,1.6mmol)。将反应混合物在
‑
78℃搅拌2小时。将水(1ml)加入到反应混合物中。混合物经无水mgso4干燥,过滤并浓缩以除去低沸点溶剂。得到标题化合物在甲苯中的10%溶液,其不经进一步纯化直接用于下一步。1h nmr(400mhz,cdcl3)δ9.73(d,j=2.0hz,1h),3.11
‑
3.03(m,1h),2.06
‑
1.92(m,4h),1.20(s,3h),1.08(s,3h)。
[0720]
步骤2:(e)
‑5‑
溴
‑3‑
(2
‑
(3,3
‑
二甲基环丁基)乙烯基)
‑2‑
甲氧基吡啶
[0721]
在0℃,向((5
‑
溴
‑2‑
甲氧基吡啶
‑3‑
基)甲基)膦酸二乙酯(0.4g,1.18mmol)在甲苯(2ml)中的溶液添加叔五氧化钠(0.13g,1.18mmol),并将混合物在0℃搅拌20分钟。滴加3,3
‑
二甲基环丁烷甲醛(由步骤1得到,甲苯溶液,约1.4mmol),并将反应混合物在0℃搅拌1.5小时。将反应混合物倒入饱和nh4cl水溶液(10ml),并用etoac(10ml
×
2)萃取。将合并的有机层用盐水(10ml)洗涤,经无水na2so4干燥并浓缩,并将残余物通过硅胶色谱(在石油醚中的0
‑
10%etoac)纯化,得到标题化合物(250mg,71%),为无色油状物。1h nmr(400mhz,cd3od)δ8.03(d,j=2.4hz,1h),7.87(d,j=2.4hz,1h),6.54(dd,j=16.0,6.8hz,1h),6.41(d,j=16.0hz,1h),3.95(s,3h),3.15
‑
2.96(m,1h),2.09
‑
1.96(m,2h),1.85
‑
1.74(m,2h),1.23(s,3h),1.11(s,3h)。
[0722]
步骤3:(e)
‑
n
‑
(5
‑
(2
‑
(3,3
‑
二甲基环丁基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0723]
将(e)
‑5‑
溴
‑3‑
(2
‑
(3,3
‑
二甲基环丁基)乙烯基)
‑2‑
甲氧基吡啶(来自步骤2,100mg,0.34mmol),烯丙基氯化钯(ii)二聚体(12mg,0.03mmol),2
‑
二叔丁基膦基
‑
2',4',6'
‑
三异丙基联苯(28mg,0.07mmol),甲磺酰胺(64mg,0.68mmol),碳酸钾(140mg,1.01mmol)在1,4
‑
二噁烷(5ml)中的混合物在氮气气氛下于100℃搅拌16小时。过滤反应混合物,并且将滤液浓缩。残余物进一步通过制备型hplc(乙腈55
‑
75/在水中的0.1%nh4hco3)纯化,得到标题化合物(13.8mg,13%),为白色固体。1h nmr(400mhz,dmso
‑
d6)δ9.33(br s,1h),7.88(d,j=2.4hz,1h),7.63(d,j=2.4hz,1h),6.47(dd,j=16.0,6.8hz,1h),6.38(d,j=16.0hz,1h),3.87(s,3h),3.13
‑
3.02(m,1h),2.95(s,3h),1.98
‑
1.91(m,2h),1.76
‑
1.69(m,
2h),1.17(s,3h),1.06(s,3h);lcms(esi
+
)m/z 311.0(m+h)
+
。
[0724]
实例37
[0725]
n
‑
(6
‑
甲氧基
‑5‑
((e)
‑2‑
(反式
‑3‑
(三氟甲基)环丁基)乙烯基)吡啶
‑3‑
基)甲磺酰胺
[0726]
实例37的总体反应方案如下:
[0727][0728]
步骤1:反式
‑
n
‑
甲氧基
‑
n
‑
甲基
‑3‑
(三氟甲基)环丁烷甲酰胺
[0729]
将3
‑
(三氟甲基)环丁烷甲酸(500mg,2.97mmol),dipea(1.3ml,7.44mmol)和hatu(1.47g,3.87mmol)在dmf(10ml)中的混合物在17℃搅拌0.5小时。加入n,o
‑
二甲基羟胺盐酸盐(377mg,3.87mmol),并将混合物在17℃搅拌1小时。将混合物浓缩并将残余物用etoac(30ml)稀释,用水(30ml)和盐水(30ml)洗涤。有机相经无水na2so4干燥,浓缩并通过硅胶柱色谱(在石油醚中的50%etoac)纯化,得到反式
‑
n
‑
甲氧基
‑
n
‑
甲基
‑3‑
(三氟甲基)环丁烷甲酰胺(200mg,32%)和顺式
‑
n
‑
甲氧基
‑
n
‑
甲基
‑3‑
(三氟甲基)环丁烷甲酰胺(400mg,64%),两者均为无色油状物。顺式异构体:1h nmr(400mhz,cdcl3)δ3.67(s,3h),3.40
‑
3.29(m,1h),3.19(s,3h),2.96
‑
2.80(m,1h),2.55
‑
2.41(m,2h),2.35
‑
2.23(m,2h)。反式异构体:1h nmr(400mhz,cdcl3)δ3.66(s,3h),3.56
‑
3.55(m,1h),3.20(s,3h),3.04
‑
2.87(m,1h),2.56
‑
2.52(m,2h),2.43
‑
2.31(m,2h)。
[0730]
步骤2:反式
‑3‑
(三氟甲基)环丁烷甲醛
[0731]
在
‑
78℃,向反式
‑
n
‑
甲氧基
‑
n
‑
甲基
‑3‑
(三氟甲基)环丁烷甲酰胺(来自步骤1,180mg,0.85mmol)在dcm(4ml)中的搅拌溶液加入dibal(在甲苯中1m,0.85ml,0.85mmol)。将反应混合物在
‑
78℃搅拌2小时。将水(0.5ml)加入到反应混合物中。将反应混合物经无水mgso4干燥并浓缩,得到标题化合物(500mg在0.5ml甲苯中),将其直接用于下一步。1h nmr(400mhz,cdcl3)δ9.79(s,1h),3.26
‑
3.25(m,1h),2.90
‑
2.83(m,2h),2.51
‑
2.46(m,2h)。
[0732]
步骤3:5
‑
溴
‑2‑
甲氧基
‑3‑
((e)
‑2‑
(反式
‑3‑
(三氟甲基)环丁基)乙烯基)吡啶
[0733]
按照与实施例36类似的过程,由反式
‑3‑
(三氟甲基)环丁烷甲醛和((5
‑
溴
‑2‑
甲氧基吡啶
‑3‑
基)甲基)膦酸二乙酯制备标题化合物。1h nmr(400mhz,cdcl3)δ8.07(d,j=2.4hz,1h),7.74(d,j=2.4hz,1h),6.49
‑
6.38(m,2h),3.96(s,3h),3.30
‑
3.24(m,1h),2.98
‑
2.88(m,1h),2.51
‑
2.45(m,2h),2.25
‑
2.20(m,2h)。
[0734]
步骤4:n
‑
(6
‑
甲氧基
‑5‑
((e)
‑2‑
(反式
‑3‑
(三氟甲基)环丁基)乙烯基)吡啶
‑3‑
基)甲磺酰胺
[0735]
按照与实例36类似的过程,由5
‑
溴
‑2‑
甲氧基
‑3‑
((e)
‑2‑
(反式
‑3‑
(三氟甲基)环丁基)乙烯基)吡啶(来自步骤3)和甲磺酰胺制备标题化合物,为白色固体(25mg,24%)。1h nmr(400mhz,cd3od)δ7.91(d,j=2.8hz,1h),7.72(d,j=2.8hz,1h),6.58
‑
6.49(m,2h),3.95(s,3h),3.27
‑
3.20(m,1h),3.07
‑
2.98(m,1h),2.94(s,3h),2.47
‑
2.41(m,2h),2.29
‑
2.22(m,2h)。lcms(esi
+
)m/z 350.9(m+h)
+
。
[0736]
实例38
[0737]
(e)
‑
n
‑
(5
‑
(2
‑
环己基乙烯基)
‑2‑
氟
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0738][0739]
步骤1:5
‑
溴
‑6‑
甲氧基
‑3‑
硝基吡啶
‑2‑
胺
[0740]
在0℃,向6
‑
甲氧基
‑3‑
硝基
‑2‑
吡啶胺(3.5g,20.7mmol)在dmf(40ml)中的溶液分批加入n
‑
溴琥珀酰亚胺(4.05g,22.7mmol)。将反应混合物在20℃搅拌2小时。将反应混合物倒入水(300ml)中。将得到的沉淀物过滤并真空干燥,得到标题化合物(4.5g,88%),为黄色固体。1h nmr(400mhz,cdcl3)δ8.50(s,1h),7.90(br s,1h),5.72(br s,1h),3.98(s,3h)。
[0741]
步骤2:3
‑
溴
‑6‑
氟
‑2‑
甲氧基
‑5‑
硝基吡啶
[0742]
在0℃,将5
‑
溴
‑6‑
甲氧基
‑3‑
硝基
‑
吡啶
‑2‑
胺(26.0g,104.8mmol)缓慢加入到hf/吡啶(200ml)的溶液中。将亚硝酸钠(7.1g,102.7mmol)缓慢地分批加入到反应混合物中,并将反应混合物搅拌1小时。将混合物倒入冰水(1l)中,并用etoac(500ml
×
2)萃取。合并有机层,并依次用1nnaoh溶液(900ml
×
2),饱和nahco3溶液(800ml)和盐水(800ml)洗涤。将有机层分离,经无水na2so4干燥,过滤并在真空下浓缩。残余物用硅胶柱色谱(在石油醚中的0
‑
10%etoac)纯化,得到标题化合物(19g,72%),为浅黄色固体。1h nmr(400mhz,cdcl3)δ8.67(d,j=8.0hz,1h),4.12(s,3h)。
[0743]
步骤3:5
‑
溴
‑2‑
氟
‑6‑
甲氧基吡啶
‑3‑
胺
[0744]
按照与实例22类似的过程,由5
‑
溴
‑2‑
氟
‑6‑
甲氧基
‑3‑
硝基
‑
吡啶制备标题化合物,为黄色固体(5.6g,64%)。lcms(esi
+
)m/z 222.8(m+h)
+
。
[0745]
步骤4:n
‑
(5
‑
溴
‑2‑
氟
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0746]
按照与实例22类似的过程,由5
‑
溴
‑2‑
氟
‑6‑
甲氧基
‑
吡啶
‑3‑
胺和甲磺酰氯制备标题化合物,为白色固体(7.2g,95%)。1h nmr(400mhz,cdcl3)δ8.06(d,j=8.8hz,1h),6.30(s,1h),3.98(s,3h),3.02(s,3h)。
[0747]
步骤5:n
‑
(2
‑
氟
‑6‑
甲氧基
‑5‑
乙烯基吡啶
‑3‑
基)甲磺酰胺
[0748]
按照与实例35类似的过程,由n
‑
(5
‑
溴
‑2‑
氟
‑6‑
甲氧基
‑3‑
吡啶基)甲磺酰胺(来自步骤4)和乙烯基硼酸频哪醇酯制备标题化合物,为白色固体(800mg,81%)。1h nmr(400mhz,cdcl3)δ7.92(d,j=9.6hz,1h),6.76(dd,j=18.0,11.2hz,1h),6.18(s,1h),5.79(d,j=18.0hz,1h),5.36(d,j=11.2hz,1h),3.95(s,3h),3.00(s,3h)。
[0749]
步骤6:(e)
‑
n
‑
(5
‑
(2
‑
环己基乙烯基)
‑2‑
氟
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0750]
按照与实例35类似的过程,由n
‑
(2
‑
氟
‑6‑
甲氧基
‑5‑
乙烯基
‑3‑
吡啶基)甲磺酰胺和碘代环己烷制备标题化合物,为白色固体(26.1mg,39%)。1hnmr(400mhz,cdcl3)δ7.88(d,
j=9.6hz,1h),6.41(d,j=16.4hz,1h),6.20(dd,j=16.4,6.8hz,1h),6.08(s,1h),3.94(s,3h),3.00(s,3h),2.21
‑
2.05(m,1h),1.83
‑
1.59(m,5h),1.37
‑
1.08(m,5h)。lcms(esi
+
)m/z 329.2(m+h)
+
。
[0751]
实例39
[0752]
(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑2‑
氟
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0753][0754]
按照与实例27类似的过程,由n
‑
(2
‑
氟
‑6‑
甲氧基
‑5‑
溴
‑3‑
吡啶基)甲磺酰胺和(e)
‑3‑
环戊基丙
‑1‑
烯基]硼酸制备标题化合物,为白色固体(74.7mg,68%)。1h nmr(400mhz,dmso
‑
d6)δ9.44(s,1h),7.85(d,j=9.6hz,1h),6.54
‑
6.21(m,2h),3.89(s,3h),3.02(s,3h),2.20(t,j=6.8hz,2h),1.98
‑
1.91(m,1h),1.79
‑
1.66(m,2h),1.62
‑
1.40(m,4h),1.27
‑
1.08(m,2h);lcms(esi
+
)m/z 329.3(m+h)
+
。
[0755]
实例40
[0756]
(e)
‑
n
‑
(5
‑
(3
‑
环戊基丙
‑1‑
烯
‑1‑
基)
‑2‑
氟
‑6‑
甲氧基吡啶
‑3‑
基)甲磺酰胺
[0757][0758]
按照与实例27类似的过程,由n
‑
(2
‑
氟
‑6‑
甲氧基
‑5‑
溴
‑3‑
吡啶基)甲磺酰胺和(e)
‑3‑
环戊基丙
‑1‑
烯基]硼酸制备标题化合物,为白色固体(74.7mg,68%)。1h nmr(400mhz,dmso
‑
d6)δ9.44(s,1h),7.85(d,j=9.6hz,1h),6.54
‑
6.21(m,2h),3.89(s,3h),3.02(s,3h),2.20(t,j=6.8hz,2h),1.98
‑
1.91(m,1h),1.79
‑
1.66(m,2h),1.62
‑
1.40(m,4h),1.27
‑
1.08(m,2h);lcms(esi
+
)m/z 329.3(m+h)
+
。
[0759]
实例41
[0760]
(r,e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑
n
‑
(1
‑
羟丁
‑2‑
基)
‑5‑
甲氧基吡啶甲酰胺
[0761]
实例40的总体反应方案如下:
[0762][0763]
步骤1:2
‑
氯
‑5‑
甲氧基异烟酰胺
[0764]
在
‑
78℃,向2
‑
氯
‑5‑
甲氧基
‑
吡啶(6.0g,42mmol)在thf(50ml)中的混合物滴加二异丙基氨基锂(在thf中2.0m,42ml,83.6mmol)。将反应混合物在
‑
78℃搅拌1小时。在
‑
78℃,将n,n
‑
二甲基甲酰胺(5.0ml,83.6mmol)加入到反应混合物中,并将混合物搅拌1小时。将饱和nh4cl溶液(100ml)加入到反应混合物中。将溶液用etoac(200ml
×
2)萃取。将合并的有机层经无水na2so4干燥并浓缩。残余物通过硅胶柱色谱(在石油醚中的0
‑
25%etoac)纯化,得到标题化合物(5.5g,77%),为白色固体。1h nmr(400mhz,cdcl3)δ10.41(s,1h),8.27(s,1h),7.59(s,1h),4.03(s,3h)。
[0765]
步骤2:(2
‑
氯
‑5‑
甲氧基吡啶
‑4‑
基)甲醇
[0766]
在15℃,向2
‑
氯
‑5‑
甲氧基
‑
吡啶
‑4‑
甲醛(6.0g,35.0mmol)在甲醇(50ml)中的混合物加入硼氢化钠(1.59g,42.0mmol)。将反应混合物在15℃搅拌1小时。将水(50ml)加入到反应混合物中,并将混合物浓缩。将残余物用水(200ml)稀释,用etoac(200ml
×
2)萃取。合并的有机层经无水na2so4干燥、过滤并浓缩,得到标题化合物(6.0g,99%),为白色固体,将其直接用于下一步。1h nmr(400mhz,cdcl3)δ7.91(s,1h),7.38(s,1h),4.69(s,2h),3.90(s,3h)。
[0767]
步骤3:4
‑
(溴甲基)
‑2‑
氯
‑5‑
甲氧基吡啶
[0768]
在0℃,向(2
‑
氯
‑5‑
甲氧基
‑4‑
吡啶基)甲醇(3.0g,17.3mmol)在二氯甲烷(30ml)中的混合物加入三溴化磷(560ul,5.9mmol)。将反应混合物在15℃搅拌2小时。浓缩溶液,并且残余物通过硅胶柱色谱(在石油醚中0
‑
20%etoac)纯化,得到标题化合物(1.9g,47%),为白色固体。1h nmr(400mhz,cdcl3)δ7.99(s,1h),7.29(s,1h),4.38(s,2h),3.97(s,3h)。
[0769]
步骤4:((2
‑
氯
‑5‑
甲氧基吡啶
‑4‑
基)甲基)膦酸二乙酯
[0770]
将4
‑
(溴甲基)
‑2‑
氯
‑5‑
甲氧基吡啶(1.9g,10.9mmol)在亚磷酸三乙酯(10ml)中的混合物在130℃搅拌3小时。浓缩反应混合物,得到标题化合物(2.4g,75%),为无色油状物,其无需纯化即可用于下一步。lcms(esi
+
)m/z 293.9(m+h)
+
。
[0771]
步骤5:4
‑
((二乙氧基磷酰基)甲基)
‑5‑
甲氧基吡啶甲酸甲酯
[0772]
将((2
‑
氯
‑5‑
甲氧基吡啶
‑4‑
基)甲基)膦酸二乙酯(2.4g,8.2mmol),碳酸钾(2.3g,
16.3mmol),乙酸钯(183mg,0.8mmol)和1,3
‑
双(二苯基膦基)丙烷(674mg,1.6mmol)在甲醇(50ml)中的混合物在co气氛(50psi)下在80℃加热16小时。过滤反应混合物并浓缩。残余物通过硅胶柱色谱(在dcm中的0
‑
10%meoh)纯化,得到标题化合物(1.7g,66%),为浅黄色油状物。1h nmr(400mhz,cdcl3)δ8.32(s,1h),8.08(d,j=2.4hz,1h),4.06(q,j=7.2hz,4h),4.01(s,3h),3.96(s,3h),3.30
‑
3.20(m,2h),1.26(t,j=7.2hz,6h)。
[0773]
步骤6:(e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基吡啶甲酸甲酯
[0774]
按照与实例36类似的过程,由4
‑
((二乙氧基磷酰基)甲基)
‑5‑
甲氧基吡啶甲酸甲酯和4,4
‑
二氟环己烷羧甲醛制备标题化合物,为白色固体(30mg,61%)。lcms(esi
+
)m/z 312.1(m+h)
+
。
[0775]
步骤7:(e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基吡啶甲酸
[0776]
按照与实例35类似的过程,由(e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基吡啶甲酸甲酯制备标题化合物,为白色固体(30mg,90%)。lcms(esi
+
)m/z 298.0(m+h)
+
。
[0777]
步骤8:(r,e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑
n
‑
(1
‑
羟丁
‑2‑
基)
‑5‑
甲氧基吡啶甲酰胺
[0778]
按照与实例35类似的过程,由(e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基吡啶甲酸和(r)
‑2‑
氨基
‑1‑
丁烯(13mg,0.15mmol)制备标题化合物,为白色固体(8.1mg,22%)。1h nmr(400mhz,cd3od)δ8.29(s,1h),8.11(s,1h),6.74(d,j=16.0hz,1h),6.55(dd,j=16.0,6.8hz,1h),4.01(s,3h),3.99
‑
3.93(m,1h),3.67
‑
3.58(m,2h),2.36
‑
2.32(m,1h),2.08
‑
2.05(m,2h),1.93
‑
1.85(m,3h),1.81
‑
1.66(m,2h),1.62
‑
1.51(m,3h),0.95(t,j=7.2hz,3h)。lcms(esi
+
)m/z 369.1(m+h)
+
。
[0779]
实例42
[0780]
n
‑
((r)
‑1‑
羟丁
‑2‑
基)
‑5‑
甲氧基
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺
[0781][0782]
步骤1:反式
‑
n
‑
甲氧基
‑
n
‑
甲基
‑4‑
(三氟甲基)环己烷甲酰胺
[0783]
将反式
‑4‑
(三氟甲基)环己烷甲酸(4.5g,22.94mmol),n,o
‑
二甲基羟胺盐酸盐(2.68g,27.53mmol),hatu(10.47g,27.53mmol)和dipea(11.32ml,68.82mmol)在dmf(60ml)中的混合物在15℃搅拌3小时。将反应混合物在etoac(100ml)中稀释,用盐水(100ml
×
3)洗涤。有机层经无水na2so4干燥、过滤并浓缩。粗残余物通过硅胶柱色谱(在石油醚中40%etoac)纯化,得到标题化合物(3.9g,71%),为固体。1h nmr(400mhz,cdcl3)δ3.71(s,3h),3.19(s,3h),2.71
‑
2.69(m,1h),2.08
‑
2.02(m,3h),1.94
‑
1.90(m,2h),1.56
‑
1.53(m,2h),1.39
‑
1.36(m,2h)。
[0784]
步骤2:反式
‑4‑
(三氟甲基)环己烷甲醛
[0785]
按照与实例36类似的过程,由反式
‑
n
‑
甲氧基
‑
n
‑
甲基
‑4‑
(三氟甲基)环己烷甲酰
胺制备标题化合物,为浅黄色油状物(1.2g,80%)。1h nmr(400mhz,cdcl3)δ9.65(s,1h),2.24
‑
2.00(m,6h),1.40
‑
1.27(m,4h)。
[0786]
步骤3:5
‑
甲氧基
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环丁基)乙烯基)吡啶甲酸甲酯
[0787]
按照与实例36类似的过程,由4
‑
((二乙氧基磷酰基)甲基)
‑5‑
甲氧基吡啶甲酸甲酯和反式
‑4‑
(三氟甲基)环己烷甲醛制备标题化合物,为白色固体(250mg,77%)。1h nmr(400mhz,cdcl3)δ8.32(s,1h),8.16(s,1h),6.65(d,j=16.4hz,1h),6.50(dd,j=16.0,6.8hz,1h),4.02(s,3h),3.99(s,3h),2.22
‑
2.20(m,1h),2.06
‑
1.98(m,5h),1.45
‑
1.41(m,2h),1.29
‑
1.25(m,2h)。
[0788]
步骤4:5
‑
甲氧基
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酸
[0789]
按照与实例35类似的过程,由5
‑
甲氧基
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酸甲酯制备标题化合物,为白色固体(200mg,83%)。lcms(esi
+
)m/z 330.1(m+h)
+
。
[0790]
步骤5:n
‑
((r)
‑1‑
羟丁
‑2‑
基)
‑5‑
甲氧基
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺
[0791]
按照与实例35类似的过程,由5
‑
甲氧基
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酸和(r)
‑2‑
氨基
‑1‑
丁醇(32mg,0.36mmol)制备标题化合物,为浅黄色固体(55mg,45%)。1h nmr(400mhz,cd3od)δ8.30(s,1h),8.12(s,1h),6.71(d,j=16.0hz,1h),6.57(dd,j=16.0,6.8hz,1h),4.03(s,3h),4.00
‑
3.95(m,1h),3.69
‑
3.61(m,2h),2.26
‑
2.10(m,2h),2.03
‑
1.95(m,4h),1.80
‑
1.58(m,2h),1.48
‑
1.27(m,4h),0.99(t,j=7.2hz,3h)。lcms(esi
+
)m/z 401.1(m+h)
+
。
[0792]
实例43
[0793]
(s,e)
‑
n
‑
(2,3
‑
二羟丙基)
‑5‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶甲酰胺
[0794][0795]
步骤1:螺[2.3]己烷
‑5‑
甲酸甲酯
[0796]
在0℃,向et2zn(11.89ml,11.89mmol)在dcm(10ml)中的溶液滴加tfa(0.88ml,11.89mmol)在dcm(10ml)中的溶液,持续30分钟。在0℃,滴加ch2i2(0.96ml,11.89mmol)在dcm(10ml)中的溶液,持续45分钟。将反应混合物在0℃搅拌1小时。将3
‑
亚甲基环丁烷甲酸甲酯(500mg,3.96mmol)在dcm(5ml)中的溶液添加到反应混合物中。将反应混合物温热至15℃,并持续16小时。将饱和nh4cl溶液(50ml)加入到反应混合物中,并将混合物用dcm(50ml
×
2)萃取。将合并的有机层经无水na2so4干燥、过滤并且浓缩。粗残余物通过硅胶柱色谱(在石油醚中10%etoac)纯化,得到标题化合物(400mg,72%),为黄色油状物。1h nmr(400mhz,cdcl3)δ3.71(s,3h),3.34
‑
3.27(m,1h),2.53
‑
2.48(m,2h),2.26
‑
2.20(m,2h),0.49
‑
0.42(m,4h)。
[0797]
步骤2:螺[2.3]己烷
‑5‑
甲醛
[0798]
按照与实例36类似的过程,由螺[2.3]己烷
‑5‑
甲酸酯制备标题化合物,为浅黄色油状物(220mg,70%)。1h nmr(400mhz,cdcl3)δ9.83(s,1h),3.31
‑
3.24(m,1h),2.44
‑
2.39(m,2h),2.31
‑
2.26(m,2h),0.50
‑
0.40(m,4h)。
[0799]
步骤3:(e)
‑5‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶甲酸甲酯
[0800]
按照与实例36类似的过程,由4
‑
(二乙氧基磷酰基甲基)
‑5‑
甲氧基
‑
吡啶
‑2‑
甲酸甲酯和螺[2.3]己烷
‑5‑
甲醛制备标题化合物,为浅黄色油状物(150mg,58%)。lcms(esi
+
)m/z 274.0(m+h)
+
。
[0801]
步骤4:(e)
‑5‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶甲酸
[0802]
按照与实例35类似的过程,由(e)
‑5‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶甲酸甲酯制备标题化合物,为浅黄色固体(100mg,70%)。lcms(esi
+
)m/z 260.0(m+h)
+
。
[0803]
步骤5:(s,e)
‑
n
‑
(2,3
‑
二羟丙基)
‑5‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶甲酰胺
[0804]
按照与实例35类似的过程,由(e)
‑5‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶甲酸(来自步骤4)和(s)
‑3‑
氨基
‑
1,2
‑
丙二醇制备标题化合物,为浅黄色固体(20mg,31%)。1h nmr(400mhz,cd3od)δ8.28(s,1h),8.14(s,1h),6.84(dd,j=16.0,6.8hz,1h),6.64(d,j=16.0hz,1h),4.02(s,3h),3.82
‑
3.80(m,1h),3.65
‑
3.55(m,3h),3.45
‑
3.43(m,1h),3.33
‑
3.31(m,1h),2.31
‑
2.18(m,4h),0.51
‑
0.40(m,4h)。lcms(esi
+
)m/z 333.1(m+h)
+
。
[0805]
实例44
[0806]
(r,e)
‑
n
‑
(1
‑
羟丁
‑2‑
基)
‑5‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶甲酰胺
[0807][0808]
按照与实例35类似的过程,由(e)
‑5‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)吡啶甲酸和(r)
‑2‑
氨基
‑1‑
丁醇制备标题化合物。1hnmr(400mhz,cd3od)δ8.29(s,1h),8.15(s,1h),6.84(dd,j=16.0,6.8hz,1h),6.65(d,j=16.0hz,1h),4.03
‑
3.97(m,4h),3.69
‑
362(m,2h),3.35
‑
3.33(m,1h),2.31
‑
2.18(m,4h),1.75
‑
1.60(m,2h),1.00
‑
0.96(m,3h),0.51
‑
0.40(m,4h)。lcms(esi
+
)m/z 333.1(m+h)
+
。
[0809]
实例45
[0810]
n
‑
(6
‑
甲氧基
‑5‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)哒嗪
‑3‑
基)甲磺酰胺
[0811]
实例45的总体反应方案如下:
[0812][0813]
步骤1:6
‑
氯
‑3‑
甲氧基哒嗪
‑4‑
甲醛
[0814]
在
‑
78℃,向2,2,6,6
‑
四甲基哌啶(2.6ml,15.2mol)在四氢呋喃(25ml)中的溶液中加入正丁基锂(2.5m,6.1ml,15.2mmol)。将反应混合物在0℃搅拌30分钟。然后将混合物冷却到
‑
78℃。逐滴加入3
‑
氯
‑6‑
甲氧基哒嗪(2.0g,13.8mmol)在thf(10ml)中的溶液(预冷至
‑
78℃)。将所得混合物在
‑
78℃搅拌30分钟。滴加n,n
‑
二甲基甲酰胺(1.33ml,41.5mmol,预冷至
‑
78℃)。将反应混合物在
‑
78℃搅拌90分钟。向反应混合物中加入浓hcl(10ml),etoh(15ml)和thf(20ml)的预混合溶液。将反应混合物温热至15℃,并用etoac(100ml
×
2)萃取。将合并的有机层用无水na2so4干燥、过滤并且浓缩,得到标题化合物(2.3g,96%),为浅棕色油状物,其无需进一步纯化即可立即用于下一步。
[0815]
步骤2:(6
‑
氯
‑3‑
甲氧基哒嗪
‑4‑
基)甲醇
[0816]
在15℃,向6
‑
氯
‑3‑
甲氧基
‑
哒嗪
‑4‑
甲醛(来自步骤1,2.3g,13.3mmol)在甲醇(30ml)中的混合物加入硼氢化钠(0.61g,16.0mmol)。将反应在15℃搅拌16小时。向反应混合物中加入水(20ml),并将混合物浓缩以除去有机溶剂。将剩余溶液用etoac(100ml
×
2)进行萃取。合并的有机层经无水na2so4干燥,浓缩并通过柱(在石油醚中的0
‑
30%etoac)纯化,得到标题化合物(1.9g,86%纯度),为白色固体。1h nmr(400mhz,cdcl3)δ7.58(t,j=1.6hz,1h),4.75(d,j=5.6hz,2h),4.13(s,3h),2.60(t,j=5.6hz,1h)。
[0817]
步骤3:6
‑
氯
‑4‑
(氯甲基)
‑3‑
甲氧基哒嗪
[0818]
在0℃,向(6
‑
氯
‑3‑
甲氧基
‑
哒嗪
‑4‑
基)甲醇(来自步骤2,1.0g,5.7mmol)在二氯甲烷(15ml)中的混合物加入亚硫酰氯(1.7ml,22.9mmol)。混合物在0℃搅拌1小时。浓缩混合物,得到标题化合物(1.1g,99%),为黑色固体。粗产物无需进一步纯化即可立即用于下一步。
[0819]
步骤4:((6
‑
氯
‑3‑
甲氧基哒嗪
‑4‑
基)甲基)膦酸二乙酯
[0820]
按照与实例41类似的过程,由6
‑
氯
‑4‑
(氯甲基)
‑3‑
甲氧基
‑
哒嗪和亚磷酸三乙酯制备标题化合物,为浅棕色油状物(1.3g,77%纯度)。1h nmr(400mhz,cdcl3)δ7.40(s,1h),4.13(s,3h),4.10(q,j=7.2hz,4h),3.17
‑
3.09(m,2h),1.30(t,j=7.2hz,6h)。
[0821]
步骤5:6
‑
氯
‑3‑
甲氧基
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)哒嗪
[0822]
按照与实例36类似步骤2的过程,由((6
‑
氯
‑3‑
甲氧基哒嗪
‑4‑
基)甲基)膦酸二乙酯和4
‑
(三氟甲基)环己烷甲醛制备标题化合物,为无色油状物(220mg,40%)。1h nmr(400mhz,cdcl3)δ7.34(s,1h),6.57(dd,j=16.0,6.8hz,1h),6.47
‑
6.40(d,j=16.0hz,1h),4.15(s,3h),2.30
‑
2.17(m,1h),2.11
‑
1.92(m,5h),1.50
‑
1.32(m,2h),1.31
‑
1.16(m,2h)。lcms(esi
+
)m/z 321.0(m+h)
+
。
[0823]
步骤6:n
‑
(6
‑
甲氧基
‑5‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)哒嗪
‑3‑
基)甲磺酰胺
[0824]
按照与实例36类似的过程,由6
‑
氯
‑3‑
甲氧基
‑4‑
[(e)
‑2‑
[反式
‑4‑
(三氟甲基)环己基]乙烯基]哒嗪和甲磺酰胺制备标题化合物,为白色固体(16.8mg,14%)。1h nmr(400mhz,cd3od)δ7.60(s,1h),6.71(dd,j=16.0,6.8hz,1h),6.48(d,j=16.0hz,1h),3.97(s,3h),3.05(s,3h),2.30
‑
2.19(m,1h),2.18
‑
2.06(m,1h),2.02
‑
1.88(m,4h),1.46
‑
1.28(m,4h)。lcms(esi
+
)m/z380.1(m+h)
+
。
[0825]
实例46
[0826]
n
‑
((r)
‑1‑
羟丁
‑2‑
基)
‑6‑
甲氧基
‑5‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)哒嗪
‑3‑
甲酰胺
[0827][0828]6‑
氯
‑3‑
甲氧基
‑4‑
[(e)
‑2‑
[反式
‑4‑
(三氟甲基)环己基]乙烯基]哒嗪(130mg,0.4mmol),(r)
‑2‑
氨基
‑1‑
丁醇(108mg,1.2mmol),乙酸钯(9mg,0.04mmol),1,3
‑
双(二苯基膦基)丙烷(33.4mg,0.08mmol)和碳酸钾(168mg,1.22mmol)在n,n
‑
二甲基甲酰胺(5ml)中的混合物在co气氛(50psi)下在80℃加热16小时。将溶液用etoac(20ml)稀释,用水(5ml
×
3)洗涤。有机层经无水na2so4干燥、过滤并浓缩。将残余物通过制备型tlc(在dcm中的10%meoh)纯化,得到粗产物(30mg),将其通过反相色谱(phenomenex gemini 150*25mm*10um,水(0.05%氢氧化氨v/v)
‑
acn,49%
‑
79%)进一步纯化,得到标题化合物(7.4mg,5%),为白色固体。1h nmr(400mhz,cd3od)δ8.12(s,1h),6.74(dd,j=16.0,7.2hz,1h),6.56(d,j=16.0hz,1h),4.19(s,3h),4.06
‑
3.97(m,1h),3.66
‑
3.64(m,2h),2.26
‑
2.30(m,1h),2.18
‑
2.07(m,1h),1.99
‑
1.95(m,4h),1.81
‑
1.54(m,2h),1.45
‑
1.26(m,4h),0.97(t,j=7.6hz,3h)。lcms(esi
+
)m/z 402.1(m+h)
+
。
[0829]
实例47
[0830]
(r,e)
‑
n
‑
(1
‑
羟丁
‑2‑
基)
‑6‑
甲氧基
‑5‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)哒嗪
‑3‑
甲酰胺
[0831][0832]
步骤1:(e)
‑6‑
氯
‑3‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)哒嗪
[0833]
按照与实例45类似的过程,由((6
‑
氯
‑3‑
甲氧基哒嗪
‑4‑
基)甲基)膦酸二乙酯和螺[2.3]己烷
‑5‑
甲醛制备标题化合物,为浅黄色油状物(0.25g,49%)。1h nmr(400mhz,cdcl3)δ7.38(s,1h),6.89(dd,j=15.6,7.6hz,1h),6.40(d,j=16.0hz,1h),4.16(s,3h),3.39
‑
3.29(m,1h),2.32
‑
2.27(m,2h),2.22
‑
2.17(m,2h),0.50
‑
0.41(m,4h)。
[0834]
步骤2:(r,e)
‑
n
‑
(1
‑
羟丁
‑2‑
基)
‑6‑
甲氧基
‑5‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)哒嗪
‑3‑
甲酰胺
[0835]
按照与实例46类似的过程,由(e)
‑6‑
氯
‑3‑
甲氧基
‑4‑
(2
‑
(螺[2.3]己
‑5‑
基)乙烯基)哒嗪和(r)
‑
(
‑
)
‑2‑
氨基
‑1‑
丁醇制备标题化合物,为浅黄色固体(50mg,25%)。1h nmr(400mhz,cd3od)δ8.15(s,1h),7.05(dd,j=15.6,7.6hz,1h),6.52(d,j=16.0hz,1h),4.21(s,1h),4.08
‑
4.02(m,1h),3.68
‑
3.67(m,2h),3.38
‑
3.31(m,1h),2.32
‑
2.22(m,4h),1.82
‑
1.71(m,1h),1.68
‑
1.57(m,1h),1.01
‑
0.98(t,j=7.2hz,3h),0.51
‑
0.41(m,4h)。lcms(esi
+
)m/z 332.0(m+h)
+
。
[0836]
实例48
[0837]
(e)
‑
n
‑
(5
‑
甲氧基
‑4‑
(2
‑
(4
‑
(三氟甲基)环己基)乙烯基)吡啶
‑2‑
基)甲磺酰胺
[0838][0839]
步骤1:(e)
‑
n
‑
(5
‑
甲氧基
‑4‑
(2
‑
(4
‑
(三氟甲基)环己基)乙烯基)吡啶
‑2‑
基)甲磺酰胺
[0840]
将((5
‑
甲氧基
‑2‑
(甲基磺酰胺基)吡啶
‑4‑
基)甲基)膦酸二乙酯(59mg,0.167mmol)溶于thf(0.5ml)中并冷却至0℃。随后在氩气气氛下加入nah(10mg,0.251mmol,1.5eq.,60%),并将混合物在0℃搅拌30分钟。在0℃,将4
‑
(三氟甲基)环己烷
‑1‑
甲醛(30.2mg,0.167)加入到反应中,并将混合物在rt搅拌直至观察到起始材料耗尽。将反应混合物倒入冰水中,并将化合物萃取至乙酸乙酯(3x2 ml)中,并将合并的有机层用无水na2so4干燥,过滤并在真空下浓缩以产生油状物。粗产物通过使用快速色谱,使用dcm和meoh作为梯度纯化,得到灰白色固体(39mg,61.5%)。lcms(esi+)m/z 379.0。1h nmr(400mhz,dmso
‑
d6)δ=10.10(br s,1h),8.02(br s,1h),7.02(s,1h),6.58
‑
6.48(m,1h),6.44
‑
6.31(m,1h),3.86(s,3h),3.21(s,3h),2.32
‑
2.13(m,2h),1.96
‑
1.81(m,4h),1.40
‑
1.20(m,4h)。
[0841]
实例49
[0842]
n
‑
[3
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑4‑
甲氧基
‑
苯基]环丙磺酰胺
[0843][0844]
步骤1:(e)
‑3‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯胺
[0845]
向100ml螺旋顶部小瓶中加入3
‑
溴
‑4‑
甲氧基
‑
苯胺(1g,4.9mmol),磷酸三碱(2equiv.,9.8985mmol),4
‑
氯
‑
β
‑
苯乙烯基硼酸频哪醇酯(1.5equiv.,7.4239mmol),氯(2
‑
二环己基膦基
‑
2',6'
‑
二甲氧基
‑
1,1'
‑
联苯)(2'
‑
氨基
‑
1,1'
‑
联苯
‑2‑
基)钯(ii)(0.05equiv.,0.24746mmol),二环己基((2
‑
[(2,6
‑
二甲氧基苯基)甲基]苯基)甲基)膦(0.05equiv.,0.24746mmol)和10:1甲苯/水(0.25m,20ml)。然后将反应加热至80℃过夜。将反应冷却至rt,用过滤,用mgso4干燥并浓缩。然后将有机物通过硅胶色谱(从0%
庚烷到100%iproac)纯化,得到3
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑4‑
甲氧基苯胺(1g,3.851mmol),77%产率。lcms(esi+)m/z 259.9(m+h)
+1
h nmr(400mhz,dmso
‑
d6)δ=7.58
–
7.53(m,2h),7.42
–
7.38(m,2h),7.34(d,j=16.5hz,1h),7.02(d,j=16.5hz,1h),6.88(d,j=2.7hz,1h),6.77(d,j=8.7hz,1h),6.54(dd,j=8.6,2.7hz,1h),3.72(s,3h)。
[0846]
步骤2:n
‑
[3
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑4‑
甲氧基
‑
苯基]环丙磺酰胺
[0847]
向100ml小瓶中加入3
‑
[(i)
‑2‑
(4
‑
氯苯基)乙烯基]
‑4‑
甲氧基苯胺(100mg,0.39mmol),n,n
‑
二异丙基乙胺(4equiv.,1.54mmol),环丙烷磺酰氯(1.5equiv.,0.5776mmol)和二氯甲烷(0.2m,2ml)。搅拌反应直至lc
‑
ms表明起始材料已耗尽,然后通过0.45μm过滤器过滤并浓缩。将有机物通过反相hplc(在水中0.1%甲酸/乙腈40
‑
80,gemini
‑
nx c18 10um)纯化,得到n
‑
[3
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑4‑
甲氧基
‑
苯基]环丙磺酰胺(53.5mg,0.147mmol,38.2%)。lcms(esi+)m/z 364.0(m)
+1
h nmr(400mhz,dmso
‑
d6)δ9.39(s,1h),7.65
–
7.54(m,2h),7.51
–
7.34(m,4h),7.21
–
6.99(m,3h),3.84(s,3h),2.59
–
2.53(m,1h),1.00
–
0.82(m,4h)。
[0848]
实例50
[0849]
(e)
‑2‑
氰基
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)
‑2‑
甲基丙烷
‑1‑
磺酰胺
[0850][0851]
将5
‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑6‑
甲氧基
‑
吡啶
‑3‑
胺(50mg,0.18mmol)稀释于吡啶(0.2m,1ml)中,然后加入2
‑
氰基
‑2‑
甲基
‑
丙烷
‑1‑
磺酰氯(36mg,1.1equiv.,0.2050mmol)。搅拌反应直至lc
‑
ms表明起始材料已耗尽。然后将反应混合物通过0.45um过滤器过滤并浓缩。将反应通过sfc(5
‑
60%,在水中的1%nh4oh,吡啶基酰胺)纯化,得到2
‑
氰基
‑
n
‑
[5
‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑6‑
甲氧基
‑3‑
吡啶]
‑2‑
甲基
‑
丙烷
‑1‑
磺酰胺(31.4mg,0.0759mmol,41%)。lcms(esi+)m/z 414.1(m+h)
+1
h nmr(400mhz,dmso
‑
d6)δ9.75(s,1h),8.27(d,j=2.5hz,1h),7.98(d,j=2.5hz,1h),6.53(dd,j=16.3,1.2hz,1h),6.32(dd,j=16.2,6.9hz,1h),3.90(s,3h),3.34(s,2h),2.41
–
2.29(m,1h),2.16
–
1.77(m,6h),1.52(m 8h)。
[0852]
实例51
[0853]
(e)
‑3‑
(4
‑
氯苯乙烯基)
‑
n
‑
(4
‑
羟丁
‑2‑
基)
‑4‑
甲氧基苯甲酰胺
[0854][0855]
步骤1:3
‑
甲酰基
‑4‑
羟基苯甲酸乙酯
[0856]
向4
‑
羟基苯甲酸乙酯(100g,0.6mol)和et3n(450ml,3.6mol)在dce(1l)中的溶液添加mgcl2(285g,3mol),并将混合物在40℃搅拌1h。加入多聚甲醛(180g,6mol),并将混合
物在70℃搅拌3小时。冷却至0℃后,加入1m hcl(3l)。过滤混合物,并用dcm(170ml)洗涤。将有机层分离,用1m hcl(170ml)和盐水(170ml)洗涤,经无水na2so4干燥,并在真空中浓缩。将粗产物通过硅胶柱色谱纯化,得到所需的产物(80g,68%)。1h nmr(300mhz,cdcl3):d 11.40(s,1h),9.97(s,1h),8.34(s,1h),8.21(d,j=10.8hz,1h),7.05(d,j=8.7hz,1h),4.41(q,j=7.2hz,2h),1.42(t,j=7.2hz,2h)。
[0857]
步骤2:3
‑
甲酰基
‑4‑
甲氧基苯甲酸乙酯
[0858]
向3
‑
甲酰基
‑4‑
羟基苯甲酸乙酯(155g,0.8mol,1eq)在丙酮(1.5l)中的溶液加入k2co3(144g,1.04mol,1.3eq)和me2co3(86.4g,0.96mol,1.2eq)。将所得混合物搅拌并回流1h。冷却后,过滤不溶物,并将滤饼用etoac(100ml x 3)洗涤。将过滤物用etoac(1l)和nahco3水溶液(1l)稀释。分离有机层,并且水层用etoac(3x1 l)萃取。合并的有机层用水(2x1l)洗涤,并用mgso4干燥。蒸发溶剂,得到粗产物3
‑
甲酰基
‑4‑
甲氧基苯甲酸乙酯,将其在硅胶柱上纯化,得到所需产物(115g,69%)。1hnmr(300mhz,cdcl3):10.47(s,1h),8.51(s,1h),8.26(d,j=10.8hz,1h),7.05(d,j=8.7hz,1h),4.38(q,j=7.2hz,2h),4.02(s,3h),1.41(t,j=7.2hz,2h)。
[0859]
步骤3:(e)
‑3‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯甲酸乙酯
[0860]
在0℃,向(4
‑
氯苄基)膦酸二乙酯(160g,0.61mol)在甲苯(1.5l)中的溶液添加叔戊醇钠(89g,0.87mol),并将混合物在0℃搅拌20分钟。然后在20分钟内滴加3
‑
甲酰基
‑4‑
甲氧基苯甲酸乙酯(120g,0.58mol,1eq)在thf(500ml)中的溶液,并将反应混合物在0℃搅拌1.5h。将反应混合物倒入饱和nh4cl水溶液(3l)中,并用etoac(2l x 2)萃取。将有机层合并,用盐水(2l)洗涤,经无水na2so4干燥,过滤并真空浓缩,得到粗(e)
‑3‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯甲酸乙酯(204g)。将所得粗产物不经纯化直接用于下一步。
[0861]
步骤4:(e)
‑3‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯甲酸
[0862]
向粗(e)
‑3‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯甲酸乙酯(160g)在meoh(1l)中的溶液加入20%的koh水溶液(260ml)。将混合物在65℃搅拌2h,并且然后冷却至0℃。通过添加1m hcl将反应混合物的ph调节至3。过滤所得沉淀物,得到所需的产物(e)
‑3‑
(4
‑
氯苯乙烯基)
‑4‑
甲氧基苯甲酸(104g)。lcms(esi+)m/z 286.7(m
‑
h)
‑1h nmr(300mhz,dmso
‑
d6):d 12.77(br,1h),8.21(s,1h),7.89(d,j=8.7hz,1h),7.66
‑
7.63(m,2h),7.46
‑
7.41(m,3h),7.27
‑
7.17(m,1h),7.15(d,j=8.7hz,1h),3.94(s,3h)。
[0863]
步骤5:((e)
‑3‑
(4
‑
氯苯乙烯基)
‑
n
‑
(4
‑
羟丁
‑2‑
基)
‑4‑
甲氧基苯甲酰胺
[0864]
将3
‑
[(e)
‑2‑
(4
‑
氯苯基)乙烯基]
‑4‑
甲氧基
‑
苯甲酸(100mg,0.3464mmol)加入到20ml小瓶中,然后加入dmf(0.2m,1.2ml),然后加入三乙胺(0.193ml,1.4mmol),然后加入pybop(270mg,0.51mmol)。将反应搅拌30分钟,并且然后加入3
‑
氨基
‑
丁
‑1‑
醇(62mg,0.6928mmol)。用饱和碳酸钠水溶液淬灭反应,用iproac萃取,用mgso4干燥、过滤并浓缩。粗产物通过手性sfc(25%meoh w/0.1%nh4oh,chiralpak ic,峰2(rt=1.14min))纯化,以20%的产率得到所需产物(25.2mg)。lcms(esi+)m/z 360.1(m+1)
+1
h nmr(400mhz,dmso
‑
d6)δ8.16
–
8.07(m,2h),7.80(dd,j=8.7,2.2hz,1h),7.67
–
7.58(m,2h),7.48
–
7.38(m,3h),7.28(d,j=16.5hz,1h),7.11(d,j=8.7hz,1h),4.43(t,j=5.1hz,1h),4.13(m,1h),3.91(s,3h),3.46(m,2h),1.79
–
1.57(m,2h),1.17(d,j=6.6hz,3h)。
[0865]
实例52
[0866]
(e)
‑
n
‑
(6
‑
环丙基
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)吡啶
‑3‑
基)甲磺酰胺
[0867]
实例52的总体反应方案如下:
[0868][0869]
步骤1:3
‑
(溴甲基)
‑2‑
氯
‑5‑
硝基吡啶
[0870]
向2
‑
氯
‑3‑
甲基
‑5‑
硝基吡啶(1.72g,10mmol)在ccl4(20ml)中的溶液加入nbs(1.96g,11mmol)和aibn(164mg,1mmol)。将反应混合物在密封管中加热至120℃并搅拌2h。然后将反应冷却至室温,并减压浓缩,得到粗残余物。加入20ml水,并将有机物用etoac(20ml x 3)萃取。合并的有机层经na2so4干燥、过滤并浓缩,得到粗残余物。将残余物在硅胶色谱上纯化,得到标题化合物(900mg,36%)。1h nmr(300mhz,cdcl3):d 9.19(s,1h),8.61(s,1h),4.63(s,2h)。
[0871]
步骤2:((2
‑
氯
‑5‑
硝基吡啶
‑3‑
基)甲基)膦酸二乙酯
[0872]
向3
‑
(溴甲基)
‑2‑
氯
‑5‑
硝基吡啶(900mg,3.6mmol)在1,4
‑
二噁烷(10ml)中的溶液加入亚磷酸三乙酯(1.2g,7.2mmol)。将反应混合物加热至回流并搅拌过夜。减压浓缩反应混合物,得到粗残余物,将其在硅胶色谱上纯化,得到标题化合物(300mg,27%)。1h nmr(300mhz,cdcl3):d 9.11(s,1h),8.56(s,1h),4.15
‑
4.11(m,4h),3.44(d,j=21.9hz,2h),1.33
‑
1.11(m,6h)。
[0873]
步骤3:(e)
‑2‑
氯
‑3‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
硝基吡啶
[0874]
将二异丙胺(0.4ml,2.8mmol)在thf(15ml)中的溶液在氩气气氛下冷却至
‑
78℃。缓慢加入正丁基锂(1.12ml,在己烷中2.5m),然后加入((2
‑
氯
‑5‑
硝基吡啶
‑3‑
基)甲基)膦酸二乙酯(862mg,2.8mmol)在thf(10ml)中的溶液。将混合物温热至0℃,然后搅拌1小时。滴加4,4
‑
二氟环己烷
‑1‑
甲醛(370mg,2.5mmol)在无水thf(15ml)中的溶液。将反应在0℃保持2小时,然后温热至室温并搅拌24小时。用饱和nh4cl水溶液淬灭反应,并用etoac萃取。干燥合并的有机相,过滤并浓缩至干。硅胶色谱得到标题化合物(250mg,29%)。1h nmr(300mhz,cdcl3)d 9.08(s,1h),8.57(s,1h),6.75(d,j=15.6hz,1h),6.44
‑
6.36(m,1h),2.42
‑
2.40(m,1h),2.20
‑
2.18(m,2h),1.94
‑
1.58(m,6h)。
[0875]
步骤4:(e)
‑6‑
氯
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)吡啶
‑3‑
胺
[0876]
向(e)
‑2‑
氯
‑3‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
硝基吡啶(600mg,2mmol)在乙酸(3ml)中的搅拌溶液中加入铁粉(560mg,10mmol)。将反应加热至80℃并搅拌2小时。此时,将反应物通过过滤,并用乙酸洗涤。将滤液蒸发至干,然后用饱和碳酸氢钠水溶液将溶液调节至ph为8。用二氯甲烷(5ml x 5)萃取有机物。将合并的有机层用盐水洗涤,经na2so4干燥、过滤并浓缩,得到标题化合物,其无需进一步纯化即可直接用于下一步(450mg,粗品)。1h nmr(300mhz,cdcl3):d 7.79(s,1h),7.15(s,1h),6.65(d,j=15.6hz,1h),6.15
‑
6.07(m,1h),3.53(br,2h),2.32
‑
2.30(m,1h),2.17
‑
2.14(m,2h),1.92
‑
1.57(m,6h)。
[0877]
步骤5:(e)
‑
n
‑
(6
‑
氯
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)吡啶
‑3‑
基)甲磺酰胺
[0878]
将(e)
‑6‑
氯
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)吡啶
‑3‑
胺(450mg,1.65mmol)和吡啶(156.4mg,1.98mmol,1.2eq)在dcm(3ml)中的溶液冷却至10℃。向溶液中滴加甲磺酰氯(225.7mg,1.98mmol)。将反应混合物温热至室温,并且继续搅拌20小时。然后将反应混合物用dcm(5ml)稀释,并用水(10ml)和盐水洗涤。将有机层用无水硫酸钠干燥并浓缩,得到粗残余物。有机物质在硅胶色谱上纯化,得到标题化合物(210mg,步骤4和5总计36%)。1h nmr(300mhz,cdcl3):d 8.19(s,1h),7.92
‑
7.86(m,2h),6.66(d,j=15.6hz,1h),6.28
‑
6.21(m,1h),3.09(s,3h),2.34
‑
2.30(m,1h),2.14
‑
2.07(m,2h),1.89
‑
1.57(m,6h)。
[0879]
步骤6:(e)
‑
n
‑
(6
‑
环丙基
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)吡啶
‑3‑
基)甲磺酰胺
[0880]
将(e)
‑
n
‑
(6
‑
氯
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)吡啶
‑3‑
基)甲磺酰胺(150mg,0.4276mmol),四(三苯基膦)钯(0)(49mg,0.043mmol),碳酸钾(236mg,1.71mmol)和环丙基硼酸(116mg,1.28mmol)装入10ml密封管中。然后加入1,4
‑
二噁烷(0.85ml)和水(0.09ml),并且将溶液用氮气脱气5分钟,然后密封。然后将反应加热至110℃并保持72小时,此时将其冷却至室温。将有机物通过0.45um过滤器过滤并浓缩。通过非手性sfc(在meoh中的5
‑
15%co2/0.1%nh4oh,torus dea柱)纯化,得到标题化合物(10.3mg,7%产率)。lcms(esi+)m/z 357.2(m+1)
+1
h nmr(400mhz,dmso
‑
d6)δ9.69(s,1h),8.15(d,j=2.4hz,1h),7.53(d,j=2.4hz,1h),6.85(dd,j=16.0,1.3hz,1h),6.15(dd,j=16.0,6.8hz,1h),2.99(s,3h),2.45
–
2.31(m,1h),2.23(m,1h),2.06(m,2h),1.99
–
1.78(m,4h),1.57
–
1.38(m,2h),0.95
–
0.85(m,4h)。
[0881]
实例53
[0882]
实例53a:制备4,4
‑
二氟环己烷甲醛和结构的中间体:
[0883][0884]
在
‑
78℃,向4,4
‑
二氟环己烷甲酸乙酯(1.0g,5.2mmol)在二氯甲烷(20ml)中的混合物加入dibal
‑
h(4.8ml,4.8mmol)。将反应在
‑
78℃搅拌1h。反应用nh4cl(5ml)淬灭。混合物经mgso4干燥、过滤并浓缩,得到标题化合物(1g,纯度75%),为无色油状物,其无需进一步纯化即可直接用于下一步。
[0885]
实例53b:制备4
‑
(三氟甲基)环己烷甲醛
[0886]
实例53b的总体反应方案如下:
[0887][0888]
步骤1:n
‑
甲氧基
‑
n
‑
甲基
‑4‑
(三氟甲基)环己烷甲酰胺
[0889]
将hatu(11.7g,30.59mmol),n,o
‑
二甲基羟胺盐酸盐(3g,30.6mmol)和4
‑
(三氟甲基)环己烷甲酸(5g,25.5mmol)的混合物溶解在dmf(50ml)中。然后加入n,n
‑
二异丙基乙胺(17.8ml,102.0mmol)。将混合物在20℃搅拌1h。所得溶液用乙酸乙酯(20ml x 2)萃取,并合并有机层。用无水硫酸钠使有机层干燥,并且在真空下进行浓缩。将残余物通过硅胶快速色谱纯化,用甲基meoh/dcm(1:15)洗脱,得到标题化合物(5.7g,93%),为白色固体。1h nmr(400mhz,cdcl3):δ3.69(s,3h),3.19(s,3h),2.97
‑
2.85(m,1h),2.12
‑
2.06(m,1h),2.04
‑
1.88(m,4h),1.78
‑
1.66(m,2h),1.63
‑
1.54(m,2h)。
[0890]
步骤2:4
‑
(三氟甲基)环己烷甲醛
[0891]
在
‑
78℃,将n
‑
甲氧基
‑
n
‑
甲基
‑4‑
(三氟甲基)环己烷甲酰胺(3.8g,16mmol)在二氯甲烷(62ml)中的混合物与dibal
‑
h(47.65ml,47.65mmol)合并。将反应在
‑
78℃搅拌1h。反应用饱和nh4cl(5ml)淬灭。然后混合物经mgso4干燥、过滤并浓缩,得到标题化合物(1g,70%纯度),为无色油状物,其随后无需进一步纯化即可直接使用。
[0892]
实例54
[0893]
(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)烟酰胺
[0894]
实例54的总体反应方案如下:
[0895][0896]
步骤1:(e)
‑5‑
溴
‑3‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑2‑
甲氧基吡啶
[0897]
在0℃,向5
‑
溴
‑3‑
(二乙氧基磷酰基甲基)
‑2‑
甲氧基
‑
吡啶(0.2g,0.59mmol)在甲苯(10ml)中的溶液添加叔五氧化钠(0.07g,0.65mmol),并将混合物在0℃搅拌20min。然后滴加4,4
‑
二氟环己烷甲醛(0.11g,0.56mmol,75%纯度)在thf(2ml)中的溶液,并将反应混合物在0℃搅拌1.5h。将反应混合物倒入饱和nh4cl水溶液(50ml),并用etoac(100ml x 2)
萃取。有机层经na2so4干燥、过滤并浓缩至干。残余物通过硅胶柱色谱(在石油醚中的0
‑
10%etoac)纯化,得到标题化合物(180mg,91%),为无色油状物。1h nmr(400mhz,cdcl3):δ8.05(d,j=2.4hz,1h),7.71(d,j=2.4hz,1h),6.51(d,j=15.6hz,1h),6.21(dd,j=15.6,7.2hz,1h),3.95(s,3h),2.30
‑
2.04(m,3h),1.94
‑
1.71(m,4h),1.60
‑
1.57(m,2h);lcms(esi):m/z 332.0(m+h)
+
。
[0898]
步骤2:(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)烟酰胺
[0899]
将5
‑
溴
‑3‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑2‑
甲氧基
‑
吡啶(100mg,0.30mmol),pd(oac)2(7mg,0.03mmol),xantphos(35mg,0.06mmol),na2co3(160mg,1.51mmol)和2
‑
[3
‑
(氨基甲基)苯基]
‑
n
‑
甲基
‑
乙酰胺盐酸盐(130mg,0.60mmol)在甲苯(2ml)和dmf(2ml)中的混合物在co气氛(50psi)下在80℃搅拌12小时。所得溶液用二氯甲烷(20ml
×
2)和水(20ml)萃取。合并有机层,经无水硫酸钠干燥并在真空下浓缩。将残余物通过硅胶快速色谱纯化,用甲醇/二氯甲烷(1:15)洗脱,得到标题化合物(16.1mg,12%),为棕色固体。1h nmr(400mhz,cdcl3):δ8.44(d,j=2.0hz,1h),8.10(d,j=2.0hz,1h),7.39
‑
7.29(m,2h),7.26
‑
7.16(m,2h),6.58(d,j=16.0hz,1h),6.50(t,j=5.6hz,1h,nh),6.31(dd,j=16.0,6.8hz,1h),5.44(br s,1h),4.65(d,j=5.6hz,2h),4.02(s,3h),3.56(s,2h),2.77(d,j=4.8hz,3h),2.29
‑
2.26(m,1h),2.20
‑
2.06(m,2h),1.95
‑
1.70(m,4h),1.60
‑
1.50(m,2h);lcms(esi):m/z 458.2(m+h)
+
。
[0900]
实例55
[0901]
(e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)吡啶甲酰胺
[0902]
实例55的总体反应方案如下:
[0903][0904]
步骤1:(e)
‑2‑
氯
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基吡啶
[0905]
在0℃,向2
‑
氯
‑4‑
(二乙氧基磷酰基甲基)
‑5‑
甲氧基
‑
吡啶(0.3g,1.02mmol)在甲苯(10ml)中的溶液加入叔五氧化钠(0.12g,1.12mmol),并将混合物在0℃搅拌20min。然后滴加4,4
‑
二氟环己烷甲醛(0.19g,1.25mmol)在thf(15ml)中的溶液,并将反应混合物在0℃搅拌1.5h。将反应混合物倒入饱和nh4cl水溶液(50ml)中,并用etoac(100ml x 2)萃取。将有机层合并,用盐水(50ml)洗涤,经na2so4干燥并浓缩。残余物通过硅胶色谱(在石油醚中的
0
‑
10%etoac)纯化,得到标题化合物(140mg,48%),为无色油状物。1h nmr(400mhz,cdcl3):δ7.99
‑
7.94(m,1h),7.29(s,1h),6.62(d,j=16.4hz,1h),6.38(dd,j=16.4,6.8hz,1h),3.92(s,3h),2.32
‑
2.28(m,1h),2.22
‑
2.10(m,2h),1.92
‑
1.90(m,1h),1.86
‑
1.72(m,2h),1.67
‑
1.52(m,3h);lcms(esi):m/z 288.1(m+h)
+
。
[0906]
步骤2:(e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基吡啶甲酸甲酯
[0907]
将2
‑
氯
‑4‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑5‑
甲氧基
‑
吡啶(0.14g,0.49mmol),碳酸钾(0.13g,0.97mmol),pd(oac)2(11mg,0.05mmol)和1,3
‑
双(二苯基膦基)丙烷(41mg,0.10mmol)在甲醇(3ml)中的混合物在co气氛(50psi)下在80℃加热16小时。用硅藻土过滤溶液,并浓缩滤液。残余物通过tlc(在石油醚中的50%etoac,r
f
=0.4)纯化,得到标题化合物4
‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑5‑
甲氧基
‑
吡啶
‑2‑
甲酸甲酯(0.10g,66%),为浅黄色油状物。lcms(esi):m/z 312.1(m+h)
+
。
[0908]
步骤3:(e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基吡啶甲酸
[0909]
将lioh.h2o(68mg,1.61mmol)和4
‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑5‑
甲氧基
‑
吡啶
‑2‑
甲酸甲酯(0.1g,0.32mmol)在甲醇(6ml)和水(6ml)中的混合物在15℃搅拌16小时。浓缩反应混合物以去除甲醇,并用1n hcl将ph调节至6。所得溶液用etoac(30ml x 2)萃取,并且有机层经na2so4干燥并浓缩,得到标题化合物(90mg,94%),为棕色固体。lcms(esi)m/z 297.9(m+h)
+
。
[0910]
步骤4:(e)
‑4‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑5‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)吡啶甲酰胺
[0911]
向4
‑
[(e)
‑2‑
(4,4
‑
二氟环己基)乙烯基]
‑5‑
甲氧基
‑
吡啶
‑2‑
甲酸(90mg,0.34mmol),2
‑
[3
‑
(氨基甲基)苯基]
‑
n
‑
甲基
‑
乙酰胺盐酸盐(87mg,0.40mmol)在dmf(2ml)中的混合物加入n,n
‑
二异丙基乙胺(0.3ml,1.68mmol)。然后加入hatu(255mg,0.67mmol)。将反应混合物在15℃搅拌16h。加入水(30ml)淬灭,并将溶液用etoac(30ml x2)萃取。有机层经na2so4干燥并浓缩。残余物通过tlc(在dcm中的13%meoh,r
f
=0.6)纯化,得到标题化合物(73.2mg,48%),为白色固体。1h nmr(400mhz,cdcl3):δ8.44
‑
8.08(m,3h),7.34
‑
7.32(m,2h),7.23
‑
7.20(m,1h),6.84
‑
6.50(m,2h),5.61(s,1h),4.69(s,2h),4.04(s,3h),3.59(s,2h),2.80(s,3h),2.38
‑
2.35(m,1h),2.20
‑
2.17(m,2h),2.03
‑
1.75(m,4h),1.65
‑
1.63(m,2h);lcms(esi):m/z 458.2(m+h)
+
。
[0912]
实例56
[0913]6‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
((e)
‑2‑
(顺式
‑4‑
(三氟甲基)环己基)乙烯基)烟酰胺和6
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)烟酰胺
[0914]
实例56的总体反应方案如下:
[0915][0916]
步骤1:(e)
‑5‑
溴
‑2‑
甲氧基
‑3‑
(2
‑
(4
‑
(三氟甲基)环己基)乙烯基)吡啶
[0917]
在0℃,向5
‑
溴
‑3‑
(二乙氧基磷酰基甲基)
‑2‑
甲氧基
‑
吡啶(0.5g,1.48mmol)在甲苯(7.5ml)中的溶液添加叔五氧化钠(0.2g,1.77mmol),并将混合物在0℃搅拌20min。然后滴加4
‑
(三氟甲基)环己烷甲醛(0.64g,3.54mmol)在四氢呋喃(7.5ml)中的溶液,并将反应混合物在0℃搅拌1.5h。将反应混合物倒入饱和nh4cl水溶液(50ml)中,并用etoac(100ml x 2)萃取。将有机层合并,用盐水(50ml)洗涤,经na2so4干燥并浓缩。残余物通过硅胶色谱(在石油醚中的0
‑
10%etoac)纯化,得到标题化合物(100mg,19%),为无色油状物。lcms(esi):m/z 364.0(m+h)
+
。
[0918]
步骤2:(e)
‑6‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
(2
‑
(4
‑
(三氟甲基)环己基)乙烯基)烟酰胺
[0919]
加入2
‑
[3
‑
(氨基甲基)苯基]
‑
n
‑
甲基
‑
乙酰胺盐酸盐(354mg,1.65mmol),4,5
‑
双(二苯基膦基)
‑
9,9
‑
二甲基氧杂蒽(96mg,0.16mmol),5
‑
溴
‑2‑
甲氧基
‑3‑
[(e)
‑2‑
[4
‑
(三氟甲基)环己基]乙烯基]吡啶(300mg,0.82mmol)在n,n
‑
二甲基甲酰胺(7.5ml)和甲苯(7.5ml)中的混合物加入pd(oac)2(32mg,0.08mmol)。将反应在co气氛(50psi)下在80℃搅拌16h。向其中加入水(30ml),并且溶液用etoac(30ml x2)萃取。有机层经na2so4干燥、过滤并浓缩。残余物通过tlc(在dcm中的13%meoh,r
f
=0.6)纯化,得到标题化合物(50mg,12%),为白色固体。lcms(esi):m/z 490.1(m+h)
+
。
[0920]
步骤3:6
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
((e)
‑2‑
(顺式
‑4‑
(三氟甲基)环己基)乙烯基)烟酰胺和6
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)烟酰胺
[0921]6‑
甲氧基
‑
n
‑
[[3
‑
[2
‑
(甲基氨基)
‑2‑
氧代
‑
乙基]苯基]甲基]
‑5‑
[(e)
‑2‑
[4
‑
(三氟甲基)环己基]乙烯基]吡啶
‑3‑
甲酰胺(50mg,0.10mmol)用sfc(daicel chiralpak ic(250mm*30mm,5um))(在etoh中的0.1%nh3h2o,40%)分离,得到6
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
((e)
‑2‑
(顺式
‑4‑
(三氟甲基)环己基)乙烯基)烟酰胺(6.9mg,19%)和6
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)烟酰胺(7.2mg,14%),均为白色固体。
[0922]6‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
((e)
‑2‑
(顺式
‑4‑
(三氟甲基)环己基)乙烯基)烟酰胺。1h nmr(400mhz,cdcl3):δ8.44(s,1h),8.12(s,1h),7.40
‑
7.30
(m,2h),7.24
‑
7.19(m,2h),6.65
‑
6.55(m,1h),6.54
‑
6.39(m,2h),5.44(s,1h),4.66(d,j=5.2hz,2h),4.03(s,3h),3.56(s,2h),2.77(d,j=4.0hz,3h),2.59(m,1h),2.13(m,1h),1.92
‑
1.68(m,8h)。
[0923]6‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑5‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)烟酰胺。1h nmr(400mhz,cdcl3):δ8.44(s,1h),8.10(s,1h),7.38
‑
7.28(m,2h),7.25
‑
7.15(m,2h),6.64
‑
6.49(m,2h),6.28(dd,j=16.0,6.8hz,1h),5.50(s,1h),4.63(d,j=4.8hz,2h),4.02(s,3h),3.54(s,2h),2.77(d,j=4.0hz,3h),2.18
‑
2.15(m,1h),2.07
‑
1.91(m,5h),1.46
‑
1.32(m,2h),1.29
‑
1.15(m,2h)。
[0924]
实例57
[0925]5‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
((e)
‑2‑
(顺式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺和5
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺
[0926]
实例57的总体反应方案如下:
[0927][0928]
步骤1:(e)
‑2‑
氯
‑5‑
甲氧基
‑4‑
(2
‑
(4
‑
(三氟甲基)环己基)乙烯基)吡啶
[0929]
在0℃,向2
‑
氯
‑4‑
(二乙氧基磷酰基甲基)
‑5‑
甲氧基
‑
吡啶(1.0g,3.15mmol)在甲苯(18ml)中的溶液添加叔五氧化钠(0.42g,3.78mmol),并将混合物在0℃搅拌20min。然后滴加4
‑
(三氟甲基)环己烷甲醛(1.62g,6.3mmol,70%纯度)在thf(18ml)中的溶液,并将反应混合物在0℃搅拌1.5h。将反应混合物倒入饱和nh4cl水溶液(50ml)中,并用etoac(100ml x 2)萃取。将有机层合并,用盐水(50ml)洗涤,经na2so4干燥并浓缩。残余物通过硅胶柱色谱(在石油醚中的0
‑
10%etoac)纯化,得到标题化合物(340mg,34%),为无色油状物。lcms(esi):m/z 320.1(m+h)
+
。
[0930]
步骤2:(e)
‑5‑
甲氧基
‑4‑
(2
‑
(4
‑
(三氟甲基)环己基)乙烯基)吡啶甲酸甲酯
[0931]
将2
‑
氯
‑5‑
甲氧基
‑4‑
[(e)
‑2‑
[4
‑
(三氟甲基)环己基]乙烯基]吡啶(0.32g,1mmol),碳酸钾(0.28g,2mmol),pd(oac)2(23mg,0.10mmol)和1,3
‑
双(二苯基膦基)丙烷
(83mg,0.20mmol)在meoh(10ml)和dmf(10ml)中的混合物在co气氛(50psi)下在80℃加热16小时。用etoac(30ml x 2)萃取溶液,并用水(30ml)洗涤。有机层经na2so4干燥并浓缩。残余物通过tlc(在石油醚中的50%etoac,r
f
=0.4)纯化,得到标题化合物(0.31g,90%),为浅黄色油状物。lcms(esi):m/z 344.1(m+h)
+
。
[0932]
步骤3:(e)
‑5‑
甲氧基
‑4‑
(2
‑
(4
‑
(三氟甲基)环己基)乙烯基)吡啶甲酸
[0933]
将lioh
·
h2o(190mg,4.5mmol)和5
‑
甲氧基
‑4‑
[(e)
‑2‑
[4
‑
(三氟甲基)环己基]乙烯基]吡啶
‑2‑
甲酸甲酯(0.31g,0.90mmol)在水(15ml),meoh(15ml)和四氢呋喃(3ml)中的混合物在15℃搅拌16小时。浓缩反应溶液以去除有机溶剂,并用1n hcl水溶液将ph调节至6。然后将溶液用etoac(30ml x 2)萃取,并用水(30ml)洗涤。有机层经na2so4干燥并浓缩,得到标题化合物(200mg,67%),为白色固体。lcms(esi):m/z 330.1(m+h)
+
。
[0934]
步骤4:(e)
‑5‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
(2
‑
(4
‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺
[0935]
向5
‑
甲氧基
‑4‑
[(e)
‑2‑
[4
‑
(三氟甲基)环己基]乙烯基]吡啶
‑2‑
甲酸(200mg,0.61mmol)和2
‑
[3
‑
(氨基甲基)苯基]
‑
n
‑
甲基
‑
乙酰胺盐酸盐(157mg,0.73mmol),n,n
‑
二异丙基乙胺(0.54ml,3.04mmol)在n,n
‑
二甲基甲酰胺(5ml)中的溶液加入hatu(462mg,1.21mmol)。将反应在15℃搅拌16h。加入水(30ml),并将溶液用etoac(30ml x 2)萃取。有机层经na2so4干燥、过滤并浓缩至干。残余物通过制备型tlc(在dcm中的10%meoh,r
f
=0.6)纯化,得到标题化合物(130mg,44%),为白色固体。lcms(esi):m/z 490.1(m+h)
+
。
[0936]
步骤5:5
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
((e)
‑2‑
(顺式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺和5
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺
[0937]5‑
甲氧基
‑
n
‑
[[3
‑
[2
‑
(甲基氨基)
‑2‑
氧代
‑
乙基]苯基]甲基]
‑4‑
[(e)
‑2‑
[4
‑
(三氟甲基)环己基]乙烯基]吡啶
‑2‑
甲酰胺(130mg,0.27mmol)用sfc(daicel chiralpak as
‑
h(250mm*30mm,5um))(在ipa中的0.1%nh3h2o,50%)分离,得到5
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
((e)
‑2‑
(顺式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺(79.2mg,61%)和5
‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺(28.9mg,22%),均为白色固体。
[0938]5‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
((e)
‑2‑
(顺式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺。1h nmr(400mhz,cd3od):δ8.27(s,1h),8.16(s,1h),7.95(br s,1h),7.31
‑
7.21(m,3h),7.20(d,j=6.8hz,1h),6.79
‑
6.64(m,2h),4.58(s,2h),4.01(s,3h),3.47(s,2h),2.73
‑
2.66(m,3h),2.64
‑
2.55(m,1h),2.29
‑
2.13(m,1h),1.86
‑
1.83(m,2h),1.79
‑
1.58(m,6h)。
[0939]5‑
甲氧基
‑
n
‑
(3
‑
(2
‑
(甲基氨基)
‑2‑
氧乙基)苄基)
‑4‑
((e)
‑2‑
(反式
‑4‑
(三氟甲基)环己基)乙烯基)吡啶甲酰胺。1h nmr(400mhz,cd3od):δ8.28(s,1h),8.13(s,1h),7.33
‑
7.21(m,3h),7.18(d,j=6.8hz,1h),6.69(d,j=16.0hz,1h),6.53(dd,j=16.0,6.8hz,1h),4.58(s,2h),4.01(s,3h),3.47(s,2h),2.69(s,3h),2.27
‑
2.07(m,2h),2.05
‑
1.89(m,4h),1.49
‑
1.25(m,4h)。
[0940]
实例58
[0941]
(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)乙烯磺酰胺
[0942][0943]
步骤1:(e)
‑2‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
[0944][0945]
在手套箱中,将2,2,6,6
‑
四甲基哌啶
‑1‑
锂(在thf中1.0m,8.10ml,8.10mmol)转移到50ml烧瓶中。将烧瓶密封,并从手套箱中取出。在0℃,将thf(5.0ml)加入到烧瓶中,并加入双(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)甲烷(2.20g,8.1mmol)在thf(5.0ml)中的溶液。然后将反应搅拌10分钟,并且然后冷却至
‑
78℃。加入4,4
‑
二氟环己烷甲醛(10.0g,6.7mmol)在thf(20.0ml)中的溶液。将反应在
‑
78℃再搅拌4小时。用饱和nh4cl(50ml)淬灭反应混合物。将溶液用etoac(50ml x 3)萃取。将有机层用水(50ml)洗涤,经na2so4干燥并浓缩。残余物通过硅胶柱色谱(在石油醚中的0
‑
2%etoac)纯化,得到标题化合物(300mg,16%),为白色固体。1h nmr(400mhz,cdcl3):δ6.56(dd,j=18.0,6.0hz,1h),5.46(dd,j=18.0,1.2hz,1h),2.21
‑
2.03(m,3h),1.89
‑
1.67(m,4h),1.57
‑
1.42(m,2h),1.28(s,12h)。
[0946]
步骤2:(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
胺
[0947][0948]
向5
‑
溴
‑6‑
甲氧基
‑
吡啶
‑3‑
胺(100mg,0.49mmol)在二噁烷(5.0ml)和水(1.0ml)中的溶液添加pd(dppf)cl2(36mg,0.050mmol),(e)
‑2‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷(200mg,0.74mmol)和na2co3(160mg,1.5mmol)。然后将反应混合物置于氮气气氛下,并在100℃搅拌16h。将反应混合物浓缩。残余物通过制备型tlc(在石油醚中的50%etoac)纯化,得到标题化合物(120mg,90%),为白色固体。1h nmr(400mhz,dmso
‑
d6):δ7.40(d,j=2.4hz,1h),7.11(d,j=2.8hz,1h),6.45(d,j=16.0hz,1h),6.16(dd,j=16.0,7.2hz,1h),4.71(s,2h),3.79
‑
3.70(m,3h),2.33
‑
2.24(m,1h),2.09
‑
1.99(m,2h),1.96
‑
1.76(m,4h),1.48
‑
1.31(m,2h)。
[0949]
步骤3:(e)
‑
n
‑
(5
‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
基)乙烯磺酰胺
[0950][0951]
在0℃,向(e)
‑5‑
(2
‑
(4,4
‑
二氟环己基)乙烯基)
‑6‑
甲氧基吡啶
‑3‑
胺(70mg,0.26mmol)在吡啶(3.0ml)中的混合物加入乙磺酰氯(0.04ml,0.32mmol)。将反应混合物在室温搅拌2h。将混合物浓缩并将残余物通过制备型hplc(boston green ods 150*30mm*5um,乙腈50
‑
80/水(0.225%fa))纯化,得到标题化合物(19.93mg,21%),为白色固体。1h nmr(400mhz,cdcl3):δ7.84(d,j=2.4hz,1h),7.61(d,j=2.4hz,1h),6.61
‑
6.44(m,2h),6.28
‑
6.15(m,2h),6.09(s,1h),5.99(dd,j=10.0,2.0hz,1h),3.97(s,3h),2.35
‑
2.25(m,1h),2.19
‑
2.10(m,2h),1.92
‑
1.72(m,4h),1.65
‑
1.56(m,2h)。lcms(esi):m/z 359.0(m+h)
+
。
[0952]
实例59
[0953]
根据以下方法进行tead脂质测定。将带有组氨酸标签的tead蛋白与bodipy
‑
c16 fp探针(life technologies cat#d3821)在室温预孵育30分钟,以预形成tead
‑
探针复合物。tead
‑
探针复合物的相对较大尺寸导致探针的滚动较慢,从而产生较高的荧光偏振值(mp)。加入作为tead脂质口袋粘结剂的化合物会导致探针偏离tead,并降低荧光偏振(mp)值。将化合物与tead bodipy
‑
c16复合物孵育60分钟后,在envision多标记酶标仪(perkin elmer cat#2104
‑
0010a)上测量荧光偏振值。游离探针导致更快的滚动或较低的荧光偏振值。每个测试化合物均生成了重复的10点剂量响应曲线。通过使用非线性4参数曲线拟合产生的ic
50
值确定化合物作为tead脂质口袋粘结剂的效能。
[0954]
detroit 562报告基因测定如下进行。为了稳定地生成和维持报告基因系,在hippo通路响应元件tead的控制下,用含有纳米荧光素酶报告基因元件的报告质粒转染detroit 562细胞(atcc cat#ccl
‑
138)。作为反向筛选,该质粒还包含萤火虫荧光素酶,其受与hippo通路无关的pgk启动子控制。转染和稀释克隆后,选择并鉴定单个克隆。使克隆生长并保持在rpmi 1640、10%胎牛血清、2mm l
‑
谷氨酰胺、50ug/ml zeocin(invitrogen#r25005)中。为了用待测化合物进行报告基因测定,将细胞铺板(第1天)在384孔组织培养处理过的测定板中,并孵育过夜。每个化合物板制备两个细胞板。第二天(第2天),将细胞用化合物处理并孵育过夜。在第三天,将细胞板与用于通路抑制的靶标确定的nanoglo纳米荧光素酶试剂(promega cat#n1150)孵育,或与萤火虫荧光素酶试剂(promega cat#e8150)孵育,以测定化合物的脱靶活性。在envision多标记酶标仪(perkin elmer cat#2104
‑
0010a)上测量发光度。每个测试化合物均生成了重复的10点剂量响应曲线。通过使用非线性4参数曲线拟合产生的ic
50
值确定化合物作为tead脂质口袋粘结剂的效能。
[0955]
表1至表3中所列的化合物的结果(化合物54、55、56a、56b、57a和57b除外)示出于下表4中。
[0956]
表4
[0957]
[0958]
[0959][0960]
表1中所列的化合物54、55、56a、56b、57a、57b和58的结果示出于下表5中。
[0961]
表5
[0962]
[0963][0964]
该书面描述使用实例来公开本发明,其包括最佳模式,并且还使本领域技术人员能够实践本发明,其包括制造和使用任何设备或系统以及执行任何并入的方法。本发明的专利范围由权利要求书限定,并且可以包括本领域技术人员想到的其他实例。如果这样的其他实例具有与权利要求书的字面语言相同的结构元件,或者如果它们包括与权利要求书的字面语言没有实质性差异的等效结构元件,则它们旨在落入权利要求书的范围内。
[0965]
应当理解,本发明不限于上述公开的特定实施例和方面,因为可以对特定实施例和方面进行变型,并且仍然落入所附权利要求书的范围内。本文引用或依赖的所有文件均明确地通过引用并入。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1