用于制造和疗法的脱氧核糖核酸酶的工程改造的制作方法
相关申请
本申请要求以下美国临时申请的权益和优先权:2018年10月8日提交的第62/742,682号;2018年12月5日提交的第62/775,563号;2018年12月13日提交的第62/779,104号;2019年2月21日提交的第62,808,601号;和2019年5月13日提交的第62/846,904号,其内容都以全文引用的方式并入本文中。
发明领域
本发明涉及被工程改造的脱氧核糖核酸酶(dnase)领域。
背景技术:
炎症是控制入侵微生物并治愈受损组织的一种必不可少的宿主反应。不受控的持续炎症在许多炎症性病症中引起组织损伤。中性粒细胞是急性炎症中的主要白细胞。在感染期间,中性粒细胞产生中性粒细胞胞外陷阱(neutrophilextracellulartrap,net),这是一种由有毒组蛋白以及固定并中和细菌的酶装饰的dna细丝形成的网状物。然而,不当地释放的net可能由于其细胞毒性、促炎性和促血栓形成活性而损害宿主细胞。
脱氧核糖核酸酶1(dnase1,d1)与脱氧核糖核酸酶1样蛋白质1(dnase1-like1,d1l1)、脱氧核糖核酸酶1样蛋白质2(dnase1-like2,d1l2)和脱氧核糖核酸酶1样蛋白质3(dnase1-like3,d1l3)(dnase1蛋白质家族,一组同源分泌的脱氧核糖核酸酶)一起形成。dnase2a和dnase2b形成另一组同源细胞外脱氧核糖核酸酶。dnase1和dnase2蛋白质家族成员具有进化保守性并且在包括人类在内的多个物种中表达。重组人dnase1和dnase2蛋白质家族成员提供用于net相关疾病的药物候选物。尽管已经开发出d1在患者中的一些治疗应用,但并未描述用于大规模制造dnase1蛋白质家族其它成员的条件。此外,这些酶的生理、酶和药物动力学特性对于临床应用来说并不理想。因此,需要确定d1l1、d1l2和d1l3酶的制造方法,并且需要工程改造脱氧核糖核酸酶以用于疗法中,包括用于降解net。
发明概要
本发明提供了被工程改造的人细胞外dnase蛋白质(例如dnase1(d1)、dnase1-like1(d1l1)、dnase1-like2(d1l2)、dnase1-like3同工型1(d1l3)、dnase1-like3同工型2(d1l3-2)、dnase2a(d2a)和dnase2b(d2b)的变体),这些蛋白质可用于治疗以细胞外dna、细胞外染色质和中性粒细胞胞外陷阱(net)积聚和/或释放为特征的疾患。根据本发明各方面,本文中所描述的脱氧核糖核酸酶变体更适合用于疗法和/或更易于大规模制造。在一些实施例中,本文中所描述的脱氧核糖核酸酶变体对于医学疗法,包括对于全身性疗法具有益处。这类益处包括药物消除变慢,例如循环半衰期(例如血清半衰期)延长;药效学活性持续时间延长;高染色质降解活性;以及蛋白酶抗性。
在一些方面,本发明提供一种d1l3变体,其中与seqidno:4的野生型d1l3同工型1酶或seqidno:5的野生型d1l3同工型2酶相比,所述d1l3变体具有以下中的一种或多种:增加的蛋白质稳定性、较慢的药物消除和延长的药效学活性持续时间、对蛋白水解降解的抗性、在体外表达系统中较高的生产水平、较佳的纯化适宜性以及未明显变低的、相同的或较佳的染色质和/或net降解活性。
在一些实施例中,d1l3变体是融合蛋白,该融合蛋白包含与由seqidno:4或seqidno:5限定的成熟酶具有至少80%同一性的氨基酸序列、在该成熟酶的n端的白蛋白氨基酸序列以及任选地,在白蛋白氨基酸序列(白蛋白结构域)与d1l3氨基酸序列(d1l3结构域)之间的连接氨基酸序列。在这些实施例中,d1l3呈现较慢的消除(例如改善的循环半衰期或血清半衰期)和延长的药效学活性持续时间,包括用于全身性疗法的情形。在一些实施例中,与不具有白蛋白融合物的酶相比,白蛋白通过连接序列与d1l3结构域融合不会显著影响酶的染色质降解活性(例如使用体外测定法测量)。
在这些实施例中,融合蛋白的d1l3结构域具有野生型d1l3酶中存在的c端碱性结构域的全部或一部分缺失。c端碱性结构域的缺失或失活显著改善染色质降解活性。也就是说,去除c端碱性结构域(bd)将活化野生型d1l3酶以降解染色质。
在一些实施例中,d1l3变体具有一个或多个来自d1的构造单元(buildingblock)取代。举例来说,d1l3变体可以具有q282_s305delinsk的构造单元取代,该取代包括c端碱性结构域的缺失,该结构域在d1中不存在。在一些实施例中,d1l3变体在对应于seqidno:4的101位的位置处具有氨基酸取代。所述取代基于来自d1的相应构造单元可以是arg,或在一些实施例中,可以是lys。此位置处的取代可以增强d1l3变体的染色质降解活性。
接头当存在时,可以是柔性接头、刚性接头或生理学上可裂解的接头,如蛋白酶可裂解的接头。举例来说,接头可以是亲水性氨基酸序列,并且可以主要由选自gly、ala、ser、thr和pro的氨基酸构建。在一些实施例中,变体是柔性接头,该接头主要是甘氨酸和丝氨酸残基(例如(gys)n接头,其中y是1至5且n是1至20)。在一些实施例中,接头是α-螺旋接头。在一些实施例中,接头具有至少15个氨基酸,或至少25个氨基酸。在各种实施例中,当在哺乳动物和非哺乳动物表达系统,如在cho细胞或毕赤酵母(pichiapastoris)中表达时,具有至少15个氨基酸的较长接头可以提供产量的改善。此外且意外的是,与较短的接头序列相比,较长的接头序列在体外染色质降解测定法中展示改善的染色质降解活性。
在各种实施例中,d1l3变体包含seqidno:17至30中的任一个的氨基酸序列,在各种情况下,任选地具有一至二十个独立地选自插入、缺失或取代的氨基酸修饰。这些序列提供d1l3(或d1l3变体)与白蛋白序列之间的例示性融合蛋白,包括利用各种接头设计。在一些实施例中,氨基酸修饰是在d1l3结构域、白蛋白结构域或这两个结构域中。在一些实施例中,变体具有seqidno:19、seqidno:22、seqidno:26、seqidno:27、seqidno:28、seqidno:29或seqidno:30的氨基酸序列。在这些实施例中,d1l3变体从n端到c端依序包含:白蛋白氨基酸序列、中间或长柔性接头和d1l3氨基酸序列(即,包括d1l3变体)。seqidno:28进一步包含在c端处通过长柔性肽接头实现的白蛋白融合。
在其它实施例中,接头可被蛋白酶,如凝血途径蛋白酶,如活化的因子xii裂解。在某些实施例中,接头含有因子xi和/或前激肽释放酶的氨基酸序列。在其它实施例中,接头包括肽序列,该序列是中性粒细胞特异性蛋白酶,如中性粒细胞弹性蛋白酶、组织蛋白酶g或蛋白酶3的裂解目标。
在一些方面,本发明提供细胞外dnase酶的变体,这些变体被工程改造成在制造方面具有优点,能够产生适用于疗法的重组酶。在各种实施例中,本发明提供一种重组d1、d1l1、d1l2和d1l3变体,该变体包含对半胱氨酸残基的一个或多个氨基酸取代(或cys残基的聚乙二醇化),使得在蛋白质表达期间通过二硫桥进行的分子内和分子间交联减少。
在其它方面,本发明提供细胞外dnase酶的变体,这些变体被工程改造成在蛋白酶抗性方面具有优点,以改善体内暴露,例如减缓消除,例如延长半衰期(例如血清半衰期),和延长药效学活性持续时间,以及减少在重组酶产生期间的蛋白水解。本公开鉴别出例如对由纤维蛋白溶酶、凝血酶和/或胰蛋白酶进行的蛋白水解敏感的d1l3残基,以及对由哺乳动物和非哺乳动物细胞系产生的蛋白酶敏感的残基(例如成对的碱性氨基酸)。这些残基的被工程改造的突变可以赋予蛋白酶抗性这些优点。
在其它方面,本发明提供一种用于重组产生细胞外dnase蛋白质,包括本文中所描述的其变体的方法。在一些实施例中,所述方法使用非哺乳动物表达系统,例如真核非哺乳动物表达系统,如毕赤酵母。在一些实施例中,毕赤酵母借助于脱氧核糖核酸酶的原生信号肽来编码该酶,由此允许从宿主细胞分泌。在一些实施例中,表达系统是哺乳动物细胞表达系统,如中国仓鼠卵巢(cho)细胞。
在一些实施例中,重组表达系统具有在成对的碱性氨基酸处裂解的一种或多种蛋白酶的缺失或失活。例示性酶包括弗林蛋白酶(furin)(由cho细胞表达)以及由毕赤酵母表达的天冬氨酸蛋白酶3(ysp1)和枯草溶菌素(kexin)(kex2)。在一些实施例中,这些酶未在遗传上缺失或失活,但在重组蛋白质产生期间,其活性被蛋白酶抑制剂抑制。
在一些实施例中,用于非哺乳动物表达系统或哺乳动物表达系统的生长培养基补充有聚阴离子,如硫酸葡聚糖、肝素、柠檬酸铁和edta。在其它实施例中,毕赤酵母或其它表达系统的生长培养基补充有硫酸葡聚糖,所述硫酸葡聚糖的平均分子量在5kda与100kda之间。举例来说,可以将聚阴离子以足以与所产生的重组蛋白质络合的量添加到培养物中。在一些实施例中,非哺乳动物表达系统或哺乳动物表达系统的培养基中重组细胞外dnase蛋白质和其变体是通过以下方法纯化,该方法包括重组细胞外dnase蛋白质和变体从聚阴离子,如从硫酸葡聚糖、肝素和edta解离。
在其它方面,本发明提供编码d1、d1l1、d1l2或d1l3变体的分离的多核苷酸,以及载体和宿主细胞。多核苷酸可以编码mrna或dna。宿主细胞可以是重组表达系统(包括细菌或真核生物)的细胞,无论是非哺乳动物如毕赤酵母的细胞,还是哺乳动物如cho的细胞。在其它实施例中,宿主细胞可以被递送用于脱氧核糖核酸酶疗法。举例来说,在一些实施例中,本发明提供被修饰成用于分泌本文中所描述的细胞外dnase蛋白质中的一种或多种且意图作为治疗剂施用的宿主细胞,例如人体细胞,例如白细胞。
本发明还提供药物组合物,所述药物组合物包含如本文中所描述的细胞外dnase蛋白质或其变体,或任选的如所描述的多核苷酸或载体,以及药学上可接受的载剂。药物组合物可以被配制成用于任何给药途径。
在其它方面,本发明提供一种用于治疗需要细胞外dna降解、细胞外染色质降解、细胞外陷阱(et)降解和/或中性粒细胞胞外陷阱(net)降解的受试者的方法,该方法是通过施用治疗有效量的本文中所描述的细胞外dnase或其变体或组合物来进行。
本发明的其它方面和实施例将由以下详细描述显而易见。
附图说明
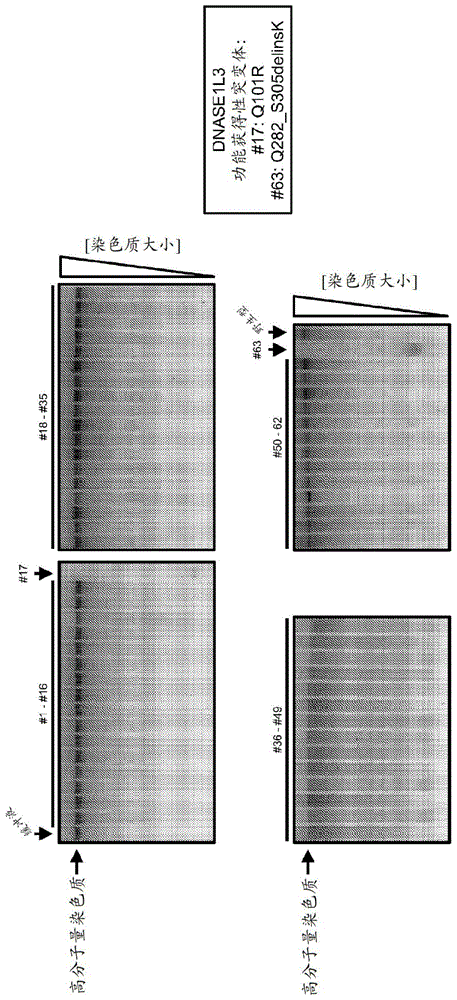
图1说明seqidno:4中的突变q101r和q282_s305delinsk增加降解dnase1l3的高分子量染色质的活性。用野生型dnase1l3或具有构造单元取代的dnase1l3瞬时转染cho细胞。将转染后的细胞的上清液与纯化的细胞核(高分子量染色质)或缓冲液一起培育。分离dna并通过琼脂糖凝胶电泳进行分析。本图展示用dna染料染色的琼脂糖凝胶。
图2展示两种dnase1l3变体的表征。使用抗dnase1l3抗体,通过蛋白质印迹法(westernblot;wb)分析用野生型dnase1l3或具有q101r或q282_s305delinsk突变的dnase1l3转染的不同浓度的cho细胞的上清液。在具有野生型dnase1l3和q101r突变体的样品中检测到较大(变体1)和较小(变体2)谱带。具有q282_s305delinsk突变体的样品中仅展示较小谱带(变体2)。同时,分析不同浓度的上清液中的染色质降解活性。本图展示由琼脂糖凝胶电泳分析的dna。与野生型dnase1l3相比,q101r或q282_s305delinsk突变都增加染色质降解活性。
图3说明用野生型dnase1l3稳定转染的cho细胞的上清液中存在dnase1l3变体1和2。使用抗dnase1l3抗体,通过蛋白质印迹法(wb)分析样品。在5个克隆中检测到较大(变体1)和较小(变体2)谱带。
图4展示用于鉴别常见裂解位点的毕赤酵母中以重组方式表达的野生型d1l3的c端氨基酸序列。对纯化的野生型d1l3进行氨基酸测序鉴别出三个c端缺失突变体:k291_s305del、k292_s305del和s293_s305del。未检测到野生型d1l3的c端。同时,分析不同浓度的纯化的蛋白质中的染色质降解活性并将其与纯化的dnase1(d1)和具有f275y/f279_k280delinsvm/q282_s305delinsk突变的碱性结构域缺失的dnase1l3(bdd-d1l3)相比较。本图展示由琼脂糖凝胶电泳分析的dna。
图5展示向cho培养基中添加硫酸葡聚糖使蛋白质产量改善。在标准cho培养基或补充有硫酸葡聚糖的cho培养基中培育表达野生型d1l3的稳定cho细胞池。使用抗dnase1l3抗体,通过蛋白质印迹法(wb)分析上清液。本图展示d1l3在cho细胞中表达不足且具有低产率。添加硫酸葡聚糖增加产率,但未防止生产片段化。
图6说明使用阴离子交换表面和阳离子交换表面对与硫酸葡聚糖络合的d1l3进行亲和纯化。
图7列出用于限制d1l3降解的胰蛋白酶裂解位点突变策略。
图8是人d1(seqidno:1)与人d1l3(seqidno:4)氨基酸序列的比对,其中展示出纤维蛋白溶酶敏感性kr残基。
图9说明用于限制d1l3降解的纤维蛋白溶酶裂解位点突变策略。
图10展示具有突变的纤维蛋白溶酶裂解位点的d1l3保留酶活性。将来自细胞的上清液与纯化的细胞核(高分子量染色质)或缓冲液一起培育,所述细胞是用在四个推定质粒裂解位点中含有突变(k180_a181delinsgl、p198_a201delinsrpsq、k259a、r285a)的dnase1l3瞬时转染。分离dna并通过琼脂糖凝胶电泳进行分析。本图展示用dna染料染色的琼脂糖凝胶。
图11列出基于纤维蛋白溶酶消化的纤维蛋白溶酶裂解位点并且展示用于限制d1l3降解的突变策略。
图12展示d1l3在cho细胞中表达时具有错误折叠的倾向。小图a说明使用原生分泌型信号肽进行d1l3表达的简单表达载体。使用抗dnase1l3抗体,通过蛋白质印迹法分析稳定池的上清液。小图b展示在非还原条件下存在高分子量聚集体,所述高分子量聚集体在还原条件下分解。
图13是人d1(seqidno:1)与人d1l3(seqidno:4)氨基酸序列的比对,其中展示出保守性和非保守性半胱氨酸残基。
图14列出d1l3中的半胱氨酸残基,并且展示用于在蛋白质表达期间限制高分子量聚集体的突变策略。
图15展示d1l3中的c68a和c194a突变不会影响染色质降解活性。突变c24a和c52a消除染色质降解活性。将来自用突变型dnase1l3变体瞬时转染的细胞的上清液与纯化的细胞核或缓冲液一起培育。分离dna并通过琼脂糖凝胶电泳进行分析。本图展示用dna染料染色的琼脂糖凝胶。
图16a说明使用原生分泌型信号或来自酿酒酵母(saccharomycescerevisiae)的α-交配因子(αmf)于毕赤酵母中表达d1l3。αmf引起糖基化和信号肽的不加工(图16b)。
图17a说明具有αmf、人血清白蛋白(hsa)、接头序列和d1l3的融合构建体。此融合构建体在毕赤酵母表达系统中未糖基化(图17b),且保留染色质降解活性(图17c)。
图18说明碱性结构域缺失的dnase1l3(bdd-d1l3)或野生型dnase1l3(d1l3)的人血清白蛋白(hsa)融合构建体在毕赤酵母中的表达水平。hsa与bdd-d1l3或d1l3的n端或c端融合。两个接头序列l1和l2被置放于hsa与bdd-d1l3或d1l3之间。
图19说明野生型dnase1l3(d1l3)的人血清白蛋白(hsa)融合构建体在毕赤酵母中的表达水平。hsa与d1l3的n端融合。三个不同的接头序列(l2、l3、l4)被置放于hsa与d1l3之间。
图20说明在毕赤酵母中产生的碱性结构域缺失的dnase1l3(bdd-d1l3)的人血清白蛋白(hsa)融合构建体的表达水平和染色质降解活性。hsa与bdd-d1l3的n端融合。三个不同的接头序列(l5、l6、l7)被置放于hsa与d1l3之间。
图21a展示被注射sedidno:14和seqidno:19的dnase1-/-dnase1l3-/-小鼠在血清中展示类似的染色质降解活性。图21b展示seqidno:19在表达人fcrn受体的小鼠体内的循环半衰期是3.3天。
图22说明在毕赤酵母中产生的碱性结构域缺失的dnase1l3(bdd-d1l3)的人血清白蛋白(hsa)融合构建体的表达水平和染色质降解活性。hsa与bdd-d1l3的n端和c端融合。两个不同的接头序列(l7和l8)被置放于hsa与bdd-d1l3之间。
图23说明具有hsa和可被因子xiia裂解的接头的融合构建体。展示出含有人因子xi序列(seqidno:42)的接头和含有人前激肽释放酶(seqidno:44)序列的接头。
图24说明将因子xiia可裂解接头用于半衰期延长型融合蛋白,包括用于人细胞外脱氧核糖核酸酶、人凝血因子和人补体因子的其它构建体。
发明描述
本发明提供被工程改造的人细胞外dnase蛋白质(例如dnase1(d1)、dnase1-like1(d1l1)、dnase1-like2(d1l2)、dnase1-like3同工型1(d1l3)、dnase1-like3同工型2(d1l3-2)、dnase2a(d2a)和dnase2b(d2b)的变体)的候选物,所述候选物可用于治疗以细胞外dna、细胞外染色质和中性粒细胞胞外陷阱(net)积聚和/或释放为特征的疾患。根据本发明各方面,本文中所描述的脱氧核糖核酸酶变体对于疗法来说更合适和/或更有效,和/或更易于大规模制造。在一些实施例中,本文中所描述的脱氧核糖核酸酶变体对于全身性疗法来说具有益处。这类益处包括较长的暴露(例如较慢的消除、较长的循环半衰期)、延长的药效学作用持续时间、改善的染色质降解活性,以及蛋白酶抗性。
定义
除非上下文另外明确指示,否则如本文中和权利要求书中所使用,单数形式“一个(种)(a/an)”和“所述”包括一个(种)和多个(种)参考物。因此,举例来说,提到“一种药剂”包括单一药剂和多种这类药剂。
术语“染色质酶”是指一种脱氧核糖核酸酶,该酶呈现不可忽略的切割、裂解或消化染色质(即,与一种或多种组蛋白缔合的dna)的能力。人dnase1l3是一种染色质酶。通常,本文中所公开的各种dnase1l3变体都是染色质酶。并非所有的dnase酶都是染色质酶。举例来说,人dnase1基本上不具有切割、裂解或消化染色质的能力,并且不是染色质酶。
如本文中关于药物所使用,“半衰期”是指在感兴趣基质(例如血清或血浆)中测量的动物体内药物的浓度的消除半衰期。本领域的技术人员应理解,并非所有药物都呈现一级动力学或在所有消除阶段期间都呈现一级动力学。在这类情况下,本领域的技术人员应理解,术语“半衰期延长”或“延长的半衰期”是较慢消除速率的表述。
“分离的”意思指从天然状态改变或移出。举例来说,天然存在于活动物中的核酸或肽不是“分离的”,但与其天然状态的共存物质部分或完全分离的相同核酸或肽是“分离的”。分离的核酸或蛋白质可以呈基本上纯的形式存在,或可以存在于非原生环境,例如宿主细胞中。
如本文中所使用,“中性粒细胞胞外陷阱”和首字母缩写“net”是指包含细胞核内含物,例如包含结合于由免疫细胞,典型地由中性粒细胞以程序性方式释放的组蛋白的dna的细胞外纤维的网状物。
除非另外说明,否则“编码氨基酸序列的核苷酸序列或核酸”包括彼此互为简并形式并且编码相同氨基酸序列的所有核苷酸序列。就编码蛋白质的核苷酸序列在某种形式中可以含有一个或多个内含子而言,短语编码蛋白质或rna的核苷酸序列还可以包括内含子。
术语“约”和“大致”包括在相关数值的±10%范围内的量。
术语“细胞外dnase”是指dnase1家族和dnase2家族的细胞外dnase蛋白质(例如dnase1(d1)、dnase1-like1(d1l1)、dnase1-like2(d1l2)、dnase1-like3同工型1(d1l3)、dnase1-like3同工型2(d1l3-2)、dnase2a(d2a)和dnase2b(d2b))。
在一些方面和实施例中,细胞外dnase或其变体与半衰期延长部分,如白蛋白、转铁蛋白、fc或弹性蛋白样蛋白质或其变体融合,任选地借助于插入接头融合。参见例如us9,458,218,该案以全文引用的方式并入本文中。在一些实施例中,细胞外dnase或其变体通过免疫球蛋白铰链区进行二聚化。举例来说,本文中所描述的工程改造的酶还可以包括fc融合域(例如免疫球蛋白的铰链和ch2域和ch3域)。在一些实施例中,dnase(例如d1l3变体)与白蛋白氨基酸序列或结构域,例如与人白蛋白或其片段或变体融合。参见例如wo2015/066550和us9,221,896,各案以全文引用的方式并入本文中。白蛋白可以在工程改造的细胞外dnase或其变体的n端和/或c端处与dnase接合,任选地借助于插入接头接合。例示性白蛋白氨基酸序列由seqidno:39提供。在一些实施例中,d1l3和d1或如本文中所描述的变体一起通过fc铰链区二聚化,产生具有降解net的协同功能特性的二聚分子。在一些实施例中,细胞外dnase或其变体在n端处通过肽接头与白蛋白氨基酸序列融合。肽接头可以是柔性接头、刚性接头或在一些实施例中,可以是生理学上可裂解的接头(例如蛋白酶可裂解的接头)。在一些实施例中,接头的长度是5至100个氨基酸,或其长度是5至50个氨基酸。在又其它实施例中,接头是与细胞外dnase和半衰期延长部分(例如白蛋白)共价偶合的有机分子、基团、聚合物(例如peg)或化学部分。
在一些方面,本发明提供一种d1l3变体,其中与seqidno:4的野生型d1l3同工型1酶或seqidno:5的野生型d1l3同工型2酶相比,所述d1l3变体具有以下中的一种或多种:增加的蛋白质稳定性、增加的药物动力学暴露和药效学活性持续时间、对蛋白水解降解的抗性、在体外表达系统中较高的生产水平、较佳的纯化适宜性以及未明显变低的、相同的或较佳的染色质和/或net降解活性。如本文中所使用,除非作相反陈述,否则术语“d1l3”包括同工型1或同工型2。
酶,例如d1l3变体的dna和/或染色质和/或net降解活性可以在体外,例如通过将酶与例如从纯化的细胞核、dna或被诱导以形成net的离体血液或中性粒细胞获得的dna、染色质或net一起培育来测量。或者,酶,例如d1l3变体的dna和/或染色质和/或net降解活性可以在体内,例如通过以下来测量:向受试者施用酶,其中所述受试者产生或被诱导产生细胞外dna、染色质或net;并测量所述酶对基质中,例如对血清中dna、染色质或net的浓度的影响,优选地使用平行阴性对照,或通过在时间上比较在施用酶之前与之后的浓度。
在一些实施例中,与seqidno:4的野生型d1l3同工型1酶或seqidno:5的野生型d1l3同工型2酶相比,d1l3变体具有大致相同的染色质和/或net降解活性。在一些实施例中,与seqidno:4的野生型d1l3同工型1酶或seqidno:5的野生型d1l3同工型2酶相比,d1l3变体具有较高的染色质和/或net降解活性。
在一些实施例中,d1l3变体是包含白蛋白结构域、任选的接头和d1l3结构域的融合蛋白。在一些实施例中,白蛋白结构域和任选的接头位于d1l3结构域的n端侧。在一些实施例中,白蛋白结构域和任选的接头位于d1l3结构域的c端侧。在所有这类实施例中,任选的接头插入在白蛋白结构域与d1l3结构域之间。
在一些实施例中,融合蛋白的白蛋白氨基酸序列或结构域与由seqidno:39限定的参考白蛋白序列具有至少约75%,或至少约80%,或至少约85%、至少90%、至少95%、至少97%、至少98%或至少99%同一性。在一些实施例中,白蛋白氨基酸序列或结构域包含由seqidno:39限定的参考白蛋白序列或由所述参考白蛋白序列组成。在各种实施例中,白蛋白氨基酸序列结合于新生儿fc受体(fcrn),例如人fcrn。白蛋白氨基酸序列可以是野生型hsa(例如由seqidno:39表示)的变体。在各种实施例中,白蛋白变体可以相对于seqidno:39具有一至二十个或一至十个独立地选自缺失、取代和插入的氨基酸修饰。在一些实施例中,白蛋白氨基酸序列是任何哺乳动物白蛋白氨基酸序列。
在一些实施例中,白蛋白氨基酸序列或结构域是如由seqidno:39表示的全长白蛋白的片段。当在白蛋白的情形中使用时,术语“片段”是指全长白蛋白或其变体(如上文所描述)的任何片段,其使得与其融合或缀合的dnase酶的半衰期相对于相应未融合dnase有所延长。在一些实施例中,白蛋白的片段可以指包含白蛋白的多个域(参见例如wo2011/124718),如域i和iii,以及域ii和iii的融合物的氨基酸序列。通常,白蛋白的片段具有全长序列的至少约100个氨基酸,或至少约200个或至少约300个氨基酸。在各种实施例中,白蛋白片段保持结合人fcrn的能力。
在一些实施例中,融合蛋白的d1l3样结构域与由seqidno:4或seqidno:5限定的成熟d1l3酶参考序列具有至少约85%,或至少约90%,或至少约95%、至少约97%,或至少约98%,或至少约99%同一性。在一些实施例中,d1l3结构域包含由seqidno:4或seqidno:5限定的参考序列或由所述参考序列组成。在一些实施例中,参考序列不包括seqidno:4或5的由c端23个氨基酸限定的c端碱性结构域。
在一些实施例中,融合蛋白包含d1l3结构域,其中d1l3结构域的氨基酸序列与由seqidno:4或seqidno:5限定的成熟酶具有至少约80%同一性。融合蛋白可以进一步包含在成熟酶的n端处的白蛋白氨基酸序列或结构域,和在白蛋白氨基酸序列与成熟酶的氨基酸序列之间的连接氨基酸序列。在一些实施例中,d1l3结构域包含与由seqidno:4或seqidno:5限定的成熟酶参考序列具有至少约90%同一性的氨基酸序列。在一些实施例中,参考序列不包括seqidno:4或5的由c端23个氨基酸限定的c端碱性结构域。包含d1l3结构域的融合蛋白呈现改善的循环半衰期和药效学作用持续时间,包括用于全身性疗法的情形。此外,如使用体外染色质降解测定法确定,与不具有白蛋白融合物的变体相比,白蛋白通过连接序列融合不会显著影响染色质降解活性(或在一些实施例中,对染色质降解活性不具有任何不良影响)。
当提到与野生型脱氧核糖核酸酶的序列同一性时,且除非另外说明,否则序列是指不具有信号肽的成熟酶。此外,除非另外说明,否则为了清楚起见,氨基酸位置是相对于完全翻译的包括信号肽在内的脱氧核糖核酸酶序列编号。因此,举例来说,提到与seqidno:4的酶(人d1l3,同工型1)的序列同一性是指与在n端具有m21的成熟酶的同一性百分比。类似地,提到与seqidno:1的酶(人d1)的序列同一性是指与在n端具有l23的成熟酶的同一性百分比。
在一些实施例中,d1l3具有c端碱性结构域的全部或一部分的缺失。c端碱性结构域被定义为seqidno:4或seqidno:5的c端23个氨基酸。d1l3的c端碱性结构域的缺失或失活显著改善染色质降解活性。参见图1、2和4。在一些实施例中,d1l3变体具有c端碱性结构域氨基酸,如c端碱性结构域的至少5个氨基酸,或在一些实施例中至少10个氨基酸,或在一些实施例中至少15个氨基酸,或在一些实施例中至少20个氨基酸的缺失。在一些实施例中,d1l3变体具有由seqidno:4或seqidno:5的c端23个氨基酸限定的整个c端碱性结构域的缺失。例示性bd缺失包括q282_s305delinsk(参见seqidno:9)、s305delinsk(参见seqidno:10)、k292_s305del(参见seqidno:11)和s293_s305del(参见seqidno:12)。在一些实施例中,d1l3结构域(具有bd缺失)的c端具有在c端处的不与c端bd对准且在体外测定法中不会不利地影响染色质降解活性的1至10个或1至5个氨基酸。
在一些实施例中,d1l3变体是工程改造的融合蛋白,该融合蛋白包含:具有选自seqidno:8至seqidno:16的序列的dnase1l3域;具有选自seqidno:31至seqidno:38的序列的接头;以及具有seqidno:39的序列的白蛋白结构域或如所描述的变体或片段。在一些实施例中,d1l3变体具有一个或多个来自d1的构造单元取代,所述取代描述于以引用的方式并入本文中的pct/us2018/04708中。
在一些实施例中,d1l3序列或结构域含有来自d1的构造单元取代,所述取代可以选自以下中的一个或多个:m21_r22delinslk、c24_s25delinsaa、v28_s30delinsiqt、s34t、q36_v44delinsmsnatlvsy、k47_k50delinsqils、c52y、i55_m58delinsialvqe、i60_k61delinsvr、n64_i70delinshltavgk、m72_k74delinsldn、r77_i83delinsqdapd、n86h、i89v、s91_r92delinsep、t97s、q101r、a103l、l105v、k107_l110delinsrpdq、v113_r115delinsavd、h118y、h120d、y122_a127delinsgcepcgn、v129t、s131n、f135_v136delinsai、w138r、q140_h143delinfsrf、a145_d148delinsevre、v150a、i152v、t156_t157delinsaa、e159_s161delinsgda、k163a、e167a、v169_e170delinsyd、t173l、k176_r178delinsqek、k180_a181delinsgl、n183_f186delinsdvml、p198_a201delinsrpsq、k203_n204delinsss、r208w、d210s、r212t、v214q、g218p、q220_e221delinssa、v225_s228delinsatp、n230h、l238_r239delinsva、q241_s246delinsmllrga、k250d、n252_v254delinsalp、d256n、k259a、k262g、t264_e267delinssdql、l269_v271delinsqai、f275y、f279_k280delinsvm、q282_s205delinsk,其中前述取代各自是参照seqidno:4编号。
举例来说,d1l3变体可以具有来自d1的构造单元取代q282_s305delinsk,该取代包括c端碱性结构域的缺失,该结构域在d1中不存在。在一些实施例中,d1l3酶在对应于seqidno:4的101位的位置处具有氨基酸取代。取代基于来自d1的相应构造单元可以是arg,或在一些实施例中,可以是lys。在此位置处的取代可以增强d1l3的染色质降解活性。在此位置处的其它取代可能展示类似特性。
接头当存在时可以选自柔性、刚性和可裂解的肽接头。柔性接头主要或完全由小型、非极性或极性残基,如gly、ser和thr构成。例示性柔性接头包含(glyyser)n接头,其中y是1至10(例如1至5)且n是1至约10,并且在一些实施例中是3至约6。在例示性实施例中,y是2至4且n是3至8。这些接头由于其柔性而是非结构化的。刚性较高的接头包括聚脯氨酸或聚pro-ala基序和α-螺旋接头。例示性α-螺旋接头是a(eaaak)na,其中n如上文所定义(例如1至10,或2至6)。通常,接头可以主要由选自gly、ser、thr、ala和pro的氨基酸构成。例示性接头序列含有至少10个氨基酸且可以在15至35个氨基酸的范围内。例示性接头设计是如seqidno:31至38所提供。
在一些实施例中,变体包含接头,其中接头的氨基酸序列主要是甘氨酸和丝氨酸残基,或基本上由甘氨酸和丝氨酸残基组成。在一些实施例中,接头中ser与gly的比率分别是约1:1至约1:10、约1:2至约1:6,或约1:4。例示性接头序列包含s(ggs)4gss(seqidno:36)、s(ggs)9gs(seqidno:37)、(ggs)9gs(seqidno:39)。在一些实施例中,接头具有至少10个氨基酸,或至少15个氨基酸,或至少20个氨基酸,或至少25个氨基酸。举例来说,接头的长度可以是15至30个氨基酸。在各种实施例中,当在毕赤酵母中表达时,具有至少15个氨基酸的较长接头可以提供产量的改善。参见图20。此外且意外的是,与较短的接头序列相比,较长的接头序列展示改善的染色质降解活性。参见图20。
在各种实施例中,d1l3变体是包含seqidno:17至30中的任一个的氨基酸序列的融合蛋白。在其它实施例中,d1l3变体是包含seqidno:17至30中的任一个的氨基酸序列的融合蛋白,并且相对于选自seqidno:17至30的参考序列,该融合蛋白具有一至二十个或一至十个或一至五个独立地选自氨基酸插入、缺失或取代的氨基酸修饰。在一些实施例中,氨基酸修饰是在融合蛋白的d1l3结构域、白蛋白结构域或两个结构域中。在一些实施例中,变体具有seqidno:19、seqidno:22、seqidno:26、seqidno:27、seqidno:28、seqidno:29或seqidno:30的氨基酸序列。在这些实施例中,白蛋白氨基酸序列通过中间或长柔性接头在d1l3(或变体)的n端或n端侧融合。
在其它实施例中,接头是生理学上可裂解的接头,如蛋白酶可裂解的接头。举例来说,蛋白酶可以是凝血途径蛋白酶,如活化因子xii。在某些实施例中,接头包含因子xi(seqidno:42)和/或前激肽释放酶(seqidno:44或45)或其生理学上可裂解的片段的氨基酸序列。在所选择的实施例中,来自因子xi的接头氨基酸序列含有全部或一部分seqidno:42(例如一部分seqidno:42,包括允许被因子xiia裂解的seqidno:42的修饰)。在一些实施例中,来自前激肽释放酶的接头氨基酸序列含有全部或一部分seqidno:44(例如一部分seqidno:44,包括允许被因子xiia裂解的seqidno:44的修饰)。在其它实施例中,接头包括肽序列,该肽序列是中性粒细胞特异性蛋白酶,如中性粒细胞弹性蛋白酶、组织蛋白酶g和蛋白酶3的裂解目标。
d1l3融合蛋白的一些例示性实施例包含三个氨基酸序列的组合,所述氨基酸序列可以独立地选自本文中所公开的序列且这类序列从n端至c端,按以下顺序排列:
融合物1:seqidno:4、seqidno:31、seqidno:39;
融合物2:seqidno:5、seqidno:31、seqidno:39;
融合物3:seqidno:8、seqidno:31、seqidno:39;
融合物4:seqidno:9、seqidno:31、seqidno:39;
融合物5:seqidno:10、seqidno:31、seqidno:39;
融合物6:seqidno:11、seqidno:31、seqidno:39;
融合物7:seqidno:12、seqidno:31、seqidno:39;
融合物8:seqidno:13、seqidno:31、seqidno:39;
融合物9:seqidno:14、seqidno:31、seqidno:39;
融合物10:seqidno:15、seqidno:31、seqidno:39;
融合物11:seqidno:16、seqidno:31、seqidno:39;
融合物12:seqidno:4、seqidno:32、seqidno:39;
融合物13:seqidno:5、seqidno:32、seqidno:39;
融合物14:seqidno:8、seqidno:32、seqidno:39;
融合物15:seqidno:9、seqidno:32、seqidno:39;
融合物16:seqidno:10、seqidno:32、seqidno:39;
融合物17:seqidno:11、seqidno:32、seqidno:39;
融合物18:seqidno:12、seqidno:32、seqidno:39;
融合物19:seqidno:13、seqidno:32、seqidno:39;
融合物20:seqidno:14、seqidno:32、seqidno:39;
融合物21:seqidno:15、seqidno:32、seqidno:39;
融合物22:seqidno:16、seqidno:32、seqidno:39;
融合物23:seqidno:4、seqidno:33、seqidno:39;
融合物24:seqidno:5、seqidno:33、seqidno:39;
融合物25:seqidno:8、seqidno:33、seqidno:39;
融合物26:seqidno:9、seqidno:33、seqidno:39;
融合物27:seqidno:10、seqidno:33、seqidno:39;
融合物28:seqidno:11、seqidno:33、seqidno:39;
融合物29:seqidno:12、seqidno:33、seqidno:39;
融合物30:seqidno:13、seqidno:33、seqidno:39;
融合物31:seqidno:14、seqidno:33、seqidno:39;
融合物32:seqidno:15、seqidno:33、seqidno:39;
融合物33:seqidno:16、seqidno:33、seqidno:39;
融合物34:seqidno:4、seqidno:34、seqidno:39;
融合物35:seqidno:5、seqidno:34、seqidno:39;
融合物36:seqidno:8、seqidno:34、seqidno:39;
融合物37:seqidno:9、seqidno:34、seqidno:39;
融合物38:seqidno:10、seqidno:34、seqidno:39;
融合物39:seqidno:11、seqidno:34、seqidno:39;
融合物40:seqidno:12、seqidno:34、seqidno:39;
融合物41:seqidno:13、seqidno:34、seqidno:39;
融合物42:seqidno:14、seqidno:34、seqidno:39;
融合物43:seqidno:15、seqidno:34、seqidno:39;
融合物44:seqidno:16、seqidno:34、seqidno:39;
融合物45:seqidno:4、seqidno:35、seqidno:39;
融合物46:seqidno:5、seqidno:35、seqidno:39;
融合物47:seqidno:8、seqidno:35、seqidno:39;
融合物48:seqidno:9、seqidno:35、seqidno:39;
融合物49:seqidno:10、seqidno:35、seqidno:39;
融合物50:seqidno:11、seqidno:35、seqidno:39;
融合物51:seqidno:12、seqidno:35、seqidno:39;
融合物52:seqidno:13、seqidno:35、seqidno:39;
融合物53:seqidno:14、seqidno:35、seqidno:39;
融合物54:seqidno:15、seqidno:35、seqidno:39;
融合物55:seqidno:16、seqidno:35、seqidno:39;
融合物56:seqidno:4、seqidno:36、seqidno:39;
融合物57:seqidno:5、seqidno:36、seqidno:39;
融合物58:seqidno:8、seqidno:36、seqidno:39;
融合物59:seqidno:9、seqidno:36、seqidno:39;
融合物60:seqidno:10、seqidno:36、seqidno:39;
融合物61:seqidno:11、seqidno:36、seqidno:39;
融合物62:seqidno:12、seqidno:36、seqidno:39;
融合物63:seqidno:13、seqidno:36、seqidno:39;
融合物64:seqidno:14、seqidno:36、seqidno:39;
融合物65:seqidno:15、seqidno:36、seqidno:39;
融合物66:seqidno:16、seqidno:36、seqidno:39;
融合物67:seqidno:4、seqidno:37、seqidno:39;
融合物68:seqidno:5、seqidno:37、seqidno:39;
融合物69:seqidno:8、seqidno:37、seqidno:39;
融合物70:seqidno:9、seqidno:37、seqidno:39;
融合物71:seqidno:10、seqidno:37、seqidno:39;
融合物72:seqidno:11、seqidno:37、seqidno:39;
融合物73:seqidno:12、seqidno:37、seqidno:39;
融合物74:seqidno:13、seqidno:37、seqidno:39;
融合物75:seqidno:14、seqidno:37、seqidno:39;
融合物76:seqidno:15、seqidno:37、seqidno:39;
融合物77:seqidno:16、seqidno:37、seqidno:39;
融合物78:seqidno:4、seqidno:38、seqidno:39;
融合物79:seqidno:5、seqidno:38、seqidno:39;
融合物80:seqidno:8、seqidno:38、seqidno:39;
融合物81:seqidno:9、seqidno:38、seqidno:39;
融合物82:seqidno:10、seqidno:38、seqidno:39;
融合物83:seqidno:11、seqidno:38、seqidno:39;
融合物84:seqidno:12、seqidno:38、seqidno:39;
融合物85:seqidno:13、seqidno:38、seqidno:39;
融合物86:seqidno:14、seqidno:38、seqidno:39;
融合物87:seqidno:15、seqidno:38、seqidno:39;
融合物88:seqidno:16、seqidno:38、seqidno:39;
融合物89:seqidno:4、seqidno:42、seqidno:39;
融合物90:seqidno:5、seqidno:42、seqidno:39;
融合物91:seqidno:8、seqidno:42、seqidno:39;
融合物92:seqidno:9、seqidno:42、seqidno:39;
融合物93:seqidno:10、seqidno:42、seqidno:39;
融合物94:seqidno:11、seqidno:42、seqidno:39;
融合物95:seqidno:12、seqidno:42、seqidno:39;
融合物96:seqidno:13、seqidno:42、seqidno:39;
融合物97:seqidno:14、seqidno:42、seqidno:39;
融合物98:seqidno:15、seqidno:42、seqidno:39;
融合物99:seqidno:16、seqidno:42、seqidno:39
融合物100:seqidno:4、seqidno:43、seqidno:39;
融合物101:seqidno:5、seqidno:43、seqidno:39;
融合物102:seqidno:8、seqidno:43、seqidno:39;
融合物103:seqidno:9、seqidno:43、seqidno:39;
融合物104:seqidno:10、seqidno:43、seqidno:39;
融合物105:seqidno:11、seqidno:43、seqidno:39;
融合物106:seqidno:12、seqidno:43、seqidno:39;
融合物107:seqidno:13、seqidno:43、seqidno:39;
融合物108:seqidno:14、seqidno:43、seqidno:39;
融合物109:seqidno:15、seqidno:43、seqidno:39;
融合物110:seqidno:16、seqidno:43、seqidno:39;
融合物111:seqidno:4、seqidno:44、seqidno:39;
融合物112:seqidno:5、seqidno:44、seqidno:39;
融合物113:seqidno:8、seqidno:44、seqidno:39;
融合物114:seqidno:9、seqidno:44、seqidno:39;
融合物115:seqidno:10、seqidno:44、seqidno:39;
融合物116:seqidno:11、seqidno:44、seqidno:39;
融合物117:seqidno:12、seqidno:44、seqidno:39;
融合物118:seqidno:13、seqidno:44、seqidno:39;
融合物119:seqidno:14、seqidno:44、seqidno:39;
融合物120:seqidno:15、seqidno:44、seqidno:39;
融合物121:seqidno:16、seqidno:44、seqidno:39;
融合物122:seqidno:4、seqidno:45、seqidno:39;
融合物123:seqidno:5、seqidno:45、seqidno:39;
融合物124:seqidno:8、seqidno:45、seqidno:39;
融合物125:seqidno:9、seqidno:45、seqidno:39;
融合物126:seqidno:10、seqidno:45、seqidno:39;
融合物127:seqidno:11、seqidno:45、seqidno:39;
融合物128:seqidno:12、seqidno:45、seqidno:39;
融合物129:seqidno:13、seqidno:45、seqidno:39;
融合物130:seqidno:14、seqidno:45、seqidno:39;
融合物131:seqidno:15、seqidno:45、seqidno:39;
融合物132:seqidno:16、seqidno:45、seqidno:39;
在一些实施例中,融合蛋白被合成而具有信号肽。信号肽可以在从宿主细胞分泌期间去除。经展示,例示性信号肽是seqidno:4至16和seqidno:44至46。在一些实施例中,融合蛋白是成熟蛋白质,也就是说,不具有信号肽。
在各种实施例中,融合蛋白是选自融合蛋白1至132,并且所选择的融合蛋白可以任选地具有最多20个(或最多10个)独立地选自氨基酸缺失、插入和取代的氨基酸修饰。
在一些方面,本发明提供细胞外dnase酶的变体,所述变体被工程改造成在制造方面具有优点,能够产生适用于疗法的重组酶,并且可以任选地与如已描述的融合蛋白实施例(包括白蛋白融合物实施例)结合使用。在各种实施例中,本发明提供一种重组d1、d1l1、d1l2和d1l3变体,该变体包含半胱氨酸残基的一个或多个氨基酸取代或缺失,使得在蛋白质表达期间通过二硫桥进行的分子内和分子间交联减少。举例来说,脱氧核糖核酸酶变体可能不具有一个、两个或三个存在于野生型序列中的半胱氨酸残基(例如缺失一个、两个或三个半胱氨酸残基),或其中一个或多个这类半胱氨酸被其它氨基酸取代。在一些实施例中,一个或多个半胱氨酸残基被独立地选自ala、gly和ser的氨基酸取代,或一个或多个半胱氨酸残基被取代而作为构造单元取代的一部分。在一些实施例中,被取代的一个或多个半胱氨酸残基在d1蛋白质家族的其它成员(例如d1、d1l1、d1l2和d1l3)之间不具有保守性。在一些实施例中,工程改造的酶包含或进一步包含至少一个在d1蛋白质家族另一成员中的构造单元取代和/或其它点突变,所述点突变使得与野生型酶相比,蛋白质稳定性增加、对由蛋白酶引起的降解的抗性增加、生物可用性增加以及基本上相同或较佳的dna和/或染色质和/或net降解活性(体外或体内)。在一些实施例中,取代和/或修饰包括半胱氨酸残基中的仅单个修饰和其它修饰。在一些实施例中,去除单个半胱氨酸残基足以在制造方面提供显著优点。
在其它方面,本发明提供细胞外dnase酶的变体,所述变体被工程改造成在蛋白酶抗性方面具有优点,以改善体内半衰期以及减少在重组酶产生期间的蛋白水解。本公开鉴别出例如对由纤维蛋白溶酶、凝血酶和/或胰蛋白酶进行的蛋白水解敏感的d1l3残基,以及对由哺乳动物和非哺乳动物细胞系产生的蛋白酶敏感的残基(例如成对的碱性氨基酸)。
本文中所描述的重组细胞外dnase变体可以具有点突变的组合,所述点突变包括半胱氨酸残基的取代、蛋白酶敏感性残基的取代,和/或可以包含一个或多个单元取代。构造单元蛋白质工程改造(buildingblockproteinengineering,bbpe)描述于pct/us18/47084和us62/800,790中,其公开内容以引用的方式并入本文中。bbpe涉及提供供体与接受体细胞外dnase酶的蛋白质-蛋白质比对和鉴别用于转移的可变氨基酸序列(“构造单元”)。可变氨基酸侧接供体和接受体细胞外dnase酶中的一个或多个保守性氨基酸(在构造单元的上游和下游)。这些构造单元可以在接受体与供体蛋白质之间交换,以产生嵌合酶。
在其它方面,本发明提供一种用于重组产生细胞外dnase蛋白质,包括本文中所描述的其变体的方法。在一些实施例中,所述方法使用非哺乳动物表达系统,如毕赤酵母。在一些实施例中,毕赤酵母借助于原生信号肽来编码脱氧核糖核酸酶,由此允许从宿主细胞分泌。在一些实施例中,表达系统是哺乳动物细胞表达系统,如中国仓鼠卵巢(cho)细胞。在一些实施例中,通过去除对于活性不必要的半胱氨酸残基,本发明避免了以其它方式形成和阻碍重组产生的分子间和分子内二硫键。在一些实施例中,错误的分子间和分子内二硫键的显著减少可以通过单一半胱氨酸残基的取代来实现。
在一些实施例中,重组表达系统具有在成对的碱性氨基酸处裂解的一种或多种蛋白酶的缺失或失活。例示性酶包括弗林蛋白酶(furin)(由cho细胞表达)以及由毕赤酵母表达的天冬氨酸蛋白酶3(ysp1)和枯草溶菌素(kexin)(kex2)。在一些实施例中,这些酶未在遗传上缺失或失活,但在重组蛋白质产生期间,其活性被蛋白酶抑制剂抑制。
在一些实施例中,用于非哺乳动物表达系统或哺乳动物表达系统的生长培养基补充有聚阴离子,如硫酸葡聚糖、肝素、柠檬酸铁和edta。在其它实施例中,毕赤酵母或其它表达系统的生长培养基补充有硫酸葡聚糖,所述硫酸葡聚糖的平均分子量在5kda与100kda之间。在一些实施例中,硫酸葡聚糖的平均分子量是约10kda或更低,或约20kda或更低,或约30kda或更低,或约40kda或更低,或约50kda或更低,或约75kda或更低,或约100kda或更低。在各种实施例中,聚阴离子是以足以与所产生的重组蛋白质络合的量添加到培养物中。
在一些实施例中,非哺乳动物表达系统或哺乳动物表达系统的培养基中的重组细胞外dnase蛋白质和其变体是通过以下方法纯化,该方法包括重组细胞外dnase蛋白质和变体从聚阴离子,如从硫酸葡聚糖、肝素、edta解离。在某些实施例中,纯化方法包括强阴离子交换树脂,如三乙基氨基乙基。在一些实施例中,根据所述方法产生的细胞外dnase蛋白质是d1l3或其变体。
因此,在一些实施例中,本发明提供一种d1l3变体,该变体包含与由seqidno:4(人d1l3,同工型1)或seqidno:5(人d1l3,同工型2)限定的酶具有至少80%同一性的氨基酸序列,并且具有一个或多个半胱氨酸残基取代和/或对蛋白水解,例如对体内蛋白水解敏感的氨基酸的一个或多个取代。在一些实施例中,d1l3蛋白质变体包含一个或多个其它修饰,与seqidno:4或seqidno:5的野生型d1l3蛋白质相比,所述修饰引起蛋白质稳定性(例如蛋白酶抗性)增加、在体外表达系统中较高的生产水平和/或未显著变低的、相同的或较佳的dna和/或染色质和/或net降解活性。举例来说,d1l3变体可以包含至少一个如pct/us2018/47084(以全文引用的方式并入本文中)中所公开的其它构造单元取代或点突变,或可以包括一个或多个本文中所描述的用于增加蛋白酶抗性的取代。
在一些实施例中,d1l3变体具有cys68的取代,所述cys任选地被选自ala、ser和gly的氨基酸取代。在一些实施例中,变体包含取代n64_i70delinshltavgk。在一些实施例中,序列hltavgk可以被一个、两个或三个取代、缺失和/或插入(共同地)进一步修饰,只要不包括cys残基即可。在一些实施例中,d1l3变体包含与参考seqidno:4或seqidno:5具有至少约85%、至少约90%、至少约95%或至少约98%同一性的氨基酸序列。
在一些实施例中,本发明提供一种d1l3酶,该酶具有在对应于cys68的位置处缀合的聚乙二醇(peg)部分,该cys被认为是不成对的半胱氨酸。在一些实施例中,d1l3变体具有与对应于c194的氨基酸缀合的peg。在这些实施例中,peg部分将提供半衰期延长特性,同时避免二硫键混杂和/或蛋白质错误折叠。在一些实施例中,peg部分是通过可以在温和条件下进行的顺丁烯二酰亚胺化学方法缀合。已知且可以使用其它缀合化学方法,如乙烯基砜、二硫吡啶和碘乙酰胺活化化学方法。peg部分可以是线性或分支的,并且通常可以在10kda至40kda范围内,或在20至30kda范围内。
或者或另外,本发明提供一种d1l3变体,该变体包含一个或多个被取代的精氨酸和/或赖氨酸残基,引起蛋白酶抗性的增加。在一些实施例中,d1l3变体在对应于seqidno:4的k180、k200、k259和/或r285的一个或多个位置处具有取代。根据本公开,这类赖氨酸和精氨酸残基被鉴别为潜在的蛋白酶敏感性位点。因此,这些残基中的一个或多个(例如1、2、3或4个)可以被不带电残基,如被独立地选自ala、gly、leu、ile、val、thr、ser和pro的残基修饰。在一些实施例中,蛋白酶敏感性赖氨酸或精氨酸残基被取代而作为构造单元取代的一部分。举例来说,d1l3变体可以包含一个或多个选自以下的取代:k180_a181delinsgl、p198_a201delinsrpsq和k259a。在一些实施例中,d1l3变体包含以下一个或两个取代:k180_a181delinsgl和/或p198_a201delinsrpsq,其中任一个任选地被一个或两个氨基酸取代、缺失或插入修饰,只要构造单元取代不被由r或k残基进行的取代或插入修饰即可。在一些实施例中,d1l3变体增加对由一种或多种选自纤维蛋白溶酶、凝血酶和/或胰蛋白酶的蛋白酶进行的蛋白水解的抗性。
或者或另外,d1l3变体包含成对的碱性残基的一个或多个突变。在一些实施例中,成对的碱性残基对应于选自seqidno:4的k50/r51、r80/r81、k114/r115、k199/k200、k226/k227、k291/k292、r297/k298/k299和k303/r304的位置。在一些实施例中,d1l3变体具有一个或多个取代,所述取代选自对应于seqidno:4的r114t、r114a、r114d、r114q、k227s和k227e的取代。在一些实施例中,成对的碱性残基的一个或多个突变包括对应于r51k、r81k、r115k和r304k的氨基酸取代。在一些实施例中,成对的碱性残基是使用相应的构造单元取代来取代。根据这些实施例,d1l3变体将对由重组蛋白质表达系统(例如cho和毕赤酵母)表达的蛋白酶具有较高的抗性。
在一些方面,本发明提供一种脱氧核糖核酸酶1(d1)变体,该变体包含与由seqidno:1限定的酶具有至少80%同一性的氨基酸序列,和一个或多个半胱氨酸残基取代。在一些实施例中,d1蛋白质变体具有一个或多个其它修饰,与seqidno:1的野生型d1蛋白质相比,所述修饰引起蛋白质稳定性增加、在体外表达系统中较高的生产水平和/或未显著变低的、相同的或较佳的dna和/或染色质和/或net降解活性。举例来说,d1变体可以包含至少一个如以全文引用的方式并入本文中的pct/us2018/47084中所公开的其它构造单元取代或点突变。
在一些实施例中,d1变体具有c123和c126中的一个或两个的取代,并且任选地被ala、ser和gly取代。在一些实施例中,d1变体包含取代g122_n128delinsyqgda。在一些实施例中,d1变体包含与seqidno:1具有至少85%、至少90%、至少95%或至少98%同一性的氨基酸序列。
在一些实施例中,本发明提供一种d1酶,该酶具有在对应于c123和/或c126的位置处缀合的peg部分。在这些实施例中,peg部分将提供半衰期延长特性,同时避免二硫键混杂和/或蛋白质错误折叠。在一些实施例中,peg部分是通过可以在温和条件下进行的顺丁烯二酰亚胺化学方法缀合。已知且可以使用其它缀合化学方法,如乙烯基砜、二硫吡啶和碘乙酰胺活化化学方法。peg部分可以是线性或分支的,并且通常可以在10kda至40kda范围内,或在20至30kda范围内。
在其它方面,本发明提供一种d1l1变体,该变体包含与由seqidno:2限定的酶具有至少80%同一性的氨基酸序列,和一个或多个被取代的半胱氨酸残基。半胱氨酸残基任选地在d1家族内不具有保守性(例如c22和/或c50),并且任选地被gly、arg或ser取代,或被取代而作为构造单元取代的一部分。在一些实施例中,d1l1变体包含与seqidno:2具有至少85%、至少90%、至少95%或至少98%同一性的氨基酸序列。
在一些实施例中,本发明提供一种d1l1酶,该酶具有在对应于c22和/或c50的位置处缀合的peg部分。在这些实施例中,peg部分将提供半衰期延长特性,同时避免二硫键混杂和/或蛋白质错误折叠。在一些实施例中,peg部分是通过可以在温和条件下进行的顺丁烯二酰亚胺化学方法缀合。已知且可以使用其它缀合化学方法,如乙烯基砜、二硫吡啶和碘乙酰胺活化化学方法。peg部分可以是线性或分支的,并且通常可以在10kda至40kda范围内,或在20至30kda范围内。
在一些方面,本发明提供一种d1l2变体,该变体包含与由seqidno:3限定的酶具有至少80%同一性的氨基酸序列,和一个或多个被取代的半胱氨酸残基。半胱氨酸残基可以在d1家族内不具有保守性(例如c43),并且任选地被gly、arg或ser取代,或被取代而作为构造单元取代的一部分。在一些实施例中,d1l2变体包含与seqidno:3具有至少85%、至少90%、至少95%或至少98%同一性的氨基酸序列。
在一些实施例中,本发明提供一种d1l2酶,该酶具有在对应于c43的位置处缀合的peg部分。在这些实施例中,peg部分将提供半衰期延长特性,同时避免二硫键混杂和/或蛋白质错误折叠。在一些实施例中,peg部分是通过可以在温和条件下进行的顺丁烯二酰亚胺化学方法缀合。已知且可以使用其它缀合化学方法,如乙烯基砜、二硫吡啶和碘乙酰胺活化化学方法。peg部分可以是线性或分支的,并且通常可以在10kda至40kda范围内,或在20至30kda范围内。
在其它方面,本发明提供了编码本文中所公开的d1、d1l1、d1l2或d1l3变体的分离的多核苷酸,以及载体和宿主细胞。宿主细胞可以是任何表达系统(包括细菌或真核生物)的细胞,无论是非哺乳动物如毕赤酵母的细胞,还是哺乳动物如cho的细胞。
在一些实施例中,将多核苷酸递送用于疗法。编码多核苷酸可以使用已知的程序,例如电穿孔或细胞挤压,和/或载体(包括病毒载体),以mrna或dna构建体形式递送。mrna多核苷酸可以包括已知的修饰(mmrna)以避免先天免疫系统活化。参见wo2014/028429,该案以全文引用的方式并入本文中。在一些实施例中,将多核苷酸递送至受试者的身体中。在一些实施例中,将多核苷酸递送至体外细胞中,并将所述细胞递送至受试者的身体中。细胞可以是例如白细胞(例如t细胞或巨噬细胞)、内皮细胞、上皮细胞、肝细胞或干细胞。
在其它方面,本发明提供一种用于产生本文中所描述的细胞外dnase变体的方法。所述方法包括培养表达多核苷酸的细胞,所述多核苷酸编码细胞外dnase;和回收重组dnase蛋白质。细胞可以是原核或真核细胞。在一些实施例中,脱氧核糖核酸酶是使用非哺乳动物表达系统表达,该表达系统任选地是毕赤酵母或酵母属种(saccharomycesspp.)。在一些实施例中,使用哺乳动物表达系统,如cho细胞。
本发明还提供药物组合物,该药物组合物包含如本文中所描述的细胞外dnase或其变体,或任选的如所描述的多核苷酸或载体,以及药学上可接受的载剂。
载体通常包含分离的核酸,并且可以用于将分离的核酸递送至细胞内部。许多载体是本领域中已知的,包括但不限于线性多核苷酸、与离子性或两性化合物缔合的多核苷酸、质粒和病毒。例示性载体包括自主复制质粒或病毒。所述术语还应解释为包括非质粒和非病毒化合物,所述化合物促进核酸转移至细胞中,例如聚赖氨酸化合物、脂质体等。病毒载体的实例包括但不限于腺病毒载体、腺相关病毒载体、逆转录病毒载体等。
药物组合物可以被配制成用于任何施用途径,包括表面、肠胃外或经肺施用。在各种实施例中,组合物被配制成用于皮内、肌肉内、腹膜内、关节内、静脉内、皮下、动脉内、经口、舌下、经肺或透皮施用。在一些实施例中,组合物被配制成用于静脉内或皮下施用。
在其它方面,本发明提供一种用于治疗需要细胞外dna降解、细胞外染色质降解、细胞外陷阱(et)降解和/或中性粒细胞胞外陷阱(net)降解的受试者的方法。所述方法包括施用治疗有效量的本文中所描述的细胞外dnase或其变体或组合物。受试者需要细胞外dna或染色质降解(包括et或net降解)的例示性适应症公开于pct/us18/47084中,其公开内容以引用的方式并入本文中。在一些实施例中,本发明提供一种用于治疗有需要的受试者的方法,该方法包括施用治疗有效量的由序列seqidno:8至seqidno:30中的任一个表示的蛋白质。
在描述用于治疗受试者的方法的各种情况下,本发明也提供一种或多种细胞外dnase蛋白质用于治疗或预防与et和/或net相关的疾病的用途。
在各种实施例中,本发明提供一种用于治疗、预防或管理以net的存在或积聚为特征的疾病或疾患的方法。这类疾病或疾患包括但不限于与慢性中性白细胞增多、中性粒细胞聚集和白细胞淤滞相关的疾病、血栓形成和血管闭塞、局部缺血-再灌注损伤、手术和创伤性组织损伤、急性或慢性炎症性反应或疾病、自身免疫疾病、心血管疾病,代谢疾病、全身性炎症、呼吸道炎症性疾病、肾炎症性疾病、与移植组织相关的炎症性疾病(例如移植物抗宿主疾病)和癌症(包括白血病)。
在某些实施例中,本发明涉及以d1l3缺乏或d1缺乏为特征的疾病或疾患的治疗。在一些情况下,受试者具有dnase1l3基因或dnase1基因的突变(例如功能丧失性突变)。这类受试者可表现出自身免疫疾病(例如全身性红斑狼疮(sle)(包括狼疮肾炎)、硬皮病或全身性硬化症、类风湿性关节炎、炎症性肠病(包括克罗恩氏病(crohn’sdisease)和溃疡性结肠炎)和荨麻疹性血管炎)。在一些情况下,受试者具有d1(例如抗dnase1抗体和肌动蛋白)和/或d1l3(例如抗dnase1l3抗体)的获得性抑制剂。这类受试者还可能患有自身免疫或炎症性疾病(例如sle、全身性硬化症)。
在一些实施例中,受试者具有阻塞导管系统的net或有产生所述net的风险。举例来说,可以向受试者施用本文中所公开的dnase酶以治疗胰腺炎、胆管炎、结膜炎、乳腺炎、干眼病、输精管梗阻或肾病。
在一些实施例中,受试者具有在内皮表面(例如手术粘连)、皮肤(例如伤口/疤痕)上或在滑膜关节(例如痛风和关节炎,例如类风湿性关节炎)中积聚的net或具有产生所述net的风险。可以向受试者施用本文中所描述的dnase酶以治疗以内皮表面上net积聚为特征的疾患,如但不限于手术粘连。
可以使用本文中所公开的dnase酶治疗或预防的其它与net相关的疾病和疾患包括:anca相关血管炎、哮喘、慢性阻塞性肺病、中性粒细胞性皮肤病、皮肌炎、烧伤、蜂窝组织炎、脑膜炎、脑炎、中耳炎、咽炎、扁桃体炎、肺炎、心内膜炎、膀胱炎、肾盂肾炎、阑尾炎、胆囊炎、胰腺炎、葡萄膜炎、角膜炎、弥散性血管内凝血、急性肾损伤、急性呼吸窘迫综合症、休克肝、肝肾综合症、心肌梗塞、中风、肠缺血、肢体缺血、睾丸扭转、先兆子痫、子痫和实体器官移植(例如肾脏、心脏、肝脏和/或肺移植)。此外,本文中所公开的dnase酶可以用于在具有疤痕或挛缩风险的个体中,例如在具有手术切口、裂伤或烧伤的个体中预防疤痕或挛缩,例如通过局部施用于皮肤进行预防。
在各种实施例中,受试者患有用或曾经用包括d1和链球菌脱氧核糖核酸酶在内的野生型脱氧核糖核酸酶治疗的疾病。这类疾病或疾患包括血栓、中风、败血症、肺损伤、动脉粥样硬化、病毒感染、镰状细胞病、心肌梗塞、耳部感染、伤口愈合、肝损伤、心内膜炎、肝感染、胰腺炎、原发性移植物功能障碍、肢体缺血再灌注、肾脏损伤、血液凝结、明矾诱发的炎症、肝肾损伤、胸膜渗出物、血胸、胆管内血凝块、肺炎后贫血(postpneumaticanemia)、溃疡、耳鼻喉科疾病、口腔感染、轻微损伤、鼻窦炎、鼻整形术后、不育症、膀胱导管、伤口清洗、皮肤反应测试、肺炎球菌性脑膜炎、痛风、腿溃疡、囊性纤维化、卡氏综合症(kartegener’ssyndrome)、哮喘、肺叶膨胀不全、慢性支气管炎、支气管扩张、狼疮、原发性睫状运动障碍、细支气管炎、脓胸、胸膜感染、癌症、干眼病、下呼吸道感染、慢性血肿、阿尔茨海默氏病(alzheimer’sdisease)和阻塞性肺病。
本发明的其它方面和实施例将由以下实例显而易见。
实例
所有生物制剂中有将近70%是使用中国仓鼠卵巢(cho)细胞产生的。实际上,通常在cho细胞中产生野生型dnase1(d1;α链道酶(dornasealpha))。尽管使用cho细胞在细胞系发育和大规模生产方面具有显著优点,但由于存在相当大程度的可变性以及不存在用于预测或模拟细胞生长特征的可靠方法,故在脱氧核糖核酸酶的生产方面仍具有重大挑战。重要的是,cho细胞不能稳定地产生d1的高活性变体,从而阻碍其临床制造,而且在本公开之前,包括dnase1-like3(d1l3)在内的其它dnase1蛋白质家族成员的制造特性是未知的。
使用cho和微生物表达系统,在d1l3的制造中发现几个挑战,包括低产量、蛋白水解降解、蛋白质错误折叠以及错误的或不合需要的糖基化。本公开提供了针对制造中的这些和其它挑战的技术解决方案,这些技术方案还可以改善d1l3的治疗特性。
实例1:具有碱性结构域缺失(bdd)的d1l3在中国仓鼠卵巢(cho)细胞和毕赤酵母中的表达和表征
dnase1和dnase1l3分别优先裂解不含蛋白质的dna和dna-组蛋白复合物(即,染色质)。先前的研究表明,不存在于dnase1中的在dnase1l3的c端处的碱性结构域(bd)引起两种酶的不同底物特异性(sisirak等人,细胞(cell),2016;keyel,发育生物学(developmentalbiology),2017)。
蛋白质工程改造技术,称为构造单元蛋白质工程改造,描述于pct/us18/47084和us62/800,790中,其公开内容以全文引用的方式并入本文中。此方法可以应用于dnase1和dnase2蛋白质家族的成员。所述方法是基于以下步骤:提供供体与接受体脱氧核糖核酸酶的蛋白质-蛋白质比对;鉴别用于转移的可变氨基酸序列,所述可变氨基酸侧接供体和接受体脱氧核糖核酸酶中的一个或多个保守性氨基酸;用供体脱氧核糖核酸酶的可变氨基酸取代接受体脱氧核糖核酸酶的可变氨基酸以产生嵌合脱氧核糖核酸酶;和以重组方式产生嵌合脱氧核糖核酸酶。
为了表征引起染色质降解活性(“染色质酶”活性)的氨基酸,用来自d1的构造单元取代来取代野生型d1l3,如pct/us2018/047084中所公开。针对d1l3的构造单元取代是选自人d1并产生人d1l3的变体,其特征在于以下突变:关于seqidno:4的m21_r22delinslk、c24_s25delinsaa、v28_s30delinsiqt、s34t、q36_v44delinsmsnatlvsy、k47_k50delinsqils、c52y、i55_m58delinsialvqe、i60_k61delinsvr、n64_i70delinshltavgk、m72_k74delinsldn、r77_i83delinsqdapd、n86h、i89v、s91_r92delinsep、t97s、q101r、a103l、l105v、k107_l110delinsrpdq、v113_r115delinsavd、h118y、h120d、y122_a127delinsgcepcgn、v129t、s131n、f135_v136delinsai、w138r、q140_h143delinfsrf、a145_d148delinsevre、v150a、i152v、t156_t157delinsaa、e159_s161delinsgda、k163a、e167a、v169_e170delinsyd、t173l、k176_r178delinsqek、k180_a181delinsgl、n183_f186delinsdvml、p198_a201delinsrpsq、k203_n204delinsss、r208w、d210s、r212t、v214q、g218p、q220_e221delinssa、v225_s228delinsatp、n230h、l238_r239delinsva、q241_s246delinsmllrga、k250d、n252_v254delinsalp、d256n、k259a、k262g、t264_e267delinssdql、l269_v271delinsqai、f275y、f279_k280delinsvm、q282_s205delinsk。
针对染色质降解活性的损失或增加来筛选这63个d1l3变体。简单来说,使用体外表达载体在cho细胞中瞬时表达d1l3变体。收集培养物上清液并使用纯化的细胞核作为染色质来源,针对染色质降解活性进行测试。如图1中所示,当与野生型d1l3相比时,来自d1的构造单元取代#17和#63显著改善高分子量(hmw)染色质降解成小片段。构造单元取代#7引起错义突变q101r,该突变用精氨酸置换101位的谷氨酰胺(seqidno:8)。构造单元取代#63引起突变q282_s305delinsk,该突变缺失d1l3的全部c端bd,即从氨基酸位置283至305,并用赖氨酸置换282位的谷氨酰胺(q)(seqidno:9)。接着,对上清液进行蛋白质印迹分析以检测野生型d1l3和两种突变体的表达水平(图2)。令人惊讶的是,我们在具有野生型d1l3和q101r突变体的样品中检测到具有不同大小的两种d1l3变体。具有q282_s305delinsk的样品仅含有较小的d1l3变体。数据表明,野生型d1l3的bd在cho细胞中表达期间或分泌后自发地去除(例如被蛋白水解)。还在来自稳定表达wt-d1l3的cho细胞的上清液中检测到两种d1l3变体(图3)。值得注意的是,当与野生型d1l3相比时,碱性结构域缺失的d1l3(bdd-d1l3)展示出显著增加的染色质酶活性。
接着,测试作为cho细胞的替代性微生物表达系统的毕赤酵母。当与野生型d1l3相比时,通常在bdd-d1l3情况下观察到较高的表达水平。此处,我们纯化和表征来自毕赤酵母发酵上清液的野生型d1l3和bdd-d1l3(图4)。意外的是,我们观察到野生型d1l3在bd内氨基酸位置k291、k291或s293处以蛋白水解方式截短,在纯化之后产生d1l3变体的异源混合物。与野生型d1l3不同,由三个构造单元取代(f275y、f279_k280delinsvm、q282_s205delinsk)引起的bdd-d1l3的表达产生纯蛋白质。
接着,我们比较两种d1l3纯化的染色质酶活性。我们观察到,在位置k291、k291或s293处具有bd截短的d1l3变体的异源混合物的染色质酶活性要比具有由f275y/f279_k280delinsvm/q282_s205delinsk引起的完全bd缺失的d1l3变体低约10倍。总起来说,数据说明,bd的蛋白水解裂解可以在微生物和哺乳动物表达系统(即,cho和毕赤酵母)中天然地发生,并且去除bd看来会活化d1l3降解染色质的活性。
实例2:生物反应器中d1l3在cho细胞中的表达
本文中公开了产生野生型d1l3(seqidno:4)的稳定cho细胞系的研发。使用标准cho培养基,在生物反应器中培养所述细胞系。具体地说,图5展示在生物反应器中,在cgmp相容性条件下,由cho细胞表达和分泌的人d1l3的蛋白质印迹。在不同时间点(t1-t3)收集样品。仅检测到极低水平的d1l3和d1l3片段。数据表明,d1l3的低产量是d1l3制造中的一个挑战。
如本文中所公开,通过向培养基中添加聚阴离子来实现野生型d1l3的高生产水平。这类聚阴离子可以包含肝素、硫酸葡聚糖、柠檬酸铁和乙二胺四乙酸中的一种或多种,并且表示“抗细胞凝集剂”中的生物活性成分。具体地说,我们向cho培养基中添加硫酸葡聚糖并观察到d1l3以及d1l3片段的显著增加(图5)。数据说明,聚阴离子增加d1l3的产量,但未阻止蛋白水解降解。
图6a展示聚阴离子,如硫酸葡聚糖(ds),与d1l3形成络合物。d1l3-ds络合物阻止在生产过程期间带负电表面与d1l3发生相互作用和清除。这类带负电表面包括但不限于生产细胞(例如cho细胞、毕赤酵母、酵母属种)的细胞表面、垂死细胞暴露的dna和生物反应器表面。图6b和图6c展示从ds-d1l3络合物获得d1l3的两步骤纯化工艺。如图6中所示,第一个步骤旨在解离ds-d1l3络合物。解离可以通过将ds-d1l3络合物与强阴离子交换表面一起培育来实现,所述表面结合ds并由此释放d1l3。具体地说,纯化工艺可以包括使含有ds-d1l3的培养基穿过填充有强阴离子交换树脂的色谱柱,随后收集流出液(flowthrough),所述流出液包括不含ds的d1l3。纯化工艺的第二个步骤展示于图6c中,并且包括通过应用强阳离子交换树脂,从不含ds的流出液获得d1l3的亲和纯化。总之,通过添加聚阴离子,如硫酸葡聚糖,可以显著增加d1l3的产量。
实例3:工程改造d1l3以获得蛋白酶抗性
野生型d1l3含有50个精氨酸和赖氨酸残基,这使得该酶对蛋白酶,如胰蛋白酶、凝血酶和纤维蛋白溶酶特别敏感。在本实例中,在d1l3中鉴别胰蛋白酶和纤维蛋白溶酶裂解位点。这些位点可以突变以产生d1l3的蛋白酶抗性变体。
简单来说,用胰蛋白酶消化纯化的d1l3。分离d1l3片段,并使用液相色谱(lc)与质谱(ms)的组合来确定所述片段的氨基酸序列。经鉴别,胰蛋白酶在以下精氨酸和赖氨酸残基处裂解d1l3:r22、r29、r51、r66、r80、r81、r95、k99、r115、k147、k163、k180、r208、r212、r235、r239、k250和k262。这些精氨酸和赖氨酸残基可以被较小氨基酸,如丙氨酸、缬氨酸和丝氨酸,或被根据格兰瑟姆距离评分(grantham’sdistancescore)而具有类似特性的氨基酸(例如组氨酸、谷氨酰胺和谷氨酸;图7)取代。具有蛋白酶抗性的d1的特征在于对应于r51、r95、k99和r235的精氨酸和赖氨酸残基,表明这些残基不是引起d1l3的蛋白水解降解的主要原因。
应用构造单元蛋白质工程改造从d1转移以下构造单元,以置换d1l3中含有胰蛋白酶裂解位点的构造单元(图7):r22(突变:m21_r22delinslk)、r29(v28_s30delinsiqt)、r66(n64_i70delinshltavgk)、r80(r77_i83delinsqdapd)、r81(r77_i83delinsqdapd)、r115(v113_r115delinsavd)、k163(k163a)、k180(k180_a181delinsgl)、r208(r208w)、mr212(r212t)、r239(l238_r239delinsva)、k250(k250d)和k262(k262g)。
纤维蛋白溶酶是一种血浆蛋白酶,该酶是通过其酶原纤维蛋白溶酶原的活化而产生。纤维蛋白溶酶原活化物抑制剂1(pai-1)抑制纤维蛋白溶酶的活化。有趣的是,pai-1增加血清中d1l3的酶活性,表明纤维蛋白溶酶可以蛋白水解方式使d1l3失活。然而,并未鉴别d1l3中的纤维蛋白溶酶裂解位点。
计算机模拟(insilico)分析展示,认为氨基酸组合赖氨酸-丙氨酸(ka)或精氨酸-丙氨酸(ra)优选被蛋白酶纤维蛋白溶酶或具有纤维蛋白溶酶样活性的蛋白酶裂解。计算机模拟分析表明,认为氨基酸组合赖氨酸-丙氨酸(ka)或精氨酸-丙氨酸(ra)被蛋白酶纤维蛋白溶酶或具有纤维蛋白溶酶样活性的蛋白酶优选裂解。d1l3含有总共四个推定的纤维蛋白溶酶裂解位点(图8):(位点1)k180/a181(k160/a161,不具有信号肽)、(位点2)k200/a201(k180/a181,不具有信号肽)、(位点3)k259/a260(k239/a240,不具有信号肽)和(位点4)r285/a286(r270/a250,不具有信号肽)。使用d1和d1l3的成对比对,我们发现d1中不存在纤维蛋白溶酶裂解位点(图8)。数据与以下事实一致:d1活性对由血清蛋白酶,如由凝血酶和纤维蛋白溶酶引起的失活具有抗性。应用构造单元蛋白质工程改造从d1转移以下构造单元,以置换d1l3中含有纤维蛋白溶酶裂解位点的构造单元(图9):(位点1)k180_a181delinsgl、(位点2)p198_a201delinsrpsq和(位点3)k259a。r285/a286(位点4)位于在d1中不存在的c端延伸部分中。因此,我们产生了全部四个推定的纤维蛋白溶酶裂解位点都突变的d1l3变体:k180_a181delinsgl、p198_a201delinsrpsq、k259a和r285a。接着,我们分析由d1l3变体进行的染色质降解并在突变型d1l3中观察到强效的染色质降解活性(图10)。总之,数据展示,四个精氨酸和赖氨酸残基,即k180、k200、k259和r285,可以突变以降低蛋白水解降解的风险而不损害酶活性。
接着,用纯化的纤维蛋白溶酶消化纯化的d1l3。分离d1l3片段,并使用lc与ms的组合来确定所述片段的氨基酸序列。我们鉴别出纤维蛋白溶酶在以下精氨酸和赖氨酸残基处裂解d1l3:r22、r29、k45、k47、k74、r81、r92、k107、k176、r212、r226、r227、k250、k259和k262。这些精氨酸和赖氨酸残基可以被较小氨基酸,如丙氨酸、缬氨酸和丝氨酸,或被根据格兰瑟姆距离评分而具有类似特性的氨基酸(例如组氨酸、谷氨酰胺和谷氨酸;图11)取代。具有蛋白酶抗性的d1的特征在于对应于k45的赖氨酸残基,表明此残基不是引起d1l3被纤维蛋白溶酶蛋白水解降解的主要原因。通过计算机模拟,应用构造单元蛋白质工程改造从d1转移以下构造单元,以置换d1l3中含有胰蛋白酶裂解位点的构造单元(图11):r22(突变:m21_r22delinslk)、r29(v28_s30delinsiqt)、k47(k47_k50delinsqils)、k74(m72_k74delinsldn)、r81(r77_i83delinsqdapd)、r92(s91_r92delinsep)、k107(k107_l110delinsrpdq)、k176(k176_r178delinsqek)、r212(r212t)、k226(v225_s228delinsatp)、k227(v225_s228delinsatp)、k250(k250d)、k259(k259a)和k262(k262g)。
最终,分离以重组方式表达的野生型d1l3并对其c端进行测序。鉴别出分别以s290(seqidno:10)、k291(seqidno:11)和k292(seqidno:12)结尾的三个不同氨基酸序列(图4,实例1)。数据鉴别出在大规模制造期间,赖氨酸残基291和292是d1l3的主要蛋白水解裂解位点。
实例4:工程改造d1l3以避免降解
我们观察到d1l3在毕赤酵母中异源表达之后片段化。针对片段的分析将成对的碱性氨基酸,即精氨酸(r)和赖氨酸(k)残基,表征为蛋白水解裂解位点。在cho细胞中表达d1l3之后观察到类似的降解模式。这些观察结果表明,毕赤酵母和cho细胞共有同源蛋白酶,所述蛋白酶在成对的碱性氨基酸处裂解d1l3,不过,所述作用在cho细胞中更为明显。
由此确定,成对的碱性氨基酸裂解酶(pace)有助于dnase1l3片段化。pace,又称为弗林蛋白酶(uniprotid:p09958),在人类和哺乳动物中表达。毕赤酵母表达靶向成对的碱性氨基酸的两种酶,即天冬氨酸蛋白酶3(基因:ysp1;uniprotid:p32329)和枯草溶菌素(基因:kex2;uniprotid:p13134)。因此,dnase1l3和dnase1l3变体可以在以药理学方式抑制或以遗传方式耗尽弗林蛋白酶、天冬氨酸蛋白酶3和枯草溶菌素的毕赤酵母和cho细胞中表达。
此外,dnase1l3和dnase1l3变体中成对的碱性氨基酸的突变使其能够在片段化减少的情况下,在cho和毕赤酵母中表达。针对dnase1l3片段的分析鉴别出在以下位置处的特征性成对的碱性氨基酸:seqidno:2中的k50/r51、r80/r81、k114/r115、k199/k200、k226/k227、k291/k292、r297/k298/k299和k303/r304。
如美国临时专利申请第62/800,790号(以全文引用的方式并入本文中)所公开,来自其它物种的dnase1l3的特征在于在这些裂解位点处的氨基酸取代,包括r114t(小鼠)、r114a(大鼠)、r114d(天竺鼠)、r114q(牛)、k227s(犬)和k227e(大象)。这些氨基酸取代可以应用于人dnase1l3以使得酶对蛋白水解降解具有抗性,包括在cho细胞和毕赤酵母中表达期间。
枯草溶菌素优选在kr和rr残基之后裂解。在k50/r51、r80/r81、k114/r115和k303/r304处的dnase1l3特征是4个kex2裂解位点。这些残基的氨基酸取代使得dnase1l3对kex2具有抗性并且使dnase1l3和dnase1l3变体能够在毕赤酵母和cho细胞中表达。这些氨基酸取代可以是保守性的,例如r51k、r81k、r115k和r304k。
实例5:工程改造d1l3变体以防止产生高分子量聚集体
在d1l3于cho细胞中进行cgmp相容性表达期间(图12a),观察到d1l3的高分子量聚集体的积聚,指出临床上制造d1l3的另一项挑战。在毕赤酵母中观察到的高分子量聚集体的程度要低得多。
对生物反应器材料的蛋白质应用还原条件会使d1l3聚集体溶解。数据说明,d1l3聚集体形成是在蛋白质表达期间,由通过二硫桥进行的分子内和/或分子间交联引起的。具体地说,如图12b中所示,在非还原条件下跑胶,并且展示d1l3的高分子量聚集体的积聚随时间的变化。在还原条件下跑胶,并且未检测到聚集体。数据说明,错误的分子内和分子间二硫键在制造条件下引起人d1l3的错误折叠。
图13展示人d1(seqidno:1)与人d1l3(seqidno:4)的氨基酸序列比对。突出显示出信号肽、保守性氨基酸、可变氨基酸、非保守性半胱氨酸残基和保守性半胱氨酸残基。非保守性半胱氨酸残基中的突变将降低蛋白质表达期间形成分子内和分子间二硫键的可能性。针对d1l3的氨基酸序列(seqidno:4)的分析展示存在五个半胱氨酸(c)残基:c24、c52、c68、c194和c231(图14)。半胱氨酸残基c194和c231在dnase1蛋白质家族的所有成员中具有保守性,并且形成dnase1的酶活性所需的二硫键。在本公开之前,并不知晓半胱氨酸残基在d1l3中的功能。因此,如本文中所公开,这些半胱氨酸残基的突变减少通过二硫桥进行的交联并因此增加蛋白质生产的产量。
半胱氨酸残基可以被其它较小氨基酸,即丙氨酸(a)、丝氨酸(s)和甘氨酸(g)等取代。这类取代引起以下氨基酸突变:c24a/s/g、c52a/s/g、c68a/s/g、c194a/s/g和c231a/s/g。此外,包含保守性半胱氨酸残基的构造单元可以被来自dnase1蛋白质家族的供体脱氧核糖核酸酶(例如d1和d1l3)的构造单元置换。使用以下来自d1的构造单元置换d1l3中含有非保守性半胱氨酸残基c24、c52和c68的构造单元:c24_s25delinsaa、c52y和n64_i70delinshltavgk。如pct/us18/4708中所描述,对d1l3变体的染色质降解活性进行定量。常规氨基酸取代(c24a、c52a)和构造单元取代(c24_s25delinsaa、c52y)都会引起完全不存在染色质降解,表明c24和c52是d1l3活性所需的(图15)。重要的是,由常规氨基酸取代[c68a,(seqidno:13)]或由bb突变(n64_i70delinshltavgk)进行的半胱氨酸c68的突变会产生具有染色质降解活性的d1l3变体(图15)。氨基酸序列比对展示,半胱氨酸c68在其它dnase1蛋白质家族成员中不具有保守性,支持了酶活性不需要c68的观点。此外,还观察到利用丙氨酸对高保守性半胱氨酸c194进行氨基酸取代(c194a)将产生酶活性d1l3变体,而利用丙氨酸对高保守性半胱氨酸c231进行突变(c231a)则不能(图15)。因此,半胱氨酸c68和c194可以突变以降低在d1l3生产期间出现错误的二硫键的风险。
可以应用类似的方法使dnase1蛋白质家族其它成员中的非保守性半胱氨酸残基突变:d1、dnase1-like1(d1l1)和dnase1-like2(d1l2)。d1具有两个非保守性半胱氨酸:c123和c126。d1l1展示两个非保守性半胱氨酸残基(c22、c50),这些残基对应于仅具有一个非保守性半胱氨酸残基c43的d1l2中的c24和c52。dnase1蛋白质家族成员的非保守性半胱氨酸残基的突变将减少在蛋白质表达期间由错误的二硫桥引起的交联并因此允许制造d1、d1l1、d1l2和d1l3以用于治疗应用。
实例6:毕赤酵母中d1l3和白蛋白-d1l3融合蛋白的构建和表达
测试包括d1l3在内的重组人细胞外dnase的毕赤酵母表达。如图16a中所示,利用来自酿酒酵母的α-交配因子(amf)前-原分泌前导序列(seqidno:46)引导d1l3的n端,所述前导序列是毕赤酵母中异源蛋白质表达的常用工具。如本文中所公开,由于糖基化,amf与d1l3的组合出人意料地引起amf的不加工(图16b)。d1l3蛋白质的糖基化阻止将毕赤酵母用于d1l3的临床制造。当n端是由d1l3的原生分泌型信号肽引导时,d1l3被正确地加工[图16b,(seqidno:48)]。重要的是,当与d1l3的原生信号肽相比时,amf使d1l3的表达增加3-5倍。因此,我们测试d1l3融合蛋白的加工。在初步研究中,产生amf和人血清白蛋白[hsa,(seqidno:39)]与d1l3的n端融合物(图17a)。在初步研究中,产生amf和人类血清白蛋白[hsa,(seqidno:39)]与d1l3的n端融合物(图17a)。一些变体在hsa与d1l3之间含有接头肽[例如(gssss)3]。如图17b和图17c中所示,融合蛋白于毕赤酵母中表达产生未糖基化且具有酶活性的d1l3。此外,当与d1l3的原生分泌型信号肽驱动的表达相比时,其表达水平增加5-10倍。总之,数据说明d1l3与白蛋白融合使得能够在毕赤酵母中进行制造。
基于这些初步研究,设计出野生型d1l3和bdd-d1l3的各种hsa融合构建体并针对靶蛋白质(seqidno:17至28)的表达水平进行筛选。如图18中所示,我们观察到人血清白蛋白(seqidno:17)与bdd-d1l3变体(seqidno:16)的n端融合不会显著增加表达水平。然而,值得注意的是,当在hsa与bdd-d1l3之间插入由甘氨酸(g)和丝氨酸(s)残基构成的柔性接头时,检测到表达水平的显著增加。此外,接头序列的长度与表达增加相关。举例来说,在利用5个氨基酸的接头(seqidno:18)的情况下获得12±1.9个相关单位的表达,而在利用15个氨基酸的接头(seqidno:19)的情况下,表达是32±3.2个相关单位,相较于无接头的hsa融合物有约7.5倍的改善。此外,n端位置对于改善表达水平来说很重要,因为接头-hsa构建体的c端融合物是以低水平表达(seqidno:20、seqidno:21)。值得注意的是,hsa通过柔性接头进行的n端融合还稳健地增加野生型d1l3(seqidno:22)的表达,其表达水平是原生d1l3(seqidno:4)的约20倍。总之,hsa通过接头与n端融合能够产生d1l3以及bdd-d1l3变体。
接着,我们测试接头序列的性质对于d1l3表达的改善是否很重要。我们测试另外两个序列apapapapapapap(seqidno:33,14个氨基酸,刚性接头)和aeaaakeaaaka(seqidno:34,12个氨基酸,刚性螺旋接头)。如图19中所示,在两个测试构建体(seqidno:23、seqidno:24)中,我们观察到表达的显著增加,但刚性螺旋接头未实现与在ggggsggggsggggs接头情况下所观察到的表达水平类似的强表达水平。因此,接头的长度和酸组成会影响d1l3表达水平。
接着,我们分析接头长度、表达水平和酶活性之间的关系。对于这些测试,设计出包含hsa通过gs接头与bdd-d1l3变体(seqidno:25至27)的n端融合物的表达载体。测试三种不同的接头长度:sggsgss[7个氨基酸,(seqidno:35)]、sggsggsggsggsgss[16个氨基酸,(seqidno:36)]和sggsggsggsggsggsggsggsggsggsgss[31个氨基酸,(seqidno:37)]。如图20中所示,我们观察到接头序列从7个氨基酸延长到16个氨基酸引起表达水平的增加。从16个进一步延长到31个氨基酸并未增加蛋白质表达,但增加酶活性,这是通过hmw-染色质降解成lmw-染色质检测的。与白蛋白融合物融合的生物制剂通常展示降低的活性,因为白蛋白在空间上阻碍与底物和配体的相互作用。因此,肽接头可以用于增加白蛋白与融合蛋白或肽之间的距离。然而,在hsa与d1l3之间插入接头序列会同时改善酶活性和表达水平的观察结果是出人意料的。
我们比较bdd-d1l3(seqidno:14)与其白蛋白融合对应物(seqidno:19)的染色质降解活性。简单来说,向dnase1-/-dnase1l3-/-小鼠注射seqidno:4或seqidno:19。简单来说,向dnase1-/-dnase1l3-/-小鼠注射seqidno:4或seqidno:19。在注射后15分钟收集血清。如图21a中所示,我们在两种动物中观察到类似的血清染色质降解活性。重要的是,白蛋白与d1l3和其它人细胞外dnase的n端融合将提供半衰期延长的dnase治疗剂。如本文中所公开,我们在可商购的啮齿动物模型中确定sedidno:19(一种含具有15个氨基酸的柔性gs接头的hsa-bdd-d1l3融合蛋白)的半衰期。动物模型的特征在于人fcrn的转基因表达,其引起白蛋白在循环中的长半衰期。未缀合的d1l3(例如seqidno:4)在循环中具有极短的半衰期(<30分钟),但白蛋白融合物使半衰期延长至3.3天,由此显著改善全身暴露,同时还实现快速吸收,其中tmax是5分钟(图21b)。总之,数据表明hsa通过接头序列与d1l3的n端融合不仅促进制造,而且还改善d1l3的体内药物动力学特性。
最终,我们测试hsa与d1l3的n端和c端的双重融合。首先,我们分析d1l3的c端的潜在连接位点。我们鉴别出在283位和284位的两个丝氨酸残基,这些残基提供bd(raftnskksvtlrkktkskrs)与d1l3的核心体的柔性连接。因此,我们去除bd并选择通过柔性gs接头(seqidno:38)将hsa连接至s284。如图22中所示,hsa与bdd-d1l3(seqidno:28)的n端和c端融合保持了在n端hsa融合(seqidno:27)情况下所观察到的高表达水平。
实例7:可裂解接头序列的设计
本文中所公开的研究结果具有除制造以外的含义。举例来说,具有c端氨基酸缺失的d1l3变体可以用于d1l3疗法,所述变体保留了其降解染色质和/或net的酶活性,如由seqidno:9至seqidno:12例示。此外,通常使用不成对的半胱氨酸硫醇的位点特异性烷基化来产生半衰期延长的生物制剂,以用于治疗应用。具体地说,d1l3的非必需半胱氨酸c68和c194可以用于位点特异性聚乙二醇化(pegylation;peg,聚乙二醇)。此外,预期由于突变,如k180_a181delinsgl、p198_a201delinsrpsq、k259a和r285a而对由纤维蛋白溶酶引起的失活具有抗性的d1l3变体具有改善的半衰期并因此在治疗应用中具有功效。
重要的是,白蛋白与d1l3和其它人细胞外dnase的n端的合将提供半衰期延长的dnase治疗剂(图23a)。使用若干接头序列以减少白蛋白对d1l3的空间抑制作用。此外,还研发出生理学上可裂解的肽接头。接头肽被设计成在融合蛋白紧密接近中性粒细胞胞外陷阱(net)时裂解。作为中性粒细胞特异性蛋白酶,如中性粒细胞弹性蛋白酶、组织蛋白酶g和蛋白酶3的靶的肽序列是可裂解接头序列的候选物。
已研发出可裂解接头序列,该接头序列在血管内裂解并因此最适合用于静脉内和动脉内施用的dnase治疗剂。为了设计肽,我们认为net具有活化凝血因子,尤其是凝血因子xii(fxii)的能力。活化的fxii(fxiia)具有两种主要底物:凝血因子xi(fxi,seqidno:40)和前激肽释放酶(pk,seqidno:41)。氨基酸序列比对展示,fxiia裂解位点在fxi和pk中具有保守性(图23b)。在fxi中,裂解位点位于精氨酸387与异亮氨酸388之间。在pk中,裂解位点位于精氨酸390与异亮氨酸391之间。实际上,fxi和pk是同源蛋白质。如本文中所公开,我们设计出若干接头肽,其含有fxi序列380位至403位(seqidno:42、seqidno:43)或pk序列383位至406位(seqidno:44)中的全部或一部分。
最终,fxiia可裂解接头可以用于制造其它生物制剂的半衰期延长型式(图24),包括但不限于其它细胞外dnase的变体、人凝血因子(例如因子vii、因子viii和因子ix)以及补体因子(例如因子h)。
本文中引用的所有专利和专利公开都以全文引用的方式并入本文中。
野生型人dnase
seqidno:1
dnase1(np_005212.2):信号肽,成熟蛋白质:
mrgmkllgallalaallqgavslkiaafniqtfgetkmsnatlvsyivqilsrydialvqevrdshltavgklldnlnqdapdtyhyvvseplgrnsykerylfvyrpdqvsavdsyyyddgcepcgndtfnrepaivrffsrftevrefaivplhaapgdavaeidalydvyldvqekwgledvmlmgdfnagcsyvrpsqwssirlwtsptfqwlipdsadttatpthcaydrivvagmllrgavvpdsalpfnfqaayglsdqlaqaisdhypvevmlk
seqidno:2
dnase1-like1(np_006721.1):信号肽;成熟蛋白质:
mhyptallflilangaqafricafnaqrltlakvareqvmdtlvrilarcdimvlqevvdssgsaiplllrelnrfdgsgpystlsspqlgrstymetyvyfyrshktqvlssyvyndeddvfarepfvaqfslpsnvlpslvlvplhttpkavekelnalydvflevsqhwqskdvillgdfnadcasltkkrldklelrtepgfhwviadgedttvrasthctydrvvlhgercrsllhtaaafdfptsfqlteeealnisdhypvevelklsqahsvqplsltvllllsllspqlcpaa
seqidno:3
dnase1-like2(np_001365.1):信号肽,成熟蛋白质:
mggprallaalwaleaagtaalrigafniqsfgdskvsdpacgsiiakilagydlalvqevrdpdlsavsalmeqinsvseheysfvssqplgrdqykemylfvyrkdavsvvdtylypdpedvfsrepfvvkfsapgtgerapplpsrraltppplpaaaqnlvliplhaaphqavaeidalydvyldvidkwgtddmlflgdfnadcsyvraqdwaairlrssevfkwlipdsadttvgnsdcaydrivacgarlrrslkpqsatvhdfqeefgldqtqalaisdhfpvevtlkfhr
seqidno:4
dnase1-like3;同工型1(np_004935.1):信号肽,成熟蛋白质:
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssraftnskksvtlrkktkskrs
seqidno:5
dnase1-like3,同工型2(np_001243489.1):信号肽;成熟蛋白质:
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnreklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssraftnskksvtlrkktkskrs
seqidno:6
dnase2a(o00115):信号肽;成熟蛋白质:
miplllaallcvpagaltcygdsgqpvdwfvvyklpalrgsgeaaqrglqykyldessggwrdgralinspegavgrslqplyrsntsqlafllyndqppqpskaqdssmrghtkgvllldhdggfwlvhsvpnfpppassaayswphsactygqtllcvsfpfaqfskmgkqltytypwvynyqlegifaqefpdlenvvkghhvsqepwnssitltsqagavfqsfakfskfgddlysgwlaaalgtnlqvqfwhktvgilpsncsdiwqvlnvnqiafpgpagpsfnstedhskwcvspkgpwtcvgdmnrnqgeeqrgggtlcaqlpalwkafqplvknyqpcngmarkpsrayki
seqidno:7
dnase2b(q8wz79):信号肽;成熟蛋白质:
mkqkmmarllrtsfallflglfgvlgaatiscrneegkavdwftfyklpkrqnkesgetgleylyldsttrswrkseqlmndtksvlgrtlqqlyeayasksnntayliyndgvpkpvnysrkyghtkglllwnrvqgfwlihsipqfppipeegydypptgrrngqsgicitfkynqyeaidsqllvcnpnvyscsipatfhqelihmpqlctrassseipgrllttlqsaqgqkflhfaksdsflddifaawmaqrlkthlltetwqrkrqelpsncslpyhvynikaiklsrhsyfssyqdhakwcisqkgtknrwtcigdlnrsphqafrsggfictqnwqiyqafqglvlyyesck
人dnase1l3变体
seqidno:8
dnase1-like3,q101r(信号肽;成熟蛋白质)
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeryaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssraftnskksvtlrkktkskrs
seqidno:9
dnase1l3,q282_s305delinksk(信号肽;成熟蛋白质):
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklk
seqidno:10
dnase1l3,s305delinsk(信号肽;成熟蛋白质):
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwglenfifmgdfnagcsyvrpsqwknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqaayklteeealdvsdhfpvefklqssraftns
seqidno:11
dnase1l3,k292_s305del(信号肽;成熟蛋白质):
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwglenfifmgdfnagcsyvrpsqwknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqaayklteeealdvsdhfpvefklqssraftnsk
seqidno:12
dnase1l3,s293_s305del(信号肽;成熟蛋白质):
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwglenfifmgdfnagcsyvrpsqwknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqaayklteeealdvsdhfpvefklqssraftnskk
seqidno:13
dnase1l3,c68a(信号肽;成熟蛋白质):
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnriapilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssraftnskksvtlrkktkskrs
seqidno:14
dnase1l3,f275y/f279_k280delinsvm/q282_s305delinsk(信号肽;成熟蛋白质):
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhypvevmlk
seqidno:15
dnase1l3,s283_s305del(信号肽;成熟蛋白质):
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklq
seqidno:16
dnase1l3,r285_s305del(信号肽;成熟蛋白质):
msrelapllllllsihsalamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnreklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqss
白蛋白与dnase1l3和变体的融合物
seqidno:17
白蛋白-dnase1l3变体融合蛋白(白蛋白,dnase1l3变体):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhypvevmlk
seqidno:18
白蛋白-dnase1l3变体融合蛋白。(白蛋白,dnase1l3变体):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglggggsmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhypvevmlk
seqidno:19
白蛋白-dnase1l3变体融合蛋白。(白蛋白,dnase1l3变体):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglggggsggggsggggsmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhypvevmlk
seqidno:20
dnase1l3变体-白蛋白融合蛋白。(白蛋白,dnase1l3变体):
mricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhypvevmlkggggsdahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgl
seqidno:21
dnase1l3变体-白蛋白融合蛋白。(白蛋白,dnase1l3变体):
mricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhypvevmlkggggsggggsggggsdahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgl
seqidno:22
白蛋白-dnase1l3融合蛋白。(白蛋白,dnase1l3):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglggggsggggsggggsmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssraftnskksvtlrkktkskrs
seqidno:23
白蛋白-dnase1l3融合蛋白。(白蛋白,dnase1l3):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglapapapapapapapmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssraftnskksvtlrkktkskrs
seqidno:24
白蛋白-dnase1l3融合蛋白。(白蛋白,dnase1l3):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglaeaaakeaaakamricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssraftnskksvtlrkktkskrs
seqidno:25
白蛋白-dnase1l3变体融合蛋白。(白蛋白,dnase1l3变体):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglsggsgssmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklq
seqidno:26
白蛋白-dnase1l3变体融合蛋白。(白蛋白,dnase1l3变体):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglsggsggsggsggsgssmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklq
seqidno:27
白蛋白-dnase1l3变体融合蛋白。(白蛋白,dnase1l3变体):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglsggsggsggsggsggsggsggsggsggsgssmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklq
seqidno:28
白蛋白-dnase1l3变体-白蛋白融合蛋白。(白蛋白,dnase1l3变体):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglsggsggsggsggsggsggsggsggsggsgssmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnrnsrrgitynyvissrlgrntykeqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssggsggsggsggsggsggsggsggsggsgsdahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglseqidno:29
白蛋白-dnase1l3同工型2融合蛋白。(白蛋白,dnase1l3同工型2):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglsggsggsggsggsggsggsggsggsggsgssmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnreqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklqssraftnskksvtlrkktkskrs
seqidno:30
白蛋白-dnase1l3同工型2变体融合蛋白。(白蛋白,dnase1l3同工型2):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalglsggsggsggsggsggsggsggsggsggsgssmricsfnvrsfgeskqedknamdvivkvikrcdiilvmeikdsnnricpilmeklnreqyaflykeklvsvkrsyhyhdyqdgdadvfsrepfvvwfqsphtavkdfviiplhttpetsvkeidelvevytdvkhrwkaenfifmgdfnagcsyvpkkawknirlrtdprfvwligdqedttvkkstncaydrivlrgqeivssvvpksnsvfdfqkayklteeealdvsdhfpvefklq
接头序列
seqidno:31
ggggs
seqidno:32
ggggsggggsggggs
seqidno:33
apapapapapapap
seqidno:34
aeaaakeaaaka
seqidno:35
sggsgss
seqidno:36
sggsggsggsggsgss
seqidno:37
sggsggsggsggsggsggsggsggsggsgs
seqidno:38
ggsggsggsggsggsggsggsggsggsgs
其它序列
seqidno:39
人血清白蛋白(成熟蛋白质):
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgl
seqidno:40
人因子xi:
miflyqvvhfilftsvsgecvtqllkdtcfeggdittvftpsakycqvvctyhprcllftftaespsedptrwftcvlkdsvtetlprvnrtaaisgysfkqcshqisacnkdiyvdldmkginynssvaksaqecqerctddvhchfftyatrqfpslehrnicllkhtqtgtptritkldkvvsgfslkscalsnlacirdifpntvfadsnidsvmapdafvcgricthhpgclfftffsqewpkesqrnlcllktsesglpstrikkskalsgfslqscrhsipvfchssfyhdtdflgeeldivaaksheacqklctnavrcqfftytpaqascnegkgkcylklssngsptkilhgrggisgytlrlckmdnecttkikprivggtasvrgewpwqvtlhttsptqrhlcggsiignqwiltaahcfygvespkilrvysgilnqseikedtsffgvqeiiihdqykmaesgydiallklettvnytdsqrpiclpskgdrnviytdcwvtgwgyrklrdkiqntlqkakiplvtneecqkryrghkithkmicagyreggkdackgdsggplsckhnevwhlvgitswgegcaqrerpgvytnvveyvdwilektqav
seqidno:41
人前激肽释放酶:
milfkqatyfislfatvscgcltqlyenaffrggdvasmytpnaqycqmrctfhprcllfsflpassindmekrfgcflkdsvtgtlpkvhrtgavsghslkqcghqisachrdiykgvdmrgvnfnvskvssveecqkrctnnircqffsyatqtfhkaeyrnncllkyspggtptaikvlsnvesgfslkpcalseigchmnifqhlafsdvdvarvltpdafvcrtictyhpnclfftfytnvwkiesqrnvcllktsesgtpssstpqentisgyslltckrtlpepchskiypgvdfggeelnvtfvkgvnvcqetctkmircqfftysllpedckeekckcflrlsmdgsptriaygtqgssgyslrlcntgdnsvcttktstrivggtnsswgewpwqvslqvkltaqrhlcggslighqwvltaahcfdglplqdvwriysgilnlsditkdtpfsqikeiiihqnykvsegnhdialiklqaplnytefqkpiclpskgdtstiytncwvtgwgfskekgeiqnilqkvniplvtneecqkryqdykitqrmvcagykeggkdackgdsggplvckhngmwrlvgitswgegcarreqpgvytkvaeymdwilektqssdgkaqmqspa
可活化的接头序列
seqidno:42
fxiia敏感性接头(因子xi肽):
cttkikprivggtasvrgewpwqvt
seqidno:43
fxiia敏感性接头
ggggspriggggs
seqidno:44
fxiia敏感性接头(前激肽释放酶肽):
vcttktstrivggtnsswgewpwqvs
eqidno:45
fxiia敏感性接头(前激肽释放酶肽):
strivgg
信号肽
seqidno:46
α交配因子(p01149):
mrfpsiftavlfaassalaapvntttedetaqipaeavigysdlegdfdvavlpfsnstnngllfinttiasiaakeegvs
seqidno:47
人白蛋白分泌型信号肽+前肽(p02768):
mkwvtfisllflfssaysrgvfrr
seqidno:48
人dnase1l3信号肽(q13609):
msrelapllllllsihsala
- 还没有人留言评论。精彩留言会获得点赞!