半乳糖凝集素的半乳糖苷抑制剂的制作方法
1.本发明涉及新型化合物、所述化合物作为药物的用途以及用于制造治疗哺乳动物炎症;纤维症;疤痕;瘢痕瘤形成;异常瘢痕形成;手术粘连;脓毒性休克;癌症;自身免疫性疾病;代谢紊乱;心脏病;心脏衰竭;病理性血管生成;眼部疾病;动脉粥样硬化症;代谢性疾病;哮喘及其他间质性肺病;和肝病的药物的用途。本发明还涉及包含所述新型化合物的药物组合物。
背景技术:
2.半乳糖凝集素(galectin)是具有特征性糖识别结构域(crd)的蛋白质(leffler et al,2004)。这是一种具有如下两个定义特征的约130个氨基酸(约15kda)紧密折叠的β
‑
夹心结构:1)β
–
半乳糖结合位点和2)约7个氨基酸的序列基序具有足够相似性,其中大部分(大约六个残基)构成β
‑
半乳糖结合位点。但是,与β
‑
半乳糖结合位点相邻的位点是天然糖类紧密结合所必需的,且这些位点的不同偏好使半乳糖凝集素对天然糖类具有不同的精细特异性。
3.最近完成的人类、小鼠和大鼠基因组测序显示,在一个哺乳动物基因组中有约15个半乳糖凝集素和半乳糖
‑
样蛋白,各物种间略有不同(leffler et al.,2004)。
4.半乳糖凝集素亚基在单肽链中可以含有一个或两个crd。第一类(单
‑
crd半乳糖凝集素)在脊椎动物中可以以单体或二聚体(两种类型)出现。迄今为止研究最充分的半乳糖凝集素是二聚半乳糖凝集素
‑
1,和在溶液中为单体,但遇到配体时可以聚集并形成多聚体的半乳糖凝集素
‑
3(leffler et al.,2012)。这些首先发现的半乳糖凝集素,在许多组织中的含量都非常丰富。
5.现在,在pubmed上已有超过5700篇关于半乳糖凝集素的文献,如上所述,其中大部分是关于半乳糖凝集素
‑
1(>1400)和半乳糖凝集素
‑
3(>2800)的。强有力的证据表明,半乳糖凝集素在炎症、癌症和发育等方面发挥作用(blidner et al,2015,ebrahim et al,2014)。
6.半乳糖凝集素在游离核糖体上合成为没有信号肽的胞质蛋白。它们的n
‑
末端被乙酰化(细胞质蛋白的一种典型修饰),并且它们在胞质溶胶中驻留很长一段时间(非典型的分泌蛋白)。从此处,它们可以靶向细胞核、特异性胞质位点(cytososlic site),或者通过目前未知的非经典(非
‑
er
‑
高尔基体(non
‑
er
‑
golgi))途径分泌(诱导型或组成型),但是可能类似于例如il
‑
1的外运(export)(leffler et al.,2015)。他们还可以在所有这些区室中发挥功能;对于半乳糖凝集素
‑
3,在重要杂志中刊登的确凿证据支持其在以下方面的作用:细胞核中的rna剪接、胞质溶胶中抑制细胞凋亡、在破裂的囊泡周围聚集、与纤毛微管组织中心结合以及对细胞信号传导和粘附的多种胞外作用(elola et al.2015,funasaka et al,2014,aits et al,2015,clare et al.,2014)。其他半乳糖凝集素也可能通过促进细胞凋亡、调节某些细胞的细胞周期和分化而在胞质溶胶中发挥作用。大部分半乳糖凝集素也在细胞外通过使糖蛋白(例如层粘连蛋白、整联蛋白和ige受体)交联,可能形成超分子有序
排列(elola et al.,2015)而起作用,并且由此可能调节细胞粘附和诱导细胞内信号。与此相关,最近几年报道了这些半乳糖凝集素功能的分子机制,涉及在膜内形成微区(格子),进而影响细胞内运输和糖蛋白受体的细胞表面呈现(elola et al.,2015)。这一点已经在细胞培养、无效突变小鼠和用半乳糖凝集素或半乳糖凝集素抑制剂处理的动物中得到了证明。(johannes,l;jacob,r.;leffler,h.galectins at a glance.j.cell.sci.2018,131(9),jcs208884.)。
7.半乳糖凝集素
‑
3抑制剂的潜在治疗用途
8.半乳糖凝集素
‑
3与多种现象有关,因此,这些抑制剂可能具有多种用途(blanchard et al.,2014)。很容易将这视为缺乏特异性或缺乏科学焦点。因此,根据阿司匹林和环氧合酶(cox
‑
i和ii)进行类推是有用的。cox产生各种前列腺素的前体,并因此参与多种生物机制。它们的抑制剂,阿司匹林和其他nsaid(非甾体抗炎药),也具有广泛的和多样化的效果。尽管如此,这些抑制剂在医学上非常有用,并且它们在多个方面都具有着不同的具体应用。
9.所以,如果半乳糖凝集素如同cox一样是一些基本的生物调控机制的一部分(目前未知),它们很可能被“自然使用”用于不同情况的不同用途。如同nsaid一样,半乳糖凝集素抑制剂预期不会清除整个系统,但预期会使平衡倾斜一点。
10.抑制炎症
11.在无效突变小鼠中,半乳糖凝集素
‑
3的促炎作用表现为在炎症部位细胞中诱导对免疫细胞的各种影响(例如,在中性粒细胞中的氧化爆发(oxidative burst)和单核细胞中的趋化性(chemotaxis),以及主要在嗜中性粒细胞和巨噬细胞中降低炎症反应(blidner et al,2015,arthur et al.,2015)。重要的是,最近的研究已经确定,半乳糖凝集素
‑
3是巨噬细胞m2分化和肌成纤维细胞活化的关键限速因素,影响纤维化的发展(mackinnon et al.,2008;mackinnon et al,2012,li et al,2014)。
12.炎症是机体对侵入的生物体和组织损伤的保护性反应。然而,如果不平衡,炎症经常也是破坏性的,并且是许多疾病病理的一部分。正因为如此,人们对炎症的药理学调节存在极大的医学兴趣。半乳糖凝集素
‑
3抑制剂预期将为可用于此目的的医药库提供重要补充。
13.纤维化相关疾病的治疗
14.半乳糖凝集素
‑
3在纤维化中可能发挥作用的想法来自于对巨噬细胞分化的细胞研究和体外研究(mackinnon et al.,2008)以及来自于对巨噬细胞分化和肌成纤维细胞活化的体内研究(mackinnon et al.,2012)。简单地说,假设如下:半乳糖凝集素
‑
3已显示出延长了细胞表面停留并由此增加了某些受体(elola et al.,2015),例如tgf
‑
β受体的响应性(mackinnon,2012),其转而调节替代性巨噬细胞向m2巨噬细胞的分化以及肌成纤维细胞的活化。
15.因此,由于半乳糖凝集素
‑
3是tgf
‑
β信号转导和替代性巨噬细胞分化及肌成纤维细胞活化的内源性增强子的良好候选物,因此,半乳糖凝集素
‑
3抑制剂在治疗纤维化和不良组织重塑中可能非常有用。
16.治疗癌症
17.大量的免疫组织化学研究表明,某些半乳糖凝集素在癌症中的表达发生了变化
(thijssen et al,2015;ebrahim et al.,2014),例如半乳糖凝集素
‑
3现在已是公认的甲状腺癌组织化学标志物。半乳糖凝集素
‑
3在癌症中作用的直接证据主要来自小鼠模型。在配对的肿瘤细胞系(半乳糖凝集素
‑
3的表达降低或增加)中,诱导半乳糖凝集素
‑
3引起更多的肿瘤和转移,而抑制半乳糖凝集素
‑
3引起较少的肿瘤和转移。人们已经提出,半乳糖凝集素
‑
3由于抗细胞凋亡而促进肿瘤生长,促进血管生成,或者通过影响细胞粘附而促进转移。此外,最近的证据表明,半乳糖凝集素
‑
3在肿瘤微环境中起着关键作用(ruvolo,2015)。人们认为,半乳糖凝集素
‑
3还调节肿瘤细胞和免疫细胞,如t
‑
淋巴细胞(t
‑
细胞)之间的相互作用,并且已经表明,抑制半乳糖凝集素
‑
3恢复了t
‑
细胞活性(demotte et al.2010,kouo et al.2015,menero et al.2015)。由上可知,显然,半乳糖凝集素
‑
3的抑制剂可能具有宝贵的抗癌效果。实际上,根据报道,声称但未证明抑制半乳糖凝集素
‑
3的糖类具有抗癌症效果。在我们自己的研究中,含有crd的半乳糖凝集素
‑
3片段通过充当显性负性抑制剂而在小鼠模型中抑制了乳腺癌(john et al.,2003)。最近已经证明,在细胞试验和体外试验中使用小分子抑制半乳糖凝集素
‑
3的确极大地增强了肿瘤细胞对辐射和标准促凋亡药物的敏感性(blanchard et al.,2015)。
18.另外,其他半乳糖凝集素也经常在低分化癌细胞中过度表达,或在特定类型的癌细胞中诱导表达(thijssen et al,2015;ebrahim et al.,2014)。半乳糖凝集素
‑
1在活化t
‑
细胞中诱导细胞凋亡,并且在体内对自身免疫性疾病具有显著的免疫抑制作用(blidner et al,2015)。因此,这些半乳糖凝集素在癌症中的过表达可以协助肿瘤本身防御由宿主产生的t
‑
细胞响应。
19.已经建立了半乳糖凝集素
‑
1、
‑
3、
‑
7和
‑
9的无效突变小鼠,在动物饲养条件下它们都很健康且明显正常地繁殖。然而,进一步的研究揭示了在不同类型挑战下的微妙表型,主要是免疫细胞的功能(blidner et al.,2015),也包括其他类型的细胞(viguier et al,2014)。表达的部位、特异性和其他性质的差异使得不同的半乳糖凝集素在功能上不太可能彼此替换。正如在动物饲养条件下可以观察到的,在无效突变小鼠中观察到的情况表明半乳糖凝集素对于基本的生命支持功能不是必需的。相反,它们可能是正常功能的优化剂(optimizer)和/或在动物饲养条件下未出现而在应激条件下是必需的。半乳糖凝集素抑制剂在无效突变体小鼠中不存在强烈的影响,可能使其作为药物更有利。如果按照上文所述,半乳糖凝集素活性促进了病理状况而对正常状况作用较小,那么抑制它们造成的不良副作用也将较小。
20.治疗血管生成
21.通过vegf受体
‑
2(vegfr
‑
2)的血管内皮生长因子(vegf)信号转导是主要的血管生成通路。已有研究表明半乳糖凝集素
‑
1(gal
‑
1)和半乳糖凝集素
‑
3(gal
‑
3)是vegf/vegfr
‑
2信号通路的重要调节因子(croci et al,2014)。公开的研究还表明,预期半乳糖凝集素抑制剂tdx在阻止病理性血管生成方面有效(chen 2012)。
22.已知的抑制剂
23.天然配体
24.固相结合试验和抑制测定已经鉴定出许多具有结合半乳糖凝集素能力的糖类和结合糖(leffler,2001和leffler et al.,2004进行了综述)。所有半乳糖凝集素与乳糖结合的kd为0.5
‑
1mm。d
‑
半乳糖的亲和力相比之下低50
‑
100倍。与n
‑
乙酰乳糖胺及相关二糖的
结合与乳糖大致相同,但是对于某些半乳糖凝集素来说,它们的结合更差,或者更好10倍。半乳糖凝集素
‑
3最好的糖类小配体是携带与乳糖或lacnac
‑
残基连接的血型a
‑
决定子的那些配体,并且发现它们的结合比乳糖好大约50倍。半乳糖凝集素
‑
1没有表现出对这些糖类的偏好性。
25.聚乳糖胺型的较大糖类被认为是半乳糖凝集素的优选配体。在溶液中,使用携带聚乳糖胺的糖肽,已经证明半乳糖凝集素
‑
3的情况是这样,但是半乳糖凝集素
‑
1则非如此(leffler and barondes,1986)。据报道,修饰的植物果胶多糖与半乳糖凝集素
‑
3结合(pienta et al.,1995)。
26.已经识别为半乳糖凝集素
‑
3配体的上述天然糖类并不适合作为药物组合物的活性组分,因为它们在胃中对酸水解和对酶促降解敏感。另外,天然糖类在本质上是亲水性的,在口服后不容易经胃肠道吸收。
27.半乳糖凝集素特异性
28.使用上述天然小分子糖类抑制半乳糖凝集素的特异性研究表明,所有半乳糖凝集素都与乳糖、lacnac和相关二糖结合,但是半乳糖凝集素
‑
3与某些更长糖类的结合更好(leffler and barondes,1986)。这些更长糖类的特征在于具有在半乳糖c
‑
3位增加的其他糖残基(例如乳糖或lacnac中),其与延伸的结合沟结合。各种半乳糖凝集素之间这种沟的形状不同,表明相同的延伸不会与不同半乳糖凝集素相等地结合。
29.合成抑制剂
30.与氨基酸连接、具有抗癌活性的糖类首先在血清中作为天然化合物被识别出来,但后来制备出了合成的类似物(glinsky et al.,1996)。其中,乳糖或半乳糖与氨基酸偶联的那些合成类似物抑制半乳糖凝集素,但其效力仅与对应的未衍生化糖类大致相同。抑制半乳糖凝集素
‑
3的化学修饰形式的柑橘果胶(piatt and raz,1992)在体内显示出抗肿瘤活性(pienta et al.,1995;nangia
‑
makker et al.,2002)。
31.具有多至四个乳糖单元的簇分子与半乳糖凝集素
‑
3时结合时显示出强烈的多价效应(multivalency effect),但与半乳糖凝集素
‑
1和半乳糖凝集素
‑
5结合时则未显示出这种效应(vrasidas et al.,2003)。具有7个半乳糖、乳糖或n
‑
乙酰基乳糖胺残基的环糊精类糖簇分子也显示出对半乳糖凝集素
‑
3强烈的多价效应,但对半乳糖凝集素
‑
1和半乳糖凝集素
‑
7的效应则较弱(andre et al.,2004)。乳糖残基多价的星射状树形聚合物(starburst dendrimers)(andre et al.,1999)和糖聚合物(pohl et al.,1999;david et al.,2004)已经被描述为半乳糖凝集素
‑
3抑制剂,与乳糖相比,其效力略有提高。已经被确定为半乳糖凝集素
‑
3配体的前述合成化合物不适合作为药物组合物的活性组分,因为它们本质上都是亲水性的,口服后不容易从胃肠道中吸收。
32.上述天然寡糖、糖簇分子、糖树状聚合物和糖聚合物太大且极性过高以致于不能被吸收,并且在一些情况下大到足以在患者中产生免疫应答。另外,它们对胃内的酸水解和酶促水解敏感。因此,需要小的合成分子。
33.已知硫代二半乳糖苷是合成的且水解稳定的极性抑制剂,与n
‑
乙酰基乳糖胺几乎一样有效(leffler and barondes,1986)。已经证明,在c
‑
3'携带有芳香酰胺或取代苄基醚的n
‑
乙酰基乳糖胺衍生物是半乳糖凝集素
‑
3的高效抑制剂,其ic50值前所未有地低至4.8μm,与天然n
‑
乙酰基乳糖胺二糖相比,改进了20倍(et al.,2002;et al.,
2003b)。由于存在芳香酰胺基单元,这些衍生物的极性整体上更弱,并由此更加适合作为体内抑制半乳糖凝集素的试剂。另外,已经证明,c3
‑
三唑基半乳糖苷是与一些半乳糖凝集素的相应c3
‑
酰胺一样有效的抑制剂。因此,任何适当构造的半乳糖c3
‑
取代基可以赋予增强的半乳糖凝集素亲和力。
34.然而,由于在半乳糖和n
‑
乙酰基乳糖胺的糖基单元中存在糖苷键,c3
‑
酰胺基
‑
衍生化合物和c3
‑
三唑基
‑
衍生化合物仍然对体内水解降解敏感,并且,虽然它们是半乳糖凝集素
‑
3有效的小分子抑制剂,但是仍需要进一步提高其亲和力和稳定性。因此,已经开发出基于硫代二半乳糖苷的3,3'
‑
二酰胺基或3,3'
‑
二三唑基衍生化抑制剂,(cumpstey etal.,2005b;cumpstey etal,2008;salameh etal,2010;wo/2005/113569和us2007185041;wo/2005/113568;us7,638,623b2;t.delaine,2016,chembiochem 10.1002/cbic.201600285)其不存在水解和酶促不稳定的o
‑
糖苷键。这些抑制剂对于多种半乳糖凝集素也表现出优异的亲和力(kd降至较低nm范围)。然而,虽然对半乳糖凝集素表现出较高亲和力,但是3,3'
‑
衍生硫代二半乳糖苷(3,3'
‑
derivatized thiodigalactoside)在其涉及双重转化(double inversion)反应以得到3
‑
n
‑
衍生半乳糖(3
‑
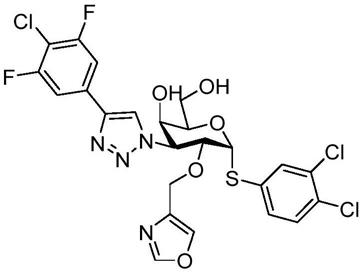
n
‑
derivatized galactose)结构单元的多步骤合成中存在一些缺点。另外,已经证明,环己烷取代硫代二半乳糖苷中的一个半乳糖环模仿半乳糖环,从而提供效率接近双酰胺基
‑
和双三唑基
‑
硫代二半乳糖苷衍生物的半乳糖凝集素
‑
1和
‑
3抑制剂(wo/2010/126435)。用取代环己烷置换d
‑
吡喃半乳糖单元降低了极性,并极有可能还降低了代谢易感性,从而改善药物性质。
35.一些早先描述的化合物具有下述通式:
[0036][0037]
如wo/2005/113568中所述,和
[0038][0039]
如wo/2005/113569所述,其中r
i
可以是d
‑
半乳糖。
[0040]
在最近公开的us20140099319、wo2014067986和(t.delaine,2016,chembiochem10.1002/cbic.201600285)中公开了下述通式化合物:
[0041][0042]
在两个苯环相对于三唑环的间位上都含有氟(f)。已经表明,这种化合物是颇有前
烷氧基和至少一种卤素取代的c1‑6烷氧基组成的组中的至少一种取代);氨基;以及取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);v)c1‑6烷氨基;vi)取代c1‑6烷氨基,被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代;vii)杂芳基;viii)取代杂芳基,被由以下组成的组中的至少一种取代:卤素;cn;c2‑6烯基;c2‑6炔基;羧基;c1‑6烷氧基;c1‑6硫代烷基;氨基;取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基;取代芳基,被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、取代c1‑6烷氧基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c1‑6烷基、取代c1‑6烷基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);杂芳基;取代杂芳基,被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、取代c1‑6烷氧基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c1‑6烷基、取代c1‑6烷基(被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c3‑7环烷基、取代c3‑7环烷基(被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c3‑7环烷氧基和取代c3‑7环烷氧基(被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);c1‑6羰基;取代c1‑6羰基,被由以下组成的组中的至少一种取代:卤素、c1‑6烷氧基、c1‑6烷基、取代c1‑6烷基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代));ix)杂环;x)取代杂环,被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、取代c1‑6烷氧基(被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c1‑6烷基、取代c1‑6烷基(被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至
少一种取代)、c3‑7环烷基、取代c3‑7环烷基(被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c3‑7环烷氧基和取代c3‑7环烷氧基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);c1‑6羰基;取代c1‑6羰基,被由以下组成的组中的至少一种取代:卤素、c1‑6烷氧基、c1‑6烷基、取代c1‑6烷基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);xi)c1‑6烷基;xii)取代c1‑6烷基,被由以下组成的组中的至少一种取代:卤素;c1‑6烷氧基;c1‑6烷基;c3‑7环烷基;硝基;硫基;c1‑6烷硫基;氨基;羟基和c1‑6羰基;xiii)c1‑6羰基;xiv)取代c1‑6羰基,被由以下组成的组中的至少一种取代:c1‑6烷基;c2‑6烯基;芳基;杂芳基;和杂环;xv)c1‑6烷基
‑
conh
‑
;xvi)取代c1‑6烷基
‑
conh
‑
,其中一个或多个烷基碳原子被由以下组成的组中的至少一种取代:杂芳基;取代杂芳基,被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、取代c1‑6烷氧基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);c1‑6烷基、取代c1‑6烷基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基;以及取代芳基,被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、取代c1‑6烷氧基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c1‑6烷基、取代c1‑6烷基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);
[0051]
x1选自由o、s、so、so2、c=o、氨基、c1‑6烷基取代氨基和cr’r”组成的组,其中r’和r”独立地选自氢、oh或卤素;
[0052]
b1选自由以下组成的组:a)c1‑6烷基;b)取代c1‑6烷基,被由以下组成的组中的至少一种取代:五元或六元杂芳环;取代五元或六元杂芳环,被由以下组成的组中的至少一种取代:氰基、卤素、c1‑6烷基、取代c1‑6烷基(被由卤素、羟基和c1‑6烷基组成的组中的至少一种取代)、c1‑6烷氧基、取代c1‑6烷氧基(被由卤素、羟基和c1‑6烷基组成的组中的至少一种取代)、羟基和r
#
‑
conh
‑
,其中r
#
选自由c1‑6烷基和c1‑6环烷基组成的组;芳基;取代芳基,被由以下组成的组中的至少一种取代:氰基、卤素、c1‑6烷基、取代c1‑6烷基(被由卤素、羟基和c1‑6烷基组成的组中的至少一种取代)、c1‑6烷氧基、取代c1‑6烷氧基(被由卤素、羟基和c1‑6烷基组成的组中的至少一种取代)、羟基和r
¤
‑
conh
‑
,其中r
¤
选自由c1‑6烷基和c1‑6环烷基组成的组);c)芳基;d)取代芳基,被由以下组成的组中的至少一种取代:卤素;氰基;羟基;羧基;羧酰胺基;取代羧酰胺基,被由c1‑6烷基和c3‑6环烷基组成的组中的至少一种取代);c1‑6烷基;取代c1‑6烷基,被由卤素、羟基和r
&
‑
conh
‑
组成的组中的至少一种取代,其中r
&
选自由c1‑6烷基和
c1‑6环烷基组成的组);c1‑6环烷基;取代c1‑6环烷基,被由卤素、羟基和r
%
‑
conh
‑
组成的组中的至少一种取代,其中r
%
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6烷氧基;取代c1‑6烷氧基,被由卤素、羟基和r
§
‑
conh
‑
组成的组中的至少一种取代,其中r
§
选自由c1‑6烷基和c1‑6环烷基组成的组);c3‑6环烷氧基;取代c3‑6环烷氧基,被由卤素、羟基和r
*
‑
conh
‑
组成的组中的至少一种取代,其中r
*
选自由c1‑6烷基和c1‑6环烷基组成的组);氨基;取代氨基,被由c1‑6烷基和c1‑6环烷基组成的组中的至少一种取代);以及r
**
‑
conh
‑
,其中r
**
选自由c1‑6烷基和c1‑6环烷基组成的组;e)c4‑
10
环烷基;f)取代c4‑
10
环烷基,被由以下组成的组中的至少一种取代:氰基、卤素、c1‑6烷基、取代c1‑6烷基(被由卤素、羟基和c1‑6烷基组成的组中的至少一种取代)、c1‑6烷氧基、取代c1‑6烷氧基(被由卤素、羟基和c1‑6烷基组成的组中的至少一种取代)、羟基和r
##
‑
conh
‑
,其中r
##
选自由c1‑6烷基和c1‑6环烷基组成的组);以及g)取代杂环,被由以下组成的组中的至少一种取代:卤素;氰基;羟基;羧基;羧酰胺基;取代羧酰胺基(被由c1‑6烷基和c3‑6环烷基组成的组中的至少一种取代);c1‑6烷基;取代c1‑6烷基(被由卤素、羟基和r
&&
‑
conh
‑
组成的组中的至少一种取代,其中r
&&
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6环烷基;取代c1‑6环烷基(被由卤素、羟基和r
%%
‑
conh
‑
组成的组中的至少一种取代,其中r
%%
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6烷氧基;取代c1‑6烷氧基(被由卤素、羟基和r
§§
‑
conh
‑
组成的组中的至少一种取代,其中r
§§
选自由c1‑6烷基和c1‑6环烷基组成的组);c3‑6环烷氧基;取代c3‑6环烷氧基(被由卤素、羟基和r
a
‑
conh
‑
组成的组中的至少一种取代,其中r
a
选自由c1‑6烷基和c1‑6环烷基组成的组);氨基;取代氨基(被由c1‑6烷基和c1‑6环烷基组成的组中的至少一种取代);r
aa
‑
conh
‑
,其中r
aa
选自由c1‑6烷基和c1‑6环烷基组成的组;取代杂芳,被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基;取代芳基,被由以下组成的组中的至少一种取代:卤素、氰基、c1‑6烷氧基、取代c1‑6烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、c1‑6烷基、取代c1‑6烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);杂芳基;取代杂芳基,被由以下组成的组中的至少一种取代:卤素、氰基、c1‑6烷氧基、取代c1‑6烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、c1‑6烷基、取代c1‑6烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c3‑7环烷基、取代c3‑7环烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、c3‑7环烷氧基、取代c3‑7环烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟
基和c1‑6羰基组成的组中的至少一种取代));c1‑6羰基;以及取代c1‑6羰基,被由以下组成的组中的至少一种取代:卤素、c1‑6烷氧基、c1‑6烷基、取代c1‑6烷基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);
[0053]
r1是具有一对或两对孤对电子(lone pairs)或酸性质子或者两者都具有的酸性电子等排体(acid isostere);或其药学上可接受的盐或溶剂化物。
[0054]
在本发明的另一个实施例中,所述化合物选自式ii化合物
[0055][0056]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,其中a2选自
[0057][0058]
其中het
1a
选自五元或六元杂芳环,任选地被以下基团取代:br;f;cl;cn;nr
19a
r
20a
,其中r
19a
和r
20a
独立地选自h、c1‑3烷基、环丙基、异丙基、
‑
c(=o)
‑
r
21a
,其中r
21a
选自h和c1‑3烷基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);及oc1‑3烷基(任选被f取代);
[0059]
其中r
1a
‑
r
5a
独立地选自h、cn、nh2、cl、f、甲基(任选被f取代)和och3(任选被f取代);
[0060]
其中r
6a
选自c1‑6烷基,任选被卤素、支链c3‑6烷基和c3‑7环烷基取代;
[0061]
其中r
7a
选自五元或六元杂芳环及苯基,其中五元或六元杂芳环任选被br、f、cl、甲基(任选被f取代)和och3(任选被f取代)取代,苯基任选被br、f、cl、甲基(任选被f取代)和och3(任选f取代)取代;
[0062]
其中r
8a
‑
r
12a
独立地选自h、f、甲基(任选被f取代)和och3(任选被f取代);
[0063]
其中r
13a
是五元或六元杂芳环或芳基,其中五元或六元杂芳环任选被选自以下基团取代:h、oh、f、甲基(任选被f取代)和och3(任选被f取代);芳基,例如苯基或萘基,任选被
选自以下基团取代:h、oh、f、甲基(任选被f取代)和och3(任选被f取代);
[0064]
x1选自s、so、so2、o、c=o和cr
32a
r
33a
,其中r
32a
和r
33a
独立地选自氢、oh或卤素;
[0065]
其中r
27a
选自c1‑6烷基、支链c3‑6烷基、c1‑6烷氧基和支链c3‑6烷氧基;
[0066]
b2选自a)五元或六元杂芳环取代的c1‑6烷基或支链c3‑6烷基,五元或六元杂芳环任选被选自cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
14a
‑
conh
‑
(其中r
14a
选自c1‑3烷基和环丙基)的取代基取代;或苯基取代的c1‑6烷基,苯基任选被以下基团取代:cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
15a
‑
conh
‑
(其中r
15a
选自c1‑3烷基和环丙基);b)芳基,如苯基或萘基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
22a
r
23a
,其中r
22a
和r
23a
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
28a
r
29a
(其中r
28a
和r
29a
独立地选自h、c1‑3烷基和异丙基);oh;和r
16a
‑
conh
‑
,其中r
16a
选自c1‑3烷基和环丙基;c)c5‑7环烷基,任选被以下基团取代:卤素、cn、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
17a
‑
conh
‑
(其中r
17a
选自c1‑3烷基和环丙基);及d)杂环,如杂芳基或杂环烷基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
24a
r
25a
,其中r
24a
和r
25a
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
30a
r
31a
,其中r
30a
和r
31a
独立地选自h、c1‑3烷基和异丙基;oh;和r
18a
‑
conh
‑
,其中r
18a
选自c1‑3烷基和环丙基;e)c1‑6烷基或支链c3‑6烷基;
[0067]
r1是具有一对或两对孤对电子或酸性质子或者两者都具有的酸性电子等排体;或其药学上可接受的盐或溶剂化物。
[0068]
在本发明的另一个实施例中,所述化合物选自式ii化合物
[0069][0070]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,
[0071]
a2是
[0072][0073]
其中het
1c
选自由式2至式9组成的组中的五元或六元杂芳环:
[0074][0075]
其中r
2c
至r
23c
和r
27c
独立地选自h;卤素;oh;cn;sh;s
‑
c1‑3烷基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);oc1‑3烷基(任选被f取代);nr
24c
r
25c
,其中r
24c
选自h和c1‑3烷基,r
25c
选自h、c1‑3烷基和cor
26c
,其中r
26c
选自h和c1‑3烷基;
[0076]
x1选自s、so、so2;
[0077]
b2选自a)五元或六元杂芳环取代的c1‑6烷基或支链c3‑6烷基,五元或六元杂芳环任选被选自cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
27#
‑
conh
‑
(其中r
27#
选自c1‑3烷基和环丙基)的取代基取代;或苯基取代的c1‑6烷基,苯基任选被以下基团取代:cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
28c
‑
conh
‑
,其中r
28c
选自c1‑3烷基和环丙基;b)芳基,如苯基或萘基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
29c
r
30c
,其中r
29c
和r
30c
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基,任选被f取代;环丙基,任选被f取代;异丙基,任选被f取代;oc1‑3烷基,任选被f取代;o
‑
环丙基,任选被f取代;o
‑
异丙基,任选被f取代;nr
31c
r
32c
,其中r
31c
和r
32c
独立地选自h、c1‑3烷基和异丙基;oh;和r
33c
‑
conh
‑
,其中r
33c
选自c1‑3烷基和环丙基;c)c5‑7环烷基,任选
被以下基团取代:卤素、cn、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
34c
‑
conh
‑
,其中r
34c
选自c1‑3烷基和环丙基;以及d)杂环,如杂芳基或杂环烷基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
35c
r
36c
,其中r
35c
和r
36c
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基,任选被f取代;环丙基,任选被f取代;异丙基,任选被f取代;oc1‑3烷基,任选被f取代,;o
‑
环丙基,任选被f取代;o
‑
异丙基,任选被f取代;nr
37c
r
38c
,其中r
37c
和r
38c
独立地选自h、c1‑3烷基和异丙基;oh;和r
39c
‑
conh
‑
,其中r
39c
选自c1‑3烷基和环丙基;e)c1‑6烷基或支链c3‑6烷基;
[0078]
r1是具有一对或两对孤对电子或酸性质子或者两者都具有的酸性电子等排体;或其药学上可接受的盐或溶剂化物。
[0079]
在本发明的另一个实施例中,所述化合物选自式ii化合物
[0080][0081]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,
[0082]
a2是
[0083][0084]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,het
1d
选自由以下组成的组:
[0085][0086]
其中r
2d
选自由oh和卤素组成的组;
[0087]
r
3d
选自由氢、c1‑6烷基和卤素组成的组;
[0088]
r
4d
选自由oh和卤素组成的组;
[0089]
r
5d
选自由氢、c1‑6烷基和卤素组成的组;
[0090]
x1是s;
[0091]
b2选自a)芳基,如苯基或萘基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
29d
r
30d
,其中r
29d
和r
30d
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基,任选被f取代;环丙基,任选被f取代;异丙基,任选被f取代;oc1‑3烷基,任选被f取代;sc1‑3烷基,任选被f取代;o
‑
环丙基,任选被f取代;o
‑
异丙基,任选被f取代;nr
31d
r
32d
,其中r
31d
和r
32d
独立地选自h、c1‑3烷基和异丙基;oh;和r
33d
‑
conh
‑
,其中r
33d
选自c1‑3烷基和环丙基;b)杂环,如杂芳基或杂
环烷基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
35d
r
36d
,其中r
35d
和r
36d
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基,任选被f取代;环丙基,任选被f取代;异丙基,任选被f取代;oc1‑3烷基,任选被f取代;o
‑
环丙基,任选被f取代;sc1‑3烷基,任选被f取代;o
‑
异丙基,任选被f取代;nr
37d
r
38d
,其中r
37d
和r
38d
独立地选自h、c1‑3烷基和异丙基;oh;和r
39d
‑
conh
‑
,其中r
39d
选自c1‑3烷基和环丙基;
[0092]
r1是具有一对或两对孤对电子或酸性质子或者两者都具有的酸性电子等排体;或其药学上可接受的盐或溶剂化物。
[0093]
在本发明的另一个实施例中,所述化合物选自式ii化合物
[0094][0095]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,
[0096]
a2选自
[0097][0098]
其中het
1b
选自吡啶基,任选被以下基团取代:h、cn、br、cl、i、f、甲基(任选被f取代)、och3(任选被f取代)和sch3(任选被f取代);或嘧啶基,任选被以下基团取代:h、cn、br、cl、i、f、甲基(任选被f取代)、och3(任选被f取代)和sch3(任选被f取代);
[0099]
其中r
1b
‑
r
5b
独立地选自由h、cn、br、cl、i、f、甲基(任选被f取代)、och3(任选被f取代)和sch3(任选被f取代)组成的组;
[0100]
x1选自s、so、so2;
[0101]
b2选自a)五元或六元杂芳环取代的c1‑6烷基或支链c3‑6烷基,五元或六元杂芳环任选被以下基团取代:cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
14b
‑
conh
‑
(其中r
14b
选自c1‑3烷基和环丙基);或苯基取代的c1‑6烷基,苯基任选被以下基团取代:cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
15b
‑
conh
‑
,其中r
15b
选自c1‑3烷基和环丙基;b)芳基,如苯基或萘基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
22b
r
23b
,其中r
22b
和r
23b
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基,任选被f取代;环丙基,任选被f取代;异丙基,任选被f取代;oc1‑3烷基,任选被f取代;o
‑
环丙基,任选被f取代;o
‑
异丙基,任选被f取代;nr
28b
r
29b
,其中r
28b
和r
29b
独立地选自h、c1‑3烷基和异丙基;oh;和r
16b
‑
conh
‑
,其中r
16b
选自c1‑3烷基和环丙基;c)c5‑7环烷基,任选被以下基团取代:卤素、cn、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
17b
‑
conh
‑
,其中r
17b
选自c1‑3烷基和环丙基;及d)杂环,如杂芳基或杂环烷基,任选被以
下基团取代:卤素;cn;
‑
cooh;
‑
conr
24b
r
25b
,其中r
24b
和r
25b
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
30b
r
31b
,其中r
30b
和r
31b
独立地选自h、c1‑3烷基和异丙基;oh;和r
18b
‑
conh
‑
,其中r
18b
选自c1‑3烷基和环丙基;e)c1‑6烷基或支链c3‑6烷基;
[0102]
r1是具有一对或两对孤对电子或酸性质子或者两者都具有的酸性电子等排体;或其药学上可接受的盐或溶剂化物。在上述式ii化合物的具体实施例中,a2是
[0103][0104]
其中r
1b
‑
r
5b
独立地选自由以下组成的组:h、cn、br、cl、i、f、甲基(任选被f取代)、och3(任选被f取代)和sch3(任选被f取代);
[0105]
x1是s;
[0106]
b2选自b)苯基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
22b
r
23b
,其中r
22b
和r
23b
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基,任选被f取代;环丙基,任选被f取代;异丙基,任选被f取代;oc1‑3烷基,任选被f取代;o
‑
环丙基,任选被f取代;o
‑
异丙基,任选被f取代;nr
28b
r
29b
,其中r
28b
和r
29b
独立地选自h、c1‑3烷基和异丙基;oh;和r
16b
‑
conh
‑
,其中r
16b
选自c1‑3烷基和环丙基;d)杂芳基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
24b
r
25b
,其中r
24b
和r
25b
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基,任选被f取代;环丙基,任选被f取代;异丙基,任选被f取代;oc1‑3烷基,任选被f取代;o
‑
环丙基,任选被f取代;o
‑
异丙基,任选被f取代;nr
30b
r
31b
,其中r
30b
和r
31b
独立地选自h、c1‑3烷基和异丙基;oh;和r
18b
‑
conh
‑
,其中r
18b
选自c1‑3烷基和环丙基;
[0107]
r1是具有一对或两对孤对电子或酸性质子或者两者都具有的酸性电子等排体;或其药学上可接受的盐或溶剂化物。在上述式ii化合物的更优选实施例中,a2是
[0108][0109]
其中r
1b
‑
r
5b
独立地选自由h、cl和f组成的组;
[0110]
x1是s;
[0111]
b2选自b)被卤素取代的苯基;及d)被卤素取代的杂芳基;
[0112]
r1是具有一对或两对孤对电子或酸性质子或者两者都具有的酸性电子等排体;或
其药学上可接受的盐或溶剂化物。在上述式ii化合物的最优选实施例中,a2是
[0113][0114]
其中r
1b
和r
5b
是氢,r
2b
‑
r
4b
中至少一个独立地选自cl和f,其余是氢;
[0115]
x1是s;
[0116]
b2选自b)被cl取代的苯基;及d)被br取代的吡啶基;
[0117]
r1是具有一对或两对孤对电子或酸性质子或者两者都具有的酸性电子等排体;或其药学上可接受的盐或溶剂化物。
[0118]
在本发明的式i或式ii化合物的另一个实施例中,r1选自:a)磷酸酯;b)硫酸酯;c)取代c1‑6烷基,被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑6烷基和甲基磺酰基;杂环,如杂芳基或杂环烷基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);
‑
so2‑
nhr3,其中r3选自杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代),及
‑
co
‑
r4,其中r4选自氢和杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);d)支链c3‑6烷基,被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑6烷基和甲基磺酰基;杂环,如杂芳基或杂环烷基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);
‑
so2‑
nhr3,其中r3选自杂环,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代),及
‑
co
‑
r4,其中r4选自氢和杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、
c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)。a)至d)基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0119]
在本发明式i或式ii化合物的另一个实施例中,r1选自由以下组成的组:a)磷酸酯,b)硫酸酯,c)取代c1‑3烷基,被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑3烷基和甲基磺酰基;杂芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);
‑
so2‑
nhr3,其中r3选自杂环,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代),及
‑
co
‑
r4,其中r4选自氢和杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);d)支链c3‑6烷基,被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑3烷基和甲基磺酰基;杂芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);
‑
so2‑
nhr3,其中r3选自杂环,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代),及
‑
co
‑
r4,其中r4选自氢和杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代)。a至d)基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0120]
在本发明式i或式ii化合物的另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及取代甲基(被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、甲基和甲基磺酰基;恶唑基;四唑基;被由卤素和羟基组成的组中的至少一种取代的苯基。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题,例如,在一个实施例中,r1选自恶唑基;四唑基;被由卤素和羟基组成的组中的至少一种取代的苯基。在另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及取代甲基(被选自磷酸酯、氧磷酰基的基团取代)。在另一个实施例中,r1选自
‑
cooh、
‑
conhr2,其中r2选自氢、甲基和甲基磺酰基。
[0121]
在本发明式i或式ii化合物的另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及取代甲基(被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2是甲基磺酰基;恶唑基;四唑基;被由卤素和羟基组成的组中的至少一种取代的苯基)。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0122]
在本发明的另一个实施例中,所述化合物选自由以下组成的组:
[0123]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0124]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0125]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磺基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0126]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磺基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0127]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(磷酰氧基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0128]
3,4
‑
二氯苯基2
‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0129]
3,4
‑
二氯苯基2
‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0130]5‑
溴吡啶
‑3‑
基2
‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0131]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[2
‑
(甲基磺酰胺基)
‑2‑
氧乙基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0132]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
(恶唑
‑4‑
基甲基)
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0133]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
(3,5
‑
二氟
‑4‑
羟基苄基)
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0134]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0135]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0136]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0137]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
咪唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0138]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1
‑
甲基
‑
1h
‑
咪唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0139]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(恶唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0140]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(恶唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0141]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(异恶唑
‑3‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0142]
3,4
‑
二氯苯基3
‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
[(恶唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0143]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0144]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0145]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0146]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0147]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(
‑
1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0148]5‑
嗅吡啶
‑3‑
基2
‑
o
‑
羧丙基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0149]5‑
嗅吡啶
‑3‑
基2
‑
o
‑
(1
‑
羧基)乙基)
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(非对映异构体1),及
[0150]5‑
嗅吡啶
‑3‑
基2
‑
o
‑
(1
‑
羧基)乙基)
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(非对映异构体2);或其药学上可接受的盐或溶剂化物。
[0151]
另一方面,本发明涉及本发明式i或式ii化合物作为药物的用途。
[0152]
另一方面,本发明涉及包含本发明式i或式ii化合物及任选药学上可接受的添加剂,如载体和/或赋形剂的药物组合物。
[0153]
另一方面,本发明涉及本发明式i或式ii化合物在哺乳动物(如人类)中治疗与半乳糖凝集素
‑
3(galectin
‑
3)和配体的结合相关的病症的用途。在本发明的另一个实施例中,疾病选自由以下组成的组:炎症;纤维症(如肺纤维化、肝纤维化、肾纤维化、眼睛纤维化及皮肤和心脏纤维化);疤痕;瘢痕瘤形成;异常瘢痕形成;手术粘连;脓毒性休克;癌症(如
癌、恶性肿瘤、白血病和淋巴瘤,如t
‑
细胞淋巴瘤);转移癌;自身免疫性疾病(如牛皮癣、类风湿性关节炎、克罗恩氏病、溃疡性结肠炎、强直性脊柱炎、全身性红斑狼疮);代谢紊乱;心脏病;心脏衰竭;病理性血管生成(如眼部血管生成或与眼部血管生成相关的疾病或症状,如与癌症相关的新血管生成);及眼部疾病,如年龄相关性黄斑变性和角膜新生血管形成;动脉粥样硬化症;代谢性疾病(如糖尿病);2型糖尿病;胰岛素抵抗;肥胖;舒张性心脏衰竭;哮喘及其它间质性肺病(包括赫曼斯基
‑
普德拉克综合征、间皮瘤);及肝病(如非酒精性脂肪性肝炎)。
[0154]
另一方面,本发明涉及一种治疗哺乳动物(如人类)中与半乳糖凝集素
‑
3和配体结合有关的疾病的方法,其中向需要所述治疗的哺乳动物施用治疗有效剂量的本发明式i或式ii化合物中的至少一种化合物。在本发明的另一个实施例中,疾病选自由以下组成的组:炎症;纤维症(如肺纤维化、肝纤维化、肾纤维化、眼睛纤维化及皮肤和心脏纤维化);疤痕;瘢痕瘤形成;异常瘢痕形成;手术粘连;脓毒性休克;癌症(如癌、恶性肿瘤、白血病和淋巴瘤,如t
‑
细胞淋巴瘤);转移癌;自身免疫性疾病(如牛皮癣、类风湿性关节炎、克罗恩氏病、溃疡性结肠炎、强直性脊柱炎、全身性红斑狼疮);代谢紊乱;心脏病;心脏衰竭;病理性血管生成(如眼部血管生成或与眼部血管生成相关的疾病或症状,如与癌症相关的新血管生成);及眼部疾病,如年龄相关性黄斑变性和角膜新生血管形成;动脉粥样硬化症;代谢性疾病(如糖尿病);2型糖尿病;胰岛素抵抗;肥胖;舒张性心脏衰竭;哮喘及其它间质性肺病(包括赫曼斯基
‑
普德拉克综合征、间皮瘤);及肝病(如非酒精性脂肪性肝炎)。
[0155]
本发明的另一方面涉及将本发明式i或式ii化合物及与本发明化合物不同的治疗活性化合物(与“不同的治疗活性化合物”互换使用)一起施用的组合疗法。在一个实施例中,本发明涉及本发明式i或式ii化合物与不同的治疗活性化合物组合用于治疗哺乳动物半乳糖凝集素
‑
3和配体结合有关的疾病的用途。这些疾病披露如下。
[0156]
在本发明的一个实施例中,将治疗有效剂量的本发明式i或式ii化合物中的至少一种化合物与不同的治疗活性化合物一起向需要的哺乳动物施用。在另一个实施例中,所述化合物与不同治疗活性化合物的组合用于患以下疾病的哺乳动物:炎症;纤维症(如肺纤维化、肝纤维化、肾纤维化、眼睛纤维化及皮肤和心脏纤维化);疤痕;瘢痕瘤形成;异常瘢痕形成;手术粘连;脓毒性休克;癌症(如癌、恶性肿瘤、白血病和淋巴瘤,如t
‑
细胞淋巴瘤、转移癌);自身免疫性疾病(如牛皮癣、类风湿性关节炎、克罗恩氏病、溃疡性结肠炎、强直性脊柱炎、全身性红斑狼疮);代谢紊乱;心脏病;心脏衰竭;病理性血管生成(如眼部血管生成或与眼部血管生成相关的疾病或症状,如与癌症相关的新血管生成);及眼部疾病,如年龄相关性黄斑变性和角膜新生血管形成;动脉粥样硬化症;代谢性疾病(如糖尿病);2型糖尿病;胰岛素抵抗;肥胖;舒张性心脏衰竭(hf);哮喘及其它间质性肺病(包括赫曼斯基
‑
普德拉克综合征、间皮瘤);肝病(如非酒精性脂肪性肝炎)。
[0157]
通过施用本发明式i或式ii化合物与不同的治疗活性化合物组合可以治疗、管理与/或预防的非限制性癌症实例包括:结肠癌、乳腺癌、胰腺癌、卵巢癌、前列腺癌、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨原性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴肉瘤、淋巴管内皮瘤、滑膜瘤、间皮瘤、尤因氏肉瘤、平滑肌肉瘤、横纹肌肉瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺瘤、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯瘤、宫颈癌、睾丸肿瘤、肺癌、小细
胞肺癌、膀胱癌、上皮癌、成胶质细胞瘤、神经鞘瘤、颅咽管瘤、许旺氏细胞瘤、胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、脑膜瘤、黑色素瘤、成神经细胞瘤、成视网膜细胞瘤、白血病和淋巴瘤、急性淋巴细胞白血病、急性髓细胞真性红细胞增多、多发性骨髓瘤、华氏巨球蛋白血症、重链病、急性非淋巴细胞白血病、慢性淋巴细胞白血病、慢性髓细胞性白血病、何杰金氏病、非何杰金淋巴瘤、直肠癌、肾盂癌、子宫癌、口腔癌、皮肤癌、胃癌、脑瘤、肝癌、喉癌、食管癌、乳腺肿瘤、儿童非急性淋巴性白血病(acute lymphoid leukemia,all)、胸腺all、b细胞all、急性髓性白血病、髓单核细胞白血病、急性巨核细胞白血病、伯基特淋巴瘤、急性髓性白血病、慢性髓性白血病、t细胞白血病、小和大非小细胞肺癌、急性粒细胞性白血病、生殖细胞瘤、子宫内膜癌、胃癌、头颈癌、慢性淋巴细胞白血病、毛细胞白血病和甲状腺癌。
[0158]
在本发明的一些方面,施用至少一种本发明式i或式ii化合物中的至少一种化合物和至少一种其它治疗剂证明具有治疗协同效果。在本发明方法的一些方面,与单独施用本发明式i或式ii化合物中的至少一种化合物或至少一种其它治疗剂相比,施用本发明式i或式ii化合物中的至少一种化合物和至少一种其它治疗剂后观察到的治疗效果指标得到改善。
[0159]
本发明的另一方面涉及将本发明式i或式ii化合物以及与本发明式i或式ii化合物不同的抗纤维化合物一起施用的组合疗法。在另一个实施例中,所述抗纤维化化合物选自下述非限制性抗纤维化化合物:吡非尼酮、尼达尼布、辛妥珠单抗(gs
‑
6624,ab0024)、bg00011(stx100)、prm
‑
151、prm
‑
167、peg
‑
fgf21、bms
‑
986020、fg
‑
3019、mn
‑
001、iw001、sar156597、gsk2126458和pbi
‑
4050。
[0160]
本发明的另一个方面涉及向有需要的哺乳动物施用本发明的式i或式ii化合物及与其它常规癌症治疗联合的组合疗法,常规癌症治疗方法例如为化学疗法或放射疗法,或免疫刺激性物质治疗、基因疗法、抗体治疗以及树突状细胞治疗。
[0161]
在一个实施例中,本发明的化合物与选自抗肿瘤化疗剂的至少一种其它治疗剂联合施用。在另一个实施例中,所述抗肿瘤化疗剂选自:全反式维甲酸、辅酶b12(actimide)、阿扎胞苷、硫唑嘌呤、博来霉素、卡铂、卡培他滨、顺铂、瘤可宁、环磷酰胺、阿糖孢苷、道诺霉素、多烯紫杉醇、去氧氟尿苷、阿霉素、表阿霉素、依托泊苷、氟达拉滨、氟尿嘧啶、吉西他滨、羟基脲、伊达比星、伊立替康、来那度胺、亚叶酸、氮芥、马法兰、巯嘌呤、甲氨蝶呤、米托蒽醌、奥沙利铂、紫杉醇、培美曲塞、雷利度胺、替莫唑胺、替尼泊苷、硫鸟嘌呤、戊柔比星、长春花碱、长春新碱、长春地辛和长春瑞滨。在一个实施例中,与本发明制剂联合使用的化疗剂本身可以是不同化疗剂的组合。合适的组合包括folfox和ifl。folfox是包括5
‑
氟尿嘧啶(5
‑
fu)、亚叶酸和奥沙利铂的组合。ifl治疗包括伊立替康、5
‑
fu和亚叶酸。
[0162]
在本发明的另一个实施例中,其它常规癌症治疗包括放射疗法。在一些实施例中,放射疗法包括肿瘤局部放射治疗。在一些实施例中,放射疗法包括全身放射治疗。
[0163]
在本发明的其它实施例中,其它癌症治疗方法选自免疫刺激性物质,如细胞因子和抗体。所述细胞因子可选自由以下组成的组,但并不限于:gm
‑
csf、i型干扰素(ifn)、白细胞介素21、白细胞介素2、白细胞介素12和白细胞介素15。抗体优选是免疫刺激性抗体,如抗
‑
cd40或抗
‑
ctla
‑
4抗体。所述免疫刺激性物质还可以是能够清除免疫抑制性细胞(如调节性t
‑
细胞)或因子的物质,例如所述物质可以是e3泛素连接酶。e3泛素连接酶(hect、ring
和u
‑
box蛋白)是免疫细胞功能的重要分子调节剂,它们中的每一个在感染期间通过靶向特异性抑制性分子进行蛋白水解破坏而参与调节免疫应答。目前,几种hect和ring e3蛋白也与免疫自身耐受性的诱导和维护相关:c
‑
cbl、cbl
‑
b、grail、itch和nedd4,它们中的每一种都负调节t细胞生长因子产生和增殖。
[0164]
在本发明的一些实施例中,本发明的式i或式ii化合物与选自检查点抑制剂的至少一种其它治疗剂联合施用。在本发明的一些实施例中,检查点抑制剂在下述一个或多个(非限制性)靶点上作用:ceacam1、半乳糖凝集素
‑
9、tim3、cd80、ctla4、pd
‑
1、pd
‑
l1、hvem、btla、cd 160、vista、b7
‑
h4、b7
‑
2、cd155、cd226、tigit、cd96、lag3、gitf、ox40、cd137、cd40、ido和tdo。这些都是已知的靶点,其中一些靶点在melero et al,nature reviews cancer(2015)中进行了描述。
[0165]
在本发明的一些实施例中,本发明的式i或式ii化合物与选自吲哚胺
‑
2,3
‑
双加氧酶(ido)抑制剂的至少一种其它治疗剂联合施用。
[0166]
在本发明的一些实施例中,本发明的式i或式ii化合物与选自一种或多种ctla4路径抑制剂的至少一种其它治疗剂联合施用。在一些实施例中,ctla4路径抑制剂选自一种或多种ctla4抗体。
[0167]
在本发明的一些实施例中,本发明的式i或式ii化合物与选自一种或多种pd
‑
1/pd
‑
l路径抑制剂的至少一种其它治疗剂联合施用。在一些实施例中,一种或多种pd
‑
1/pd
‑
l路径抑制剂选自一种或多种pd
‑
1、pd
‑
l1和/或pd
‑
l2抗体。
[0168]
另一方面,本发明涉及一种制备式i和式ii(如上文式i和式ii定义)化合物或其药学上可接受的盐的方法,该方法包括步骤a1):
[0169]
a1)式i或式ii化合物,其中半乳糖苷环的4位和6位的oh采用保护基团(如亚苄基)保护,r1是氢,与试剂(如pocl3)在碱(如diea)存在下反应,得到中间体,用水处理中间体,得到其中r1是磷酸酯(
‑
op(=o)oh2)的式i或式ii化合物;或与试剂(如三氧化硫
‑
三乙胺复合物)反应,得到其中r1是硫酸酯(
‑
so2oh)的式i或式ii化合物;或与试剂如低聚甲醛,然后与四丁基磷酸铵反应,得到其中r1是磷酸甲酯(ch2op(=o)oh2)的式i或式ii化合物;或与试剂如二
‑
叔丁基氯甲基磷酸酯在ago和nai存在下反应,得到中间体,采用tfa处理中间体,得到其中r1是磷酸甲酯(ch2op(=o)oh2)的式i或式ii化合物;或与式r1y1化合物反应,其中r1如式i或式ii所定义,y1是离去基团,如卤化物、甲苯磺酰基或甲磺酰基。
具体实施方式
[0170]
本发明的化合物是新型吡喃半乳糖化合物,其出乎意料地具有良好的溶解性,并且可用于增加最大剂量,从而产生剂量相关的生物利用度。本发明的化合物对半乳糖凝集素3具有较高亲和力并且能抑制半乳糖凝集素3。正如进一步所示,本发明化合物对半乳糖凝集素3的选择性高于对半乳糖凝集素1的选择性。本发明已开发了各种化合物,其中在吡喃半乳糖的c2氧上引入一个修饰基团。
[0171]
优选地,所述吡喃糖环是α
‑
d
‑
吡喃半乳糖,这种化合物作为半乳糖凝集素3的抑制剂具有非常好的溶解性和适用性。特别是,具有c2修饰的吡喃半乳糖环的水溶性高于1.5mg/ml,并且在某些情况下高于10mg/ml。
[0172]
从广义上来说,本发明涉及式(i)的化合物:
[0173][0174]
其中吡喃糖环是α
‑
或β
‑
d
‑
吡喃半乳糖(以波浪线表示);其中r1、a1、x1和b1如上文所定义。
[0175]
在一个实施例中,a1选自取代杂芳基,被由以下组成的组中的至少一种取代:卤素;cn;c2‑6烯基;c2‑6炔基;羧基;c1‑6烷氧基;c1‑6硫代烷基;氨基;取代氨基,被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代;芳基;取代芳基,被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、取代c1‑6烷氧基(被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c1‑6烷基、取代c1‑6烷基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);杂芳基;取代杂芳基,被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基羧基、c1‑6烷氧基、c1‑6硫代烷基、取代c1‑6烷氧基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c1‑6烷基、取代c1‑6烷基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c3‑7环烷基、取代c3‑7环烷基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c3‑7环烷氧基和取代c3‑7环烷氧基(被由卤素、氨基、取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);c1‑6羰基;取代c1‑6羰基,被由以下组成的组中的至少一种取代:卤素、c1‑6烷氧基、c1‑6烷基、取代c1‑6烷基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代));在更具体的实施例中,a1是杂芳基,芳基被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、取代c1‑6烷氧基(被由卤素、氨基和取代氨基组成的组中的至少一种取代,其中取代氨基被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)。在更具体的实施例中,a1是三唑基,例如1,2,3
‑
三唑基,被苯基取代,其中苯基被至少一个卤素,如被1、2或3个f取
代,或被2个f和1个cl取代。
[0176]
在另一个实施例中,x1选自由o和s组成的组。优选地,x1是s。
[0177]
在另一个实施例中,b1选自由以下组成的组:d)取代芳基,被由以下组成的组中的至少一种取代:卤素;氰基;羟基;羧基;羧酰胺基;取代羧酰胺基(被由c1‑6烷基和c3‑6环烷基组成的组中的至少一种取代);c1‑6烷基;取代c1‑6烷基(被由卤素、羟基和r
&
‑
conh
‑
组成的组中的至少一种取代,其中r
&
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6环烷基;取代c1‑6环烷基(被由卤素、羟基和r
%
‑
conh
‑
组成的组中的至少一种取代,其中r
%
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6烷氧基、取代c1‑6烷氧基(被由卤素、羟基和r
§
‑
conh
‑
组成的组中的至少一种取代,其中r
§
选自由c1‑6烷基和c1‑6环烷基组成的组);c3‑6环烷氧基;取代c3‑6环烷氧基(被由卤素、羟基和r
*
‑
conh
‑
组成的组中的至少一种取代,其中r
*
选自由c1‑6烷基和c1‑6环烷基组成的组);氨基;取代氨基(被由c1‑6烷基和c1‑6环烷基组成的组中的至少一种取代);以及r
**
‑
conh
‑
,其中r
**
选自由c1‑6烷基和c1‑6环烷基组成的组;以及g)取代杂芳基,被由以下组成的组中的至少一种取代:卤素;氰基;羟基;羧基;羧酰胺基;取代羧酰胺基(被由c1‑6烷基和c3‑6环烷基组成的组中的至少一种取代);c1‑6烷基;取代c1‑6烷基(被由卤素、羟基和r
&&
‑
conh
‑
组成的组中的至少一种取代,其中r
&&
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6环烷基;取代c1‑6环烷基(被由卤素、羟基和r
%%
‑
conh
‑
组成的组中的至少一种取代,其中r
%%
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6烷氧基;取代c1‑6烷氧基(被由卤素、羟基和r
§§
‑
conh
‑
组成的组中的至少一种取代,其中r
§§
选自由c1‑6烷基和c1‑6环烷基组成的组);c3‑6环烷氧基;取代c3‑6环烷氧基(被由卤素、羟基和r
a
‑
conh
‑
组成的组中的至少一种取代,其中r
a
选自由c1‑6烷基和c1‑6环烷基组成的组);氨基;取代氨基(被由c1‑6烷基和c1‑6环烷基组成的组中的至少一种取代);r
aa
‑
conh
‑
,其中r
aa
选自由c1‑6烷基和c1‑6环烷基组成的组;取代杂芳基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基;取代芳基,被由以下组成的组中的至少一种取代:卤素、氰基、c1‑6烷氧基、取代c1‑6烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、c1‑6烷基、取代c1‑6烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);杂芳基;取代杂芳基,被由以下组成的组中的至少一种取代:卤素、氰基、c1‑6烷氧基、取代c1‑6烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、c1‑6烷基、取代c1‑6烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c3‑7环烷基、取代c3‑7环烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中
的至少一种取代))、c3‑7环烷氧基和取代c3‑7环烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代));c1‑6羰基;以及取代c1‑6羰基,被由卤素、c1‑6烷氧基、c1‑6烷基、取代c1‑6烷基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)。优选地,b1选自由以下组成的组:d)取代苯基,被由以下组成的组中的至少一种取代:卤素;氰基;羟基;羧基;羧酰胺基;取代羧酰胺基(被由c1‑6烷基和c3‑6环烷基组成的组中的至少一种取代);c1‑6烷基;取代c1‑6烷基(被由卤素、羟基和r
&
‑
conh
‑
组成的组中的至少一种取代,其中r
&
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6环烷基;取代c1‑6环烷基(被由卤素、羟基和r
%
‑
conh
‑
组成的组中的至少一种取代,其中r
%
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6烷氧基;取代c1‑6烷氧基(被由卤素、羟基和r
§
‑
conh
‑
组成的组中的至少一种取代,其中r
§
选自由c1‑6烷基和c1‑6环烷基组成的组);c3‑6环烷氧基;取代c3‑6环烷氧基(被由卤素、羟基和r
*
‑
conh
‑
组成的组中的至少一种取代,其中r
*
选自由c1‑6烷基和c1‑6环烷基组成的组);氨基;取代氨基(被由c1‑6烷基和c1‑6环烷基组成的组中的至少一种取代);以及r
**
‑
conh
‑
,其中r
**
选自由c1‑6烷基和c1‑6环烷基组成的组;及g)取代吡啶基,被由以下组成的组中的至少一种取代:卤素;氰基;羟基;羧基;羧酰胺基;取代羧酰胺基(被由c1‑6烷基和c3‑6环烷基组成的组中的至少一种取代);c1‑6烷基;取代c1‑6烷基(被由卤素、羟基和r
&&
‑
conh
‑
组成的组中的至少一种取代,其中r
&&
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6环烷基;取代c1‑6环烷基(被由卤素、羟基和r
%%
‑
conh
‑
组成的组中的至少一种取代,其中r
%%
选自由c1‑6烷基和c1‑6环烷基组成的组);c1‑6烷氧基;取代c1‑6烷氧基(被由卤素、羟基和r
§§
‑
conh
‑
组成的组中的至少一种取代,其中r
§§
选自由c1‑6烷基和c1‑6环烷基组成的组);c3‑6环烷氧基;取代c3‑6环烷氧基(被由卤素、羟基和r
a
‑
conh
‑
组成的组中的至少一种取代,其中r
a
选自由c1‑6烷基和c1‑6环烷基组成的组);氨基;取代氨基(被由c1‑6烷基和c1‑6环烷基中组成的组的至少一种取代);r
aa
‑
conh
‑
,其中r
aa
选自由c1‑6烷基和c1‑6环烷基组成的组;取代杂芳基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基;取代芳基(被由以下组成的组中的至少一种取代:卤素、氰基、c1‑6烷氧基、取代c1‑6烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、c1‑6烷基、取代c1‑6烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);杂芳基;取代杂芳基,被由以下组成的组中的至少一种取代:卤素、氰基、c1‑6烷氧基、取代c1‑6烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、c1‑6烷基、取代c1‑6烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的
组中的至少一种取代))、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、c3‑7环烷基、取代c3‑7环烷基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代))、c3‑7环烷氧基和取代c3‑7环烷氧基(被由以下组成的组中的至少一种取代:卤素、氨基、取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代));c1‑6羰基;以及取代c1‑6羰基,被由以下组成的组中的至少一种取代:卤素、c1‑6烷氧基、c1‑6烷基、取代c1‑6烷基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)、硝基、硫基、c1‑6烷硫基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、c3‑7环烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代。最优选地,b1选自由以下组成的组:d)取代苯基,被至少一个卤素(如1或2个cl)取代;及g)取代吡啶基,被至少一个卤素,如1个br取代。
[0178]
在本发明式i或式ii化合物的另一个实施例中,r1选自由以下组成的组:a)磷酸酯,b)硫酸酯,c)取代c1‑6烷基,被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑6烷基和甲基磺酰基;杂环,如杂芳基或杂环烷基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);
‑
so2‑
nhr3,其中r3选自杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代),及
‑
co
‑
r4,其中r4选自氢和杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);d)支链c3‑6烷基,被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑6烷基和甲基磺酰基;杂环,如杂芳基或杂环烷基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);
‑
so2‑
nhr3,其中r3选自杂环,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代),及
‑
co
‑
r4,其中r4选自氢和杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、
硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)。
[0179]
在本发明的式i或式ii化合物的另一个实施例中,r1选自由以下组成的组:a)磷酸酯,b)硫酸酯,c)取代c1‑3烷基,被以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑3烷基和甲基磺酰基;杂芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);
‑
so2‑
nhr3,其中r3选自杂环,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代),及
‑
co
‑
r4,其中r4选自氢和杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);d)支链c3‑6烷基,被选自以下基团取代:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑3烷基和甲基磺酰基;杂芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);
‑
so2
‑
nhr3,其中r3选自杂环,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代),及
‑
co
‑
r4,其中r4选自氢和杂环,杂环任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑3烷氧基、c1‑3硫代烷基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基、c1‑3羰基、氨基和取代氨基(被由卤素、c1‑3烷氧基、c1‑3烷基、硝基、硫基、c1‑3烷硫基、氨基、羟基和c1‑3羰基组成的组中的至少一种取代)。
[0180]
在另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及被选自以下基团取代的c1‑4烷基:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑4烷基,及甲基磺酰基;杂
芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑4烷氧基、c1‑4硫代烷基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基、c1‑4羰基、氨基和取代氨基(被由卤素、c1‑4烷氧基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基和c1‑4羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑4烷氧基、c1‑4硫代烷基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基、c1‑4羰基、氨基和取代氨基(被由卤素、c1‑4烷氧基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基和c1‑4羰基组成的组中的至少一种取代)。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0181]
在另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及被选自以下基团取代的c1‑3烷基:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑3烷基,及甲基磺酰基;杂芳基,选自由恶唑基、咪唑基、异恶唑基和四唑基组成的组,例如,恶唑基和四唑基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);苯基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑6烯基、c2‑6炔基、羧基、c1‑6烷氧基、c1‑6硫代烷基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基、c1‑6羰基、氨基和取代氨基(被由卤素、c1‑6烷氧基、c1‑6烷基、硝基、硫基、c1‑6烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代)。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0182]
在另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及被选自以下基团取代的c1‑3烷基:磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、c1‑3烷基,及甲基磺酰基;杂芳基,选自由恶唑基、咪唑基、异恶唑基和四唑基组成的组,例如,恶唑基和四唑基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑4烷氧基、c1‑4硫代烷基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基、c1‑4羰基、氨基和取代氨基(被由卤素、c1‑4烷氧基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基和c1‑6羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑4烷氧基、c1‑4硫代烷基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基、c1‑4羰基、氨基和取代氨基(被由卤素、c1‑4烷氧基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基和c1‑4羰基组成的组中的至少一种取代)。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0183]
在另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及被选自以下基团取代的c1‑3烷基(如甲基):磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、甲基,及甲基磺酰基;杂芳基,选自由恶唑基、咪唑基、异恶唑基和四唑基组成的组,例如,恶唑基和四唑基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑4烷氧基、c1‑4硫代烷基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基、c1‑4羰基、氨基和取代氨基(被由卤素、c1‑4烷氧基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基和c1‑4羰基组成的组中的至少一种取代);芳基,任选被由以下组成的组中的至少一种取代:卤素、cn、c2‑4烯基、c2‑4炔基、羧基、c1‑4烷氧基、c1‑4硫代烷基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基、c1‑4羰基、氨基和取代氨基(被由卤素、c1‑4烷氧基、c1‑4烷基、硝基、硫基、c1‑4烷硫基、氨基、羟基和c1‑4羰基组
成的组中的至少一种取代)。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0184]
在另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及被选自以下基团取代的c1‑3烷基(如甲基):磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自氢、甲基,及甲基磺酰基;咪唑基,任选被甲基取代;异恶唑基;恶唑基;四唑基;苯基,被由卤素和羟基组成的组中的至少一种取代。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0185]
在另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及被选自以下基团取代的c1‑3烷基(如甲基):磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自甲基磺酰基;异恶唑基;咪唑基,任选被甲基取代;恶唑基;四唑基;被由卤素(如f)和羟基组成的组中的至少一种取代的苯基。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0186]
在另一个实施例中,r1选自由以下组成的组:磷酸酯、硫酸酯及被选自以下基团取代的c1‑3烷基(如甲基):磷酸酯、氧磷酰基、
‑
cooh、
‑
conhr2,其中r2选自甲基磺酰基;恶唑基;四唑基;被由卤素(如f)和羟基组成的组中的至少一种取代的苯基。这些r1基团中的每个基团都可以与上述实施例和本发明各个方面中的任何一个相联系而成为各个实施例的主题。
[0187]
在本发明的另一个实施例中,所述化合物选自式ii化合物
[0188][0189]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,其中
[0190]
a2选自上文所定义的a1;
[0191]
x1选自s、so、so2、o、c=o和cr
32a
r
33a
,其中r
32a
和r
33a
独立地选自氢、oh或卤素;
[0192]
b2选自上文所定义的b1;
[0193]
r1如上文所定义;或
[0194]
其药学上可接受的盐或其溶剂化物;
[0195]
在另一个实施例中,a2选自
[0196][0197]
其中het
1a
选自五元或六元杂芳环,任选被以下述基团取代:br;f;cl;cn;nr
19a
r
20a
,其中r
19a
和r
20a
独立地选自h、c1‑3烷基、环丙基、异丙基、
‑
c(=o)
‑
r
21a
,其中r
21a
选自h和c1‑3烷基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);以及oc1‑3烷基(任选被f取代);
[0198]
其中r
1a
‑
r
5a
独立地选自h、cn、nh2、cl、f、甲基(任选被f取代)和och3(任选被f取代);
[0199]
其中r
6a
选自c1‑6烷基,任选被卤素、支链c3‑6烷基和c3‑7环烷基取代;
[0200]
其中r
7a
选自五元或六元杂芳环和苯基,五元或六元杂芳环任选被选自br、f、cl、甲基(任选被f取代)和och3(任选被f取代)的基团取代;苯基任选被选自br、f、cl、甲基(任选被f取代)和och3(任选被f取代)的基团取代;
[0201]
其中r
8a
‑
r
12a
独立地选自h、f、甲基(任选被f取代),及och3(任选被f取代);
[0202]
其中r
13a
是五元或六元杂芳环或芳基,五元或六元杂芳环任选被以下基团取代:h、oh、f、甲基(任选被f取代)和och3(任选被f取代);芳基,如苯基或萘基,任选被h、oh、f、甲基(任选被f取代)和och3(任选被f取代)。优选地,a2是式2a,其中r
1a
‑
r
5a
独立地选自h、cl、cn、nh2、f、甲基(任选被f取代)和och3(任选被f取代)。更优选地,a2是式2a,其中r
1a
和r
5a
是氢,r
2a
‑
r
4a
独立地选自h、cl、cn、nh2、f、甲基(任选被f取代)和och3(任选被f取代)。最优选地,a2是式2a,其中r
1a
和r
5a
是氢,r
2a
‑
r
4a
独立地选自h、cl和f。通常,a2是式2a,其中r
1a
和r
5a
是氢,r
2a
‑
r
4a
都是f或者r
2a
‑
r
4a
选自cl和f。通常,a2是式2a,其中r
1a
和r
5a
是氢,r
2a
‑
r
4a
选自cl和f,其中一个是cl,另两个是f。
[0203]
在另一个实施例中,x1选自s和o。优选地,x1是s。
[0204]
在另一个实施例中,b2选自a)五元或六元杂芳环取代的c1‑6烷基或支链c3‑6烷基,五元或六元杂芳环任选被选自以下取代基取代:cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
14a
‑
conh
‑
(其中r
14a
选自c1‑3烷基和环丙基);或苯基取代的c1‑6烷基,苯基任选被以下基团取代:cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
15a
‑
conh
‑
,其中r
15a
选自c1‑3烷基和环丙基;b)芳基,如苯基或萘基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
22a
r
23a
,其中r
22a
和r
23a
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被
f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
28a
r
29a
(其中r
28a
和r
29a
独立地选自h、c1‑3烷基和异丙基);oh;及r
16a
‑
conh
‑
,其中r
16a
选自c1‑3烷基和环丙基;c)c5
‑
7环烷基,任选被以下基团取代:卤素、cn、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
17a
‑
conh
‑
,其中r
17a
选自c1‑3烷基和环丙基;及d)杂环,如杂芳基或杂环烷基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
24a
r
25a
,其中r
24a
和r
25a
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
30a
r
31a
,其中r
30a
和r
31a
独立地选自h、c1‑3烷基和异丙基;oh;和r
18a
‑
conh
‑
,其中r
18a
选自c1‑3烷基和环丙基;e)c1‑6烷基或支链c3‑6烷基。
[0205]
在另一个实施例中,b2选自b)芳基,如苯基或萘基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
22a
r
23a
,其中r
22a
和r
23a
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
28a
r
29a
,其中r
28a
和r
29a
独立地选自h、c1‑3烷基和异丙基;oh;及r
16a
‑
conh
‑
,其中r
16a
选自c1‑3烷基和环丙基;和d)杂环,如杂芳基或杂环烷基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
24a
r
25a
,其中r
24a
和r
25a
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
30a
r
31a
,其中r
30a
和r
31a
独立地选自h、c1‑3烷基和异丙基;oh;和r
18a
‑
conh
‑
,其中r
18a
选自c1‑3烷基和环丙基。在另一个实施例中,b2选自b)苯基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
22a
r
23a
,其中r
22a
和r
23a
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
28a
r
29a
,其中r
28a
和r
29a
独立地选自h、c1‑3烷基和异丙基;oh;及r
16a
‑
conh
‑
,其中r
16a
选自c1‑3烷基和环丙基;和d)杂环,如杂芳基或杂环烷基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
24a
r
25a
,其中r
24a
和r
25a
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
30a
r
31a
,其中r
30a
和r
31a
独立地选自h、c1‑3烷基和异丙基;oh;和r
18a
‑
conh
‑
,其中r
18a
选自c1‑3烷基和环丙基。在另一个实施例中,b2选自b)被卤素(如cl)取代的苯基。在另一个实施例中,b2选自b)被卤素(如cl)取代的苯基,及
‑
conr
22a
r
23a
,其中r
22a
和r
23a
独立地选自h、c1‑3烷基。在另一个实施例中,b2选自d)被卤素取代的杂芳基,如吡啶基。
[0206]
在另一个实施例中,r1是上文定义实施例中的任一种r1。
[0207]
在本发明的另一个实施例中,所述化合物选自式ii化合物
[0208][0209]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,
[0210]
a2是
[0211][0212]
其中het
1c
选自由式2c至式9c组成的组中的五元或六元杂芳环:
[0213][0214]
其中r
2c
至r
23c
和r
27c
独立地选自h;卤素;oh;cn;sh;s
‑
c1‑3烷基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);oc1‑3烷基(任选被f取代);nr
24c
r
25c
,其中r
24c
选自h和c1‑3烷基,r
25c
选自h、c1‑3烷基,及cor
26c
,其中r
26c
选自h和c1‑3烷基;
[0215]
x1选自s;
[0216]
b2选自a)五元或六元杂芳环取代的c1‑6烷基或支链c3‑6烷基,五元或六元杂芳环任选被选自以下基团取代:cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
27#
‑
conh
‑
(其中r
27#
选自c1‑3烷基和环丙基);或苯基取代的c1‑6烷基,苯基任
选被以下基团取代:cn、卤素、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh,和r
28c
‑
conh
‑
,其中r
28c
选自c1‑3烷基和环丙基;b)芳基,如苯基或萘基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
29c
r
30c
,其中r
29c
和r
30c
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
31c
r
32c
,其中r
31c
和r
32c
独立地选自h、c1‑3烷基和异丙基;oh;及r
33c
‑
conh
‑
,其中r
33c
选自c1‑3烷基和环丙基;c)c5
‑
7环烷基,任选被以下基团取代:卤素、cn、甲基(任选被f取代)、och3(任选被f取代)、och2ch3(任选被f取代)、oh和r
34c
‑
conh
‑
,其中r
34c
选自c1‑3烷基和环丙基;及d)杂环,如杂芳基或杂环烷基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
35c
r
36c
,其中r
35c
和r
36c
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
37c
r
38c
,其中r
37c
和r
38c
独立地选自h、c1‑3烷基和异丙基;oh;和r
39c
‑
conh
‑
,其中r
39c
选自c1‑3烷基和环丙基;e)c1‑6烷基或支链c3‑6烷基;
[0217]
r1是具有一对或两对孤对电子(lone pairs)或酸性质子或者两者都具有的酸性电子等排体(acid isostere);或其药学上可接受的盐或其溶剂化物。
[0218]
在本发明的另一个实施例中,所述化合物选自式ii化合物
[0219][0220]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,
[0221]
a2是
[0222][0223]
其中het
1d
选自
[0224][0225]
其中r
2d
选自由oh和卤素组成的组;
[0226]
r
3d
选自由氢、c1‑6烷基和卤素组成的组;r
4d
选自由oh和卤素组成的组;
[0227]
r
5d
选自由氢、c1‑6烷基和卤素组成的组;
[0228]
x1是s;
[0229]
b2选自a)芳基,如苯基或萘基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
29d
r
30d
,其中r
29d
和r
30d
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);sc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
31d
r
32d
(其中r
31d
和r
32d
独立地选自h、c1‑3烷基和异丙基);oh;及r
33d
‑
conh
‑
,其中r
33d
选自c1‑3烷基和环丙基;b)杂环,如杂芳基或杂环烷基,任选被下述基团取代:卤素;cn;
‑
cooh;
‑
conr
35d
r
36d
,其中r
35d
和r
36d
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);sc1‑3烷基(任选被f取代);o
‑
异丙基(任选被f取代);nr
37d
r
38d
,其中r
37d
和r
38d
独立地选自h、c1‑3烷基和异丙基;oh;和r
39d
‑
conh
‑
,其中r
39d
选自c1‑3烷基和环丙基;
[0230]
r1是具有一对或两对孤对电子或酸性质子或者两者都具有的酸性电子等排体;或其药学上可接受的盐或其溶剂化物。
[0231]
在本发明的另一个实施例中,所述化合物选自式ii化合物
[0232][0233]
其中吡喃糖环是α
‑
d
‑
吡喃半乳糖,其中
[0234]
a2选自上文所定义的a1;
[0235]
x1选自s、so、so2和o;
[0236]
b2选自上文所定义的b1;
[0237]
r1如上文所定义;或
[0238]
其药学上可接受的盐或其溶剂化物。
[0239]
在一个实施例中,a2选自
[0240][0241]
其中het
1b
选自吡啶基,任选被以下基团取代:h、cn、br、cl、i、f、甲基(任选被f取代)、och3(任选被f取代)和sch3(任选被f取代)取代;或嘧啶基,任选被h、cn、br、cl、i、f、甲基(任选被f取代)、och3(任选被f取代)和sch3(任选被f取代);
[0242]
在另一个实施例中,a2选自
[0243][0244]
其中r
1b
‑
r
5b
独立地选自h、cn、br、cl、i、f、甲基(任选被f取代)、och3(任选被f取代)和sch3(任选被f取代)。优选a2是式2b,r
1b
和r
5b
都是氢,r
2b
‑
r
4b
独立地选自h、cn、br、cl、i、f、甲基(任选被f取代)、och3(任选被f取代)和sch3(任选被f取代)。通常,a2是式
2b
,r
1b
和r
5b
都是氢,r
2b
‑
r
4b
独立地选自h、br、cl、i和f,例如,r
2b
‑
r
4b
都是f,或者r
2b
‑
r
4b
选自f和cl,例如,r
2b
是f,r
3b
是cl和r
4b
是f。
[0245]
在另一个实施例中,x1是s。
[0246]
在另一个实施例中,b2选自b)苯基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
22b
r
23b
,其中r
22b
和r
23b
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
28b
r
29b
,其中r
28b
和r
29b
独立地选自h、c1‑3烷基和异丙基;oh;及r
16b
‑
conh
‑
,其中r
16b
选自c1‑3烷基和环丙基;和d)杂芳基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
24b
r
25b
,其中r
24b
和r
25b
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
30b
r
31b
,其中r
30b
和r
31b
独立地选自h、c1‑3烷基和异丙基;oh;和r
18b
‑
conh
‑
,其中r
18b
选自c1‑3烷基和环丙基。
[0247]
在一个实施例中,b2选自b)苯基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
22b
r
23b
,其中r
22b
和r
23b
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
28b
r
29b
,其中r
28b
和r
29b
独立地选自h、c1‑3烷基和异丙基;oh;及r
16b
‑
conh
‑
,其中r
16b
选自c1‑3烷基和环丙基。通常,b2选自被卤素(例如,1
‑
3个选自cl、f、br和i生物基团)取代的苯基。在具体实施例中,b2选自1
‑
3个cl(如2个cl)取代的苯基。
[0248]
在另一个实施例中,b2选自杂芳基,任选被以下基团取代:卤素;cn;
‑
cooh;
‑
conr
24b
r
25b
,其中r
24b
和r
25b
独立地选自h、c1‑3烷基、环丙基和异丙基;c1‑3烷基(任选被f取代);环丙基(任选被f取代);异丙基(任选被f取代);oc1‑3烷基(任选被f取代);o
‑
环丙基(任选被f取代);o
‑
异丙基(任选被f取代);nr
30b
r
31b
,其中r
30b
和r
31b
独立地选自h、c1‑3烷基和异丙基;oh;及r
18b
‑
conh
‑
,其中r
18b
选自c1‑3烷基和环丙基。通常,b2选自被以下基团(例如,被1
‑
3个以下基团)取代的吡啶基:cl、f、br和i。在具体实施例中,b2选自1
‑
3个br(如1个br)取代的吡啶基。
[0249]
在本发明的另一个实施例中,其中所述化合物具有式ii,其中a2是式2b,x1选自s、so、so2和o;b2选自上文所定义的b1,r1选自上文定义实施例中的任一种r1。
[0250]
在本发明的另一个实施例中,所述式i或式ii化合物选自:
[0251]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0252]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0253]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磺基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0254]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磺基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0255]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(磷酰氧基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0256]
3,4
‑
二氯苯基2
‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0257]
3,4
‑
二氯苯基2
‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0258]5‑
溴吡啶
‑3‑
基2
‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0259]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[2
‑
(甲基磺酰胺基)
‑2‑
氧乙基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0260]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
(恶唑
‑4‑
基甲基)
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0261]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
(3,5
‑
二氟
‑4‑
羟基苄基)
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0262]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0263]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0264]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0265]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
咪唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0266]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1
‑
甲基
‑
1h
‑
咪唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0267]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(恶唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0268]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(恶唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0269]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(异恶唑
‑3‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0270]
3,4
‑
二氯苯基3
‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
[(恶唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0271]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0272]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0273]5‑
嗅吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0274]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0275]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(
‑
1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0276]5‑
嗅吡啶
‑3‑
基2
‑
o
‑
羧丙基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷、
[0277]5‑
嗅吡啶
‑3‑
基2
‑
o
‑
(1
‑
羧基)乙基)
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(非对映异构体1),及
[0278]5‑
嗅吡啶
‑3‑
基2
‑
o
‑
(1
‑
羧基)乙基)
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(非对映异构体2)。
[0279]
另一方面,本发明涉及本发明化合物作为药物的用途。在一个实施例中,所述化合物具有式i。在更优选的实施例中,所述化合物具有式ii。
[0280]
另一方面,本发明涉及包含本发明式i或式ii化合物以及任选药学上可接受的添加剂,如载体和/或赋形剂的药物组合物。
[0281]
另一方面,本发明涉及本发明式i或式ii化合物在哺乳动物(如人类)中治疗与半乳糖凝集素
‑
3(galectin
‑
3)和配体的结合相关的病症的用途。在一个实施例中,所述疾病选自由以下组成的组:炎症;纤维症(如肺纤维化、肝纤维化、肾纤维化、眼睛纤维化及皮肤和心脏纤维化);疤痕;瘢痕瘤形成;异常瘢痕形成;手术粘连;脓毒性休克;癌症(如癌、恶性肿瘤、白血病和淋巴瘤,如t
‑
细胞淋巴瘤);转移癌;自身免疫性疾病(如牛皮癣、类风湿性关节炎、克罗恩氏病、溃疡性结肠炎、强直性脊柱炎、全身性红斑狼疮);代谢紊乱;心脏病;心脏衰竭;病理性血管生成(如眼部血管生成或与眼部血管生成相关的疾病或症状,如与癌症相关的新血管生成);及眼部疾病,如年龄相关性黄斑变性和角膜新生血管形成;动脉粥样硬化症;代谢性疾病(如糖尿病);2型糖尿病;胰岛素抵抗;肥胖;舒张性心脏衰竭;哮喘及其它间质性肺病(包括赫曼斯基
‑
普德拉克综合征、间皮瘤);及肝病(如非酒精性脂肪性肝炎)。通过施用式i或式ii化合物可以治疗、管理与/或预防的非限制性癌症实例包括:结肠癌、乳腺癌、胰腺癌、卵巢癌、前列腺癌、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨原性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴肉瘤、淋巴管内皮瘤、滑膜瘤、间皮瘤、尤因氏肉瘤、平滑肌肉瘤、横纹肌肉瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺瘤、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯瘤、宫颈癌、睾丸肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、成胶质细胞瘤、神经鞘瘤、颅咽管瘤、许旺氏细胞瘤、胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、脑膜瘤、黑色素瘤、成神经细胞
瘤、成视网膜细胞瘤、白血病和淋巴瘤、急性淋巴细胞白血病、急性髓细胞真性红细胞增多、多发性骨髓瘤、华氏巨球蛋白血症、重链病、急性非淋巴细胞白血病、慢性淋巴细胞白血病、慢性髓细胞性白血病、何杰金氏病、非何杰金淋巴瘤、直肠癌、肾盂癌、子宫癌、口腔癌、皮肤癌、胃癌、脑瘤、肝癌、喉癌、食管癌、乳腺肿瘤、儿童非急性淋巴性白血病(all)、胸腺all、b
‑
细胞all、急性髓性白血病、髓单核细胞白血病、急性巨核细胞白血病、伯基特淋巴瘤、急性髓性白血病、慢性髓性白血病、t细胞白血病、小和大非小细胞肺癌、急性粒细胞性白血病、生殖细胞瘤、子宫内膜癌、胃癌、头颈癌、慢性淋巴细胞白血病、毛细胞白血病和甲状腺癌。这些疾病中的每种疾病都被视为是一个实施例,可以是针对这类疾病或病症的权利要求的主题。
[0282]
另一方面,本发明涉及一种治疗哺乳动物(如人类)与半乳糖凝集素
‑
3和配体结合有关的疾病的方法,其中向需要所述治疗的哺乳动物施用治疗有效剂量的本发明式i或式ii化合物中的至少一种化合物。在本发明的另一个实施例中,疾病选自由以下组成的组炎症;纤维症(如肺纤维化、肝纤维化、肾纤维化、眼睛纤维化及皮肤和心脏纤维化);疤痕;瘢痕瘤形成;异常瘢痕形成;手术粘连;脓毒性休克;癌症(如癌、恶性肿瘤、白血病和淋巴瘤,如t
‑
细胞淋巴瘤);转移癌;自身免疫性疾病(如牛皮癣、类风湿性关节炎、克罗恩氏病、溃疡性结肠炎、强直性脊柱炎、全身性红斑狼疮);代谢紊乱;心脏病;心脏衰竭(hf);病理性血管生成(如眼部血管生成或与眼部血管生成相关的疾病或症状,如与癌症相关的新血管生成);及眼部疾病,如年龄相关性黄斑变性和角膜新生血管形成;动脉粥样硬化症;代谢性疾病(如糖尿病);2型糖尿病;胰岛素抵抗;肥胖;舒张性心脏衰竭;哮喘及其它间质性肺病(包括赫曼斯基
‑
普德拉克综合征、间皮瘤);及肝病(如非酒精性脂肪性肝炎)。这些疾病中的每种疾病都被视为是一个实施例,可以是针对这类疾病或病症的权利要求的主题。
[0283]
本领域技术人员将理解的是,可能必须调整或改变方法al中步骤的顺序,这种顺序的改变包含在反应方案中的上述方法的各方面以及方法步骤的描述中。
[0284]
此外,本领域技术人员将理解的是,上述方法以及下文方法中,中间化合物的官能团可能需要被保护基团保护。
[0285]
需要保护的官能团包括羟基、氨基和羧酸。合适的羟基保护基团包括任选取代的和/或不饱和的烷基(如甲基、烯丙基、苄基或叔丁基)、三烷基硅烷基或二芳基烷基硅烷基(如叔
‑
丁基二甲基硅烷基、叔丁基二苯基硅烷基或三甲基硅烷基)、aco(乙酰氧基)、tbs(叔丁基二甲基硅烷基)、tms(三甲基硅烷基)、pmb(对
‑
甲氧基苄基)和四氢吡喃基。合适的羧酸保护基团包括(c1‑6)
‑
烷基酯或苄基酯。合适的氨基保护基团包括叔丁氧基羰基、苄氧基羰基、2
‑
(三甲基硅烷基)
‑
乙氧基
‑
甲基或2
‑
三甲基硅烷基乙氧基羰基(teoc)。合适的s保护基团包括s
‑
c(=n)nh2、tips。
[0286]
官能团的保护和去保护可在上述方法提到的任何反应之前或之后进行。
[0287]
此外,本领域技术人员应该理解的是,为了以替代方式,在某些情况下,以更方便的方式获得本发明的化合物,前面提到的各方法步骤可以采用不同的顺序,和/或各反应可以在总体路线的不同阶段执行(即结合特定的反应,取代基可以被添加到与上述中间体不同的中间体上和/或对其进行化学转化)。这样可能不再需要保护基团或可能必须采用保护基团。
[0288]
在另一个实施例中,式i或式ii化合物是游离形式。本文所述“游离形式”指的是式
i或式ii化合物,根据取代基,可以是酸的形式或碱的形式,或是中性化合物。此外,游离形式并不另外包含任何酸性盐或碱性盐。在一个实施例中,游离形式是无水化合物。在另一个实施例中,游离形式是溶剂化物,如水合物。
[0289]
在另一个实施例中,式i或式ii化合物是结晶形式。本领域技术人员可以开展试验,从而发现多晶型,本文使用的术语“结晶形式”包括这些多晶型。
[0290]
当将本文公开的化合物和药物组合物用于上述治疗时,将治疗有效剂量的至少一种化合物施用于需要所述治疗的哺乳动物。
[0291]
本文所用的术语“c1‑
x
烷基”指的是包含1
‑
x个碳原子的烷基,如c1‑5或c1‑6,如甲基、乙基、丙基、丁基、戊基或己基。
[0292]
本文所用的术语“支链c3‑6烷基”指的是包含3
‑
6个碳原子的支链烷基,如异丙基、异丁基、叔丁基、异戊基、3
‑
甲基丁基、2,2
‑
二甲基丙基、正
‑
己基、2
‑
甲基戊基、2,2
‑
二甲基丁基、2,3
‑
二甲基丁基。
[0293]
本文所用的术语“c3‑7环烷基”指的是包含3‑7个碳原子的环烷基,如环丙基、环丁基、环戊基、环己基、环庚基及1
‑
甲基环丙基。
[0294]
本文所用的术语“c5‑7环烷基”指的是包含5
‑
7个碳原子的环烷基,如环戊基、环己基或环庚基。
[0295]
本文所用的术语“氧代”指的是双键氧原子,还表示为=o。
[0296]
本文所用的术语“cn”指的是氰基。
[0297]
本文所用的术语“五元或六元杂芳环”指的是一个五元杂芳环或一个六元杂芳环。五元杂芳环包含5个环原子,其中1至4个环原子是选自n、o和s的杂原子。六元杂芳环包含6个环原子,其中1至5个环原子是选自n、o和s的杂原子。实例包括噻吩、呋喃、吡喃、吡咯、咪唑、吡唑、异噻唑、异恶唑、吡啶、吡嗪、嘧啶和哒嗪。当所述杂芳环是取代基时,它们被称为噻吩基、呋喃基、吡喃基、吡咯基、咪唑基、吡唑基、异噻唑基、异恶唑基、吡啶基、吡嗪基、嘧啶基和哒嗪基。还包括恶唑基、噻唑基、噻二唑基、恶二唑基和吡啶酮基。
[0298]
本文所用的术语“杂环,如杂芳基或杂环烷基”指的是由一个或多个3‑7元环体系组成的杂环,其中环体系包含一个或多个杂原子,其中所述环体系任选是芳烃。本文所述“杂芳基”指的是包含一个或多个(例如1
‑
10个,如1‑6个)选自o、s和n的杂原子的单环或双环芳香环体系,包括但不限于恶唑基、恶二唑基、噻吩基、噻二唑基、噻唑基、吡啶基、嘧啶基、吡啶酮基、嘧啶酮基、喹啉基、氮杂喹啉基、异喹啉基、氮杂异喹啉基、喹唑啉基、氮杂喹唑啉基、苯并恶唑基、氮杂苯并恶唑基、苯并噻唑基或氮杂苯并噻唑基。本文所述“杂环烷基”指的是包含一个或多个(例如1
‑
7个,如1
‑
5个)选自o、s和n的杂原子的单环或双环3‑7元脂肪族杂环,包括但不限于哌啶基、四氢吡喃基、四氢噻喃基或哌啶酮基。
[0299]
本文所用的术语“治疗”指的是管理和护理患者,与疾病,如病症或症状做斗争。该词语旨在包括针对患者所遭受的给定病症提供的所有治疗,如施用活性化合物,缓解症状或并发症,延缓疾病、症状或状况的发展,缓解或减轻症状和并发症,和/或治愈或消除疾病、症状或状况,以及预防疾病,其中预防应理解为管理和护理患者,与疾病、状况或症状做斗争,包括施用活性化合物,防止出现症状或并发症。治疗可以以急性或慢性方式执行。优选地,治疗的患者是哺乳动物;具体地,治疗的患者是人类,但是还可以包括动物,如狗、猫、牛、羊和猪。
[0300]
本文用于本发明式i或式ii化合物的术语“治疗有效剂量”指的是足够治愈、缓解或部分抑制给定疾病和其并发症的临床表现所需的量。足够实现这一点的量被定义为“治疗有效剂量”。每种用途的有效剂量将取决于疾病或伤害的严重程度及患者的体重和基本情况。应该理解的是,可以通过常规实验,构建数值矩阵并测试矩阵中的不同点来确定合适的剂量,这些方法是熟练医生或兽医的普通技能。
[0301]
另一方面,本发明涉及包含式i或式ii化合物及任选药学上可接受的添加剂,如载体和/或赋形剂的药物组合物。
[0302]
本文所用的术语“药学上可接受的添加剂”包括但不限于载体、赋形剂、稀释剂、佐剂、颜料、香料、防腐剂等,但不限于这些,这些添加剂是本领域技术人员配制本发明化合物,从而制备药物组合物时考虑使用的添加剂。
[0303]
本发明组合物中可以使用的佐剂、稀释剂、赋形剂与/或载体,从其与式i或式ii化合物及药物组合物其它成分相容,并且不会对患者有害这方面意义来说是药学上可接受的。优选地,所述组合物应不包含可能带来不良反应,如过敏反应的任何材料。本发明药物组合物可以使用的佐剂、稀释剂、赋形剂和载体为本领域技术人员所熟知。
[0304]
如上所述,除本文公开的化合物之外,本文公开的组合物,特别是药物组合物可以进一步包含至少一种药学上可接受的佐剂、稀释剂、赋形剂和/或载体。在一些实施例中,所述药物组合物包括1
‑
99wt%所述至少一种药学上可接受的佐剂、稀释剂、赋形剂和/或载体和1
‑
99wt%本文公开的化合物。活性成分及药学上可接受的佐剂、稀释剂、赋形剂与/或载体的总含量并不占组合物,特别是药物组合物重量的100%以上。
[0305]
在一些实施例中,仅采用本文公开的一种化合物用于上述用途。
[0306]
在一些实施例中,联合使用本文公开的两种或多种化合物用于上述用途。
[0307]
包括本文所述化合物的组合物,特别是药物组合物可适用于口服、静脉内、局部、腹膜内、经鼻、口腔、舌下或皮下施用,或者适用于采用例如气雾剂或空气悬浮细粉的形式经呼吸道施用。因此,该药物组合物可以是例如片剂、胶囊剂、粉剂、纳米颗粒、晶体、无定形物质、溶液、透皮贴剂或栓剂的形式。
[0308]
该方法的其它实施例在本文的实验部分进行说明,每种方法及每种起始材料构成的实施例可能是实施例的一部分。
[0309]
除非指定一个实施例涉及本发明的某些方面,否则,上述实施例应视为涉及本文描述的其中任何一个方面(如“治疗方法”、“药物组合物”、“化合物作为药物的用途”或“化合物在方法中的用途”)以及本文描述的任何一个实施例。
[0310]
本文引用的所有参考文献,包括出版物、专利申请和专利,通过引用而并入本技术中,就好象每个参考文献都独立地且特定地通过引用而整体纳入本技术中一样。
[0311]
本文使用的所有标题和副标题仅仅是为了方便,不管怎样,都不应视为限制本发明。
[0312]
除非本文明确指出或上下文明显矛盾,上述要素各种可能变化的任何组合都包括在本发明内。
[0313]
除非本文另外指出或上下文明显矛盾,在描述本发明的上下文中,词语“一”和“该”及类似的指代应视为包括单数和复数。
[0314]
本文数值范围的列举仅旨在作为单独谈到每个落在范围内的每个独立值的速记
方法,除非另外指明,每个独立值均包括在本说明书中,正如其在本文单独引用一样。除非特别声明,本文提供的所有准确数值都是对应近似值的代表(例如,所有准确示范值都是相对一个特定因子或指标提供,可以视为也提供对应的近似指标,若合适的话,通过“大约”修饰)。
[0315]
除非本发明另外指出或根据上下文明显矛盾,否则本文描述的所有方法可以按任何合适的顺序执行。
[0316]
除非另外声明,任何实例及所有实例,或示例性语言(例如“例如”)的使用仅仅是为了更好地阐述本发明,并不旨在限制本发明的范围。除非明确声明,说明书中的任何文字都不应视为表明任何要素是实践本发明必不可少的。
[0317]
本文中专利文件的引用和包纳只是为了方便,并不反映这些专利文件的任何有效性、专利性与/或实施性。
[0318]
除非另外声明或上下文明显矛盾,涉及一个要素或多个要素时采用词语,如“包括”、“具有”、或“包含”描述本发明任何方面或实施例,旨在支持本发明的类似方面或实施例,“组成”、“基本上组成”或“基本上包括”该特定要素或多个要素(例如,本文将组合物描述为包括某一特定要素应理解为还描述了一种由该要素组成的组合物,除非另外声明或或上下文明显矛盾)。根据适用法律允许的最大限度,本发明包括本文各方面或权利要求提到的主题物质的所有修改和相当形式。
[0319]
本发明将通过下述实例进一步阐明,但是,这些实例不应视为限制本发明的保护范围。前面说明和下述实例公开的特征,独立的特征和这些特征的任何组合,都是实现本发明各种形式的材料。
[0320]
实验程序(kd值的评估)
[0321]
采用荧光各向异性试验测定实例1
‑
28与半乳糖凝集素的亲和力,其中所述化合物作为半乳糖凝集素和荧光素标记糖探针之间相互反应的抑制剂,如p.,kahl
‑
knutsson,b.,huflejt,m.,nilsson,u.j.,and leffler h.(2004)fluorescence polarization as an analytical tool to evaluate galectin
‑
ligand interactions;anal.biochem.334:36
‑
47,(et al.,2004);monovalent interactions of galectin
‑
1by salomonsson,emma;larumbe,amaia;tejler,johan;tullberg,erik;rydberg,hanna;sundin,anders;khabut,areej;frejd,torbjorn;lobsanov,yuri d.;rini,james m.;et al,from biochemistry(2010),49(44),9518
‑
9532,(salomonsson et al.,2010)所述。
[0322]
[0323]
[0324]
[0325]
[0326]
[0327]
[0328][0329]
一般实验:
[0330]
采用400mhzbrukeravanceiii500仪器或varian仪器记录在25℃、400mhz条件下的核磁共振(nmr)谱。采用残余溶剂作为内标物,以ppm(d)报告化学位移。峰的多重性表示如下:s,单峰;d,双峰;dd,双重双峰;t,三重峰;dt,双重三峰;q,四重峰;m,多重峰;brs,宽单峰。采用agilent1200hplc与agilentmsd质谱仪联用,质谱仪操作模式采用es(+)离子化模式,获得lc
‑
ms。柱子:xbridgec18(4.6x50mm,3.5μm)或sunfirec18(4.6x50mm,3.5μm)。溶剂a为水+0.1%tfa,溶剂b为乙腈+0.1%tfa,或溶剂a为水(10mm碳酸氢铵),溶剂b为乙腈。波长:254nm。或者,采用agilent1100hplc与agilentmsd质谱仪联用,质谱仪操作模式采用es(+)离子化模式,获得lc
‑
ms。柱子:waterssymmetry2.1x30mmc18或chromolithrp
‑
182x50mm。溶剂a水+0.1%tfa,溶剂b为乙腈+0.1%tfa。波长254nm。
[0331]
在gilson215上执行制备型hplc。流速:25ml/min。柱子:xbrigeprepc1810μmobd(19
×
250mm)柱。波长:254nm。溶剂a为水(10mm碳酸氢铵),溶剂b为乙腈。或者在gilson系统上执行制备型hplc。流速:15ml/min。柱子:kromasil100
‑5‑
c18柱。波长:220nm。溶剂a为水+0.1%tfa,溶剂b为乙腈+0.1%tfa。
[0332]
采用下述缩略语:
[0333]
aq:水性
[0334]
calcd:计算值
[0335]
dcm:二氯甲烷
[0336]
diea:n,n
‑
二异丙基乙胺
[0337]
dmap:4
‑
二甲基氨基吡啶
[0338]
dmf:n,n
‑
二甲基甲酰胺
[0339]
esi
‑
ms:电喷雾电离质谱法
[0340]
etoac:乙酸乙酯
[0341]
h:小时
[0342]
mecn:乙腈
[0343]
min:分钟
[0344]
nd未测定
[0345]
prep.制备
[0346]
pe:石油醚
[0347]
rt:室温
[0348]
tbs:叔丁基二甲基硅烷基
[0349]
tbaf:四丁基氟化铵
[0350]
tfa:三氟乙酸
[0351]
tms:三甲基硅烷基
[0352]
uv:紫外
[0353]
实例1
[0354]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0355][0356]5‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0357][0358]
在n2气氛下,在0℃下向5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.322mmol)和dmap(78.6mg,0.644mmol)的dcm(15.0ml)溶液中加入diea(1.38ml,8.05mmol),然后逐滴加入pocl3(0.147ml,1.61mmol)。当tlc显示没有剩余起始材料后,在真空室温下脱除溶剂,加入氢氧化铵(15ml),过滤收集沉淀出来的白色固体,无需进一步提纯直接用于下一步。[c
26
h
21
brf3n4o7ps][m
‑
h]
‑
的esi
‑
msm/z计算值:699.0;实测值:698.9。
[0359]5‑
溴吡啶
‑3‑
基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0360][0361]
将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(220mg,0.314mmol)溶于10%tfa的dcm溶液中,搅拌反应3小时。脱除溶剂,剩余物采用制备型hplc提纯,得到标题化合物(63.4mg,33%)。[c
19
h17brf3n4o7ps][m
‑
h]
‑
的esi
‑
ms m/z计算值:611.0;实测值:610.8。1h nmr(400mhz,meod)δ8.71(d,j=1.7hz,1h),8.63(s,1h),8.55(d,j=2.0hz,1h),8.38(t,j=1.9hz,1h),7.66(dd,j=8.8,6.7hz,2h),6.24(d,j=5.3hz,1h),5.43
‑
5.31(m,1h),5.13(dd,j=11.5,2.7hz,1h),4.55(t,j=5.9hz,1h),4.22(s,1h),3.77
‑
3.65(m,2h)。
[0362]
实例2
[0363]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0364][0365]
3,4
‑
二氯苯基
‑
4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0366][0367]
向3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(605mg,1.16mmol)的无水mecn(24ml)溶液中,加入苯甲醛二甲缩醛(0.87ml,5.79mmol)和樟脑磺酸(30mg,0.12mmol)的无水mecn(1ml)溶液。室温搅拌此透明黄色混合物。20分钟后,反应混合物变为浑浊的白色沉淀。2小时后,将溶剂蒸发,停止反应。加热条件下,将粗反应物溶于etoh(180ml)中,并在室温放置36小时让其结晶。将形成的晶体过滤并在真空下无水,得到呈无定形白色固体状的标题化合物(247mg,35%)。1h nmr((cd3)2so,400mhz):δ8.85(s,1h,ph),7.84
‑
7.76(m,3h,ph),7.63(d,j=8.6hz,1h,ph),
7.52(dd,j=8.6,2.1hz,1h,ph),7.39
‑
7.30(m,5h,ph),6.17(d,j=5.3hz,1h,h
‑
l),6.10(d,j=4.8hz,1h,oh
‑
2),5.57(s,1h,ch),5.09(dd,j=11.0,3.1hz,1h,h
‑
3),4.90(m,1h,h
‑
2),4.56(d,j=2.9hz,1h,h
‑
4),4.26(s,1h,h
‑
5),4.13(d,j=12.5hz,1h,h
‑
6),3.96(d,j=12.5hz,1h,h
‑
6)。
13
c nmr((cd3)2so,100mhz):δ137.8,135.1,131.7,131.5,130.9,130.7,129.4,128.7,128.0,125.9,122.8,109.5,109.3,99.4,88.2,74.1,68.3,64.2,63.1,61.5。[c
27
h
21
f3cl2n
304
s]
+
的hrms计算值:610.0582;实测值:610.0575。
[0368]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磷酸
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0369][0370]
将咪唑和3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷与甲苯共蒸发而变成无水。在n2气氛下,将pcl3(0.10ml,1.18mmol)的无水mecn:dcm 1:1(4ml)溶液用插管加入到咪唑(380mg,5,50mmol)的无水mecn:dcm 1:1(6ml)搅拌溶液中。此反应混合物变白/浅绿和浑浊。然后,将et3n(0.44ml,3.15mmol)的无水mecn:dcm 1:1(4ml)溶液用插管加入到搅拌溶液中。将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(240mg,0.39mmol)溶于无水mecn:dcm 1:1(50+10ml)中,并在25分钟内缓慢用插管加入到搅拌溶液中。在0℃搅拌此反应混合物45分钟,再加入吡啶:h2o 4:1(50ml)。tlc结果显示起始材料全部消耗完。将粗反应物浓缩,并通过柱色谱法提纯(sio2,dcm:meoh 10:1,含1%et3n)。将膦酸酯溶解在无水吡啶(9ml)中。加入tms
‑
cl(0.5ml,3.93mmol),在室温反应5分钟,然后加入碘(205mg,0.79mmol)的无水吡啶(1ml)溶液。搅拌10分钟,加入水(0.35ml),并将溶剂蒸发。粗反应物经反复柱色谱法纯化(sio2,dcm:meoh:h20 10:1:0
‑
>65:35:1)。将得到的固体材料溶于hoac(70%水溶液,20ml),并在40℃搅拌。30小时后,将溶剂蒸发,采用柱色谱法提纯粗反应物(sio2,dcm:meoh:h205:l:0
‑
>65:35:1),得到呈无定形白色固体状的标题化合物(48mg,20%)。1h nmr(meod,400mhz):δ8.55(s,1h,ph),7.64(dd,j=9.0,6.8hz,2h,ph)7.57(dd,j=8.4,2.2hz,1h,ph),7.49(d,j=8.4hz,1h,ph),6.08(d,j=5.4hz,1h,h
‑
l),5.41(m,1h,h
‑
2),5.17(dd,j=11.5,2.9hz,1h,h
‑
3)4.57(t,j=6.3hz,1h,h
‑
5),4.23(m,1h,h
‑
4),3.73(m,2h,h
‑
6)。
13
c nmr(meod,100mhz):δ135.3,135.3,133.6,133.0,131.9,123.2,111.0,110.8,89.2,73.6,71.0,69.9,64.3,64.2,64.1。[c
20
h
18
f3cl2n3o7ps]
+
的hrms计算值:601.9932;实测值:601.9934。
[0371]
实例3
[0372]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磺基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0373][0374]
将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(225mg,0.37mmol)和三氧化硫
‑
三乙胺复合物(560mg,3.82mmol)溶于无水的dmf(20ml)中,并在50℃搅拌。30小时后,将溶剂蒸发,用柱色谱法提纯粗反应物(sio2,etoac:庚烷9:1
‑
>1:0)。在柱色谱法之后,观察到溶剂蒸发期间出现部分脱硫。将粗反应物溶于hoac(90%水溶液,30ml),并在40℃搅拌22小时,然后将溶剂蒸发。采用柱色谱法提纯粗反应物(sio2,etoac:庚烷1:1
‑
>etoac:庚烷1:0),得到呈无定形白色固体状的标题化合物(48mg,22%)。1h nmr(meod,400mhz):δ8.56(s,1h,ph),7.83(d,j=2.1hz,1h,ph),7.62(dd,j=9.0,6.3hz,2h,ph),7.57(dd,j=8.3,2.1hz,1h,ph),7.48(d,j=8.3hz,1h,ph),6.24(d,j=5.3hz,1h,h
‑
l),5.48(dd,j=11.7,5.3hz,1h,h
‑
2),5.13(dd,j=11.7,2.9hz,1h,h
‑
3),4.56(t,j=6.1hz,1h,h
‑
5),4.26(d,j=2.8hz,1h,h
‑
4),4.12(d,j=7.2hz,1h,h
‑
6),4.08(d,j=7.2hz,1h,h
‑
6)。
[0375]
实例4
[0376]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磺基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0377][0378]5‑
溴吡啶
‑3‑
基
‑
4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0379][0380]
向5
‑
溴吡啶
‑3‑
基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.38mmol)的dmf(10ml)搅拌溶液中加入苯甲醛二甲缩醛(285mg,1.88mmol),然后加入d(+)
‑
10
‑
樟脑磺酸(17.4mg,0.075mmol)。在50℃、真空条件下
搅拌所得混合物3小时。lcms显示起始材料全部消耗完,并得到产品斑点。在剧烈搅拌条件下,将溶液逐滴加入到nahco3(100ml)水溶液中。然后,过滤,并用水洗涤,得到呈白色固体状的标题化合物(220mg,94%)。[c
26
h
20
brf3n4o4s][m+h]
+
的esi
‑
ms m/z计算值:621.0;实测值:621.1。1h nmr(400mhz,dmso)δ8.86(s,1h),8.67(d,j=1.5hz,1h),8.62(d,j=1.9hz,1h),8.28(s,1h),7.87
‑
7.72(m,2h),7.35(dt,j=9.8,4.9hz,5h),6.25(d,j=5.2hz,1h),6.17(d,j=4.8hz,1h),5.57(s,1h),5.12(dd,j=11.3,3.2hz,1h),4.91(dd,j=10.9,5.4hz,1h),4.57(d,j=2.9hz,1h),4.29(s,1h),4.12(d,j=12.2hz,1h),3.92(d,j=12.7hz,1h)。
[0381]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
磺基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0382][0383]
将5
‑
溴吡啶
‑3‑
基
‑
4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(50mg,0.081mmol)和三氧化硫
‑
三甲胺复合物(224mg,1.61mmol)溶于无水dmf(4.0ml)中,混合物在n2气氛下室温搅拌过夜,然后采用制备型hplc提纯。将所得材料溶于ch3co2h(1.60ml)和h2o(0.40ml)中。在50℃下搅拌反应4小时。脱除溶剂,剩余物用制备型hplc提纯,得到标题化合物(3.2mg,6%)。[c
19
h
16
brf3n4o7s2][m
‑
h]的esi
‑
ms m/z计算值:611.0;实测值:611.0。1hnmr(400mhz,meod)δ8.71(s,1h),8.56(s,2h),8.35(s,1h),7.75
‑
7.49(m,2h),6.26(d,j=5.3hz,1h),5.49(dd,j=11.7,5.3hz,1h),5.16(dd,j=11.8,2.6hz,1h),4.56(dd,j=13.5,7.6hz,1h),4.27(s,1h),3.71(d,j=6.0hz,2h)。
[0384]
实例5
[0385]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(磷酰氧基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0386][0387]5‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(二
‑
叔丁基
‑
磷酰氧基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0388][0389]
在氮气气氛下,将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.32mmol)、氧化银(149mg,0.64mmol)、nai(96.5mg,0.644mmol)和分子筛(500mg)溶于dmf(6ml)中。加入二叔丁基氯甲基磷酸酯(167mg,0.644mmol)的dmf(0.5ml)溶液。室温搅拌反应过夜,lcms显示所有起始材料都消耗完。通过过滤反应物,并脱除溶剂。剩余物用制备型hplc提纯,得到呈白色固体状的标题化合物(260mg,96%)。1h nmr(400mhz,dmso)δ8.73(s,1h),8.70(d,j=1.9hz,1h),8.68(d,j=2.1hz,1h),8.30(t,j=2.0hz,1h),7.72(dd,j=8.9,6.7hz,2h),7.34(s,5h),6.40(d,j=5.1hz,1h),5.62(s,1h),5.30(dd,j=11.6,3.2hz,1h),5.19(dd,j=9.8,5.7hz,1h),5.13(dd,j=9.8,5.8hz,1h),5.04(dd,j=11.5,5.2hz,1h),4.65(d,j=3.1hz,lh),4.42(s,1h),4.14(d,j=11.6hz,1h),4.01(d,j=11.7hz,1h),1.31(d,j=4.0hz,18h)。
[0390]5‑
溴吡啶
‑3‑
基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(磷酰氧基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0391][0392]
将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(二
‑
叔丁基
‑
磷酰氧基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(210mg,0.25mmol)溶于10%(v/v)tfa的dcm中,混合物搅拌反应4小时。lcms表明所有起始材料都消耗完,产物是主峰。脱除溶剂,剩余物采用制备型hplc提纯,得到呈白色固体状的标题化合物(73.6mg,46%)。[c
20
h
19
brf3n4o8ps][m
‑
h]
+
的esi
‑
ms m/z计算值:643.0;实测值:643.1。1hnmr(400mhz,meod)δ8.79
‑
8.64(m,2h),8.54(d,j=2.0hz,1h),8.37(s,1h),7.79
‑
7.61(m,2h),6.36(d,j=5.1hz,1h),5.20(dd,j=11.6,5.2hz,1h),5.16
‑
5.08(m,2h),4.94
‑
4.89(m,1h),4.48(t,j=5.9hz,1h),4.18(s,1h),3.76
‑
3.59(m,2h)。
[0393]
实例6
[0394]
3,4
‑
二氯苯基2
‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0395][0396]
3,4
‑
二氯苯基
‑
4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
(甲氧基羰基)甲基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0397][0398]
将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.33mmol)和nah(60%油溶液,20mg,0.52mmol)溶于无水dmf(21ml)中,并在室温搅拌。30分钟后,向溶液中加入溴乙酸甲酯(0.06ml,0.66mmol),将温度升高到50℃,搅拌21小时。蒸发大约50%的溶剂,用dcm(30ml)稀释剩余粗反应物,加入0.5m柠檬酸(30ml)。用水(3
×
30ml)洗涤有机相,然后干燥。采用柱色谱法提纯剩余物(sio2,庚烷:etoac 4:1),得到呈无定形白色固体状的标题化合物(88mg,39%)。1h nmr(cdcl3,400mhz):δ8.36(s,1h,ph),8.64(d,j=2.1hz,1h,ph),7.79(dd,j=8.5,6.6hz,2h,ph),7.41(d,j=8.4hz,1h,ph),7.37(s,5h,ph),7.35(dd,j=8.5,2.1hz,1h,ph),6.22(d,j=5.1hz,1h,h
‑
l),5.51(s,1h,ch),5.31(dd,j=11.3,3.3hz,1h,h
‑
3),4.98(dd,j=11.2,5.1hz,1h,h
‑
2),4.57(d,j=3.2hz,1h,h
‑
4),4.34(s,1h,h
‑
5),4.31(dd,j=12.7,1.8hz,1h,h
‑
6),4.16(dd,j=12.7,1.8hz,1h,h
‑
6),4.11(d,j=ml,1h,ch2),4.02(d,j=17.2hz,1h,ch2),3.68(s,3h,ch3)。
13
c nmr((cd3)2so,100mhz):δ170.0,136.9,133.4,132.2,132.0,131.0,130.1,129.4,128.5,125.8,121.5,110.0,109.8,100.8,85.9,75.1,72.0,69.1,65.6,63.5,61.0,52.3。[c
30
h
25
f3cl2n3o6s]
+
的hrms计算值:682.0793;实测值:682.0792。
[0399]
3,4
‑
二氯苯基
‑2‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0400][0401]
将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基l]
‑2‑
o
‑
(甲氧基羰基)甲基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(52mg,0.072mmol)溶于hoac(90%水溶液,50ml)中,并在40℃下搅拌。19小时后,加热到90℃,再搅拌反应3小时,然后将溶剂蒸发。将剩余粗反应物和lioh(40mg,1.67mmol)一起溶于thf:h2o(10:1,16.5ml)中,搅拌1小时,然后采用dowex 50w
‑
x8(h
+
)树脂淬灭,并采用柱色谱法(sio2,etoac:庚烷3:1)提纯,得到呈无定形白色固体状的标题化合物(33mg,75%)。1h nmr(meod,400mhz):δ8.79(s,1h,ph),7.82(d,j=2.1hz,1h,ph),7.62(dd,j=9.0,6.7hz,2h,ph),7.56(dd,j=8.4,2.1hz,1h,ph),7.48(d,j=1a hz,1h,ph),6.24(d,j=5.2hz,1h,h
‑
l),5.07(dd,j=11.3,2.9hz,1h,h
‑
3),4.95(dd,j=11.3,5.4hz,1h,h
‑
2),4.49(t,j=6.1hz,1h,h
‑
5),4.27(d,j=2.5hz,1h,h
‑
4),4.24(d,j=16.9hz,1h,ch2),4.18(d,j=16.9hz,1h,ch2),3.73(dd,j=11.6,5.7hz,1h,h
‑
6),3.68(dd,j=11.6,6.7hz,1h,h
‑
6)。
13
c nmr(meod,100mhz):δ173.1,145.3,135.3,135.2,133.6,133.4,132.7,131.8,123.9,110.9,110.6,87.7,73.8,73.3,69.8,66.7,64.5,62.1。[c
22
h
19
f3cl2n
306
s]
+
的hrms计算值:580.0324;实测值:580.0321。
[0402]
实例7
[0403]
3,4
‑
二氯苯基2
‑
o
‑
羧甲基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0404][0405]
3,4
‑
二氯苯基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0406]
[0407]
将五水硫酸铜(ii)(127mg,0.5mmol)溶于热水(5.0ml)中,并加入到l(+)
‑
抗坏血酸钠(198mg,1.0mmol)中。将所得褐色分散液加入到3,4
‑
二氯苯基3
‑
叠氮
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(2.33g,4.7mmol)、k2co3(6.5g,47mmol)和三甲基
‑
[2
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)乙炔基]硅烷(1.40g,5.68mmol)的meoh(20ml)和thf(20ml)溶液的混合物中。将所得混合物在50℃下搅拌20小时,加入硅藻土,将混合物过滤,滤饼用etoac/meoh洗涤。将滤液在etoac和hc1(0.5m)水溶液之间分配,并将有机相浓缩。剩余物采用色谱(sio2,pe/etoac)提纯,将粗产物在mecn(30ml)中捣碎,得到产物(1.73g,68%)。[c
20
h
16
cl3f2n3o4s][m+h]
+
的esi
‑
ms m/z计算值:538.0;实测值:538.0。1h nmr(400mhz,甲醇
‑
d4)δ8.60(s,1h),7.80(d,j=2.0hz,1h),7.67(d,j=8.0hz,2h),7.54(dd,j=8.4,2.0hz,1h),7.48(d,j=8.4hz,1h),5.85(d,j=5.2hz,1h),4.99(dd,j=11.4,2.7hz,1h),4.96
‑
4.90(m,1h),4.49(t,j=6.0hz,lh),4.20(d,j=1.9hz,1h),3.77
‑
3.66(m,2h)。
[0408]
3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0409][0410]
向3,4
‑
二氯苯基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(1.73g,3.2mmol)的mecn(40ml)溶液中,加入溶于苯甲醛二甲缩醛(0.974ml,6.46mmol),然后加入对甲苯磺酸(50mg,0.26mmol)。将悬浮液室温搅拌72小时,然后冷却到0℃,过滤得到产品(1.876g,93%)。1h nmr(400mhz,dmso
‑
de)δ8.92(s,1h),7.86
‑
7.75(m,3h),7.63(d,j=8.5hz,1h),7.52(dd,j=8.5,2.0hz,1h),7.35(dt,j=11.3,3.9hz,5h),6.18(d,j=5.2hz,1h),6.13(d,j=4.7hz,1h),5.57(s,1h),5.10(dd,j=11.3,3.2hz,1h),4.91(dt,j=10.9,5.0hz,1h),4.56(d,j=3.0hz,1h),4.29(s,1h),4.13(d,j=12.1hz,1h),3.96(d,j=12.4hz,1h)。
[0411]
3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
(甲氧基羰基)甲基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0412][0413]
将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(800mg,1.28mmol)和nah(60%油溶液,77mg,1.91mmol)在dmf(3.0ml)中搅拌5分钟,然后加入溴乙酸甲酯(0.16ml,1.66mmol)。将混合物
室温搅拌2小时,然后倒至冰冷的水(30ml)和hcl(4ml,1m)上。过滤分离得到固体,并在etoac/pe中重新结晶得到产品(746mg,84%)。1h nmr(400mhz,dmso
‑
de)δ8.97(s,1h),7.86(d,j=1.9hz,1h),7.73(d,j=8.5hz,2h),7.66(d,j=8.4hz,1h),7.54(dd,j=8.3,1.8hz,1h),7.34(s,5h),6.61(d,j=5.2hz,1h),5.59(s,1h),5.23(dd,j=11.5,3.2hz,1h),4.87(dd,j=11.4,5.1hz,1h),4.61(d,j=3.1hz,1h),4.34(s,1h),4.31(s,2h),4.14(d,j=12.6hz,1h),3.99(d,j=12.5hz,1h),3.54(s,3h)。
[0414]
3,4
‑
二氯苯基3
‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
羧甲基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0415][0416]
将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
(甲氧基羰基)甲基
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(721mg,1.103mmol)在80%tfa水溶液(10ml)中搅拌30分钟,将混合物浓缩,加入水产生沉淀。过滤收集沉淀,然后,在etoh(5.0ml)和naoh(3.0ml,2m)中搅拌2小时。采用hcl(1m)中和混合物,浓缩,加入水,采用hcl(1m)将ph调节到大约1。收集沉淀,然后在meoh/水中捣碎,收集固体,并向所得粗产物中加入meoh(3.0ml)和28%氨水(0.20ml)。将混合物浓缩至干燥,然后在et2o中捣碎,收集沉淀,得到呈铵盐形式的产物(381mg,60%)。[c
22
h
18
cl3f2n3o6s][m+h]
+
的esi
‑
ms m/z计算值:596.0;实测值:596.1。1h nmr(400mhz,甲醇
‑
d4)δ9.18(s,1h),7.83(d,j=1.9hz,1h),7.67(d,j=8.1hz,2h),7.57(dd,j=8.4,1.8hz,1h),7.48(d,j=8.4hz,1h),6.24(d,j=3.9hz,1h),5.05(m,2h),4.48(t,j=6.1hz,1h),4.29(s,1h),4.04(d,j=15.7hz,1h),3.96(d,j=15.7hz,1h),3.76
‑
3.63(m,2h)。
[0417]
实例8
[0418]5‑
溴吡啶
‑3‑
基2
‑
o
‑
羧甲基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0419][0420]
将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(1.00g,1.6mmol)和nah(60%油溶液,100mg,2.4mmol)在dmf(5ml)中搅拌10分钟。加入溴乙酸甲酯(230μl,2.4mmol),搅拌混合物1小时,
然后倒至冰冷的水(50ml)和hcl(1m,5ml)上。过滤分离固体,然后将其在etoh(20ml)和2m naoh(4ml)的混合物中搅拌。形成凝胶,用hcl酸化反应混合物,然后在热etoac和水之间分配,分离并蒸发有机相。将剩余物溶解在甲酸(20ml)和水(2ml)的混合物中,并在40℃下搅拌2小时,然后,蒸发,并在40℃于etoh(20ml)和2m naoh(4ml)的混合物中水解1小时。将混合物浓缩,加入水,然后加入hcl(ph 1
‑
2),过滤收集沉淀,采用色谱法提纯(sio2,etoac/meoh;10/1
‑
2/1
‑
0/1)。收集级分,蒸发,将剩余物溶于meoh(10ml)和氢氧化铵(28%水溶液,1ml)的混合物中。脱除挥发性物质,剩余物在乙醚中捣碎,得到呈铵盐形式的标题化合物(365mg,37%)。[c
21
h
18
brf3n4o6s]
+
[m
‑
h]
+
的esi
‑
ms m/z计算值:591.0;实测值:591.1。1h nmr(400mhz,甲醇
‑
d4)δ9.06(s,1h),8.69(d,j=1.5hz,1h),8.55(d,j=1.8hz,1h),8.36(s,1h),7.72
‑
7.60(m,2h),6.33(d,j=3.8hz,1h),5.06(m,2h),4.48(t,j=6.0hz,1h),4.29(s,1h),4.05(d,j=16.0hz,1h),3.99(d,j=15.7hz,1h),3.69(m,2h)。
[0421]
实例9
[0422]
3,4
‑
二氯苯基3
‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
[2
‑
(甲基磺酰胺基)
‑2‑
氧乙基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0423][0424]
3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
[2
‑
(甲基磺酰胺基)
‑2‑
氧乙基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0425][0426]
在室温条件下,向3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(130mg,0.21mmol)的dmf(5.0ml)中加入nah(19.1mg,0.83mmol)。搅拌混合物30分钟,一次性加入2
‑
氯
‑
n
‑
甲磺酰基
‑
乙酰胺(214mg,1.24mmol)。搅拌反应过夜,然后用etoac萃取三次。将有机相蒸发,并采用硅胶色谱提纯,得到标题化合物(106mg,67%)。[c
30
h
25
cl3f2n4o7s2][m+h]
+
的esi
‑
ms m/z计算值:761.0;实测值:760.9。1h nmr(400mhz,cdc13)δ8.29(s,1h),7.59(s,1h),7.48
‑
7.28(m,9h),
6.13(d,j=5.0hz,1h),5.48(s,1h),5.33
‑
5.18(m,1h),4.84(dd,j=11.1,5.1hz,1h),4.51(s,1h),4.31(s,1h),4.18(dd,j=ma,12.9hz,2h),3.98(dd,j=35.8,16.0hz,2h),3.12(s,3h)。
[0427]
3,4
‑
二氯苯基3
‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
[2
‑
(甲基磺酰胺基)
‑2‑
氧乙基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0428][0429]
将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
[2
‑
(甲基磺酰胺基)
‑2‑
氧乙基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(100mg,0.13mmol)溶于tfa/dcm(1/20)中,并在室温下搅拌溶液2小时。真空脱除溶剂,剩余物采用制备型hplc提纯,得到标题化合物(12.0mg,14%)。[c
23
h
21
cl3f2n4o7s2][m+h]
+
的esi
‑
ms m/z计算值:673.0;实测值:672.9。1h nmr(400mhz,meod)δ8.79(s,1h),7.74(d,j=1.9hz,1h),7.59(d,j=8.1hz,2h),7.47(dd,j=8.4,1.9hz,1h),7.39(d,j=8.4hz,1h),6.14(d,j=4.9hz,1h),4.96(m,2h),4.39(t,j=6.0hz,1h),4.15(s,1h),4.05(d,j=4.0hz,2h),3.60(dd,j=12.1,5.2hz,2h),3.04(s,3h)。
[0430]
实例10
[0431]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
(恶唑
‑4‑
基甲基)
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0432][0433]
在0℃下,将nah(60%油溶液,38mg,1.0mmol)加入到恶唑
‑4‑
基甲醇(24mg,0.24mmol)的thf(1ml)溶液中,45分钟后,加入甲磺酰氯(28mg,0.24mmol),15分钟后加入5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(124mg,0.20mmol)的thf(1ml)溶液。所得混合物在1小时内达到室温,并在40℃下加热4小时。混合物采用etoac稀释,并用水和盐水洗涤,将有机相干燥、蒸发,剩余物采用色谱法提纯(sio2,石油醚/etoac,3/1
‑
1/1)。将所得产物用80%tfa水溶液(1ml)处理30min,将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化
合物(64mg,52%)。[c
23
h
19
brf3n5o5s][m+h]
+
的esi
‑
ms m/z计算值:614.0;实测值:614.0,1h nmr(400mhz,甲醇
‑
d4)δ8.70(d,j=1.6hz,1h),8.59(d,j=1.9hz,1h),8.46(s,1h),8.37(t,j=1.8hz,1h),8.07(s,1h),7.80(s,1h),7.68
‑
7.58(m,2h),6.27(d,j=5.3hz,1h),5.08(dd,j=11.3,2.7hz,1h),4.89
‑
4.81(m,1h),4.64(d,j=12.7hz,1h),4.53(d,j=12j hz,1h),4.47(t,j=5.9hz,1h),4.26
‑
4.19(m,1h),3.76
‑
3.65(m,2h)。
[0434]
实例11
[0435]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
(3,5
‑
二氟
‑4‑
羟基苄基)
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0436][0437]4‑
(氯甲基)
‑
2,6
‑
二氟苯基甲磺酸酯
[0438][0439]
将3,5
‑
二氟
‑4‑
羟基苯甲酸(1.00g,5.45mmol)、咪唑(1.05g,15.26mmol)和叔丁基二甲基氯硅烷(3.12g,20mmol)在dmf(6ml)中搅拌20小时,然后在乙醚和水之间分配。将有机相蒸发,然后溶于thf(5ml),并在50℃下用bh
3x
thf(15ml,15mmol)处理4小时。混合物用meoh(2ml)淬灭、蒸发,并在50℃于meoh中搅拌1小时。蒸发,将剩余物在ph 4下在乙醚和水之间分配。将有机相蒸发,剩余物溶于1m naoh和乙醇混合物中,加入hcl水溶液,调节ph至1
‑
2,混合物在乙醚和水之间分配。将有机相蒸发,得到主要为3,5
‑
二氟
‑4‑
羟基苯甲酸的605mg材料,1h nmr(400mhz,dmso
‑
de)δ13.08(s,1h),11.16(s,1h),7.58
‑
7.47(m,2h)。将该材料用氢化锂铝(2m thf溶液,4ml)和thf(4ml)回流6小时。采用水和乙酸处理,并过滤和萃取(etoac/水,ph 4),得到362mg 3,5
‑
二氟
‑4‑
羟基
‑
苯甲醇,其足够纯可用于进一步反应。1h nmr(400mhz,dmso
‑
de)δ10.03(bs,1h),6.94(m,2h),5.23(bs,1h),4.38(s,2h)。将该材料(362mg,2.27mmol)溶于dcm(6ml)和三乙胺(14mmol,1.94ml)中。加入甲磺酰氯(530μl,6.8mmol),搅拌混合物18小时,然后在0.2m hcl和etoac之间分配,将有机相分离、浓缩,并采用色谱法提纯(sio2,etoac/pe:1/1)得到标题化合物(339mg,1.07mmol)。1h nmr(400mhz,氯仿
‑
d)δ7.11(d,j=8.1hz,2h),4.53(s,2h),3.34(s,3h)。
[0440]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
(3,
5
‑
二氟
‑4‑
羟基苄基)
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0441][0442]
将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(582mg,0.84mmol)和nah(60%油溶液,44mg,1.1mmol)在dmf(3ml)中搅拌15分钟。加入4
‑
(氯甲基)
‑
2,6
‑
二氟苯基甲磺酸酯(0.74mmol,200mg)的dmf(1ml)溶液,搅拌混合物4小时,然后倒至冰冷的水(20ml)和hcl(1m,2ml)上。将固体过滤分离,然后在meoh(5ml)、thf(4ml)和koh(2ml,5m)混合物中搅拌18小时。混合物用hcl(ph 1
‑
2)酸化,过滤分离固体(554mg)。将该材料在80%tfa水溶液(4ml)中搅拌2小时,然后在etoac/水之间分配,将有机相分离、干燥和浓缩。采用色谱法(sio2,etoac/pe;1/1)进一步提纯,得到粗的标题化合物(111mg)。将该材料(110mg)用hplc(c
18
,h2o/mecn/0.1%tfa)提纯,采用hplc分析纯级分,并汇合在一起,浓缩期间晶体沉淀出来,收集晶体,得到标题化合物(69mg,14%)。[c
26
h
20
brf5n4o5s][m+h]
+
的esi
‑
ms m/z计算值:675.0;实测值:675.1,1h nmr(400mhz,dmso
‑
de)δ10.10(s,1h),8.75(s,1h),8.71(d,j=1.4hz,1h),8.65(d,j=1.9hz,1h),8.35(s,1h),7.84
‑
7.71(m,2h),6.73(d,j=8.0hz,2h),6.35(d,j=5.2hz,1h),5.64(d,j=6.1hz,1h),4.95(dd,j=11.4,2.5hz,1h),4.77(s,1h),4.65(dd,j=11.4,5.3hz,1h),4.61(d,j=11.7hz,1h),4.39(d,j=11.7hz,1h),4.31(t,j=6.1hz,1h),4.09(s,1h),3.52(s,1h),3.49
‑
3.38(m,1h)。
[0443]
实例12
[0444]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0445][0446]
将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.32mmol)和nah(60%油溶液,19mg,0.48mmol)在dmf(2ml)中搅拌30分钟。加入5
‑
(氯甲基)四唑(50mg,0.42mmol)的dmf(1ml)溶
液,室温搅拌混合物2小时,然后采用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下在80%tfa水溶液(3ml)中搅拌1小时。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(87mg,44%)。[c
21
h
18
brf3n8o4s][m+h]
+
的esi
‑
ms m/z计算值:615.0;实测值:615.1,1h nmr(400mhz,甲醇
‑
d4)δ8.66(s,1h),8.60(s,1h),8.42(s,1h),8.35(s,1h),7.62
‑
7.55(m,2h),6.29(d,j=5.3hz,1h),5.13(dd,j=11.3,2.7hz,1h),5.07(d,j=13.6hz,1h),5.01
‑
4.93(m,2h),4.49(t,j=6.0hz,1h),4.21(d,j=2.4hz,1h),3.71(d,j=6.2hz,2h)。
[0447]
实例13
[0448]
3,4
‑
二氯苯基3
‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0449][0450]
将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.32mmol)和nah(60%油溶液,31mg,0.81mmol)在dmf(2ml)中搅拌15分钟。加入5
‑
(氯甲基)四唑(189mg,1.60mmol)的dmf(1.5ml)溶液,在50℃下搅拌混合物4小时,然后采用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下于80%tfa水溶液(4ml)中搅拌1小时。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(17mg,9%)。[c
22
h
18
cl3f2n7o4s][m+h]
+
的esi
‑
ms m/z计算值:620.0;实测值:620.1,1h nmr(400mhz,甲醇
‑
d4)δ8.47(s,1h),7.78(s,1h),7.60(d,j=8.0hz,2h),7.49(s,2h),6.19(d,j=5.3hz,1h),5.11(dd,j=11.4,2.7hz,1h),5.04(d,j=13.6hz,1h),4.98
‑
4.92(m,2h),4.49(t,j=6.0hz,1h),4.20(s,1h),3.76
‑
3.66(m,2h)。
[0451]
实例14
[0452]
3,4
‑
二氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0453][0454]
将3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三
唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.33mmol)和nah(60%油溶液,63mg,1.64mmol)在dmf(2.5ml)中搅拌30分钟。加入5
‑
(氯甲基)四唑(58mg,0.49mmol)的dmf(0.5ml)溶液,在50℃下搅拌混合物1小时,然后用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下于80%tfa水溶液(4ml)中搅拌1小时。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(10mg,5%)。[c
22
h
18
cl2f3n7o4s][m+h]
+
的esi
‑
ms m/z计算值:604.1;实测值:604.1,1h nmr(400mhz,甲醇
‑
d4)δ8.42(s,1h),7.77(s,1h),7.64
‑
7.55(m,2h),7.50
‑
7.47(m,2h),6.19(d,j=5.3hz,1h),5.10(dd,j=11.3,2.6hz,1h),5.04(d,j=13.6hz,1h),4.98
‑
4.91(m,2h),4.49(t,j=6.0hz,1h),4.20(d,j=2.6hz,1h),3.76
‑
3.66(m,2h)。
[0455]
实例15
[0456]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
咪唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0457][0458]
将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(150mg,0.24mmol)和nah(60%油溶液,46mg,1.21mmol)在dmf(3ml)中搅拌10分钟,然后加入2
‑
(氯甲基)
‑
1h
‑
咪唑盐酸盐(101mg,0.60mmol)。将混合物在40℃下搅拌2小时,然后采用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下于80%tfa水溶液(3ml)中搅拌1小时。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(4mg,3%)。[c
23
h
20
brf3n6o4s][m+h]
+
的esi
‑
ms m/z计算值:613.0;实测值:613.1,1h nmr(400mhz,甲醇
‑
d4)δ8.67(s,1h),8.60(s,1h),8.50(s,1h),8.35(t,j=1.9hz,1h),7.64
‑
7.57(m,2h),7.44(s,2h),6.26(d,j=5.3hz,1h),5.16(dd,j=11.3,2.8hz,1h),5.08
‑
5.00(m,2h),4.88
‑
4.87(m,1h),4.51(t,j=5.9hz,1h),4.23(s,1h),3.76
‑
3.67(m,2h)。
[0459]
实例16
[0460]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1
‑
甲基
‑
1h
‑
咪唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0461][0462]
将socl2(106μl,1.45mmol)缓慢加入到(1
‑
甲基咪唑
‑2‑
基)甲醇盐酸盐(59mg,0.36mmol)的dcm(1ml)溶液中,并室温搅拌10分钟。将混合物蒸发,并真空干燥。将剩余物溶于dmf(1ml)中,并加入到5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(150mg,0.24mmol)和nah(60%油溶液,46mg,1.21mmol)的dmf(2ml)搅拌溶液中。将混合物在40℃下搅拌3小时,然后采用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下在80%tfa水溶液(3ml)中搅拌40分钟。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(9mg,6%)。[c
24
h
22
brf3n6o4s][m+h]
+
的esi
‑
ms m/z计算值:627.1;实测值:627.1,1h nmr(400mhz,甲醇
‑
d4)δ8.70(s,1h),8.62(s,1h),8.55(s,1h),8.38(s,1h),7.67
‑
7.61(m,2h),7.48(s,1h),7.46(s,1h),6.32(d,j=5.3hz,1h),5.17
‑
5.09(m,2h),5.04(dd,j=11.1,5.6hz,1h),4.88
‑
4.87(m,1h),4.51(t,j=5.9hz,1h),4.24(s,1h),3.73(d,j=6.4hz,2h),3.62(d,j=4.0hz,3h)。
[0463]
实例17
[0464]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(恶唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0465][0466]
将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(150mg,0.24mmol)和nah(60%油溶液,37mg,0.97mmol)在dmf(3ml)中搅拌5分钟,然后加入2
‑
(氯甲基)恶唑(62mg,0.48mmol)。将混合物在40℃下搅拌90分钟,然后用etoac稀释,并用水洗涤。将有机相干燥、蒸发,剩余物在室温下于80%tfa水溶液(3ml)中搅拌30分钟。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(16mg,11%)。[c
23
h
19
brf3n5o5s][m+h]
+
的esi
‑
ms m/z计算值:614.0;实测值:614.1,1h nmr(400mhz,甲醇
‑
d4)δ8.68(d,j=1.9hz,1h),8.60(d,j=2.1hz,1h),8.49(s,1h),8.365(t,j=2.0hz,1h),7.80
‑
7.77(m,1h),7.63(dd,j=8.8,6.6hz,2h),7.10(s,1h),6.23(d,j=5.3hz,1h),5.09(dd,j=11.3,2.8hz,1h),4.94(dd,j=11.3,
5.3hz,1h),4.76(d,j=13.3hz,1h),4.68(d,j=13.3hz,1h),4.48(t,j=5.9hz,1h),4.21(s,1h),3.73
‑
3.69(m,2h)。
[0467]
实例18
[0468]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(恶唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0469][0470]
向5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(300mg,0.48mmol)和nah(60%油溶液,56mg,1.45mmol)的dmf(2ml)溶液中加入5
‑
(溴甲基)恶唑(195mg,1.21mmol)的dmf(0.5ml)溶液。将混合物在50℃下搅拌3小时,然后用etoac稀释,并用水和盐水洗涤。将有机相进行干燥,蒸发,剩余物采用色谱法(sio2,etoac/pe)提纯。将产物在室温下于80%tfa水溶液(4ml)中搅拌1小时。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(121mg,41%)。[c
23
h
19
brf3n5o5s][m+h]
+
的esi
‑
ms m/z计算值:614.0;实测值:614.1,1h nmr(400mhz,甲醇
‑
d4)δ8.70
‑
8.67(m,1h),8.60
‑
8.57(m,1h),8.41
‑
8.39(m,1h),8.37
‑
8.33(m,1h),8.01(s,1h),7.64
‑
7.59(m,2h),7.09(s,1h),6.23(d,j=5.3hz,1h),5.07(dd,j=11.2,2.7hz,1h),4.87(被水遮盖,1h),4.75(d,j=13.4hz,1h),4.62(d,j=13.4hz,1h),4.46(t,j=6.0hz,1h),4.20(d,j=2.9hz,1h),3.76
‑
3.63(m,2h)。
[0471]
实例19
[0472]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(异恶唑
‑3‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0473][0474]
向5
‑
溴吡啶
‑3‑
基
‑
4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(352mg,0.54mmol)、nai(82mg,0.54mmol)和3
‑
(氯甲基)异恶唑(100mg,0.81mmol)的dmf(2ml)溶液中加入nah(60%油溶液,65mg,1.62mmol)。将混合物在50℃下搅拌2.5小时,然后倒至冰冷的水(20ml)和hcl(1m,5ml)上。将固体过滤分离,并在meoh(3ml)、水(1ml)和28%nh3(一滴)中结晶。将结晶分离,然后在室温下于80%
tfa水溶液(3ml)中搅拌1小时。将混合物倒至冰和naoh(5m,16ml)上。将沉淀过滤分离,采用色谱法提纯(sio2,etoac/pe)。产物从etoac/pe中结晶,得到标题化合物(105mg,31%)。[c
23
h
19
brf3n5o5s][m+h]
+
的esi
‑
ms m/z计算值:614.0;实测值:614.1,1h nmr(400mhz,甲醇
‑
d4)δ8.68(d,j=1.7hz,1h),8.58(d,j=2.0hz,1h),8.49(s,1h),8.34(t,j=2.0hz 1h),7.63(m,2h),6.26(d,j=5.3hz,1h),6.20(s,1h),5.11(dd,j=11.3,2.8hz,1h),4.88(dd,j=11.3,5.3hz,1h),4.83(d,j=12.6hz,1h),4.66(d,j=12.6hz,1h),4.49(t,j=6.0hz,1h),4.21(d,j=2.6hz,1h),3.76
‑
3.65(m,2h)。
[0475]
实例20
[0476]
3,4
‑
二氯苯基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑2‑
o
‑
[(恶唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0477][0478]
将恶唑
‑4‑
基甲醇(40mg,0.38mmol)溶于thf(1ml)中,并冷却至0℃,然后加入nah(60%油溶液,61mg,1.60mmol)。45分钟后,加入甲磺酰氯(30μl,0.38mmol),15分钟后加入3,4
‑
二氯苯基4,6
‑
o
‑
亚苄基
‑3‑
[4
‑
(4
‑
氯
‑
3,5
‑
二氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.32mmol)和thf(1ml)。让混合物在1小时内达到室温,然后在40℃下搅拌4小时。混合物用etoac(20ml)稀释,用水(20ml)和盐水(20ml)洗涤,将有机相进行干燥并蒸发。剩余物在室温下于80%tfa水溶液(3ml)中搅拌1小时。加入冷水,并进行倾析,剩余物从异丙醇中共蒸发。剩余物采用色谱法(sio2,etoac/pe)提纯。产物进一步采用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(36mg,16%)。[c
24
h
19
cl3f2n4o5s][m+h]
+
的esi
‑
ms m/z计算值:619.0;实测值:619.1,1h nmr(400mhz,甲醇
‑
d4)δ8.74(s,1h),8.25(s,1h),7.91(s,1h),7.86(d,j=2.0hz,1h),7.79(d,j=8.3hz,2h),7.62(d,j=8.4hz,1h),7.54(dd,j=8.4,2.0hz,1h),6.34(d,j=5.1hz,1h),5.59(d,j=6.2hz,1h),4.90(dd,j=11.4,2.7hz,1h),4.76
‑
4.67(m,3h),4.59(d,j=12.6hz,1h),4.50(d,j=12.6hz,1h),4.27(t,j=5.9hz,1h),4.12‑4.03(m,1h),3.52(m,1h),3.43(m,1h)。
[0479]
实例21
[0480]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0481][0482]
将5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.32mmol)和nah(60%油溶液,49mg,1.29mmol)在dmf(3ml)中搅拌10分钟,然后加入4
‑
(氯甲基)噻唑盐酸盐(90mg,0.48mmol)。将混合物在40℃下搅拌3小时,然后用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下于80%tfa水溶液(3ml)中搅拌1小时。将混合物浓缩,并采用色谱法(sio2,etoac/pe)提纯。产物进一步采用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(75mg,37%)。[c
23
h
19
brf3n5o4s2][m+h]
+
的esi
‑
ms m/z计算值:630.0;实测值:630.1,1h nmr(400mhz,甲醇
‑
d4)δ8.89(d,j=1.9hz,1h),8.68(d,j=1.9hz,1h),8.59(d,j=2.1hz,1h),8.35(d,j=1.9hz 1h),7.64
‑
7.57(m,2h),6.22(d,j=5.3hz,1h),5.10(dd,j=11.3,2.7hz,1h),4.91
‑
4.86(m,1h),4.71(d,j=12.5hz,1h),4.48(t,j=6.0hz,1h),4.22(s,1h),3.75
‑
3.65(m,2h)。
[0483]
实例22
[0484]5‑
溴吡啶
‑3‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0485][0486]
将5
‑
羟甲基噻唑(131mg,1.08mmol)在dcm(1.5ml)中搅拌,加入亚硫酰氯(300μl,4.0mmol),并在室温搅拌混合物10分钟。将混合物蒸发、干燥,并与5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(335mg,0.54mmol)和nai(162mg,1.08mmol)在dmf(3.0ml)中一起搅拌5分钟。将混合物冷却到0℃,并加入nah(60%油溶液,132mg,3.3mmol)。将混合物在室温下搅拌2小时,然后倒至冰冷的水(30ml)和hcl(1m,5ml)上。将固体过滤分离,然后在meoh(4ml)、水(1ml)和nh3(一滴)中搅拌过夜。将沉淀过滤分离,然后在80%tfa水溶液(4ml)中搅拌30分钟。将混合物浓缩到体积约2ml,然后倒至冰和naoh(1m,20ml)上。将沉淀过滤分离,然后在etoac中搅拌,产生结晶。将结晶分离,并从hoac和水中重结晶,得到标题化合物(63mg,19%)。[c
23
h
19
brf3n5o4s2][m+h]
+
的esi
‑
ms m/z计算值:630.0;实测值:630.1,1h nmr(400mhz,甲
醇
‑
d4)δ8.84(s,1h),8.69(s,1h),8.58(d,j=1.7hz,1h),8.44(s,1h),8.34(s,1h),7.76
‑
7.57(m,2h),6.25(d,j=5.3hz,1h),5.10(dd,j=11.3,2.7hz,1h),5.01(d,j=12.6hz,1h),4.86(dd,j=11.3,5.3hz,1h),4.79(d,j=12.5hz,1h),4.48(t,j=6.0hz,1h),4.21(s,1h),3.76
‑
3.65(m,2h)。
[0487]
实例23
[0488]5‑
溴吡啶
‑3‑
基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑2‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0489][0490]
将l,3
‑
噻唑
‑
2基甲醇(132mg,1.08mmol)在dcm(2ml)中搅拌,加入亚硫酰氯(300μl,4.0mmol),并在室温下搅拌混合物5分钟。将混合物蒸发、干燥,并与5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(224mg,0.36mmol)在dmf(3.0ml)中一起搅拌。加入nah(60%油溶液,160mg,4.0mmol)。将混合物在室温下搅拌18小时,然后倒至冰冷的水(20ml)和hcl(1m,5ml)上。将固体过滤分离,并采用色谱法提纯(sio2,etoac/pe)。将产物在80%tfa水溶液(1.5ml)中搅拌1小时。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(35mg,13%)。[c
23
h
19
brf3n5o4s2][m+h]
+
的esi
‑
ms m/z计算值:630.0;实测值:629.7,1h nmr(400mhz,甲醇
‑
d4)δ8.70(d,j=1.9hz,1h),8.59(d,j=2.1hz,1h),8.54(s,1h),8.37(t,j=2.0hz,1h),7.69(d,j=3.3hz,1h),7.66
‑
7.58(m,2h),7.48(d,j=3.3hz,1h),6.29(d,j=5.3hz,1h),5.15(dd,j=11.4,2.8hz,1h),5.07(d,j=13.1hz,1h),4.98(dd,j=11.3,5.3hz,1h),4.83(d,j=13.1hz,1h),4.50(t,j=5.9hz,1h),4.23(d,j=2.0hz,1h),3.77
‑
3.67(m,2h)。
[0491]
实例24
[0492]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0493][0494]5‑
氯
‑2‑
氰苯基2,4,6
‑
三
‑
o
‑
乙酰基
‑3‑
叠氮
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0495][0496]
将2,4,6
‑
三
‑
o
‑
乙酰基
‑3‑
叠氮
‑3‑
脱氧
‑
β
‑
d
‑
吡喃半乳糖基氯化物(wo2016120403)(9.6g,27.3mmol)、4
‑
氯
‑2‑
腈基硫酚(5.1g,30.1mmol)、cs2co3(17.8g,54.7mmol)和dmf(40ml)在室温下搅拌20小时。将混合物在乙醚/etoac/hcl水溶液/水之间分配,将有机相分离、浓缩,并将剩余物采用色谱法(sio2,pe/etoac)提纯,得到产物(5.63g,42%)。1h nmr(400mhz,氯仿
‑
d)δ7.69(d,j=1.7hz,1h),7.61(d,j=8.3hz,1h),7.39(dd,j=8.3,1.9hz,1h),6.07(d,j=5.5hz,1h),5.51(d,j=2.2hz,1h),5.31(dd,j=11.0,5.5hz,1h),4.68
‑
4.60(m,1h),4.14(dd,j=11.7,5.1hz,1h),4.05(dd,j=11.6,7.6hz,1h),3.99(dd,j=11.0,3.2hz,1h),2.23(s,3h),2.17(s,3h),2.02(s,3h)。
[0497]5‑
氯
‑2‑
氰苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0498][0499]
称取5
‑
氯
‑2‑
氰苯基2,4,6
‑
三
‑
o
‑
乙酰基
‑3‑
叠氮
‑3‑
脱氧
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(454mg,0.94mmol),三甲基
‑
[2
‑
(3,4,5
‑
三氟苯基)乙炔基]硅烷(429mg,1.88mmol)和k2co3(1.30g,9.41mmol)到玻璃烧瓶中,用氮气吹扫。加入meoh(5.0ml)和thf(5.0ml),然后加入五水硫酸铜(ii)(40mg,0.16mmol)和l(+)
‑
抗坏血酸钠(70mg,0.35mmol)的水溶液(2.5ml)。在60℃下搅拌混合物8小时,然后加入五水硫酸铜(ii)(40mg,0.16mmol)和l(+)
‑
抗坏血酸钠(70mg,0.35mmol)。在60℃下继续搅拌4小时。将混合物用etoac洗脱通过硅胶层过滤,并浓缩。剩余物采用色谱法(sio2,pe/etoac)提纯,将剩余物先从etoac/己烷中重结晶,再从etoh和水中重结晶,得到产物(248mg,51%)。[c
21
h
16
clf3n4o4s][m+h]
+
的esi
‑
ms m/z计算值:513.06;实测值:513.1。1h nmr(400mhz,甲醇
‑
d4)δ8.55(s,1h),7.98(d,j=1.8hz,1h),7.74(d,j=8.4hz,1h),7.71
‑
7.61(m,2h),7.47(dd,j=8.4,1.9hz,1h),6.13(d,j=5.1hz,1h),5.06(dd,j=11.4,2.6hz,1h),4.99(dd,j=11.4,5.2hz,1h),4.42(t,j=6.1hz,1h),4.23(d,j=2.4hz,1h),3.71(dd,j=11.4,5.6hz,1h),3.64(dd,j=11.3,6.6hz,1h)。
[0500]2‑
羧基
‑5‑
氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0501][0502]
在氮气气氛、在80℃下,将5
‑
氯
‑2‑
氰苯基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(717mg,1.39mmol)在etoh(36ml)和naoh(18ml,3m)的混合物中搅拌5小时。将混合物浓缩至大约25ml,并用hcl(5m)酸化至ph为大约1。过滤分离沉淀,得到产物(702mg,95%)。1h nmr(400mhz,甲醇
‑
d4)δ8.55(s,1h),7.96
‑
7.88(m,2h),7.70
‑
7.59(m,2h),7.29(d,j=8.4hz,1h),6.00(d,j=5.4hz,1h),5.09(dd,j=11.5,2.7hz,1h),4.99(dd,j=11.4,5.4hz,1h),4.42(t,j=6.2hz,1h),4.22(s,1h),3.76(dd,j=11.3,6.0hz,1h),3.67(dd,j=11.2,6.3hz,1h)。
[0503]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0504][0505]
将2
‑
羧基
‑5‑
氯苯基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(473mg,0.82mmol)、1
‑
羟基苯并三唑水合物(195mg,1.23mmol)和n
‑
(3
‑
二甲氨基丙基)
‑
n
’‑
乙基碳二亚胺盐酸盐(243mg,1.23mmol)在dmf(3ml)中搅拌,加入二甲胺(0.82ml,2m thf溶液,1.64mmol),然后加入diea(0.14ml,0.82mmol)。室温搅拌混合物6小时,然后加入水(20ml),并进行倾析。将剩余物在室温下于etoh(5ml)和naoh(1.0ml,2m)中搅拌1小时,然后倒至冰/水和hcl上。过滤收集沉淀,采用色谱法(sio2,pe/etoac)提纯,得到产物(268mg,58%)。[c
23
h
22
clf3n4o5s][m+h]
+
的esi
‑
ms m/z计算值:559.1;实测值:558.7。1h nmr(400mhz,甲醇
‑
d4)δ8.53(s,1h),7.86(s,1h),7.65(m,2h),7.42(d,j=8.2hz,1h),7.27(d,j=8.2hz,1h),5.92(d,j=5.0hz,1h),4.96(dd,j=11.4,2.5hz,1h),4.90(dd,j=11.4,5.0hz,1h),4.48(t,j=6.1hz,1h),4.19(s,1h),3.71(m,2h),3.13(s,3h),2.90(s,3h)。
[0506]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0507][0508]
向4
‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(200mg,0.36mmol)、苯甲醛二甲缩醛(110μl,1.36mmol)和对甲苯磺酸一水合物(5mg,0.026mmol)的mecn(10ml)溶液在室温下搅拌20小时。将混合物进行浓缩,并采用色谱法提纯(sio2,pe/etoac),得到标题化合物(216mg,93%)。[c
30
h
26
clf3n4o5s][m+nh3]
+
的esi
‑
ms m/z计算值:663.2;实测值:663.2。1h nmr(400mhz,氯仿
‑
d)δ8.04(d,.7=2.4hz,1h),7.73(d,.7=2.0hz,1h),7.47
‑
7.41(m,2h),7.39(dd,j=8.1,2.1hz,2h),7.36(s,5h),7.18(d,.7=8.2hz,1h),5.91(d,j=4.8hz,1h),5.49(s,1h),5.14(dd,j=11.3,3.1hz,1h),4.88(dd,j=11.3,4.9hz,1h),4.55(d,j=2.5hz,1h),4.41(d,j=12.7hz,1h),4.31(s,1h),4.18(d,j=13.9hz,1h),3.12(s,3h),2.87(s,3h)。
[0509]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(噻唑
‑4‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0510][0511]
将4
‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(74mg,0.11mmol)和nah(60%油溶液,17mg,0.45mmol)在dmf(1.5ml)中搅拌10分钟,然后加入4
‑
(氯甲基)噻唑盐酸盐(31mg,0.17mmol)。将混合物在40℃搅拌2小时,然后采用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下于80%tfa水溶液(2ml)中搅拌1小时。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(24mg,32%)。[c
27
h
25
clf3n5o5s2][m+nh3]
+
的esi
‑
ms m/z计算值:672.1;实测值:671.8,1h nmr(400mhz,甲醇
‑
d4)δ8.92(d,j=1.8hz,1h),8.45(s,1h),7.87(s,1h),7.61(d,j=8.0hz,2h),7.47(d,j=8.5hz,1h),7.41(s,1h),7.30(d,j=8.1hz,1h),6.25(d,j=4.7hz,1h),5.07(dd,j=11.4,2.7hz,1h),4.90
‑
4.86(m,1h),4.81(dd,j=10.8,5.2hz,4h),4.69(d,j=12.5hz,1h),4.59
‑
4.52(m,1h),4.23(s,1h),3.76
‑
3.70(m,2h),3.05(s,3h),2.87(s,3h)。
[0512]
实例25
[0513]4‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑2‑
o
‑
[(1h
‑
四唑
‑5‑
基)甲基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0514][0515]
向4
‑
氯
‑
n,n
‑
二甲基
‑
苯甲酰胺
‑2‑
基3
‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(53mg,0.095mmol)和对甲苯磺酸一水合物(3.6mg,0.019mmol)的mecn(3ml)溶液中加入苯甲醛二甲缩醛(29μl,0.19mmol),并将混合物在室温下搅拌4小时。混合物用三乙胺(6.5μl,0.047mmol)中和,并浓缩。剩余物和nah(60%油溶液,11mg,0.28mmol)在dmf(3ml)中搅拌20分钟,然后加入5
‑
(氯甲基)
‑
1h
‑
四唑(23mg,0.19mmol)。将混合物在40℃下搅拌2小时,然后用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下于80%tfa水溶液(2ml)中搅拌1小时。将混合物浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(20mg,33%)。[c
25
h
24
clf3n8o5s][m+h]
+
的esi
‑
ms m/z计算值:641.1;实测值:641.2,1h nmr(400mhz,甲醇
‑
d4)δ8.42(s,1h),7.89(s,1h),7.62
‑
7.56(m,2h),7.47(d,j=7.6hz,1h),7.30(d,j=8.1hz,1h),6.28(d,j=3.2hz,1h),5.12
‑
5.05(m,2h),4.96
‑
4.88(m,2h),4.57(t,j=5.2hz,1h),4.21(d,j=2.2hz,1h),3.74(d,j=6.0hz,2h),2.99(s,3h),2.83(s,3h)。
[0516]
实例26
[0517]5‑
嗅吡啶
‑3‑
基2
‑
o
‑
羧丙基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷
[0518][0519]
向5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(888mg,1.42mmol)、nai(454mg,3.0mmol)和4
‑
溴丁酸叔丁酯(460mg,2.0mmol)的dmf(10ml)溶液中加入nah(60%油溶液,120mg,2.86mmol)。将混合物在室温下搅拌20小时,然后倒至冰冷的水(80ml)和hcl(1m,10ml)上。将固体过滤分离,然后在etoac和水之间分配。将有机相干燥、蒸发,并用色谱法(sio2,etoac/pe)提纯。所得
材料在etoac/pe(1:1)中捣碎,得到产物,将产物在室温下于80%tfa水溶液(3ml)中搅拌45分钟。将混合物进行浓缩,并用hplc提纯(c
18
,h2o/mecn/0.1%tfa),得到标题化合物(23mg,3%)。[c
23
h
22
brf3n4o6s][m+h]
+
的esi
‑
ms m/z计算值:619.0;实测值:619.1,1h nmr(400mhz,dmso
‑
d6)δ11.91(s,1h),8.85(s,1h),8.68(s,1h),8.63(s,1h),8.33(s,1h),7.86
‑
7.74(m,2h),6.36(d,j=5.2hz,1h),5.59(d,j=6.1hz,1h),4.89(d,j=11.5hz,1h),4.76(s,1h),4.57(dd,j=11.3,5.2hz,1h),4.28(d,j=6.1hz,1h),4.06(s,1h),3.79
‑
3.67(m,1h),3.59
‑
3.47(m,1h),3.47
‑
3.34(m,2h),2.00(t,j=7.3hz,2h),1.54(q,j=6.8hz,2h)。
[0520]
实例27和28
[0521]5‑
溴吡啶
‑3‑
基2
‑
o
‑
(1
‑
羧基)乙基)
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(非对映异构体1)
[0522][0523]5‑
溴吡啶
‑3‑
基2
‑
o
‑
(1
‑
羧基)乙基)
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(非对映异构体2)
[0524][0525]
向5
‑
溴吡啶
‑3‑
基4,6
‑
o
‑
亚苄基
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基]
‑1‑
硫代
‑
α
‑
d
‑
吡喃半乳糖苷(150mg,0.24mmol)和nah(60%油溶液,14mg,0.36mmol)的dmf(2ml)溶液中加入2
‑
溴丙酸酯(35μl,0.31mmol)。将混合物在室温下搅拌1小时,然后用etoac稀释,并用水和盐水洗涤。将有机相干燥、蒸发,剩余物在室温下于80%tfa水溶液(3ml)中搅拌1小时。将混合物浓缩,并与liohxh2o(50mg,1.21mmol)一起溶于thf/h2o(3.5ml,9:1)。室温搅拌3小时后,将混合物浓缩,并用hplc(c
18
,h2o/mecn/0.1%tfa)提纯。分离出两种非对映异构体,而没有确定2
‑
o
‑
(1
‑
羧基)乙基)取代基的确切立体化学。在hplc的c
18
柱上,非对映异构体1(36mg,25%)首先洗脱出来,然后非对映异构体2(34mg,23%)洗脱出来。
[0526]5‑
溴吡啶
‑3‑
基2
‑
o
‑
(1
‑
羧基)乙基)
‑3‑
脱氧
‑3‑
[4
‑
(3,4,5
‑
三氟苯基)
‑
1h
‑
1,2,3
‑
therapeutic benefits in experimental models of mouse lymphoma and human glioblastoma.j.med.chem.49:1800
‑
1807.
[0554]
john,c.m.,leffler,h.,kahl
‑
knutsson,b.,svensson,i.,and jarvis,g.a.(2003)truncated galectin
‑
3 inhibits tumor growth and metastasis in orthotopic nude mouse model of human breast cancer.clin.cancer res.9:2374
‑
2383.
[0555]
kouo,t.,huang,l.,pucsek,a.b.,cao,m.,solt,s.,armstrong,t.,jaffee,e.(2015)cancer immonol.res.3:412
‑
23.
[0556]
leffler,h.and barondes,s.h.(1986)specificity of binding of three soluble rat lung lectins to substituted and unsubstituted mammalian beta
‑
galactosides.j.biol.chem.261:10119
‑
10126.
[0557]
leffler,h.galectins structure and function
‑‑
a synopsis in mammalian carbohydrate recognition systems(crocker,p.ed.)springer verlag,heidelberg,2001 pp.57
‑
83.
[0558]
leffler,h.,carlsson,s.,hedlund,m.,qian,y.and poirier,f.(2004)introduction to galectins.glycoconj.j.19:433
‑
440.
[0559]
lepur a,salomonsson e,nilsson uj,leffler h.(2012)ligand induced galectin
‑
3 protein self
‑
association.j biol chem.2012 jun 22;287(26):21751
‑
6.
[0560]
li lc,li j,gao j.(2014)functions of galectin
‑
3 and its role in fibrotic diseases.j pharmacol exp ther.2014 nov;351(2):336
‑
43.
[0561]
mackinnon,a.c.,farnworth,s.l.,henderson,n.c.,hodkinson,p.s.,kipari,t.,leffler,h.,nilsson,u.j.,haslett,c.,hughes,j.,and sethi t.(2008).regulation of alternative macrophage activation by galectin
‑
3.j.immun.180;2650
‑
2658.
[0562]
mackinnon,a.,gibbons,m.,farnworth,s.,leffler,h.,nilsson,u.j.,delaine,t.,simpson,a.,forbes,s.,hirani,n.,gauldie,j.,and sethi t.(2012).regulation of tgf
‑
β1 driven lung fibrosis by galectin
‑
3.am.j.resp.crit.care med.,in press.
[0563]
massa,s.m.,cooper,d.n.w.,leffler,h.,barondes,s.h.(1993)l
‑
29,an endogenous lectin,binds to glycoconjugate ligands with positive cooperativity.biochemistry 32:260
‑
267.
[0564]
melero,i.,berman,d.m.,aznar,m.a.,korman,a.j.,gracia,j.l.p.,haanen,j.(2015)nature reviews cancer,15:457
‑
472.
[0565]
partridge,e.a.,le roy,c.,di guglielmo,g.m.,pawling,j.,cheung,p.,granovsky,m.,nabi,i.r.,wrana,j.l.,and dennis,j.w.(2004).regulation of cytokine receptors by golgi n
‑
glycan processing and endocytosis.science 306:120
‑
124.
[0566]
pienta,k.j.,naik,h.,akhtar,a.,yamazaki,k.,reploge,t.s.,lehr,j.,donat,t.l.,tait,l.,hogan,v.,and raz,a.(1995).inhibition of spontaneous metastasis in a rat prostate cancer model by oral administration of modified citrus pectin.j natl cancer inst 87,348
‑
353.
[0567]
ramos
‑
soriano,j.;niss,u.;angulo,j.;angulo,m.;moreno
‑
vargas,a.j.;
carmona,a.t.;ohlson,s.;robina,i.chem.eur.j.2013,19,17989
‑
18003.
[0568]
ruvolo,p.p.biochim.biophys acta.molecular cell research(2015)e
‑
pub ahead of print,title:galectin
‑
3 as a guardian of the tumor microenvironment,published on
‑
line 8 april 2015:(http://www.sciencedirect.com/science/article/pii/s0167488915002700),
[0569]
salameh,b.a.,leffler,h.and nilsson,u.j.(2005)bioorg.med.chem.lett.15:3344
‑
3346.
[0570]
salameh,b.a.,cumpstey,i.,sundin,a.,leffler,h.,and nilsson,u.j.(2010).1h
‑
1,2,3
‑
triazol
‑1‑
yl thiodigalactoside derivatives as high affinity galectin
‑
3 inhibitors.bioorg med chem 18:5367
‑
5378.
[0571]
salomonsson,e.,larumbe,a.,tejler,j.,tullberg,e.,rydberg,h.,sundin,a.,khabut,a.,frejd,t.,lobsanov,y.d.,rini,j.m.,nilsson,u.j.,and leffler,h(2010).monovalent interactions of galectin
‑
1.biochemistry 49:9518
‑
9532.
[0572]
p.,qian,y.,nyholm,p.
‑
g.,leffler,h.,nilsson,u.j.(2002)low micromolar inhibitors of galectin
‑
3 based on 3
′‑
derivatization of n
‑
acetyllactosamine.chembiochem 3:183
‑
189.
[0573]
p.,kahl
‑
knutsson,b.,wellmar,u.,nilsson,u.j.,and leffler h.(2003a)fluorescence polarization to study galectin
‑
ligand interactions.meth.enzymol.362:504
‑
512.
[0574]
p.,kahl
‑
knutsson,b.,wellmar,u.,magnusson,b.
‑
g.,leffler h.,and nilsson,u.j.(2003b)design and synthesis of galectin inhibitors.meth.enzymol.363:157
‑
169.
[0575]
p.,kahl
‑
knutsson,b.,huflejt,m.,nilsson,u.j.,and leffler h.(2004)fluorescence polarization as an analytical tool to evaluate galectin
‑
ligand interactions.anal.biochem.334:36
‑
47.
[0576]
thijssen vl,heusschen r,caers j,griffioen aw.(2015)galectin expression in cancer diagnosis and prognosis:a systematic review.biochim biophys acta.2015 apr;1855(2):235
‑
47.
[0577]
toscano,m.a.,bianco,g.a.,ilarregui,j.m.,croci,d.o.,correale,j.,hernandez,j.d.,zwirner,n.w.,poirier,f.,riley,e.m.,baum,l.g.,et al.(2007).differential glycosylation of th1,th2 and th
‑
17 effector cells selectively regulates susceptibility to cell death.nat immunol 8:825
‑
834.
[0578]
viguier m,advedissian t,delacour d,poirier f,deshayes f.(2014)galectins in epithelial functions.tissue barriers.2014 may 6;2:e29103.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1