膜蛋白FieF的表达载体及其表达纯化方法
膜蛋白fief的表达载体及其表达纯化方法
技术领域
1.本发明属于蛋白质生产技术领域,涉及一种铁离子外排泵(fief)的表达载体及其表达纯化方法。
背景技术:
2.细胞膜是细胞内部与外部的边界,担负着信息传递、能量传输和物质交换的重要功能,是最重要的细胞器。药物作用的靶点经常位于细胞膜上。目前已知50%以上药物作用的靶标是膜蛋白。因此,对于膜蛋白的研究具有非常重要的意义。
3.然而,膜蛋白由于其天然状态的含量稀少,具有多次跨膜结构,因而折叠容易出现错误,结构复杂,所以膜蛋白的大规模制备一直是难点和热点。在国内,基本没有生物公司可以做到12次以上的跨膜蛋白的表达,只有一两家公司可以做到四次跨膜蛋白的表达。
4.大肠杆菌作为常用的表达宿主一直是蛋白表达的首选,然而,即使是大肠杆菌自身蛋白都很难在大肠杆菌中大量表达。目前,由于抗生素的滥用,导致在今后的50年内面临无法对抗耐药菌的窘境。因此通过大量表达膜蛋白作为抗生素的作用靶点,为后续非变性质谱的高通量筛选提供先导性技术支持。
技术实现要素:
5.本发明的目的在于提供一种大量表达膜蛋白fief的表达载体及其表达纯化方法。本发明针对大肠杆菌膜蛋白fief,建立高效的融合表达系统,可以用于后续进一步的蛋白质非变性实时监控质谱研究。
6.实现本发明目的的技术方案如下:
7.本发明的膜蛋白fief的表达载体,以本实验室获得的用于莱茵衣藻蛋白质定位的超折叠维纳斯荧光蛋白(中国专利申请201910347575.3)作为起始蛋白质骨架,通过对序列表达所用的密码子组成进行进一步优化,获得分子刚性的荧光蛋白表达标签并且适用于大肠杆菌膜蛋白的大规模表达。本发明利用分子刚性的荧光蛋白作为筛选标记以及表达进程指示剂,并且该荧光蛋白由于具有分子水平刚性结构可以迅速折叠,并且帮助氮端膜蛋白fief稳定其构象。
8.本发明的膜蛋白fief的表达载体为表达质粒ply077-fief(seq id no.2),包含:噬菌体t7启动子;大肠杆菌核糖体结合位点,其中包含ncoi序列ccatgg、大肠杆菌膜蛋白fief序列(seq id no.1)以及bamhi位点ggatcc;烟草蚀纹病毒半胱氨酸蛋白酶切割位点gagaacctgtacttccaatcc;ndei酶切位点catatg;超折叠维纳斯荧光蛋白编码序列;xhoi酶切位点ctcgag;6个组氨酸位点以及终止密码子tag。
9.本发明还提供上述膜蛋白fief的表达载体的表达纯化方法,具体步骤如下:
10.步骤1,大肠杆菌膜蛋白fief表达载体突变株的制备:将膜蛋白fief的表达载体即表达质粒ply077-fief转化到宿主大肠杆菌中,并涂布于含抗生素以及0.1mm iptg琼脂平板,挑选黄绿色的阳性单克隆菌进行扩大培养和诱导表达;
11.步骤2,将挑选的突变菌株转化株接种至培养基中进行扩大培养,并用1mm iptg大规模诱导表达膜蛋白fief。
12.优选地,步骤1中,所述的大肠杆菌为大肠杆菌bl21(de3)。
13.优选地,步骤2中,所述的培养基为lb培养基或tb培养基。
14.本发明通过全合成表达载体,将目标基因和密码子优化过的具有分子刚性的超折叠维纳斯荧光蛋白引入表达载体中,并通过在核酸编码一级序列进行优化,大大提高了目标基因的转录和翻译效率。此外,通过控制羧基端刚性荧光蛋白的折叠速度,帮助目标膜蛋白正确折叠并插入膜中。刚性荧光蛋白不仅可以用于监测蛋白质的实时表达进程,还可以用于保护蛋白的羧基端,从而使得目标蛋白得到富集。本发明通过对大肠杆菌膜蛋白的大量表达,后期纯化以便实现对于新型抗生素的高通量筛选,具有重要的商业化前景。
附图说明
15.图1为fief核酸编码序列的pcr琼脂糖凝胶电泳结果图。
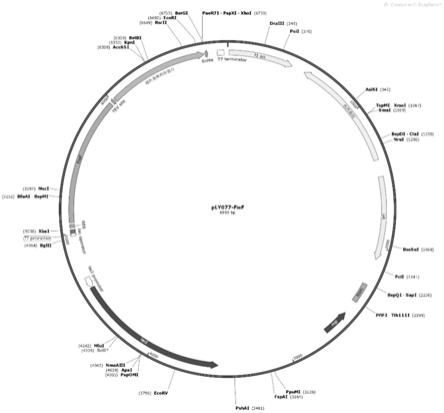
16.图2为ply077-fief质粒的结构示意图。
17.图3为ply077-fief菌落pcr验证结果图。
18.图4为质粒ply077-fief的ncoiⅰ和bamhiⅰ单酶切双酶切琼脂糖凝胶电泳结果图。
19.图5为转化琼脂平板上的菌落荧光图。
20.图6为诱导后的荧光成像以及诱导前后全菌蛋白对比图。
具体实施方式
21.下面结合具体实施例和附图对本发明作进一步的说明,但并不局限于此。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
22.实施例中所用材料如下:
23.1.细胞来源
24.大肠杆菌dh5α、bl21(de3),c41(de3),c43(de3)菌株购自武汉灵淼生物公司。
25.2.质粒来源
26.ply077质粒和fief编码序列由上海生工生物有限公司合成,ply077质粒包含:噬菌体t7启动子;大肠杆菌核糖体结合位点,其中包含了ncoi序列ccatgg以及bamhi位点ggatcc;烟草蚀纹病毒半胱氨酸蛋白酶切割位点gagaacctgtacttccaatcc;ndei酶切位点catatg;超折叠维纳斯荧光蛋白编码序列;xhoi酶切位点ctcgag;6个组氨酸位点以及终止密码子tag。ply077质粒和fief编码序列见序列表。
27.3.引物来源
28.合成引物均来自北京擎科生物技术有限公司。
29.4.主要试剂
30.胰蛋白胨、酵母提取物、nacl、tris-baes均购自sigma公司;限制性核酸内切酶、phusion酶购自thermo fisher公司;rtaq酶、t4连接酶购自takara公司。质粒小提试剂盒、凝胶回收试剂盒购自axygen公司。ntp、depc水、rnase inhibitor购自上海生物生工有限公司。
31.实施例1fief的基因克隆
32.1.fief的克隆
33.a)根据对比fief序列所用密码子与kazusa在线数据库(http://www.kazusa.or.jp/codon/)下的escherichia coli密码子使用频率,设计全新fief编码序列(seq id no.1),并合成。之后通过pcr方法扩增。pcr反应体系配置如表1所示。
34.表1 pcr反应体系配制表
[0035][0036][0037]
pcr结果如图1所示。目的片段长度为921bp,最佳退火温度为52℃。
[0038]
b)回收目标dna,用ncoⅰ和bamhi酶切目的片段和ply077载体,后进行琼脂糖凝胶电泳,回收酶切产物;将回收的目的片段和ply077载体片段,按摩尔比为5:1比例加入小离心管中,加入t4连接酶,在16℃下连接过夜。
[0039]
c)以上连接产物取20μl用42℃热激法转化入80μl dh5α感受态细胞,加入700μl lb培养基后置于37℃摇床,在200转/分钟下培养45分钟。
[0040]
d)上述菌液在4000转/分钟转速下离心1分钟后,吸去700μl上清;用移液器轻轻吹吸剩余培养基后涂布在含有氨苄青霉素的lb固体平板上,倒置于37℃培养箱中,培养12小时。
[0041]
e)挑取上述平板中的单菌落,小量扩增后提取质粒,用ncoⅰ和bamhi单酶切双酶切所提取质粒后经琼脂糖凝胶电泳鉴定,经测序鉴定正确,即得到膜蛋白fief的表达载体ply077-fief,质粒的结构示意图如图2所示。图3为ply077-fief菌落pcr验证结果图。图4为质粒ply077-fief的ncoiⅰ和bamhiⅰ单酶切双酶切琼脂糖凝胶电泳结果图。
[0042]
实施例2fief的表达
[0043]
融合蛋白fief-超折叠荧光蛋白的诱导表达
[0044]
将鉴定正确的ply077-fief质粒转入到大肠杆菌表达宿主bl21(de3)中,涂布在含有0.1mm异丙基硫代半乳糖苷(iptg)得到稳定转化的菌落;通过对于菌落荧光的检测,图5为转化琼脂平板上的菌落荧光图,由是否存在荧光可知菌落里是否含有重组质粒,含有重组质粒的菌落显示荧光,可以看出获得了大量表达目标蛋白的突变株。
[0045]
分别接种单菌落到含有100μg/ml氨苄青霉素的lb以及tb液体培养基中,在200转/分钟、37℃下培养过夜,得到过夜菌。将过夜菌接种到750ml lb以及tb培养基中,接种比例
为1:250,在230转/分钟,30℃下培养至od
600
达到0.8-1.0,加入终浓度为0.5mm的iptg,后25℃培养2-6小时。4000转/分钟离心15分钟收集菌体。将菌体重悬于pbs缓冲液中,后经过4000转/分钟离心15分钟,即得到含有fief融合表达蛋白菌体。图6为诱导后的荧光成像以及诱导前后全菌蛋白对比图。从图6可知,以大肠杆菌bl21(de3)为表达菌株,在tb培养基中诱导6h后,fief蛋白表达量最高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1