一种检测2019新型冠状病毒的双靶位点反转录荧光PCR引物、探针及试剂盒的制作方法
本发明涉及病毒检测
技术领域:
,特别是涉及用于检测2019新型冠状病毒的靶位点,针对靶位点的特异性引物和探针,本发明还涉及利用该引物和探针进行2019新型冠状病毒检测的方法和试剂盒。
背景技术:
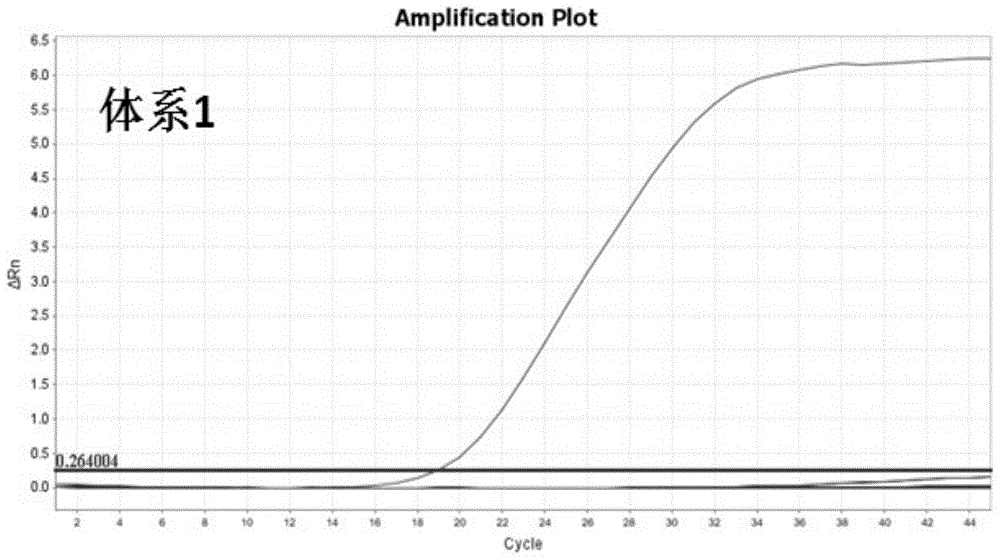
:新型冠状病毒(2019-ncov)是2020年1月最新检测到的一种人致病性冠状病毒,引发不明原因肺炎疫情的呼吸道病原。临床表现为发热、乏力等全身症状,伴有干咳,住院患者呼吸困难较为常见;绝大多数患者入院时生命体征大致平稳。该病毒虽未发现人与人之间的传染性,但仍然需要密切监测防止更大规模的感染。2020年1月11日至12日,该病毒的6组基因组序列信息公布,通过基因组序列对比,发现其序列与sars病毒较为相近,是sars病毒的变异株,而6组基因序列中有冠状病毒n基因上的变异。检测病毒感染的传统手段为显微镜镜检、抗原检测。显微镜镜检涉及细胞培养,耗时较长,且需要一定的镜检技术经验;抗原检测大多基于elisa,虽然能够快速得到检测结果,但灵敏度仍然较低。目前,病毒感染的检测主要依赖于核酸检测技术,如pcr、全基因组测序等,尤其是实时荧光pcr(qpcr)技术,具有极高的灵敏度和特异性,能够快速、准确的得到检测结果。目前,2019-ncov感染无法通过特异性的临床症状进行识别诊断,核酸检测技术是其最重要的技术手段,通过快速的rt-qpcr技术,能够快速、准确地识别临床有疑似症状的检测者。可做到对2019-ncov的快速检测,防止疫情扩散。2019-ncov归属为新型的sars变异病毒,但目前尚没有经cfda认证的商品化2019-ncov核酸检测试剂盒,部分生物科技公司目前研发了针对2019-ncov检测的科研用核酸检测试剂盒。但目前所有的2019-ncov核酸检测试剂盒均是基于传统rt-qpcr检测技术,其检测使用的引物探针均是针对单一的病原核酸序靶位点都设计的。众所周知,病毒的核酸序列变异程度高,其单碱基突变的频率约为10-6,远高于细菌的10-9。因此,针对病毒的核酸检测,单一靶位点容易产生由于突变导致假阴性检测结果,造成漏检。技术实现要素:本发明目的在于建立一种具有高灵敏度和特异度的双靶位点2019-ncov检测的rt-qpcr方法、及用于该方法的特异性引物、探针和试剂盒。以弥补目前该新型冠状病毒核酸检测方法的空白;针对病毒核酸变异性高的特点,双靶位点的设计可极大的降低单一靶点对变异病毒的漏检情况。本发明通过对6株2019新型冠状病毒(2019-ncov)全基因测序和比对,发现了3段2019-ncov的n基因上保守且具有种间特异性的核酸序列(w1-w3),其序列分别如seqidno.1-3所示。本发明这对这3个靶点涉及了多套相应的特异性引物探针组合用于分别检测3个靶点,在多套引物探针组合中,进一步筛选出4套检测效果优良的特异性引物探针组合,它们对靶位点的检测限达到了10-100拷贝。本发明进一步设计了针对该2019-ncov病毒检测的双靶位点反转录荧光pcr(rt-qpcr)引物和探针,并由此进行检测的方法和试剂盒。具体而言,第一方面,本发明首先提供了用于检测2019新型冠状病毒的靶序列,其核苷酸序列如seqidno.1、和/或seqidno.2、和/或seqidno.1所示。这3个特异性强的靶序列分别命名为w1、w2、w3。本发明提供了上述靶序列w1、和/或w2、和/或w3在检测2019-ncov病毒中的应用。优选地,本发明提供了用于检测2019新型冠状病毒的靶序列组合,即w1+w2,其核苷酸序列如seqidno.1、和seqidno.2所示。第二方面,本发明提供了用于检测上述靶序列或靶序列组合的检测试剂在检测2019新型冠状病毒中的应用。第三方面,本发明提供了一种用于检测2019新型冠状病毒的特异性引物探针组合,其为以下任一个或多个特异性引物探针组合:(1)引物序列如seqidno.4-5所示,探针序列如seqidno.6所示;或(2)引物序列如seqidno.7-8所示,探针序列如seqidno.9所示;或(3)引物序列如seqidno.10-11所示,探针序列如seqidno.12所示;或(4)引物序列如seqidno.13-14所示,探针序列如seqidno.15所示。含有上述特异性引物探针组合属于本发明的保护范围。优选地,本发明提供一种用于检测2019新型冠状病毒的特异性引物探针组合,其由两个特异性引物探针组合组成,(1)引物序列如seqidno.4-5所示,探针序列如seqidno.6所示;和(2)引物序列如seqidno.7-8所示,探针序列如seqidno.9所示。探针的5’分别标记荧光基团,3’标记淬灭基团。所述荧光基团选自但不限于fam、vic或cy5,所述淬灭基团选自但不限于bhq1、mgb。在本发明的实施例中,探针类型是mgb探针,荧光基团为fam。第四方面,本发明提供一种检测2019新型冠状病毒的双靶位点反转录荧光检测试剂盒,该试剂盒含有两个特异性引物探针组合,(1)引物序列如seqidno.4-5所示,探针序列如seqidno.6所示;和(2)引物序列如seqidno.7-8所示,探针序列如seqidno.9所示。上述试剂盒工作原理是以待测样品基因组rna为模板,同时利用第(1)、第(2)个特异性引物探针组合,进行双靶位点反转录荧光定量pcr,根据扩增曲线和荧光信号判定结果。优选地,所述反转录荧光定量pcr的25μl反应体系为:和/或,所述反转录荧光定量pcr的反应程序为:50℃15min;95℃预变性3min;95℃变性30s,58-61℃退火30s,45个循环。第五方面,本发明一种检测2019新型冠状病毒的双靶位点反转录荧光检测方法,以待测样品基因组rna为模板,同时利用上述第(1)、(2)组的特异性引物探针组合,进行双靶位点反转录荧光定量pcr,根据扩增曲线和荧光信号判定结果。本领域技术人员能够理解,出于防疫部门对流行病学第一手资料掌握与统计的目的、或检验检疫部门对进出口食品、生活用品、动植物产品的检验检疫的目的,均需要快速、准确、灵敏地实现对2019新型冠状病毒的检测,因此,本发明提供了一种非疾病诊断目的的检测2019新型冠状病毒的双靶位点反转录荧光检测方法,以待测样品基因组rna为模板,同时利用上述第(1)、(2)组的特异性引物探针组合,进行双靶位点反转录荧光定量pcr,根据扩增曲线和荧光信号判定结果。无论是疾病诊断目的,还是非疾病诊断目的,采用本发明的试剂盒或本发明的方法对待测样品进行检测时,每次检测标本时必须设立ntc对照(无模板对照)、neg(阴性对照)和pos对照(阳性对照),三种对照对于结果判读起决定性作用:有效扩增:ntc(-)、neg(-)、pos(+);无效扩增:ntc(-)、neg(-)、pos(-)提示试剂失效;无效扩增:ntc(-)、neg(+)、pos(+)提示加样污染;无效扩增:ntc(+)、neg(+)、pos(+)提示体系污染。只有对照有效扩增情况下的样品检测结果才可信,否则试验需要重复。在检测中三种对照为有效扩增时,样本结果判断标准如下:ct值小于等于36的标本为阳性结果;ct值大于38的标本为阴性结果;ct值在36-38之间的标本需要重复,重复试验如ct值依然低于38判定为阳性扩增,超过38判定为阴性扩增。本发明通过已报道的6条2019-ncov全基因组核酸序列比对,发现了3段2019-ncov的n基因上保守且具有种间特异性的核酸序列(w1-w3),设计并选取了4套相应的特异性rt-qpcr检测探针和引物(实施例中体系1-4),井进行体系优化和特异性验证。随后通过两两组合优化和筛选,最终建立了基于体系1和2组合(对应前述的第(1)、(2)特异性引物探针组合)的双靶位点rt-qpcr试剂盒,该试剂盒对2019-ncov的检测灵敏度在10copies以内,对临床常见22种呼吸道病原体均无非特异扩增,显示出良好的特异度,可有效避免单靶点突变造成的假阴性结果,而造成对变异变动的漏检情况;双靶位点的检测可增强荧光检测信号,提高检测的灵敏度。附图说明图1a-图1d分别为采用1-4组引物探针组合形成的4套rt-qpcr检测体系特异度检测图,结果显示除阳性模板外其余模板均无扩增,图1a-图1d中横坐标自左至右标识的数值依次按等差数列递进排练,为2,4,6,8……40,42,44。以下图2,图3的a图,图4横坐标排练均同此描述。图2为双靶点rt-qpcr检测体系对相同浓度阳性模板检测结果比对图。图3为双靶点rt-qpcr检测体系标准扩增曲线。a为标准曲线示意图,b为标准曲线对数图。图4为位点突变对于双靶点rt-qpcr检测体系和单靶点体系比较结果图,a为模拟2019-ncov核酸模板,b为模拟2019-ncov突变株核酸模板。具体实施方式以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。实施例12019新型冠状病毒2019-ncov基因序列比对与靶序列确定依据最新公布的6条2019-ncov全基因组,通过ncbi数据库进行核酸序列比对,找到了该病毒n基因中特异性核酸序列:w1(seqidno.1),w2(seqidno.2)和w3(seqidno.3)。实施例2针对靶序列的引物和探针的设计针对实施例1确定的靶序列(seqidno.1-3),发明人设计了多个引物与探针组合。并进一步从诸多引物探针组合中,选出检测效果较好的4组mgb探针与引物组合,分别见表1-表4。其中体系1用于检测靶序列w1,体系2用于检测靶序列w2,体系3和4分别用于检测靶序列w3。表1体系1的引物探针序列2019-ncov-f1:tggcaatggcggtgatg(seqidno.4)2019-ncov-r1:agctggttcaatctgtcaagca(seqidno.5)2019-ncov-p1:tgctcttgctttgctg(seqidno.6)表2体系2的引物探针序列2019-ncov-f2:gaagcctcggcaaaaacg(seqidno.7)2019-ncov-r2:gccgaaagcttgtgttacattg(seqidno.8)2019-ncov-p2:actgccactaaagcat(seqidno.9)表3体系3的引物探针序列2019-ncov-f3:cgggaacgtggttgaccta(seqidno.10)2019-ncov-r3:tctttgaaatttggatctttgtcatc(seqidno.11)2019-ncov-p3:cag(c/g)tgccatcaaa(seqidno.12)表4体系4的引物探针序列2019-ncov-f4:agtcacaccttcgggaacgt(seqidno.13)2019-ncov-r4:tctttgaaatttggatctttgtcatc(seqidno.14)2019-ncov-p4:ttgacctacacag(c/g)tgc(seqidno.15)本实施例进一步对筛选的4种体系荧光定量pcr方法的退火温度进行了优化实验,从55℃-65℃改变,结果显示体系1的最优退火温度为58℃-61℃,体系2的最优退火温度为56℃-62℃,体系3的最优退火温度为58℃-60℃,体系4的最优退火温度为58℃-62℃。每次检测标本时必须设立ntc对照(无模板对照)、neg(阴性对照)和pos对照(阳性对照),三种对照对于结果判读起决定性作用:有效扩增:ntc(-)、neg(-)、pos(+);无效扩增:ntc(-)、neg(-)、pos(-)提示试剂失效;无效扩增:ntc(-)、neg(+)、pos(+)提示加样污染;无效扩增:ntc(+)、neg(+)、pos(+)提示体系污染。只有对照有效扩增情况下的样品检测结果才可信,否则试验需要重复。在检测中三种对照为有效扩增时,样本结果判断标准如下:ct值小于等于36的标本为阳性结果;ct值大于38的标本为阴性结果;ct值在36-38之间的标本需要重复,重复试验如ct值依然低于38判定为阳性扩增,超过38判定为阴性扩增。实施例34种荧光pcr检测体系对2019-ncov的检测灵敏度、特异性验证1.灵敏度评价目前由于缺乏2019-ncov毒株,灵敏度实验使用人工合成的2019-ncov序列体外反转录后的rna序列作为阳性模板,其中sars合成片段:s1-s3,分别对应2019-ncov的w1-w3,s1-s3的序列分别如seqidno.16-18所示;mers合成片段:m1-m3,分别对应2019-ncov的w1-w3,m1-m3的序列分别如seqidno.19-21所示。将合成序列分别掺入12份正常人咽拭子中,4套rt-qpcr的检测结果均为阳性,灵敏度达100%(12/12)。2.特异度评价分别使用实施例2筛选并确定的4套rt-qpcr检测呼吸道常见菌株22种及人类染色体(见表5),以2019-ncov人工合成序列体外反转录后的rna序列(对应w1-w3)作为阳性对照。结果除阳性对照外,其余病原体模板均为阴性(见图1a-图1d)。表5用于检测2019-ncov反转录荧光pcr体系特异性模板3.体系检测限的评价以2019-ncov人工合成序列体外反转录后的rna序列作为模板,分别进行4套rt-qpcr检测体系检测限评价。每个浓度梯度取5μl检测,按照优化的反应体系和反应条件进行real-timepcr,每个浓度梯度做3个平行样。体系1的检测限为10copies,体系2的检测限为10-100copies,体系3的检测限为100copies,体系4的检测限为10-100copies。实施例44rt-qpcr套体系组合优化和筛选对上述4套rt-qpcr检测体系进行两两组合和优化,形成1+2,1+3,1+4,2+3,2+4,3+4六种双靶点检测组合体系,其分别与最灵敏的单靶点体系1(10copies检测限)进行比对,筛选出最优化的双靶点体系为1+2体系,其检测限为10copies,相比单靶点中最灵敏的体系1,其荧光信号值更高,检测ct值更低,优于单靶点体系(见图2)。确定以体系1+2的双靶点rt-qpcr检测体系作为检测2019-ncov的最佳方案。实施例5双靶点rt-qpcr检测体系(体系1+2)及扩增条件25微升的双靶点rt-qpcr检测体系的配置为:扩增条件:50℃15min;95℃预变性3min;95℃变性30s,58-61℃退火30s,45个循环。实施例6双靶点rt-qpcr检测体系标准曲线以标准浓度模板的log值为横坐标,以相应的ct值为纵坐标,绘制实施例4确定的双靶点rt-qpcr检测体系的real-timepcr标准曲线。结果显示:阳性模板量在10-106copies这个范围内时,其的对数值与ct值具有非常好的相关性(r2=1.000),且扩增效率e=93.4%(见图3)。实施例7双靶点rt-qpcr检测体系特异性验证采用实施例4确定的双靶位点rt-qpcr检测方法对呼吸道常见菌株22种及人类染色体(见表5),以2019-ncov人工合成序列体外反转录后的rna序列作为阳性对照。结果除阳性对照外,其余病原体模板均为阴性,说明本发明确定的双靶点rt-qpcr检测方法特异性为100%。实施例8模拟2019-ncov单碱基突变对双靶点rt-qpcr检测体系及单靶点体系(体系1)检测结果的影响依据实施例1确定的2019-ncov的n基因中特异性序列片段w1,模拟病毒体外突变,设计一个体系探针位点上单碱基突变的变异序列片段w1'(序列中相对于w1序列的第34位的t碱基突变为g碱基),将w1+w2序列混合模拟现有2019-ncov核酸模板,将w1'+w2序列混合模拟2019-ncov单碱基突变株核酸模板,分别进行双靶点rt-qpcr检测体系(体系1+2)和单靶点体系(体系1)检测。使用103copies的低载量阳性模板检测,双靶点rt-qpcr检测体系及单靶点体系对模拟2019-ncov核酸模板(w1+w2序列混合)均能检测(图4的a),仅双靶点rt-qpcr检测体系对模拟2019-ncov核突变酸模板(w1'+w2序列混合)可以检测(见图4的b)。综合上述实施例,本发明提供的双靶点rt-qpcr检测体系(体系1+2)检测2019-ncov取得了特异性好、灵敏度优异、准确度高的检测效果:检测灵敏度在10copies以内,对临床常见22种呼吸道病原体均无非特异扩增,显示出良好的特异度,双靶点的确定、引物探针设计及进行同时检测待测样品,可有效避免病毒的单靶点突变造成的假阴性结果而导致漏检。满足了临床检测领域、食品卫生检验检疫领域对快速检测2019新型冠状病毒的要求,领域取得了优异的效果,应用前景良好。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。序列表<110>西安博睿康宁生物医学中心有限公司<120>一种检测2019新型冠状病毒的双靶位点反转录荧光pcr引物、探针及试剂盒<130>khp201110350.3<160>21<170>siposequencelisting1.0<210>1<211>71<212>dna<213>人工序列(artificialsequence)<400>1tggctggcaatggcggtgatgctgctcttgctttgctgctgcttgacagattgaaccagc60ttgagagcaaa71<210>2<211>83<212>dna<213>人工序列(artificialsequence)<400>2tctaagaagcctcggcaaaaacgtactgccactaaagcatacaatgtaacacaagctttc60ggcagacgtggtccagaacaaac83<210>3<211>107<212>dna<213>人工序列(artificialsequence)<400>3cgcattggcatggaagtcacaccttcgggaacgtggttgacctacacagctgccatcaaa60ttggatgacaaagatccaaatttcaaagatcaagtcattttgctgaa107<210>4<211>17<212>dna<213>人工序列(artificialsequence)<400>4tggcaatggcggtgatg17<210>5<211>22<212>dna<213>人工序列(artificialsequence)<400>5agctggttcaatctgtcaagca22<210>6<211>16<212>dna<213>人工序列(artificialsequence)<400>6tgctcttgctttgctg16<210>7<211>18<212>dna<213>人工序列(artificialsequence)<400>7gaagcctcggcaaaaacg18<210>8<211>22<212>dna<213>人工序列(artificialsequence)<400>8gccgaaagcttgtgttacattg22<210>9<211>16<212>dna<213>人工序列(artificialsequence)<400>9actgccactaaagcat16<210>10<211>19<212>dna<213>人工序列(artificialsequence)<400>10cgggaacgtggttgaccta19<210>11<211>26<212>dna<213>人工序列(artificialsequence)<400>11tctttgaaatttggatctttgtcatc26<210>12<211>14<212>dna<213>人工序列(artificialsequence)<400>12cagstgccatcaaa14<210>13<211>20<212>dna<213>人工序列(artificialsequence)<400>13agtcacaccttcgggaacgt20<210>14<211>26<212>dna<213>人工序列(artificialsequence)<400>14tctttgaaatttggatctttgtcatc26<210>15<211>17<212>dna<213>人工序列(artificialsequence)<400>15ttgacctacacagstgc17<210>16<211>71<212>dna<213>人工序列(artificialsequence)<400>16tggctagcggaggtggtgaaactgccctcgcgctattgctgctagacagattgaaccagc60ttgagagcaaa71<210>17<211>83<212>dna<213>人工序列(artificialsequence)<400>17tctaaaaagcctcgccaaaaacgtactgccacaaaacagtacaacgtcactcaagcattt60gggagacgtggtccagaacaaac83<210>18<211>107<212>dna<213>人工序列(artificialsequence)<400>18cgcattggcatggaagtcacaccttcgggaacatggctgacttatcatggagccattaaa60ttggatgacaaagatccacaattcaaagacaacgtcatactgctgaa107<210>19<211>71<212>dna<213>人工序列(artificialsequence)<400>19tcggagcagtaggaggtgatctactttaccttgatcttctgaacagactacaagcccttg60agtctggcaaa71<210>20<211>77<212>dna<213>人工序列(artificialsequence)<400>20aataagatgcgccacaagcgcacttccaccaaaagtttcaacatggtgcaagcttttggt60cttcgcggaccaggaga77<210>21<211>108<212>dna<213>人工序列(artificialsequence)<400>21cgggctgttaaggatggcatcgtttgggtccatgaagatggcgccactgatgctccttca60acttttgggacgcggaaccctaacaatgattcagctattgttacacaa108当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1