新型冠状病毒2019-nCoV核酸试剂盒和病毒核酸采集方法与流程
本发明涉及检测试剂盒领域,主要是一种新型冠状病毒2019-ncov核酸试剂盒和病毒核酸采集方法。
背景技术:
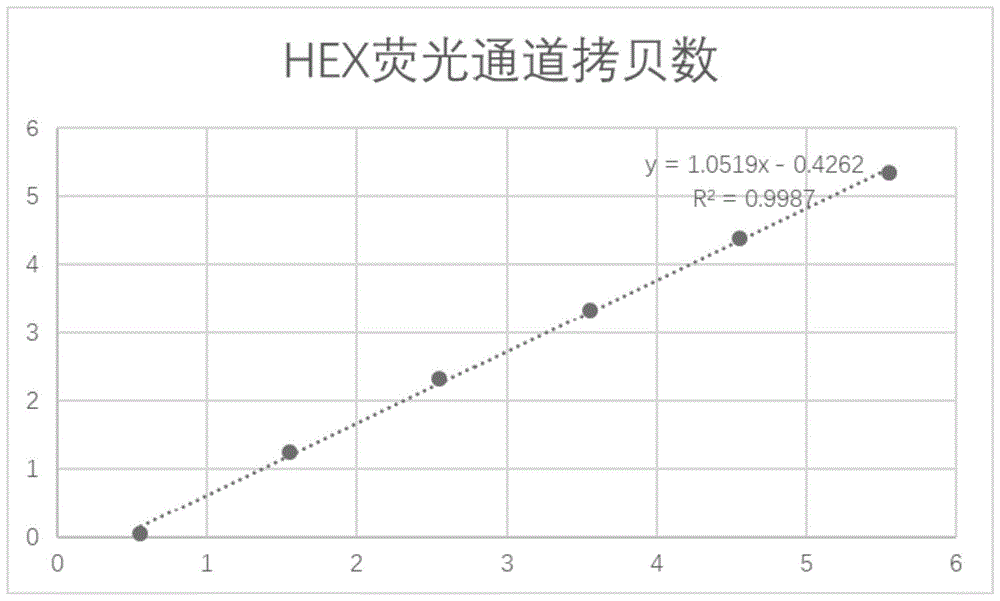
:2019新型冠状病毒(2019novelcoronavirus,2019-ncov),于2020年1月12日被世界卫生组织(worldhealthorganization,who)命名。可靠的实验室诊断是促进公共卫生干预措施的首要任务。在急性呼吸道感染中,实时pcr、即rt-pcr通常用于检测呼吸道分泌物中的致病病毒。目前临床上主要采用实时荧光pcr法检测2019-ncov核酸(开发读码框1ab和核壳蛋白)来对病例进行早期确诊,为阳性才能确诊。所来源的样品主要包括痰液以及带有或不带有病毒转运介质的鼻拭子和咽拭子。而对于一些病毒载量丰度较低的样品,荧光pcr法往往因为灵敏度的原因,会出现很多假阴性结果,实际临床应用中也有很多报道,往往需要进行2-3次重复采样,甚至有第6次咽拭子核酸检测才阳性确诊的患者,这不仅增加了医务人员工作量,同时这些假阴性患者如若处理不当,很容易再次成为传染源。造成检出率低的原因,除了本身荧光pcr法的局限性,更重要的是因为新型冠状病毒本身的特性、造成在咽部等上呼吸道病毒低度很低,因此我们需要一种更有效的病毒标本采集分法,同时结合digitalpcr可以直接检测核酸分子的绝对数目,其灵敏度可低至单拷贝能精确的对低丰度样品进行定量检测的特点,从而可望大大提高检出率。基于目前的流行病学调查,新型冠状病毒2019-ncov潜伏期为1-14天,多为3-7天。更为重要的是潜伏期也具有传染性,无症状感染者也可能成为传染源。因此急需一种新型而高灵敏度的检测方法,为疫情防控提供解决方案。技术实现要素:本发明的目的在于克服现有技术存在的不足,而提供一种新型冠状病毒2019-ncov核酸试剂盒和病毒核酸采集方法。本发明的目的是通过如下技术方案来完成的。一种digitalpcr探针法结合快速精准检测新型冠状病毒2019-ncov核酸试剂盒,根据新型冠状病毒2019-ncovorf1ab和n基因作为扩增靶区域,设计特异性引物及荧光探针用于样品中新型冠状病毒2019-ncov核酸的检测;target1(orf1ab):正向引物(f):ccctgtgggttttacacttaa反向引物(r):acgattgtgcatcagctga荧光探针(p):5'-hex-ccgtctgcggtatgtggaaaggttatgg-bhq1-3'target2(n基因):正向引物(f):ggggaacttctcctgctagaat反向引物(r):cagacattttgctctcaagctg荧光探针(p):5'-fam-ttgctgctgcttgacagatt-bhq1-3'。本发明提供了一种病毒核酸采集方法,将配制好的superpremix反应液a结合superpremix反应液b和c,采用一步法对2019-ncov核酸rna进行digitalpcr绝对定量,将稀释后的阳性病毒样品rna进行digitalpcr检测,以标本病毒rna以900nm的引物终浓度和300nm的探针终浓度为最佳反应浓度,orf1ab探针和n基因的探针在温度为60.0℃时进行退火处理;通过orf1ab和n基因两组特异性探针对2019-ncov进行检测;组别分为阳性、阴性质控品及待检样品,检测结果判定:待检样品的hex和fam荧光通道均为阳性,可判定为待检样品2019n-cov病毒核酸阳性,且阳性质控品通道为阳性,阴性质控品通道为nocall;相反,待检样品判定为阴性。本发明的有益效果为:通过新型病毒核酸采集法,再结合digitalpcr探针法,提高新型冠状病毒2019-ncov感染的核酸阳性检出率,确保过程规范、标准,降低人为不规范操作对检测结果造成的影响,保证结果的可靠性,同时避免痰液和咽拭子取样结合实时荧光pcr法检测带来的假阴性结果。附图说明图1为本发明hex荧光通道拷贝数示意图。图2为本发明fam荧光通道拷贝数示意图。具体实施方式下面将结合附图和实施例对本发明做详细的介绍:1、特异性引物和探针的设计:本发明根据新型冠状病毒2019-ncovorf1ab(开放读码框1ab)和n基因(核壳蛋白)作为扩增靶区域,设计特异性引物及荧光探针(中国疾病预防控制中心公布的序列),用于样品中新型冠状病毒2019-ncov核酸的检测,保证本发明的检测特异性target1(orf1ab):正向引物(f):ccctgtgggttttacacttaa反向引物(r):acgattgtgcatcagctga荧光探针(p):5'-hex-ccgtctgcggtatgtggaaaggttatgg-bhq1-3'target2(n基因):正向引物(f):ggggaacttctcctgctagaat反向引物(r):cagacattttgctctcaagctg荧光探针(p):5'-fam-ttgctgctgcttgacagatt-bhq1-3'本发明根据中国疾病预防控制中心公布的序列,对探针进行不同荧光的修饰,实现单管一步法检测。以上引物及探针均在宝日医生物技术(北京)有限公司(takara中国)合成,并经过hplc纯化。2、新型病毒核酸采集方法:口罩采集(内含活性炭,聚丙烯等材料)基于2019-ncov新型冠状病毒的特性,本发明制备了特殊口罩收集患者经呼吸道排出(咳嗽等)的病毒,之后用病毒溶解液对口罩进行润洗再进行富集,可提高病毒载量丰度,大大提升检出率。3、基于digitalpcr的实验原理,本发明主要分为superpremix反应液和质控品两部分:superpremix反应液a:(包含热启动taq酶,rt酶,dtt,特异性引物和探针,缓冲液等)superpremix反应液b(探针液滴产生油)superpremix反应液c(液滴读取器油)质控品(阴性质控品见表1和阳性质控品见表2)表1阴性参考品组份编号组分浓度negative1腺病毒1000copies/μlnegative2甲型流感病毒1000copies/μlnegative3呼吸道合胞病毒1000copies/μlnegative4mers冠状病毒假病毒1000copies/μlnegative5sars冠状病毒假病毒1000copies/μlnegative6副流感病毒1000copies/μlnegative7冠状病毒hku11000copies/μlnegative8冠状病毒nl631000copies/μlnegative9冠状病毒229e1000copies/μlnegative10冠状病毒oc431000copies/μl表2阳性参考品组份编号组分浓度positive12019-ncov假病毒1000copies/μlpositive22019-ncov假病毒100copies/μlpositive32019-ncov假病毒10copies/μl将配制好的superpremix反应液a结合superpremix反应液b和c,进行digitalpcr检测。组别分为阳性、阴性质控品及待检样品,选择适合的仪器,按操作说明书进行。检测结果判定:待检样品的hex和fam荧光通道均为阳性,可判定为待检样品2019n-cov病毒核酸阳性,且阳性质控品通道为阳性,阴性质控品通道为nocall。相反,待检样品判定为阴性。本发明采用一步法对2019-ncov核酸rna进行digitalpcr绝对定量,通过orf1ab和n基因两组特异性探针对2019-ncov进行检测。本发明还对各要素进行了系统优化,操作更简单、灵敏度更高、污染小等优点。发明的效果本发明通过与荧光pcr法比较,检测2019-ncov阳性样品,发现具有明显的灵敏度高、检测限低等优点。实验室病毒进行富集后,并将阳性样品rna浓度按10-1~10-7倍比稀释,进行rt-荧光pcr法和rt-digitalpcr法进行定量。通过实验发现rt-digitalpcr法的定量结果如表3所示,hex(orf1ab)荧光通道的拷贝数分别为:6840、670、69、6.8、5.4、4.2、1.6copies/μl;fam(n基因)荧光通道的拷贝数分别为:6350、640、63、6.6、5.1、4.3、1.8copies/μl。rt-荧光pcr扩增曲线ct值如表4所示,稀释度为10-7时,rt-荧光pcr与阴性对照均无明显扩增,无ct值显示,因此rt-荧光pcr法的灵敏度为稀释度为10-6阳性样品的浓度,hex(orf1ab)的ct值为34.77;fam(n基因)的ct值为35.45(小于37)。而rt-digitalpcr法在微滴生成正常,满足泊松分布的条件下,在稀释度为10-7时实测阳性样品的拷贝数浓度分别为3.6和3.1copies/μl。结果显示rt-digitalpcr法最低检测限低至个位拷贝数,rt-digitalpcr法的灵敏度比rt-荧光pcr法高一个数量级。表3rt-digitalpcr法结果样本稀释度hex(orf1ab)拷贝数fam(n基因)拷贝数10-16480copies/μl6350copies/μl10-2670copies/μl640copies/μl10-369copies/μl63copies/μl10-46.8copies/μl6.6copies/μl10-55.4copies/μl5.1copies/μl10-64.2copies/μl4.3copies/μl10-71.6copies/μl1.8copies/μl表4rt-荧光pcr法结果样本稀释度hex(orf1ab)ct值fam(n基因)ct值10-120.1420.7710-223.1623.7610-326.4226.8910-428.4329.1310-530.2631.3910-632.5133.2410-7unknowunknow本发明通过检测2019-ncov阳性样品以及肠道病毒、腺病毒,如表5所示2019-ncov阳性样品的hex拷贝数488copies/μl;fam荧光通道拷贝数465copies/μl。肠道病毒与腺病毒检测结果均为nocall,说明本发明具有高特异性。表5本发明检测的2019-ncov阳性样品、肠道病毒及腺病毒结果rt-digitalpcr法2019-ncov阳性样品肠道病毒腺病毒hex(orf1ab)拷贝数488copies/μlnocallnocallfam(n基因)拷贝数465copies/μlnocallnocall本发明通过不同时间检测同一2019-ncov阳性样品,结合实验结果的标准偏差和相对标准偏差,如表6和7所示。说明本发明的检测节结果在组间重复和组内重复都具有良好的重复性。表6:hex荧光通道数值稀释度第一天第五天第十天标准偏差(sd)平均值相对标准偏差(rsd%)10-1876389239012103.028899.331.1610-286583391232.44870.003.7310-37656678.1866.3312.3310-48.57.68.30.398.134.7410-56.56.25.70.336.135.3810-63.43.12.90.213.136.56表7:fam荧光通道数值稀释度第一天第五天第十天标准偏差(sd)平均值相对标准偏差(rsd%)10-1925698738903400.869344.004.2910-294596587638.13928.674.1110-38998923.7493.004.0210-49.18.99.70.349.233.6810-57.36.77.80.457.276.1910-64.34.73.80.374.278.63实施例本发明的具体实验步骤如下:阳性标本病毒rna提取(采用takaraminibestviralrna/dnaextractionkit)1.原液中病毒的裂解:取200μl病毒原液,加入200μl的buffervgb、20μl的proteinasek,充分混匀于56℃水浴10分钟。向裂解液中加入200μl无水乙醇,充分吸打混匀。2.将spincolumn安置于collectiontube上,溶液移至spincolumn中,12,000rpm离心2分钟,弃滤液。3.将500μl的bufferrwa加入至spincolumn中,12,000rpm离心1分钟,弃滤液。4.将700μl的bufferrwb加入至spincolumn中,12,000rpm离心1分钟,弃滤液。5.重复操作步骤4。6.将spincolumn安置于collectiontube上,12,000rpm离心2分钟。7.将spincolumn安置于新的1.5mlrnasefreecollectiontube上,在spincolumn膜的中央处加入30-50μl的rnasefreedh2o,室温静置5分钟。8.12,000rpm离心2分钟洗脱rna。9.rna浓度检测。rt-digitalpcr实验步骤(伯乐公司的qx200pcr仪)微滴生成:配制20μl探针反应体系:反应体系体积(μl)superpremix反应液a18rna模板2将上述转移至微滴生成卡夹中,再加入本发明superpremix反应液b70μl,将卡夹放在微滴生成仪autodgtm上,开始生成微滴。pcr扩增1.自动液滴发生器中取出包含微滴的微滴板。用px1pcrplatesealer密封板2.进行热循环扩增微滴读取扩增完后,将96孔板放在qx200读取仪上,并加上本发明superpremix反应液c,打开quantsoft软件,进行液滴读取。每个实验中的阴性对照组中加入阴性质控品代替反应模板。由于引物和探针的最佳反应浓度及退火温度对本发明的特异性和灵敏度至关重要,因此在本发明过程中,进行了digitalpcr探针浓度的优化和digitalpcr退火温度的优化。探针浓度的优化:根据上述实验步骤,将稀释后的阳性病毒样品rna进行digitalpcr检测,探索本发明探针浓度的最优条件。实验中分别选用900nm引物终浓度和从左到右依次为500、400、300、200、100nm5个不同的探针终浓度。结果如表8所示,从荧光信号强度来看,探针浓度越高拷贝数信号越强。当orf1ab和n基因探针浓度均为500nm或400nm时,反应的荧光信号强度过高,出现阳性扩增抑制。而当探针浓度为200或100nm时,反应的荧光信号强度较弱;因此,从实验结果显示标本病毒rna以900nm的引物终浓度和300nm的探针终浓度均为最佳反应浓度。表8探针浓度梯度结果探针浓度hex(orf1ab)拷贝数fam(n基因)拷贝数500nm435copies/μl445copies/μl400nm523copies/μl519copies/μl300nm786copies/μl762copies/μl200nm598copies/μl593copies/μl100nm387copies/μl391copies/μl探针退火温度的优化:根据优化后的探针浓度,将稀释后的阳性病毒样品rna进行digitalpcr检测,探索本发明探针退火温度的最优条件。如表9所示,orf1ab探针在不同退火温度下65.0℃、63.8℃、62.8℃、61.5℃、60.0℃、57.9℃、56.8℃、55.0℃对样品进行rt-digitalpcr。横坐标表示微滴数目,纵坐标表示荧光信号强度,直接在quantasoft软件上读取微滴数和拷贝数,实验所检测样品的拷贝数分别为344、356、378、398、469、412、388和365copies/μl。而n基因的探针在相同退火温度梯度下拷贝数分别为354、376、373、412、508、455、372和324copies/μl。结果显示,orf1ab探针和n基因在温度为60.0℃时,检测样本的拷贝数都为最高,由此可见本发明的反应最佳退火温度为60.0℃,大大提高了本发明的可靠性。表9探针退火温度梯度结果本发明的线性分析和最低检出限确定:提取核酸病毒rna后,通过nanodroplite紫外分光光度计进行定量,其浓度为3.56×106copies/μl。并将其作为标准品进行10倍稀释,浓度分别为s0-s7:3.56×106,3.56×105,3.56×104,3560,356,35.6,3.5copies/μl。rt-digitalpcr检测后hex和fam荧光通道拷贝数如表10所示。以标准品拷贝数的log10为纵坐标,rt-digitalpcr检测hex荧光通道线性方程为y=1.0519x-0.4262,相关系数r2=0.9987,检测fam荧光通道线性方程为y=1.0205x-0.3296,相关系数r2=0.9989,线性关系良好,见图1和2,表明本发明结果准确可靠。由此可确定rt-digitalpcr法对2019-ncov病毒的定量检测线性范围为5个数量级,且digitalpcr测定2019-ncov病毒的检测限为1.43copies/μl。s0s1s2s3s4s5s6s7标准品(copies/ul)3.56x1063.56x1053.56x104356035635.63.56hex(copies/ul)nocall214563245672214212181.13fam(copies/ul)nocall196534232341787198221.43表10标准品线性分析及最低限测定临床标本验证:1、检测方法的比较利用本发明建立好的digitalpcr体系,对临床标本进行2019-ncov病毒核酸检测。同一患者,每隔2天前后采集三次咽拭子标本,提取病毒rna后,分别进行rt-荧光pcr法和rt-digitalpcr法对病毒核酸进行定量。根据表11所示,rt-荧光pcr法前两次检测结果均无荧光信号;而第三次采集的标本检测时,hex和fam均出现了荧光扩增信号,ct值为33.56和32.22,表示标本病毒核酸为阳性。而根据本发明实验步骤,rt-digitalpcr法检测结果显示,3次采集标本均为病毒核酸阳性,只是前两次病毒拷贝数较低,如表12所示hex(orf1ab)荧光通道分别为1.7copies/μl、2.1copies/μl;fam(n基因)荧光通道分别为1.9copies/μl,2.3copies/μl。第三次标本hex(orf1ab)为14.4copies/μl;fam(n基因)为13.2copies/μl。说明本发明具有更高的灵敏度,对疫情早期筛查至关重要。表11临床标本荧光pcr法检测结果标本采集第一次第二次第三次hex(orf1ab)ct值unknowunknow33.56fam(n基因)ct值unknowunknow32.22表12临床标本荧光pcr法检测结果标本采集第一次第二次第三次hex(orf1ab)拷贝数1.7copies/μl4.1copies/μl14.4copies/μlfam(n基因)拷贝数1.9copies/μl4.3copies/μl13.2copies/μl2、标本采集的比较临床同一患者分别采用咽拭子和痰液及本发明的口罩病毒富集法。佩戴本发明的特制口罩2h后,润洗并富集病毒rna后,进行rt-digitalpcr法对病毒核酸进行定量。根据表13结果所示,本发明的口罩标本富集法检测结果,在hex(orf1ab)荧光通道和fam(n基因)荧光通道拷贝数都远远大于咽拭子和痰液标本结果,大大提高了病毒载量丰度,进而提高了本发明的2019-ncov病毒核酸检测灵敏度表13临床标本痰液及口罩富集法检测结果标本采集方式咽拭子痰液口罩富集法hex(orf1ab)拷贝数3.5copies/μl5.8copies/μl25.4copies/μlfam(n基因)拷贝数3.2copies/μl6.1copies/μl25.3copies/μl本发明经过多次实验优化,在口罩标本富集法基础上,建立了一步法digitalpcr法检测2019-ncov病毒核酸绝对定量的方法,减少了两步法和荧光定量pcr法中可能出现的污染,具有特异性强、灵敏度高、检测限低等优点。对疫情的检出和防控等方面具有重要意义。可以理解的是,对本领域技术人员来说,对本发明的技术方案及发明构思加以等同替换或改变都应属于本发明所附的权利要求的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1