一种从人多能干细胞分化为自然杀伤细胞的方法及应用与流程
本发明涉及干细胞生物学领域,尤其涉及多能或多潜能干细胞的谱系特异性分化,具体涉及一种从人多能干细胞分化为自然杀伤细胞的方法及应用。
背景技术:
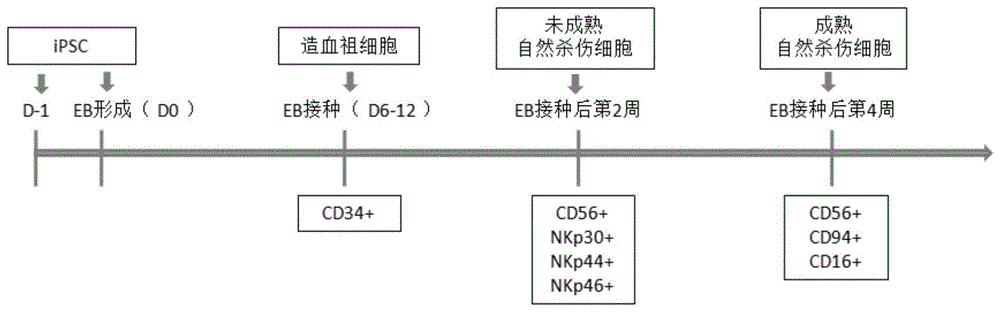
:2018年全国最新癌症报告显示2014年全国恶性肿瘤估计新发病例数380.4万例,平均每天超过1万人被确诊为癌症。肿瘤发病率为278.07/10万,0-74岁累积发病率为21.58%,累积死亡率为12.00%。2013年《科学》杂志将肿瘤免疫治疗列为十大科学突破之首,免疫治疗成为继手术、化疗、放疗、肿瘤靶向治疗后的新一代的肿瘤治疗手段,为肿瘤病人的治疗带来了新的希望。自然杀伤细胞(naturalkillercell,nk)是先天免疫系统的主力军,是机体防御感染和抗击肿瘤的第一道防线,可通过恶性病变细胞表面的“自我缺失”(missing-self)模式或“压力诱导”(stress-induced)模式识别并杀伤病变细胞。nk细胞的激活依赖于其细胞表面的活化型和抑制型受体信号平衡的结果。活化的nk细胞可通过多种机制杀伤肿瘤细胞:nk细胞可释放穿孔素和颗粒酶,直接作用于靶细胞以杀伤癌细胞;可通过分泌促炎性细胞因子促进癌细胞凋亡;可定向识别单克隆抗体药物标记的癌细胞来完成杀伤。nk细胞的识别和杀伤具有mhc-i非限制性、泛特异性和快速应答的特点,无移植物抗宿主反应(gvhd),可采用异体细胞回输,体内存活周期短,且无细胞因子风暴等副作用,可以与肿瘤靶向抗体联合使用以增强抗癌效果,可以与基因编辑技术相结合开发出针对不同肿瘤靶点的靶向型的nk细胞产品,这些特点使其在肿瘤免疫治疗中展现出巨大的应用潜力。以往研究证实,肿瘤患者体内nk细胞通常数量减少、功能受损。因此nk细胞的过继疗法有恢复患者免疫功能以抵抗肿瘤的功效。但自体来源nk细胞回输后的临床研究结果显示其抗肿瘤效果非常有限。主要原因可能包括:(1)自体nk细胞的kir受体与肿瘤细胞hla相匹配,“自我”识别信号抑制nk细胞活化;(2)患者自体nk细胞功能受损,难以产生理想的杀伤作用。直接从外周血扩增的nk细胞有一定的难度,对患者的细胞可能出现扩增失败,且通常扩增出的细胞混合物都含有一定比例的t细胞,需要做t细胞清除,否则会造成移植物抗宿主病(gvhd)。同时不同供体的nk细胞质量差异性很大,直接影响疗效,难以形成标准化产品。人多能干细胞(humanpluripotentstemcell,hpsc)包括人胚胎干细胞(humanembryonicstemcell,hesc)和人诱导多能干细胞(humaninducedpluripotentstemcells,hipsc),具有无限增殖的能力,并且在体外可以分化为几乎所有功能细胞,包括nk细胞。从人多能干细胞在体外规模化、标准化制备nk细胞是nk细胞产品成药的有效的解决途径。但目前已报道的分化过程,存在过程复杂、周期长、饲养层细胞依赖、培养基成分不明确、分化细胞功能缺陷、纯度和活力低等问题,使其分化过程不利于规模化生产。与本发明最接近的专利有:专利cn102388130a公开了一种多能细胞的分化,专利cn107429230a公开了一种用于诱导造血细胞分化的方法和组合物,专利cn102822332a公开了一种从源于hesc的成血管细胞产生自然杀伤细胞和树突细胞的方法。专利cn102388130a至少存在以下一些问题:仅仅包括hpsc向造血前体细胞的分化,而不包含造血前体细胞继续向nk细胞的分化阶段。所用因子组合没有绕过原始造血期。专利cn107429230a至少存在以下一些问题:(1)eb3d培养时效率极低。(2)从hpsc到永久多潜能血液前体细胞采用2d分化条件。(3)全程用了成分不明确的昂贵的商业化培养基(如stempro34)、牛血清等,不利于临床级细胞产品的生产。(4)将富集的cd34+/cd45+细胞用于ink(ipsc-derivednk,由ipsc诱导分化的nk细胞)分化,流程繁琐。专利cn102822332a至少存在以下一些问题:(1)使用了成分不明确的昂贵的商业培养基;(2)得到的成血内皮细胞大部分属于原始造血期细胞;(3)涉及到了把分化第4天的eb消化得到的单细胞接种到了methylcellulose培养体系中进一步分化得到血管细胞,这一体系不利于临床级nk细胞的规模化生产;(4)方法中的第二和第三步均用到了含人血清的培养基。综上所述,nk细胞应用于免疫治疗癌症具有独特的优势和广泛的应用前景,而外周血来源的nk细胞(pb-nk)的nk细胞细胞来源有限,质量和产率不一,扩增后往往含有t细胞污染。因此以hpsc为来源制备nk细胞可以解决这些问题而达到稳定的规模化生产。但是现有的分化方案中存在很多问题:如使用含血清的培养基,而血清是不可控的培养因素更带来批次差异等不稳定因素;动物细胞来源的饲养层细胞如op9的使用不符合临床的生产要求;使用商业化的无血清培养基价格昂贵,不适合规模化生产;分化过程复杂,细胞因子使用剂量和时间未充分优化精简,导致成本高昂;分化周期长也增加了生产成本同时提高了不可控的过程控制;分化出的nk细胞纯度低和功能欠缺的问题。因此,亟需发明一种稳定高效、低成本、高纯度、有功能的nk细胞分化体系,为nk细胞的规模化生产和临床应用建立基础。技术实现要素:虽然从多能干细胞体外分化为自然杀伤细胞的过程在原理层面已经较为明确,且目前已有多种诱导分化的方法,但现有的分化方法或者存在分化周期长、分化效率和纯度低、分化成分不明、饲养层细胞依赖、操作复杂成本高的问题,因此难以扩大生产并用于临床。本发明提供的分化程序,基于成分明确的培养基和优化的细胞因子组合,能够快速、高效、简便,且成本较低的诱导多能干细胞分化为自然杀伤细胞。其优势如下:第一,本发明实现了稳定、高效的自然杀伤细胞的分化,可以在40天左右获纯度90%以上且具有功能性的nk细胞;第二,整个分化过程我们未使用含有血清的培养体系或饲养层细胞,适于扩大生产和临床应用;第三,我们尽量简化和优化了分化过程中使用的培养基和细胞因子,避免了使用昂贵的商业化培养基如stemspan等,因此整个分化过程的成本大大降低。本发明的关键创新点在于:1)eb3d分化的方法成本低、周期短、效率高,只需要25天左右就能获得数量大、纯度高,并且与外周血来源的nk细胞有类似的细胞毒作用的nk细胞,适合规模化生产;2)分化培养基的成分明确,可在不使用血清和滋养层细胞的条件下成功分化nk细胞,适合临床应用;3)优化了扩增条件,同样可在无血清和滋养层细胞的情况下对分化获得的nk细胞进行大量扩增;4)优化了冻存条件,nk细胞可以长期储存,并在复苏后保持较高的细胞活力。具体的,本发明的技术方案如下:本发明第一个方面公开了一种多能干细胞来源的自然杀伤细胞,其表达cd56、nkp30、nkp44和nkp46,还表达成熟自然杀伤细胞的标志物cd16和cd94。本发明中,nkp46、nkp30和nkp44均属于自然细胞毒性受体(ncr),三者均为免疫球蛋白超家族(igsf)成员,但彼此无同源性。ncr只表达于nk细胞表面,是nk细胞特有的标志,通常在kir/klr丧失识别“自我”能力时,发挥杀伤作用。nkp30(ncr3)是ncr家族的一个重要成员,表达于所有nk细胞表面,在nk细胞活化以及杀伤肿瘤的过程中发挥重要作用。nkp44即cd336,属igsf成员,一种天然细胞毒性受体(ncr2)。其表达于活化nk细胞中,配体为dap12,参与介导nk细胞的杀伤活性。nkp46胞外区含有2个ig样结构域,nkp30胞外区只有一个v型结构域。nkp46和nkp30胞浆区较短,跨膜区均含带正电荷的精氨酸。本发明第二个方面公开了一种制备自然杀伤细胞的方法,包括以下步骤:s1:形成拟胚体;s2:拟胚体向造血祖细胞分化;s3:造血祖细胞向nk细胞分化;s4:nk细胞的成熟和扩增。优选的,所述s1包括:s11:将人多能干细胞的细胞悬液置于摇床上摇动培养过夜,形成拟胚体。优选的,所述s2包括:s21:去除拟胚体上清液,加入新鲜的第一步骤分化培养基进行细胞培养;其中,所述第一步骤分化培养基是在基础分化培养基中添加小分子gsk3β抑制剂,以及至少一种以下成分:bmp信号通路激活剂、vegf(血管内皮生长因子)、bfgf(碱性成纤维生长因子)、scf(干细胞因子)、flt3l(fms样酪氨酸激酶3配体)、il3(白细胞介素3)、il6(白细胞介素6)、insulin(胰岛素)、igf-1(胰岛素样生长因子1)和tpo(人促血小板生成素);s22:去除第一步骤分化培养基,加入第二步骤分化培养基进行细胞培养;其中,所述第二步骤分化培养基是在基础分化培养基中添加vegf、bfgf,以及至少一种以下成分:bmp信号通路激活剂、noda抑制剂、scf、flt3l、il15、il3、il6、insulin、igf-1和tpo的细胞因子。s23:去除第二步骤分化培养基,加入第三步骤分化培养基进行细胞培养,得到造血祖细胞;其中,所述第三步骤分化培养基是在基础分化培养基中添加生长因子和集落刺激因子。更优选的,所述生长因子选自egf(表皮生长因子)、vegf(血管内皮生长因子)、bfgf、insulin、igf-1、pgf(血小板生长因子)和pdgf(血小板衍生生长因子)中的一种或多种;所述集落刺激因子选自g-csf(粒细胞集落刺激因子)、m-csf(巨噬细胞集落刺激因子)、gm-csf(重组人粒-巨噬细胞集落刺激因子)、multi-csf(多重集落刺激因子,又称为il-3)、epo(促红细胞生成素)、tpo、scf和flt-3l中的一种或多种。优选的,在s3中,去除第三步骤分化培养基,将细胞接种于包被有基质蛋白的细胞培养容器,加入第四步骤分化培养基进行细胞培养;所述基质蛋白至少包括notch通路激活蛋白或整合蛋白中的一种;其中,所述第四步骤分化培养基是在基础分化培养基中添加集落刺激因子和白细胞介素。通过包被有notch通路激活蛋白和整合蛋白的细胞培养容器进行培养,不仅可以增加细胞的生长速度的同时,还可以提高nk细胞的分化效率。在本发明的一些具体实施例中,所述细胞培养容器为细胞培养瓶。更优选的,所述集落刺激因子选自g-csf、m-csf、gm-csf、multi-csf(il-3)、epo、tpo、scf和flt-3l中的一种或多种;所述白细胞介素选自il-1、il-2、il-6、il-7、il-12、il-15、il-18、il-21和il-27中的一种或多种。更优选的,所述notch通路激活蛋白选自dll1重组蛋白、dll4重组蛋白、jagged-1重组蛋白、jagged-2重组蛋白以及它们变体中的一种或多种,此处“它们”指dll1重组蛋白、dll4重组蛋白、jagged-1重组蛋白或jagged-2重组蛋白。所述整合蛋白选自fibronectin(纤维粘连蛋白)、laminin(层粘连蛋白)、vitronectin(玻璃粘连蛋白)、madcam-1(粘接细胞黏附分子-1)、vcam-1(血管细胞粘附分子-1)和icam(细胞间黏附分子)以及这些整合蛋白的变体中的一种或多种,此处“它们”指fibronectin(纤维粘连蛋白)、laminin(层粘连蛋白)、vitronectin(玻璃粘连蛋白)、madcam-1(粘接细胞黏附分子-1)、vcam-1(血管细胞粘附分子-1)或icam(细胞间黏附分子)。优选的,所述s4包括:去除第四步骤分化培养基,加入第五步骤分化培养基进行细胞培养;其中,所述第五步骤分化培养基是在基础分化培养基中添加白细胞介素和促进nk细胞成熟和扩增的物质。更优选的,所述白细胞介素选自il-2、il-12、il-18、il-21和il-27和il-15中的一种或者多种;所述促进nk细胞成熟和扩增的物质选自人ab血浆、人血小板裂解物、vitamina(维生素a)、烟酰胺、vitamine(维生素e)和heparin(肝素)中的一种或者多种。优选的,还包括步骤s5:将分化得到的nk细胞采用冻存液进行冻存;所述冻存液包括:氯化钠、葡萄糖钠、醋酸钠、氯化钾、氯化镁、人血白蛋白和dmso。在本发明的一些具体实施例中,nk细胞的冻存液成分如下表1所示。表1序号成分终浓度1氯化钠1-10mg/ml2葡萄糖酸钠1-10mg/ml3醋酸钠1-10mg/ml4氯化钾0-1mg/ml5氯化镁0-1mg/ml6hsa(人血白蛋白)10-30%7dmso(二甲基亚砜)5-20%本发明中制备上述的自然杀伤细胞的方法的步骤具体如下:(一)day-1~day0:拟胚体(eb)的形成将状态良好未分化的、培养至聚合度70-90%的ipsc消化为单细胞悬液,以一定密度重悬于ipsc维持培养基中,置于37℃培养箱内的摇床上摇动培养过夜,形成大小和形态较为均一的eb。day-1~day0实验操作细节及优化1)人ipsc的培养实验中所用的人ipsc经过严格的多能性验证(表达各种多能性标志物,并可在免疫缺陷小鼠体内形成包含内、中、外三个胚层的畸胎瘤)。ipsc在ipsc维持培养基中正常培养,所用的培养基为e8或tesr或其它类似培养基。2)eb的形成按上述方法培养ipsc至70-90%聚合度时进行拟胚体形成实验。具体操作为:使用tryple或accutase将ipsc消化为完全的单细胞悬液,重悬于ipsc维持培养基中,并向培养基中加入rock抑制剂。将此细胞悬液置于37℃培养箱内的3d摇床上摇动培养,摇床的转速为10-100rpm;此步骤摇动培养的时间为8-32小时;培养结束时,获得大小和形态较为均一的eb。例如使用t25培养瓶时,rock抑制剂是y-27632,浓度为10μm;细胞密度为0.1×106-5×106/ml;摇床的转速为10-20rpm;培养的时间为8-32小时。(二)day0~day6-12:多能干细胞向造血祖细胞的分化将上述d0的eb在不同的时间点更换分化培养基,并在d6-12收获含有高表达cd34+细胞的eb。day0~day6-12实验操作细节及优化1)day0:更换为第一步骤分化培养基从培养箱内取出装有d0eb的培养瓶,倾斜培养瓶使eb沉于底部,去除上清,加入新鲜的第一步骤分化培养基。第一步骤分化培养基是在基础分化培养基中添加小分子gsk3β抑制剂,以及一种或多种选自bmp信号通路激活剂、vegf、bfgf、scf、flt3l、il3、il6、insulin、igf-1和tpo的细胞因子。bmp信号通路激活剂是bmp2、bmp4、sb4、ventromorphins(sj000291942,sj000063181,sj000370178)、isoliquiritigenin、diosmetin(香叶木素)、apigenin(芹菜素)和biochanin(鹰嘴豆芽素)等,其中,isoliquiritigenin是从光果甘草根中分到的黄酮类化合物,具有抗肿瘤的活性;gsk3β抑制剂是np031112,tws119,sb216763,chir-98014,azd2858,azd1080,sb415286,ly2090314和chir99021等。例如当使用t25培养瓶进行培养时,其中gsk3β抑制剂是chir99021,浓度为0.5-20μm;bmp信号通路激活剂是bmp4,浓度为0-200ng/ml;细胞因子包括insulin、igf-1、vegf、bfgf,浓度分别为0-10μg/ml、0-100ng/ml、5-100ng/ml和0-100ng/ml。eb在第一步骤分化培养基中培养的时间是(2-4)天。基础分化培养基的成分如下表2所示。表22)day2-4:更换为第二步骤分化培养基从培养箱内取出装有eb的培养瓶,倾斜培养瓶使eb沉于底部,去除第一步骤分化培养基上清,加入新鲜的第二步骤分化培养基。第二步骤分化培养基是在基础分化培养基中添加vegf、bfgf,以及一种或多种选自bmp信号通路激活剂、noda抑制剂、scf、flt3l、il15、il3、il6、insulin、igf-1和tpo的细胞因子。bmp信号通路激活剂的选择范围与d0相似;noda抑制剂选自lefty-a、lefty-b、lefty-1、lefty-2、sb431542、sb202190、sb505124、npc30345、sd093、sd908、sd208、ly2109761、ly364947、lt580276、a83-01,以及它们的衍生物。例如当使用t25培养瓶进行培养时,其中bmp信号通路激活剂是bmp4,浓度为0-200ng/ml;noda抑制剂是sb431542,浓度为0-20μm;细胞因子包括insulin、igf-1、vegf、bfgf、il3和il6,浓度分别为0-10μg/ml、0-100ng/ml、5-100ng/ml、0-100ng/ml、0-20ng/ml和0-20ng/ml。第二步骤分化培养基的换液时间点可以在day2至day4间。3)day3-6:更换为第三步骤分化培养基从培养箱内取出装有eb的培养瓶,倾斜培养瓶使eb沉于底部,去除第二步骤分化培养基上清,加入新鲜的第三步骤分化培养基。第三步骤分化培养基是在基础分化培养基中添加生长因子和集落刺激因子。生长因子是选自egf、vegf、bfgf、insulin、igf-1、pgf和pdgf等的一种或多种。集落刺激因子是选自g-csf、m-csf、gm-csf、multi-csf(il-3)、epo、tpo、scf和flt-3l等的一种或多种。例如当使用t25培养瓶进行培养时,其中生长因子是insulin、vegf、igf-1和bfgf,浓度分别为0.5-10μg/ml、5-100ng/ml、0-100ng/ml和0.5-100ng/ml;集落刺激因子是tpo、scf和flt-3l,浓度分别为0-100ng/ml、0-100ng/ml和0-100ng/ml;第三步骤分化培养基的换液时间点可以在day3至day6间。4)day6-12:对所得的造血祖细胞进行检测分化培养的第0天、第5天、第12天对拟胚体的直径进行检测。day6~day12期间选择合适的时间点,对拟胚体中的造血祖细胞使用流式细胞仪检测其细胞表型,证明所得细胞中含有表达cd34的造血祖细胞,cd34阳性的造血祖细胞占总细胞百分比应在20%至80%之间。其中,流式的抗体信息如下:apcmouseanti-humancd34clone581(ruo),bd,#555824;fitcanti-humancd45,biolegend,#304006。(三)eb接种后第1-2周(day6-12~day20-26):造血祖细胞向nk细胞分化将上述day6-12含cd34+造血祖细胞的eb重悬于第四步骤分化培养基中,接种于包被有细胞基质的培养瓶中培养2周,并在第1周和第2周结束时更换培养基,以维持下述各因子不同的作用时间段。在第2周结束时(day20-26)收获含有高cd3-cd56+的nk细胞。eb接种后第1-2周(day6-12~day20-26)实验操作细节:1)day6-12:更换为第四步骤分化培养基倾斜培养瓶使eb沉于底部,去除第三步骤分化培养基上清,将eb重悬于新鲜的第四步骤分化培养基中。第四步骤分化培养基是在基础分化培养基中添加集落刺激因子和白细胞介素。集落刺激因子是选自g-csf、m-csf、gm-csf、multi-csf(il-3)、epo、tpo、scf和flt-3l等中的一种或多种。白细胞介素是选自il-1、il-2、il-6、il-7、il-12、il-15、il-18、il-21和il-27等中的一种或多种。例如当使用t25培养瓶进行培养时,集落刺激因子是tpo、scf、flt-3l和il-3,浓度分别为0-100ng/ml、5-100ng/ml、5-100ng/ml和5-100ng/ml,作用的时间段是接种后的第1周、第2周或第1-2周。白细胞介素是il-2、l-7和il-15,浓度分别为100-1000iu/ml、5-100ng/ml和5-100ng/ml,作用的时间段是eb接种后的第1周、第2周或第1-2周。第四步骤分化培养基的换液时间点可以在day6至day12间。将重悬于第四步骤分化培养基中的eb按照合适的密度接种于包被有基质蛋白的培养瓶中。基质蛋白为至少一种以下成分:notch通路激活蛋白和整合蛋白。notch通路激活蛋白是dll1重组蛋白、dll4重组蛋白、jagged-1重组蛋白、jagged-2重组蛋白,以及这些notch通路激活蛋白的变体等。整合蛋白是fibronectin(纤维粘连蛋白)、laminin(层粘连蛋白)、vitronectin(玻璃粘连蛋白)、madcam-1(粘接细胞黏附分子-1)、vcam-1(血管细胞粘附分子-1)和icam(细胞间黏附分子),以及这些整合蛋白的变体等。例如当使用t25培养瓶进行培养时,notch通路激活蛋白是dll4-fc重组蛋白。整合蛋白是vcam-1。视细胞密度,每3-7天更换一半新鲜的第四步骤培养基。2)eb接种后第2周(day20-26)对所得的nk细胞进行检测eb接种后第2周,收集孔中的悬浮细胞。用流式细胞术检测细胞表面相关指标蛋白的表达情况。检测指标包括:cd56,nkp30,nkp44,nkp46。其中,流式的抗体信息如下:pemouseanti-humancd56cloneb159(ruo),bd,#555516;alexa647mouseanti-humancd337(nkp30),bd,#558408;alexa647mouseanti-humannkp44(cd336),bd,#558564;apcmouseanti-humancd335(nkp46),bd,#558051。3)eb接种后第3-4周(day27~day40):nk细胞的成熟和扩增eb接种后第3-4周(day27~day40)实验操作细节:eb分化两周后,细胞密度达到(1-2)×106个/ml,收集细胞,离心去除第四步骤分化培养基,以(0.5-1)×106个/ml的细胞密度重悬于新鲜的第五步骤分化培养基中。第五步骤分化培养基是在基础分化培养基中添加白细胞介素及其它促进nk细胞成熟和扩增的物质。白细胞介素是选自il-1、il-2、il-6、il-7、il-12、il-15、il-18、il-21和il-27等中的一种或多种。其它促进nk细胞成熟和扩增的物质是选自人ab血浆、人血小板裂解物、vitamina、烟酰胺(nam,vitaminb3)、vitamine和heparin等。例如当使用t25培养瓶进行培养时,白细胞介素是il-2、il-12、il-18、il-21和il-27和il-15,浓度分别为100-1000iu/ml、0-100ng/ml、0-100ng/ml、0-100ng/ml、0-100ng/ml和5-100ng/ml;促进nk细胞成熟和扩增的添加物质是人血小板裂解物、烟酰胺(nam)、vitamine和heparin,浓度分别为1-10%、1-10mmol/l、0-10mg/ml和0-100μg/ml。eb接种后第3-4周(day27-40)对所得的nk细胞进行检测在eb分化至第3-4周时(day27-40),收集孔中的悬浮细胞。用流式细胞术检测细胞表面相关指标蛋白的表达情况。检测指标包括:cd56、cd94和cd16。其中,流式的抗体信息如下:pemouseanti-humancd56cloneb159(ruo),bd,#555516;apcmouseanti-humancd94,bd,#559876;apcmouseanti-humancd16cloneb73.1(ruo),bd,#561304。在本发明的一具体实施例中,上述人多能干细胞通过专利cn108085299a公开的方法进行制备。应当理解,本领域技术人员还可以根据需要选择任意的人多能干细胞商业细胞系或细胞株来完成本发明,且均在本发明的保护范围之内。本发明中:1.基础分化培养基的成分包括:imdm、f-12、rhsa(重组人血白蛋白)、mtg-monothioglycerol(硫代甘油)、ascorbicacid(抗坏血酸)、humantransferrin(人类转铁蛋白)、naselenite(亚硒酸钠)和ethanolamine(乙醇胺)。其中,imdm和f12可作为开发无血清配方的基础,该培养基适用于血清含量较低条件下哺乳动物细胞培养;此培养基配方中,imdm和f-12以1:1混合配制。其他成份的组合和浓度是经过优化的、具有替代血清功能的补充剂,是维持向血液祖细胞分化和维持分化细胞增殖的添加剂。2.gsk-3抑制剂:阻碍gsk3β蛋白质的激酶活性的物质,例如gsk3β抑制剂ix(6-溴靛玉红3’-肟)、sb216763、gsk3β抑制剂vii(4-二溴苯乙酮)、l803-mts,以及具有高选择性的chir99021。本发明中优选chir99021。培养基中chir99021浓度只要是阻碍gsk3β蛋白质的激酶活性的浓度就没有特别限定,例如为0.1μm、0.2μm、0.3μm、0.4μm、0.5μm、0.6μm、0.7μm、0.8μm、0.9μm、1μm、1.1μm、1.2μm、1.3μm、1.4μm、1.5μm、2μm、2.5μm、3μm、4μm、5μm、6μm、8μm、10μm,但不限于此。优选为1~8μm。3.bmp信号通路激活剂:激活bmp信号通路的物质,可选择bmp2、bmp4、sb4、ventromorphins(sj000291942,sj000063181,sj000370178)、isoliquiritigenin,diosmetin、apigenin、biochanina等。本发明中使用的bmp激活剂为bmp4。培养基中bmp4的浓度只要是激活bmp信号通路就没有特别的限定,例如为5ng/ml、10ng/ml、20ng/ml、30ng/ml、40ng/ml、50ng/ml、60ng/ml、70ng/ml、80ng/ml、90ng/ml、100ng/ml、110ng/ml、120dng/ml、130ng/ml、140ng/ml、150ng/ml、160ng/ml、180ng/ml、200ng/ml,但不限于此。优选为5~50ng/ml。4.nodal抑制剂:抑制nodal信号通路的物质。可选择lefty-a、lefty-b、lefty-1、lefty-2、sb431542、sb202190、sb505124、npc30345、sd093、sd908、sd208、ly2109761、ly364947、lt580276、a83-01,以及它们的衍生物。本发明中使用的nodal抑制剂为sb431542。培养基中sb431542浓度只要是阻碍nodal信号通路就没有特别的限定,例如为0μm、1μm、2μm、3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、20μm、25μm、30μm,但不限于此。优选为1-20μm。5.集落刺激因子:能刺激的造血干细胞增殖和分化的细胞因子。可选择g-csf、m-csf、gm-csf、multi-csf(il-3)、epo、tpo、scf和flt-3l等。本发明中使用的集落刺激因子为g-csf、gm-csf、tpo、scf和flt-3l和multi-csf。培养基中tpo、scf和flt-3l的浓度只要是能刺激造血干细胞增殖和分化就没有特别的限定,例如tpo的浓度为0ng/ml、5ng/ml、10ng/ml、15ng/ml、20ng/ml、30ng/ml、40ng/ml、50ng/ml、60ng/ml、70ng/ml、80ng/ml、90ng/ml、100ng/ml,但不限于此。优选为0~100ng/ml。scf的浓度为0ng/ml、10ng/ml、20ng/ml、30ng/ml、40ng/ml、50ng/ml、60ng/ml、80ng/ml、100ng/ml、150ng/ml、200ng/ml,但不限于此。优选为0~100ng/ml。flt-3l的浓度为0ng/ml、1ng/ml、5ng/ml、10ng/ml、20ng/ml、30ng/ml、40ng/ml、50ng/ml、80ng/ml、100ng/ml、150ng/ml、200ng/ml,但不限于此。优选为0~100ng/ml。6.notch信号通路激活剂:激活notch信号通路的重组蛋白。可选择dll1重组蛋白、dll4重组蛋白、jagged-1重组蛋白、jagged-2重组蛋白,以及这些notch通路激活蛋白的变体等。本发明中使用的notch激活剂为dll4-fc重组蛋白。包被的dll4-fc重组蛋白包被的密度只要是能激活notch信号通路就没有特别的限定,例如dll4-fc重组蛋白包被的的密度为0μg/cm2、0.1μg/cm2、0.2μg/cm2、0.3μg/cm2、0.4μg/cm2、0.5μg/cm2、0.6μg/cm2、0.7μg/cm2、0.8μg/cm2、0.9μg/cm2、1μg/cm2、2μg/cm2、3μg/cm2、4μg/cm2、5μg/cm2,但不限于此。优选为0.5~2μg/cm2。7.生长因子:能刺激细胞增殖和细胞分化天然的蛋白。可选择egf、vegf、bfgf、insulin、igf-1、pgf、pdgf等。本发明中使用的生长因子为insulin、vegf、igf-1和bfgf。培养基中insulin、vegf和bfgf的浓度只要是能刺激细胞增殖和细胞分化就没有特别的限定,例如insulin的浓度为0μg/ml、0.5μg/ml、1μg/ml、2μg/ml、3μg/ml、4μg/ml、5μg/ml、6μg/ml、7μg/ml、8μg/ml、9μg/ml、10μg/ml、20μg/ml和30μg/ml。优选为0~10μg/ml。vegf的浓度为5ng/ml、10ng/ml、15ng/ml、20ng/ml、30ng/ml、40ng/ml、50ng/ml、60ng/ml、70ng/ml、80ng/ml、90ng/ml、100ng/ml、150ng/ml、200ng/ml,但不限于此。优选为5~100ng/ml。igf-1的浓度为5ng/ml、10ng/ml、15ng/ml、20ng/ml、30ng/ml、40ng/ml、50ng/ml、60ng/ml、70ng/ml、80ng/ml、90ng/ml、100ng/ml、150ng/ml、200ng/ml。优选为0~100μg/ml。begf的浓度为5ng/ml、10ng/ml、15ng/ml、20ng/ml、30ng/ml、40ng/ml、50ng/ml、60ng/ml、70ng/ml、80ng/ml、90ng/ml、100ng/ml、150ng/ml、200ng/ml,但不限于此。优选为0~100ng/ml。8.白细胞介素:能介导免疫细胞激活、增殖与分化的细胞因子。在不同的分化阶段可选择il-1、il-2、il-6、il-7、il-12、il-15、il-18、il-21和il-27等中的一种或几种。本发明中d6-12~d20-26(即eb接种后的两周内)使用的白细胞介素为il-2、il-7和il-15。培养基中il-2、il-7和il-15的浓度只要是能介导免疫细胞激活、增殖与分化就没有特别的限定,例如il-2的浓度为0iu/ml、50iu/ml、100iu/ml、200iu/ml、300iu/ml、400iu/ml、500iu/ml、700iu/ml、800iu/ml、1000iu/ml、2000iu/ml,但不限于此。优选为0~1000iu/ml。il-7的浓度为10ng/ml、20ng/ml、30ng/ml、40ng/ml、50ng/ml、60ng/ml、70ng/ml、80ng/ml、90ng/ml、100ng/ml、150ng/ml、200ng/ml,但不限于此。优选为5~100ng/ml。il-15的浓度为1ng/ml、5ng/ml、10ng/ml、15ng/ml、20ng/ml、25ng/ml、30ng/ml、40ng/ml、50ng/ml、60ng/ml、80ng/ml、100ng/ml、150ng/ml、200ng/ml,但不限于此。优选为5~100ng/ml。9.rock抑制剂:抑制rho激酶(rock)功能的物质。例如:y-27632、ha100、ha1152,和blebbistatin。本发明中优选y-27632。培养基中y-27632的浓度只要是抑制rho激酶的浓度就没有特别限定,例如为1μm、1.5μm、2μm、2.5μm、3μm、3.5μm、4μm、4.5μm、5μm、5.5μm、6μm、6.5μm、7μm、7.5μm、8μm、9μm、10μm、15μm、20μm、30μm、50μm,但不限于此。优选为10μm。本发明第三个方面公开了一种自然杀伤细胞,其由上述的方法制备而得。本发明第四个方面公开了一种细胞群,富集有上述的自然杀伤细胞。本发明第五个方面公开了一种预防和/或治疗肿瘤的药物,所述药物包含上述的自然杀伤细胞。本发明的关键点和欲保护点:1)基于小分子化合物和细胞因子联合使用的快速、高效、成本低的eb3d分化方法(包括小分子化合物和细胞因子的种类及其组合方式、加入时间、浓度等),使操作更简便、结果更稳定、成本更低廉,利于规模化ink生产。2)nk细胞分化和扩增培养基的成分。关键的创新点:分化和扩增培养基的成分明确,可在不使用血清和滋养层细胞的条件下成功分化和扩增nk细胞,适合规模化细胞制剂的生产和临床应用。3)优化了冻存条件,nk细胞可以长期储存,并在复苏后保持较高的细胞活力。在符合本领域常识的基础上,上述各优选条件,可任意组合,而不超出本发明的构思与保护范围。本发明相对于现有技术具有如下的显著优点及效果:第一,本方法在诱导分化期间使用3d悬浮培养,可在短期内(40天左右)1×105的hipsc获得大于1×107的nk细胞,适于规模化细胞制剂生产;第二,通过小分子化合物和细胞因子的联合使用,对分化过程进行精细调控,实现了稳定、高效的分化,最终培养体系中cd56+nk细胞比例可达90%以上;第三,本方法制备的nk细胞与pb-nk细胞有相近的细胞表型和功能性,且制备成本低廉,具有极大的临床及科研应用潜能;第四,本方法在诱导分化和扩增期间均使用无血清培养基且不使用饲养层细胞,适于后续临床级细胞制剂的生产和应用。附图说明图1显示了本发明公开的制备自然杀伤细胞的流程图。图2显示了本发明公开的方法中从多能干细胞诱导分化为成熟nk细胞的过程(分别为第-1天、第0天、第5天、第12天、eb接种2周后和eb接种4周后)。图3采用流式细胞仪对d8eb的特异性指标进行检测,显示造血干细胞(cd34+)已达到较高水平。图4采用流式细胞仪分别对eb接种后第2周和第4周的ink细胞的特异性指标进行检测,显示eb接种后第2周时cd56阳性的ink细胞已经达到80%以上,并同时高表达nkp30、nkp44和nkp46。eb接种后第4周时ink细胞同时表达成熟nk细胞的特异性指标cd94和cd16,表明nk细胞已经成熟。图5显示了eb接种后第4周收集的ink细胞对靶细胞k562产生了显著的细胞毒作用,细胞杀伤能力与pb-nk类似。图6显示第一步骤分化培养基中chir99021的浓度影响cd34+血液祖细胞的分化效率。图7显示第二分化培养基更换的时间影响cd34+血液祖细胞的分化效率。图8显示第三分化培养基更换的时间影响cd34+血液祖细胞的分化效率。图9显示eb接种时间点影响nk细胞(cd3-cd56+)的分化效率。图10显示bmp4的作用浓度影响cd34+血液祖细胞的分化效率。图11显示sb的作用浓度影响cd34+血液祖细胞的分化效率。图12显示bfgf的作用浓度影响cd34+血液祖细胞的分化效率。具体实施方式下面结合图和实施例对本发明的技术方案进行详细描述,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。本发明所用试剂和原料均市售可得。实施例1本实施例公开了一种制备自然杀伤细胞的方法,包括以下步骤:s1:形成拟胚体;s2:拟胚体向造血祖细胞分化;s3:造血祖细胞向nk细胞分化;s4:nk细胞的成熟和扩增。具体的,流程图如图1所示,步骤如下:(一)day-1~day0:拟胚体(eb)的形成1)人多能干细胞(ipsc)的培养实验中所用的人ipsc经过严格的多能性验证(表达各种多能性标志物,并可在免疫缺陷小鼠体内形成包含内、中、外三个胚层的畸胎瘤)。ipsc在ipsc维持培养基中正常培养,所用的培养基为e8或tesr或其它类似培养基。该人ipsc通过专利cn108085299a公开的方法进行制备。2)eb的形成按上述方法培养ipsc至70-90%聚合度时进行拟胚体形成实验。具体操作为:使用tryple或accutase将ipsc消化为完全的单细胞悬液,重悬于ipsc维持培养基中,并向培养基中加入rock抑制剂。将此细胞悬液置于37℃培养箱内的3d摇床上摇动培养,摇床的转速为10-100rpm;此步骤摇动培养的时间为8-32小时;培养结束时,获得大小和形态较为均一的eb。使用t25培养瓶时,rock抑制剂是y-27632,浓度为10μm;细胞密度为0.1×106-5×106/ml;摇床的转速为10-20rpm;培养的时间为8-32小时。(二)day0~day6-12:多能干细胞向造血祖细胞的分化1)day0:更换为第一步骤分化培养基从培养箱内取出装有d0eb的培养瓶,倾斜培养瓶使eb沉于底部,去除上清,加入新鲜的第一步骤分化培养基。第一步骤分化培养基是在基础分化培养基中添加小分子gsk3β抑制剂,以及一种或多种选自以下成分:bmp信号通路激活剂、vegf、bfgf、scf、flt3l、il3、il6、insulin、igf-1和tpo。bmp信号通路激活剂是bmp2、bmp4、sb4、ventromorphins(sj000291942,sj000063181,sj000370178)、isoliquiritigenin、diosmetin(香叶木素)、apigenin(芹菜素)和biochanin(鹰嘴豆芽素)等;gsk3β抑制剂是np031112,tws119,sb216763,chir-98014,azd2858,azd1080,sb415286,ly2090314和chir99021等。例如当使用t25培养瓶进行培养时,其中gsk3β抑制剂是chir99021,浓度为0.5-20μm;bmp信号通路激活剂是bmp4,浓度为0-200ng/ml;细胞因子包括insulin、igf-1、vegf、bfgf,浓度分别为0-10μg/ml、0-100ng/ml、5-100ng/ml和0-100ng/ml。其中,isoliquiritigenin是从光果甘草根中分到的黄酮类化合物,具有抗肿瘤的活性。eb在第一步骤分化培养基中培养的时间是(2-4)天。基础分化培养基的成分如下表2所示。表22)day2-4:更换为第二步骤分化培养基从培养箱内取出装有eb的培养瓶,倾斜培养瓶使eb沉于底部,去除第一步骤分化培养基上清,加入新鲜的第二步骤分化培养基。第二步骤分化培养基是在基础分化培养基中添加vegf、bfgf,以及一种或多种选自bmp信号通路激活剂、noda抑制剂、scf、flt3l、il15、il3、il6、insulin、igf-1和tpo的细胞因子。bmp信号通路激活剂的选择范围与d0相似;noda抑制剂选自lefty-a、lefty-b、lefty-1、lefty-2、sb431542、sb202190、sb505124、npc30345、sd093、sd908、sd208、ly2109761、ly364947、lt580276、a83-01,以及它们的衍生物。当使用t25培养瓶进行培养时,其中bmp信号通路激活剂是bmp4,浓度为0-200ng/ml;noda抑制剂是sb431542,浓度为0-20μm;细胞因子包括insulin、igf-1、vegf、bfgf、il3和il6,浓度分别为0-10μg/ml、0-100ng/ml、5-100ng/ml、0-100ng/ml、0-20ng/ml和0-20ng/ml。第二步骤分化培养基的换液时间点可以在day2至day4间。3)day3-6:更换为第三步骤分化培养基从培养箱内取出装有eb的培养瓶,倾斜培养瓶使eb沉于底部,去除第二步骤分化培养基上清,加入新鲜的第三步骤分化培养基。第三步骤分化培养基是在基础分化培养基中添加生长因子和集落刺激因子。生长因子是选自egf、vegf、bfgf、insulin、igf-1、pgf和pdgf等的一种或多种。集落刺激因子是选自g-csf、m-csf、gm-csf、multi-csf(il-3)、epo、tpo、scf和flt-3l等的一种或多种。例如当使用t25培养瓶进行培养时,其中生长因子是insulin、vegf、igf-1和bfgf,浓度分别为0.5-10μg/ml、5-100ng/ml、0-100ng/ml和0.5-100ng/ml;集落刺激因子是tpo、scf和flt-3l,浓度分别为0-100ng/ml、0-100ng/ml和0-100ng/ml;第三步骤分化培养基的换液时间点可以在day3至day6间。4)day6-12:对所得的造血祖细胞进行检测分化培养的第0天、第5天、第12天,拟胚体的直径分别为50-120μm、300-400μm、400-650μm。具体细胞形态见图3。day6~day12期间选择合适的时间点,对拟胚体中的造血祖细胞使用流式细胞仪检测其细胞表型,证明所得细胞中含有表达cd34的造血祖细胞,cd34阳性的造血祖细胞占总细胞百分比应在20%至80%之间。具体数据见图5。其中,流式的抗体信息如下:apcmouseanti-humancd34clone581(ruo),bd,#555824;fitcanti-humancd45,biolegend,#304006。(三)eb接种后第1-2周(day6-12~day20-26):造血祖细胞向nk细胞分化将上述day6-12含cd34+造血祖细胞的eb重悬于第四步骤分化培养基中,接种于包被有细胞基质的培养瓶中培养2周,并在第1周和第2周结束时更换培养基,以维持下述各因子不同的作用时间段。在第2周结束时(day20-26)收获含有高cd3-cd56+的nk细胞。eb接种后第1-2周(day6-12~day20-26)实验操作细节:1)day6-12:更换为第四步骤分化培养基倾斜培养瓶使eb沉于底部,去除第三步骤分化培养基上清,将eb重悬于新鲜的第四步骤分化培养基中。第四步骤分化培养基是在基础分化培养基中添加集落刺激因子和白细胞介素。集落刺激因子是选自g-csf、m-csf、gm-csf、multi-csf(il-3)、epo、tpo、scf和flt-3l等中的一种或多种。白细胞介素是选自il-1、il-2、il-6、il-7、il-12、il-15、il-18、il-21和il-27等中的一种或多种。使用t25培养瓶进行培养时,集落刺激因子是tpo、scf、flt-3l和il-3,浓度分别为0-100ng/ml、5-100ng/ml、5-100ng/ml和5-100ng/ml,作用的时间段是接种后的第1周、第2周或第1-2周。白细胞介素是il-2、l-7和il-15,浓度分别为100-1000iu/ml、5-100ng/ml和5-100ng/ml,作用的时间段是eb接种后的第1周、第2周或第1-2周。第四步骤分化培养基的换液时间点可以在day6至day12间。将重悬于第四步骤分化培养基中的eb按照合适的密度接种于包被有基质蛋白的培养瓶中。基质蛋白为至少一种以下成分:notch通路激活蛋白和整合蛋白。notch通路激活蛋白是dll1重组蛋白、dll4重组蛋白、jagged-1重组蛋白、jagged-2重组蛋白,以及这些notch通路激活蛋白的变体等。整合蛋白是fibronectin(纤维粘连蛋白)、laminin(层粘连蛋白)、vitronectin(玻璃粘连蛋白)、madcam-1(粘接细胞黏附分子-1)、vcam-1(血管细胞粘附分子-1)和icam(细胞间黏附分子),以及这些整合蛋白的变体等。例如当使用t25培养瓶进行培养时,notch通路激活蛋白是dll4-fc重组蛋白。整合蛋白是vcam-1。视细胞密度,每3-7天更换一半新鲜的第四步骤培养基。2)eb接种后第2周(day20-26)对所得的nk细胞进行检测eb接种后第2周,收集孔中的悬浮细胞。用流式细胞术检测细胞表面相关指标蛋白的表达情况。检测指标包括:cd56,nkp30,nkp44,nkp46。其中,流式的抗体信息如下:pemouseanti-humancd56cloneb159(ruo),bd,#555516;alexa647mouseanti-humancd337(nkp30),bd,#558408;alexa647mouseanti-humannkp44(cd336),bd,#558564;apcmouseanti-humancd335(nkp46),bd,#558051。3)eb接种后第3-4周(day27~day40):nk细胞的成熟和扩增eb接种后第3-4周(day27~day40)实验操作细节:eb分化两周后,细胞密度达到(1-2)×106个/ml,收集细胞,离心去除第四步骤分化培养基,以(0.5-1)×106个/ml的细胞密度重悬于新鲜的第五步骤分化培养基中。第五步骤分化培养基是在基础分化培养基中添加白细胞介素及其它促进nk细胞成熟和扩增的物质。白细胞介素是选自il-1、il-2、il-6、il-7、il-12、il-15、il-18、il-21和il-27等中的一种或多种。其它促进nk细胞成熟和扩增的物质是选自人ab血浆、人血小板裂解物、vitamina、烟酰胺(nam,vitaminb3)、vitamine和heparin等。例如当使用t25培养瓶进行培养时,白细胞介素是il-2、il-12、il-18、il-21和il-27和il-15,浓度分别为100-1000iu/ml、0-100ng/ml、0-100ng/ml、0-100ng/ml、0-100ng/ml和5-100ng/ml;促进nk细胞成熟和扩增的添加物质是人血小板裂解物、烟酰胺(nam)、vitamine和heparin,浓度分别为1-10%、1-10mmol/l、0-10mg/ml和0-100μg/ml。eb接种后第4周(day27-40)对所得的nk细胞进行检测在eb分化至第4周时(day27-40),收集孔中的悬浮细胞。用流式细胞术检测细胞表面相关指标蛋白的表达情况。检测指标包括:cd56、cd94和cd16。其中,流式的抗体信息如下:pemouseanti-humancd56cloneb159(ruo),bd,#555516;apcmouseanti-humancd94,bd,#559876;apcmouseanti-humancd16cloneb73.1(ruo),bd,#561304。分化培养的第-1天、第0天、第5天、第12天、eb接种后第2周和eb接种后第4周的具体细胞形态图见图2。实施例2本实施例研究不同的eb培养方法对eb分化率的影响。实验组中,整个诱导分化过程中采用3d悬浮培养形成拟胚体的培养方法,即在3d摇床上直接将ipsc形成较小体积的eb,然后在不同分化阶段更换成不同的特殊分化培养基(具体步骤参见实施例1)。在培养过程中,eb的体积逐渐增大,细胞不断增殖。相对于2d的分化方案(参见专利cn107429230a),3d分化条件大大节省了培养空间和培养体积,在相同的培养体系下获得的细胞数量显著增多,有利于hpsc向多潜能血液前体细胞的规模化生产。相对于spineb的分化方案(us20180072992a1)及文献中对eb细胞中的造血祖细胞进行分选和纯化后再用于进一步分化的方法,本发明的3d分化方案更简单易行,效率也更高,更适合于临床级的规模化生产。同时,本方案直接将第6-12天的eb用于分化,获得了较高的分化效率(eb分化第四周时cd56阳性的nk细胞比例达到90%以上),结果见图4。实施例3本发明发现3d诱导培养中,使用小分子试剂、细胞因子和细胞基质可替代血清和滋养层细胞,并加快分化进程、提高分化效率,利于后续临床级细胞制剂的生产。在我们的分化方法中,除了使用3d可提高分化效率,小分子试剂、细胞因子和细胞基质的联合使用不仅避免了血清和滋养层细胞的使用,也进一步增加了血液前体细胞的比例。gsk3β抑制剂选择chir99021,bmp信号通路激活剂使用bmp4,nodal抑制剂使用sb431542,细胞基质中的notch信号通路激活剂使用dll4-fc重组蛋白。在第6-12天时,获得的血液祖细胞的比例(cd34+)可高达20-80%,高于已有文献报道中用含血清培养基和滋养层细胞的分化方法得到的阳性细胞比例(如在专利cn102822332a中,cd56+的细胞比例只达到20-30%)。实施例4本发明发现起始人ipsc的细胞密度和培养时间会影响eb形成的大小,从而影响3d分化的效率。分化第0天,我们使用accutase(细胞消化液)将人ipsc消化成单细胞,初始细胞密度控制在0.1~5百万个细胞/t25,hpsc维持培养基培养8~32小时。实施例5本发明发现优化第一步骤分化培养基中chir99021的浓度可显著提高多能干细胞向血液祖细胞分化的效率。当使用t25培养瓶进行eb分化时,其它条件方法如实施例1所述,对第一步骤分化培养基中chir99021的作用浓度进行梯度优化,即在分别使用0μm、1μm、2μm、4μm,6μm、8μm或10μm的chir99021处理细胞,并在d12时使用流式细胞仪测定血液祖细胞的指标cd34,结果见图6。可见,优化的chir99021的加入会提高血液祖细胞的分化的效率;在较低浓度时,血液祖细胞的分化比例偏低,在较高浓度时,血液祖细胞的分化受到抑制;优化chir99021浓度可提高d6-12时血液祖细胞的纯度,即提高了cd34+细胞的比例;chir99021较优浓度应为1~8μm。实施例6本发明发现优化第二步骤分化培养基的换液时间点可显著提高多能干细胞向血液祖细胞分化的效率。使用t25培养瓶进行eb分化时,其它条件方法如实施例1所述,对更换为第二步骤分化培养基的时间点进行优化,即在d1、d2、d2.5、d3、d3.5、d4或d5更换为第二步骤分化培养基继续分化,并在d12时使用流式细胞仪测定血液祖细胞的指标cd34,结果见图7。可见,优化第二步骤分化培养基的换液时间点可显著提高获得血液祖细胞的比例;在较早或较晚的时间点换液,血液祖细胞的分化比例偏低;第二步骤分化培养基的换液时间点较优选择应为d2~d4。实施例7本发明发现优化第三步骤分化培养基的换液时间点可显著提高多能干细胞向血液祖细胞分化的效率。使用t25培养瓶进行eb分化时,其它条件方法如实施例1所述,对更换为第三步骤分化培养基的时间点进行优化,即在d3、d4、d5、d6、d7或d8更换为第四步骤分化培养基继续分化,并在d12时使用流式细胞仪测定血液祖细胞的指标cd34,结果见图8。可见,优化更换为第三步骤分化培养基的时间点可显著提高获得血液祖细胞的比例;在较晚的时间点更换,血液祖细胞的分化比例偏低;第三步骤分化培养基的换液时间点较优选择应为d3~d6。实施例8本发明发现优化的eb接种时间点可显著提高nk细胞的分化效率。使用t25培养瓶进行eb分化时,其它条件方法如实施例1所述,对eb接种时间点进行优化,即按上述分化方法形成eb后,分别在分化的第4天、第6天、第8天、第10天、第12天和第14天取出eb,接种于包被有基质蛋白的培养板中,进行后续的分化。在接种两周后检测分化出nk细胞(cd56+)的比例,结果见图9。可见,优化eb接种时间点会提高nk细胞的分化效率;时间点处于早期(第4天)的eb和时间点处于晚期(第14天)的eb的nk细胞的分化效率较低;较优的eb接种时间点应为d6~d12。实施例9本发明发现优化bmp4的作用浓度可显著提高获得血液祖细胞的比例。使用t25培养瓶进行eb分化时,其它条件方法如实施例1所述,对第一步骤分化培养基和第二步骤分化培养基中bmp4的作用浓度进行梯度优化,即在分别使用0ng/ml、10ng/ml、20ng/ml、30ng/ml,40ng/ml、50ng/ml、60ng/ml、70ng/ml、80ng/ml、90ng/ml或100ng/ml的bmp4处理细胞,并在d12时使用流式细胞仪测定血液祖细胞的指标cd34,结果见图10。可见,优化的bmp4的加入会提高血液祖细胞的分化的效率;在较低浓度时,血液祖细胞的分化比例偏低,在较高浓度时,血液祖细胞的分化受到抑制;优化bmp4浓度可提高d12时血液祖细胞的纯度,即提高了cd34+细胞的比例;bmp4较优浓度应为10~50ng/ml。实施例10本发明发现优化sb431542的作用浓度可显著提高获得血液祖细胞的比例。使用t25培养瓶进行eb分化时,其它条件方法如实施例1所述,对第二步骤分化培养基中sb431542的作用浓度进行梯度优化,即在分别使用0μm、2μm、4μm、6μm、8μm、10μm、20μm、30μm、40μm或50μm的sb431542处理细胞,并在d12时使用流式细胞仪测定血液祖细胞的指标cd34,结果见图11。可见,优化的sb431542的加入会提高血液祖细胞的分化的效率,但在较高浓度时,血液祖细胞的分化受到抑制;优化sb431542浓度可提高d6-12时血液祖细胞的纯度,即提高了cd34+细胞的比例;sb431542较优浓度应为0~20μm。实施例11本发明发现优化bfgf的作用浓度可显著提高获得血液祖细胞的比例。使用t25培养瓶进行eb分化时,其它条件方法如实施例1所述,对第一步骤分化培养基、第二步骤分化培养基和第三步骤分化培养基中bfgf的作用浓度进行梯度优化,即在分别使用0ng/ml、0.1ng/ml、0.5ng/ml、1ng/ml、2.5ng/ml、5ng/ml、10ng/ml或20ng/ml的bfgf处理细胞,并在d6-12时使用流式细胞仪测定血液祖细胞的指标cd34,结果见图12。可见,优化的bfgf的加入会提高血液祖细胞的分化的效率,但在较高浓度时,血液祖细胞的分化受到抑制;优化bfgf浓度可提高d6-12时血液祖细胞的纯度,即提高了cd34+细胞的比例;bfgf较优浓度应为0.1~5ng/ml。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1