一种单一转氨酶催化级联反应不对称合成L-草铵膦的方法与流程
本发明涉及生物工程
技术领域:
,尤其涉及一种单一转氨酶催化级联反应不对称合成l-草铵膦的方法。
背景技术:
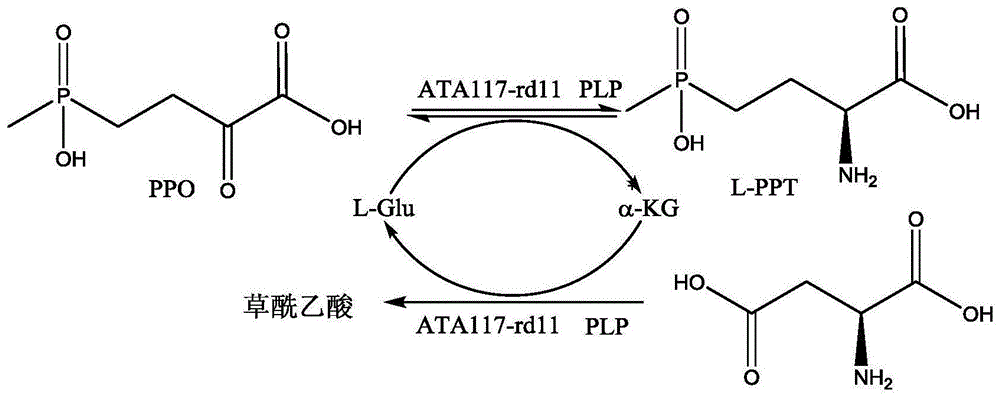
:草铵膦,也称草丁膦,英文名为phsophinothricin(简称ppt),化学名为2-氨基-4-[羟基(甲基)膦酰基]-丁酸,是一种高效、广谱、低毒的非选择性除草剂,是目前转基因抗性作物理想的除草剂,应用前景非常广阔。草铵膦具有两种对映异构体,但只有l-构型具有植物毒性,且在土壤中易分解,对人类和动物的毒性小,对环境的破坏力小。目前,市场上销售的草铵膦一般都是外消旋混合物。如果草铵膦产品能以l-构型的光学纯异构体形式使用,可使草铵膦的使用量降低50%,这对于提高原子经济性、降低成本、减轻环境压力都具有十分重要的意义。生成l-草铵膦的方法有化学合成法、发酵法、生物合成法。其中,生物合成法中涉及到的酶类主要有:蛋白酶、脱乙酰基酶、转氨酶、酰胺酶、酯水解酶和腈水合酶。在诸多草铵膦的酶法合成路线中,酮酸中间体的酮羰基是潜手性官能团,能够通过酶法合成途径构建手性中心,酮酸路线也因原料价廉易得且可以避免使用剧毒氰化物,而成为适宜l-草铵膦工业化开发生产的路线。转氨酶(aminetransaminase,ata,ec2.6.1.x)属于转移酶类,是催化1个氨基供体(氨基酸或简单的胺)上的氨基转移到前手性的受体酮,得到手性胺和副产物酮或者α-酮酸的一类酶,反应过程需要磷酸吡哆醛(pyridoxalphosphate,plp)的参与,其催化的反应是可逆的。根据氨基被转移到不同位置的氨基受体上,转氨酶又可以被分为α-转氨酶和ω-转氨酶(ec2.6.1.1)ω-转氨酶反应过程可分为两步,第一步反应是在ω-转氨酶的作用下将氨基供体上的氨基转移到plp的羰基上,从而形成5-磷酸吡哆胺(pmp)和与氨基供体对应的酮;第二步反应同样在ω-转氨酶的作用下将pmp上的氨基转移到氨基受体上,pmp又转变为plp实现循环。schulza等利用从e.colik-12中分离到的转氨酶,以2-羰基-4-(羟基甲基膦酰胺)丁酸为底物,l-谷氨酸作为氨基供体,利用转氨作用生产l-草铵膦(stereospecificproductionoftheherbicidephosphinothricin(glufosinate)bytransamination:isolationandcharacterizationofaphosphinothricin-specifictransaminasefromescherichiacoli[j].appliedandenvironmentalmicrobiology,1990,56(1):1-6),产物最高浓度可达76.1g/l。转氨酶经固定化后安装至生物反应器,反应器的最高产物生成速率为50g/(l.h),草铵膦e.e.值超过99.9%。但这个工艺有两大缺陷,其一是原料ppo不能完全转化为l-ppt,转化率最高只有90%;其二是要使可逆反应向生成l-ppt的方向进行,需要4倍当量以上的l-谷氨酸作为氨基供体,过量的谷氨酸给分离带来了很大的麻烦,问题的关键在于以l-谷氨酸作为氨基供体时酶促转氨反应是一个可逆反应。授权公告号为cn105603015b的发明专利报道了利用来源于枯草芽孢杆菌168(bacillussubtis168)的转氨酶,以2-羰基-4-(羟基甲基膦酰胺)丁酸为底物,当底物浓度为100mm时,l-丙氨酸作为氨基供氢体,利用转氨作用生产l-草铵膦,转化率可达100%。该反应原料易得,成本低廉,以水相作为反应体系,绿色环保;但是,该反应中氨基供体的用量仍然较多,需要进一步进行优化,以便降低l-草铵膦的生产成本。bartschk(美国专利us6335186b1)在schulza等提供的单酶反应体系下,增加一个草酰乙酸转氨酶,组成双转氨酶偶联反应体系(图2)。然而,草酰乙酸转氨酶的活性不高,导致整个偶联反应速率受限,使得反应时间较长,时空产率低,而且在此工艺中ppo的转化率最高也只有85%。因此,有必要对上述工艺做进一步改进,以解决发酵成本提高,反应时间过长等问题。技术实现要素:本发明提供了一种单一转氨酶催化级联反应不对称合成l-草铵膦的方法,该方法采用单一转氨酶,该转氨酶不仅能够以l-谷氨酸为氨基供体特异性催化2-羰基-4-(羟基甲基膦酰胺)丁酸反应生成l-2-氨基-4-[羟基(甲基)膦酰基]-丁酸和α-酮戊二酸,而且能够以l-天冬氨酸为氨基供体,特异性催化α-酮戊二酸反应得到草酰乙酸和l-谷氨酸,解决了现有技术中采用单一转氨酶时氨基供体用量过高以及采用两种转氨酶时发酵成本过高、反应时间过长等问题。具体技术方案如下:一种单一转氨酶催化级联反应不对称合成l-草铵膦的方法,包括:以4-(甲基羟基磷酰基)-2-羰基-丁酸或其盐为底物,在氨基供体存在的反应体系中,利用离体的转氨酶或体外表达转氨酶的细胞催化底物,发生转氨反应,得到l-草铵膦;所述氨基供体由两种氨基酸组成,分别为l-谷氨酸和l-天冬氨酸;反应体系中仅添加一种转氨酶,且该转氨酶的氨基酸序列如seqidno.4所示。上述反应的方程式如下:由上述反应式可知,本发明采用的转氨酶ata117--rd11同时参与两个转氨反应,即:(1)转氨酶ata117--rd11催化底物4-(甲基羟基磷酰基)-2-羰基-丁酸(简称ppo)与氨基供体l-glu发生转氨反应,得到2-氨基-4-[羟基(甲基)膦酰基]-丁酸(简称ppt)和α-酮戊二酸(简称α-kg);(2)转氨酶ata117--rd11催化底物α-酮戊二酸与氨基供体l-天冬氨酸发生转氨反应,得到草酰乙酸和l-谷氨酸。因转氨酶ata117--rd11能够同时参与两个转氨反应,从而减少了整个反应体系中转氨酶的施用量,以及氨基供体的用量。进一步地,所述细胞为表达转氨酶的工程菌,所述工程菌的宿主细胞为e.colibl21(de3)。作为优选,反应体系中,以湿菌体重量计,所述工程菌的添加量为20~200g/l反应液;更优选,所述工程菌的添加量为20~100g/l反应液;最优选,所述工程菌的添加量为20g/l反应液。进一步地,所述反应体系中的缓冲液为tris/hcl缓冲液,ph为8~9。本发明对缓冲液进行筛选,发现在ph为8~9的tris/hcl缓冲液中进行时,本发明方法的转化率较高;而在硼砂-硼酸缓冲液和磷酸氢二钠-磷酸二氢钠缓冲液中,无论ph范围如何,转化率均较低。理论上,本发明采用的氨基供体中仅需少量l-谷氨酸保证生成ppt的反应进程可以进行即可,经试验发现,所述l-谷氨酸和l-天冬氨酸的摩尔比为1:4~1:8,此时氨基供体投入低,转化率高。进一步地,作为优选,所述氨基供体与底物的摩尔比为1.2~1.6:1。作为优选,所述转氨反应的温度为35~45℃,时间为24~48h。作为优选,反应体系中还包括辅酶,所述辅酶为磷酸吡哆醛,所述辅酶与底物的摩尔比为1:10~1:200。本发明反应体系中,催化剂的用量以湿菌体重量计为20~200g/l,底物的初始浓度为10~500mm,辅酶的用量为0.02~25mm,氨基供体用量为10~700mm,其中,l-谷氨酸用量为1~100mm,l-天冬氨酸用量为6~600mm。进一步地,催化剂的用量以湿菌体重量计为20~100g/l反应液,底物的初始浓度为100~200mm,辅酶的用量为2~10mm,氨基供体用量为100~300mm,其中,l-谷氨酸用量为10~50mm,l-天冬氨酸用量为90~250mm。与现有技术相比,本发明具有以下有益效果:本发明方法采用的转氨酶ata117--rd11不仅能够以l-谷氨酸为氨基供体特异性催化2-羰基-4-(羟基甲基膦酰胺)丁酸反应生成l-2-氨基-4-[羟基(甲基)膦酰基]-丁酸和α-酮戊二酸,而且能够以l-天冬氨酸氨基供体,特异性催化α-酮戊二酸反应得到草酰乙酸和l-谷氨酸,既解决了现在使用单一转氨酶工艺中氨基供体用量过高的问题,又解决了现有两种转氨酶工艺中生物催化剂成本偏高、发酵工序繁琐以及反应时间偏长的技术难题。附图说明图1为本发明单一转氨酶催化级联反应不对称合成l-草铵膦的反应方程式示意图。图2为转氨酶和草酰乙酸转氨酶联合生产l-草铵膦的反应方程式示意图。图3为实施例7中pet-28b-ata117-rd11重组质粒的物理图谱。图4为实施例7中转氨酶基因ata117-rd11低熔点琼脂糖凝胶电泳图;其中,泳道1为dl2000dnamarker;泳道2为转氨酶ata117-rd11的基因片段。图5为实施例7中转氨酶的sds-page图;其中,泳道1为蛋白质分子量marker,泳道2为转氨酶ata117-rd11。具体实施方式下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施例,但本发明的保护范围不仅限于此。实施例1转氨酶基因ata117的扩增根据genbank收录的来自节杆菌(arthrobactersp)knk168的转氨酶基因测序信息为依据,用核酸快速提取仪提取节杆菌(arthrobactersp)knk168菌体的总基因组dna,以该基因组dna为模板,在引物的作用下进行pcr扩增。引物1:5’-atggcgttctcagcggacacccctg-3’;引物2:5’-ttagtactgtaccggggtcagcag-3’。pcr反应体系(总体积50μl):10×pfudnapolymerasebuffer5μl,10mmdntpmixture(datp、dctp、dgtp和dttp各2.5mm)1μl,浓度均为50μm的克隆引物1、引物2各1μl,基因组dna1μl,pfudnapolymerase1μl,无核酸水40μl。采用biorad的pcr仪,pcr反应条件:预变性95℃5min,95℃变性30s,65℃退火45s,72℃延伸1min,共30个循环,最后72℃延伸10min。pcr反应液用0.9%琼脂糖凝胶电泳检测并切胶回收纯化该片段,利用taqdna聚合酶向片段5’端引入碱基a。在t4dna连接酶作用下将该片段同pmd18-t载体进行连接,得到克隆重组质粒pmd18-t-ata117。将该重组质粒转化至大肠杆菌jm109中,利用篮白斑筛选系统进行筛选,随机挑取白色克隆测序,利用软件分析测序结果,结果表明:经引物1和引物2扩增到的核苷酸序列长度为990bp(ata117基因,其核苷酸序列如seqidno:1所示,编码蛋白的氨基酸序列为seqidno:2所示),该序列编码一个完整的开放阅读框。实施例2重组大肠杆菌bl21(de3)/pet28b-ata117的构建根据实施例1的ata117基因序列设计引物,引物3:5’-ccgcatatggcgttctcagcggaca-3’;引物4:5’-ttgctcgaggtagtgcacaggcgtc-3’;并分别在引物3和引物4中引入了ndei和xhoi限制性酶切位点。在引物3和引物4的引发下,利用高保真pfudna聚合酶进行扩增,以重组质粒pmd18-t-ata117为模板(实施例1中获得),获ata117基因序列,测序后利用ndei和xholi限制性内切酶(takara)对扩增片段进行处理,并利用t4dna连接酶(takara)将该片段同用相同的限制性内切酶处理的商业化载体pet28b(invitrogen)进行连接,构建表达载体pet28b-ata117。将构建的表达载体pet28b-ata117转化至大肠杆菌bl21(de3)(invitrogen)中(42℃,90s),涂布于含有50μg/ml卡那霉素抗性的lb平板,37℃下培养8-12h,随机挑取克隆抽提质粒进行测序鉴定,筛选获得含有表达重组质粒pet28b-ata117的重组大肠杆菌bl21(de3)/pet28b-ata117。实施例3转氨酶(ata117)的诱导表达将实施例2获得的重组大肠杆菌bl21(de3)/pet28b-ata117接种至含有50μg/ml卡那霉素抗性的lb液体培养基,37℃,200rpm下培养12h,再以1%(v/v)接种量接种至新鲜的含有50μg/ml卡那霉素抗性的lb液体培养基中,于37℃,150rpm下培养至菌体od600达0.6-0.8,加入终浓度为0.1mm的iptg,25℃下诱导培养18h后,4℃、8000rpm离心20min,弃去上清液,收集沉淀,即获得含有表达重组质粒的重组大肠杆菌bl21/pet28b-ata117湿菌体。该菌体可直接作为生物催化剂。实施例4转氨酶(pet28b-ata117)的分离纯化将实施例3中获得的湿菌体(即重组大肠杆菌bl21(de3)/pet28b-ata117湿菌体)以结合缓冲液(50mm,ph7.4磷酸钠缓冲液)重悬后,经超声破碎,12000rpm离心40min,上清与经上述结合缓冲液平衡过的ni亲和层析树脂孵育后,再用冲洗缓冲液(50mm,ph7.4磷酸钠缓冲液)冲洗至基本无杂蛋白,随后以洗脱缓冲液(50mm,ph7.4磷酸钠缓冲液)洗脱并收集目的蛋白,电泳鉴定纯度后合并目的蛋白并以透析缓冲液(50mm,ph磷酸钠缓冲液)透析48h,取截留液采用考马斯亮蓝法测定蛋白含量为2mg/ml,将酶液稀释至终浓度为0.5mg/ml分装,冻存于-80℃,获得转氨酶ata117纯酶。实施例5重组转氨酶ata117的活性测定以实施例3方法分离纯化得到的转氨酶ata117全细胞用于催化底物4-(甲基羟基磷酰基)-2-羰基-丁酸。催化体系组成及催化条件如下:10mltris/hcl缓冲液(100mm,ph8.0)中加入转氨酶ata117全细胞(菌体量为50g/l缓冲液),l-天冬氨酸(终浓度20mm)与l-谷氨酸(终浓度4mm),4-(甲基羟基磷酰基)-2-羰基-丁酸(终浓度20mmol/l缓冲液),plp(终浓度1mmol/l缓冲液)构成反应体系。35℃,转速600r/min条件下反应24h,取样检测底物的转化率。同样条件下,以大肠杆菌bl21(de3)以及大肠杆菌bl21(de3)/pet28a菌体破碎上清经透析,得到的截留液作为对照。表1转氨酶ata117的酶活测定菌株/质粒酶的底物转化率大肠杆菌bl21(de3)0大肠杆菌bl21(de3)/pet28b0大肠杆菌bl21(de3)/pet28b-ata11735.91%实施例6ata117基因突变文库的建立以实施例2中构建质粒pet28b-ata117为模板,进行易错pcr。在引物1(5’-atggcgttctcagcggacacccctg-3’)、引物2(5’-ttagtactgtaccggggtcagcag-3’)的作用下进行易错pcr。pcr反应体系(总体积50μl):10×pfudnapolymerasebuffer5μl,10mmdntpmixture(datp、dctp、dgtp和dttp各2.5mm)1μl,浓度均为50μm的克隆引物1、引物2各0.5μm,质粒模板0.8ng/μl,taqdnapolymerase2.5u,mncl20.2mm,去离子水补足50μl。采用biorad的pcr仪,pcr反应条件:预变性95℃5min,95℃变性30s,65℃退火45s,72℃延伸1min,共30个循环,最后72℃延伸10min。纯化易错pcr产物后,以该产物作为引物、实施例2中构建质粒pet28b-ata117为模板进行大引物pcr,获得大引物pcr产物(即突变体文库1)。pcr体系:大引物10ng/μl,质粒模板1ng/μl,pfudnapolymerase2.5u。pcr反应条件:去a尾72℃5min,预变性96℃2min,96℃变性30s,60℃退火45s,72℃延伸4min,共25个循环,最后72℃延伸10min。实施例7基因突变文库筛选获得突变体ata117-rd11将实施例6突变体文库1转入大肠杆菌e.colibl21(de3)的感受态细胞中,转化条件42℃,热击90秒,在含有50μg/ml卡那霉素的lb抗性平板上挑取单克隆7017个,分别接种于含有50μg/ml卡那霉素的lb培养基中进行诱导表达,诱导条件如实施例3,获得7017个含有突变体基因的重组大肠杆菌湿菌体,即突变体湿菌体。得到含有突变蛋白的大肠杆菌后,对0.36g草胺磷前体酮ppo进行生物转化,催化体系(10ml)终浓度组成及催化条件如下:突变体e.colibl21(de3)/pet28b-ata117-rd11湿菌体0.075g,tris-hcl缓冲液(ph8.0),磷酸吡哆醛0.2mm,l-丙氨酸70mm,20mm4-(甲基羟基磷酰基)-2-羰基-丁酸。反应条件:温度35℃、搅拌速度150r/min,反应时间24h。同样条件下,以无菌体加入的反应液作为空白对照,以含空载体的大肠杆菌bl21/pet28b湿菌体代替上述突变体湿菌体作为阴性对照。反应结束后,取样进行hplc检测(50:50乙腈:水,10mm乙酸铵,0.8ml/min流速,268nm检测波长),从7017个突变蛋白中,有6198个突变蛋白的活力低于原始蛋白,778个突变蛋白的活力与原始蛋白相当,仅41个突变蛋白的活力显著高于原始蛋白(增加20%),其中底物的转化率最高的一个突变体pet28b-ata117-rd11,转化率为96%,ee>99%。突变体pet28b-ata117-rd11的核苷酸序列与氨基酸序列如序列表中的seqidno:3和seqidno:4所示。突变体pet28b-ata117-rd11是将seqidno:2所示氨基酸第8位的丝氨酸取代为脯氨酸,第26位的组氨酸取代为缬氨酸,第60、61、62位的酪氨酸、亮氨酸、组氨酸取代为苯丙氨酸、酪氨酸、苏氨酸,第65位的缬氨酸取代为丙氨酸,第69位的缬氨酸取代为苏氨酸,第81位的天冬氨酸取代为甘氨酸,第94、96位的蛋氨酸、异亮氨酸取代为异亮氨酸、亮氨酸,第122、124、126的苯丙氨酸、丝氨酸、丝氨酸取代为蛋氨酸、苏氨酸、苏氨酸,第136、137位的甘氨酸、谷氨酸取代为苯丙氨酸、苏氨酸,第150、152位的酪氨酸、缬氨酸取代为丝氨酸、半胱氨酸,第169位的丙氨酸取代为亮氨酸,第178位的苏氨酸取代为丝氨酸,第199位的缬氨酸取代为异亮氨酸,第209位的丙氨酸取代为亮氨酸,第215、217位的甘氨酸、甘氨酸取代为半胱氨酸、天冬酰胺,第223位的丝氨酸取代为脯氨酸,第269位的亮氨酸取代为脯氨酸,第273位的亮氨酸取代为酪氨酸,第282、284位的苏氨酸、丙氨酸取代为丝氨酸、甘氨酸,第297位的脯氨酸取代为丝氨酸,第321位的丝氨酸取代为脯氨酸。实施例8转氨酶ata117-rd11在转氨过程中不同氨基供体的试验以实施例7方法获得的含有表达重组质粒的重组大肠杆菌bl21/pet28b-ata117-rd11湿菌体作为生物催化剂,以4-(甲基羟基磷酰基)-2-羰基-丁酸为底物。分别以l-天冬氨酸与l-谷氨酸,l-天冬氨酸,l-谷氨酸,l-丙氨酸为氨基供体。转化体系:配tris-hcl缓冲液90ml,加入0.36g(20mm)ppo(草铵膦酮酸),0.3192g(24mm)l-天冬氨酸,0.0588g(4mm)l-谷氨酸。补加1.2gtris调ph至8.0。定容至100ml,加0.0247gplp(1mm),ata117-rd11湿菌体量为50g/l。将氨基供体分别换成0.3724g(28mm)l-天冬氨酸、0.4116g(28mm)l-谷氨酸、0.6237g(70mm)l-丙氨酸。同时,在35℃下反应24h,分别取样,稀释10倍,进行衍生化,根据标曲,可得如下结果:氨基供体转化率%l-天冬氨酸与l-谷氨酸63.95l-天冬氨酸26.70l-谷氨酸61.97l-丙氨酸43.22为探究使用l-天冬氨酸与l-谷氨酸作为混合氨基供体时,转化率均比分别使用两种氨基酸作为氨基供体高的原因,以确定转氨酶ata117-rd11是否可以同时催化两步反应,进行了以下补充实验:(1)配tris-hcl缓冲液90ml,加入0.353g(20mm)l-谷氨酸,分别加入2mm、4mm、6mm、8mm、10mm、20mm、30mmppo。补加tris调ph至8.0。定容至100ml,加0.0247gplp(1mm),ata117-rd11湿菌体量为50g/l。在35℃下反应24h,分别取样,稀释10倍,进行衍生化,根据标曲,可得如下结果:底物浓度(mm)转化率(%)21004100695.44890.161077.482060.583043.15(2)配tris-hcl缓冲液90ml,加入0.266g(20mm)l-天冬氨酸,分别加入2mm、4mm、6mm、8mm、10mm、20mm、30mmα-酮戊二酸。补加tris调ph至8.0。定容至100ml,加0.0247gplp(1mm),ata117-rd11湿菌体量为50g/l。在35℃下反应24h,分别取样,稀释10倍,进行衍生化,根据标曲,可得如下结果:α-kg浓度(mm)转化率(%)253.67%451.42%655.50%861.61%1060.96%2036.97%3036.22%由此说明,转氨酶ata117-rd11可以同时催化两步反应。实施例9转氨酶ata117-rd11在转氨过程中的条件优化(1)缓冲体系的选择分别以磷酸氢二钠-磷酸二氢钠缓冲液、磷酸缓冲液、tris/hcl缓冲液、硼砂-硼酸缓冲液、氢氧化钠作为缓冲体系。转化体系1:①磷酸氢二钠-磷酸二氢钠缓冲液反应体系:配磷酸氢二钠-磷酸二氢钠缓冲液40ml×2,分别都加入0.18gppo(草铵膦酮酸),0.16gl-天冬氨酸,0.0294gl-谷氨酸。分别调至ph为6.0,7.0。定容至50ml,加0.0125gplp(1mm)。ata117-rd11湿菌体量为50g/l。35℃反应6h,12h,24h取样稀释,分别取200μl进行衍生化。②tris/hcl缓冲液反应体系:配tris/hcl缓冲液40ml×2,分别都加入0.18gppo(草铵膦酮酸),0.16gl-天冬氨酸,0.0294gl-谷氨酸。分别调至ph为8.0,9.0。定容至50ml,加0.0125gplp(1mm)。ata117-rd11湿菌体量为50g/l。35℃反应6h,12h,24h取样稀释,分别取200μl进行衍生化。③氯化钾-氢氧化钠作为缓冲液反应体系:配氯化钾-氢氧化钠缓冲液40ml,加入0.18gppo(草铵膦酮酸),0.16gl-天冬氨酸,0.0294gl-谷氨酸。调至ph10.0。定容至50ml,加0.0125gplp(1mm)。ata117-rd11湿菌体量为50g/l。35℃反应6h,12h,24h取样稀释,分别取200μl进行衍生化。根据标曲,可得如下结果:转化体系2:①配硼砂-硼酸缓冲液40ml×4,分别都加入0.18gppo(草铵膦酮酸),0.16gl-天冬氨酸,0.0294gl-谷氨酸。分别调至ph为7.5,8.0,8.5,9.0。定容至50ml,加0.0125gplp(1mm)。ata117-rd11湿菌体量为50g/l。35℃反应4h取样稀释,分别取200μl进行衍生化。②配磷酸氢二钠-磷酸二氢钠缓冲液40ml×3,分别都加入0.18gppo(草铵膦酮酸),0.16gl-天冬氨酸,0.0294gl-谷氨酸。分别调至ph为6.0,6.5,7.0。定容至50ml,加0.0125gplp(1mm)。ata117-rd11湿菌体量为50g/l。35℃反应4h取样稀释,分别取200μl进行衍生化。根据标曲,可得如下结果:(2)温度优化转化体系:配tris/hcl缓冲液40ml,加入0.18gppo(草铵膦酮酸),0.16gl-天冬氨酸,0.0294gl-谷氨酸。补加tris溶液调ph至8.0。定容至50ml,加0.0125gplp(1mm),ata117-rd11湿菌体量为50g/l。分别在30℃、35℃、40℃、45℃、50℃的水浴锅下反应4h,取样稀释,分别取200μl进行衍生化,根据标曲,可得如下结果:(3)菌体量优化转化体系:配tris/hcl缓冲液40ml,加入0.9gppo(草铵膦酮酸),0.8gl-天冬氨酸,0.2352gl-谷氨酸。补加tris溶液调ph至8.0。定容至50ml,加0.0625gplp。每10ml反应体系称量0.05g、0.1g、0.2g、0.4g、0.6g、0.8g、1.0g的菌体量,在40℃水浴锅下反应4h,取样稀释,分别取200μl进行衍生化,根据标曲,可得如下结果:(4)辅酶plp用量优化转化体系:tris/hcl缓冲液40ml,加入0.18gppo(草铵膦酮酸),0.16gl-天冬氨酸,0.0294gl-谷氨酸。补加tris溶液调ph至8.0。分别称量0.02mm至2mm梯度的plp,定容至50ml,ata117-rd11湿菌体量为50g/l。在40℃水浴锅下反应4h,取样稀释,分别取200μl进行衍生化,根据标曲,可得如下结果:实施例10转氨酶ata117-rd11合成l-草铵膦的反应进程称取0.36g(20mm)ppo(草铵膦酮酸),0.3192g(24mm)l-天冬氨酸,0.0588g(4mm)l-谷氨酸。用tris缓冲液调ph至8.0。定容至100ml,加0.0247gplp(1mm),ata117-rd11湿菌体量为50g/l。40℃反应,取样稀释,分别取200μl进行衍生化,根据标曲,可得如下结果:反应时间/h转化率128.51%239.35%448.75%661.27%1270.54%2467.20%实施例11配tris/hcl缓冲液30ml,调ph至8.0,加入0.36g(20mm)ppo(草铵膦酮酸),0.399g(30mm)l-天冬氨酸,0.0588g(4mm)l-谷氨酸。补加tris调ph至8.0。定容至30ml,加0.0247gplp(1mm),ata117-rd11湿菌体量为50g/l。40℃反应,取样稀释,分别取200ul进行衍生化,根据标曲,可得如下结果:实施例12配tris/hcl缓冲液8ml,调ph至8.0,加入0.18g(100mm)ppo(草铵膦酮酸),0.16g(120mm)l-天冬氨酸,0.0294g(20mm)l-谷氨酸。补加tris调ph至7.0。定容至10ml,加0.0125gplp,ata117-rd11湿菌体量为60g/l。40℃反应,取样稀释,分别取200μl进行衍生化,根据标曲,可得如下结果:反应时间/h转化率664.63%1278.87%2486.82%3688.69%4891.71%实施例13配tris/hcl缓冲液8ml,调ph至8.0,加入0.36g(200mm)ppo(草铵膦酮酸),0.32g(600mm)l-天冬氨酸,0.0588g(100mm)l-谷氨酸。补加tris调ph至7.0。定容至10ml,加0.025gplp,ata117-rd11湿菌体量为60g/l。40℃反应,取样稀释,分别取200μl进行衍生化,根据标曲,可得如下结果:反应时间/h转化率659.37%1273.61%2477.06%3682.45%4883.33%实施例14配tris/hcl缓冲液8ml,调ph至8.0,加入0.9g(500mm)ppo(草铵膦酮酸),0.8g(600mm)l-天冬氨酸,0.147g(100mm)l-谷氨酸。补加tris调ph至7.0。定容至10ml,加0.0625gplp,ata117-rd11湿菌体量为60g/l。40℃反应,取样稀释,分别取200μl进行衍生化,根据标曲,可得如下结果:反应时间/h转化率624.57%1232.56%2453.82%3662.75%4868.87%由以上实验结果可知,本发明得到的含有转氨酶基因的重组大肠杆菌具有较强的转氨能力,可直接以含酶的菌体细胞为酶源进行生物催化或者转化反应。转氨酶(bl21(de3)/pet28a-ata117-rd11)作为转化用酶,可以利用4-(甲基羟基磷酰基)-2-羰基-丁酸为底物,进行生物转化反应制备高光学纯的农药—l-草铵膦。序列表<110>浙江工业大学<120>一种单一转氨酶催化级联反应不对称合成l-草铵膦的方法<150>201910216011.6<151>2020-03-13<160>10<170>siposequencelisting1.0<210>1<211>990<212>dna<213>节杆菌(pseudomonasfluorescensknk168)<400>1atggcgttctcagcggacacccctgaaatcgtttacacccacgacaccggtctggactat60atcacctactctgactacgaactggacccggctaacccgctggctggtggtgctgcttgg120atcgaaggtgctttcgttccgccgtctgaagctcgtatccctatcttcgaccagggtttt180tatacttctgacgctacctacaccaccttccacgtttggaacggtaacgctttccgtctg240ggggaccacatcgaacgtctgttctctaatgcggaatctattcgtttgatcccgccgctg300acccaggacgaagttaaagagatcgctctggaactggttgctaaaaccgaactgcgtgaa360gcgatggttaccgttacgatcacccgtggttactcttctaccccattcgagcgtgacatc420accaaacatcgtccgcaggtttacatgagcgctagcccgtaccagtggatcgtaccgttt480gaccgcatccgtgacggtgttcacctgatggttgctcagtcagttcgtcgtacaccgcgt540agctctatcgacccgcaggttaaaaacttccagtggggtgacctgatccgtgcaattcag600gaaacccacgctcgtggtttcgagttgccgctgctgctggactgcgacaacctgctggct660gaaggtccgggcttcaacgttgttgttatcaaagacggtgttgttcgttctccgggtcgt720gctgctctgccgggtatcacccgtaaaaccgttctggaaatcgctgaatctctgggtcac780gaagctatcctggctgacatcaccccggctgaactgtacgacgctgacgaagttctgggt840tgctcaaccggtggtggtgtttggccgttcgtttctgttgacggtaactctatctctgac900ggtgttccgggtccggttacccagtctatcatccgtcgttactgggaactgaacgttgaa960ccttcttctctgctgaccccggtacagtac990<210>2<211>330<212>prt<213>节杆菌(pseudomonasfluorescensknk168)<400>2metalapheseralaaspthrsergluilevaltyrthrhisaspthr151015glyleuasptyrilethrtyrserasptyrgluleuaspproalaasn202530proleualaglyglyalaalatrpilegluglyalaphevalpropro354045serglualaargileserilepheaspglnglytyrleuhisserasp505560valthrtyrthrvalphehisvaltrpasnglyasnalapheargleu65707580aspasphisilegluargleupheserasnalaglusermetargile859095ileproproleuthrglnaspgluvallysgluilealaleugluleu100105110valalalysthrgluleuargglualaphevalservalserilethr115120125argglytyrserserthrproglygluargaspilethrlyshisarg130135140proglnvaltyrmettyralavalprotyrglntrpilevalprophe145150155160aspargileargaspglyvalhisalametvalalaglnservalarg165170175argthrproargserserileaspproglnvallysasnpheglntrp180185190glyaspleuileargalavalglngluthrhisaspargglypheglu195200205alaproleuleuleuaspglyaspglyleuleualagluglysergly210215220pheasnvalvalvalilelysaspglyvalvalargserproglyarg225230235240alaalaleuproglyilethrarglysthrvalleugluilealaglu245250255serleuglyhisglualaileleualaaspilethrleualagluleu260265270leuaspalaaspgluvalleuglycysthrthralaglyglyvaltrp275280285prophevalservalaspglyasnproileseraspglyvalprogly290295300provalthrglnserileileargargtyrtrpgluleuasnvalglu305310315320serserserleuleuthrprovalglntyr325330<210>3<211>990<212>dna<213>节杆菌(pseudomonasfluorescensknk168)<400>3atggcttttagcgctgatactccggaaatcgtttacactcatgataccggtctggactac60atcacctactccgatcacgaactggacccggcgaaccctctggctggcggcgctgcgtgg120attgaaggtgcgttcgtaccgccgtctgaagcgcgcatttccatcttcgaccagggcttt180tatacttccgatgcgacttacaccaccttccatgtttggaacggcaacgctttccgcctg240ggcgatcatatcgagcgtctgttctctaacgcagagtctatccgtctgattccaccgctg300acccaggatgaagtaaaagaaatcgcgctggaactggtggcgaaaaccgagctgcgtgaa360gcgatggtaactgttaccatcactcgtggttactcttctactccgttcacccgtgatatc420accaaacatcgtcctcaggtgtacatgtctgcatgtccgtaccagtggatcgttcctttc480gatcgtattcgtgacggcgttcacctgatggtcgcccagagcgtgcgtcgttctccgcgc540tccagcatcgacccgcaagtgaaaaacttccagtggggtgatctgattcgtgctatccag600gaaacccacgaccgcggcttcgaactgcctctgctgctggattgcgataacctgctggcg660gaaggtccgggtttcaacgtagtagtgattaaagacggtgttgtgcgttctcctggtcgc720gctgcgctgccgggtatcacccgtaaaacggttctggaaattgcagaatccctgggccat780gaagcaatcctggccgacattacgccggctgaactgtacgatgctgacgaagtactgggt840tgctccacgggcggcggcgtctggccgtttgtgtctgttgatggcaatagcatctctgac900ggtgtaccgggcccagttacccagtccattattcgtcgttactgggagctgaacgtagaa960ccgagcagcctgctgacgcctgtgcactac990<210>4<211>330<212>prt<213>节杆菌(pseudomonasfluorescensknk168)<400>4metalapheseralaaspthrprogluilevaltyrthrhisaspthr151015glyleuasptyrilethrtyrserasphisgluleuaspproalaasn202530proleualaglyglyalaalatrpilegluglyalaphevalpropro354045serglualaargileserilepheaspglnglyphetyrthrserasp505560alathrtyrthrthrphehisvaltrpasnglyasnalapheargleu65707580glyasphisilegluargleupheserasnalagluserileargleu859095ileproproleuthrglnaspgluvallysgluilealaleugluleu100105110valalalysthrgluleuargglualametvalthrvalthrilethr115120125argglytyrserserthrprophethrargaspilethrlyshisarg130135140proglnvaltyrmetseralacysprotyrglntrpilevalprophe145150155160aspargileargaspglyvalhisleumetvalalaglnservalarg165170175argserproargserserileaspproglnvallysasnpheglntrp180185190glyaspleuileargalaileglngluthrhisaspargglypheglu195200205leuproleuleuleuaspcysaspasnleuleualagluglyprogly210215220pheasnvalvalvalilelysaspglyvalvalargserproglyarg225230235240alaalaleuproglyilethrarglysthrvalleugluilealaglu245250255serleuglyhisglualaileleualaaspilethrproalagluleu260265270tyraspalaaspgluvalleuglycysserthrglyglyglyvaltrp275280285prophevalservalaspglyasnserileseraspglyvalprogly290295300provalthrglnserileileargargtyrtrpgluleuasnvalglu305310315320proserserleuleuthrprovalhistyr325330<210>5<211>25<212>dna<213>人工序列(artificialsequence)<400>5atggcgttctcagcggacacccctg25<210>6<211>24<212>dna<213>人工序列(artificialsequence)<400>6ttagtactgtaccggggtcagcag24<210>7<211>25<212>dna<213>人工序列(artificialsequence)<400>7ccgcatatggcgttctcagcggaca25<210>8<211>25<212>dna<213>人工序列(artificialsequence)<400>8ttgctcgaggtagtgcacaggcgtc25<210>9<211>25<212>dna<213>人工序列(artificialsequence)<400>9atggcgttctcagcggacacccctg25<210>10<211>24<212>dna<213>人工序列(artificialsequence)<400>10ttagtactgtaccggggtcagcag24当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1