具有高杂交性能的寡核苷酸缀合物及其应用的制作方法
1.本发明属于基因检测领域,具体地说,本发明涉及具有高杂交性能的寡核苷酸缀合物及其应用。
背景技术:
2.实时荧光定量pcr技术,是指在pcr反应体系中加入荧光染料或荧光标记探针,在pcr扩增设备上选择合适的荧光通道,利用荧光信号积累实时监测整个pcr进程,再通过标准曲线对未知模板进行定量分析的方法。通常用的检测方法有染料法和taqman探针法。
3.染料法中通常使用sybr green,sybr green等可以结合到双链dna上的染料。当pcr反应体系中的模板进行扩增时,sybr green可以有效结合到新合成的双链上,随着pcr的进行,结合到新合成的双链上的sybr green染料越来越多,被仪器检测到的荧光信号越来越强,从而达到定量的目的。
4.taqman探针法的原理是在pcr反应体系中加入一对引物和一条特异性的荧光标记探针,该探针为一寡核苷酸序列,序列两端分别标记一个报告荧光基团和一个淬灭荧光基团。探针完整且当两个基团的距离很近时,报告基团发射的荧光信号被淬灭基团吸收,不发荧光。扩增开始时,在95度变性条件下,双链模板解离成单链,在退火温度下,探针开始结合在dna其中一条单链上,在pcr延伸时,耐热性taqdna聚合酶发挥其5’-3’端外切酶活性将探针降解,使得报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积与pcr产物形成完全同步。
5.由于染料法在pcr扩增时,染料会插入到所有的双链结构中,当实验中出现非特异扩增或引物二聚体时,会极大地影响结果的准确性。另外,染料法无法在同一个反应管中检测多个靶基因。taqman探针法与染料法最大的区别是,探针法中的荧光信号只来源于目标序列,故不会受非特异性扩增产物及引物二聚体的影响。
6.taqman探针法的设计利用的是fret原理,即荧光能量共振转移。是距离很近的两个荧光分子间产生的一种能量转移现象。当供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠,并且两个分子的距离在10nm(100埃)范围以内时,就会发生一种非放射性的能量转移,供体的荧光被受体淬灭,即fret现象。当供体和受体的距离大于100埃时,两种荧光分子间发生fret的有效性会降低甚至无法进行fret作用。所以,探针设计受到了序列长度的限制。为了增加单核苷酸基因分型的区分度以及对复杂的靶基因提供设计的灵活性,减少探针长度变得至关重要。然而,探针缩短会降低熔解温度(tm值),在pcr循环温度下阻碍了探针与靶序列的有效结合。
7.因此,本领域技术人员致力于解决探针设计长度和理想的tm值之间的矛盾。
技术实现要素:
8.本发明的目的在于提供一种用于核酸检测的探针及检测方法,尤其是一种用于实
时荧光定量pcr检测的探针及检测方法。
9.在本发明的第一方面,提供了寡核苷酸缀合物,所述寡核苷酸缀合物结构如下式i所示:
10.r-n-q-d,i
11.其中,r为任选地荧光基团,n为寡核苷酸单元,q为淬灭基团,d为阳离子单元。
12.在另一优选例中,r为无或为荧光基团。
13.在另一优选例中,式i中,各
“-”
独立地为化学键或者接头(linker)。
14.在另一优选例中,式i中,各
“-”
独立地为磷酸二酯键。
15.在另一优选例中,所述寡核苷酸缀合物为pcr检测探针或引物。
16.在另一优选例中,n为3-60个碱基的寡核苷酸序列;优选的为8-40个碱基的寡核苷酸序列;更优选地为10-30个碱基的寡核苷酸序列。
17.在另一优选例中,式i中,n的5’端连接r,n的3’端连接q。
18.在另一优选例中,式i中,n的3’端连接r,n的5’端连接q。
19.在另一优选例中,r选自下组:fam、vic、hex、ned、rox、tet、joe、tamra、cy3、和cy5。
20.在另一优选例中,q选自下组:eclipse、bhq-1、bhq-2、和bhq-3。
21.在另一优选例中,阳离子单元d包含一个或多个氨基。
22.在另一优选例中,d为a聚体的有机阳离子单元,其中a为1至30之间的整数;优选地,a为2至20之间的整数;更优选地,a为3至10之间的整数。
23.在另一优选例中,所述有机阳离子为精胺。
24.在本发明的第二方面,提供了本发明第一方面所述的寡核苷酸缀合物的用途,用于制备pcr检测用的引物或探针。
25.在本发明的第三方面,提供了一种试剂盒,所述试剂盒包括本发明第一方面所述的寡核苷酸缀合物。
26.在另一优选例中,所述试剂盒包括由本发明第一方面所述的寡核苷酸缀合物制成的探针,或者包括由本发明第一方面所述的寡核苷酸缀合物制成的引物。
27.在另一优选例中,所述试剂盒还包括选自下组的一种或多种试剂:
28.pcr缓冲液、dntps、热启动taq酶、逆转录酶、和rna酶抑制剂。
29.在本发明的第四方面,提供了一种实时荧光定量pcr体系,所述实时荧光定量pcr体系包括本发明第一方面所述的寡核苷酸缀合物。
30.在另一优选例中,所述实时荧光定量pcr体系包括由本发明第一方面所述的寡核苷酸缀合物制成的探针,或者包括由本发明第一方面所述的寡核苷酸缀合物制成的引物。
31.在另一优选例中,所述实时荧光定量pcr体系包括靶核酸、和本发明第一方面所述的寡核苷酸缀合物,其中,所述的寡核苷酸缀合物中的寡核苷酸单元n至少和靶核酸的部分序列反向互补(匹配或完全匹配)。
32.在另一优选例中,所述实时荧光定量pcr体系还包括选自下组的一种或多种试剂:
33.pcr缓冲液、dntps、热启动taq酶、逆转录酶、和rna酶抑制剂。
34.本发明的第五方面,提供了一种实时荧光定量pcr的方法,所述方法包括步骤:
35.(1)提供待检测对象的核酸样本;
36.(2)制备pcr反应体系并进行pcr检测:
37.其中,所述pcr反应体系包括:步骤(1)提供的所述核酸样本、和本发明第一方面所述的寡核苷酸缀合物。其中,寡核苷酸缀合物以探针和/或引物的形式存在于所述pcr反应体系中。
38.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
39.图1显示了本发明寡核苷酸缀合物的示例结构。
40.图2显示了相同碱基序列,标记5个zip单位的两种zna探针的荧光值。
41.图3显示了偶联5个zip单位的zna探针与相同碱基序列的普通taqman探针比较的结果。
42.图4显示了随着zip偶联数量的增加,zna探针荧光本底值呈逐渐下降趋势。
43.图5显示了随着zip偶联数量的增加,在zna探针中ct值呈递减趋势。
44.图6和图7显示了当淬灭基团偶联于不同位置时,探针的扩增效果。
45.图8和图9显示了当不同淬灭基团偶联于相同位置时,探针的扩增效果。
46.图10显示了不同探针荧光本底值的比较。
47.图11显示了不同探针的扩增效率比较。
48.图12显示了不同探针的反复冻融后的稳定性检测结果。
49.图13显示了临床样本的检测结果。
具体实施方式
50.本发明人通过广泛而深入的研究,获得了一种寡核苷酸缀合物,本发明的寡核苷酸缀合物用作pcr探针可以使探针设计更灵活,保守区域更易得。实验结果表明,探针的特异性更好,而且探针荧光值显著更高,荧光本底显著降低,探针灵敏度得到了极大的提升。
51.在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
52.除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
53.虽然在本发明的实施或测试中可以使用与本发明中所述相似或等价的任何方法和材料,本文在此处例举优选的方法和材料。
54.寡核苷酸缀合物
55.本发明的目的在于提供一种新型的寡核苷酸缀合物,其寡核苷酸序列部分偶联了能减少其与靶基因之间的静电排斥作用的阳离子单元。阳离子单元包含一定数量的阳离子单体,能够调节着整个寡核苷酸缀合物的电荷,提高寡核苷酸缀合物与靶序列结合的稳定性。
56.本发明的寡核苷酸缀合物,结构如下式i所示:
57.r-n-q-d,i
58.其中,r为任选地荧光基团,n为寡核苷酸单元,q为淬灭基团,d为阳离子单元。
59.其中,阳离子单元为多聚体的有机阳离子单元(有机阳离子多聚体)。
60.有机阳离子优选为精胺:
[0061][0062]
因此,在本发明优选地实施方式中,阳离子单元为多聚精胺。多聚精胺的制备方法,可以参考本领域现有的常规方法进行制备。
[0063]
该寡核苷酸缀合物作为探针使用时,能灵活的提高探针的tm值(5-15℃),可使探针的设计更短,探针的本底更低,灵敏度更高,同时设计的保守区域更易得,同时在扩增效率、snp分型方面也有自己独特的优势;本发明的寡核苷酸缀合物也可以作为修饰引物,提高引物tm值的同时大大增加了引物的扩增效率。
[0064]
基于本发明的寡核苷酸缀合物,本发明提供了一种用于实时荧光pcr的探针技术。本发明的探针序列长度根据实验目的进行设计,探针的组成为:一段和靶核酸匹配的碱基序列,5’端修饰荧光报告基团,3’末端依次偶联荧光淬灭基团和聚阳离子单元(优选地为聚氨基的衍生物)。
[0065]
合成本发明的寡核苷酸缀合物,可以采用本领域的常规方法进行。
[0066]
本发明的寡核苷酸缀合物的合成路线概述如下:
[0067]
第一步,脱保护(deblocking)。用三氯乙酸(tca)去除合成柱载体所连核苷上的dmt,以暴露5’羟基,供下一步缩合。
[0068]
第二步,连接(coupling)。碱基单体与四唑混合形成亚磷酰胺四唑活性中间体进入合成柱,与合成柱载体所连的核苷5’羟基发生亲核反应,合成的寡核苷酸链延长一个碱基。
[0069]
第三步,盖帽(capping)。防止上一步未反应完全的5’羟基在随后的合成循环中被延伸,用乙酰化试剂封闭该羟基。
[0070]
第四步,氧化(oxidation)。完成偶合反应的核苷酸之间通过亚磷酯键(三价磷)连接,用碘的四氢呋喃溶液将三价磷氧化为五价磷。循环上述合成步骤,寡核苷酸链延伸至所需长度时即完成合成。
[0071]
当合成至染料标记基团或聚阳离子单元时,将第二步的单体分别替换为染料单体或聚阳离子单体(如精胺)即可。
[0072]
如本文所用,碱基的“匹配”或“配对”是指两条核苷酸序列中相应的碱基按照a与t,g与c配对的原则形成反向互补的双链结构。
[0073]
如本文所用,本文所用“匹配”是指引物或探针与模板之间序列完全互补或者虽然不完全互补但是仅存在适当的碱基错配(如1、2、或3个的碱基错配)。
[0074]
如本文所用,本文所用“完全匹配”是指引物或探针与模板之间序列完全互补,不存在任何碱基错配。
[0075]
如本文所用,术语“核酸”或“寡核苷酸”,具体指的是一种多聚物,其包括尤其是通
过亚单位之间的磷酸二酯键(有些情况下是硫代磷酸、甲基膦酸酯等等)共价键合的核糖核酸和/或脱氧核糖核酸。所述术语涵盖了天然存在的核酸以及合成核酸。
[0076]
如本文所用,术语“探针”是一种寡核苷酸序列,与目标序列匹配,通常与目标序列上游引物和下游引物之间的序列配对,探针的5’端一般连接荧光基团,3’端连接淬灭基团。当完整的探针与目标序列配对时,荧光基团发射的荧光因与3’端的淬灭剂接近而被淬灭,但在进行延伸反应时,聚合酶的5’外切酶活性将探针进行酶切,使得荧光基团与淬灭剂分离。随着扩增循环数的增加,释放出来的荧光基团不断积累,因此荧光强度与扩增产物的数量呈正比关系,呈现一种s型曲线。
[0077]
在本发明中,通常在引物的3’端进行修饰或封闭。典型地,引物3’羟基被修饰和封闭的类型可以是荧光基团也可以是淬灭基团(封闭基团)。
[0078]
荧光基团可以标记在荧光引物的5’端,也可以标记在3’端,相应地,其淬灭基团标记在荧光引物的3’端或5’端,标记在荧光引物3’端的荧光基团或淬灭基团封闭3’端的-oh(羟基),使其在正常pcr扩增反应中无法延伸。
[0079]
代表性的荧光基团的例子包括(但并不限于):fam、cy5、texas red、hex、vic、tet、joe、tamra、rox、lc red610、lc red640、lccyan500、yakima yellow、或其组合。
[0080]
代表性的淬灭基团的例子包括(但并不限于):bhq1、bhq2、bhq3、eclipse、tamra、dabcyl、或其组合。
[0081]
在本发明中,被修饰的核苷酸种类没有特别限制,可以是:a、t、c、g或其组合。
[0082]
在本发明中,优化的反应体系可以使用单荧光引物或多重荧光引物。
[0083]
实时荧光定量pcr
[0084]
实时荧光定量pcr技术是dna定量技术的一次飞跃。运用该项技术,可以对dna、rna样品进行定量和定性分析。定量分析包括绝对定量分析和相对定量分析。目前实时荧光pcr技术已经被广泛应用于基础科学研究、临床诊断、疾病研究及药物研发等领域。
[0085]
本发明的应用
[0086]
本发明可广泛用于诊断和非诊断性的检测,并且可用于点突变(耐药)、单核苷酸多态性、插入和缺失突变的检测。
[0087]
在另一类优选例中,本发明的检测可以是针对食品、病原微生物(细菌、病毒等)的检测。
[0088]
在一优选实施方式中,本发明用于检测待测基因(疾病相关基因、药物代谢、药物治疗相关基因等)的待测突变位点上是否存在突变。
[0089]
此外,本发明可广泛用于人类遗传性疾病、长寿衰老相关的基因、健康风险相关的基因、疾病易感基因、肿瘤个性化治疗相关snp、病原体耐药检测。
[0090]
术语“核酸样本”在本文中以广义使用,并且意欲包括含有核酸的多种来源和组合物。示例性的生物样品包括但不限于:细胞样品、环境样品,从身体获得的样品,特别是体液样品,以及人、动物或植物组织样品。非限制性实例包括但不限于:细胞、全血、血液制品、红细胞、白细胞、血沉棕黄层、血浆、血清、拭子、尿、痰、唾液、精液、淋巴液、羊水、脑脊液、腹膜腔积液、胸腔积液、活检样品、囊肿液、滑液、玻璃体液、房水、粘液囊、洗眼液、眼部抽吸液、血浆、血清、肺灌洗液、肺吸出液、动物(尤其是人)或植物组织、包括但不限于肝、脾、肾、肺、肠、脑、心脏、肌肉、胰腺、细胞培养物以及裂解物、提取物或从上述样品获得的材料和部分。
优选地,所述样品来源于人、动物或植物的生物样品。所述样品可以选自下组:细胞、组织、肿瘤细胞和体液、例如血液、血液制品例如血沉棕黄层、血浆和血清,尿、体液、痰、粪便、csf和精子、上皮拭子、活检、骨髓样品和组织样品,优选器官组织样品。术语“样品”还包括经处理的样品,例如经保存的、固定的和/或稳定的样品。然而,所述含核酸的样品也可以是包含了释放形式的核酸的粗制样品,并且可以由通过相应生物样品获得的裂解物提供。
[0091]
本发明的主要优点在于:
[0092]
1.探针设计更灵活,保守区域更易得;
[0093]
2.探针的特异性更好;
[0094]
3.探针tm值的大小可以调整;
[0095]
4.提高扩增效率;
[0096]
5.减少非特异性扩增,避免假阳性结果;
[0097]
6.探针荧光值显著更高,荧光本底显著降低,探针灵敏度得到了极大的提升;
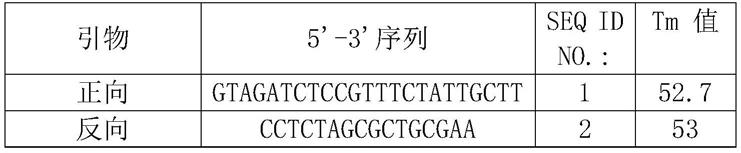
[0098]
7.探针的稳定性更好。
[0099]
下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
[0100]
实施例1寡核苷酸及其缀合物的制备
[0101]
zna探针((zip nucleic acid)合成采用固相亚磷酰胺三酯法,用于合成的单体试剂都是亚磷酰胺单体结构。每种单体上的氨基、羟基、亚磷酸基团都有保护基团,在合成结束后用浓氨水进行脱保护。在固相载体上通过dna合成仪从3’端向5’方向完成寡核苷酸链的合成,相邻的核苷酸通过3
’5’
磷酸二酯键连接。在dna合成仪上每个碱基都通过四步化学反应完成zna探针的合成。
[0102]
第一步,脱保护(deblocking)。用三氯乙酸(tca)去除合成柱载体所连核苷上的dmt,以暴露5’羟基,供下一步缩合。
[0103]
第二步,连接(coupling)。碱基单体与四唑混合形成亚磷酰胺四唑活性中间体进入合成柱,与合成柱载体所连的核苷5’羟基发生亲核反应,合成的寡核苷酸链延长一个碱基。
[0104]
第三步,盖帽(capping)。防止上一步未反应完全的5’羟基在随后的合成循环中被延伸,用乙酰化试剂封闭该羟基。
[0105]
第四步,氧化(oxidation)。完成偶合反应的核苷酸之间通过亚磷酯键(三价磷)连接,用碘的四氢呋喃溶液将三价磷氧化为五价磷。循环上述合成步骤,寡核苷酸链延伸至所需长度时即完成合成。
[0106]
当合成至染料标记基团或聚阳离子单元时,将第二步的单体分别替换为染料单体或聚阳离子单体(如精胺)即可。
[0107]
合成上机操作
[0108]
3900dna合成仪(美国abi公司)由惰性气体氩气驱动合成的进行,氩气作为惰性气体,比重比空气大,既可以做为合成试剂的保护气,又参与合成驱动。
[0109]
部分合成原料例举如下:
[0110]
名称货号厂家6-fam荧光素单体10-5901-90,100umole/瓶glen research精胺单体10-1939-90,100umol/瓶glen researchbhq1单体10-5941-90,100umol/瓶glen researcheclipse单体10-5925-90,100umol/瓶glen researchda10-1000-20,2g/瓶glen researchdg10-1029-20,2g/瓶glen researchdt10-1030-20,2g/瓶glen researchdc10-1015-20,2g/瓶glen research
[0111]
zna探针合成操作过程如下:
[0112]
1)检查环境温湿度,准备所需要用到的试剂和载体,室温平衡;检查氩气压力值,总压表≥5mpa,分压表压力0.4-0.5mpa;
[0113]
2)将zna探针序列导入合成仪,设置合成程序,包括所有试剂的打液量、打液次数、偶联时间;
[0114]
3)分别用15ml无水乙腈冲洗碱基和修饰位管路;
[0115]
4)准备无水乙腈、注射器、针头、移液器。按照碱基单体和修饰单体的分子量和质量,用注射器抽吸无水乙腈溶解至0.05mol/l,充分摇匀。
[0116]
5)将辅助试剂(deblock,activator,capa/b,oxidizer)、无水乙腈接入合成仪;将溶解的单体试剂安装在合成仪对应位置;按合成序列导入顺序将合成柱载体插入内仓bank;
[0117]
6)执行prime,打液检查管路是否通畅,执行purge,检查合成仪表盘压力是否正常;
[0118]
7)运行合成软件,执行合成程序。
[0119]
每一步循环反应参数如下:
[0120]
1.乙腈wash,200ul*3次后,抽吸液体;
[0121]
2.三氯乙酸脱保护,180ul*3次,抽吸液体;
[0122]
3.乙腈wash,200ul*3次,抽吸液体;
[0123]
4.四唑、碱基混合进样,进样体积分别为45ul和30ul,反应时间60s;抽吸液体;
[0124]
5.乙酸酐、1-甲基咪唑混合进样,进样体积30ul,抽吸液体;
[0125]
6.乙腈wash,200ul*3次,抽吸液体;
[0126]
7.四氢呋喃的碘液,60ul,抽吸液体;
[0127]
8.乙腈wash,200ul*3次,抽吸液体;
[0128]
9.重复8;
[0129]
10.干燥合成柱。
[0130]
注:当合成至染料和聚阳离子时,在步骤4中分别使用染料单体和阳离子单体替换“碱基”即可。
[0131]
合成后处理
[0132]
用浓氨水将合成好的zna探针从合成柱载体上切割下来,同时对序列上的单体、修
饰基团、荧光染料等的保护基进行脱除。氨水切割指的是对探针序列3’末端合成柱载体上的酯键部位进行切割。具体操作步骤如下:
[0133]
1)取数个冻存管,按探针名称进行编号;
[0134]
2)将合成完毕的装有zna探针的合成柱从合成仪内仓取出;
[0135]
3)用注射器针头将合成柱内的cpg戳入步骤1)的冻存管中;
[0136]
4)每个冻存管中加入新鲜浓氨水800ul,盖紧管盖;
[0137]
5)设置水浴锅温度28℃,待反应6h后将冻存管取出;
[0138]
6)准备2.5ml脱脂棉注射器,用灭菌纯化水润湿;
[0139]
7)准备5ml离心管,将氨解结束的zna探针转移到脱脂棉注射器后,过滤掉cpg,使探针流入5ml离心管;
[0140]
8)用灭菌纯化水平衡nap-25小柱5遍后,用移液器将zna探针转移进nap-25小柱,样品通过重力流入柱填料后,加灭菌纯化水洗脱目的样品。用5ml离心管收集先流出的组分(颜色分层),达到去除氨水和游离荧光染料的作用。
[0141]
9)用灭菌纯化水平衡nap-25小柱10次后,放进4℃冰箱备用。
[0142]
实施例2探针效果测试
[0143]
从genebank设计沙眼衣原体(chlamydia trachomatis,ct)引物、探针序列,这些引物探针在含有耐热dna聚合酶,高质量脱氧核糖核苷三磷酸(dntps)的pcr反应酶系以及含有mg
2+
等成份的pcr反应液中,通过荧光pcr仪实现体外核酸的循环扩增来进行测试。
[0144]
表1.ct引物
[0145][0146]
表2.ct长探针(29mer-dna)
[0147][0148]
表3.普通taqman短探针
[0149][0150][0151]
表4.mgb探针
[0152][0153]
表5.zna探针
[0154][0155]
其中:普通探针的5’端修饰fam荧光报告基团,3’端修饰bhq1荧光淬灭基团;
[0156]
zna探针和对照zna探针的5’端修饰fam荧光报告基团,3’端修饰zip(多聚精胺)和bhq1荧光淬灭基团。可以根据实验需要,将zip设计为包含1、2、3、4、5个精胺单体。
[0157]
其中,所述特异性上下游引物和探针为目标基因的靶点序列相互补的特异引物和探针序列。
[0158]
采用实施例1的方法合成上述引物探针序列。
[0159]
pcr反应
[0160]
1.现配反应体系45ul:反应液a 40ul、反应液b 3ul、ct阳性定量参考品2ul。
[0161]
其中反应液a为引探buffer的混合物;反应液b为taq酶系。
[0162]
2.pcr反应条件
[0163]
93℃变性2min;93℃45s,55℃1min扩增10个循环;接着93℃30s,55℃45s扩增30个循环,在55℃进行荧光收集检测
[0164]
2.1两种zna探针效果对比
[0165]
对比了本发明zna探针(zna探针,方法
①
)和对照zna探针(方法
②
)的扩增效果。
[0166]
本发明zna探针为21mer02-z5(即,21mer02-zna,3’端依次修饰bhq1荧光淬灭基团和zip(5聚精胺)),对照zna探针为21mer02-5z(3’端依次修饰zip(5聚精胺)和bhq1荧光淬灭基团)。
[0167]
如图2所示,相同碱基序列,标记5个zip单位(5聚精胺)的两种zna探针在对梯度稀释的质粒进行检测时,但zna探针的荧光值比对照zna探针更高,荧光值约高35%,且ct值更低(
△
ct≈0.5)。并且模板浓度越低,本发明zna探针的ct值比对照zna探针更小,1x104梯度浓度下
△
ct=0.95
[0168]
如图3所示,偶联5个zip单位的zna探针与相同碱基序列的普通taqman探针比较,zna探针的荧光值高于同序列的普通探针2.05倍,同时ct值明显减小,
△
ct=2.12,灵敏度提升6.4倍。
[0169]
2.2偶联zip单位的数量
[0170]
zna探针的其中一个优势之处在于,研究人员可以根据序列长度和需要提升的tm值灵活添加zip单位的数量。如图4所示,随着zip偶联数量的增加(从1个增加到5个单体偶
联),合成的zna探针荧光本底值呈逐渐下降趋势;且指数期扩增曲线更好,表现为每个循环荧光值增长更多、更接近理想的指数扩增曲线。同时,如图5所示,随着zip偶联数量的增加,在zna探针中ct值呈递减趋势,ct
z5-ct
z1
=|-1.34︱。
[0171]
2.3淬灭基团
[0172]
bhq1和eclipse是两种常用的不发光染料,两种基团吸收波长范围不同,在比较合成模式时,需要把bhq1和eclipse对两种合成模式的影响都考虑在内。
[0173]
如图6和图7,在对10
7-102梯度稀释的质粒进行检测时,eclipse和bhq1与碱基和zip相邻时,pcr扩增效率优于两种染料都标记在序列的3’末端。荧光值都提高了20-30%,ct值更低(
△
ct≈0.5);如图8和图9,eclipse和bhq1与碱基和zip相邻时,两种染料在ct值的表现上没有差异;两种染料同时标记在序列3’末端时,ct值也没有差异。这说明,常用的两种淬灭基团对不同偶联位置没有影响。
[0174]
实施例3普通taqman、mgb、zna探针序列优选
[0175]
在ct长探针(29mer-dna,理论tm值64.3℃)的基础上设计三种类型的短探针,每种设计三到四条,比较其pcr扩增曲线,每组优选一条进行pcr扩增性能比较。从四条普通taqman短探针(理论tm值54.4-57.2℃,在pcr扩增效率上没有明显的差异)选取20mer03-dna备用;三条mgb探针,序列长度17-18个碱基,理论tm值69-71℃,其中17mer01-mgb扩增效率优于其他两条,荧光值高20-30%,ct值低0.5-0.8;四条zna探针,序列长度20-21,理论tm值65.1-67.3℃,四条探针ct值无明显差异,选取21mer02-zna备用。
[0176]
主要对四组探针进行扩增曲线评价、质粒样本评价、检测特异性、临床样本评价和比较mgb探针和zna探针序列延长或缩短后的差异性。
[0177]
3.1扩增曲线比较
[0178]
3.1.1荧光本底值比较
[0179]
如图10,四组探针荧光本底值显示,21mer02-zna探针荧光本底值最低,其次为20mer03-dna探针;17mer01-mgb探针本底与29mer-dna探针相当。
[0180]
荧光本底与pcr扩增灵敏度相关,zna探针序列与普通短探针长度相同,优选的20mer03-dna探针在四条taqman短探针中荧光本底最低。本实验结果显示,21mer02-zna探针的荧光本底值比20mer03-dna探针低41%、比17mer01-mgb探针和29mer-dna探针的荧光本底值分别低了73%和75%。
[0181]
3.1.2扩增效率比较
[0182]
如图11,21mer02-zna探针优于其他类型探针:荧光值比29mer-dna探针高90%、比20mer03-dna探针高52%、比17mer01-mgb探针高17%;ct值分别提前1.4、1.3和1.1。
[0183]
3.2质粒样本评价结果
[0184]
前述4组探针,使用梯度稀释的质粒(10
7-104copies/μl)作为标准品进行10次重复检测,并计算标准曲线。结果表明,四组探针的ct值与模板浓度之间都呈现良好的线性关系,四组探针的相关系数r2分别为:21mer02-zna 0.998、17mer01-mgb 0.997、20mer03-dna 0.998、29mer-dna 0.996。
[0185]
3.3特异性检测结果
[0186]
使用灭菌纯化水作为模板,对前述四组探针配制的pcr体系进行48次重复检测,每组做一个低浓度(103)的阳参。结果表明,各体系均可获得良好的检测特异性,无非特异性
扩增出现。
[0187]
3.4探针冻融测试
[0188]
分别对四组探针冻融0次、5次、10次、15次和20次进行测试,检测四组探针反复冻融后的稳定性。
[0189]
结果显示,在多次冻融情况下,zna探针的检测稳定性最佳,不同浓度模板检测ct值的变异系数cv%=0.5-1.4,平均ct值低于其它探针(如图12);最低浓度(104拷贝/μl)的ct值偏离最小(cv%=1.4),明显优于其他三组探针(29mer-dna3.7%、20mer03-dna 1.7%、17mer01-mgb 2.2%)
[0190]
3.5临床样本评价结果
[0191]
如图13所示。对35例临床样本用前述四组探针进行检测,21mer02-zna探针明显优于29mer-dna普通taqman探针,曲线ct值靠前、荧光值高。
[0192]
选择一例高浓度样本进行梯度稀释,分别稀释至200、150、100和50拷贝/μl,用前述四组探针进行检测,结果如表6所示。zna探针的灵敏度最佳,以90%阳性作为指标,可以发现样本浓度为200、150和100拷贝/μl时,zna探针的检出率分别对应为100%、95%和90%,高于其它三种标记方式的探针。尤其在最低浓度50拷贝/μl时,四组探针检出率均有所下降,但zna探针检出率仍为最高,且下降趋势相对缓慢
[0193]
表6
[0194][0195][0196]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1