一种适用于静磁场环境的生物样品培养装置及其应用的制作方法
本发明涉及生物样品培养装置领域,尤其涉及的是一种适用于静磁场环境的生物样品培养装置及其应用。
背景技术:
静磁场作为一种重要的物理条件,不仅在物理、化学以及材料等领域具有显著作用,还会对生命系统产生一系列影响。从分子水平(dna、蛋白质等)、细胞水平(抑制肿瘤细胞增殖)到动物水平(鸽子和海龟的磁感应),均有静磁场生物学效应的报道。
研究表明,静磁场的生物学效应与场强是正相关的,具体就是场强越高,效应越明显。很多在中低场强条件下不明显的生命现象在强磁场条件下会被显著放大。因此,强静磁场条件下的生物学效应值得系统深入的研究,而设计制作在强静磁场中工作的生物样品培养装置尤为重要。
生物样品的培养维持需要满足特定的条件。以细胞培养为例,需要维持37℃,含有5%co2的空气以及一定的湿度等条件,所以通常在专门的细胞培养箱中进行细胞培养实验。因此,为了能够在强静磁场条件下开展生物实验,就需要在磁体发生装置的圆柱体空腔中搭建生物培养装置,维持生物样品活力所需的温度、湿度和气体环境等。
目前可用于研究强磁场生物学效应的装置比较少,且存在无法长期连续培养以及样品腔较小等技术缺陷。中国专利(cn101892219a)将磁场设置于细胞培养品的底部,虽然通过这种方法可保证位于培养瓶同一高度的细胞所暴露的磁场强度一致,但是培养瓶内不同高度的细胞所受到的磁场强度不同,而且该系统不能提供必要的温度(37℃)和气体环境(5%co2气体氛围),因此不能进行长期细胞实验。此外,该装置只适用于细胞实验,无法进行动物实验。中国专利(cn103756899b)公布了一种可用于稳态强磁场效应研究的生物培养及成像装置,尽管该装置可以在强磁场条件下进行生物样品培养,但是其空间较小,一次实验能够处理的样品较少,无法进行高通量测试。此外该装置只能将样品静置于磁场中,无法检测生物样品切割磁感线后的效应。
因此研制出一种适用于细胞以及动植物等生物样品的磁场暴露装置具有非常重要的价值和意义。同时在磁体中搭建生物培养装置,需要克服一些技术难题,例如空间狭小、强磁场对材料要求苛刻、温度分布不均、湿度以及气体环境控制困难等问题。本发明正是针对上述问题,着重于扩大样品量、样品切割磁感线等方面进行改进。
技术实现要素:
本发明所要解决的技术问题在于提供了一种适用于静磁场环境的生物样品培养装置。
本发明是通过以下技术方案解决上述技术问题的:
一种适用于静磁场环境的生物样品培养装置,包括水浴套筒,所述水浴套筒具有夹层;
所述水浴套筒内开设有中间腔体,所述中间腔体内设有若干个上、下间隔设置的金属笼;
若干个所述金属笼之间通过若干个金属杆固定连接;
若干个所述金属笼连接有驱动机构,通过所述驱动机构驱动若干个所述金属笼旋转;
所述水浴套筒的一端固定连接有盖板,通过所述盖板密封所述水浴套筒的一端;
所述盖板上连通有进气管,所述水浴套筒的另一端固定连接有密封挡盘,所述密封挡盘上连通有出气管;
所述水浴套筒的外侧壁上固定连接有装配磁体的结合法兰。
优选地,所述水浴套筒上端连通有加热丝入口管;
所述水浴套筒上端连通有水温计入口管,所述加热丝入口管与水温计入口管对称设置。
优选地,所述水浴套筒上端连通有注水管,所述注水管的注水端连通夹层。
优选地,所述中间腔体内设有15个上、下间隔设置的金属笼;
15个所述金属笼之间通过4个对角分布的金属杆固定连接。
优选地,所述驱动机构包括固定连接在金属笼底部的转轴,所述转轴焊接于所述最下方金属笼底部;
所述驱动机构还包括驱动电机,所述转轴的连接端贯穿出气管,所述转轴的连接端位于水浴套筒外;
所述转轴的连接固定连接至驱动电机的输出轴上。
优选地,所述物样品培养装置还包括连通进气管的供气组件;
所述供气组件包括压缩气体供装置,所述压缩气体供装置连通有湿气盒;
所述湿气盒内承载有水,所述湿气盒的一端连通有入气管,所述入气管的出气端位于水的液面下方,所述入气管的进气端连通至压缩气体供装置的出气端上;
所述湿气盒的相对一端连通有排气管,所述排气管的进气端位于水的液面上方,所述排气管的出气端连通至进气管上。
优选地,所述水浴套筒包括外层不锈钢管以及同轴设置的内层不锈钢管;
所述外层不锈钢管以及内层不锈钢管在连接处焊接密封,所述外层不锈钢管以及内层不锈钢管形成夹层;
所述外层不锈钢管的外径为99mm,所述外层不锈钢管的内径为95mm;
所述内层不锈钢管的外径为87mm,所述外层不锈钢管的内径为84mm;
所述夹层用于填充超纯水,所述中间腔体的直径为84mm。
优选地,所述金属笼的材质为304不锈钢;
所述金属笼的外径为82mm,高52mm。
优选地,所述盖板与水浴套筒的左端之间通过法兰连接;
所述盖板与水浴套筒之间通过o型橡胶圈密封。
本发明同时公开上述装置在抑制肺癌细胞增殖及瘤体生长中的应用。
本发明相比现有技术具有以下优点:
本发明公开一种适用于静磁场环境的生物样品培养装置,通过设计水浴套筒(水浴套筒的中心具有中间腔体)、夹层、金属笼、盖板进行密封、进气管、出气管、注水管、加热丝入口管、水温计入口管,实现多个实验样品同时测试、控温控湿和提供适合的培养条件。该培养装置所使用的材料均为微弱磁性材料,受磁场影响较小,同时具有足够机械强度,成本较低,并可耐受75%酒精擦拭灭菌,减少了微生物污染的可能性。
本发明生物培养装置可以用于强磁场条件下的细胞及动物培养,为研究强静磁场条件下的生物学效应提供了一种独特的培养装置。
采用上述结构的生物样品培养装置,不仅结构简单,而且操作方便。
附图说明
图1是本发明实施例1的整体结构示意图;
图2是本发明实施例1中的剖视图;
图3为本发明实施例1图1中的俯视图;
图4为本发明实施例1中金属笼的结构示意图;
图5为本发明实施例1中湿气盒与生物样品培养装置的连通关系结构示意图;
图6为本发明实施例1中水浴套筒的立面结构示意图;
图7为本发明实施例1中金属笼与金属杆的连接关系结构示意图;
图8为本发明实施例2中超导磁体中金属笼不同位置对应的磁场强度,
其中,图8中横坐标表示金属笼的间距(单位mm),纵坐标表示磁场强度(单位t);
图9为本发明实施例2中置于装置中培养的a549肺癌细胞被不同方向9.4t磁场处理后细胞数的变化;
图10为本发明实施例2中置于装置中培养的a549肺癌细胞被不同方向9.4t磁场处理后细胞凋亡水平的变化;
图11为本发明实施例2中置于装置中培养的a549肺癌细胞被不同方向9.4t磁场处理后细胞周期的变化;
图12为本发明实施例2中置于装置中培养的a549肺癌细胞被不同方向9.4t磁场处理后有丝分裂指数的变化;
图13为本发明实施例2中置于装置中培养的a549肺癌细胞被不同方向9.4t磁场处理后细胞dna合成水平的变化;
图14为本发明实施例2中置于装置中培养的a549肺癌细胞被不同方向9.4t磁场处理后细胞内活性氧自由基(ros)水平的变化;
图15为本发明实施例2中置于装置中培养的荷瘤小鼠被不同方向9.4t磁场处理后小鼠体内肿瘤体积和质量的变化;
图16为本发明实施例2中置于装置中的荷瘤小鼠被不同方向9.4t磁场处理后小鼠体内肿瘤组织p53蛋白免疫组化切片图;
图17为本发明实施例2中置于装置中的荷瘤小鼠被不同方向9.4t磁场处理后小鼠体内肿瘤组织he染色切片图;
图18为本发明实施例2中置于装置中的荷瘤小鼠被不同方向9.4t磁场处理后小鼠体内心脏组织he染色切片图;
图19为本发明实施例2中置于装置中的荷瘤小鼠被不同方向9.4t磁场处理后小鼠体内肝脏组织he染色切片图;
图20为本发明实施例2中置于装置中的荷瘤小鼠被不同方向9.4t磁场处理后小鼠体内脾脏组织he染色切片图;
图21为本发明实施例2中置于装置中的荷瘤小鼠被不同方向9.4t磁场处理后小鼠体内肺部组织he染色切片图;
图22为本发明实施例2中置于装置中的荷瘤小鼠被不同方向9.4t磁场处理后小鼠体内肾脏组织he染色切片图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
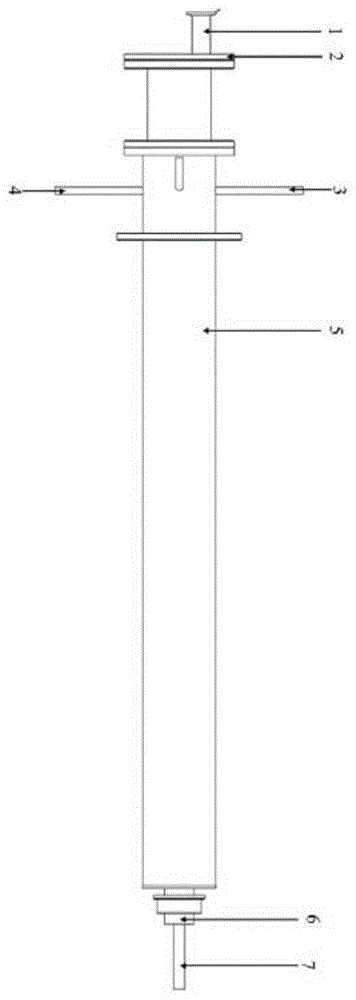
如图1-7所示,一种适用于静磁场环境的生物样品培养装置,包括水浴套筒5,所述水浴套筒5具有夹层。水浴套筒5的夹层采用如下方式形成:
水浴套筒5包括外层不锈钢管以及同轴设置的内层不锈钢管;外层不锈钢管以及内层不锈钢管在连接处焊接密封,外层不锈钢管以及内层不锈钢管形成夹层。
上述外层不锈钢管的外径为99mm,所述外层不锈钢管的内径为95mm;内层不锈钢管的外径为87mm,所述外层不锈钢管的内径为84mm。
设计夹层的目的在于:夹层用于填充超纯水,所述中间腔体的直径为84mm。
水浴套筒5内开设有中间腔体(既内层不锈钢管的空腔)。中间腔体直径84mm。
在中间腔体内设有15个上、下间隔设置的开口圆柱金属笼11;15个所述金属笼11之间通过4根对称分布的金属杆111固定连接,既4根金属杆111依次将15个所述金属笼11上、下串联连接起来。
上述15个串联起来的金属笼11连接有驱动机构,通过所述驱动机构驱动15个所述金属笼11旋转。具体是,驱动机构包括固定连接在金属笼11底部的转轴7,所述转轴7焊接于所述金属笼11下端(具体为:最下端部位的金属笼11的底部固定连接转轴7)。金属笼11与中间腔体的内壁间隔设置不影响转动。
驱动机构还包括驱动电机(图中未画出)(驱动电机位于水浴套筒5外,具体放置在水浴套筒5的最下方,实际工作过程中水浴套筒5利用法兰固定于磁体中)。具体而言,转轴7的连接端贯穿下述的出气管6(转轴7的连接端位于水浴套筒5外,实际工作中,具体设计在水浴套筒5的正下方)。转轴7的连接端固定连接至驱动电机的输出轴上。通过该方式实现将金属笼11旋转,满足实验需求。
上述金属笼11的材质为304不锈钢;金属笼11的单个外径为82mm,高52mm。
在水浴套筒5的上端的端部固定连接有盖板2,通过所述盖板2密封所述水浴套筒5的上端。具体而言,盖板2与水浴套筒5的顶端之间通过法兰连接;盖板2与水浴套筒5之间通过o型橡胶圈密封。o型橡胶圈由医用硅胶制作,使用时可以起到很好的密封作用,还可以耐受75%酒精擦拭。
上述金属笼11的具体形状如下:
如图7所示,金属笼11为筒形结构,左侧开设有多个通孔,右侧开放,同时在侧壁上具有若干个环形分布的条形通孔。
上述金属笼11内形成放置生物样品的生物样品腔室。实际工作过程中,将金属笼11设计多层结构类型的金属笼11,每层金属笼11可以叠放规格为60mm细胞培养皿3个,一共放置45皿细胞。具体按照现有方式,在金属笼11内通过设计挡板形成多层结构(挡板按照上、下垂直方式设计)。
实际工作过程中,为了实现往水浴套筒5内通入三元气(三元气即76%氮气、19%氧气和5%二氧化碳)满足实验需求,采用下述结构设计:
盖板2上连通有进气管1,水浴套筒5内的下端固定连接有密封挡盘,所述密封挡盘上连通有出气管6。
实际工作过程中,为了实现对中间腔室的加热,采用下述结构设计:
水浴套筒5上端连通有注水管8,所述注水管8的出水端连通夹层(将水从注水管8注入到夹层内)。水浴套筒5上端连通有加热丝入口管3(加热丝从加热丝入口管3伸入到夹层内,对夹层中的水进行加热)。水浴套筒5上端连通有水温计入口管4(水温计从水温计入口管4伸入到夹层内)。所述加热丝入口管3与水温计入口管4对称设置。
实际工作过程中为了监测中间腔体内的温度,在盖板2上开设用于插入腔体温度计接口9。
实际工作过程中,为了实现将磁体连接到水浴套筒5上,形成磁性环境,在水浴套筒5的外侧壁上固定连接有装配磁体的结合法兰10,按照现有方式将磁体通过结合法兰10安装到水浴套筒5。
通过安装磁体,水浴套筒5内形成一个最高10t静磁场环境的生物培养环境。
实际工作过程中,为了给中间腔体内通入上述三元气,采用如下结构设计:
物样品培养装置还包括连通进气管1的供气组件;供气组件包括压缩气体供装置15(压缩气体供装置15,具体可以为装有上述三元气压缩气体的高压气瓶),所述压缩气体供装置15连通有湿气盒14。湿气盒14采用亚克力制成,为密闭的盒体,在湿气盒14内放入用于润湿上述三元气的水。
具体而言,湿气盒14的一端连通有入气管12,入气管12的出气端位于水的液面下方,所述入气管12的进气端连通至压缩气体供装置15的出气端上;湿气盒14的相对一端连通有排气管13,所述排气管13的进气端位于水的液面上方,所述排气管13的出气端连通至进气管1上。
首先,压缩气体供装置15将三元气从入气管12通入到湿气盒14的液面下方,三元气等到润湿后,从排气管13排出,并经过进气管1输入到水浴套筒5的中间腔室中,为细胞实验提供需要气体环境。
由于上述金属笼11还能够用于动物实验如上述小鼠实验,因此,在进行动物实验时,直接通过加压泵把空气从进气管1进入到水浴套筒5的中间腔室中。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
实施例2
本实施例公开一种基于适用于静磁场环境的生物样品培养装置在抑制肺癌细胞及瘤体增殖中的应用。具体是上述生物样品培养装置通过配合超导磁体产生的9.4t静磁场在抑制肺癌a549细胞及瘤体增殖中的应用。
本实施例优选采用的培养细胞和小鼠的装置包括中间三层金属笼11(因为中间三层金属笼11所在位置磁场较为均匀,条件一致)的水浴套筒5。
细胞实验部分
步骤一、35mm细胞培养皿中接种约1×106个细胞后放置于中间三层金属笼11中(图8所示),再将金属笼11放置入水浴套筒5中(水浴套筒5事先已安装上磁体),将金属笼11所处腔体温度调整在37℃,同时通入提前润湿的三元气体。与此同时,空白对照组的装置除了没有放置于磁体以内,其它操作均与曝磁组一致。
步骤二、待细胞放置完毕后,通过调整电缆连接方式改变细胞所受磁体方向,设置为向上或向下。打开磁体电源,开始励磁,励磁速率为0.01a/s,当超导线圈中电流达到112.8a时停止励磁(细胞所受磁感应强度为9.4t),处理24小时后开始退磁,速率为0.02a/s,退到0a关闭电源。
步骤三、细胞相关指标检测,包括细胞数目变化,细胞周期变化、细胞凋亡变化、有丝分裂指数变化、胞内dna合成变化以及ros水平变化。
上述实施例得到9.4t向上静磁场处理组细胞及其对照组细胞,9.4t向下静磁场处理组细胞及其对照组细胞。
细胞计数:所有贴壁的a549细胞均用500μl胰蛋白酶消化后再用500μl培养基终止,然后利用流式细胞仪计数。
细胞周期分布检测:将a549细胞用胰蛋白酶消化并用pbs洗涤,然后在-20℃下用预冷的70%酒精固定过夜。后用pbs清洗细胞并于室温下在pi(碘化丙啶)溶液中避光孵育30分钟,通过流式细胞仪测量所有细胞的周期分布情况。
细胞凋亡检测:将a549细胞用胰蛋白酶消化后用pbs洗涤,然后于室温下在100μl结合缓冲液,5μlfitc-annexin和5μlpi混合避光孵育30分钟。后加入400μl结合缓冲液并利用流式细胞仪检测凋亡。
细胞ros水平检测:实验后收获细胞并置于不含fbs的dmem培养基中,加入5μldcfh-da并在37℃孵箱中避光混合30分钟,之后洗涤并重悬于pbs中,利用流式细胞仪测量ros水平。
细胞dna合成水平检测:提前将细胞接种于35mm细胞培养皿中,用10μm的brdu处理,然后进行曝磁实验。实验后收集所有细胞,用pbs清洗,再用2mhcl重悬,在旋转器上室温孵育30分钟。后在室温条件下用0.1mna2b4o7(ph8.5)静置10分钟,离心,后用pbs重悬并洗一次。最后用抗brdu抗体孵育2.5小时,用alexa-fluor488结合抗体孵育1.5h。流式细胞仪检测所有样品。
实验结果:
1)如图9所示,利用9.4t向上的静磁场处理人肺癌a549细胞24小时后,曝磁组细胞数明显少于对照组;与之相反,9.4t向下的静磁场处理24小时后,曝磁组细胞数目相较于对照组反而增多。
2)如图10所示,9.4t向上和向下的静磁场处理人肺癌a549细胞24小时后,曝磁组细胞的细胞凋亡水平并没有明显变化。
3)如图11所示,9.4t向上静磁场处理人肺癌a549细胞24小时后,曝磁组细胞相对对照组的s期减少,g2/m期却增加;然而9.4t向下静磁场处理后,各期却无明显变化。
4)如图12所示,9.4t向上和向下的静磁场处理人肺癌a549细胞24小时后,曝磁组细胞的有丝分裂指数均下降,结合图11的细胞周期结果,表明9.4t向上组的g2期细胞显著增多。
5)如图13所示,9.4t向上和向下的静磁场处理人肺癌a549细胞24小时后,曝磁组细胞的dna合成水平均下降。
6)如图14所示,9.4t向上静磁场处理人肺癌a549细胞24小时后,曝磁组细胞相对对照组的ros水平增加;然而9.4t向下静磁场处理后,ros水平无明显变化。
本发明能够长时间保持细胞培养所需的温度、湿度和气体条件,配合超导磁体产生的不同方向和不同强度的静磁场,能够系统深入的研究静磁场对各种细胞的效应。
动物实验部分,本发明中所有动物实验均经中国科学院合肥物质科学研究院动物伦理委员会审核批准。
步骤一、1×106个a549细胞与基质胶等体积混合后,于6周龄balb/c裸鼠右上腹皮下注射。待荷瘤成功后将携带直径约2mm的肿瘤裸鼠随机分成对照组和9.4t曝磁组,对照组和曝磁组各6只裸鼠,每隔一天用向上或向下的9.4t静磁场处理8个小时(11:00-19:00,不包括励磁的3小时和退磁的1.5小时)
上述实施例得到9.4t向上静磁场处理组荷瘤裸鼠及其对照组荷瘤裸鼠,9.4t向下静磁场处理组荷瘤裸鼠及其对照组荷瘤裸鼠。
肿瘤大小测量:每两天用电子数码卡尺测量肿瘤直径,并且通过公式(1)计算肿瘤体积:volume=0.5×length×(width)2。
收集器官及肿瘤组织:最后,用过量的二氧化碳气体窒息法使所有裸鼠安乐死,对肿瘤组织进行称重,并收集器官及肿瘤组织用于进一步分析。
裸鼠器官和肿瘤组织he染色:将裸鼠的心脏、肝脏、脾脏、肺脏、肾脏以及肿瘤组织包埋并切片,将切片脱石蜡并用乙醇-二甲苯再水合,然后用苏木精和曙红染色。后使用pannoramicdesk(3dhistech)软件扫描染色的切片。染色后,细胞核为蓝色,细胞质为红色。
p53抗体免疫组化检测:处死裸鼠后,包埋所有肿瘤组织并切片。将切片脱石蜡并再水合,然后在3%的双氧水中温浴25分钟以淬灭内源性过氧化物酶活性。此外,加热切片以回收抗原并在室温下用3%的bsa封闭30分钟。
实验结果:
1)如图15左所示,9.4t向上静磁场处理荷瘤裸鼠过程中,曝磁组裸鼠相对对照组的肿瘤生长速率明显降低;然而9.4t向下静磁场处理后,两组肿瘤生长速率无明显差异。
2)如图15右所示,9.4t向上静磁场处理荷瘤裸鼠21天后,曝磁组裸鼠肿瘤质量相对对照组的显著降低,肿瘤抑制率达到44.7%;然而9.4t向下静磁场处理后,两组肿瘤质量无明显差异。
3)如图16所示,9.4t向上静磁场显著上调裸鼠肿瘤组织p53水平,而9.4t向下静磁场则无此效果。
4)如图17所示,9.4t向上和向下静磁场对肿瘤组织内部结构并无明显影响。
5)如图18所示,9.4t向上和向下静磁场对心脏组织内部结构并无明显影响。
6)如图19所示,9.4t向上和向下静磁场对肝脏组织内部结构并无明显影响。
7)如图20所示,9.4t向上和向下静磁场对脾脏组织内部结构并无明显影响。
8)如图21所示,9.4t向上和向下静磁场对肺脏组织内部结构并无明显影响。
9)如图22所示,9.4t向上和向下静磁场对肾脏组织内部结构并无明显影响。
上述动物和细胞实验中,数据表示方式均为平均值±标准偏差。由graphpadprismv6.02,t-检验进行数据差异性分析。细胞实验和动物实验:假曝磁对照组和9.4t曝磁组之间,“*”代表p<0.05;“**”代表p<0.01;“***”代表p<0.005。
本发明能够长时间保持动物培养所需的温度、湿度和气体条件,配合超导磁体产生的不同方向和不同强度的静磁场,能够系统深入的研究静磁场对各种小型动物的效应。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!