一种化合物及其应用的制作方法
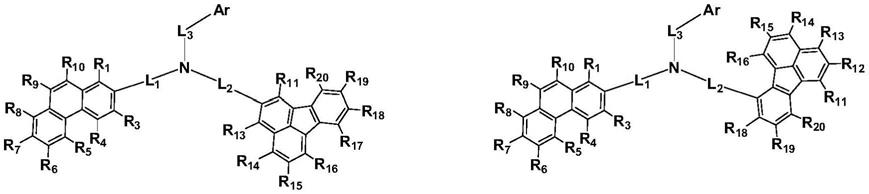
1.本发明涉及有机电致发光技术领域,尤其涉及一种提供适用于有机电致发光器件中的有机发光材料,特别涉及一种菲和荧蒽基团通过氮连接的化合物及其在有机电致发光器件上的应用。
背景技术:
2.目前,作为新一代显示技术的有机电致发光器件(oled)在显示和照明技术方面都获得了越来越多的关注,应用前景十分广泛。但是,和市场应用要求相比,oled器件的发光效率、驱动电压、使用寿命等性能还需要继续加强和改进。
3.一般来说,oled器件基本结构为在金属电极中间夹杂各种不同功能的有机功能材料薄膜,犹如一个三明治的结构,在电流的驱动下,从阴阳两极分别注入空穴和电子,空穴和电子在移动一段距离后,在发光层得到复合,并以光或热的形式进行释放,从而产生了oled的发光。然而,有机功能材料是有机电致发光器件的核心组成部分,材料的热稳定性、光化学稳定性、电化学稳定性、量子产率、成膜稳定性、结晶性、色饱和度等都是影响器件性能表现的主要因素。
4.专利文献1(us20150155491)记载了3-菲基直接或经由连接体键合于氮原子的化合物,这些化合物可作为空穴注入层材料、空穴传输层材料、电子阻隔层材料等用于有机电致发光器件。专利文献2(jp2014511352)记载了2-菲基直接或经由连接体键合于氮原子的化合物,这些化合物作为空穴传输层材料或电子阻挡层材料被用于有机电致发光器件。专利文献3(cn107848950)记载了两个菲基直接或经由连接体键合于氮原子的化合物,这些化合物作为电子阻隔层材料被用于有机电致发光器件中,其光、电、热稳定性及发光效率等性能方面还有待于进一步提高。
技术实现要素:
5.本发明是为了解决上述课题而完成的,目的在于提供高性能的有机电致发光器件及可实现这样的有机电致发光器件的新型材料。
6.本发明人为了达成前述目的而反复进行了深入的研究,结果发现,通过使用下述式(1)表示的化合物,可以得到高性能的有机电致发光器件。
7.本发明的目的之一在于提供一种菲和荧蒽通过氮连接的化合物,该类化合物具有成膜性好,光、电、热稳定性好,发光效率高,电压低、寿命长,等优点,可用于有机发光器件中。特别是作为电空穴传输材料、电子阻隔层材料,具有应用于amoled产业的可能。
8.为达到上述目的,本发明采用如下技术方案:
9.一种化合物,其结构式如式(1)所示:
[0010][0011]
其中,r1-r10中的任一个为用于与l1键合的单键,其余各自独立地为取代基;
[0012]
r11-r20中的任一个为用于与l2键合的单键,其余各自独立地为取代基;
[0013]
所述取代基各自独立地选自氢、氘、卤素、被r取代的或未取代的c1-c10烷基、被r取代的或未取代的c3-c20环烷基、被r取代的或未取代的c1-c10杂烷基、被r取代的或未取代的c6-c30芳烷基、被r取代的或未取代的c1-c10烷氧基、被r取代的或未取代的c6-c30芳氧基、氨基、被r取代的或未取代的c3-c30硅烷基、被r取代的或未取代的c6-c30芳基、被r取代的或未取代的c3-c30杂芳基、氰基、硝基;或者两个相邻的取代基之间相互连接以形成环;
[0014]
l
1-l3各自独立地表示单键、被r取代或未取代的成环碳数为c6-50的亚芳基、被r取代或未取代的成环原子数为c5-50的亚杂芳基;
[0015]
ar表示被r取代或未取代的成环碳数为6-50的芳基、被r取代或未取代的成环原子数为5-50的杂芳基、被r取代或未取代的单环或多环c3-c60脂环族环或芳香族环、或者被r取代或未取代的单环或多环c3-c60脂环族环或芳香族环中一个或多个碳原子由选自o、s、n、se、si、ge中的至少一个杂原子所替换;所述杂芳基或杂烷基中的杂原子选自o、s、n、se、si、ge中的至少一个杂原子;
[0016]
所述r独立的选自氘、f、cl、br、c1-c4烷基、c1-c4烷氧基、c3-c20环烷基、c6-c10的芳基、具有成环碳数6-10的芳基的碳数为7-30的芳烷基、碳数1-20的烷氧基、成环碳数为6-10的芳基氧基、具有选自碳数1-10的烷基及成环碳数6-10的芳基中的取代基的单取代、二取代或三取代甲硅烷基、氰基、硝基中的至少1个基团;
[0017]
所作优选的化合物,其由下述式(1-1a)到(1-1d)表示:
[0018]
[0019][0020]
优选:所述r
1-r
20
取代基各自独立地选自氢、氘、卤素、c1-c4烷基、c3-c6环烷基、c6-c14芳烷基、c1-c14烷氧基、c6-c14芳氧基、氨基、c6-c14芳基、氰基、硝基;
[0021]
l
1-l3各自独立地表示单键、被r取代或未取代的成环碳数为6-14的亚芳基、被r取代或未取代的成环原子数为5-13的亚杂芳基;
[0022]
所述杂芳基中的杂原子选自o、s、n中的至少一个杂原子;
[0023]
所述r独立的选自氘、f、cl、br、c1-c4烷基。
[0024]
进一步优选:所述r
1-r4、r
9-r
20
各自独立地选自氢,r
5-r8中三个为氢,另一个为氢、c1-c4烷基、c1-c4烷基取代的苯基、苯基、或萘基;
[0025]
l
1-l3各自独立地表示单键、c1-c4烷基取代或未取代亚苯基、c1-c4烷基取代或未取代亚萘基。
[0026]
所作优选的化合物,其特征在于,所述r1-r20两个相邻的取代基可以相互连接形成的并环结构为下述通式(2)、式(3)所示的环:
[0027][0028]
其中,y1、y2和y3、y4为与环连接的位置,x独立地选自o/s/so2/nr
109
/cr
110
r
111
/si r
112
r
113
,r
101-r
109
各自独立地为选自氢、氘、卤素、被r取代的或未取代的c1-c10烷基、被r取代的或未取代的c3-c20环烷基、被r取代的或未取代的c1-c10杂烷基、被r取代的或未取代的c6-c30芳烷基、被r取代的或未取代的c1-c10烷氧基、被r取代的或未取代的c6-c30芳氧基、氨基、被r取代的或未取代的c3-c30硅烷基、被r取代的或未取代的c6-c30芳基、被r取代的或未取代的c3-c30杂芳基、氰基、硝基。
[0029]
所作优选的化合物,其中,ar由下述式(a)-式(x)中任一式表示;
[0030]
[0031][0032]
其中r
200-r
257
分别独立地代表无取代到最大可能取代数,当r
200-r
257
为取代基时,各自独立地为选自氘、卤素、被r取代的或未取代的c1-c10烷基、被r取代的或未取代的c3-c20环烷基、被r取代的或未取代的c1-c10杂烷基、被r取代的或未取代的c6-c30芳烷基、被r取代的或未取代的c1-c10烷氧基、被r取代的或未取代的c6-c30芳氧基、氨基、被r取代的或未取代的c3-c30硅烷基、被r取代的或未取代的c6-c30芳基、被r取代的或未取代的c3-c30杂芳基、氰基、硝基;或者两个相邻基团之间相互连接以形成环;
[0033]
*表示与式(1)中地l3相连地键合位置。
[0034]
优选:其中r
200-r
257
各自独立地为选自氢、c1-c4烷基、c1-c4烷基取代或未取代苯基、c1-c4烷基取代或未取代萘基。
[0035]
作为优选的化合物,所述化合物的具体结构式为;
[0036]
[0037]
[0038]
[0039]
[0040]
[0041]
[0042]
[0043]
[0044]
[0045]
[0046]
[0047]
[0048][0049]
本发明的目的之一还在于提供一种包含上述化合物的有机电致发光器件;
[0050]
本发明的材料在有机电致发光器件中作为空穴传输材料;或者
[0051]
本发明的材料在有机电致发光器件中作为电子阻挡层材料。
[0052]
本发明的材料具有成膜性好,光、电、热稳定性好,发光效率高,电压低、寿命长等优点,可用于有机发光器件中。特别是作为空穴传输材料、电子阻隔层材料,具有应用于amoled产业的可能。
具体实施方式
[0053]
所述实施例仅仅是为了便于理解技术发明,不应视为本发明的具体限制。
[0054]
本发明中的化合物合成中涉及的原物料和溶剂等均购自于alfa、acros等本领域技术人员熟知的供应商。
[0055]
实施例1:化合物a1的合成
[0056][0057]
化合物03的合成:向一个1l三口烧瓶,依次加入化合物01(45g,0.13mol,1.0eq)、化合物02(16.3g,0.13mol,1.0eq),pd(pph3)4(3.1g,2.68mol,0.02eq)、k2co3(37.02g,0.26mol,2.0eq),thf/h2o混合溶剂(8/2,共450ml),搅拌下真空、n2置换3次,在约70℃下加热搅拌5h,tlc监测原料01反应完全(展开剂为hex)。降温,加入甲苯(300ml),搅拌0.5h,萃取分液收集有机相,浓缩去除溶剂,采用柱层析(洗脱剂为hex)分离,干燥后得到22.09g白色固体化合物03,收率49.5%。质谱:334.22(m+h)。
[0058]
化合物05的合成:向一个1l三口烧瓶,依次加入化合物03(22g,66.02mmol,1.0eq)、化合物04(10.53g,67.34mmol,1.02eq)、pd(dppf)cl2(0.966g,1.32mmol,0.02eq)、k2co3(18.25g,132.04mmol,2.0eq),1,4-dioxane/h2o混合溶剂(10/2,共264ml),搅拌下真空、n2置换3次,加热至80℃反应8h。tlc监测原料03反应完全(展开剂为dcm/hex=1:20)。反应液降至室温,加入甲苯(200ml),搅拌0.5h,萃取分液收集有机相,有机相采用硅藻土进行过滤,少量甲苯淋洗滤饼,收集滤液浓缩有机相至仅剩150ml左右,降至室温,缓慢加入甲醇(250ml)搅拌析晶3h。过滤,滤饼用少量甲醇淋洗,收集固体60℃下真空干燥8h,得到19.78g
类白色固体化合物05,收率82.1%。质谱:365.87(m+h)。
[0059]
化合物08的合成:向一个1l三口烧瓶,依次加入化合物06(26.8g,82.66mmol,1.0eq)、化合物07(20.34g,82.66mmol,1.0eq),pd132(585.3mg,0.826mmol,0.01eq),k2co3(22.85g,165.32mmol,2.0eq),甲苯/乙醇/水(10/2/2,共375ml),搅拌下真空、n2置换3次,加热回流16h。tlc监测原料06反应完全(展开剂为dcm/hex=1:5)。降至室温后过滤,滤饼用乙醇(100ml)淋洗,抽干。滤饼加入到1l单口瓶中,再加入dcm(600ml)搅拌溶解,进行硅藻土过滤,旋干。将所得固体用dcm(150ml)打浆2次,70℃下真空干燥后得到27.3g类白色固体化合物08,收率74.2%。质谱:446.55(m+h)。
[0060]
化合物a1的合成:向一个1l三口烧瓶,依次加入化合物08(15g,33.67mmol,1.0eq)、化合物05(12.28g,33.67mmol,1.0eq),pd2(dba)3(924.8mg,1.01mmol,0.03eq),p(t-bu)3的50%甲苯溶液(1.63g,2.02mmol,0.06eq),t-buona(4.85g,50.5mmol,1.5eq),干燥的二甲苯(200ml),搅拌下真空、n2置换3次,加热回流16h。tlc监测原料05反应完全(展开剂为dcm/hex=1:8)。降至室温后,向反应液中加入甲醇(150ml),搅拌2h,抽滤收集固体。固体加入到1l单口瓶中,再加入dcm(450ml)搅拌溶解,加入去离子水,水洗分液3次(每次150ml),收集有机相进行硅胶过滤,滤液旋干。将所得固体用thf(180ml)加热溶解,冷却后缓慢滴加甲醇(180ml),搅拌析晶2h,抽滤得到固体。再按照该方法重结晶2次,70℃下真空干燥后得到16.81g白色固体化合物a1,收率64.5%。将16.81g的a1粗品升华纯化后得到升华品a1(11.5g,68.7%)。质谱:774.96(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,2h),8.78(d,1h),8.43(d,j=4.0hz,3h),7.92(d,2h),7.75(t,j=27.5hz,8h),7.62(d,2h),7.45(m,j=65.0,25.0hz,17h),7.27(t,1h),7.17(m,j=5.0hz,1h),7.06(d,1h).
[0061]
实施例2:化合物a2的合成:
[0062][0063]
化合物10的合成:参照化合物08的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:446.55(m+h)。
[0064]
化合物a2的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到17.6g白色固体化合物a2,收率67.8%。将17.6g的a2粗品升华纯化后得到升华品a 2(12.2g,69.3%)。质谱:774.96(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,2h),8.54(d,1h),8.43(m,j=4.0hz,6h),8.10(m,2h),7.92(d,2h),7.75(m,j=27.5hz,5h),7.62(m,2h),7.45(m,j=65.0,25.0hz,16h),7.27(d,1h),7.17(d,j=5.0hz,2h).
[0065]
实施例3:化合物a4的合成:
[0066][0067]
化合物12的合成:参照化合物03的合成过程及后处理纯化方法,只需要将对应的
原物料变更即可。质谱:334.22(m+h)。
[0068]
化合物13的合成:参照化合物05的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:365.87(m+h)。
[0069]
化合物a4的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到15.1g白色固体化合物a4,收率62.1%。将15.1g的a4粗品升华纯化后得到升华品a 4(9.87g,65.36%)。质谱:774.96(m+h)。1h nmr(400mhz,cdcl3)δ9.08(dd,2h),8.42(m,2h),8.29(t,2h),8.21(dd,2h),8.10(m,2h),7.88
–
7.71(m,6h),7.68(d,j=15.0hz,3h),7.62
–
7.32(m,16h),7.27(d,2h),7.17(m,j=5.0hz,2h).
[0070]
实施例4:化合物a21的合成:
[0071][0072][0073]
化合物15的合成:参照化合物05的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:289.8(m+h)。
[0074]
化合物17的合成:参照化合物08的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:446.6(m+h)。
[0075]
化合物a21的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到13.2g白色固体化合物a21,收率64.8%。将13.2g的a21粗品升华纯化后得到升华品a 21(8.8g,66.6%)。质谱:698.9(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.70(dd,1h),8.55
–
8.31(m,6h),8.10(m,2h),7.91(m,j=10.0hz,2h),7.86
–
7.31(m,17h),7.27(t,2h),7.17(dd,j=5.0hz,4h).
[0076]
实施例5:化合物a24的合成:
[0077][0078]
化合物20的合成:向一个500ml三口烧瓶,依次加入化合物18(17.43g,67.22mmol,1.05eq)、化合物19(18g,64.02mmol,1.0eq),pd2(dba)3(1.17g,1.28mmol,0.02eq),p(t-bu)3的50%甲苯溶液(1.04g,2.56mmol,0.04eq),t-buona(9.23g,96.04mmol,1.5eq),干燥的甲苯(150ml),搅拌下真空、n2置换3次,加热至105℃,反应6h。tlc监测原料19反应完全
(展开剂为dcm/hex=1:5)。降至室温后,向反应液中加入甲苯150ml,继续搅拌1h至溶清,将反应液进行硅胶过滤,用少量甲苯淋洗,收集滤液浓缩有机相至仅剩150ml左右,降至室温,缓慢加入甲醇(200ml)搅拌析晶2h。过滤,滤饼用少量甲醇淋洗。将所得固体用thf(180ml)加热溶解,冷却后缓慢滴加甲醇(180ml),搅拌析晶2h,抽滤得到固体。,70℃下真空干燥后得到20.07g淡黄色固体化合物20,收率68.2%。质谱:460.5(m+h)。
[0079]
化合物a24的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到12.4g白色固体化合物a24,收率63.03%。将12.4g的a24粗品升华纯化后得到升华品a 24(9.3g,75%)。质谱:712.8(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.70(dd,1h),8.50
–
8.35(m,6h),8.15
–
7.87(m,7h),7.82
–
7.50(m,11h),7.39(t,j=10.0hz,7h),7.30(d,j=15.0hz,2h).
[0080]
实施例6:化合物a27的合成:
[0081][0082]
化合物22的合成:参照化合物05的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:289.8(m+h)。
[0083]
化合物a27的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到14.2g白色固体化合物a27,收率58.9%。将14.2g的a27粗品升华纯化后得到升华品a 27(9.5g,66.9%)。质谱:712.8(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.70(dd,1h),8.53
–
8.35(m,5h),8.18
–
7.86(m,7h),7.84
–
7.49(m,10h),7.46
–
7.32(m,4h),7.33
–
7.23(m,3h),7.17(d,j=5.0hz,2h).
[0084]
实施例7:化合物a33的合成:
[0085][0086]
化合物24的合成:参照化合物05的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:289.8(m+h)。
[0087]
化合物a33的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到12.5g白色固体化合物a33,收率57.9%。将12.5g的a33粗品升华纯化后得到升华品a 33(7.9g,63.2%)。质谱:712.8(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.85(dd,1h),8.39(m,j=27.6,7.4hz,5h),8.05(m j=45.0,15.0hz,5h),7.90(dd,1h),7.77(d,j=22.0hz,3h),7.73
–
7.47(m,8h),7.46
–
7.33(m,5h),7.32
–
7.22(m,3h),7.18(d,j
=5.0hz,2h).
[0088]
实施例8:化合物a70的合成:
[0089][0090]
化合物27的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:419.5(m+h)。
[0091]
化合物a70的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到9.9g白色固体化合物a70,收率54.7%。将12.5g的a70粗品升华纯化后得到升华品a 70(6.8g,66.6%)。质谱:672.8(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.95(dd,1h),8.70(dd,1h),8.50(m,1h),8.42(m,j=13.0hz,2h),7.90(t,j=7.5hz,3h),7.86
–
7.61(m,9h),7.55(m,6h),7.38(m,j=20.0,10.0hz,7h),7.18(dd,1h),6.93(d,1h).
[0092]
实施例9:化合物a72的合成:
[0093][0094]
化合物a2的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:419.5(m+h)。
[0095]
化合物a72的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到12.0g白色固体化合物a72,收率63.8%。将12.0g的a72粗品升华纯化后得到升华品a 72(8.7g,72.5%)。质谱:672.8(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.95(dd,1h),8.70(dd,1h),8.50(m,1h),8.46
–
8.37(m,5h),8.10(m,2h),7.90(m,j=7.5hz,3h),7.82
–
7.58(m,7h),7.55(m,j=5.0hz,5h),7.35(m,j=37.5,22.5hz,7h).
[0096]
实施例10:化合物a81的合成
[0097][0098]
化合物a81的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到16.6g白色固体化合物a81,收率54.3%。将16.6g的a81粗品升华纯化后得到升华品a 81(11.9g,71.6%)。质谱:672.8(m+h)。1h nmr(400mhz,cdcl3)δ9.10(d,1h),8.95(dd,1h),8.85(dd,1h),8.50(m,1h),8.39(m j=30.7,5.7hz,5h),8.10(m,2h),7.89(d,j=5.0hz,2h),7.77(m,j=9.1,5.9hz,5h),7.70
–
7.49(m,7h),7.47
–
7.23(m,6h),
7.17(d,j=5.0hz,2h).
[0099]
实施例11:化合物a118的合成
[0100][0101]
化合物30的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:459.6(m+h)。
[0102]
化合物a118的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到9.3g白色固体化合物a118,收率61.2%。将9.3g的a118粗品升华纯化后得到升华品a118(6.7g,72.1%)。质谱:711.9(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.70(dd,1h),8.55(dd,1h),8.45(m,j=16.1hz,2h),8.19(m,1h),7.91(m,j=10.0hz,2h),7.86
–
7.47(m,13h),7.39(m,j=15.0,10.0hz,5h),7.16(m,j=27.5,17.5hz,6h),7.04(m,1h),6.93(d,1h).
[0103]
实施例12:化合物a138的合成
[0104][0105][0106]
化合物32的合成:向一个1l三口烧瓶,依次加入化合物09(18g,73.15mmol,1.0eq)、化合物31(21.1g,74.61mmol,1.02eq)、pd(dppf)cl2(1.07g,1.46mmol,0.02eq)、k2co3(20.2g,146.3mmol,2.0eq),1,4-dioxane/h2o混合溶剂(10/2,共216ml),搅拌下真空、n2置换3次,加热至70℃反应8h。tlc监测原料09反应完全(展开剂为dcm/hex=1:20)。反应液降至室温,加入甲苯(100ml),搅拌0.5h,萃取分液收集有机相,有机相采用硅藻土进行过滤,少量甲苯淋洗滤饼,收集滤液浓缩至仅剩100ml左右,降至室温,缓慢加入正己烷(250ml)搅拌析晶3h。过滤,滤饼用少量正己烷淋洗,收集固体60℃下真空干燥8h,得到18.79g白色固体化合物32,收率71.9%。质谱:358.2(m+h)。
[0107]
化合物33的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:536.5(m+h)。
[0108]
化合物a138的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到12.3g白色固体化合物a138,收率62.1%。将12.3g的a138粗品升华
纯化后得到升华品a138(7.9g,64.2%)。质谱:788.9(m+h)。1h nmr(400mhz,cdcl3)δ9.09(d,1h),8.92(d,1h),8.85(dd,1h),8.70(t,1h),8.49
–
8.30(m,4h),8.05(m,j=45.0,15.0hz,5h),7.90(s,1h),7.81(dd,1h),7.78
–
7.49(m,13h),7.37(m,j=30.0,20.0hz,9h).
[0109]
实施例13:化合物a150的合成
[0110][0111]
化合物35的合成:参照化合物32的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:358.2(m+h)。
[0112]
化合物36的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:536.5(m+h)。
[0113]
化合物a150的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到10.56g白色固体化合物a150,收率77.2%。将10.56g的a150粗品升华纯化后得到升华品a150(6.4g,60.6%)。质谱:788.9(m+h)。1h nmr(400mhz,cdcl3)δ9.05(d,1h),8.85(dd,1h),8.52
–
8.32(m,5h),8.29(d,1h),8.05(m,j=45.0,15.0hz,5h),7.90(dd,1h),7.81(dd,1h),7.75(s,2h),7.73
–
7.49(m,10h),7.39(m,j=10.0hz,6h),7.29(m,j=20.0hz,2h),7.17(m,j=5.0hz,2h).
[0114]
实施例14:化合物a158的合成
[0115][0116]
化合物38的合成:参照化合物32的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:358.2(m+h)。
[0117]
化合物40的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:535.6(m+h)。
[0118]
化合物a158的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到6.52g白色固体化合物a158,收率68.1%。将6.52g的a158粗品升华纯化后得到升华品a158(4.93g,75.6%)。质谱:788.0(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.68(m,j=21.6hz,2h),8.53(m,j=23.8hz,2h),8.43(m,j=5.0hz,3h),8.19(m,1h),8.10(m,2h),7.91(m,j=10.0hz,2h),7.76(m,j=5.0hz,2h),7.70
–
7.57(m,5h),7.57
–
7.33(m,7h),7.27(s,2h),7.23
–
7.09(m,9h),7.04(s,1h).
[0119]
实施例15:化合物a159的合成
[0120][0121]
化合物41的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:535.6(m+h)。
[0122]
化合物a159的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到6.94g白色固体化合物a159,收率65.5%。将6.94g的a159粗品升华纯化后得到升华品a159(5.1g,73.4%)。质谱:788.0(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.70(dd,1h),8.55(dd,1h),8.52
–
8.35(m,7h),8.19(m,1h),8.10(m,2h),7.91(m,j=10.0hz,2h),7.78(dd,j=30.0hz,2h),7.72
–
7.61(m,3h),7.55(m,j=12.5hz,4h),7.41(m,j=10.0hz,2h),7.27(t,2h),7.24
–
7.09(m,9h),7.04(m,1h).
[0123]
实施例16:化合物a174的合成
[0124][0125]
化合物42的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:496.6(m+h)。
[0126]
化合物a174的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到7.4g白色固体化合物a174,收率71.1%。将7.4g的a174粗品升华纯化后得到升华品a174(5.2g,70.2%)。质谱:748.9(m+h)。1h nmr(400mhz,cdcl3)δ9.40(t,1h),9.07(d,1h),8.95(dd,1h),8.85(dd,1h),8.61(d,1h),8.50(m,1h),8.42(m,2h),8.36(d,j=10.0hz,2h),8.10(m,2h),7.89(d,j=5.0hz,2h),7.86
–
7.73(m,6h),7.73
–
7.49(m,10h),7.47
–
7.29(m,8h).
[0127]
实施例17:化合物a181的合成
[0128][0129]
化合物44的合成:参照化合物32的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:358.2(m+h)。
[0130]
化合物45的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:496.6(m+h)。
[0131]
化合物a181的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到6.3g白色固体化合物a181,收率62.1%。将6.3g的a181粗品升华纯化后得到升华品a181(4.2g,66.6%)。质谱:748.9(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.95(dd,1h),8.70(dd,1h),8.46(t,j=17.5hz,3h),7.90(m,j=7.5hz,3h),7.86
–
7.75(m,6h),7.65(q,j=5.0hz,6h),7.55(s,6h),7.47
–
7.29(m,4h),7.27(dd,2h),7.17(m,j=5.0hz,4h),7.06(dd,1h).
[0132]
实施例18:化合物a94的合成
[0133][0134]
化合物47的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:532.6(m+h)。
[0135]
化合物a94的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到6.1g白色固体化合物a94,收率57.0%。将6.1g的a94粗品升华纯化后得到升华品a94(4.3g,70.4%)。质谱:784.9(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.70(dd,1h),8.41(m,j=20.5hz,2h),7.96
–
7.75(m,9h),7.75
–
7.61(m,4h),7.55(m,4h),7.47(dd,1h),7.43
–
7.29(m,4h),7.30
–
7.14(m,6h),6.93(d,1h),6.81(m,2h),6.43(dd,j=11.5hz,2h).
[0136]
实施例19:化合物a96的合成
[0137][0138]
化合物48的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:532.6(m+h)。
[0139]
化合物a96的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到6.07g白色固体化合物a96,收率65.3%。将6.07g的a96粗品升华纯化后得到升华品a96(4.02g,66.2%)。质谱:785.0(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.70(dd,1h),8.51
–
8.35(m,4h),8.26(d,1h),8.10(m,2h),8.02
–
7.83(m,6h),7.78(dd,j=29.9hz,2h),7.64(m,j=17.5hz,3h),7.55(dd,j=5.0hz,3h),7.44(dd,1h),7.36(m,j=13.6hz,3h),7.25(m,j=11.8hz,6h),6.95(m,2h),6.44(m,j=17.7hz,2h).
[0140]
实施例20:化合物a99的合成
[0141][0142]
化合物a99的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到6.74g白色固体化合物a99,收率67.2%。将6.74g的a99粗品升华纯化后得到升华品a99(4.87g,72.2%)。质谱:785.0(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),δ8.70(dd,1h),8.48
–
8.37(m,4h),8.34(d,1h),8.10(m,2h),7.96
–
7.79(m,9h),7.76(m,j=13.7hz,2h),7.71(m,j=35.0hz,1h),7.62(m,j=10.0hz,2h),7.55(m,j=5.0hz,2h),7.34(dd,1h),7.23(dt,j=31.4,5.0hz,9h),6.95(d,1h),6.26(dd,1h).
[0143]
实施例21:化合物a101的合成
[0144][0145]
化合物50的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:532.6(m+h)。
[0146]
化合物a101的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到8.69g白色固体化合物a101,收率67.7%。将8.69g的a101粗品升华纯化后得到升华品a101(5.88g,67.6%)。质谱:785.0(m+h)。1h nmr(400mhz,cdcl3)δ9.01(d,1h),8.85(dd,1h),8.50
–
8.31(m,4h),8.10(m,2h),7.97
–
7.83(m,5h),7.84
–
7.73(m,6h),7.65(d,j=25.0hz,2h),7.55(m,3h),7.37(m,j=10.8hz,4h),7.24(m,j=5.0hz,5h),7.01(m,2h),6.50(dd,1h),6.38(d,1h).
[0147]
实施例22:化合物a108的合成
[0148][0149]
化合物52的合成:参照化合物20的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:459.6(m+h)。
[0150]
化合物a108的合成:参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,得到7.61g白色固体化合物a108,收率59.7%。将7.61g的a108粗品升华纯化后得到升华品a108(4.87g,63.9%)。质谱:711.8(m+h)。1h nmr(400mhz,cdcl3)δ9.11(d,1h),8.70(dd,1h),8.55(dd,1h),8.50(d,1h),8.43(t,j=2.5hz,4h),8.24(d,1h),8.10
(dd,2h),7.91(m,j=10.0hz,2h),7.75(dd,j=2.3hz,2h),7.72
–
7.45(m,12h),7.37(d,2h),7.33
–
7.21(m,3h),7.13(m,j=25.0hz,2h).应用例:有机电致发光器件的制作
[0151]
将50mm*50mm*1.0mm的具有ito(100nm)透明电极的玻璃基板在乙醇中超声清洗10分钟,再150度烘干后经过n2 plasma处理30分钟。将洗涤后的玻璃基板安装在真空蒸镀装置的基板支架上,首先再有透明电极线一侧的面上按照覆盖透明电极的方式蒸镀化合物hatcn,形成膜厚为5nm的薄膜,紧接着蒸镀一层htm1形成膜厚为60nm的薄膜作为htl1,再在htm1薄膜上蒸镀一层htm2形成膜厚为10nm的薄膜作为htl2,然后,在htm2膜层上再采用共蒸镀的模式蒸镀主体材料和掺杂材料(参杂比例为2%),膜厚为25nm,主体材料和参杂材料比例为90%:10%。在发光层上再依次按照下表的搭配蒸镀etl(30nm)作为电子传输材料,接着在电子传输材料层之上蒸镀liq(1nm)作为电子注入材料,接着再采用共蒸镀的模式蒸镀mg/ag(100nm,1:9)作为阴极材料。
[0152][0153]
评价:
[0154]
将上述器件进行器件性能测试,在各实施例和比较例中,使用恒定电流电源(keithley2400),使用固定的电流密度流过发光元件,使用分光辐射俩都系(cs 2000)测试发光波谱。同时测定电压值以及测试亮度为初始亮度的90%的时间(lt90)。结果如下表1:
[0155]
表1:
[0156][0157][0158]
由上面表格中的数据对比可知,使用本发明的化合物应用于有机电致发光器件作为空穴传输层、电子阻隔层,相较于对比化合物在驱动电压、发光效率、器件寿命都表现出
更加优越的性能。
[0159]
上述结果表明本发明的化合物具有光、电、热稳定性好,发光效率高,电压低、寿命长等优点,可用于有机发光器件中。特别是作为空穴传输层材料、电子阻隔层材料,具有应用于amoled产业的可能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1