金刚乙胺半抗原、金刚乙胺完全抗原及其制备方法与试纸条与流程
本发明涉及生物医药材料领域,尤其涉及一种金刚乙胺半抗原、金刚乙胺完全抗原及其制备方法与试纸条。
背景技术:
免疫分析是以抗原与抗体之间特异性识别和可逆性结合反应为基础的痕量分析方法,其不仅适用于大分子化合物(如蛋白质、核酸、细菌)的检测,也适用于小分子化合物(如激素、药物)的测定。建立小分子化合物的免疫分析方法的关键是能够制备出对小分子化合物具有高亲和力和高选择性的抗体。由于大多数小分子化合物的分子量小于1000,不具有免疫原性,即缺乏t细胞表位而无法直接诱导动物机体等产生特异性抗体。然而,小分子化合物可以通过适当的化学修饰方法,与大分子载体结合,生成小分子化合物-大分子载体的偶联物,此偶联物即为完全抗原,它可以借助t细胞表位来间接诱导b细胞的增殖及分化,产生特异性抗体。
金刚乙胺(melatonin,mlt)是一种小分子物质,化学名为n-乙酰-5-甲氧基色胺,分子量仅为232.28d,不具有免疫原性,用于免疫,必须先与蛋白质大分子载体结合,形成金刚乙胺-蛋白质载体偶联的完全抗原后才具免疫原性。然而,制备金刚乙胺-蛋白质载体偶联的完全抗原不能影响金刚乙胺的空间构象,而且需要保持金刚乙胺抗原决定簇(如5-甲氧基、n-烷基侧链)的有效性,才能获得效价高、特异性强的金刚乙胺抗体。因此,如何制备具有良好免疫原性的完全抗原是建立测定金刚乙胺的免疫分析方法的难点。
技术实现要素:
本发明提供了一种金刚乙胺半抗原、金刚乙胺完全抗原及其制备方法与试纸条,旨在解决上述问题。
根据本申请实施例的第一方面,提供了一种金刚乙胺半抗原,其结构式为:
根据本申请实施例的第二方面,提供了一种金刚乙胺半抗原的制备方法,包括以下步骤:
提供金刚乙胺,其结构式为
将金刚乙胺和丁二酸酐按1:1~1:2的摩尔比溶于吡啶中,得到反应液,所述反应液在80~100℃下反应2~3小时后,分离纯化反应液,得到金刚乙胺半抗原。
根据本申请实施例的第三方面,提供了一种金刚乙胺完全抗原,其结构式为
式中,r为载体蛋白,n为5~20的自然数。
根据本申请实施例的第四方面,提供了一种金刚乙胺完全抗原的制备方法,包括以下步骤:
将金刚乙胺半抗原溶解在n,n-二甲基甲酰胺溶液中,然后加入1-乙基-碳酰二亚胺盐酸盐和n-羟基丁二酰亚胺,或者加入3-二甲基氨基丙基-碳酰二亚胺盐酸盐和n-羟基丁二酰亚胺,得到第一反应液;
在室温下搅拌反应12~16小时后,得到第二反应液;
配置载体蛋白的磷酸盐缓冲液;
将第二反应液逐滴加入到所述载体蛋白的磷酸盐缓冲液中,在室温下搅拌反应过夜,得到含金刚乙胺完全抗原的混合溶液,将所述含金刚乙胺完全抗原的混合溶液进行透析后离心,得到含金刚乙胺完全抗原的上清溶液,所述金刚乙胺完全抗原的结构式为
式中,r为载体蛋白,n为5~20的自然数。
根据本申请实施例的第五方面,提供了一种检测金刚乙胺的胶体金免疫层析试纸条,包括背板、样品垫、金标垫、反应垫和吸水垫;其中,所述样品垫、金标垫、反应垫和吸水垫依次设置于所述背板上;所述反应垫上具有检测线和质控线,所述检测线包被有金刚乙胺完全抗原,所述质控线包被有抗金刚乙胺抗体金标复合物,所述金标垫上喷有金刚乙胺抗体金标复合物。
本申请实施例提供的技术方案可以包括以下有益效果:
本发明提供的金刚乙胺完全抗原包括金刚乙胺分子和载体蛋白,所述金刚乙胺分子和载体蛋白通过连接臂进行连接,在所述金刚乙胺完全抗原中,其金刚乙胺分子的抗原决定簇能充分暴露,且具有较完整的空间构象,因此,本发明提供的金刚乙胺完全抗原具有较好的免疫原性。
本发明提供的检测金刚乙胺的胶体金免疫层析试剂盒能用于对金刚乙胺进行的免疫检测,大大提高了其检测灵敏度,通过该胶体金试剂盒可快速筛选出金刚乙胺所有阳性样本,能检出大于1.8ng/ml的样本。
本发明提供的检测金刚乙胺的胶体金免疫层析试剂盒检测时间短;不需要任何特殊仪器;操作简便,操作人员无需培训,检测成本低;总之,该检测试剂盒使用简单、经济、便捷。
本发明提供的检测金刚乙胺的胶体金免疫层析试剂盒的制备方法简单易行,采用的试纸为常规试纸,采用的抗体可以按照本发明提供的方法进行制备,可以进行大规模生产,且生产成本低。
附图说明
为了更清楚地说明本发明实施例技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
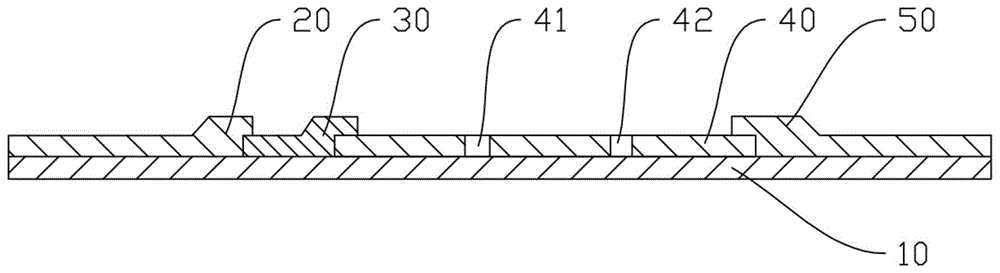
图1是本发明实施例的检测金刚乙胺的胶体金免疫层析试纸条的结构示意图。
标号说明:
10、背板;20、样品垫;30、金标垫;40、反应垫;41、检测线;42、质控线;50、吸水垫。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
还应当理解,在此本发明说明书中所使用的术语仅仅是出于描述特定实施例的目的而并不意在限制本发明。如在本发明说明书和所附权利要求书中所使用的那样,除非上下文清楚地指明其它情况,否则单数形式的“一”、“一个”及“该”意在包括复数形式。
还应当进一步理解,在本发明说明书和所附权利要求书中使用的术语“和/或”是指相关联列出的项中的一个或多个的任何组合以及所有可能组合,并且包括这些组合。
下述实施例中试剂和生物材料如无特殊说明,均可从商业渠道获得。
本发明公开了一种金刚乙胺半抗原,其结构式为
本发明公开了一种金刚乙胺半抗原的制备方法,其包括步骤s101-s102。
s101、提供金刚乙胺,其结构式为
s102、将所述金刚乙胺和丁二酸酐按1:1~1:2的摩尔比溶于吡啶中,得到反应液,所述反应液在80~100℃下反应2~3小时后,分离纯化反应液,得到金刚乙胺半抗原。
在一个可选的实施例中,本发明公开了一种金刚乙胺完全抗原,其结构式为
式中,r为载体蛋白,n为5~20的自然数。
金刚乙胺完全抗原的制备方法包括步骤s201-s202。
s201、将金刚乙胺半抗原溶解在n,n-二甲基甲酰胺溶液中,然后加入1-乙基-碳酰二亚胺盐酸盐和n-羟基丁二酰亚胺,或者加入3-二甲基氨基丙基-碳酰二亚胺盐酸盐和n-羟基丁二酰亚胺,得到第一反应液;
s202、在室温下搅拌反应12~16小时后,得到第二反应液。
具体地,在第一反应液中,金刚乙胺半抗原的浓度为0.05
mol/l,1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和n-羟基丁二酰亚胺的摩尔浓度分别为所述金刚乙胺半抗原摩尔浓度的1.2倍;
s203、配置载体蛋白的磷酸盐缓冲液。
具体地,载体蛋白的摩尔浓度为0.001mol/l,所述磷酸盐的摩尔浓度为0.01mol/l。
将第二反应液逐滴加入到所述载体蛋白的磷酸盐缓冲液中,在室温下搅拌反应过夜,得到含金刚乙胺完全抗原的混合溶液,将所述含金刚乙胺完全抗原的混合溶液进行透析后离心,得到含金刚乙胺完全抗原的上清溶液,所述金刚乙胺完全抗原的结构式为
式中,r为载体蛋白,n为5~20的自然数。
在一个可选的实施例中,载体蛋白为球蛋白、牛血清白蛋白、鸡卵清蛋白、钥孔血蓝蛋白、兔血清白蛋白、人血清白蛋白、甲状腺球蛋白、纤维蛋白原、兔丙种球蛋白和鸡丙种球蛋白中的任一种。
本发明公开了一种检测金刚乙胺的胶体金免疫层析试纸条,包括背板、样品垫、金标垫、反应垫和吸水垫,其中样品垫、金标垫、反应垫和吸水垫依次设置于所述背板上,样品垫和吸水垫分别设置于背板的两个端部,反应垫设置于背板的中部,金标垫的靠近反应垫的端部的下表面与反应垫的上表面贴合,金标垫上靠近样品垫的端部的上表面与样品垫的下表面贴合。反应垫远离金标垫的一端的上表面与吸水垫的上表面贴合,通过此结构使得待测液充分溢到反应垫上,最后被吸水垫吸收。反应垫上具有平行设置的检测线和质控线,检测线包被有金刚乙胺完全抗原,质控线包被有抗金刚乙胺抗体金标复合物,金标垫上喷有金刚乙胺抗体金标复合物。
本发明还提供了一种检测金刚乙胺的胶体金免疫层析试纸条的制备方法,其包括以下步骤s301-s303。
s301、金刚乙胺抗体、胶体金和金标垫的制备。
具体地,金刚乙胺抗体是以金刚乙胺完全抗原为免疫原,采用常规方法制备金刚乙胺抗体。胶体金是采用柠檬酸三钠还原法制备25~40nm的胶体金。
金标垫的制备包括以下步骤,经处理液浸渍处理的玻璃纤维,烘干后,将金刚乙胺抗体金标复合物以0.5~4μl/cm的用量喷涂在预处理的玻璃纤维上,25℃~30℃干燥后,得到金标垫(3)置于2℃~8℃的环境下备用。
上述的金刚乙胺抗体金标复合物制备时,调节胶体金ph7.0~9.0,搅拌条件下,按每毫升胶体金溶液加入4~25μg蛋白的用量缓慢加入所述金刚乙胺抗体,静置10~30min,然后加入牛血清蛋白bsa至终浓度0.5~5%,静置10~30min,离心,弃上清,将沉淀用洗涤液洗涤2~3次,末次用十分之一初始体积的重悬液将沉淀重悬,置4℃备用。
s302、检测线和质控线的设置。
具体地,检测线的设置用包被膜缓冲液稀释分别将金刚乙胺完全抗原稀释至浓度为1.0~1.5mg/ml;取反应垫,用划膜仪以1~10μl/cm的用量将金刚乙胺完全抗原划在反应垫上,形成检测线。
质控线的设置,用包被膜缓冲液将羊抗鼠igg稀释至浓度为0.8~1.5mg/ml,然后采用划膜仪以1~10μl/cm的用量将羊抗鼠igg划在反应垫上,形成质控线,随后置放于37℃烘干备用。
检测线和质控线之间的距离设置在5~8mm范围之间,两线喷线粗细均匀,37℃烘干反应垫后,封装备用;反应垫的材质为nc膜,nc膜可以为任何商品化硝酸纤维素膜,优选为s&sae99、whatman8μm、milliporem135、sartoriuscn140。
包被膜缓冲液可以是硼酸盐,碳酸盐,磷酸盐,tris-hcl或tris-磷酸盐,醋酸盐,巴比妥,等等,其缓冲液的目的为提供一定ph和离子强度使蛋白包被并牢固包被于nc膜,其缓冲液ph值一般约为6~9.5范围内,优选为6.5~7.5的中性缓冲范围内,且最优选缓冲液的ph值为7.0~7.4范围内。优选为磷酸盐。取试剂naci8.0g、kh2po40.2g、na2hpo4.12h2o2.9g和kci0.2g按次序加入定量容器中,加适量蒸馏水溶解后,再定容至1000ml,调ph值至7.4,高压消zhidao毒灭菌112kpa20min,冷却后,保存于4℃冰箱中备用。
s303、检测金刚乙胺的胶体金免疫层析试纸条的组装。
具体地,取背板、样品垫、吸水垫、经过处理后的金标垫和经过处理后的反应垫进行组装,得到检测苯甲酸的胶体金免疫层析试剂盒,其中样品垫、金标垫、反应垫和吸水垫依次设置于所述背板上,样品垫和吸水垫分别设置于背板的两个端部,反应垫设置于背板的中部,金标垫的靠近反应垫的端部的下表面与反应垫的上表面贴合,金标垫上靠近样品垫的端部的上表面与样品垫的下表面贴合。反应垫远离金标垫的一端的上表面与吸水垫的上表面贴合,通过此结构使得待测液充分溢到反应垫上,最后被吸水垫吸收。检测线包被有金刚乙胺完全抗原,所述质控线包被有抗金刚乙胺抗体金标复合物,所述金标垫上喷有金刚乙胺抗体金标复合物。
在一些可选的实施例中,可以将上述的试纸条安装在一个外壳内,反应垫外露,使得用户可以在外部观察反应垫的反应,并且读取结果,样品垫对应处的外壳也开设有开口,使得用户可以通过开口,将样品投入样品垫上。
本实施例中,背板的材质为pvc板,样品垫的材质为玻璃纤维,吸水垫的材质为吸水纸。组装时,室内温度应控制在25℃~37℃,湿度20%~30%。
在一个可选的实施例中,金刚乙胺抗体金标复合物包括金刚乙胺抗体和胶体金纳米颗粒,金刚乙胺抗体金标复合物具有识别并特异性结合金刚乙胺的能力。金刚乙胺抗体为单克隆抗体或多克隆抗体。金刚乙胺抗体金标复合物所述金刚乙胺抗体和胶体金纳米颗粒通过静电结合的方式形成。
在一个可选的实施例中,金刚乙胺抗体为单克隆抗体,其制备方法包括步骤s301-s304。
s301、动物免疫。
以偶联物mlt-bsa为免疫抗原免疫balb/c小鼠,100μg/kg体重。首免时将免疫原与等量的弗氏完全佐剂混合制成乳化剂,颈背部皮下多点注射,间隔2周取相同剂量免疫原加等量弗氏不完全佐剂混合乳化,继续三免、方法剂量同二免,三免一周后尾部采血检测血清效价及抑制,待检测符合要求时腹腔冲击免疫一次,3天后取脾细胞。
s302、细胞融合和克隆化。
取免疫balb/c小鼠脾细胞,按5:1比例与sp2/0骨髓瘤细胞融合,采用间接竞争elisa测定细胞上清液,筛选阳性孔。利用有限稀释法对阳性孔进行克隆化,直到得到稳定分泌单克隆抗体的杂交瘤细胞株。
s303、细胞冻存和复苏。
取处于对数生长期的杂交瘤细胞用冻存液制成5×l06个/ml的细胞悬液,分装于冻存管,在液氮中长期保存。复苏时取出冻存管,立即放入37℃水浴中速融,离心去除冻存液后,移入培养瓶内培养。
s304、单克隆抗体的制备与纯化。
采用体内诱生法,将8周龄的balb/c小鼠腹腔注入弗氏不完全佐剂0.5ml/只,7天后腹腔注射杂交瘤细胞5×l06个/只,7天后采集腹水。用亲和层析柱进行腹水纯化,紫外分光光度计测定蛋白浓度,-20℃保存备用。采用elisa法测定纯化抗体的效价(1:128000),结果表明,纯化的抗体对金刚乙胺表现出较高的特异性和灵敏性。
在一个可选的实施例中,金刚乙胺抗体为多克隆抗体,其制备方法包括步骤s401-s402。
s401、动物免疫。
以本发明实施例一提供的偶联物mlt-bsa为免疫抗原免疫8周龄的balb/c小鼠,1mg/kg体重。首免时将免疫原与等量的弗氏完全佐剂混合制成乳化剂,颈背部皮下多点注射,间隔2周取相同剂量免疫原加等量弗氏不完全佐剂混合乳化,加强免疫一次,共免疫5次。
s402、抗血清的采集和多克隆抗体的纯化。
最后一次免疫7天后采血,测定血清抗体效价,腹动脉采全血收集血清,经亲和层析柱分离得到纯化的多克隆抗体,采用elisa法测定纯化抗体的效价(1:10000),纯化的抗体表现出对金刚乙胺较高的特异性和灵敏性。
在一个可选的实施例中,胶体金的制备方法,包括步骤s501-s503。
s501、将1g的氯金酸(haucl4)溶于100g超纯水中制备成1%氯金酸溶液4c放置待用;
s502、将1g的二水柠檬酸三钠溶于100g超纯水中制备成1%的二水柠檬酸三钠溶液4c放置待用;
s503、洁净的三角瓶中加入100ml超纯水放于加热的磁力搅拌器上,搅拌加热至沸腾,然后加入1ml1%的氯金酸,待沸腾后迅速的加入1.7ml的1%的二水柠檬酸三钠溶液,待颜色变成酒红色后继续加热搅拌15分钟,然后关闭加热和搅拌。所制备的胶体金自然冷却待用;所述制备的胶体金颗粒大小为20~40nm,最大吸收峰在521nm。
在一个可选的实施例中,金刚乙胺抗体金标复合物的制备方法,包括步骤s601-s602:
s601、寻找胶体金标记最适合的蛋白质浓度
取8条聚苯乙烯微量反应管一条,各孔中先加30ul三蒸水,再向第一孔中加入30ul的实施例四制备的金刚乙胺抗体,倍比稀释至最后一孔,向各空中加入125ulph8.0的胶体金溶液,室温静止15min,向各孔中加入125ul10%的nacl溶液,观察各孔变化,以不变色一孔为最小蛋白浓度(5ug/ml-10ug/ml)。
s602、调节胶体金ph8.0,搅拌条件下,按每毫升胶体金溶液加入6μg蛋白的用量缓慢加入所述金刚乙胺抗体,静置30min,然后加入牛血清蛋白bsa至终浓度1%,静置30min,4℃,12000转离心30min,弃上清,将沉淀用洗涤液洗涤2次,末次用十分之一初始体积的重悬液将沉淀重悬,得到金刚乙胺抗体金标复合物,置4℃备用。
其中所述重悬液也即保存液为含0.2~1%大分子蛋白的硼酸盐,碳酸盐,磷酸盐,tris-hcl或tris-磷酸盐,醋酸盐,巴比妥,等等,大分子蛋白可以为牛血清白蛋白、peg20000、酪蛋白等,缓冲液优选为磷酸盐缓冲液,更优选为0.5%bsaph7.4磷酸盐缓冲液。
此外,本实施例提供的检测金刚乙胺的胶体金免疫层析试剂盒的制备方法仅仅是应用本发明提供的金刚乙胺完全抗原、金刚乙胺抗体金标复合物、抗金刚乙胺抗体金标复合物的抗体的方式之一,其他应用,尤其是对金刚乙胺的免疫分析应用,都应看成是本发明实施例的保护范围;此外,还可以对本发明提供的检测金刚乙胺的胶体金免疫层析试剂盒进行包装,包括下述步骤:将1份已切好的试纸组装在备好的试纸卡里,使加样窗对应试纸的样品垫,结果显示窗对应检测区和控制区。再与一包干燥剂、说明书、样品加样器封装在外包袋里,于4~25℃避光保存。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!