一种用于生产甘精胰岛素的培养基的制作方法
1.本发明属于发酵工程领域,具体涉及一种用于生产甘精胰岛素的培养基。
背景技术:
2.发酵研究的主要目标在于使用高生产率技术使目的产品产生良好的成本效益。由于大多数蛋白在重组大肠杆菌中属于细胞内累积,故生产率与终细胞密度及单位生产率成正比关系。高密度发酵不仅可以提高生产率,还能降低培养容积、生产成本及设备投资,同时便于下游加工、减少废水排放,故高密度培养成为近年来发酵工业重要目标与方向之一。稳定的ph值是使菌体保持最佳生长状态的必要条件,由于外界的ph值变化会通过弱酸或弱碱的变化而改变菌体细胞内的ph值,从而影响细菌的代谢反应,因此发酵过程中ph值的改变会影响细胞的生物量和基因产物的表达。另一方面,微生物的生长可引起培养液ph值的变化。在基本培养基中培养微生物,通常ph值会发生较大的变化。铵盐中氨的消耗,或者微生物利用碳源产生的代谢产物即有机酸的积累,都会造成ph值的下降,而有机酸的消耗,以及硝酸盐为氮源时硝酸根的消耗,则造成ph值上升。菌体在生长过程中最适ph值对细菌在生产期包涵体的形成产生很大的影响,如果ph处于菌体生长的最佳状态,菌体自体蛋白的合成增强,干扰重组蛋白合成,产生错误折叠,大量与重组蛋白结构相似的菌体杂蛋白卷入包涵体,使包涵体中重组蛋白相对比率降低,给进一步的纯化工作带来难度。吴军,于公义(微生物学报36(6):433一437,1996)等研究显示,适当提高培养基的ph能减少乙酸盐的抑制作用。基因工程发酵诱导前后的目的不同,生长期为菌体密度的富集提高,生产期为目的产物不断累积。本发明基于此,采用了两个阶段不同的ph梯度调控法,既有利于菌体密度的提高和目的产物的表达,还减少了发酵过程乙酸等代谢副产物的产生。
3.基因工程菌在发酵过程中重组质粒会出现一定的不稳定性,将导致得不到预期的目的基因产物及产量。质粒的不稳定性分为dna片段发生重组、缺失或插入的结构性不稳定和细胞分裂时质粒未进入子细胞的分离不稳定。质粒的稳定性受到宿主和质粒的基因型、宿主和质粒的相互作用、基因表达程度、培养温度、营养限制和反应器操作方式等多种遗传和环境因素的影响。基因工程发酵通常需要高密度菌体培养,以获得更多的目的产物,然而过高的菌体密度会影响工程菌的质粒稳定性。
4.工程菌高密度培养是获得外源基因表达产物的重要手段,但高密度培养的主要障碍之一是代谢副产物乙酸的积累。随着发酵培养密度的提高,乙酸的积累增加,并直接影响菌体的生长和外源蛋白的表达,逐渐成为制约工程菌高密度培养的重要因素。jensen(biotech bioeng,1990;36:1-11)等报道当培养液中乙酸浓度大于6g/l时,乙酸会明显抑制菌体生长;当乙酸浓度大于2.4g/l时,会显著降低比产率。konstan(biotech bioeng,1990;36(1):750-758)等报道培养液中乙酸浓度大于15g/l时菌体生长就完全停止了。boon(biotechnol letts,1992;14(12):1115-1118)等人利用从大肠杆菌衍生的三株宿主菌与对应的重组菌做乙酸抑制实验,发现重组菌比宿主菌更容易受到乙酸的抑制。
5.cn104726524a公开了一种培养基及用该培养基发酵生产甘精胰岛素前体的方法,
通过添加盐类和微量元素来降低有害代谢产物(主要是乙酸)的积累,改善细胞生长,增加菌体得率,虽然产量有所提升,但仍不理想;cn106282274a公开了一种胰岛素前体蛋白的毕赤酵母高密度发酵方法,cn107022591b公开了一种提高胰岛素及其类似物前体表达的毕赤酵母发酵方法,均属于高密度发酵,但需发酵培养130h以上,发酵周期长。
6.传染性海绵状脑病(tse)是人与动物的一种慢性、致死性、神经性疾病,包括羊痒病(scrapie)、牛海绵状脑病(bse,又称疯牛病)、人的克雅氏症(cjd)、gss综合征等。英国的流行病学(veterinary record,1987;121(18):419-420)调查表明bse最有可能是由于牛长期食用含有羊痒病肉骨粉的饲料而引起。动物源培养基具有潜在的tse/bse污染,这样在后续合成制备具体药物时,其药物的安全性也有一定的风险,甚至会危害人类的健康,严重的话还会致人于死亡。
7.基因工程菌高密度发酵,不仅需要获得高的菌体密度,还得兼顾乙酸的积累、质粒稳定性和高效表达,四者之间相互影响,相辅相成。通过以上专利和文献可以看出,现有技术通常只顾及了其中的一方面或几方面,特别是考察高密度培养过程中质粒稳定性的文献更少。因此基因工程菌仅按传统的发酵工艺进行生产是远远不够的,需要对影响高密度发酵和外源基因表达的因素进行综合分析,进而探索出一套适于外源基因高效表达的高密度发酵工艺。
技术实现要素:
8.鉴于现有技术存在的诸多缺陷,本发明提供一种杜绝tse/bse风险的简单可行的既能提高甘精胰岛素产量,又能保证低质粒丢失率的培养基。
9.本发明采取ph梯度法,分段控制发酵诱导前后的ph值,即生长期控制适宜的ph值为6.5~6.9,加速菌体生长,生产期提高ph值至7.1~7.5,以减少异体蛋白的干扰,从而提高包涵体中目的蛋白的产量。
10.本发明的第一个目的在于提供一种用于生产甘精胰岛素的基础培养基,所述基础培养基包含甘油、酵母提取物、酵母蛋白胨、柠檬酸、磷酸氢二铵、磷酸二氢钾、硫酸镁、氯化钠和微量元素。
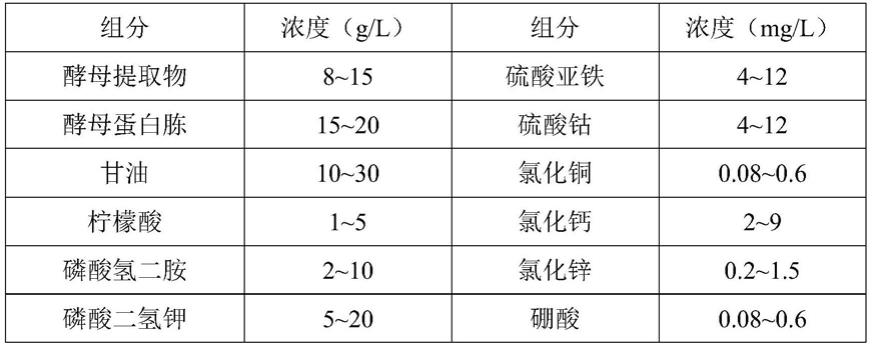
11.优选地,所述微量元素包含硫酸亚铁、硫酸钴、氯化铜、氯化钙、氯化锌、硼酸、硫酸锰。
12.进一步优选地,每升基础培养基包括下表1所示的组份:
13.表1
14.组分浓度(g/l)组分浓度(g/l)酵母提取物8~15磷酸二氢钾5~20酵母蛋白胨15~20硫酸镁0.2~2甘油10~30氯化钠0.2~2柠檬酸1~5微量元素0.4~0.6ml/l磷酸氢二胺2~10——
15.进一步优选地,所述微量元素包括下表2所示的组份:
16.表2
17.组分浓度(g/l)组分浓度(g/l)
硫酸亚铁10~20氯化锌0.5~2.5硫酸钴10~20硼酸0.2~1氯化铜0.2~1硫酸锰0.2~1氯化钙5~15——
18.在一个优选的实施方案中,所述基础培养基组分见下表。
19.表3
[0020][0021][0022]
更进一步地,基础培养基中包括如下所示的组分:
[0023]
表4
[0024]
组分浓度(g/l)组分浓度(mg/l)酵母提取物8~15硫酸亚铁5~10酵母蛋白胨15~20硫酸钴5~10甘油10~30氯化铜0.1~0.5柠檬酸2氯化钙2.5~7.5磷酸氢二胺4氯化锌0.5~1.0磷酸二氢钾12硼酸0.1~0.4硫酸镁1.2硫酸锰0.1~0.5氯化钠1——
[0025]
用酸性或者碱性溶液调节基础培养基ph值。
[0026]
在一些实施方案中,所述酸性溶液为磷酸、盐酸、硫酸的一种或多种。
[0027]
在一些实施方案中,所述碱性溶液为氢氧化钠、氨水、氢氧化钾的一种或多种
[0028]
在一些实施方案中,所述基础培养基ph值范围为6~7,优选地,ph值范围为6.5~6.9,更优选地,ph值为6.7。
[0029]
本发明的第二个目的在于提供一种用于生产甘精胰岛素的补料培养基,所述补料培养基包含酵母蛋白胨、酵母提取物、甘油、硫酸镁。
[0030]
优选地,每升补料培养基包括如下所示组份:酵母蛋白胨60~120g/l,酵母提取物60~110g/l,甘油400~600g/l,硫酸镁1~3g/l。
[0031]
本发明的第三个目的在于提供一种用于生产甘精胰岛素的发酵方法,技术方案如下:
[0032]
a、将工程菌菌种在种子培养基中逐级放大培养,获得种子液;
[0033]
步骤a种子液培养具体步骤如下:
[0034]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0035]
本发明不限定种子液培养步骤,任何现有的用于种子液培养的固体培养基、液体种子培养基及其培养方法均可用于本发明。
[0036]
b、种子液接种至发酵罐基础培养基中进行高密度培养,分段控制发酵诱导前后的ph值,至培养结束。具体步骤如下:
[0037]
按照5~10%的接种量接种二级摇瓶种子液至发酵罐基础培养基中,控制发酵罐内溶氧量不低于30%、温度36~38℃,使用氨水自动控制ph值。当溶氧上升达90%且ph同时上升时,开始第一次流加补料培养基,控制流速每5~8h流加总补料量的30~35%,暂停补料后,ph和溶氧值会短暂上升。当培养至od600=50~60时,加入终浓度为0.1~0.3mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每15~18h流加总补料量的65~70%,第二次补料过程中使用氨水自动控制ph值。补料流加完毕发酵结束,总补料量为两次流加补料培养基的总量,为基础培养基体积的23~27%。
[0038]
在一个优选的实施方案中,所述工程菌菌种为pet-glargine/bl21(de3)plyss,构建方法参照专利cn1663960b。本发明方法也适用于产甘精胰岛素的pet-glargine/bl21(de3),pet-glargine/bl21star等菌株。
[0039]
优选地,发酵过程中ph值范围为6.5-7.5。
[0040]
更优选地,发酵过程中诱导前ph值为6.5~6.9,诱导后ph值为7.1~7.5。
[0041]
在一个优选的实施方案中,一种生产甘精胰岛素的发酵方法,包括如下步骤:
[0042]
a.将工程菌菌种在种子培养基中逐级放大培养:接种工程菌菌种至固体种子培养基(固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l)的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基(液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l)中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0043]
b.发酵罐高密度培养:
[0044]
基础培养基组成为:
[0045]
表5
[0046][0047][0048]
用磷酸调节基础培养基ph值为6.5~6.9。
[0049]
补料培养基组成为:酵母蛋白胨60~120g/l,酵母提取物60~110g/l,甘油400~600g/l,硫酸镁1~3g/l。
[0050]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.5~6.9,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。当溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每5~6h流加总补料量的30~35%4.5~5.25l,暂停补料后,ph和溶氧值会短暂上升。当培养至od600=50~60时,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每15~18h流加总补料量的65~70%9.75~10.5l,第二次补料过程中使用氨水自动控制ph7.1~7.5。补料流加完毕发酵结束,发酵培养25~38h。
[0051]
本发明的有益效果:
[0052]
本发明菌的生长速度更快更好,密度更高,表达和质粒丢失率在正常水平。通过优化基础培养基组成、分段控制发酵诱导前后的ph值,以减少异体蛋白的干扰,从而提高包涵体中目的蛋白的产量,使得重组大肠杆菌发酵生产的甘精胰岛素发酵密度可达od600=152,包涵体产量1000g/罐以上,与低密度发酵相比菌密度和产量均提高了5倍以上。使用酵母蛋白胨替换动物源的胰蛋白胨,整个发酵培养基全部为非动物源的物料,杜绝了tse/bse风险,发酵培养基更安全可靠,更符合法规要求,有利于规模化生产。培养基碳源使用甘油替代葡萄糖并通过调控补料速度明显降低乙酸的产生,氨水用量减少,更有利于发酵的高密度高表达。发酵结束,质粒丢失率在4%以内,电泳表达量在45%以上。本发明的甘精胰岛素高密度发酵提高了生产效率,具有很好的应用前景。
具体实施方式
[0053]
虽然本发明己以较佳实施例公开如下,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的推演与替换。本发明的保护范围应
以权利要求记载的技术方案,包括权利要求记载的技术方案中技术特征的等同替换方案为保护范围。即在此范围内的等同替换改进,同比例放大或缩小试验也在本发明的保护范围之内。
[0054]
以下实施方式所用的菌种参照专利cn1663960b构建。发酵过程中所需试剂无特殊说明均可来自商业途径(市售可得)。
[0055]
实施例1
[0056]
a、将工程菌菌种在种子培养基中逐级放大培养
[0057]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0058]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0059]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0060]
b、发酵罐高密度培养
[0061]
基础培养基组成为:
[0062]
表6
[0063]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5甘油20氯化铜0.3柠檬酸2氯化钙5磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0064]
用磷酸调节基础培养基ph值至6.7。
[0065]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0066]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.3。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0067]
实施例2
[0068]
a、将工程菌菌种在种子培养基中逐级放大培养
[0069]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0070]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0071]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0072]
b、发酵罐高密度培养
[0073]
基础培养基组成为:
[0074]
表7
[0075]
组分浓度(g/l)组分浓度(mg/l)酵母提取物8硫酸亚铁4酵母蛋白胨15硫酸钴4甘油10氯化铜0.08柠檬酸1氯化钙2磷酸氢二胺2氯化锌0.2磷酸二氢钾5硼酸0.08硫酸镁0.2硫酸锰0.08氯化钠0.2——
[0076]
用硫酸调节基础培养基ph值至6.8。
[0077]
补料培养基组成为:酵母蛋白胨60g/l,酵母提取物60g/l,甘油400g/l,硫酸镁01g/l。
[0078]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.8,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每7h流加总补料量的35%5.67l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的65%10.53l,第二次补料过程中使用氨水自动控制ph值在7.2。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0079]
实施例3
[0080]
a、将工程菌菌种在种子培养基中逐级放大培养
[0081]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0082]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0083]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃
培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0084]
b、发酵罐高密度培养
[0085]
基础培养基组成为:
[0086]
表8
[0087][0088][0089]
用磷酸调节基础培养基ph值至6.6。
[0090]
补料培养基组成为:酵母蛋白胨120g/l,酵母提取物110g/l,甘油600g/l,硫酸镁3g/l。
[0091]
按照7%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.6,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.14l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每17h流加总补料量的70%9.66l,第二次补料过程中使用氨水自动控制ph值在7.4。补料流加完毕发酵结束,发酵培养32h。取发酵液检测菌体密度、包涵体产量等。
[0092]
实施例4
[0093]
a、将工程菌菌种在种子培养基中逐级放大培养
[0094]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0095]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0096]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0097]
b、发酵罐高密度培养
[0098]
基础培养基组成为:
[0099]
表9
[0100][0101][0102]
用盐酸调节基础培养基ph值至6.7。
[0103]
补料培养基组成为:酵母蛋白胨50g/l,酵母提取物40g/l,甘油350g/l,硫酸镁0.5g/l。
[0104]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每18h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.3。补料流加完毕发酵结束,发酵培养31h。取发酵液检测菌体密度、包涵体产量等。
[0105]
实施例5
[0106]
a、将工程菌菌种在种子培养基中逐级放大培养
[0107]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0108]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0109]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0110]
b、发酵罐高密度培养
[0111]
基础培养基组成为:
[0112]
表10
[0113]
组分浓度(g/l)组分浓度(mg/l)酵母提取物20硫酸亚铁16酵母蛋白胨25硫酸钴16甘油35氯化铜1柠檬酸10氯化钙10磷酸氢二胺15氯化锌2磷酸二氢钾25硼酸1硫酸镁4硫酸锰1氯化钠4——
[0114]
用磷酸调节基础培养基ph值至6.7。
[0115]
补料培养基组成为:酵母蛋白胨130g/l,酵母提取物120g/l,甘油650g/l,硫酸镁4g/l。
[0116]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每7h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.3。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0117]
实施例6
[0118]
a、将工程菌菌种在种子培养基中逐级放大培养
[0119]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0120]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0121]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0122]
b、发酵罐高密度培养
[0123]
基础培养基组成为:
[0124]
表11
[0125]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5甘油20氯化铜0.3柠檬酸2氯化钙5
磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0126]
用磷酸调节基础培养基ph值至6.5。
[0127]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0128]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.5,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.1。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0129]
实施例7
[0130]
a、将工程菌菌种在种子培养基中逐级放大培养
[0131]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0132]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0133]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0134]
b、发酵罐高密度培养
[0135]
基础培养基组成为:
[0136]
表12
[0137]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5甘油20氯化铜0.3柠檬酸2氯化钙5磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0138]
用盐酸调节基础培养基ph值至6.9。
[0139]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁
2.5g/l。
[0140]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.9,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.5。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0141]
实施例8
[0142]
a、将工程菌菌种在种子培养基中逐级放大培养
[0143]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0144]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0145]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0146]
b、发酵罐高密度培养
[0147]
基础培养基组成为:
[0148]
表13
[0149]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5甘油20氯化铜0.3柠檬酸2氯化钙5磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0150]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0151]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。
随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.3。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0152]
实施例9
[0153]
a、将工程菌菌种在种子培养基中逐级放大培养
[0154]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0155]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0156]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0157]
b、发酵罐高密度培养
[0158]
基础培养基组成为:
[0159]
表14
[0160]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5甘油20氯化铜0.3柠檬酸2氯化钙5磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0161]
用磷酸调节基础培养基ph值至6.7。
[0162]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0163]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0164]
实施例10
[0165]
a、将工程菌菌种在种子培养基中逐级放大培养
[0166]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0167]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0168]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0169]
b、发酵罐高密度培养
[0170]
基础培养基组成为:
[0171]
表15
[0172]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5甘油20氯化铜0.3柠檬酸2氯化钙5磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0173]
用氢氧化钠调节基础培养基ph值至7.4。
[0174]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0175]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在7.4,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0176]
实施例11
[0177]
a、将工程菌菌种在种子培养基中逐级放大培养
[0178]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0179]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0180]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0181]
b、发酵罐高密度培养
[0182]
基础培养基组成为:
[0183]
表16
[0184]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5甘油20氯化铜0.3柠檬酸2氯化钙5磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0185]
用磷酸调节基础培养基ph值至6.4。
[0186]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0187]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.4,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.6。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0188]
对比实施例1
[0189]
a、将工程菌菌种在种子培养基中逐级放大培养
[0190]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0191]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0192]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0193]
b、发酵罐高密度培养
[0194]
基础培养基组成为:
[0195]
表17
[0196]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5甘油20氯化铜0.3柠檬酸2氯化钙5
磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0197]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0198]
按照10%接种量将种子接种在100l发酵罐中,根据基因工程菌的生长规律,按照常规方法培养,最初调节转速250rpm,温度保持在37℃,空气流量调节在10l/h,ph值控制在7.0左右,溶解氧一直保持在40%以上。发酵最终od600定为69,发酵周期定为19小时。培养2h后取样检测菌体密度,继续增大转速至350rpm,始终保持溶解氧在40%以上,维持一定的生长速率。待转速调至600rpm,培养至6个小时后,检测菌体密度,当溶解氧开始瞬时升高,瞬间ph值升至7.8以上,加入终浓度0.2mm的诱导剂iptg进行诱导,随后开始补入补料培养基,补料流加速率为300ml/h,控制氧气流量、空气通量,使溶解氧继续维持在40%以上,在发酵至19小时后停止补料,待溶解氧反弹后发酵结束。
[0199]
对比实施例2
[0200]
a、将工程菌菌种在种子培养基中逐级放大培养
[0201]
固体种子培养基组成为:酵母提取物5g/l,10g/l,氯化钠10g/l,琼脂20g/l;
[0202]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0203]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0204]
b、发酵罐高密度培养
[0205]
基础培养基组成为:
[0206]
表18
[0207]
组分浓度(g/l)组分浓度(mg/l)酵母提取物10硫酸亚铁7.5酵母蛋白胨18硫酸钴7.5葡萄糖20氯化铜0.3柠檬酸2氯化钙5磷酸氢二胺4氯化锌0.75磷酸二氢钾12硼酸0.2硫酸镁1.2硫酸锰0.25氯化钠1——
[0208]
用磷酸调节基础培养基ph值至6.7。
[0209]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,葡萄糖500g/l,硫酸镁2.5g/l。
[0210]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过
程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每15h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.3。补料流加完毕发酵结束,发酵培养24h。取发酵液检测菌体密度、包涵体产量等。
[0211]
对比实施例3
[0212]
a、将工程菌菌种在种子培养基中逐级放大培养
[0213]
固体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l,琼脂20g/l;
[0214]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0215]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0216]
b、发酵罐高密度培养
[0217]
基础培养基组成为:
[0218]
表19
[0219]
组分浓度(g/l)组分浓度(g/l)酵母提取物10磷酸氢二胺4酵母蛋白胨18磷酸二氢钾12葡萄糖20硫酸镁1.2柠檬酸2氯化钠1
[0220]
用磷酸调节基础培养基ph值至6.7。
[0221]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0222]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升。当培养至od600=50~60时,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.3。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0223]
对比实施例4
[0224]
a、将工程菌菌种在种子培养基中逐级放大培养
[0225]
固体种子培养基组成为:酵母提取物5g/l,胰蛋白胨10g/l,氯化钠10g/l,琼脂
20g/l;
[0226]
液体种子培养基组成为:酵母提取物5g/l,酵母蛋白胨10g/l,氯化钠10g/l;
[0227]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0228]
b、发酵罐高密度培养
[0229]
基础培养基组成为:酵母蛋白胨10g/l,酵母提取物5g/l,葡萄糖10g/l,氯化钠10g/l。
[0230]
补料培养基组成为:酵母蛋白胨100g/l,酵母提取物80g/l,甘油500g/l。
[0231]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升至90%且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每17h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.3。补料流加完毕发酵结束,发酵培养28h。取发酵液检测菌体密度、包涵体产量等。
[0232]
对比实施例5
[0233]
a、将工程菌菌种在种子培养基中逐级放大培养
[0234]
固体种子培养基组成为:酵母提取物9g/l,胰蛋白胨5g/l,氯化钠6g/l,琼脂15g/l;
[0235]
液体种子培养基组成为:酵母提取物9g/l,胰蛋白胨5g/l,氯化钠6g/l;
[0236]
接种工程菌菌种至固体种子培养基的斜面上,37.0℃培养12~15h,取出放冰箱2~8℃保存;挑取培养好的种子斜面菌落接种于液体种子培养基中,于恒温振荡器中37.0℃培养5~8h,得一级摇瓶种子液;将培养好的一级摇瓶种子液接种于液体种子培养基中,于恒温振荡器中37.0℃培养12~15h,得二级摇瓶种子液。
[0237]
b、发酵罐高密度培养
[0238]
基础培养基组成为:
[0239]
表20
[0240]
组分浓度(g/l)组分浓度(mg/l)葡萄糖12钼酸铵0.8甘油2硫酸铜0.5酵母提取物13硼酸2柠檬酸5碘化钾0.4硫酸铁0.05氯化锰3磷酸氢二铵5乙酸锌3磷酸二氢钾3——
硫酸镁2——维生素b100.1——
[0241]
补料培养基组成为:胰蛋白胨100g/l,酵母提取物80g/l,甘油500g/l,硫酸镁2.5g/l。
[0242]
按照5%的接种量接种二级摇瓶种子液至100l发酵罐中,基础培养基体积为60l,发酵罐初始通气量4
±
0.5m3/h,温度37.0℃,设定转速200rpm,罐压0.04~0.06mpa,发酵过程中,使用氨水自动控制ph值在6.7,温度控制在37.0
±
1.0℃,通过调节转速200~600rpm、空气流量0.6~5.5m3/h、氧气流量0~1m3/h、罐压0.04~0.09mpa控制溶氧不低于30%。溶氧上升且ph同时上升时,开始第一次流加补料培养基,控制流速每6h流加总补料量的30%4.5l,暂停补料后,ph和溶氧值会短暂上升。当培养至od600=50~60时,加入终浓度0.2mm的诱导剂iptg进行诱导。随后开始第二次流加补料培养基,控制流速每16h流加总补料量的70%10.5l,第二次补料过程中使用氨水自动控制ph值在7.3。补料流加完毕发酵结束,发酵培养30h。取发酵液检测菌体密度、包涵体产量等。
[0243]
对比实施例6
[0244]
将重组大肠杆菌菌株在固体斜面培养基(ph6.7,蛋白胨5g,酵母粉9g,氯化钠6g,琼脂15g,加自来水溶解混合至1l)上培养,35℃培养24小时,得到斜面菌种。
[0245]
用接种针将斜面上约1cm2的菌种刮下,转接到装有20ml液体种子培养基(ph值6.8,葡萄糖5g,磷酸二氢钾3g,磷酸氢二钾5g,氯化钠6g,酵母粉12g,加自来水溶解混合至1l)的500ml三角瓶(0.07mpa 10min)中,于37℃往复式摇床(振幅65cm,摇床转速180r/m)振动培养18小时,得到液体种子。
[0246]
将3.0l液体种子接种入装有60l发酵培养基(将柠檬酸3g,硫酸铁0.01g,磷酸氢二铵2g,磷酸二氢钾2g,硫酸镁1g,葡萄糖8g,甘油1g,酵母提取物10g,维生素b10.05g,痕量元素钼酸铵0.5mg,硫酸铜0.1mg,硼酸1mg,碘化钾0.2mg,氯化锰1mg和乙酸锌1mg,加自来水溶解混合至1l,用5%naoh调节上述溶液的ph为6.8)的100l发酵罐中(接种前120℃灭菌8分钟)通风量(即每分钟内每单位体积发酵液通入空气的体积比)为1:0.1,37℃发酵培养,当发酵进行至13小时,停止发酵。取发酵液检测菌体密度、包涵体产量等。
[0247]
实施例与对比例的测试结果见表21。
[0248]
表21不同培养条件测试结果
[0249][0250]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1