一种18F-三氟化硼酪氨酸试剂盒及其应用的制作方法
本发明涉及放射性药物及核医学领域
技术领域:
,具体涉及一种18f-三氟化硼酪氨酸试剂盒及其应用。
背景技术:
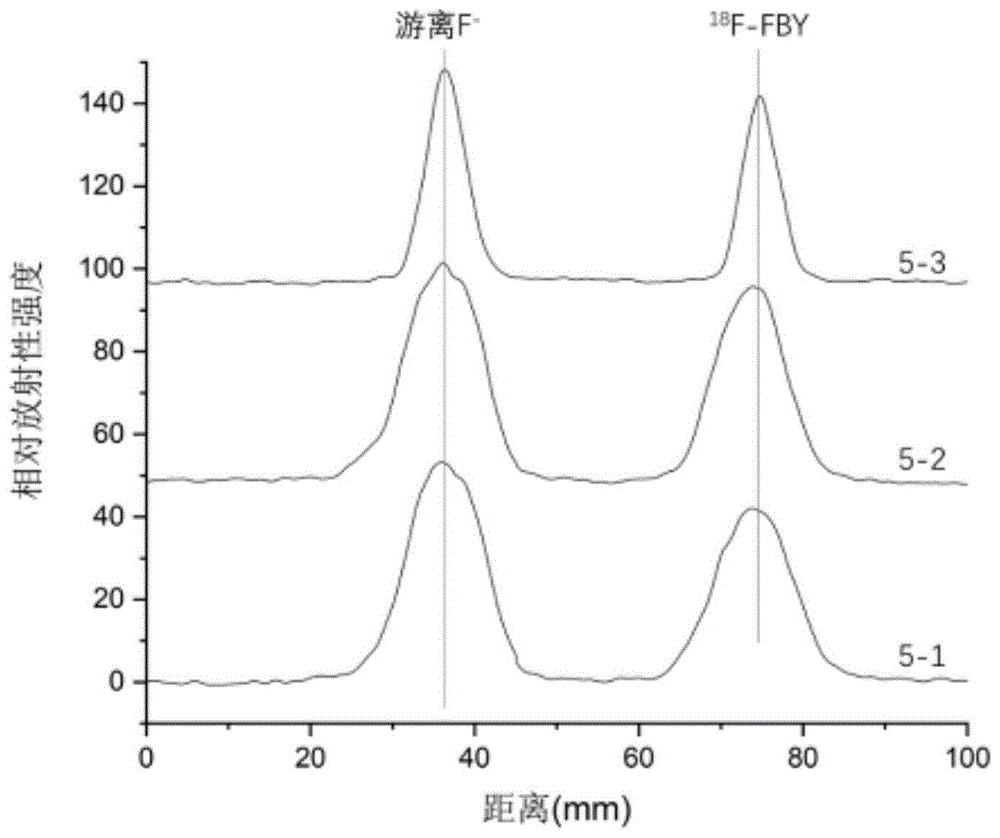
:肿瘤目前仍然是一种严重威胁人类健康的常见病和多发病,是引起死亡的主要原因之一。在肿瘤及相关疾病的诊断方法中,分子影像技术结合了分子探针和医学影像技术,能对活体内病理、生理过程在细胞及分子水平进行定性和定量研究。正电子发射断层扫描成像(positronemissiontomography,pet)是一种依托于放射性分子探针的分子影像技术。pet技术的基础是正电子湮灭所发出的成对光子的检测。从11c,18f等正电子衰变的同位素中发射出来的带正电子,很快与周围广泛分布的带负电子碰撞发生湮灭,并将能量转化为两个方向相反的能量为511kev的光子。两个光子被仪器相对的两个探头同时检测到,表明两个探头连线上发生了一次湮灭。这样,pet就能够对体内放射性的分布进行准确的定位和定量。再经过计算机重建,即可获得三维的人体pet图像。目前pet成像中应用最广泛的分子探针为18f-fdg,在恶性肿瘤诊断、分期、疗效评价和预后评估方面有显著的临床价值,与ct和mri相比诊断准确性更高。然而,由于fdg与葡萄糖代谢密切相关,fdg会在正常脑组织、炎症组织等肿瘤以外的组织富集,在部分肿瘤或特定肿瘤状态下,以18f-fdg为探针的pet/ct仍存在相对较低的诊断灵敏性和特异性,在炎癌鉴别、脑瘤诊断中受到极大的限制。硼氨酸是一类将天然氨基酸的羧基用三氟化硼取代进而发展的一类氨基酸衍生物。通过18f-19f同位素交换反应,可以使用18f进行放射性标记构建放射性探针,进而实现pet成像。专利文献cn109053781a公开了发明人此前的研究,三氟化硼酪氨酸在肿瘤区域具有高富集的现象,而对于正常脑组织、炎症组织没有富集,从而可以实现脑瘤诊断、炎癌鉴别,尤其是对术后评价具有重要积极意义。同时,由于三氟化硼酪氨酸中含有硼原子,可以实现硼中子捕获治疗(bnct,boronneutroncapturetherapy),借助18f-三氟化硼酪氨酸在pet中的定位功能,进而实现肿瘤的诊疗一体化。然而,现有的三氟化硼酪氨酸标记工艺具有标记体积小(不超过100ul)、产量低(<3.7e9bq),不适用于临床大规模、模块化标记条件的缺点;并且其标记过程十分依赖于操作者的经验,同时手工标记对操作者带来的辐射剂量造成健康危害。技术实现要素:本发明的目的在于提供18f-三氟化硼酪氨酸试剂盒及其应用,克服了现有技术中18f-三氟化硼酪氨酸(18f-fby)标记中存在的问题,构建完善了新的18f-fby标记制备工艺流程,适合于医院自动化模块操作与临床使用,可以在满足自动化模块标记下的大体积、大剂量标记反应,并组合为试剂盒,可直接安装于放射性药物多功能合成模块上使用,十分便于普通操作者使用。为此,本发明的第一方面提供了一种制备18f-fby的方法,包括:s1、用qma柱捕获加速器产生的18f-;s2、将fby溶解于盐酸溶液中,转移至反应管中;s3、用生理盐水淋洗步骤s1得到的qma柱,将18f-淋洗至反应管中;s4、将步骤s3得到的反应管密封加热,然后加入生理盐水;s5、将步骤s4得到的混合物依次通过sep-pakalumina柱和无菌滤膜,然后与乙酸钠-氯化钠溶液混合,使ph为中性,即制得目标产物。其中,所述fby的结构式如式i所示,可根据专利文献cn109053781a所记载的方法制备得到。进一步,步骤s1中,所述qma柱经过以下预处理:用饱和食盐水和去离子水对qma柱进行活化。进一步,步骤s1中,所述18f-的剂量为500-1520mci,例如500mci、700mci、1100mci、1500mci、1520mci。进一步,步骤s2中,所述盐酸溶液浓度为0.08-0.2m,优选为0.08m。进一步,步骤s4中,所述加热反应的温度为80-90℃,优选为85℃;反应时间为8-12min,优选为10min。进一步,步骤s5中,所述sep-pakalumina柱经过以下预处理:用去离子水对sep-pakalumina柱进行活化。进一步,步骤s5中,所述ph为6.8-7.5,优选为7.0。进一步,步骤s5中,所述无菌滤膜为0.22μm无菌滤膜。本发明的第二方面,提供一种18f-fby试剂盒,包括:前体瓶a、盐酸溶液瓶b、钠盐溶液瓶c、去离子水瓶d、钠盐溶液瓶e、生理盐水瓶f、生理盐水瓶g、产品瓶h、qma柱、sep-pakalumina柱和无菌滤膜;所述前体瓶a含0.5-2mgfby;优选为1mgfby;所述盐酸溶液瓶b含1ml0.08-0.2m盐酸溶液;盐酸溶液浓度优选为0.08m;所述钠盐溶液瓶c含5ml饱和氯化钠溶液或饱和碳酸氢钠溶液;其用于qma柱活化;所述去离子水瓶d含10ml去离子水;其用于qma柱活化及sep-pakalumina柱活化;所述钠盐溶液瓶e含1ml生理盐水或浓度为0.6-0.9%的碳酸氢钠溶液;其用于qma柱淋洗;所述生理盐水瓶f含1ml生理盐水;其用于反应淬灭;所述生理盐水瓶g含1ml生理盐水;其用于sep-pakalumina柱及滤膜冲洗;所述产品瓶h含1ml0.05-0.5m磷酸氢二钠溶液;磷酸氢二钠溶液浓度优选为0.2m;其用于调节产品ph和维持渗透压。本发明提供的试剂盒中,用盐酸溶液代替dmf、哒嗪等常用有机试剂的使用,可应用于临床。进一步,所述无菌滤膜为0.22μm无菌滤膜。进一步,所述前体瓶a、盐酸溶液瓶b、钠盐溶液瓶c、钠盐溶液瓶e、生理盐水瓶f、生理盐水瓶g、产品瓶h均为氮气氛围密封安瓿瓶。各安瓿瓶可选择适配于现有的fdg自动化模块或氟多功能模块的容积,例如10ml。在优选的实施方式中,本发明试剂盒中上述各瓶为氮气氛围10ml安瓿瓶,便于适配现有的18f标记模块,实现全自动产业化生产。本发明的第三方面提供了应用所述试剂盒制备18f-fby的方法,包括以下步骤:(1)将瓶b中的液体全部转移至瓶a中,充分溶解,后转移至反应管中;(2)使用瓶c中的液体活化qma柱,再使用d瓶中5ml去离子水冲洗qma柱;(3)使用d瓶中5ml去离子水冲洗活化sep-pakalumina柱;(4)将qma柱接入管路,捕获加速器产生的18f-;(5)使用e瓶溶液淋洗qma柱,淋洗液至反应管中;(6)反应管密封加热;(7)向反应管中加入f瓶溶液,混合液转移依次通过sep-pakalumina柱、无菌滤膜,进入产品瓶h中;(8)使用g瓶溶液冲洗反应管及后续管路、柱及滤膜,冲洗液亦注入产品瓶h;(9)产品瓶h内无色透明溶液即为最终产物18f-fby注射液。进一步,步骤(5)中,所述加热的反应温度为80-90℃,优选为85℃;反应时间为8-12min,优选为10min。本发明的第四方面提供了所述试剂盒在制备以下产品中的用途:(1)pet-ct肿瘤显像剂;(2)用于硼中子俘获治疗的硼携带剂;(3)肿瘤诊疗一体化药物。现有的18f-fby的标记步骤为:(1)使用生理盐水将18f-离子由qma柱上逐滴淋洗下来,选取活度浓度合适的溶液;(2)fby前体溶解于5μldmf中;(3)向前体溶液中加入5μl哒嗪-盐酸缓冲溶液(ph~2);(4)将18f-溶液加入混合溶液中,并视情况用1m盐酸调节ph~2;(5)85℃反应15min;(6)加入0.3ml生理盐水猝灭反应;(7)转移溶液,使用sep-pakaluminalightcartridge纯化,得到18f-fby(rcy~45%,<3.7e9bq)。与现有技术相比,本发明具有以下优点:(1)本发明提供的18f-fby标记方法中未使用任何有机试剂,可直接应用于临床。传统的18f标记显像剂的工艺中,最常用的合成方法是在氨基聚醚催化下发生亲核氟化反应,而氨基聚醚有毒,利用其合成的显像剂必须经过质控合格后才能用于临床。此外,现有技术还报道了避免使用氨基聚醚的标记工艺,然而,仍无法避免乙醇的使用,其毒性虽然较氨基聚醚更小,但仍然不利于临床使用。本发明提供的标记方法未使用包括乙醇在内的任何有机试剂,可直接应用于临床,具有极佳的应用前景。(2)应用本发明提供的试剂盒进行18f-fby标记,操作步骤简单,仅需约不到20分钟即可完成,合理反应规模下未校正放射化学产率约40%,放化纯度>95%。(3)本发明提供的试剂盒适用于已有的放射性模块自动化标记系统,克服了现有技术中18f-fby具有标记体积小(不超过100ul)、产量低(<3.7e9bq)的缺点,可实现快速、高效、高剂量产业化生产18f-fby,为18f-fby的gmp生产和临床转化应用奠定了基础。(4)通过应用本发明的试剂盒和相应的制备方法,减少了操作人员直接接触的放射性活度,避免了操作人员因不必要的过度暴露而造成辐射损伤。附图说明通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。在附图中:图1为本发明试剂盒制备得到的18f-fby的薄层放射性扫描结果;图2为本发明试剂盒制备得到的18f-fby放置不同时间后薄层放射性扫描结果;图3为18f-fby注射于荷瘤小鼠后的pet成像结果图;图4为不同剂量的18f-fby注射于荷瘤小鼠后的pet成像结果图;图5为18f-fby注射剂量与肿瘤部位摄取量的关系图;图6为各器官18f-fby摄取量与硼含量的关系图;图7为18f-fby注射剂量与肿瘤细胞内硼含量的关系图;图8为脑胶质瘤患者接受18f-fdg和18f-fby注射后,患处的pet成像结果图;图9为脑胶质瘤患者接受18f-fby注射后,患处的pet成像结果图。具体实施方式下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。实施例1根据表1所示的前体含量,依以下实验步骤进行实验:a)将特定质量的前体(即fby)溶解于1ml生理盐水中;b)使用1ml生理盐水淋洗滞留有1000mcif-18氟离子的qma柱,将18f-淋洗进入反应管中;c)使用浓盐水调节ph至2;d)反应管密闭85℃加热20分钟;e)使用纸层析法分析放射性产率(itlc-sg纸,95%乙腈/水展开)表1序号前体放射性产率1-10.1mgfby5.3%1-20.2mgfby7.6%1-30.5mgfby29.3%1-41.0mgfby46.8%1-51.5mgfby48.8%1-62.0mgfby49.2%实施例2根据表2所示的盐酸含量,依以下实验步骤进行实验:a)将1mgfby前体溶解于1ml特定浓度的盐酸中;b)使用1ml生理盐水淋洗滞留有500mcif-18氟离子的qma柱,将18f-淋洗进入反应管中;c)反应管密闭85℃加热20分钟;d)使用纸层析法分析放射性产率(itlc-sg纸,95%乙腈/水展开)表2序号盐酸浓度放射性产率2-10.02m0%2-20.04m0%2-30.06m5.1%2-40.08m45.1%2-50.10m46.0%2-60.15m45.8%2-70.20m43.6%实施例3根据表3所示的反应时间,依以下实验步骤进行实验:a)将1mgfby前体溶解于1ml0.08m盐酸中;b)使用1ml生理盐水淋洗滞留有500mcif-18氟离子的qma柱,将18f-淋洗进入反应管中;c)反应管密闭85℃加热特定时间;d)反应结束后加入1ml生理盐水淬灭反应;e)使用纸层析法分析放射性产率(itlc-sg纸,95%乙腈/水展开)表3序号反应时间放射性产率3-12min10.3%3-24min21.1%3-36min28.7%3-48min36.9%3-510min44.6%3-615min45.4%3-720min45.1%实施例4根据表4所示的f-18氟离子标记剂量,依以下实验步骤进行实验:a)将1mgfby前体溶解于1ml0.08m盐酸中;b)使用1ml生理盐水分别淋洗滞留有下表剂量的f-18氟离子的qma柱,将18f-淋洗进入反应管中;c)反应管密闭85℃加热10分钟;d)反应结束后加入1ml生理盐水淬灭反应;e)使用纸层析法分析放射性产率(itlc-sg纸,95%乙腈/水展开)表4序号f-18氟离子放射性产率4-1500mci47.0%4-2786mci46.8%4-31100mci44.3%4-41520mci43.5%4-52020mci35.4%4-62458min30.0%由表4可知,采用最大标记剂量为1520mci,即1.5ci,可以满足临床生产需求。实施例5本实施例提供了一种试剂盒及利用该试剂盒制备18f-fby的方法,包括以下步骤:试剂盒包括:前体瓶a(1mgfby)、盐酸溶液瓶b(1ml0.08m盐酸溶液)、钠盐溶液瓶c(5ml饱和氯化钠溶液)、去离子水瓶d(10ml去离子水)、钠盐溶液瓶e(1ml生理盐水)、生理盐水瓶f(1ml生理盐水)、生理盐水瓶g(1ml生理盐水)、产品瓶h(1ml0.2m磷酸氢二钠溶液)、qma柱、sep-pakalumina柱和0.22μm无菌滤膜。(1)将瓶b中的液体全部转移至瓶a中,充分溶解,后转移至反应管中;(2)使用瓶c中的液体活化qma柱,再使用d瓶中5ml去离子水冲洗qma柱;(3)使用d瓶中5ml去离子水冲洗活化sep-pakalumina柱;(4)将qma柱接入管路,捕获加速器产生的18f-;(5)使用e瓶溶液淋洗qma柱,淋洗液至反应管中;(6)反应管85℃加热10分钟;(7)向反应管中加入f瓶溶液,混合液转移依次通过sep-pakalumina柱、0.22μm无菌滤膜,进入产品瓶h中;(8)使用g瓶溶液冲洗反应管及后续管路、柱及滤膜,冲洗液亦注入产品瓶h;(9)产品瓶h内无色透明溶液即为最终产物18f-fby注射液。将制备得到的18f-fby用于后续实施例中。进行3次标记,关键反应条件及结果表5所示,薄层放射性扫描(tlc)分析如图1所示。表5实施例6.产物纯度与稳定性将上述实施例5制得的18f-fby溶液在室温下放置不同时间(0、1、2、4和6小时),然后进行tlc分析,计算放射化学纯度。实验结果见图2所示,根据图2可知:18f-fby在室温下可稳定存在6小时以上,其外观和放射化学纯度均无明显变化。实施例718f-fby在荷瘤小鼠的pet图像取约3.7mbq的18f-fby在异氟烷麻醉下由尾静脉注射至荷瘤小鼠体内,在注射结束后60min时进行10min的静态采集得到pet图像数据。图3表明18f-fby主要由肾脏膀胱进行代谢,除胆囊,肾脏,膀胱等主要代谢器官外,其余正常组织均无明显摄取,且肿瘤部位摄取明显。实施例818f-fby以不同剂量应用于荷瘤小鼠时的pet图像在异氟烷麻醉下,取约3.7mbq的18f-fby与不同剂量的fby(0.2mg,1mg,5mg,25mg)混合后由尾静脉注射至荷瘤小鼠体内,在注射结束后90min时进行10min的静态采集得到pet图像数据,如图4所示。fby作为硼携带剂应用于硼中子俘获疗法时,需要剂量在100mg/kg-1000mg/kg范围内,按照该剂量对小鼠进行给药,结果表明当以此剂量进行放射性标记并pet成像时,依然可以特异性地在肿瘤部位富集从而对肿瘤区域进行示踪,并且放射性信号没有明显地减弱。实施例918f-fby在荷瘤小鼠不同器官的分布取约3.7mbq的18f-fby与25mg的fby混合后在异氟烷麻醉下由尾静脉注射至荷瘤小鼠体内,在注射结束后90min时进行10min的静态采集得到pet图像数据(图5)。图5的结果表明fby可以在肿瘤部位大量富集,完全满足bnct所需的硼含量,可以作为潜在的硼携带剂应用于bnct。静态采集pet图像数据扫描结束后立即处死小鼠,并取不同器官(脑,肌肉,肿瘤等)微波消解后用icp-oes测量硼浓度(图6)。图6的结果表明在不同fby剂量下,通过icp-oes测定的各个器官硼含量与放射性信号有良好的对应关系,表明探针剂量的fby与药物剂量的fby在生物体内几乎相同,探针剂量的fby可以完全模拟药物剂量的fby在患者体内的分布,从而动态地对硼浓度进行定量检测。实施例1018f-fby注射剂量与肿瘤细胞内硼原子数目关系在异氟烷麻醉下,不同剂量的18f-fby(0.2mg,1mg,5mg,25mg)溶解在水中由尾静脉注射至荷瘤小鼠体内,在注射结束后90min处死小鼠,取肿瘤微波消解后用icp-oes测量硼浓度。并假设细胞直径为10μm估算硼原子数目,结果如图8所示,当注射25mg的18f-fby时,肿瘤细胞内硼原子数目完全满足bnct的治疗需求。结果如图7所示。实施例1118f-fby在脑胶质瘤患者中的pet-ct影像结果取约370mbq的18f-fby用生理盐水稀释至2ml静脉注射至患者体内,在注射结束后90min时进行15min的静态采集得到pet图像数据。结果如图8与9所示。图8表明18f-fby在患处有明显的高摄取,十字处为肿瘤区域;而18f-fdg无法区分肿瘤部位和正常脑组织。图9表明18f-fby在患处有明显的高对比度的摄取。以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1