基于量子点和三维杂交结构的荧光传感器及其制备与应用
本发明属于生物检测和分子生物学技术领域,具体提供基于量子点和三维杂交结构的荧光传感器及其制备与应用。
背景技术:
这里的陈述仅提供与本公开有关的背景信息,而不必然构成现有技术。
n6-甲基腺苷(m6a)是mrna中最普遍存在的内部修饰,在mrna的剪接,转录,翻译,代谢和核输出的转录后调控中发挥关键作用。fto依赖的m6a去甲基化作为一种新的rna处理调控机制,在调控脂肪生成、细胞信号转导和疾病相关的生物学疾病中发挥重要作用。fto被确定参与多种疾病过程,例如类型ii糖尿病,肥胖症,阿尔茨海默氏病,心血管疾病和癌症。因此,fto可能成为癌症治疗和药物开发的潜在分子靶点。鉴于fto在疾病过程中的重要作用,对fto活性的敏感检测和针对fto的抑制剂的开发在生物学研究、临床诊断和药物开发中具有重要意义。小分子fto活性调节剂不仅在了解fto的结构和功能方面发挥着重要作用,而且为治疗癌症、肥胖等疾病提供了独特的机会。近年来,研究人员采用了一些策略来识别一些fto抑制剂,这些小分子在体内外对m6a的fto去甲基化均表现出良好的抑制活性。利用生化和生物物理方法(即基于结构的虚拟筛选、高效液相色谱(hplc)、page分析)鉴定天然产物大黄酸是fto的第一个抑制剂。采用高通量荧光偏振法(fp)也证明甲氯灭酸(ma)为fto的高选择性抑制剂。发明人发现,虽然这些方法都开发出了一些具有高度选择性的fto抑制剂,但这些方法耗时长,且需要高浓度的fto蛋白,此外,它们不能灵敏地检测到低浓度的fto活性。
目前fto活性检测实验中,传统的凝胶电泳和放射自显影检测方法大都需要复杂的核酸标记和凝胶电泳程序,它们的灵敏度较低并且耗时费力。后期开发了fto活性检测的新技术,例如基于结构的虚拟筛选、荧光偏振法以及高效液相色谱等方法。发明人发现,虽然这些方法能够在一定的程度上检测fto的活性并筛选其抑制剂,但是这些方法往往需要耗费很长的时间,且需要耗费大量的高浓度蛋白和探针,检测的灵敏度也达不到本公开的要求。
技术实现要素:
针对现有技术中对fto抑制剂的选择方法灵敏度低、耗时长的问题。本公开提出了一种能够准确、灵敏地测定fto活性并用于fto选择性抑制剂筛选的新方法。可以从小分子中筛选出有效的fto抑制剂。且该方法操作简单,经济,灵敏度高,背景低,特异性好,可以用该方法来实现对细胞中fto活性的超灵敏检测。
本公开一个或一些实施方式中,提供一种基于量子点和三维杂交结构的荧光传感器,包括量子点以及组装在量子点表面的三维杂交结构,所述三维杂交结构包括cy5标记的探针和生物素修饰的dna。
本公开一个或一些实施方式中,提供上述基于量子点和三维杂交结构的荧光传感器的制备方法,其特征在于,包括如下步骤:
1)fto介导的m6a在ssdna底物中的去甲基化;
2)dpnii辅助去甲基化dsdna底物的切割以产生生物素化的捕获探针;
3)构建qd-dna-cy5纳米结构并随后测量fret信号。
本公开一个或一些实施方式中,提供上述基于量子点和三维杂交结构的荧光传感器或上述基于量子点和三维杂交结构的荧光传感器的制备方法制得的产品在fto抑制剂检测中的应用。
本公开一个或一些实施方式中,提供一种fto抑制剂的检测方法,用激光激发上述基于量子点和三维杂交结构的荧光传感器或上述基于量子点和三维杂交结构的荧光传感器的制备方法制得的产品,同时观察到量子点荧光信号和cy5荧光信号。
上述技术方案中的一个或一些技术方案具有如下优点或有益效果:
1)本公开不需要进行扩增就能够增强检测信号:传统的检测酶活性的方法往往需要进行扩增,而本公开的实验设计的双链dna探针的每一端都标有生物素,且切割产物是四条都标有生物素的捕获探针。与传统的扩增方法相比,极大地降低了背景信号,防止了非特异性的扩增。
2)本公开利用量子点基单分子传感技术检测灵敏度高:每一个量子点上面有大约12~15个链霉亲和素,一个链霉亲和素可以和3个生物素连接,因此,一个量子点上面理论可以连接45~48个生物素标记的探针,这极大的增强了荧光共振能量转移效率。且单分子检测的背景信号极地,灵敏度很高,可以在单个分子的水平上实现对靶标物质的检测。
3)本公开设计的双链dna探针,两端分别标记了生物素,且每条特异性模板有一段独特的相同序列和报告探针配对,简化了设计,降低了实验成本。
4)本公开不需要额外生物荧光以及猝灭基团的标记,大大降低了操作的复杂性和成本,利用量子点基单分子检测技术,大大降低了检测的背景信号。并且不需要任何外部的分离以及洗脱步骤,降低了实验的复杂程度,设计的特异性探针,降低了成本和操作的复杂性,节约资源。
附图说明
构成本公开一部分的说明书附图用来提供对本公开的进一步理解,本公开的示意性实施例及其说明用于解释本公开,并不构成对本公开的不当限定。
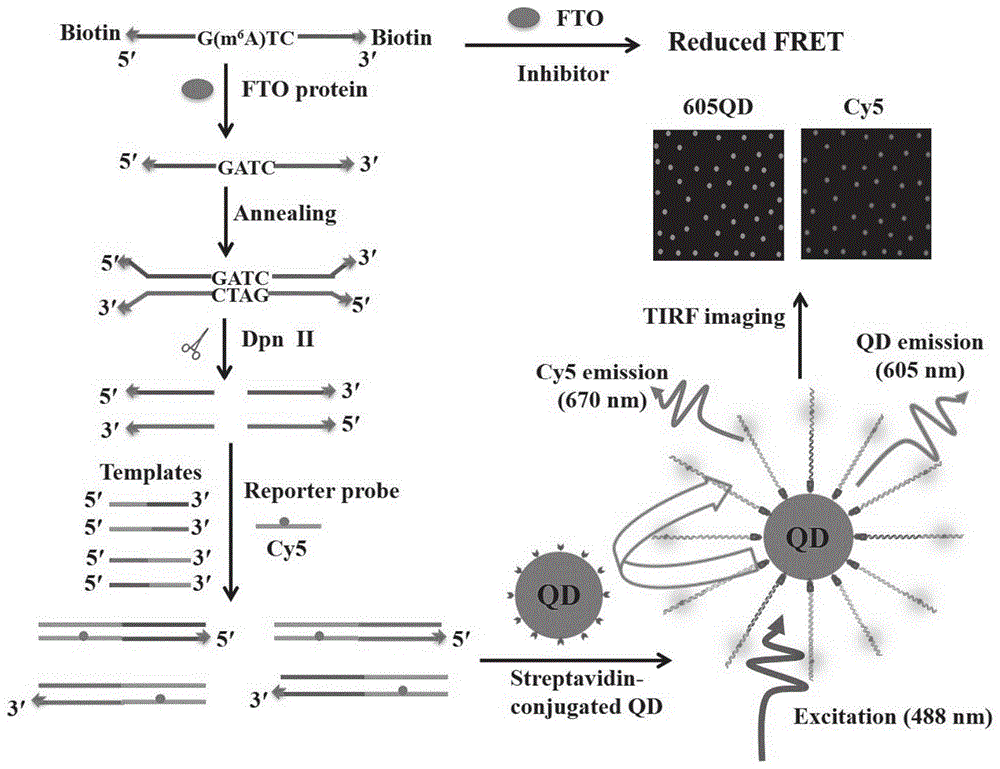
图1:实施例1机理图。
图2:实施例2非降脂聚丙烯酰胺凝胶电泳(page)来研究fto触发的dpnll切割反应图,其中,图a,非变性聚丙烯酰氨凝胶电泳分析的被fto作用后的产物。泳道1,是阳性对照;泳道2,2微摩尔dna底物+dpnll;泳道3,2微摩尔dna底物+500纳摩尔fto+dpnll;图b,红线为在fto存在下的荧光强度,黑线为在没有fto时的荧光强度。
图3:实施例3在fto存在下观察到显著的cy5的检测信号图,其中,a、d分别为有无fto存在时的量子点图;b、e分别为有无fto存在时的cy5的图。c、f分别为量子点和cy5的叠加图。
图4:实施例4中参数带来的影响图,其中,图a,605qd和cy5荧光光谱的强度作为cy5标记的报告探针与605qd比值的函数;图b,荧光效率和cy5荧光强度与cy5标记的报告基因探针与qd比值的函数;图c,cy5计数随dpnii反应温度的变化;图d,cy5计数随着dpnii量的变化。误差棒显示三个独立实验的标准偏差。
图5:实施例5在最佳实验条件下使用所提出的方法测试的各种浓度的fto结果图,图a,不同浓度fto下荧光光谱的强度;图b,荧光强度与fto浓度的对数呈线性关系;图c,不同浓度fto对cy5计数的影响;图d,cy5计数与fto浓度的对数在(1×10-13m~1×10-6m)范围内呈线性相关。误差棒显示三个独立实验的标准偏差。
图6:实施例6通过page分析比较rhein(a),diacerein(b)或plumbagin(c)对fto(0.5μm)去甲基和alkbh5(0.5μm)去甲基的酶抑制作用。抑制剂大黄酸(d),diacerein(e)或plumbagin(f)对fto(0.05μm)和alkbh5(0.05μm)脱甲基使用单分子成像分析的ic50值。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
脂肪和肥胖相关的rna去甲基化酶(fto)可以催化mrna中n6-甲基腺苷(m6a)残基的去甲基化,把m6a变成a。fto在人类肥胖中起关键作用,并可能影响癌症的发展和预后。准确检测fto活性和筛选fto的抑制剂对生物学研究、临床诊断和治疗至关重要。在此,本公开开发了一种基于单量子点(qds)的荧光共振能量转移(fret)传感平台,用于对fto活性进行检测,并筛选其有效的fto抑制剂。fto介导的m6a脱甲基后,可以通过dpnii核酸内切酶切割脱甲基的dna序列。所有切割产生的dna片段都用生物素(biotin)修饰用作捕获探针,来触发cy5标记的报告探针组装在qd表面上,使qd和cy5之间发生fret,从而致使cy5的发射,可通过单分子检测技术被量化。该方法可以灵敏地检测fto活性,检测限为7.9×10-14m。本公开还筛选了fto的几种小分子抑制剂,并确定diacerein是fto的高度选择性抑制剂。在抑制fto去甲基化的机制中,diacerein既不是2-氧戊二酸(2og)的结构模拟物,也不是金属离子的螯合剂。此外,diacerein还抑制从hela细胞提取的内源性fto的去甲基化活性,为fto相关疾病的治疗和药物的发展提供了新的方法。
本公开一个或一些实施方式中,提供一种基于量子点和三维杂交结构的荧光传感器,包括量子点以及组装在量子点表面的三维杂交结构,所述三维杂交结构包括cy5标记的探针和生物素修饰的dna。
优选的,所述生物素为fto特异性生物素。
优选的,所述生物素修饰于dna端部。
本公开一个或一些实施方式中,提供上述基于量子点和三维杂交结构的荧光传感器的制备方法,其特征在于,包括如下步骤:
1)fto介导的m6a在ssdna底物中的去甲基化;
2)dpnii辅助去甲基化dsdna底物的切割以产生生物素化的捕获探针;
3)构建qd-dna-cy5纳米结构并随后测量fret信号。
优选的,步骤1)中,以位点特异性结合m6a(5’-g-m6a-t-c-3’)ssdna作为底物,ssdna底物在3'端和5'端都有生物素标记,在存在fto的情况下,fto将使5'-g-m6a-t-c-3'的序列脱甲基,以产生5'-g-a-t-c-3'的脱甲基序列,在3'末端和5'末端都用生物素修饰的互补链可以与脱甲基ssdna部分杂交,形成具有dpnii核酸内切酶识别位点(5'-g-a-t-c-3')的dsdna。
优选的,步骤2)中,dpnii内切酶可以在识别位点(5’-g-a-t-c-3’)特异性识别和切割去甲基化的dsdna。
优选的,步骤3)中,包含4个不同的序列和1个相同的序列,与4个不同的生物素修饰的切割产物和相同的cy5标记的报告基因探针杂交形成三维杂交结构。
本公开一个或一些实施方式中,提供上述基于量子点和三维杂交结构的荧光传感器或上述基于量子点和三维杂交结构的荧光传感器的制备方法制得的产品在fto抑制剂检测中的应用。
本公开一个或一些实施方式中,提供一种fto抑制剂的检测方法,用激光激发上述基于量子点和三维杂交结构的荧光传感器或上述基于量子点和三维杂交结构的荧光传感器的制备方法制得的产品,同时观察到量子点荧光信号和cy5荧光信号。
优选的,所述激光为488nm氩激光,fto活性通过基于tirf的单分子成像简单地计数cy5信号数来定量监测。
为了使得本领域技术人员能够更加清楚地了解本公开的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例中所用寡核苷酸序列(5′-3′)如下:
dna底物1:biotin-aagctcccatgttaggatcagtgtctcg*a*g-biotin(seqidno.1)
补充1序列:biotin-acgatacatcccactgatcctaacatgc*t*c-biotin(seqidno.2)
dna底物2:catgttaggatcagtg(seqidno.3)
补充2序列:cactgatcctaacatg(seqidno.4)
去甲基化dna:catgttaggatcagtg(seqidno.5)
模板1:aatgaggactaggagctaacatgggagctt(seqidno.6)
模板2:ctcgagacactgatcaatgaggactaggag(seqidno.7)
模板3:aatgaggactaggagagtgggatgtatcgt(seqidno.8)
模板4:gagcatgttaggatcaatgaggactaggag(seqidno.9)
报告探针:p-ctcctagtcctca*t*t(seqidno.10)
sirna:aaauagccgcugcuugugaga(seqidno.11)
anti-sirna:ucucacaagcagcggcuauuu(seqidno.12)
实施例1
本实施例提供一种基于量子点和三维杂交结构的荧光传感器的制备方法,,包括三个连续的步骤:
(1)fto介导的m6a在ssdna底物中的去甲基化;
(2)dpnii辅助去甲基化dsdna底物的切割以产生生物素化的捕获探针;
(3)构建qd-dna-cy5纳米结构并随后测量fret信号。fto具有高效的氧化去甲基化活性。
因此,为了研究fto对m6a的去甲基化活性,本公开设计了以位点特异性结合m6a(5’-g-m6a-t-c-3’)ssdna作为底物,ssdna底物在3'端和5'端都有生物素标记,在存在fto的情况下,fto将使5'-g-m6a-t-c-3'的序列脱甲基,以产生5'-g-a-t-c-3'的脱甲基序列。在3'末端和5'末端都用生物素修饰的互补链可以与脱甲基ssdna部分杂交,形成具有dpnii核酸内切酶识别位点(5'-g-a-t-c-3')的dsdna。步骤2)里,dpnii内切酶可以在识别位点(5’-g-a-t-c-3’)特异性识别和切割去甲基化的dsdna。这种部分互补结构有利于切割后的解离,产生四种不同的ssdna切割产物。本公开还设计了4个不同的模板(模板1-4),包含4个不同的序列和1个相同的序列,可以与新产生的4个不同的生物素修饰的切割产物和相同的cy5标记的报告基因探针杂交形成三维杂交结构。随后,所有生物素修饰的切割产物均可作为捕获探针将三维杂交结构驱动到605qds表面,通过特异性的生物素-链霉亲和素相互作用形成605qd-dna-cy5复合物。如图1描述了fto活性测定的原理:当488nm氩激光激发605qd-dna-cy5复合物时,605qd的荧光信号与cy5的荧光信号可以同时被观察到,这是由于605qd的供体与cy5的受体发生荧光共振转移,因此,fto活性可以通过基于tirf的单分子成像简单地计数cy5信号数来定量监测。相反,在没有fto的情况下,ssdna底物仍然甲基化(5'-g-m6a-t-c-3'),并且不能被dpnii切割。因此,无论是捕获探针还是605qd-dna-cy5复合物都不能生成,因此,qd与cy5之间不会产生fret。
实施例2
本实施例提供一种fto抑制剂的检测方法,包括如下步骤:
检测fto的活性:首先,0.3微摩尔甲基化的ssdna与不同浓度的fto蛋白质在10微升反应缓冲溶液中(包括50毫摩尔hepes,ph值7.5,100微摩尔2-og,100微摩尔l-ascorbicacidand150微摩尔(nh4)2fe(so4)2)在30℃下反应2小时,然后,在95℃灭活5分钟,然后ssdna与互补链在1×退火溶液(含50毫摩尔氯化钠和10毫摩尔tris-hcl(ph值8.0)总体积为20毫升)的体系里退火。8微升生成的dsdnas,5单位dpnii,1×dpnii缓冲溶液在体系为10微升的混合溶液中,37℃反应60分钟,然后,80℃灭活20分钟。10微升生物素化的消化产物,1微摩尔cy5标记的报告探针,0.5微摩尔模板1,2,3,4被加到一个含有100毫摩尔tris-hcl,10毫摩尔(nh4)2so4和3毫摩尔mgcl2,终体积为20μl,ph为8.0的反应体系中。混合物在95℃下加热5分钟,然后在室温下孵育30分钟,得到夹层杂化物,杂化反应后,通过特异性的生物素-链霉亲和素相互作用将夹心杂化产物组装到605qds表面,形成605qd-dna-cy5纳米复合结构。然后对混合产物进行检测。
凝胶电泳实验:本实验采用14%的非变性聚丙烯酰胺凝胶电泳(page)来分析扩增产物,在1×tbe缓冲液(89毫摩尔每升tris-hcl,89毫摩尔每升硼酸,2毫摩尔每升edta,ph8.3)中,以1×sybrgold作为荧光指示剂,在110v恒定电压下室温进行14%非变性聚丙烯酰胺凝胶电泳(page)50分钟,最后,凝胶电泳图像由chemidocmp成像系统成像。
抑制剂实验:为了研究fto抑制剂对fto活性的影响,不同浓度的抑制剂,0.3微摩尔每升的dna序列,在30℃下温育15分钟,然后加入50纳摩尔的fto到溶液中30℃温育2小时,然后95℃灭活5分钟后,其他的操作程序如前所述。最后,在检测系统中进行检测以测定fto蛋白活性。fto的相对活性(ra)通过下面公式计算:
ra=(ni-n0)/(nt-n0)*100%
其中n0是在没有fto的情况下的cy5单分子计数,,nt是存在50纳摩尔时的cy5计数,ni是存在50纳摩尔fto和fto抑制剂时的单分子计数。
细胞培养和蛋白提取物的制备:hela细胞(人宫颈癌细胞系)培养在dmem培养基中,其中培养基中包含10%的胚胎牛血清和1%青霉素链霉素,放置在37℃含有5%二氧化碳的培养箱中。使用蛋白提取试剂盒根据说明书进行细胞提取物的提取,细胞提取物最终冻存于负80℃冰箱中备用。
通过瞬时转染关闭fto活性:fto的靶序列是5′-aaauagccgcugcuugugaga-3′,通过瞬时转染sirna48h,关闭hela细胞中fto的表达。使用lipofectaminetm3000转染试剂按照制造商的规定进行转染。转染48小时后,根据制造商的规定,使用核提取试剂盒(activemotif,carlsbad,ca,u.s.a.)制备核提取物。
实施例3
如图2所示,本实施例进行非降脂聚丙烯酰胺凝胶电泳(page)来研究fto触发的dpnll切割反应。在fto和dpnll存在下观察到60分钟反应时间处的切割产物的明显带(图2a,泳道3),表明fto可以启动dpnll介导的切割反应。然而,在没有fto存在的时候(图2a,泳道2)未观察到切割产物条带。本公开进一步证实了使用荧光仪检测法和单分子检测法来证明该实验的可行性,在fto存在下观察到显著的cy5的检测信号(图2b,图3c,b图),但在没有fto的情况下没有观察到明显的cy5信号(图2b,图3f,e图)。这一结果表明,只有fto存在的情况下,cy5信号才能够被检测到,重要的是该方法可以灵敏的检测fto活性。
实施例4
为了获得最高的测定灵敏度,本实施例研究了几个参数的影响,包括cy5与qd的比率,dpnll用量及反应温度。如图4a所示,随着cy5与qd的比率由1:1增大到48:1的时候,在cy5与qd的比率为24:1之前,随着比值的增大qd荧光强度降低,cy5荧光强度增高,超过24:1时没有显著的变化,因此比值定在24:1的时候为最佳的反应条件。由图4b知,37℃条件下的cy5计数远远高于25℃和45℃条件下的cy5计数,因此在后续实验中使用37℃的反应温度。由图4c知,cy5计数随着dpnii从1u到5u的增加而增加,在5u处趋于平稳,因此在后续实验中使用5udpnii。
实施例5
为了定量检测fto,本实施例在最佳实验条件下使用所提出的方法测试了各种浓度的fto。如图5a和5c所示,荧光和单分子信号以时间依赖性和浓度依赖性两种方式增加。fto浓度越高,被fto去甲基化的序列越多,因此就有更多的生物素标记的探针被切割下来,产生更强的检测信号。如图5d所示,检测信号强度随着fto浓度从1×10-13m到1×10-6m浓度的增加而增加。在7个数量级的动态范围内,检测信号与fto浓度的对数呈线性相关。线性关系可描述为n=58.63log10c+789.80,相关系数为0.9806,其中n是cy5分子数,c是fto浓度(摩尔),通过计算对照平均值加3倍的标准偏差得出的检测限为7.9×10-14。比荧光光谱法(3.3×10-12m)提高了100倍(5b)。灵敏度的提高可归因于一下几点:(1)fto介导的特异性去甲基化以及随后高效的dpnll催化的去甲基化dna的切割。(2)所有以生物素修饰为捕获探针的切割产物均可与模板和cy5标记的报告探针杂交形成多个生物素/模板/cy5复合物。(3)多个生物素/模板/cy5复合物在单个qd表面的组装提高了荧光能量转换效率。(4)单分子检测的近零背景信号。
实施例6
本实施例进一步研究了diacerein作为模型抑制剂对fto诱导的去甲基化反应的影响。fto可以与抑制剂形成一个非常特异和稳定的复合物。如图6所示,fto的相对活性随着抑制剂浓度的增加而降低。这一结果证实,所提出的方法可以进一步发展为筛选fto抑制剂的低成本高通量平台,为进一步的生物应用提供巨大潜力。
以上所揭露的仅为本发明的优选实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明申请专利范围所作的等同变化,仍属本发明所涵盖的范围。
sequencelisting
<110>山东师范大学
<120>基于量子点和三维杂交结构的荧光传感器及其制备与应用
<130>202025775
<160>12
<170>patentinversion3.3
<210>1
<211>30
<212>dna
<213>dna底物1
<400>1
aagctcccatgttaggatcagtgtctcgag30
<210>2
<211>30
<212>dna
<213>补充1序列
<400>2
acgatacatcccactgatcctaacatgctc30
<210>3
<211>16
<212>dna
<213>dna底物2
<400>3
catgttaggatcagtg16
<210>4
<211>16
<212>dna
<213>补充2序列
<400>4
cactgatcctaacatg16
<210>5
<211>16
<212>dna
<213>去甲基化dna
<400>5
catgttaggatcagtg16
<210>6
<211>30
<212>dna
<213>模板1
<400>6
aatgaggactaggagctaacatgggagctt30
<210>7
<211>30
<212>dna
<213>模板2
<400>7
ctcgagacactgatcaatgaggactaggag30
<210>8
<211>30
<212>dna
<213>模板3
<400>8
aatgaggactaggagagtgggatgtatcgt30
<210>9
<211>30
<212>dna
<213>模板4
<400>9
gagcatgttaggatcaatgaggactaggag30
<210>10
<211>15
<212>dna
<213>报告探针
<400>10
ctcctagtcctcatt15
<210>11
<211>21
<212>rna
<213>sirna
<400>11
aaauagccgcugcuugugaga21
<210>12
<211>21
<212>rna
<213>anti-sirna
<400>12
ucucacaagcagcggcuauuu21
- 还没有人留言评论。精彩留言会获得点赞!