用于核酸检测的组合物的制作方法
1.本发明涉及分子生物学领域,具体涉及一种提高核酸检测灵敏度和特异性的引物探针组合物及其在pcr反应中的应用。
背景技术:
2.聚合酶链式反应(pcr)是不采用活的生物体而对dna进行酶复制的分子生物学技术。pcr通常用于医学和生物研究实验室以承担多种任务,例如基因克隆、实验动物表型鉴定、转录组研究、遗传疾病的检测、基因指纹的鉴定、感染性疾病的诊断、亲子鉴定等等。由于其无可比拟的复制和精确能力,pcr被分子生物学家认为是核酸检测的首选方法。上世纪90年代后期,美国abi公司推出的实时荧光定量pcr(real time quantitative pcr,qpcr)技术及相关产品更是将pcr发展成为一种高灵敏、高特异性和精确定量的核酸序列分析技术。
3.数字pcr(digital pcr,dpcr)技术是一种核酸分子绝对定量技术,其利用极限稀释的原理将一个荧光定量pcr反应体系分配到成千上万份单独的纳升级微反应器中,使得每个微反应器中包含或不包含1个或多个拷贝的目标核酸分子(dna靶标),再同时进行单分子模板pcr扩增。不同于荧光定量pcr在每个扩增循环进行时采集荧光的方法,数字pcr在扩增结束后对每个反应单元的荧光信号进行独立采集,最后通过泊松分布的原理及阳性/阴性的反应单元的比例得出目标分子的原始拷贝数或浓度。
4.相较于荧光定量pcr,数字pcr不依靠ct值和标准曲线就可以进行精确的绝对定量检测,具有灵敏度高以及精确度高的优势。由于数字pcr在进行结果判读时仅判断“有/无”两种扩增状态,因此也不需要检测荧光信号与设定阈值线的交点,完全不依赖于ct值的鉴定,所以数字pcr反应和结果判读受扩增效率的影响大大降低,对pcr反应抑制物的耐受能力大大提高。此外,数字pcr实验中对反应体系进行分配的过程可以极大程度上在局部降低与靶标序列有竞争作用的背景序列浓度。因此,由于数字pcr具有更高的灵敏度和精确度,在需要以高灵敏度对拷贝量低的差异性核酸分子进行定量和检测时,体现出相比于传统的荧光定量pcr的显著优势。尤其是在复杂背景中检测稀有突变,常见于肿瘤液体活检、无创产前检测、器官移植监测、病毒载量的精确定量、转基因作物的成分检测等,例如在肿瘤患者外周血中检测稀有突变标志物,或是基因表达差异研究等。
5.现有核酸检测试剂,多采用
①
taqman探针法、
②
引物特异性区分法、
③
阻断野生型扩增法。其中
①
taqman探针法通常会采用分别针对突变型和野生型的竞争性探针,两种探针为类似于点突变检测的竞争性探针,或者在基因野生型模板上设计一条特异性探针,在基因的其它保守区域设计一条可以同时指示野生型和突变型模板的通用探针,利用两条探针测定的浓度差值来定量突变型模板的浓度,两种方法均需在探针的上下游设计扩增引物,导致扩增子较长,由于ctdna呈高度随机的片段化分布,因此,较短的ctdna片段可能会被漏检,降低检测灵敏度,同时,当某基因突变类型众多时,针对不同的突变类型需设计多种不同的突变型探针,费用较高,不利于大规模的推广使用。
②
引物特异性区分法是设计不
同的突变型引物来特异性区分不同的突变类型,在其下游的保守区域设计一条探针及下游引物,在基因的其它保守区域设计一条可以同时指示野生型和突变型模板的通用探针及其上下游引物,此方法仍存在扩增子较长的问题,不利于较短的ctdna的检测,另外对引物的特异性要求极高,易出现交叉反应。
③
阻断野生型扩增法常采用肽核酸(peptide nucleic acid,pna),锁核酸(locked nucleic acid,lna)等昂贵修饰来阻断野生型模板的扩增,从而不会产生假阳性信号,但在某些野生型序列和突变型序列差异过小或者突变区域为野生型的重复序列时,添加的抑制剂会无法区分两种序列而影响突变型的信号检测。
6.因此,需要一种灵敏度高、特异性好、成本低的引物探针设计方法来满足临床使用pcr技术检测的需求,以提高核酸检测的特异性和灵敏度。
技术实现要素:
7.为解决上述问题,本发明提供一种引物探针组合物、以及其在pcr反应中的应用、以及包括该引物探针组合物的核酸检测试剂盒,实现了提高核酸检测特异性、降低假阳性的技术效果,尤其适用于一些对引物特异性要求高的突变序列的检测试剂盒中的应用。
8.本发明第一方面,提供一种用于核酸序列检测的引物探针组合物,其包括:第一上游引物f1、第二上游引物f2、探针p、下游引物r和寡核苷酸f1c;
9.其中,第一上游引物f1从5’端至3’端依次由下述两部分组成:
10.(1)不匹配区:与靶核酸序列不发生互补配对;该不匹配区的序列从5’端至3’端包括与第二上游引物f2相同的序列,和与探针p相同的序列;
11.(2)匹配区:与靶核酸序列发生互补配对;
12.寡核苷酸f1c的末端经过修饰而无法延伸。在一些实施方案中,寡核苷酸f1c的末端可以采用本领域熟知的修饰方式、以实现封闭3
’-
oh的作用,使其在pcr扩增反应中无法延伸的目的。示例性的修饰包括磷酸化修饰、c3 spacer修饰、以及采用bhq1基团修饰等。
13.寡核苷酸f1c与第一上游引物f1的匹配区有部分核酸序列互补配对。该互补配对的序列可以包括扩增决定位点,也可以不包括。
14.在一些实施方案中,寡核苷酸f1c的长度为第一上游引物f1的匹配区长度的45%-90%,例如,可以是45%、47%、50%、60%、70%、71%、75%、80%、85%、86%、88%、90%等,优选地,寡核苷酸f1c的长度为第一上游引物f1的匹配区长度的70%-86%。
15.在一些实施方案中,该引物探针组合物中仅一种下游引物,即第一上游引物和第二上游引物共用一种下游引物。优选地,下游引物与靶核酸序列的互补区位于第一上游引物与靶核酸序列的互补区的下游1-200bp区域内,例如,可以是1bp、20bp、40bp、70bp、90bp、110bp、130bp、150bp、170bp、180bp、190bp、200bp等。
16.在一些实施方案中,第一上游引物与第二上游引物的tm值相同。在一些实施方案中,第一上游引物与第二上游引物的tm值不同,即第一上游引物的tm值可以高于第二上游引物的tm值,也可以是第一上游引物的tm值低于第二上游引物的tm值。在一些优选实施方案中,第一上游引物的tm值比第二上游引物的tm值相差0℃-20℃,例如,可以是0℃、5℃、8℃、10℃、12℃、15℃、18℃、20℃等。在一些优选实施方案中,第一上游引物的tm值比第二上游引物的tm值更高。
17.在一些实施方案中,第一上游引物的3’端具有扩增决定位点,该扩增决定位点与
靶序列上的变异检测位点互补,且扩增决定位点的上游具有由一个以上碱基组成的不与靶序列互补的错配区;在一些实施方式中,错配区的长度为1-15个碱基,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个碱基;在一些实施方案中,错配区位于第一上游引物的3’端的第2~14个碱基处。
18.在一些实施方案中,第一上游引物的匹配区和不匹配区之间间隔1个或多个碱基,也可以没有碱基间隔。第一上游引物的不匹配区不与靶核酸序列相同或互补配对或在高严格条件下杂交。
19.在一些实施方案中,探针带有报告基团。在优选的实施方案中,只有在探针被水解后,报告基团才是可检测的。在进一步的实施方案中,所述探针上带有报告基团和淬灭基团。在更进一步的实施方案中,所述报告基团可以是选自下组的荧光基团:fam、hex、vic、rox、cy5、cy3等;所述淬灭基团可以选自下组:tamra、bhq1、bhq2、bhq3、dabcyl、qxl、ddqi等。在一些实施方案中,水解探针除报告基团和淬灭基团外不带有任何其他修饰,所述其他修饰例如mgb、lna、pna、bna、superbase等。在一个优选实施方案中,本发明的探针为taqman探针。在一个优选实施方案中,所述报告基团位于探针的5’端,淬灭基团位于探针的3’端。
20.在一些实施方案中,第一上游引物f1长度可以是50-120个碱基,优选为50-90个碱基,优选为30-70个碱基。在一些实施方案中,第一正向引物f1的靶序列结合区的tm值可以是40℃-90℃,优选为50℃-80℃,gc含量为40%-80%。
21.在一些实施方案中,第二上游引物f2长度可以是10-40个碱基,优选为13-30个碱基。在一些实施方案中,第二上游引物f2的tm值可以是35℃-85℃,优选为50℃-80℃,gc含量为40%-80%。
22.在一些实施方案中,探针p的长度为12-30个碱基。在进一步的实施方案中,探针p的tm值为50℃-80℃。在更进一步的实施方案中,探针的gc含量40%-80%。
23.在一些实施方案中,反向引物r的长度为15-30个碱基。在进一步的实施方案中,反向引物r的tm值为50℃-80℃。在更进一步的实施方案中,反向引物r的gc含量40%-80%。
24.在一些实施方案中,寡核苷酸f1c的长度为15-30个碱基。在进一步的实施方案中,寡核苷酸f1c的tm值为50℃-80℃。在更进一步的实施方案中,寡核苷酸f1c的gc含量40%-80%。
25.本发明的第二方面,提供一种上述引物探针组合物在pcr反应中的应用。所述的pcr反应包括荧光定量pcr、数字pcr。
26.本发明的第三方面,提供一种包含上述引物探针组合物的核酸检测试剂盒,该检测试剂盒尤其适用于对引物特异性要求高的突变序列检测,例如,包含上述引物探针组合物的egfr基因20号外显子插入突变检测试剂盒、包含上述引物探针组合物的egfr基因t790m突变检测试剂盒。
27.本发明的第四方面,提供一种包含上述引物探针组合物的核酸检测试剂盒的使用方法,包括:
28.将待测样品与引物探针组合物、扩增试剂进行混合,得到样品混合物;
29.将样品混合物中的双链dna变性为单链;
30.将样品混合物随机分配到500个以上的反应单元中,每个反应单元含有1条单链或不含有单链;
31.对所有反应单元进行统一的热循环扩增;
32.检测每个反应单元中单链的存在;
33.其中,上述“引物探针组合物”包括第一上游引物f1、第二上游引物f2、探针p、下游引物r和寡核苷酸f1c,即为本发明第一方面提供的引物探针组合物。
34.上述“扩增试剂”是指用于pcr的试剂,包括但不限于dntp、dna聚合酶、以及一些促进pcr反应的试剂,例如kcl、mgcl2、tris-hcl、二硫苏糖醇(dtt)等。
35.上述“变性”的目的是破坏双链dna上成对的互补碱基之间的氢键,从而允许双链分开成两条单链。在一些实施方案中,可以通过加热含有双链dna混合物的方法来形成单链,例如,将混合物加热至90℃、92℃、95℃或98℃来解离双链dna。通常,在双链解离时,需要将混合物在升高的温度下维持至少10秒或者更长,例如,30秒、1分钟、2分钟、5分钟,甚至更长,以实现双链dna的90%或更高的解离。解离完成后,将其冷却至室温或室温以下。
36.在一些实施方案中,上述“变性”还可以通过改变溶液离子强度(例如,加入酸、碱、盐等)来破坏双链dna之间的氢键,也可以采用酶(例如,解旋酶)来实现将双链dna解离成单链dna。
37.在一些实施方案中,上述“热循环扩增”包括以下内容:以第一上游引物(f1)和下游引物(r)作为引物对靶核酸序列进行预扩增,获得预扩增产物;以第二上游引物(f2)和下游引物(r)作为引物对预扩增产物进行继续扩增。在一些具体实施方案中,f1和r作为引物进行预扩增的循环数为3-10个循环;更优选地,预扩增的循环数为5-8个循环。在一些具体实施方案中,f2和r作为引物进行扩增、同时水解探针(p)进行测定的循环数为35-50个循环,更优选的,循环数为40-45个循环。
38.在一些具体实施方案中,上述预扩增比继续扩增的退火温度高5℃-20℃,更优选为高10℃-15℃。
39.预扩增及继续扩增所适用的程序及常用反应条件(如变性温度、时间等)是本领域所熟知的。例如,在一些示例性的实施方案中,预扩增及继续扩的具体反应条件可以是:92℃-96℃预变性5-15分钟;92℃-95℃变性10-60秒,55℃-75℃退火及延伸30-90秒,共进行3-10个循环;92℃-95℃变性10-60秒,45℃-65℃退火及延伸30-90秒,共进行35-50个循环;94℃-98℃灭活5-15分钟;4℃-15℃终止反应。
40.本发明扩增反应体系中引物和探针的浓度可以通过本领域常规实验来确定。在一些示例性的实施方案中,反应体系中f1引物的浓度为15nm-150nm,f2引物的浓度为150nm-1500nm,探针p的浓度为50nm-800nm,r引物的浓度为150nm-1800nm,寡核苷酸f1c的浓度为15nm-500nm。在一些更优选的实施方案中,反应体系中f1引物的浓度为100nm-200nm,f2引物的浓度为300nm-600nm,探针p的浓度为150nm-400nm,引物r的浓度为300nm-900nm,寡核苷酸f1c的浓度为50nm-300nm。
41.本发明中“检测每个反应单元中单链的存在”可采用taqman探针法的原理,即利用dna聚合酶的5
’-3’
外切酶活性使探针水解进而产生荧光信号。若反应单元中含有欲检测的靶核酸,探针与靶核酸特异性结合,在热循环扩增过程中,即发出荧光信号。本发明中,对存在单链的反应单元进行计数也可采用taqman探针法的原理,由于每个反应单元中含有1条单链或不含有单链,所以发出荧光信号的反应单元数量就代表了反应体系中靶核酸的数量,最后通过泊松修正即可得到待测样品中靶核酸的浓度。
42.在一些实施方案中,待测样品可以是生物样品,例如生物体液、活体组织、冷冻组织、石蜡切片等。在一些优选的实施方案中,所述样品是,例如外周血、尿液、灌洗液、脑脊液、粪便、唾液等。
43.本发明提供的核酸序列检测的方法,可以是对待测样品中的某一种核酸进行检测,例如,仅检测样品中的突变型靶序列,或仅检测野生型靶序列,此时,扩增反应体系中可使用一种第一上游引物和一种探针。该检测方法还可以对两种以上的核酸进行检测,例如,同时检测一种突变型核酸和野生型核酸,或同时检测两种以上突变型核酸和野生型核酸等,此时,同一扩增反应体系中可使用多种(例如2种或更多种)第一上游引物(例如同一反应单元中具有多种第一上游引物),以及多种(例如2种或更多种)探针(例如同一反应单元中具有多种探针)。例如,上述多种第一上游引物的匹配区不同,上述多种探针具有互相不同的序列和报告基因。任选地,上述多种第一上游引物的不匹配区也可以不同。在使用多种第一上游引物及探针的一些实施方案中,不同的第一上游引物可以共用同一种下游引物。
44.在一些实施方案中,本发明提供的核酸序列检测的方法,可用于检测核酸序列的变异。所述核酸序列变异可以是选自下组的一项或多项:碱基置换突变、插入突变、缺失突变、和倒位突变。在一些实施方案中,所述核酸序列变异是碱基置换突变,即待检测的两种靶序列(例如野生型和突变型)之间没有碱基数目的差别,例如,其中一个或多个碱基的类型不同。在一些实施方案中,所述核酸序列变异是点突变,即只有1个碱基的类型不同。
45.定义
46.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
47.如本文中所用,术语“寡核苷酸”、“多核苷酸”可互换地使用,并且是指核苷酸单体的单链和/或双链聚合物,包括(但不限于)通过核苷酸间磷酸二酯键连接或核苷酸间类似物连接的2'-脱氧核糖核苷酸(dna)和核糖核苷酸(rna)。核酸中的核苷酸单体可称为“核苷酸残基”。核酸可以完全由脱氧核糖核苷酸构成、完全由核糖核苷酸构成或由其嵌合混合物构成,并且可以包括核苷酸类似物。核苷酸单体单元可以包含本文中所述的核苷酸中的任一个,包括(但不限于)核苷酸和/或核苷酸类似物。核酸的大小通常从几个核苷酸残基到几千个核苷酸残基不等。其中“寡核苷酸”通常指长度相对较短的核苷酸聚合物,例如1-80个。除非另外指出,否则每当呈现核酸序列时,都应了解,核苷酸从左到右是按5'到3'的顺序。非另行指出,否则“a”表示脱氧腺苷,“c”表示脱氧胞苷,“g”表示脱氧鸟苷,“t”表示脱氧胸苷,并且“u”表示脱氧尿苷。
48.根据本领域习惯用语,核酸的长度可表示为碱基、碱基对(缩写“bp”)、核苷酸/核苷酸残基(缩写为“nt”)或千碱基(“kb”)。在上下文允许的情况下,术语“碱基”、“核苷酸”、“核苷酸残基”可以描述单链或双链的多核苷酸。当该术语应用于双链分子时,其用于指整个长度,并且应理解为相当于术语“碱基对”。
49.术语“错配碱基”,是指dna双螺旋结构中碱基之间的配对不是随意的碱基,总是腺嘌呤(a)与胸腺嘧啶(t)配对,鸟嘌呤(g)与胞嘧啶(c)配对的原则。若出现了a与c或g配对,或t与g或c配对,则为碱基错配。
50.术语“引物”表示这样的寡核苷酸:其与靶核酸中的序列杂交,且能够充当沿着核
酸的互补链合成(在适合于这样的合成的条件下)的起始点。
51.本文中使用的术语“探针”表示这样的寡核苷酸:其与靶核酸中的序列杂交,且通常被可检测地标记。探针可以具有修饰(诸如3
’-
端修饰和/或5
’-
端修饰,其使探针可以被检测到或是被核酸聚合酶水解等),所述修饰也可包括一个或多个生色团。
52.本文中使用的术语“靶序列”、“靶核酸”、“靶核酸序列”或“靶标”可互换使用且意指要扩增、检测或扩增并检测的核酸序列部分,其可在杂交、退火或扩增条件下与探针或引物进行退火或杂交。术语“杂交”表示两个核酸之间的碱基配对相互作用,其导致双链体的形成。不要求2个核酸在它们的全长上具有100%互补性才可实现杂交。
53.本文中使用的术语“匹配区”、“靶序列结合区”可互换使用,是指与靶核酸序列发生互补配对的区域。
54.本发明中使用的术语“上游引物”,也称“正向引物”,是沿着负链进行不间断延长的寡核苷酸;本发明中使用的术语“下游引物”,也称反向引物,是沿着正链进行不间断延长的寡核苷酸。正链即有义链、正义链,也称编码链,一般位于双链dna上端,方向从左到右为5
’-3’
,碱基序列和该基因mrna基本相同;与该链结合的引物为反向引物;负链即无义链,也称非编码连,和正链互补,与该链结合的引物为正向引物。应理解,当正义链和反义链的指定发生互换时,对应的正向和反向引物命名也可随之互换。
55.在本发明的上下文中,“第一正向引物f1”、“第一上游引物f1”、“第一正向引物”、“第一上游引物”可互换使用;“第二正向引物f2”、“第二上游引物f2”可互换使用;“反向引物”、“反向引物r”可互换使用;“探针p”和“探针”可互换使用;“f1c”、“寡核苷酸f1c”可互换使用。
56.本文所用的术语“上游”、“位于/在
……
上游”、“上游具有
……”
等,在描述核酸序列的语境下是表示在同一核酸序列上比指代区域更靠近5’端的部分,例如可以是紧邻指代区域,也可以与指代区域有一个或多个碱基的间隔。本文所用的术语“下游”、“位于/在
……
下游”、“下游具有
……”
等,在描述核酸序列的语境下是表示在同一核酸序列上比指代区域更靠近3’端的部分,例如可以是紧邻指代区域,也可以与指代区域有一个或多个碱基的间隔。应了解,除另有说明外,在描述的核酸为双链核酸时,“上游”和“下游”的表示方法通常以正义链的5’端和3’端为准。
57.本文中术语“taqman探针(taqman probe)”与“水解探针(hydrolysis probe)”可互换使用。taqman探针是在real-time pcr技术平台发展出的荧光检测技术,探针的5’端含有荧光报告基团,3’端含有荧光淬灭基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收,当进行pcr扩增时,taq dna聚合酶的5’端到3’端的外切酶活性将探针酶切降解,使得报告基团和淬灭基团分离,发出荧光信号,从而达到荧光信号的积累与pcr产物形成完全同步。具体地,报告基团可利用fam、fam、hex、vic、rox、cy5、cy3等,淬灭基团可利用tamra、tamra、bhq1、bhq2、bhq3、dabcyl、qxl、ddqi,但并不局限于此。此外,taqman探针还衍生出其他修饰形式,例如taqman-mgb探针是在3’端具有小沟结合分子(minor groove binder,mgb)的taqman探针,提高了探针的tm值,缩短探针长度,便于多突变位点的同时检测。
58.本说明书所述的“严格条件”,可以为低严格条件、中严格条件、高严格条件中的任一种。“低严格条件”,如为5
×
ssc、5
×
denhardt溶液、0.5%sds、50%甲酰胺、32℃的条件;此外,“中严格条件”,如为5
×
ssc、5
×
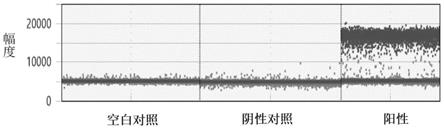
denhardt溶液、0.5%sds、50%甲酰胺、42℃的条件;“高严格条件”,如为5
×
ssc、5
×
denhardt溶液、0.5%sds、50%甲酰胺、50℃的条件。在这些条件下,预期温度越高越能有效得到同源性高的多核苷酸,如dna。虽然影响杂交的严格度的因素有多种,如温度、探针浓度、探针长度、离子强度、时间、盐浓度等,但本领域技术人员可通过适当选择这些要素得到类似的严格度。
59.本文所用术语“突变丰度”是指突变型靶标基因的相对或绝对定量值,在检测中一般将“突变丰度”定义为突变型靶标基因分子数在总的dna分子数中所占比例。
60.本文所用术语“待测样品”表示含有核酸或推测含有核酸的任何组合物。样品可来源于生物来源(“生物样品”),例如组织(例如活组织检查样品)、提取物或培养物和生物或生理流体等。例如,样品可包括皮肤、血浆、血清、脊髓液、淋巴液、滑液、尿、泪水、血细胞、器官和肿瘤。并且,样品还可包括从取自个体的细胞建立的体外培养物的样品或经固定化的样品,例如福尔马林固定的石蜡包埋组织(ffpet)和从其分离的核酸分离物。
61.有益效果
62.本发明的引物探针组合物及方法与现有技术相比,其优点在于:
63.(1)假阳性少、特异性高:本发明提供的引物探针组合物,引入特定长度的寡核苷酸f1c与上游引物f1的匹配区互补,在pcr反应过程中,可以很好地避免假阳性信号,对于一些突变型与野生型序列差异较小或者有相似序列的靶标检测,本技术可以有效提高引物特异性,尤其适用于利用数字pcr法进行突变检测。
64.(2)靶核酸序列短:本发明提供的引物探针组合物,实际与靶核酸序列配对结合的部分只有两部分:第一正向引物f1的3’端靶序列结合区以及下游引物r的序列。相比taqman探针法和arms法中至少三部分与靶核酸序列配对(上游引物、探针和下游引物),本发明提供的引物探针组合物对靶核酸待测片段的长度需求更短。这一优势可以体现在不同的检测场景中,例如在高度片段化的游离dna检测中,由于dna的片段化是随机的,更短的检测片段可以检出更多的dna靶标,进而大大提高检测的灵敏度。
65.(3)对靶核酸序列要求较低:与上述优点类似,本发明提供的引物探针设计方法由于探针p在预扩增完成后才能与上游引物f1的5’端互补序列互相配对结合,因此实际与靶核酸序列配对结合的部分只有两部分:f1的3’端序列以及下游引物r的序列。因此对于复杂的靶核酸序列检测时,本发明所述引物探针的设计方法可以避开gc不平衡区域,尤其在探针的设计难度上相对于taqman探针法以及arms更低。
66.(4)对样本中目标dna含量要求较低:在分析目标dna含量低于最优数量的样本时,本发明可以用来有效的增加样本中的目标序列的数量,提高检测的灵敏度,从而减少因为样本数量过少产生的误差。这样的样本一般包括,血浆(cf dna样本),活检穿刺,或者ffpe样本。这个方法通常包括在形成微滴前将双链dna解链成它的组成链,比如单链dna(ssdna),然后在扩增和计数前将每一条链分隔开。
67.(5)适用范围广:本发明提供的引物探针组合物及检测方法,可检测小于200bp的短片段dna,且对pcr抑制物的耐受良好,可以适用于多种样本类型的核酸检测,包括福尔马林固定石蜡包埋组织(ffpe)样本、新鲜组织样本、外周血样本、尿液样本、灌洗液样本、脑脊液样本、人工培养的细胞系样本、人工合成的质粒样本等。
68.(6)样本消耗少:本发明本发明提供的引物探针组合物可在一个反应管中同时检测突变型与野生型靶核酸序列,当将其应用于数字pcr时,能对两者进行绝对定量及突变丰
度统计,特别适合用于稀少样本,如外周血循环肿瘤dna样本的检测。
69.(7)成本低:本发明提供的引物探针组合物,无需经过昂贵的mgb修饰或lna修饰,大大减少引物探针使用成本,同时拥有更好的检测性能,满足临床使用的需要;尤其是,当本发明提供的引物探针组合物应用于数字pcr时,能将目标dna双链解旋成单链后,不需要使用末端修复酶将不均衡的游离dna进行修复,减少了检测成本。
70.(8)实验步骤简便:本发明提供的引物探针组合物,将其应用于数字pcr时,在将含有模板的反应体系经过解链步骤后,不需要在反应液中添加末端修复酶来进行修复,减少了实验步骤,节约了实验时间。
附图说明
71.图1为实施例1中egfr 20外显子插入突变的检测结果图;
72.图2为实施例2中使用不同长度的寡核苷酸f1c对egfr 20外显子插入突变进行检测的结果图;
73.图3为实施例3中egfr基因t790m突变的检测结果图。
具体实施方式
74.下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
75.主要实验设备及材料如下:
76.设备/材料厂家/型号2x ddpcr supermix for probesbio-rad,货号1863010微滴发生卡bio-rad,货号1864008ddpcr微滴发生油bio-rad,货号1863005密封条bio-rad,货号1863009微滴分析油bio-rad,货号1863004半裙边96孔板eppendorf,货号30128575微滴发生仪bio-rad,货号1864002封膜仪bio-rad,货号1814000pcr热循环仪bio-rad,货号1851197微滴分析仪bio-rad,货号1864003colo 205细胞系科佰生物,货号cbp-60026引物由生工生物合成探针由生工生物合成核酸片段化酶(kapa frag kit)roche,货号7962495001分析软件bio-rad,quantasoft数字pcr分析软件
77.实施例1
78.在本实施例中,选取一种常见的核酸变异为例对本发明的引物探针组合物及检测体系进行了测试。具体地,采用了egfr 20外显子插入突变为例模拟临床样品来评估了本发
明检测体系的性能。
79.1.样品制备:
80.准备片段化处理的293t细胞系dna样本,经过qubit荧光定量仪进行定量后,稀释到10ng/μl,作为阴性对照的样本。
81.同时准备人工合成的含egfr基因20外显子插入突变(cosm12377)序列的质粒样本,经片段化处理后,使用阴性样本进行稀释混合,作为阳性样本。
82.使用不含任何dna的tirs-edta缓冲液做为空白对照的样本。
83.2.反应体系制备
84.2.1引物探针组合物
85.本发明引物及探针由生工生物工程股份有限公司合成制备而成。其中,引物探针组合物具体序列如表1所示。
86.表1:
[0087][0088]
上述引物探针中,第一正向引物f1(seq id no:1)全长63bp,该引物3’端21个碱基与靶核酸序列互补配对,3’末端的3个碱基为egfr基因20外显子插入突变的扩增决定位点。寡核苷酸f1c-15(seq id no:5)全长15bp,并能与第一正向引物的靶序列结合区的3’末端的15bp互补配对,能够增加f1与靶序列结合的特异性。第二正向引物f2(seq id no:2)全长19bp,第一正向引物f1的5’端的19个碱基与第二正向引物f2(seq id no:3)的碱基序列相同。在第一正向引物f1的5’端第22个碱基至第40个碱基序列与探针p(seq id no:3)的碱基序列相同。在第一正向引物f1对靶核酸进行特异性扩增后,生成的扩增产物带有来自f1引物5’端的碱基序列及其互补序列,然后第二正向引物f2以及探针p可以与对应的模板互补配对,通过f2延伸水解探针p发出荧光信号。内参基因的荧光信号则由内参上游引物rf和内参下游引物rr扩增并水解内参探针rp产生。
[0089]
2.2反应体系
[0090]
pcr反应液中各试剂成分含量如表2所示。
[0091]
表2:
[0092][0093]
2.3反应单元制备
[0094]
将配制完成的pcr反应液采用95℃高温一分钟使双链dna解链成单链,然后迅速降温,使其保持单链状态;
[0095]
将上述解链后的pcr反应液20μl加入到微滴发生卡的样本孔中,然后加入70μl微滴发生油至微滴发生卡的油孔中,最后使用密封条对微滴发生卡进行密封;
[0096]
将制备好的微滴发生卡放入微滴发生器中,开始微滴生成。大约2分钟后,微滴制备完成,取出卡槽,从最上排孔中小心的转移出约40μl的微滴悬浊液至96孔pcr板。
[0097]
3.扩增读取
[0098]
将96孔板进行封膜后,放置于pcr热循环仪中进行pcr扩增。反应体系所使用程序为:95℃预变性10分钟;94℃变性30秒,65℃退火延伸60秒,共进行5个循环;94℃变性30秒,52℃退火延伸60秒,共进行40个循环;98℃灭活10分钟;10℃终止反应。
[0099]
待pcr扩增结束,将96孔板放置于微滴分析仪中选择fam/hex通道进行信号读取。
[0100]
4.分析统计
[0101]
使用quantasoft分析软件对荧光信号的强度和阴阳性判断进行分析,结果如图1所示。
[0102]
图1中,空白对照和阴性对照中没有假阳性信号的产生,即,阴性符合率为100%;阳性样本的检测中信号聚集,阈值划分清晰。可见,本发明的引物探针组合物在核酸检测应用中,具有很高的检测准确度和特异性。
[0103]
实施例2
[0104]
为体现本发明效果,本实施例使用不同长度的寡核苷酸f1c评估对检测特异性的影响。
[0105]
1.样品准备:
[0106]
准备片段化处理的293t细胞系dna样本,经过qubit荧光定量仪进行定量后,稀释
到10ng/μl,作为阴性对照的样本。
[0107]
同时准备人工合成的含egfr基因20外显子插入突变另一突变型别序列(cosm12378)的质粒样本,经片段化处理后,使用阴性样本进行稀释混合,作为阳性样本。
[0108]
2.反应体系制备
[0109]
2.1引物探针组合物
[0110]
引物探针组合物具体序列如下表3所示。
[0111]
表3:
[0112][0113]
上述引物探针中,寡核苷酸f1c-2-12的长度为12bp,并能与第一正向引物(f1-2)的靶序列结合区3’末端的12bp互补配对;寡核苷酸f1c-2-15的长度为15bp,并能与第一正向引物(f1-2)的靶序列结合区3’末端的15bp互补配对;寡核苷酸f1c-2-18的长度为18bp,并能与第一正向引物(f1-2)的靶序列结合区3’末端的18bp互补配对;寡核苷酸f1c-2-21的长度为21bp,并能与第一正向引物(f1-2)的靶序列结合区全长互补配对。
[0114]
2.2反应体系
[0115]
pcr反应液中各试剂成分含量如表4所示。
[0116]
表4:
[0117][0118]
此外,还设置一个对照组:pcr反应液中不含有寡核苷酸f1c。
[0119]
2.3反应单元制备
[0120]
将配制完成的pcr反应液采用95℃高温一分钟使双链dna解链成单链,然后迅速降温,使其保持单链状态;
[0121]
将上述解链后的pcr反应液20μl加入到微滴发生卡的样本孔中,然后加入70μl微滴发生油至微滴发生卡的油孔中,最后使用密封条对微滴发生卡进行密封;
[0122]
将制备好的微滴发生卡放入微滴发生器中,开始微滴生成。大约2分钟后,微滴制备完成,取出卡槽,从最上排孔中小心的转移出约40μl的微滴悬浊液至96孔pcr板。
[0123]
3.扩增读取
[0124]
将96孔板进行封膜后,放置于pcr热循环仪中进行pcr扩增。反应体系所使用程序为:95℃预变性10分钟;94℃变性30秒,65℃退火延伸60秒,共进行5个循环;94℃变性30秒,52℃退火延伸60秒,共进行40个循环;98℃灭活10分钟;10℃终止反应。
[0125]
待pcr扩增结束,将96孔板放置于微滴分析仪中选择fam/hex通道进行信号读取。
[0126]
4.分析统计
[0127]
使用quantasoft分析软件对荧光信号的强度和阴阳性判断进行分析,结果如图2所示。
[0128]
图2中,在不添加寡核苷酸f1c的反应体系中,阴性对照(e07)中有大量假阳性信号;在添加12bp的寡核苷酸f1c-2-12和15bp的寡核苷酸f1c-2-15的反应体系中,阴性对照(d02和d06)中假阳性信号明显减少,而在添加18bp的寡核苷酸f1c-2-18的反应体系中,阴性对照(e01)中假阳性信号基本消失,并且阳性样本(e02)的信号仍然聚集,阈值划分清晰,可以更好的帮助阴阳性判定。然而在添加21bp的寡核苷酸f1c-2-21的反应体系中,虽然阴性对照(e04)中没有假阳性信号,但阳性反应(e05)中的信号同样受到了抑制,导致阈值划分不清晰,难以进行阴阳性判定。可见,寡核苷酸f1c能有效抑制假阳性信号的产生,提高检
测的特异性,同时,特定长度的寡核苷酸f1c还能显著提高检测的准确度。
[0129]
实施例3
[0130]
为了进一步验证本发明引物及方法的效果,本实施例针对另一种基因变异(egfr基因t790m突变)进行了检测。
[0131]
1.样品准备:
[0132]
准备片段化处理的293t细胞系dna样本,经过qubit荧光定量仪进行定量后,稀释到10ng/μl,作为阴性对照的样本。
[0133]
同时准备人工合成的含egfr基因20外显子t790m突变(cosm6240)序列的质粒样本,经片段化处理后,使用阴性样本进行稀释混合,作为阳性样本。
[0134]
使用不含任何dna的tirs-edta缓冲液做为空白对照的样本。
[0135]
2.反应体系制备
[0136]
2.1引物探针组合物
[0137]
引物探针组合物具体序列如下表5所示。
[0138]
表5:
[0139][0140][0141]
引物及探针由生工生物工程股份有限公司合成制备而成。
[0142]
上述引物探针中,第一正向引物f1的靶序列结合区长度为19bp,寡核苷酸f1c的长度为17bp,寡核苷酸f1c的5’端能与第一正向引物f1的靶序列结合区的5’端有9bp的序列互补配对。
[0143]
2.2反应体系
[0144]
pcr反应液中各试剂成分含量如表6所示。
[0145]
表6:
[0146][0147]
此外,还设置一个对照组:pcr反应液中不含有寡核苷酸f1c。
[0148]
2.3反应单元制备
[0149]
与实施例1相同。
[0150]
3.扩增读取
[0151]
将96孔板进行封膜后,放置于pcr热循环仪中进行pcr扩增。所使用程序为:95℃预变性10分钟;94℃变性30秒,56℃退火延伸60秒,共进行48个循环;98℃热处理10分钟;10℃终止反应。
[0152]
待pcr扩增结束,将96孔板放置于微滴分析仪中选择fam/hex通道进行信号读取。
[0153]
4.分析统计
[0154]
使用quantasoft分析软件对荧光信号的强度和阴阳性判断进行分析。结果如图3所示。
[0155]
图3中,在不添加寡核苷酸f1c的反应体系中,阴性对照中有少量假阳性信号;在添加长度为17bp的寡核苷酸f1c(其中9bp能与靶序列结合区互补)的反应体系中,阴性对照中假阳性信号明显减少,基本消失,并且阳性样本的信号仍然聚集,阈值划分清晰,可以更好地进行阴阳性判定。
[0156]
综上,从上述实施例可知,寡核苷酸f1c的存在,能显著降低假阳性信号的产生,可能的原因是:寡核苷酸f1c能竞争性地抑制第一上游引物f1与靶核酸序列的互补配对。进一步地,当寡核苷酸f1c的长度为第一上游引物靶序列结合区长度的45%-90%时,寡核苷酸f1c不仅可以有效的降低阴性对照中的假阳性信号,而且对阳性反应中的靶核酸阳性信号影响较低,或没有影响,使得阈值划分清晰,更有效的帮助阴阳性判定。
[0157]
此外,通过本技术说明书、尤其是具体实施方式中记载的内容,本领域技术人员可以合理预期:本发明的引物探针组合物,不仅适用于egfr 20外显子插入突变或egfr基因t790m突变的检测,而且在egfr的其它变异检测、或者其他基因的变异检测应用方面,也能提高其检测特异性。并且,虽然本技术具体实施方式中采用的是数字pcr的检测方法,但是,本领域技术人员可以合理预期,本发明的引物探针组合物,也适合用于其他pcr的检测,例
如,荧光定量pcr。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1