一种链霉菌来源的新型调控因子及其本源和异源表达工程菌株构建与应用的制作方法
本发明涉及一种调控因子的克隆及其工程菌株的构建与应用,尤其涉及一种链霉菌来源的调控因子及其基因功能验证,并利用该基因构建的本源或异源表达工程菌株及其在促进抗生素生产中的应用,属于生物技术领域。
背景技术:
放线菌积累丰富的天然活性物质。这些活性产物(含抗生素)合成过程中存在庞大而复杂的调控级联系统,主要由全局性的调控因子(高层)和途径专一性的调控因子(低层)组成;它们可以直接或间接控制抗生素的产生水平。高层调控因子具有多样性和多效性,它们不仅可以调控多种次生代谢物的合成,还参与了链霉菌形态分化发育的控制;低层调控因子直接控制特定的抗生素合成酶的转录表达水平。产生这些低层调控因子的基因往往都位于特定抗生素生物合成基因簇中,称为途径专一性调控因子[1];其本身表达受上层调控因子的控制。
途径专一性调控因子根据调控机制主要分为几种类型:(1).sarps家族(streptomycesantibioticregulatoryproteins),链霉菌中广泛存在,序列呈现高度同源性,n端都含有一个与转录调控因子ompr同源的dna结合域,能够识别并结合基因簇中一些特定的启动子区域的特殊位点,激活抗生素生物合成基因的转录;(2).luxr家族,在其n端有atp/adp结合结构域,在c端有与luxr相似的dna结合结构域,其具体调控机制尚不清楚,但luxr家族蛋白在链霉菌中广泛存在并参与抗生素合成调控;在许多细菌中也作为群感效应信号受体蛋白,不排除是通过群感效应系统来调控靶基因的表达。除此之外,在某些生物合成基因簇中还发现有tetr、lysr家族等[2]。
许多新的调控基因编码的调控因子明显参与特定次级代谢途径的调控,但其作用机制尚未阐明,与其它调控蛋白没有序列同源性,美达霉素生物合成基因簇中的一种新型调控因子的编码基因med-orf10(本专利命名)就属于这种情况。抗肿瘤抗生素美达霉素属于芳香聚酮抗生素(pnq家族:pyranonaphthoquinones),由链霉菌am-7161等多种细菌产生。根据同源基因功能研究[3]推测med-orf10可能是调控基因,因其与已知机制的调控因子家族都无任何同源性,推测具有新的调控机制。
对于新型调控因子med-orf10鉴定和机制的揭示将有助于激活放线菌基因簇中大量存在的沉默基因簇,有助于构建放线菌的抗生素高产菌株,开发放线菌合成新天然药物的潜力。
参考文献:
[1]liug,chaterkf,chandrag,niug,tanh.molecularregulationofantibioticbiosynthesisinstreptomyces.microbiolmolbiolrev.2013;77(1):112-143。
[2]王蔚,王慧利,李爱英.链霉菌来源的苯并异色烷醌家族抗生素的生物合成.微生物学报,2012;52(5):541-549。
[3]taguchit,okamotosa,lezhavaa,lia,ochik,ebizukay,ichinosek.possibleinvolvementofactvi-orfaintranscriptionalregulationofactvitailoring-stepgenesforactinorhodinbiosynthesis.femsmicrobiollett.2007;269:234-239。
技术实现要素:
基于利用放线菌基因组挖掘技术开发更多天然活性产物的目标,本发明要解决的问题是从放线菌中鉴定更多参与天然活性产物生物合成的调控因子,从中克隆和鉴定调控因子的编码基因,构建调控因子本源表达工程菌株及其在异源体系中促进抗生素生产的应用。
本发明所述的链霉菌来源的调控因子的编码基因,其特征在于:所述编码基因命名为med-orf10,其核苷酸序列如seqno.1所示;该基因序列来源于链霉菌am-7161(streptomycessp.am-7161),其核苷酸序列由441个碱基组成,编码一个调控因子。
本发明所述的链霉菌来源的调控因子,其特征在于:所述调控因子命名为med-orf10,其氨基酸序列如seqidno.2所示;该序列来源于链霉菌am-7161(streptomycessp.am-7161),其氨基酸序列由146个氨基酸组成,编码的蛋白含有核转运因子ntf-2(nucleartransportorfactor-2)结构域,无其它结构域。
申请人从链霉菌am-7161(streptomycessp.am-7161)基因组上克隆到新型调控因子编码基因med-orf10,位于美达霉素生物合成基因簇中;推测具有调控功能。
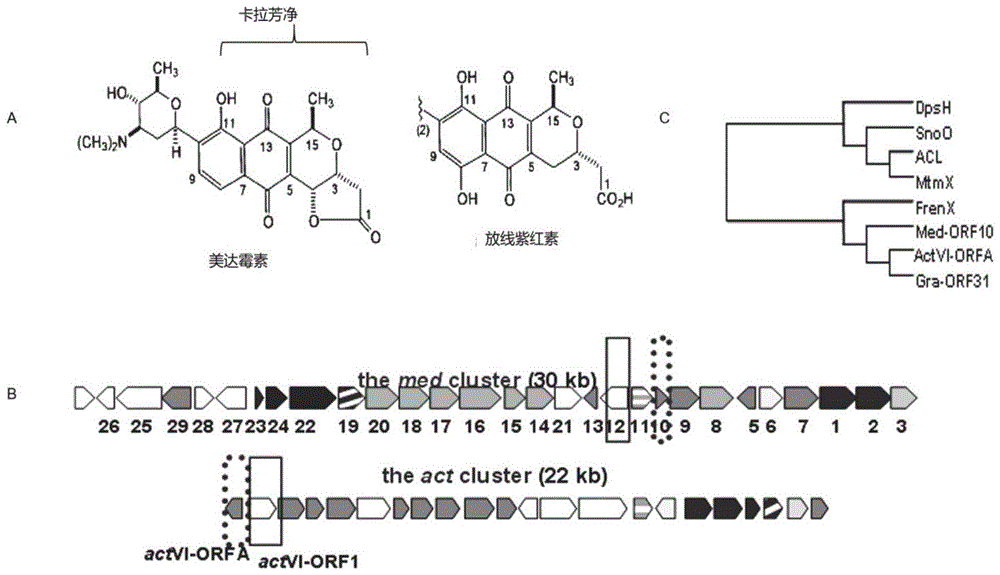
其中,含所述调控因子的野生菌株——链霉菌am-7161是放线菌,该菌株具有产生多种天然活性产物潜力,包括芳香聚酮美达霉素(medermyicn)和卡拉芳净(kalafungin)(美达霉素糖基化前的中间产物),均能以烷化机制抑制多种肿瘤活性,但其生物合成与调控机制未明(图1)。
本发明公开了一种用于检测对抗生素美达霉素合成产量有影响的工程菌,所述工程菌是一种med-orf10缺失工程菌,该菌命名为streptomycescoelicolor/pay64,是在来源于streptomycessp.am-7161的美达霉素基因簇基础上缺失med-orf10后,通过种间接合转移进入streptomycescoelicolorch999细胞内获得;其基因型为streptomycescoelicolorch999,ptst59.1携带med-orf10缺失的美达霉素基因簇导入ch999、卡那霉素抗性(kanamycinresistance)、阿泊拉霉素抗性(apramycinresistance)。
本发明公开了一种med-orf10的异源表达工程菌,其特征在于:所述工程菌命名为streptomycescoelicolorδvi-orfa/med-orf10,是利用streptomycescoelicolorδvi-orfa为出发菌株,通过种间接合转移在其细胞内导入由pij8600携带med-orf10整合插入基因组获得;其基因型为streptomycescoelicolorδvi-orfa、actvi-orfa缺失、pij8600携带med-orf10整合插入δvi-orfa、阿泊拉霉素抗性(apramycinresistance)、硫链丝菌素诱导型启动子。
本发明公开了一种med-orf10的本源表达工程菌,其特征在于:所述工程菌命名为streptomycessp.am-7161/med-orf10,是利用streptomycessp.am-7161为出发菌株,通过种间接合转移在其细胞内导入由pwhm4*携带med-orf10基因获得;其基因型为streptomycessp.am-7161、pwhm4*携带med-orf10导入am-7161、硫链丝菌素抗性(thiostreptonresistance)、组成型启动子perme。
本发明所述med-orf10的异源表达工程菌在提高放线紫红素产量中的应用。
本发明所述med-orf10的本源表达工程菌在提高美达霉素及卡拉芳净产量中的应用。
本发明所述med-orf10表达工程菌在促进和提高放线菌合成抗生素类次级代谢产物中的应用。
实验证实:相对于出发菌株(j1501/△vi-orfa),本发明所述med-orf10的异源表达工程菌中,放线紫红素表达量显著提升。相对于野生型菌株streptomycesspam-7161的产素量,本发明所述med-orf10过量表达菌株streptomycessp.am-7161/med-orf10的美达霉素及卡拉芳净产量有明显的提高。
本发明公开的med-orf10缺失工程菌株以及med-orf10表达工程菌株是首次实现对med-orf10的功能验证和异源表达。实验已经证实:本发明提供的工程菌株具有正调控功能,在表达med-orf10时,在不同菌株中都可以促进相应抗生素的生物合成水平,其应用有望为大量生产天然活性产物提高正效调控基因,在工业应用开发上具有重要价值。
附图说明
图1:pnq家族代表性化合物结构和基因簇及其med-orf10系统发育树分析
a:美达霉素、卡拉芳净、放线紫红素都属于pnq抗生素家族;b:美达霉素基因簇中含有小蛋白基因med-orf10(放线紫红素基因簇中也存在同源基因actvi-orfa);c:med-orf10与其同源基因系统进化分析揭示可能具有调控功能(因为同源基因actvi-orfa前期证明有调控功能)。
图2:med-orf10敲除后美达霉素及中间产物积累比较
a:相对于野生菌株am-7161和ch999/med-cluster,med-orf10敲除(ch999/pay64)导致美达霉素(峰1)产量下降以及中间产物(峰2)积累;b:med-orf10敲除后美达霉素还是有少量积累,说明med-orf10是调控基因;c:峰2分子量显示是中间产物;d:峰1分子量显示是美达霉素。
图3:med-orf10在streptomycescoelicolorδvi-orfa菌中异源表达对放线紫红素合成影响
a:gym固体培养基上培养,δvi-orfa缺失后导致放线紫红素产量下降(蓝色素减少,未加1nnaoh浸泡);b:r4固体培养基基上,δvi-orfa缺失后放线紫红素产量下降(δvi-orfa/pij8600),导入med-orf10导致放线紫红素产量回复(加1nnaoh浸泡,蓝色色素表征放线紫红素产生)(δvi-orfa/med-orf10)。
图4:med-orf10在streptomycesspam-7161菌中本源表达及对美达霉素等化合物合成影响
a:利用表达载体pwhm4*构建表达med-orf10质粒phsl98;b:med-orf10表达质粒的酶切验证(左:从大肠杆菌中提取质粒phsl98酶切验证;右侧:导入链霉菌am-7161后,提取质粒phsl98再导入大肠杆菌做酶切验证);c:med-orf10表达质粒phsl98导入野生菌am-7161液体培养检测对美达霉素(红褐素)产生影响;d:med-orf10表达质粒导入野生菌am-7161液体培养物进行hplc分析,发现促进两种抗生素美达霉素(medermycin)和卡拉方净(kalafungin)的产生。
具体实施方式
下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制。
下述实施例中,所使用的材料、试剂等,如无特殊说明,均从商业途径得到。所述的实验方法如无特殊说明,均为本领域常规方法。
其中:大肠杆菌bw25113(含有red重组酶系统)、大肠杆菌e.coliet12567/puz8002,streptomycescoelicolorch999、表达载体pij8600和表达载体pwhm4*来源于英国johninnes研究所;链霉菌s.coelicolorj1501/△vi-orfa)和链霉菌am-7161(streptomycessp.am-7161)来源于东京大学。
一般性说明:链霉菌am-7161(streptomycessp.am-7161)能合成抗肿瘤物质美达霉素;本发明所述调控因子的编码基因med-orf0存在于链霉菌am-7161中美达霉素基因簇中(基因簇测序并公开);streptomycescoelicolor是常用细菌异源表达宿主,其δvi-a缺失菌株放线紫红素含量急剧降低。本发明构建med-orf0的表达质粒,在这两宿主菌中表达,对不同抗生素产量都有影响。质粒构建中的基因测序由华大基因公司等完成。
r4培养基的配方(每升):酪蛋白氨基酸0.1g、酵母膏1g、葡萄糖10g、l-脯氨酸3g、微量元素溶液2ml、k2so40.2g、mgcl2·6h2o10g、tes5.6g、cacl2·2h2o4g,ph(用koh调节)7.2。
g+y液体培养基的配方(每升):酵母粉5g、可溶性淀粉20g、k2hpo40.5g、mgso4·7h2o0.5g、kno30.5g、feso40.01g、nacl0.5g、琼脂粉20g,ph7.0-7.2。
gym固体培养基的配方(每升):葡萄糖4.0g、酵母膏4.0g、caco32.0g、琼脂粉12g。
实施例1:构建一种med-orf10缺失工程菌,实验比较med-orf10敲除后美达霉素及中间产物积累情况,分析对抗生素美达霉素合成产量的影响
构建med-orf10缺失工程菌,步骤是:
(1)链霉菌am-7161基因组序列分析美达霉素基因簇(med基因簇)中的med-orf10基因序列;
(2)设计引物(med-10a-red:cgcggaccgtccgcgcggcctgacgaagggagaaccatgattccggggatccgtcgacc;med-10b-red:ccacggaagggagcggggggacgggggcggggccggtcatgtaggctggagctgcttc),通过pcr扩增(25个循环g1minat94℃,45sat60℃and1.5minat68℃)得到pcr产物含有med-orf10基因上下游两侧同源片段(50bp)以及阿泊拉霉素抗性基因;
(3)将(2)得到pcr产物导入含有完整med基因簇的大肠杆菌bw25113(预先转入含有完整med基因簇的质粒),同源重组筛选得到关于med-orf10缺失替换的med基因簇(位于质粒pay64上);
(4)将步骤(3)得到的质粒pay64(含有med-orf10缺失替换的med基因簇)电转化进入大肠杆菌e.coliet12567/puz8002,筛选阳性克隆,并提取质粒进行酶切验证;
(5)通过种间结合转移,将含质粒pay64(含有med-orf10缺失替换med基因簇)的et12567/puz8002细胞与异源宿主菌streptomycescoelicolorch999孢子混合,使质粒pay64转移进入后者(ch999),含有med-orf10缺失替换med基因簇整合进入后者细胞基因组上;即获得一种med-orf10缺失工程菌,该菌命名为streptomycescoelicolorch999/pay64,其基因型为streptomycescoelicolorch999,ptst59.1携带med-orf10缺失的美达霉素基因簇导入ch999、卡那霉素抗性(kanamycinresistance)、阿泊拉霉素抗性(apramycinresistance)。
利用hplc检测液体发酵液显示,相对于野生菌株am-7161和ch999/med-cluster,med-orf10敲除(工程菌ch999/pay64)导致美达霉素(峰1)产量下降以及中间产物(峰2)积累(图2a)。
检测还显示:med-orf10敲除后美达霉素还是有少量积累,说明med-orf10是调控基因;图2中c:峰2分子量显示是中间产物;d:峰1分子量显示是美达霉素。
实施例2:streptomycescoelicolorδvi-orfa菌中异源表达med-orf10,分析对抗生素合成的影响。
(1)med-orf10基因克隆。
以链霉菌am-7161总dna为模板pcr扩增med-orf10,引物序列如下:
med10a-pij:ggaattccatatgtccacccaccgagtc;
med10b-pij:5'-cgggatccggtcacgattccggcaggtg。
pcr产物med-orf10的核苷酸序列如seqno.1所示。
catatgt为ndei酶切位点;ggatcc为bamhi酶切位点。pcr产物与表达载体pij8600通过双酶切后连接。
实验表明:酶切验证获得正确的med-orf10表达质粒。
(2)med-orf10表达质粒导入streptomycescoelicolor
将酶切验证正确的质粒导入e.coliet12567/puz8002;然后进行大肠杆菌(et12567/puz8002/med-orf0)与链霉菌(s.coelicolorj1501/△vi-orfa)之间的属间接合转移。获得工程菌,命名为s.coelicolorj1501/△vi-orfa/med-orf10,其基因型为streptomycescoelicolorδvi-orfa、actvi-orfa缺失、pij8600携带med-orf10整合插入δvi-orfa基因组上、阿泊拉霉素抗性(apramycinresistance)、硫链丝菌素诱导型启动子。
实验表明:表达质粒导入了大肠杆菌e.coliet12567/puz8002,可以获得无甲基化修饰质粒dna;在导入后续的链霉菌宿主时,可以避免宿主菌的对外源甲基化dna的限制。
(3)med-orf10表达提升streptomycescoelicolor放线紫红素产量
工程菌streptomycescolicolorj1501/△vi-orfa/med-orf10在r4培养基上,添加6.25μg/ml硫链丝菌素诱导med-orf10的表达。5天后在菌落表面用1nnaoh处理,表征蓝色放线紫红素的积累。
实验表明:相对于出发菌株(j1501/△vi-orfa),本发明获得的异源表达工程菌中,放线紫红素表达量显著提升。出发菌株是野生菌株中敲掉同源基因actvi-orfa,导致放线紫红素产量下降;种间互补表明med-orf10与同源基因actvi-orfa功能相似,都具有调控功能(图3)。
实施例3:在streptomycesspam-7161菌中本源表达med-orf10对抗生素产量的影响分析
(1)构建med-orf10表达质粒
以链霉菌am-7161总dna为模板pcr扩增med-orf10,引物序列如下:
med-10a:5'-cgggatcccgggagaaccatgtccacc-3';
med-10b:5'-cggaattccggtcacgattccggcag-3'。
ggatcc为bamhi酶切位点;gaattc为ecori酶切位点。pcr产物与表达载体pwhm4*通过双酶切后连接,构建表达med-orf10质粒,命名为phsl98。提取质粒双酶切验证,图4a-b表明质粒构建正确。
(2)在streptomycesspam-7161菌中导入med-orf10表达质粒,构建工程菌
将构建好的质粒phsl98通过原生质体转化导入产美达霉素的野生型菌株am-7161中,利用硫链丝菌素进行筛选和复筛。转化子在g+y液体培养基中进行液体培养,培养24h后富集液体培养物的菌丝体,提取可能的工程菌株基因组总dna转化进入大肠杆菌dh5α,由于phsl98能在大肠杆菌内自主复制且能利用氨苄抗性进行筛选,将抗性平板上生长的转化子挑取单菌落在lb液体培养基中进行液体培养,提质粒酶切验证比较此时提取的质粒phsl98与原先来自大肠杆菌的质粒是否相同,从而判断phsl98是否已经成功转化进入链霉菌am-7161中(见图4b)。
实验表明:phsl98已经成功转化进入链霉菌am-7161中,所得工程菌命名为:streptomycessp.am-7161/phsl98/med-orf10。
(3)在streptomycesspam-7161中med-orf10过量表达促进美达霉素及卡拉芳净合成
本实验将验证正确的过量表达菌株streptomycessp.am-7161/phsl98/med-orf10及野生型菌株am-7161孢子悬液在r4固体平板上的产素量进行初步分析,并在液体培养基中进行培养,比较产素颜色差异;液体发酵液粗提物进行lcms分析次生代谢产物的变化。
在r4固体发酵培养基中,美达霉素产生和分泌会导致培养基呈现出红褐色。
实验表明:r4固体培养条件下,相对于野生型菌株的产素量,med-orf10过量表达菌株streptomycessp.am-7161/phsl98/med-orf10的产素量有明显的提高;在产素培养基r4中进行液体发酵;streptomycessp.am-7161/phsl98/med-orf10在各时期的产素量(红褐色表征美达霉素产生)明显大于野生型菌株(见图4c);hplc分析液体发酵产物,由图4d看出,野生型菌株含有多种化合物,结合ms的结果,判断在约13min处为美达霉素,在约17.5min处为卡拉方净。streptomycessp.am-7161/phsl98/med-orf10也产生这两个峰。对美达霉素和卡拉方净对应的峰的峰面积进行分析,过量表达菌株中美达霉素的产量增加了约2.3倍,而卡拉方净的产量大约增加了6倍。
序列表
<110>山东大学
<120>一种链霉菌来源的新型调控因子及其本源和异源表达工程菌株构建与应用
<141>2020-09-23
<160>2
<210>1
<211>441
<212>dna
<213>链霉菌(streptomycessp.)
<221>链霉菌来源的调控因子的编码基因med-orf10的核苷酸序列
<222>(1)…(441)
<400>1
atgtccacccaccgagtccagggagacctgtacagccgggtgcagcagttccacgcggcg60
cagatgcaggcgctcgacagcggccggttcgacgagtacgccgacaccttcaccgaggac120
ggcgagttccggcactcgcccggcaggccggccgcccacacccgggccggcatcgccaag180
gagctcgcggcgttccaccaggagcgcttcgccggcgaacccgtccagcgccgccactgg240
ttcaacatgctgaacgtccaggagcaggccgacggcaccatccacgccaccttctacgtc300
ctggcgctgctgacccgggagggcgagcgcgtccccgagatcgcccccagctgcctggtc360
cgggacgtcctcgtcgaggaggacggccgcctcctcacccgctcccgccgggtggagcac420
gaccacctgccggaatcgtga441
<210>2
<211>146
<212>prt
<213>链霉菌(streptomycessp.)
<221>链霉菌来源的调控因子med-orf10的氨基酸序列
<222>(1)…(146)
<400>2
msthrvqgdlysrvqqfhaaqmqaldsgrfdeyadtftedgefrhspgrpaahtragiak60
elaafhqerfagepvqrrhwfnmlnvqeqadgtihatfyvlalltregervpeiapsclv120
rdvlveedgrlltrsrrvehdhlpes146
- 还没有人留言评论。精彩留言会获得点赞!