手性双膦骨架化合物、其制备方法及其应用
1.本发明具体涉及一种手性双膦骨架类化合物、其制备方法及其应用。
背景技术:
2.在金属参与的不对称催化合成法中,手性配体扮演着极其重要的角色。因此,近四十年来人们一直都致力于开发高活性,高选择性的手性配体。目前为止,得到广泛应用的具有所谓“优势结构”(privileged structures)的手性配体(具体参考文献s.-f.zhu,q.-l.zhou,in privileged chiral ligands and catalysts,ed.:q.-l.zhou,wiley-vch,weinheim,2011,pp.137-170.)。代表性的配体骨架有binol、binap、bisoxazoline、salen、duphos、taddol、和cinchona alkaloid等。以这些“优势结构”的配体骨架为基础,可以延伸出众多手性配体。实验结果表明,绝大部分配体在许多金属催化的不对称催反应中都能表现出优异的对映选择性。但是,随着整个不对称催化反应以及手性药物的开发进程,科学家们发现还有大量的不对称反应缺少有效的手性配体。因此,进一步发展具有新颖骨架的手性配体,特别是开发一些价廉易得高效的手性配体,仍然是非常重要而极具挑战性的课题之一。氧杂蒽骨架因其特殊的分子结构,可以产生较大的咬合角且难以发生消旋化而具有极大的潜在应用价值(casey,c.p.;whiteker,g.t.isr.j.chem.1990,30,299)。基于上述特点,c2-对称性的氧杂蒽骨架是一类比较理想的手性配体骨架。
3.过去几十年来,虽然以氧杂蒽为骨架的消旋双膦配体有了很大的发展,并被成功应用于众多的化学反应中。但是,以氧杂蒽为骨架的手性双膦配体却很少被提及。主要原因在于手性三价膦的合成和分离比较困难。如何能简单、快速获得光学纯的手性双膦配体也是合成手性配体中的一大难题。消旋产物的拆分虽然可以得到一定量的手性双膦配体,但是其繁琐的过程,远远低于50%的产率等缺陷,势必对后期的合成造成更大的困难,也会进一步限制其在工业化上的生产。于是如何高效的合成手性双膦配体,尤其是具有c2对称性的手性双膦配体,也将是我们的研究焦点。
4.因此,发展一种高效不对称催化、不使用手性拆分试剂、无须进行手性拆分步骤、方法简单、后处理简便、经济环保、产物收率高、产物光学纯度和化学纯度高的制备手性双膦配体骨架化合物的方法是本领域亟待解决的问题。
5.手性烯丙基含硅化合物是一类重要的有机化合物。由于底物为较难识别的潜手性底物,所以对于简单1,3-二取代烯烃的高对映选择性硅氢化反应一般很难实现。目前已有些关于1,3-二取代烯烃的不对称硅氢化的报告中该类反应主要集中在铑,钯,铱等金属。贵金属的价格昂贵和回收困难导致难以实现大规模工业化应用的问题。其次,文献中该类反应主要集中在单膦配体和多齿配体,该类配体在1,3-二取代烯烃的硅氢化反应中底物适用范围还较窄。因此,开发价廉易得、结构简单、新颖的手性膦配体,高区域选择性、高对映选择性的催化1,3二烯的不对称硅氢化仍然是今后研究的重要内容。
技术实现要素:
6.本发明要解决的技术问题是为了克服现有技术中以氧杂蒽为骨架的手性双膦配体骨架化合物的结构单一而提供了一种手性双膦骨架化合物、其制备方法及其应用。本发明制备方法不需要采用昂贵的手性起始原料或手性拆分试剂、不需要进行手性拆分步骤、原料及工艺成本低、经济环保性高的优点。本发明的手性双膦配体制得的过渡金属催化的不对称反应的催化剂,催化效果显著,产物收率较好,产物ee值较高。
7.本发明提供了一种如式i所示的手性双膦骨架化合物,
[0008][0009]
其中,r1、r2、r3和r4独立地为c1~c
10
烷基、c3~c
10
环烷基、c1~c4烷氧基、c6~c
10
芳基或“被一个或多个r7取代的c6~c
10
芳基”;当有多个r7取代时,取代基相同或者不同;r7为c1~c6烷基、c1~c6烷氧基或c1~c6全氟烷基;r1与r2不同,r3与r4不同。
[0010]
在某一方案中,所述的如式i所示的手性双膦骨架化合物里的某些取代基可进一步具有下述的定义,下文未涉及的取代基的定义如上任一方案所述(以下简称为“在某一方案中”):
[0011]
当r7为c1~c6烷基时,所述的c1~c6烷基为c1~c4烷基,所述的c1~c4烷基可为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,例如甲基、异丙基,叔丁基。
[0012]
在某一方案中,当r7为c1~c6全氟烷基时,所述的c1~c6全氟烷基为c1~c4全氟烷基,所述的c1~c4烷基可为全氟甲基、全氟乙基、全氟正丙基、全氟异丙基、全氟正丁基、全氟异丁基或全氟叔丁基,例如三氟甲基(全氟甲基)。
[0013]
在某一方案中,当r7为c1~c6烷氧基时,所述的c1~c6烷氧基为c1~c4烷氧基,所述的c1~c4烷基可为甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基或叔丁氧基,例如甲氧基。
[0014]
在某一方案中,当r1为c1~c
10
烷基时,所述的c1~c
10
烷基为c1~c6烷基,所述的c1~c6烷基可为c1~c4烷基;例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,还例如甲基、异丙基,叔丁基。
[0015]
在某一方案中,当r2为c1~c
10
烷基时,所述的c1~c
10
烷基为c1~c6烷基,所述的c1~c6烷基可为c1~c4烷基;例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,还例如甲基、异丙基,叔丁基。
[0016]
在某一方案中,当r3为c1~c
10
烷基时,所述的c1~c
10
烷基为c1~c6烷基,所述的c1~c6烷基可为c1~c4烷基;例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,还例如甲基、异丙基,叔丁基。
[0017]
在某一方案中,当r4为c1~c
10
烷基时,所述的c1~c
10
烷基为c1~c6烷基,所述的c1~c6烷基可为c1~c4烷基;例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,还例如甲基、异丙基,叔丁基。
[0018]
在某一方案中,当r1为c6~c
10
芳基时,所述的c6~c
10
芳基为苯基。
[0019]
在某一方案中,当r2为c6~c
10
芳基时,所述的c6~c
10
芳基为苯基。
[0020]
在某一方案中,当r3为c6~c
10
芳基时,所述的c6~c
10
芳基为苯基。
[0021]
在某一方案中,当r4为c6~c
10
芳基时,所述的c6~c
10
芳基为苯基。
[0022]
在某一方案中,当r1为“被一个或多个r7取代的c6~c
10
芳基”时,所述的c6~c
10
芳基为苯基。
[0023]
在某一方案中,当r2为“被一个或多个r7取代的c6~c
10
芳基”时,所述的c6~c
10
芳基为苯基。
[0024]
在某一方案中,当r3为“被一个或多个r7取代的c6~c
10
芳基”时,所述的c6~c
10
芳基为苯基。
[0025]
在某一方案中,当r4为“被一个或多个r7取代的c6~c
10
芳基”时,所述的c6~c
10
芳基为苯基。
[0026]
在某一方案中,r1、r2、r3和r4独立地为c1~c6烷基、苯基或“被一个或多个r7取代的苯基”,r1与r4相同,r2与r3相同;r1与r2不同;当有多个r7取代时,取代基相同或者不同;r7为c1~c4烷基、c1~c4烷氧基或c1~c4全氟烷基。
[0027]
在某一方案中,r1为c1~c4烷基、苯基或“被一个或多个r7取代的c6~c
10
芳基”。
[0028]
在某一方案中,r2为c1~c4烷基、苯基或“被一个或多个r7取代的c6~c
10
芳基”,优选地为c1~c4烷基,更优选地为甲基。
[0029]
在某一方案中,r3为c1~c4烷基、苯基或“被一个或多个r7取代的c6~c
10
芳基”,优选地为c1~c4烷基,更优选地为甲基。
[0030]
在某一方案中,r4为c1~c4烷基、苯基或“被一个或多个r7取代的c6~c
10
芳基”。
[0031]
在某一方案中,r1与r4相同。
[0032]
在某一方案中,r2与r3相同。
[0033]
在某一方案中,r7为c1~c4烷基、c1~c4烷氧基或c1~c4全氟烷基。
[0034]
在某一方案中,当r7为c1~c6全氟烷基时,所述c1~c6全氟烷基位于磷元素的对位。
[0035]
在某一方案中,当r7为c1~c6烷基时,所述c1~c6烷基独立地位于磷元素的邻位、对位和间位,取代个数为1或2。
[0036]
在某一方案中,当r7为c1~c6烷氧基时,所述c1~c6烷氧基位于磷元素的对位。
[0037]
在某一方案中,当r7为甲基时,所述的甲基独立地位于磷元素的邻位。
[0038]
在某一方案中,当r7为异丙基时,所述的异丙基位于磷元素的邻位。
[0039]
在某一方案中,当r7为叔丁基时,所述的叔丁基独立地位于磷元素的间位。
[0040]
在某一方案中,当r7为三氟甲基时,所述的三氟甲基位于磷元素的对位。
[0041]
在某一方案中,当r7为甲氧基时,所述的甲氧基位于磷元素的对位。
[0042]
本发明一种优选的实施方式中,r2和r3为甲基,r1和r4独立地为苯基或“被一个或多个r7取代的苯基”,当有多个r7取代时,取代基相同:r7独立地为甲基、叔丁基、异丙基、甲氧基或三氟甲基;所述的一个或多个为一个或两个;r1与r4相同。
[0043]
本发明一种优选的实施方式中,如式i所示的手性双膦骨架化合物的结构如下任一所示:
[0044]
或其对映异构体、或其对映异构体、或其对映异构体、或其对映异构体、或其对映异构体或其对映异构体、或其对映异构体。
[0045]
本发明提供了一种如式i所示的手性双膦骨架化合物在催化烯烃的不对称反应中作为催化剂配体的应用;
[0046]
所述的应用可为不对称硅氢化。
[0047]
在本发明某一方案中,所述的不对称硅氢化反应包括如下步骤:
[0048]
在溶剂中,在所述的如式i所示的化合物和钴盐催化剂存在下,将含结构片段的1,3-二烯类化合物y与含结构片段的化合物x进行不对称硅氢化反应,得
到含结构片段的化合物vi即可。
[0049]
其中,所述的不对称硅氢化反应的条件和操作可为本领域该类反应中常规的条件和操作;本发明中优选如下:
[0050]
所述的不对称硅氢化反应在气体保护条件下进行,较佳地,所述的气体为氮气或氩气。
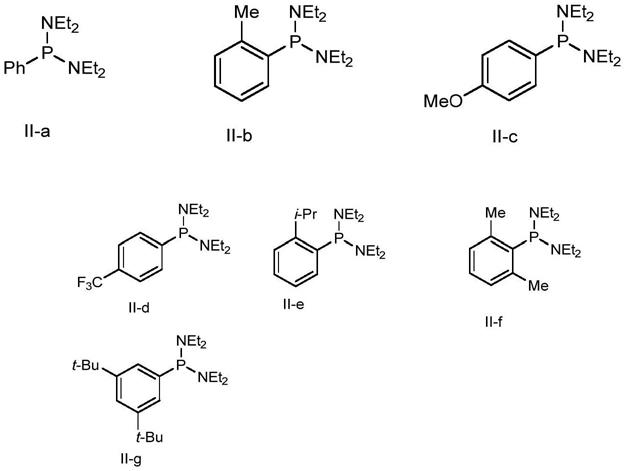
[0051]
所述的不对称硅氢化反应可在手套箱中实施。
[0052]
所述的钴盐催化剂可为co(acac)2。
[0053]
所述的钴盐催化剂与所述的1,3-二烯类化合物y的摩尔比可为1:(1~100),例如1:50。
[0054]
所述的如式i所示的化合物与所述的1,3-二烯类化合物y的摩尔比为1:(1~100),例如1:50。
[0055]
所述的化合物x与所述的1,3-二烯类化合物y的摩尔比可为(0.2~5):1;又例如(1~1.5):1;还例如1.25:1。
[0056]
所述的溶剂为芳烃类溶剂、卤代烃类溶剂、醚类溶剂、醇类溶剂、酰胺类溶剂和亚砜类溶剂中的一种或多种,例如醚类溶剂,还例如四氢呋喃。
[0057]
当所述的如式i所示的化合物为s,s构型的时候,得到含结构片段的化合物vi;较佳地,所述的化合物vi为
[0058]
当所述的如式i所示的化合物为r,r构型的时候,得到含结构片段的化合物vi;较佳地,所述的化合物vi为
[0059]
在本发明的某一优选方案中,所述的化合物x可为苯基硅烷(phsih3)。
[0060]
在本发明的某一优选方案中,所述的含结构片段的1,3-二烯类化合
物y可为如式y'所示的化合物其中,r5为苯基或“被一个或多个r
5a
取代的苯基”;r6为氢或c1~c6烷基;当有多个r
5a
取代时,取代基相同或者不同;r
5a
为c1~c6烷基。
[0061]
本发明一种优选的实施方式中,当r6为c1~c6烷基时,所述的c1~c6烷基为c1~c4烷基;例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,例如甲基、异丙基,叔丁基。
[0062]
本发明一种优选的实施方式中,当r
5a
为c1~c6烷基时,所述的c1~c6烷基为c1~c4烷基;例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,例如甲基、异丙基,叔丁基。
[0063]
本发明一种优选的实施方式中,所述的如式y'所示的化合物为以下任一结构:
[0064]
本发明一种优选的实施方式中,当如式vii所示的1,3二烯为所述的硅烷为苯基硅烷(phsih3),所述的如式i所示化合物为时;所述的不对称硅氢化的产物为
[0065]
本发明一种优选的实施方式中,当如式vii所示的1,3二烯为所述的如式i所示化合物为所述的硅烷为苯基硅烷(phsih3)时;
所述的不对称硅氢化的产物为
[0066]
本发明提供了一种如式i所示的手性双膦骨架化合物的制备方法,其包括以下步骤:
[0067]
步骤1、溶剂中,将如式v和式v’所示的手性膦化合物,在1,4-二氮杂二环〔2.2.2〕辛烷(dabco)存在下,进行脱硼反应,得脱硼反应液;
[0068]
步骤2、在烷基锂试剂和四甲基乙二胺(tmeda)存在下,将步骤1中得到的脱硼反应液与如式m所示的氧杂蒽化合物进行偶联反应,得到如式i所示的手性双膦骨架化合物即可,其中,r1、r2、r3和r4的定义与前述定义相同,且r1与r4相同,r2与r3相同;r8为c1~c6烷基。
[0069]
本发明一种优选的实施方式中,r8中,所述的c1~c6烷基为c1~c4烷基;例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,例如甲基。
[0070]
本发明一种优选的实施方式中,所述的脱硼反应的反应温度为20℃~50℃;例如40℃。
[0071]
本发明一种优选的实施方式中,所述的脱硼反应的溶剂为本领域常规非极性溶剂,例如烷烃类溶剂,还例如正己烷。
[0072]
本发明一种优选的实施方式中,所述的如式v所示的手性膦化合物与dabco的摩尔用量比为本领域常规用量比,优选为1:(0.5-5);更优选1:2。
[0073]
本发明一种优选的实施方式中,所述的偶联反应的溶剂为芳烃类溶剂、卤代烃类溶剂、醚类溶剂、醇类溶剂、酰胺类溶剂和亚砜类溶剂中的一种或多种;例如醚类溶剂;还例如四氢呋喃。
[0074]
本发明一种优选的实施方式中,所述烷基锂试剂为本领域常规烷基锂试剂,例如正丁基锂,较佳地为2.0m正丁基锂己烷溶液。
[0075]
本发明一种优选的实施方式中,所述的偶联反应的反应温度为-78℃~30℃;例如-45℃。
[0076]
本发明一种优选的实施方式中,所述的如式v所示的手性膦化合物和如式m所示的氧杂蒽化合物的摩尔用量比为本领域常规用量比,优选为(1-4):1;更优选为3:1。
[0077]
本发明一种优选的实施方式中,所述的如式v所示的手性膦化合物和tmeda的摩尔用量比为本领域常规用量比,优选为1:(0.5-2),更优选为1:1。
[0078]
本发明一种优选的实施方式中,所述的如式v所示的手性膦化合物和烷基锂的摩尔用量比为本领域常规用量比;优选为1:(0.5-2),更优选为1:1。
[0079]
本发明一种优选的实施方式中,较佳地,步骤步骤2在烷基锂试剂和四甲基乙二胺(tmeda)存在下,将步骤1中得到的的脱硼反应液与如式m所示的氧杂蒽化合物进行偶联反应,得到如式i所示的手性双膦骨架化合物即可,其中,r1、r2、r3和r4的定义与前述定义相同,且r1与r4相同,r2与r3相同;r8为c1~c6烷基)中的偶联反应还包括后处理,所述的后处理可为本领域常规的后处理,例如包括如下步骤:用饱和氯化铵溶液淬灭反应,经萃取、干燥、柱层析。
[0080]
本发明某一方案中,如式i所示的手性双膦骨架化合物的制备方法,其还包括以下步骤:
[0081]
将如式iv所示的手性化合物与r8oh,在浓硫酸作用下,进行如下所示的醇解反应,得到所述的如式v所示的手性膦化合物,r1和r2的定义与前述相同,r8为c1~c6烷基,
[0082][0083]
本发明一种优选的实施方式中,r8中,所述的c1~c6烷基为c1~c4烷基;例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,例如甲基。
[0084]
本发明一种优选的实施方式中,所述的醇解反应的反应温度可为-20℃~40℃;优选为25℃。
[0085]
本发明一种优选的实施方式中,所述的浓硫酸可为质量分数98%的浓硫酸。
[0086]
本发明一种优选的实施方式中,所述的如式iv所示的手性化合物和浓硫酸的摩尔用量比为(0.5~2):1;优选为1:1。
[0087]
本发明一种优选的实施方式中,所述的如式iv所示的手性化合物与r8oh的摩尔比体积比为1:(2~10)mol/l;优选为1:5mol/l。
[0088]
本发明一种优选的实施方式中,较佳地,所述的如式iv所示的手性化合物与r8oh混合后再滴加浓硫酸,更佳地,滴加浓硫酸的温度为0℃。
[0089]
本发明某一方案中,如式i所示的手性双膦骨架化合物的制备方法,其还包括以下步骤:
[0090]
在溶剂中,将如式iii所示的手性化合物与锂试剂进行如下所示的开环反应,得到所述的如式iv所示的化合物,
[0091][0092]
其中,r1和r2的定义与前述相同。
[0093]
本发明一种优选的实施方式中,所述的锂试剂为正丁基锂、仲丁基锂、叔丁基锂、甲基锂和苯基锂等中的一种或多种。
[0094]
本发明一种优选的实施方式中,所述反应的溶剂为芳烃类溶剂、卤代烃类溶剂、醚类溶剂、醇类溶剂、酰胺类溶剂和亚砜类溶剂中的一种或多种,例如醚类溶剂,还例如四氢呋喃。
[0095]
本发明一种优选的实施方式中,所述反应的温度为-80℃~100℃,例如-25~25℃。
[0096]
本发明一种优选的实施方式中,所述的开环反应可采用本领域常规的监测方法(例如hplc或tlc)进行监测,所述反应的时间为0.1~48小时,例如,2小时。
[0097]
本发明一种优选的实施方式中,如式iii所示的手性化合物和锂试剂的摩尔用量比为本领域常规用量比,例如1:3.2。
[0098]
本发明一种优选的实施方式中,所述的开环反应的后处理包括如下步骤:饱和氯化铵溶液淬灭,经萃取、干燥后柱层析。
[0099]
本发明某一方案中,如式i所示的手性双膦骨架化合物的制备方法,其还包括以下步骤:
[0100]
(i)溶剂中,将如式ii所示的化合物与(1s,2r)-(
–
)-顺式-1-氨基-2-茚醇进行环化反应,得到反应液;
[0101]
(ii)将步骤(i)中得到的反应液与硼烷二甲硫醚络合物进行硼化反应,得到所述的如式iii所示的化合物即可,
[0102]
其中,r1的定义与前述相同。
[0103]
本发明一种优选的实施方式中,所述的环化反应的溶剂为芳烃类溶剂、卤代烃类溶剂、醚类溶剂、醇类溶剂、酰胺类溶剂和亚砜类溶剂中的一种或多种;例如芳烃类溶剂,还例如甲苯。
[0104]
本发明一种优选的实施方式中,所述的如式ii所示的化合物和(1s,2r)-(
–
)-顺式-1-氨基-2-茚醇的摩尔比为本领域常规用摩尔比,例如1:1。
[0105]
本发明一种优选的实施方式中,所述环化反应的反应温度为50~150℃,例如80~120℃,还例如10~120℃。
[0106]
本发明一种优选的实施方式中,所述的如式ii所示的化合物和硼烷二甲硫醚络合
物的摩尔比为本领域常规摩尔比,例如1:4。
[0107]
本发明一种优选的实施方式中,所述硼化反应的反应温度为0~150℃,例如110℃。
[0108]
本发明一种优选的实施方式中,所述的硼化反应的后处理包括如下步骤:淬灭,萃取、干燥后,柱层析。
[0109]
本发明提供了一种如式v所示的手性化合物的制备方法,其包括以下步骤:将如式iv所示的手性化合物与r8oh,在浓硫酸作用下,进行如下所示的醇解反应得到如式v所示的手性膦化合物,
[0110][0111]
其中,r1和r2的定义与前述相同,r8为c1~c6烷基。
[0112]
本发明一种优选的实施方式中,所述的如式v所示的手性化合物的制备方法的反应条件及操作与前述醇解反应条件相同。
[0113]
本发明提供了一种如式iv所示的手性化合物的制备方法,包括以下步骤:
[0114]
溶剂中,将如式iii所示的手性化合物与锂试剂进行如下所示的开环反应,得到如式i所示的化合物,r1和r2的定义与前述相同,
[0115][0116]
本发明一种优选的实施方式中,所述的如式iv所示的手性化合物的制备方法反的应条件及操作与前述的开环反应条件相同。
[0117]
本发明提供了一种如式iii所示的手性化合物的制备方法,包括以下步骤:(i)溶剂中,将如式ii所示的化合物与(1s,2r)-(
–
)-顺式-1-氨基-2-茚醇进行环化反应,得到反应液;
[0118]
(ii)将步骤(i)中得到的反应液与硼烷二甲硫醚络合物进行硼化反应,得到所述的如式iii所示的化合物即可,
[0119]
其中,r1的定义与前述相同。
[0120]
本发明一种优选的实施方式中,所述的如式iii所示的手性化合物的制备方法反的条件及操作与前述的环化反应和硼化反应相同。
[0121]
本发明提供了一种如式iv所示的手性化合物,
[0122][0123]
其中,r1和r2的定义与前述相同。
[0124]
本发明提供了一种如式iv所示的手性化合物的结构如下任一所示:或其对应异构体、或其对应异构体、或其对应异构体、或其对应异构体、或其对应异构体、或其对应异构体。
[0125]
本发明提供了一种如式iii所示的手性化合物,其中,r1的定义与前述相同。
[0126]
本发明提供了一种如式iii所示的手性化合物的结构如下任一所示:
[0127]
或其对应异构体、或其对应异构体、
或其对应异构体、或其对应异构体、或其对应异构体、或其对应异构体、
[0128]
在本说明书中,可由本领域技术人员选择基团及其取代基以提供稳定的结构部分和化合物。当通过从左向右书写的常规化学式描述取代基时,该取代基也同样包括从右向左书写结构式时所得到的在化学上等同的取代基。
[0129]
在本文中定义的某些化学基团前面通过简化符号来表示该基团中存在的碳原子总数。例如,c
1-c6烷基是指具有总共1、2、3、4、5或6个碳原子的如下文所定义烷基。简化符号中的碳原子总数不包括可能存在于所述基团的取代基中的碳。
[0130]
在本文中,取代基中定义的数值范围如1-4、1至3等表明该范围内的整数,如1-4为1、2、3、4。
[0131]
除前述以外,当用于本技术的说明书及权利要求书中时,除非另外特别指明,否则以下术语具有如下所示的含义。
[0132]
术语“一种(个)或多种(个)”或“一种(个)或两种(个)以上”是指即1、2、3、4、5、6、7、8、9或更多。
[0133]
术语“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0134]
术语“被取代的”是指特定原子上的任意一个或多个氢原子被取代基取代,包括重氢和氢的变体,只要特定原子的价态是正常的并且取代后的化合物是稳定的。
[0135]
一般而言,术语“取代的”表示所给结构中的一个或多个氢原子被具体取代基所取代。进一步地,当该基团被1个以上所述取代基取代时,所述取代基之间是相互独立,即,所述的1个以上的取代基可以是互不相同的,也可以是相同的。除非其他方面表明,一个取代基团可以在被取代基团的各个可取代的位置进行取代。当所给出的结构式中不只一个位置能被选自具体基团的一个或多个取代基所取代,那么取代基可以相同或不同地在各个位置取代。
[0136]
术语“环烷基”是指仅由碳原子组成的饱和的单环基团,优选具有3-7个环碳原子、
更优选3-6个碳原子的饱和的单环基团,例如环丙基、环丁基、环戊基或环己基。
[0137]
当所列举的基团中没有明确指明其具有取代基时,这种基团仅指未被取代。例如当“c1~c4烷基”前没有“取代或未取代的”的限定时,仅指“c1~c4烷基”本身或“未取代的c1~c4烷基”。
[0138]
在本发明的各部分,描述了连接取代基。当该结构清楚地需要连接基团时,针对该基团所列举的马库什变量应理解为连接基团。例如,如果该结构需要连接基团并且针对该变量的马库什基团定义列举了“烷基”,则应该理解,该“烷基”代表连接的亚烷基基团。
[0139]
在一些具体的结构中,当烷基基团清楚地表示为连接基团时,则该烷基基团代表连接的亚烷基基团,例如,基团“卤代-c1~c6烷基”中的c
1-c6烷基应当理解为c1~c6亚烷基。
[0140]
本文中,术语“芳基”是指任何稳定的一个或多个环中至少一个环是芳香环。上述芳基单元的实例包括苯基、萘基、四氢萘基、2,3-二氢化茚基、联苯基、菲基或者蒽基基。
[0141]
除非另有规定,本文使用的所有技术术语和科学术语具有要求保护主题所属领域的标准含义。倘若对于某术语存在多个定义,则以本文定义为准。
[0142]
除非另有说明,本发明采用质谱、元素分析的传统方法,各步骤和条件可参照本领域常规的操作步骤和条件。
[0143]
除非另有指明,本发明采用分析化学、有机合成化学和光学的标准命名及标准实验室步骤和技术。在某些情况下,标准技术被用于化学合成、化学分析、发光器件性能检测。
[0144]
另外,需要说明的是,除非以其他方式明确指出,在本发明中所采用的描述方式
“…
独立地为”应做广义理解,是指所描述的各个个体之间是相互独立的,可以独立地为相同或不同的具体基团。更详细地,描述方式
“…
独立地为”既可以是指在不同基团中,相同符号之间所表达的具体选项之间互相不影响;也可以表示在相同的基团中,相同符号之间所表达的具体选项之间互相不影响。
[0145]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0146]
本发明所用试剂和原料均市售可得。
[0147]
本发明的积极进步效果在于:
[0148]
本发明的手性双膦配体制得的过渡金属催化剂在催化对称反应时,催化效果显著,产物收率较好,产物er值较高。本发明的以氧杂蒽为骨架的手性双膦配体化合物的制备方法,不需采用手性起始原料或手性拆分试剂、无须进行手性拆分步骤、方法简单、后处理简便、经济环保、产物收率高、产物光学纯度和化学纯度高。
附图说明
[0149]
图1为化合物i-b的单晶图。
具体实施方式
[0150]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0151]
本发明中,按照本领域常识,dr值表示非对映异构体之间的摩尔比值。例如,若非
对映异构体为顺反异构体,且非对映异构体中反式构型化合物与顺式构型化合物的摩尔量大,则dr值=anti/syn*100%,即dr值为非对映异构体中反式构型化合物与顺式构型化合物的摩尔比值;反之亦然。
[0152]
本发明中,按照本领域常识,ee值表示对映体过量。例如,若一对对映异构体分别为r构型和s构型,且r构型化合物摩尔量大于s构型化合物,则ee值=(r-s)/(r+s)*100%,即两个化合物的摩尔量的差值与两个化合物的摩尔量之和的比值;反之亦然。
[0153]
以下实施例中,若无特殊说明,收率或产率均指分离收率,即产物经过后处理分离纯化后所得收率,而非后处理之前的反应的转化率。
[0154]
以下实施例中,若无特殊说明,chiralcel od-h column表示日本大赛璐公司的型号为chiralcel od-h的手性柱。
[0155]
实施例1
[0156]
如下式的反应路线所示,以化合物ii-a的制备为例,在本实施例详细说明本发明所述的双(二乙胺基)苯基膦(通式ii)的通用制备方法:
[0157]
取一干燥的100ml的圆底烧瓶,加入乙醚60ml和苯基二氯化磷(31.3mmol,1.0equiv.),冷却至4℃。加入二乙胺(141mmol,4.5equiv.),恢复至室温并搅拌6h。滤去固体,滤液抽干乙醚,得产物双(二乙胺基)苯基膦(收率81%)。
[0158][0159]
按照实施例1的制备方法,仅改变反应底物的取代基,分别制备如下所示的双(二乙胺基)苯基膦ii-a~ii-g:
[0160][0161]
如式ii-a所示化合物的收率及结构鉴定数据:
[0162]
双(二乙胺基)苯基膦(ii-a).
[0163]
无色液体,产率81%;1h nmr(400mhz,cdcl3)δ7.47(ddd,j=8.2,5.4,1.4hz,2h),7.36(ddd,j=8.6,5.4,2.2hz,2h),7.29
–
7.22(m,1h),3.20
–
3.02(m,8h),1.14(t,j=
7.2hz,12h);
31
p nmr(162mhz,cdcl3)δ97.10。
[0164]
如式ii-b所示化合物的收率及结构鉴定数据:
[0165]
双(二乙胺基)邻甲苯基膦(ii-b).
[0166]
无色液体,产率98%;1h nmr(400mhz,cdcl3)δ7.45
–
7.38(m,1h),7.21
–
7.16(m,2h),7.16
–
7.10(m,1h),3.08(dq,j=9.6,7.2hz,8h),2.39(s,3h),1.09(t,j=7.2hz,12h);
31
p nmr(162mhz,cdcl3)δ91.74。
[0167]
如式ii-c所示化合物的收率及结构鉴定数据:
[0168]
双(二乙胺基)对甲氧基苯基膦(ii-c).
[0169]
无色液体,产率94%;1h nmr(400mhz,cdcl3)δ7.34(ddd,j=8.8,5.0,2.4hz,2h),6.94
–
6.86(m,2h),3.81(s,3h),3.13
–
3.03(m,8h),1.10(t,j=7.0hz,12h);
31
p nmr(162mhz,cdcl3)δ97.03。
[0170]
如式ii-d所示化合物的收率及结构鉴定数据:
[0171]
双(二乙胺基)对三氟甲基苯基膦(ii-d).
[0172]
无色液体,产率93%;1h nmr(400mhz,cdcl3)δ7.61
–
7.51(m,4h),3.09(dq,j=9.8,7.0hz,8h),1.13(t,j=7.0hz,12h);
19
f nmr(377mhz,cdcl3)δ-62.45(d,j=4.3hz);
31
p nmr(162mhz,cdcl3)δ95.54。
[0173]
如式ii-e所示化合物的收率及结构鉴定数据:
[0174]
双(二乙胺基)邻异丙基苯基膦(ii-e).
[0175]
无色液体,产率90%;1h nmr(400mhz,cdcl3)δ7.46
–
7.40(m,1h),7.33
–
7.22(m,2h),7.19
–
7.13(m,1h),3.65(pd,j=6.8,3.8hz,1h),3.14
–
2.98(m,8h),1.23(d,j=6.8hz,6h),1.07(t,j=7.2hz,12h);
31
p nmr(162mhz,cdcl3)δ92.67。
[0176]
如式ii-f所示化合物的收率及结构鉴定数据:
[0177]
双(二乙胺基)-2,6-二甲基苯基膦(ii-f).
[0178]
无色液体,产率94%;1h nmr(400mhz,cdcl3)δ7.05(dd,j=9.6,5.4hz,1h),6.95(dd,j=7.6,3.0hz,2h),3.01(dqd,j=8.6,7.0,4.8hz,8h),2.49(s,6h),1.06(t,j=7.0hz,12h);
31
p nmr(162mhz,cdcl3)δ99.03。
[0179]
如式ii-g所示化合物的收率及结构鉴定数据:
[0180]
双(二乙胺基)-3,5-二叔丁基苯基膦(ii-g).
[0181]
无色液体,产率80%;1h nmr(400mhz,cdcl3)δ7.35
–
7.28(m,3h),3.20
–
3.02(m,8h),1.34(s,18h),1.13(t,j=7.0hz,12h);
31
p nmr(162mhz,cdcl3)δ99.13。
[0182]
实施例2
[0183]
取一干燥的100ml三口瓶,加入(1s,2r)-(
–
)-顺式-1-氨基-2-茚醇(20mmol,1.0equiv.),接上球形冷凝管,加入50ml的甲苯以及双(二乙胺基)苯基膦ii-a(20mmol,1.0equiv.),加热至回流。恢复至室温,滴加硼烷二甲硫醚络合物(80mmol,4.0equiv.),恢复至室温并搅拌。将混合物缓慢滴入冰水中并充分搅拌,将过量的硼烷淬灭,经萃取、干燥后,柱层析得手性膦硼烷络合物iii-a(34%收率)。
[0184]
[0185]
按照实施例2的制备方法,仅改变反应底物的取代基,分别制备如下所示的手性膦硼烷络合物iii-a~iii-g:
[0186][0187]
如式iii-a所示化合物的收率及结构鉴定数据:
[0188]
白色固体,产率34%;1h nmr(400mhz,cdcl3)δ7.93
–
7.80(m,2h),7.61
–
7.47(m,3h),7.44
–
7.25(m,4h),5.18(tt,j=6.2,3.2hz,1h),4.97(td,j=6.2,3.2hz,1h),3.47
–
3.31(m,2h),3.26(dd,j=12.4,3.8hz,1h),1.28
–
0.30(m,3h);
13
c nmr(101mhz,cdcl3)δ140.05(d,j=3.1hz),139.69,133.43(d,j=61.6hz),131.89(d,j=2.2hz),130.06(d,j=11.9hz),129.37,128.53(d,j=10.3hz),127.82,125.46,124.44,84.70(d,j=8.1hz),64.58(d,j=2.5hz),38.53(d,j=4.7hz);
31
p nmr(162mhz,cdcl3)δ137.72。
[0189]
如式iii-b所示化合物的收率及结构鉴定数据:
[0190]
白色固体,产率43%;1h nmr(400mhz,cdcl3)δ7.82(ddd,j=11.0,7.6,1.6hz,1h),7.45
–
7.36(m,2h),7.36
–
7.20(m,5h),5.02(tt,j=6.2,3.0hz,1h),4.81(q,j=5.2hz,1h),3.44
–
3.27(m,2h),3.14(dd,j=10.4,4.2hz,1h),2.67(s,3h),1.18
–
0.28(m,3h);
13
c nmr(101mhz,cdcl3)δ141.45,141.31,140.11(d,j=3.4hz),140.02,132.00,131.58(d,j=9.5hz),130.62(d,j=8.1hz),129.59,127.99,125.72(d,j=8.8hz),125.63,124.62,84.70(d,j=8.2hz),64.70(d,j=3.0hz),38.83(d,j=4.7hz),21.19(d,j=4.7hz);
31
p nmr(162mhz,cdcl3)δ139.13。
[0191]
如式iii-c所示化合物的收率及结构鉴定数据:
[0192]
白色固体,产率33%;1h nmr(400mhz,cdcl3)δ7.80
–
7.70(m,2h),7.41
–
7.22(m,4h),6.99(dq,j=9.4,2.6hz,2h),5.17(tt,j=6.4,3.4hz,1h),4.96(td,j=6.4,3.8hz,1h),3.86(s,3h),3.44
–
3.27(m,2h),3.15(dd,j=12.2,3.8hz,1h),1.17
–
0.22(m,3h);
13
c nmr(101mhz,cdcl3)δ162.69(d,j=2.1hz),140.30(d,j=3.0hz),139.94,132.28(d,j=13.3hz),129.50,127.96,125.63,125.14,124.58,114.24(d,j=11.4hz),84.69(d,j=7.9hz),64.80(d,j=2.4hz),55.44,38.71(d,j=4.6hz);
31
p nmr(162mhz,cdcl3)δ137.95。
[0193]
如式iii-d所示化合物的收率及结构鉴定数据:
[0194]
白色固体,产率33%;1h nmr(400mhz,cdcl3)δ7.90(dd,j=10.2,8.2hz,2h),7.71(dd,j=8.2,20hz,2h),7.38
–
7.20(m,4h),5.11(tt,j=6.4,3.0hz,1h),4.90(t,j=6.4hz,1h),3.43
–
3.25(m,3h),1.15
–
0.19(m,3h);
13
c nmr(101mhz,cdcl3)δ139.96(d,j=3.0hz),139.80,138.25(d,j=58.4hz),133.74(d,j=32.5hz),130.82(d,j=11.9hz),129.81,128.20,125.76,125.62(dq,j=10.8,3.8hz),124.63,123.73(d,j=272.8hz),85.28(d,j=8.4hz),64.79(d,j=2.6hz),38.79(d,j=4.6hz);
19
f nmr(376mhz,cdcl3)δ-63.11;
31
p nmr(162mhz,cdcl3)δ137.04。
[0195]
如式iii-e所示化合物的收率及结构鉴定数据:
[0196]
白色固体,产率40%;1h nmr(400mhz,cdcl3)δ7.86(ddd,j=10.8,7.8,1.4hz,1h),7.57
–
7.44(m,2h),7.44
–
7.40(m,1h),7.39
–
7.24(m,4h),5.05(tt,j=6.4,3.2hz,1h),4.87(d,j=5.8hz,1h),3.69(tdd,j=9.8,8.2,6.6hz,1h),3.47
–
3.30(m,2h),3.22
–
3.14(m,1h),1.38(d,j=6.6hz,3h),1.33(d,j=6.8hz,3h),1.23
–
0.37(m,3h);
13
c nmr(101mhz,cdcl3)δ152.86(d,j=14.3hz),140.03(d,j=3.5hz),139.94,132.27(d,j=2.0hz),130.32(d,j=8.1hz),129.64,129.48,127.89,126.98(d,j=9.2hz),125.71(d,j=8.7hz),125.53,124.54,84.72(d,j=8.3hz),64.66(d,j=2.9hz),38.73(d,j=4.8hz),31.98(d,j=6.5hz),24.56,23.90;
31
p nmr(162mhz,cdcl3)δ139.19。
[0197]
如式iii-f所示化合物的收率及结构鉴定数据:
[0198]
白色固体,产率38%;1h nmr(400mhz,cdcl3)δ7.41
–
7.22(m,5h),7.07(dd,j=7.8,3.6hz,2h),5.05(tt,j=6.2,2.8hz,1h),4.77(q,j=5.2hz,1h),3.47
–
3.30(m,2h),3.16(dd,j=12.6,3.8hz,1h),2.71(s,6h),1.25
–
0.31(m,3h);
13
c nmr(101mhz,cdcl3)δ141.28(d,j=10.5hz),140.21(d,j=3.4hz),139.85,130.88(d,j=2.1hz),130.21(d,j=56.1hz),129.50(d,j=8.5hz),129.35,127.80,125.51,124.47,84.00(d,j=8.5hz),64.16(d,j=3.0hz),38.68(d,j=5.3hz),22.87(d,j=3.8hz);
31
p nmr(162mhz,cdcl3)δ143.37。
[0199]
如式iii-g所示化合物的收率及结构鉴定数据:
[0200]
白色固体,产率27%;1h nmr(400mhz,cdcl3)δ7.71(d,j=1.8hz,1h),7.69
–
7.63(m,2h),7.47
–
7.41(m,1h),7.40
–
7.25(m,3h),5.22(tt,j=6.4,3.2hz,1h),5.01(t,j=6.2hz,1h),3.49
–
3.33(m,2h),3.25
–
3.19(m,1h),1.42(s,18h),1.17
–
0.30(m,3h);
13
c nmr(101mhz,cdcl3)δ151.13(d,j=10.2hz),140.23(d,j=3.1hz),139.82,132.44(d,j=62.1hz),129.36,127.82,126.29(d,j=2.3hz),125.48,124.48,124.06(d,j=12.7hz),84.67(d,j=7.9hz),64.76(d,j=2.5hz),38.65(d,j=4.6hz),34.94,31.30;
31
p nmr(162mhz,cdcl3)δ139.20。
[0201]
实施例3
[0202]
取一的圆底烧瓶,加入手性膦硼烷络合物iii-a(9.0mmol,1.0equiv.),加入四氢呋喃,冷却。缓慢滴加甲基锂(28.8mmol,3.2equiv.),继续反应10min后,恢复至室温并反应2h。在冰水浴冷却下用饱和氯化铵溶液小心淬灭,经萃取、干燥后,柱层析得无色至淡黄色黏稠液体iv-a(96%收率)。
[0203][0204]
按照实施例3的制备方法,仅改变反应底物的取代基,分别制备如下所示的手性膦硼烷络合物iv-a~iv-g:
[0205][0206][0207]
如式iv-a所示化合物的收率及结构鉴定数据:
[0208]
无色稠油,产率96%;1h nmr(400mhz,cdcl3)δ7.86(ddd,j=10.8,7.6,1.8hz,2h),7.61
–
7.48(m,3h),7.30
–
7.12(m,4h),4.46(td,j=10.6,4.8hz,1h),4.24(td,j=4.8,1.4hz,1h),3.00(dd,j=16.8,4.8hz,1h),2.87(dd,j=16.8,1.6hz,1h),2.76(dd,j=10.4,6.8hz,1h),2.27(s,1h),1.83(d,j=9.6hz,3h),1.37
–
0.41(m,3h);
13
c nmr(101mhz,cdcl3)δ141.87(d,j=5.7hz),139.55,133.08(d,j=58.8hz),131.46(d,j=2.3hz),130.47(d,j=10.5hz),128.78(d,j=10.0hz),128.04,126.95,125.24,124.21,73.64(d,j=2.0hz),61.06(d,j=1.4hz),38.98,14.43(d,j=45.0hz);
31
p nmr(162mhz,cdcl3)δ53.81。
[0209]
如式iv-b所示化合物的收率及结构鉴定数据:
[0210]
淡黄色稠油,96%产率;1h nmr(400mhz,cdcl3)δ7.74(dd,j=12.4,7.6hz,1h),7.44(s,1h),7.30(dt,j=8.8,4.6hz,2h),7.20(ddt,j=8.8,5.8,3.8hz,4h),4.37(td,j=10.4,4.6hz,1h),4.27
–
4.19(m,1h),2.96(dd,j=16.6,4.8hz,1h),2.84(dd,j=16.6,1.4hz,1h),2.78
–
2.69(m,4h),2.18(s,1h),1.89(d,j=9.4hz,3h),1.54
–
0.41(m,3h);
13
c nmr(101mhz,cdcl3)δ142.01(d,j=2.9hz),141.94,139.37,131.94(d,j=19.3hz),131.93,131.66(d,j=2.3hz),129.75(d,j=57.2hz),128.00,126.97,125.80(d,j=10.1hz),125.28,124.18,73.85(d,j=1.9hz),61.22(d,j=2.2hz),39.11,21.54(d,j=4.6hz),15.48(d,j=45.4hz);
31
p nmr(162mhz,cdcl3)δ54.37。
[0211]
如式iv-c所示化合物的收率及结构鉴定数据:
[0212]
淡黄色稠油,产率92%;1h nmr(400mhz,cdcl3)δ7.83
–
7.73(m,2h),7.24
–
7.11(m,4h),7.06
–
6.98(m,2h),4.40(td,j=10.6,4.8hz,1h),4.23(td,j=4.8,1.6hz,1h),3.86(s,3h),2.99(dd,j=16.6,5.0hz,1h),2.87(dd,j=16.6,1.6hz,1h),2.62(dd,j=10.4,7.2hz,1h),2.18(s,1h),1.79(d,j=9.6hz,3h),1.41
–
0.30(m,3h);
13
c nmr(101mhz,cdcl3)δ162.22(d,j=2.2hz),141.95(d,j=5.8hz),139.66,132.47(d,j=11.9hz),128.09,126.99,125.27,124.21,123.55(d,j=63.6hz),114.40(d,j=11.0hz),73.52(d,j=1.9hz),60.96(d,j=1.5hz),55.33,38.98,14.55(d,j=45.3hz);
31
p nmr(162mhz,cdcl3)δ52.74。
[0213]
如式iv-d所示化合物的收率及结构鉴定数据:
[0214]
淡黄色稠油,产率96%;1h nmr(400mhz,cdcl3)δ7.96(dd,j=10.2,8.0hz,2h),7.79
–
7.73(m,2h),7.25
–
7.11(m,4h),4.46(td,j=10.6,4.8hz,1h),4.30(t,j=4.8hz,1h),3.02(dd,j=16.8,4.8hz,1h),2.94
–
2.83(m,2h),2.21(s,1h),1.83(d,j=9.6hz,3h),1.41
–
0.32(m,3h);
13
c nmr(101mhz,cdcl3)δ141.64(d,j=6.0hz),139.43,138.35(d,j=55.0hz),133.18(d,j=32.6hz),130.95(d,j=10.8hz),128.25,127.11,125.57(dq,j=10.7,3.8hz),125.39,124.23,123.54(d,j=273.6hz),73.85(d,j=1.9hz),61.24,39.18,14.67(d,j=45.5hz);
19
f nmr(376mhz,cdcl3)δ-63.08;
31
p nmr(162mhz,cdcl3)δ55.01。
[0215]
如式iv-e所示化合物的收率及结构鉴定数据:
[0216]
淡黄色稠油,产率94%;1h nmr(400mhz,cdcl3)δ7.79(ddd,j=12.4,7.8,1.4hz,1h),7.58
–
7.46(m,2h),7.34
–
7.27(m,1h),7.22(d,j=3.2hz,4h),4.54(td,j=10.2,4.6hz,1h),4.35(td,j=4.8,1.6hz,1h),3.92
–
3.77(m,1h),3.01(dd,j=16.6,4.8hz,1h),2.87(dd,j=16.6,1.6hz,1h),2.64(dd,j=10.4,5.2hz,1h),2.28(s,1h),1.89(d,j=9.0hz,3h),1.34(dd,j=18.6,6.8hz,6h),1.28
–
0.51(m,3h);
13
c nmr(101mhz,cdcl3)δ153.33(d,j=9.6hz),142.03(d,j=6.6hz),139.44,131.97(d,j=2.3hz),131.73(d,j=12.1hz),128.71(d,j=59.0hz),127.95,127.26(d,j=8.4hz),126.89,125.76(d,j=10.3hz),125.20,124.32,73.92(d,j=1.8hz),61.29,39.04,30.64(d,j=5.7hz),24.55(d,j=58.3hz),16.84(d,j=43.5hz);
31
p nmr(162mhz,cdcl3)δ54.02。
[0217]
如式iv-f所示化合物的收率及结构鉴定数据:
[0218]
淡黄色稠油,产率89%;1h nmr(400mhz,cdcl3)δ7.30(t,j=7.6hz,1h),7.24
–
7.07(m,6h),4.48(td,j=10.2,4.6hz,1h),4.42(dt,j=4.8,2.4hz,1h),3.02(dd,j=16.6,4.8hz,1h),2.93
–
2.84(m,1h),2.77(s,6h),2.70(dd,j=10.4,4.6hz,1h),2.55(s,1h),1.96(d,j=9.0hz,3h),1.76
–
0.74(m,3h);
13
c nmr(101mhz,cdcl3)δ142.88(d,j=10.2hz),142.17(d,j=7.0hz),139.49,131.01(d,j=2.2hz),130.27(d,j=8.4hz),128.23(d,j=50.9hz),127.82,126.78,125.11,124.25,73.80(d,j=2.1hz),61.63,39.00,24.01(d,j=4.8hz),19.62(d,j=45.2hz);
31
p nmr(162mhz,cdcl3)δ56.04。
[0219]
如式iv-g所示化合物的收率及结构鉴定数据:
[0220]
淡黄色稠油,产率99%;1h nmr(400mhz,cdcl3)δ7.71(dt,j=11.6,1.6hz,2h),7.62(s,1h),7.25
–
7.11(m,4h),4.49(td,j=10.6,4.8hz,1h),4.31(t,j=5.0hz,1h),3.02(dd,j=16.6,5.0hz,1h),2.89(d,j=17.2hz,1h),2.70(dd,j=10.4,5.6hz,1h),2.32(s,
1h),1.83(d,j=9.6hz,3h),1.39(s,18h),1.20
–
0.43(m,3h);
13
c nmr(101mhz,cdcl3)δ151.29(d,j=9.9hz),142.09(d,j=5.7hz),139.69,132.03(d,j=59.0hz),128.01,126.85,125.72,125.22,124.54(d,j=11.2hz),124.28,73.52(d,j=2.0hz),61.11,38.96,35.03,31.31,14.88(d,j=44.8hz);
31
p nmr(162mhz,cdcl3)δ55.18。
[0221]
实施例4
[0222]
取一50ml的圆底烧瓶,加入手性膦硼烷络合物iv-a(3.8mmol,1.0equiv.)和甲醇(20ml),冷却至0℃。滴加浓硫酸(质量分数为98%)(3.8mmol,1.0equiv.),恢复至室温并搅拌20h。将溶剂旋干,加水并用乙醚萃取,柱层析得无色液体醇解产物v-a(89%收率)。
[0223][0224]
按照实施例4的制备方法,仅改变反应底物的取代基,分别制备如下所示的手性膦硼烷络合物v-a~v-g:
[0225][0226]
手性膦硼烷络合物v-a~v-g相关的收率及结构分析表征数据如下:
[0227]
如式v-a所示化合物的收率及结构鉴定数据:
[0228]
无色液体,产率89%;1h nmr(400mhz,cdcl3)δ7.83
–
7.74(m,2h),7.60
–
7.45(m,3h),3.57(dd,j=12.2,0.8hz,3h),1.70(d,j=9.2hz,3h),1.24
–
0.34(m,3h);
13
c nmr(101mhz,cdcl3)δ132.14(d,j=2.4hz),131.60(d,j=55.7hz),130.63(d,j=11.2hz),128.72(d,j=10.1hz),53.58(d,j=3.0hz),16.00(d,j=47.1hz);
31
p nmr(162mhz,cdcl3)δ112.96。
[0229]
如式v-b所示化合物的收率及结构鉴定数据:
[0230]
无色液体,产率88%;1h nmr(400mhz,cdcl3)δ7.76
–
7.66(m,1h),7.31(ddd,j=9.0,6.8,1.6hz,1h),7.21
–
7.11(m,2h),3.45(dd,j=12.0,1.2hz,3h),2.48(s,3h),1.66(d,j=9.2hz,3h),1.25
–
0.24(m,3h);
13
c nmr(101mhz,cdcl3)δ141.21(d,j=5.5hz),
133.08(d,j=17.7hz),132.05(d,j=2.4hz),131.42(d,j=7.7hz),128.77(d,j=52.0hz),125.66(d,j=12.1hz),53.14(d,j=3.8hz),20.70(d,j=3.7hz),14.94(d,j=46.0hz);
31
p nmr(162mhz,cdcl3)δ116.15。
[0231]
如式v-c所示化合物的收率及结构鉴定数据
[0232]
无色液体,产率85%;1h nmr(400mhz,cdcl3)δ7.78
–
7.67(m,2h),7.04
–
6.95(m,2h),3.85(s,3h),3.51(d,j=12.2hz,3h),1.67(d,j=9.2hz,3h),1.21
–
0.26(m,3h);
13
c nmr(101mhz,cdcl3)δ162.73(d,j=2.3hz),132.74(d,j=12.5hz),122.28(d,j=59.7hz),114.25(d,j=11.0hz),55.33,53.21(d,j=3.3hz),15.85(d,j=48.2hz);
31
p nmr(162mhz,cdcl3)δ111.24。
[0233]
如式v-d所示化合物的收率及结构鉴定数据
[0234]
无色液体,产率87%;1h nmr(400mhz,cdcl3)δ7.91(t,j=9.0hz,2h),7.75(dd,j=8.4,1.8hz,2h),3.62(d,j=12.2hz,3h),1.72(d,j=9.2hz,3h),1.27
–
0.29(m,3h);
13
c nmr(101mhz,cdcl3)δ136.52(d,j=52.9hz),133.85(d,j=32.9hz),131.05(d,j=11.4hz),125.59(dq,j=10.1,3.7hz),123.48(q,j=274.0hz),54.01(d,j=2.8hz),16.22(d,j=46.8hz);
19
f nmr(377mhz,cdcl3)δ-63.26;
31
p nmr(162mhz,cdcl3)δ113.55。
[0235]
如式v-e所示化合物的收率及结构鉴定数据
[0236]
无色液体,产率90%;1h nmr(400mhz,cdcl3)δ7.84
–
7.74(m,1h),7.56
–
7.41(m,2h),7.32
–
7.24(m,1h),3.67
–
3.51(m,4h),1.80(d,j=9.0hz,3h),1.28(td,j=7.2,6.8,1.0hz,6h),1.15
–
0.37(m,3h);
13
c nmr(101mhz,cdcl3)δ153.14(d,j=6.7hz),132.83(d,j=17.5hz),132.52(d,j=2.4hz),128.20(d,j=52.7hz),127.02(d,j=7.7hz),125.88(d,j=11.9hz),53.78(d,j=3.4hz),30.71(d,j=4.7hz),24.42(d,j=17.5hz),16.48(d,j=45.8hz);
31
p nmr(162mhz,cdcl3)δ115.23。
[0237]
如式v-f所示化合物的收率及结构鉴定数据
[0238]
无色液体,产率90%;1h nmr(400mhz,cdcl3)δ7.25(td,j=7.6,1.4hz,1h),7.07(dd,j=7.6,3.2hz,2h),3.59(d,j=12.2hz,3h),2.59(s,6h),1.85(d,j=8.8hz,3h),1.46
–
0.55(m,3h);
13
c nmr(101mhz,cdcl3)δ142.67(d,j=10.9hz),131.28(d,j=2.3hz),130.09(d,j=8.4hz),128.17(d,j=47.7hz),52.81(d,j=3.8hz),23.34(d,j=4.5hz),17.32(d,j=45.4hz);
31
p nmr(162mhz,cdcl3)δ116.08。
[0239]
如式v-g所示化合物的收率及结构鉴定数据
[0240]
无色液体,产率38%;1h nmr(400mhz,cdcl3)δ7.65
–
7.57(m,3h),3.58(d,j=12.2hz,3h),1.71(d,j=9.2hz,3h),1.36(s,18h),1.21
–
0.29(m,3h);
13
c nmr(101mhz,cdcl3)δ151.35(d,j=10.0hz),130.60(d,j=56.0hz),126.45,124.62(d,j=11.9hz),53.53,35.05,31.32,16.23(d,j=46.8hz);
31
p nmr(162mhz,cdcl3)δ113.76。
[0241]
实施例5
[0242]
取一50ml干燥的圆底烧瓶,加入醇解产物v-a(3.0mmol,3.0equiv.)、1,4-二氮杂二环〔2.2.2〕辛烷(dabco)(6.0mmol,6.0equiv.)和10ml正己烷,在40℃下反应。反应至核磁显示原料已转化完毕。另取一100ml干燥的圆底烧瓶,在-45℃下,加入双碘代物(1.0mmol,1.0equiv.)、四甲基乙二胺(tmeda)(3.0mmol,3.0equiv.)和四氢呋喃。先后加入正丁基锂(3.0mmol,3.0equiv.)2.0m正丁基锂己烷溶液和脱硼烷产物溶液,随后恢复至室温并反应
过夜。用饱和氯化铵溶液淬灭,经萃取、干燥后,柱层析得i-a泡沫状固体(50%收率)。
[0243][0244]
按照实施例5的制备方法,仅改变反应底物的取代基,分别制备如下所示的手性膦硼烷络合物i-a~i-g:
[0245][0246][0247]
i-a~i-g相关的收率及结构分析表征数据如下:
[0248]
如式i-a所示化合物的收率及结构鉴定数据
[0249]
白色固体,产率50%;1h nmr(400mhz,cdcl3)δ7.57
–
7.48(m,4h),7.43
–
7.31(m,8h),6.99(t,j=7.6hz,2h),6.77(dq,j=7.6,2.0hz,2h),1.64(s,6h),1.57(t,j=2.0hz,6h);
13
c nmr(101mhz,cdcl3)δ151.89(m),138.76(m),132.85(m),129.79,129.65,128.54,128.46,128.38(t,j=3.3hz),126.12,123.29,34.33(d,j=1.5hz),32.16,11.54(m);
31
p nmr(162mhz,cdcl3)δ-36.58。
[0250]
如式i-b所示化合物的收率及结构鉴定数据(单晶图如图1所示)
[0251]
白色固体,产率30%;1h nmr(400mhz,cdcl3)δ7.41
–
7.34(m,4h),7.32
–
7.27(m,3h),7.26
–
7.22(m,3h),6.98(t,j=7.6hz,2h),6.75
–
6.67(m,2h),2.50(s,6h),1.67(s,6h),1.61
–
1.55(m,6h);
31
p nmr(162mhz,cdcl3)δ-45.25。
[0252]
单晶测试参数如下表所示:
[0253][0254][0255]
如式i-c所示化合物的收率及结构鉴定数据
[0256]
白色固体,产率50%;1h nmr(400mhz,cdcl3)δ7.54
–
7.45(m,4h),7.35(dd,j=7.8,1.6hz,2h),7.01
–
6.91(m,6h),6.76
–
6.68(m,2h),3.84(s,6h),1.66
–
1.60(m,12h);
31
p nmr(162mhz,cdcl3)δ-37.56。
[0257]
如式i-d所示化合物的收率及结构鉴定数据
[0258]
白色固体,产率27%;1h nmr(400mhz,cdcl3)δ7.63
–
7.53(m,8h),7.43(d,j=7.8hz,2h),7.06(t,j=7.6hz,2h),6.88
–
6.81(m,2h),1.66(s,6h),1.49(t,j=2.2hz,6h);
19
f nmr(377mhz,cdcl3)δ-62.63;
31
p nmr(162mhz,cdcl3)δ-36.97。
[0259]
如式i-e所示化合物的收率及结构鉴定数据
[0260]
白色固体,产率89%;1h nmr(400mhz,cdcl3)δ7.53
–
7.35(m,8h),7.33
–
7.27(m,2h),6.98(t,j=7.6hz,2h),6.76
–
6.68(m,2h),3.87
–
3.75(m,2h),1.75
–
1.72(m,6h),1.70(s,6h),1.34(d,j=6.8hz,6h),1.13(d,j=6.8hz,6h);
13
c nmr(101mhz,cdcl3)δ153.70(m),151.83(t,j=9.1hz),135.78(dd,j=7.8,4.9hz),131.04,130.40,129.61,129.47(dd,j=12.9,8.2hz),129.06,126.19,126.04,125.47(t,j=2.1hz),123.23,34.42(d,j=1.5hz),32.39,30.91(m),24.76,23.64,11.31(m);
31
p nmr(162mhz,cdcl3)δ-47.59。
[0261]
如式i-f所示化合物的收率及结构鉴定数据
[0262]
白色固体,产率51%;1h nmr(400mhz,cdcl3)δ7.35
–
7.31(m,2h),7.24
–
7.20(m,2h),7.14
–
7.10(m,4h),6.93(t,j=7.6hz,2h),6.81
–
6.77(m,2h),2.51(s,12h),1.94(d,j=3.8hz,6h),1.67(s,6h);
31
p nmr(162mhz,cdcl3)δ-40.58。
[0263]
如式i-g所示化合物的收率及结构鉴定数据
[0264]
白色固体,产率20%;1h nmr(400mhz,cdcl3)δ7.44
–
7.36(m,8h),7.01(t,j=7.6hz,2h),6.78(d,j=7.6hz,2h),1.66(s,6h),1.57(s,6h),1.32(s,36h);
31
p nmr(162mhz,cdcl3)δ-34.25。
[0265]
实施例6
[0266]
(co(i i)/手性双膦骨架配体i-b催化的1,3二烯的不对称硅氢化
[0267]
本实施例以手性双膦骨架配体i-b与co(acac)2(现场形成的络合物为手性催化剂),催化的1,3二烯的不对称硅氢化,用来例举说明本发明中手性双膦骨架化合物在不对称催化中的应用。
[0268][0269]
操作方法:在手套箱中,取一干燥的8ml的反应瓶,加入co(acac)2(0.004mmol)和i-b(0.0040mmol),加入thf(2ml),搅拌0.5小时。依次加入苯基硅烷(0.125mmol)和1,3二烯(0.1mmol),室温搅拌12h。反应溶液减压除去溶剂,用1h nmr测定转化率,残余物过硅胶短柱分离得到硅氢化产物。该硅氢化产物vi-a可以在过氧化氢的条件下发生氧化反应,生成手性烯丙醇vi-a-oxi。
[0270]
如式vi-a所示化合物的收率及结构鉴定数据
[0271]
无色液体,产率96%;1h nmr(400mhz,cdcl3)δ7.60
–
7.54(m,2h),7.43
–
7.23(m,7h),7.17(dt,j=8.8,5.6hz,1h),6.38
–
6.21(m,2h),4.30(t,j=2.6hz,2h),2.31
–
2.20(m,
1h),1.29(d,j=7.2hz,3h);
13
c nmr(101mhz,cdcl3)δ137.99,135.67,132.99,131.10,129.79,128.46,127.95,127.21,126.56,125.72,22.85,15.07。
[0272]
如式vi-a-oxi所示化合物的收率及结构鉴定数据
[0273]
无色液体,产率80%;1h nmr(400mhz,cdcl3)δ7.40
–
7.34(m,2h),7.34
–
7.27(m,2h),7.27
–
7.19(m,1h),6.55(dd,j=15.8,1.2hz,1h),6.25(dd,j=15.8,6.4hz,1h),4.47(pd,j=6.4,1.4hz,1h),1.86(s,1h),1.36(d,j=6.4hz,3h);
13
c nmr(101mhz,cdcl3)δ136.63,133.49,129.31,128.53,127.57,126.40,68.86,23.34。
[0274]
vi-a-oxi的对映体选择性测试方法:参照外消旋物质,通过超临界流体色谱仪分析测定(测定值为89:11对映体选择性.;采用手性ib色谱柱,以90:10超临界流体二氧化碳/异丙醇为溶剂,流速为1.0ml/min,检测波长为254nm)。
[0275]
如式vi-b所示化合物的收率及结构鉴定数据
[0276]
无色液体,产率81%;1h nmr(400mhz,cdcl3)δ7.66
–
7.57(m,2h),7.46
–
7.28(m,5h),7.22
–
7.14(m,3h),6.15(s,1h),4.43
–
4.31(m,2h),2.17(tdt,j=8.0,6.8,3.0hz,1h),1.90(d,j=1.4hz,3h),1.34(d,j=7.4hz,3h)。
[0277]
如式vi-b-oxi所示化合物的收率及结构鉴定数据
[0278]
无色液体,产率80%;1h nmr(400mhz,cdcl3)δ7.39
–
7.19(m,5h),6.53(s,1h),4.39(q,j=6.4hz,1h),1.90(d,j=1.4hz,3h),1.84(s,1h),1.38(d,j=6.4hz,3h)。
[0279]
vi-b-oxi的对映体选择性测试方法:参照外消旋物质,通过超临界流体色谱仪分析测定(测定值为90:10对映体选择性.;采用手性ib n-5色谱柱,以90:10超临界流体二氧化碳/异丙醇为溶剂,流速为1.0ml/min,检测波长为254nm)。
[0280]
对比例1
[0281]
对比例1操作方法:在手套箱中,取一干燥的8ml的反应瓶,加入co(acac)2(0.004mmol),加入thf(2ml),搅拌0.5小时。依次加入苯基硅烷(0.125mmol)和1,3二烯(0.1mmol),室温搅拌12h。反应溶液减压除去溶剂,用1h nmr测定,产率小于5%,无立体选择性。
[0282]
对比例2
[0283]
对比例2操作方法:在手套箱中,取一干燥的反应瓶,加入(
i-pr
pdi)cocl2(0.015mmol)/naet3bh(1m)和甲苯(2ml),搅拌后依次加入苯基硅烷(0.33mmol)和1,3二烯(0.3mmol),-78℃下搅拌至原料消失。反应溶液减压除去溶剂,用1h nmr测定转化率,残余物过硅胶短柱分离得到硅氢化产物
产率89%,er值为34:66。
[0284]
对比例3
[0285]
对比例3操作方法:在手套箱中,取一干燥的反应瓶,加入co(acac)2(4.0mmol)和4,5-双(二苯基膦)-9,9-二甲基氧杂蒽(xantphos)(4.0mmol),搅拌后依次加入苯基硅烷(0.500mmol)和1,3二烯(0.400mmol),25℃下搅拌6小时。反应溶液减压除去溶剂,用1h nmr测定转化率,残余物过硅胶短柱分离得到1,2硅氢化产物产率86%,无立体选择性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1