人源化的磷脂酰肌醇蛋白聚糖3的单克隆抗体及其应用
1.本发明涉及抗体领域。具体涉及一类人源化的磷脂酰肌醇蛋白聚糖3的单克隆抗体。
背景技术:
2.现今,抗体是医学和研究中广泛使用的物质。在医学中,发现它们在许多不同领域中的应用。例如,将抗体用作检测某些标记物的标记试剂,这使得可以诊断或预后疾病或测定特定的身体参数。例如,某些癌细胞表面的蛋白分子的检测。
3.此外,抗体还用作各种疾病的治疗和预防中的治疗剂,如癌症、心血管疾病、炎性疾病、黄斑变性、移植排斥、多发性硬化和病毒感染。在这些治疗中,抗体自身可以具有治疗活性,例如通过阻断受体或信使分子,由此抑制它们的疾病相关功能,或者通过恢复和激活患者的免疫系统的组成部分。或者,抗体可以与另一种具有治疗活性的物质结合。特别地,在癌症和感染的治疗中,所述另一种物质具有细胞杀灭活性,并且可以是,例如,放射性同位素或细胞毒素。在另一种应用中,通过将合适的抗体转移至患者的循环中,抗体可以用于被动地免疫患者。
4.目前单克隆抗体制备的常用有杂交瘤技术和噬菌体展示技术,能产生针对抗原的单个特异性表位的抗体。而这些抗体序列经常来源于哺乳动物,如鼠,兔。从进化的角度来看,哺乳动物的亲缘关系和人类很接近,很多蛋白都是同源的,所以在这些动物中产生相应的抗体。
5.鸡的亲缘关系与人更远,免疫鸡能产生覆盖更多表位的抗体。鸡抗体的框架区序列只有一种,也更容易构建噬菌体展示文库。
6.然而,在治疗应用中,这些单克隆抗体具有源自动物生物体并且其氨基酸序列与人抗体不同的问题。因此,人免疫系统将这些动物抗体识别为外来物质,并且将其从循环中快速清除。此外,可能导致全身性炎性效应。所以动物源的抗体需要进一步进行人源化改造。
7.抗体人源化的一种常用方法是互补决定区移植,其中将非人源抗体的cdrs移植到人源框架上。通常,选择与非人抗体框架区同源性最高的人构架作为cdr移植的受体。在单克隆抗体的人源化过程中,常常降低了工程化抗体的亲和力和特异性。而在实际应用中,抗原对所用抗体的紧密结合和特异性识别都是至关重要的。所以筛选最佳的框架序列既能让人源化程度更高,又能不丧失抗体的活性非常有意义。
8.gpc3(glypican-3)是硫酸肝素蛋白聚糖的一员,通过糖基磷脂酰肌醇(glycosyl-phosphatidylinositol,gpi)锚定于细胞膜表面。人gpc3基因位于x染色体(xp26)上并编码70kda蛋白质,该蛋白质含有580个氨基酸,在arg358和ser359之间被弗林蛋白酶样转化酶内切切割,产生40kda n末端亚基和30kda c末端亚基,c末端亚基上还有两条硫酸乙酰肝素(heparan sulfate,hs)链。研究表明,gpc3在约72%肝细胞癌(hepatocellular carcinoma,hcc)中的表达水平相比正常肝细胞、胆管癌和肝转移癌明显上调,但在正常成
人的肝组织中不表达。此外,肝癌患者gpc3表达量高往往伴随着较差的预后,这些都表明gpc3在hcc中作为生物标志物的潜在作用。目前gpc3已被建议作为抗体和基于细胞的免疫疗法的靶标。
技术实现要素:
9.本发明前期研究将gpc3-hfc蛋白免疫鸡后,利用噬菌体展示技术筛选得到抗体,然后通过噬菌体夹心elisa将抗体按表位初步分类,利用抗体蛋白夹心elisa的方法筛选到一系列能够高亲和力识别磷脂酰肌醇蛋白聚糖3不同表位的且具有良好的稳定性的抗体。本发明此基础上将这些gpc3高亲和力鸡抗体的框架区中大部分序列替换成人框架区后,人源化的抗体不仅免疫原性降低,而且保留有高亲和力的特性。
10.本发明具体技术方案如下:
11.本发明是基于具有与相应鸡抗体相似的抗原结合特性的人源化抗gpc3抗体的产生。
12.本发明提供了一类人源化的磷脂酰肌醇蛋白聚糖3的单克隆抗体,所述人源化抗体包括重链可变区和轻链可变区,所述重链可变区的框架区:hfr1氨基酸序列如seq id no:3的1-25位所示,hfr2氨基酸序列如seq id no:3的35-49位或seq id no:19的35-49位所示,hfr3氨基酸序列如seq id no:3的67-98位,seq id no:15的67-98位,seq id no:17的67-98位中任一项所示,hfr4氨基酸序列如seq id no:3的116-126位所示,所述轻链可变区的框架区:lfr1氨基酸序列如seq id no:4的1-22位所示,lfr2氨基酸序列如seq id no:4的30-45位或seq id no:14的30-45位所示,lfr3氨基酸序列如seq id no:4的53-84位,seq id no:6的53-84位,seq id no:8的53-84位,seq id no:10的53-84位,seq id no:12的53-84位中任一项所示,lfr4氨基酸序列如seq id no:4的98-107位所示。
13.进一步的,所述的人源化抗体,优选自:
14.(1)所述人源化抗体的重链可变区具有seq id no:3的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:4的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
15.(2)所述人源化抗体的重链可变区具有seq id no:5的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:6的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
16.(3)所述人源化抗体的重链可变区具有seq id no:7的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:8的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
17.(4)所述人源化抗体的重链可变区具有seq id no:9的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:10的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
18.(5)所述人源化抗体的重链可变区具有seq id no:11的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:12的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
19.(6)所述人源化抗体的重链可变区具有seq id no:13的1-25位、35-49位、67-98位
和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:14的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
20.(7)所述人源化抗体的重链可变区具有seq id no:15的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:16的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
21.(8)所述人源化抗体的重链可变区具有seq id no:17的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:18的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
22.(9)所述人源化抗体的重链可变区具有seq id no:19的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:20的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;
23.本发明一个具体的技术方案,所述磷脂酰肌醇蛋白聚糖3的人源化抗体,包括重链可变区和轻链可变区,
24.(1)所述抗体的重链可变区氨基酸序列如seq id no:3所示,轻链可变氨基酸序列如seq id no:4所示。
25.(2)所述抗体的重链可变区氨基酸序列如seq id no:5所示,轻链可变氨基酸序列如seq id no:6所示。
26.(3)所述抗体的重链可变区氨基酸序列如seq id no:7所示,轻链可变氨基酸序列如seq id no:8所示。
27.(4)所述抗体的重链可变区氨基酸序列如seq id no:9所示,轻链可变氨基酸序列如seq id no:10所示。
28.(5)所述抗体的重链可变区氨基酸序列如seq id no:11所示,轻链可变氨基酸序列如seq id no:12所示。
29.(6)所述抗体的重链可变区氨基酸序列如seq id no:13所示,轻链可变氨基酸序列如seq id no:14所示。
30.(7)所述抗体的重链可变区氨基酸序列如seq id no:15所示,轻链可变氨基酸序列如seq id no:16所示。
31.(8)所述抗体的重链可变区氨基酸序列如seq id no:17所示,轻链可变氨基酸序列如seq id no:18所示。
32.(9)所述抗体的重链可变区氨基酸序列如seq id no:19所示,轻链可变氨基酸序列如seq id no:20所示。
33.本发明一个具体的示例,所述人源化抗体的重链可变区具有seq id no:3的26-34位、50-66位和99-115位氨基酸残基所示的互补决定区;所述抗体的轻链可变区具有seq id no:4的23-29位、46-82位和85-97位氨基酸残基所示的互补决定区。
34.本发明所述的单克隆抗体可以为任何同种型。可以为例如igm或igg抗体,例如igg1或igg2。可特异性结合gpc3的抗体的种类可根据已知的方法彼此转换(例如,igg可转换为igm)。种类转换还可用于使一种igg亚类转换成另一亚类,例如从igg1转换成igg2。
35.本发明所述的抗体可以为:
36.(1)fab,包含抗体分子的单价抗原结合片段的片段,其可以通过用木瓜蛋白酶消
化完整抗体以产生完整轻链和一条重链的一部分而产生;
37.(2)fab',可以通过用胃蛋白酶处理完整抗体、之后进行还原以产生完整轻链和重链的一部分而获得的抗体分子片段;每个抗体分子得到两个fab'片段;
38.(3)(fab')2,可以通过将完整的抗体用胃蛋白酶处理、但之后不进行还原而得到的抗体片段;f(ab')2是两个fab'片段通过两个二硫键连接在一起的二聚体;
39.(4)fv,含有表达为2条链的轻链可变区和重链可变区的基因程片段;
40.(5)单链抗体(例如scfv),含有轻链可变区和重链可变区并通过合适的多肽接头将其连接为遗传上融合的单链分子的基因工程分子;
41.(6)单链抗体的二聚体(scfv2),定义为scfv的二聚体(还被称为“微型抗体”);
42.(7)vh单结构域抗体,由重链可变区组成的抗体片段。
43.本领域技术人员会了解,可以制备抗体的保守变体。可以在所述vh和/或vl区进行氨基酸置换(例如1个、2个、3个、4个或5个氨基酸置换),置换后的vh和vl仍然保留结合gpc3的能力,或者对gpc3的结合能力更强。功能类似的氨基酸的保守置换是本领域普通技术人员所熟知的。以下六组是被认为是互为保守置换的氨基酸的实例:
44.1)丙氨酸(a)、丝氨酸(s)、苏氨酸(t);
45.2)天冬氨酸(d)、谷氨酸(e);
46.3)天冬酰胺(n)、谷氨酰胺(q);
47.4)精氨酸(r)、赖氨酸(k);
48.5)异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、缬氨酸(v);
49.6)苯丙氨酸(f)、酪氨酸(y)、色氨酸(w)。
50.根据本发明的人源化抗体或其片段或衍生物优选用于医学中,特别是用于疾病的治疗、诊断、预后和监控中,特别是在此所述的疾病,优选癌症。
51.可将本发明所述的gpc3抗体缀合到效应分子上。效应分子包括但不限于毒素、药物或可检测的标记物。
52.本发明所述的药物是具有细胞毒性或抗肿瘤活性的物质,例如monomethyl auristatin e(mmae)、monomethylauristatin f(mmaf)、pyrrolobenzodiazepine(pbd)dimer、n2'-deacetyl-n2'-(3-mercapto-1-oxopropyl)-maytansine(美登素dm1)、长春碱、道诺霉素等,又例如放射性试剂
125
i、
32
p、
14
c、3h和
35
s等。
53.本发明所述的毒素为具有细胞毒性或抗肿瘤活性的毒蛋白,可以与本发明所述抗体缀合形成免疫毒素,包括但不限于假单胞菌外毒素、蓖麻毒蛋白、相思豆毒蛋白、白喉毒素和其亚基以及肉毒杆菌毒素a-f,以及这些毒素的截短突变体和点突变体。这些毒素可商业购买获得(例如,sigma chemical company,st.louis,mo)。所述毒素还包括上述毒素的变体(例如参见美国专利no.5,079,163和4,689,401)。在一个实施方案中,所述毒素为假单胞菌外毒素(pe)(美国专利no.5,602,095)。所述“假单胞菌外毒素”包括其天然序列、所述天然序列的细胞毒性片段、以及天然序列或其细胞毒性片段的保守修饰的变体。这些修饰包括但不限于除去结构域ia、结构域ib、ii和iii中的多个氨基酸缺失、单个或多个氨基酸置换以及在羧基端加入一个或多个序列(例如,参见,siegall et al.,j.biol.chem.264:14256-14261,1989)。假单胞菌外毒素的细胞毒性片段包括pe24、pe40、pe38和pe35等。
54.本发明所述可检测的标记物是可以被同位素分析仪、酶标仪、生物发光检测仪、化
学发光检测仪、电化学发光检测仪、荧光分析仪器检测,或裸眼可视化的物质,这些物质包括但不限于放射性同位素(如3h、
14
c、
15
n、
35
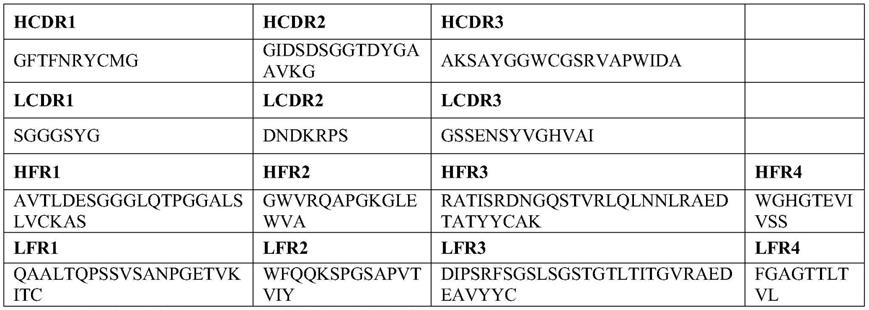
s、
90
y、、
99
tc、
111
in、
125
i、
131
i)、可用于检测的酶类(如辣根过氧化物酶、β-半乳糖苷酶、碱性磷酸酶、葡萄糖氧化酶等)、荧光蛋白(如绿色荧光蛋白(gfp)、黄色荧光蛋白(yfp)、别藻蓝蛋白apc、藻红蛋白pe)、生物发光标记物(如萤光素酶)、荧光化合物(如荧光素、异硫氰酸荧光素、罗丹明、5-二甲基氨基-1-萘磺酰氯、藻红蛋白、荧光染料cy3、cy5、稀土无机发光材料、量子点等)、生物素、磁性试剂(例如钆)、电化学发光试剂(如三联吡啶钌)、胶体金。
55.本发明另一目的在于提供一种多核苷酸,编码本发明所述的抗体,重组蛋白或者免疫缀合物。本发明另一目的在于提供一种载体,含有本发明所述的多核苷酸。所述的载体包括:细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒、或其他载体。
56.本发明提供了包含根据本发明的核酸或根据本发明的表达盒或载体的宿主细胞。根据本发明的宿主细胞可以是任何宿主细胞。可以是分离的细胞或包含在组织中的细胞。优选地,宿主细胞是培养的细胞,特别是初级细胞或已建立的细胞系的细胞,优选源自肿瘤的人细胞。
57.本发明另一目的在于提供一种药物组合物,包括本发明所述的抗体、重组蛋白、免疫缀合物、多核苷酸、载体或遗传工程化的宿主细胞中的一种或几种。所述药物组合物还包括药学上可接受的载体。所述抗体、重组蛋白、免疫缀合物、多核苷酸、载体或遗传工程化的宿主细胞可溶于水性载体,例如缓冲盐水等。还可以含有接近生理条件所需要的可药用辅料,例如ph调节剂和缓冲试剂等,乙酸钠、氯化钠、氯化钾、氯化钙和乳酸钠等。
58.本发明另一目的在于提供本发明所述的抗体、重组蛋白、免疫缀合物、多核苷酸、载体或遗传工程化的宿主细胞在制备自身免疫疾病、病毒感染或癌症的治疗药物或诊断试剂中的应用。所述癌症为肝癌、胃癌、结直肠癌、肺癌或卵巢癌,或表达gpc3的任何其他类型的癌症。
59.本发明公开的单克隆抗体还可用于制备嵌合抗原受体(car;也称为嵌合t细胞受体、人造t细胞受体或嵌合免疫受体)或双特异性抗体。
60.本发明所提供的抗体和组合物可用于多种目的,例如用于肿瘤的分子诊断,在肝癌和其它肿瘤患者样品中确认是否表达gpc3。所述样品可以为任何样品,包括但不限于来自活组织检查、尸体解剖和病理标本的组织。生物样品还包括组织的切片,例如为组织学目的获取的冷冻切片。生物样品还包括体液,例如血液、血清、血浆、痰、脊髓液或尿。生物样品一般获自哺乳动物,包括人,非人灵长类,小鼠等。
61.本发明优点:本发明提供了gpc3鸡单克隆抗体的人源化策略。以gpc3鸡单克隆抗体a5为例,本实施例以a5抗体为例,将其重链和轻链可变区(vh,seq id no:21和vl,seq id no:22)用连接肽g4s连接,形成scfv的结构。基于scfv的结构,根据其整体序列相似性和cdr环分类,从人种系抗体文库中选择最相关的框架区:重链可变区的框架区1、2和3选自人种系vh基因3-23*02。重链可变区的框架区4选自人种系基因j3*01。轻链可变区的框架区1、2和3源自人种系vl基因3-25*02。轻链可变区的框架区4选自人种系基因j7*01,并进行优化,得到的人源化抗体具有理想的亲和力,并且免疫原性更低。可用于开发活性更好的gpc3抗体药物、抗体-药物缀合物或免疫毒素类药物。
附图说明
62.图1facs法检测本发明实施例1制备的抗体a5与gpc3阴性/阳性细胞系的结合活性。
63.图2本发明实施例4人源化鸡抗体重链可变区的框架区和互补决定区的序列比对差异。
64.图3本发明实施例4人源化鸡抗体轻链可变区的框架区和互补决定区的序列比对差异。
65.图4.sds-page检测hua5.2抗体及8个突变体蛋白的纯度。
66.图5.elisa检测hua5.2抗体及8个突变体与抗原gpc3结合的亲和力。
67.图6.sds-page检测真核表达系统纯化的hua5.2抗体的纯度
68.图7.elisa检测hua5.2和a5抗体与抗原结合的亲和力
69.图8.elispot检测hua5.2和a5抗体的免疫原性
具体实施方式
70.下面结合具体实施例并参照数据进一步详细描述本发明,应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。在本发明中使用的术语,除非另有说明,一般具有本领域普通技术人员通常理解的含义。在以下实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
71.实施例1结合gpc3的鸡单克隆抗体a5的制备
72.以gpc3-hfc蛋白(sino biological,cat:10088-h02h2)免疫4月龄鸡,每次免疫300μg,每次间隔2周,免疫4次之后采集鸡的脾脏,提取脾脏中的总rna,逆转录为cdna,作为建立噬菌体抗体文库的模板,并构建鸡抗体噬菌体文库(库容量2.7
×
109)。利用gpc3蛋白作为抗原,对噬菌体文库进行4次淘选后,随机挑取300个克隆进行测序,比对序列后发现a5是其中出现频次最高的抗体。
73.将a5的scfv与hfc融合,构建表达载体ppbsps-a5-hfc,并在293f细胞中表达。表达产物用protein a层析柱(ge healthcare)进行纯化。利用纯化的抗体和夹心elisa方法对gpc3蛋白进行检测。
74.a5的vh如seq id no:21所示,vl如seq id no:22所示,其中cdr及hfr区序列分别如表1所示。
75.表1 gpc3鸡单克隆抗体的可变区氨基酸序列
76.77.实施例2结合gpc3的鸡单克隆抗体的体外表征
78.2.spr测定实施例1制得的抗体与gpc3的结合动力学与亲和力
79.将gpc3-his蛋白通过标准的胺偶联固定在羧甲基传感器芯片上(s系列传感器芯片cm5)。洗涤芯片以获取稳定的基线,随后以30μl/分钟的流速,将不同浓度的抗体分析物以及运行缓冲液注入芯片,样品结合时间为180秒,随后的解离时间为600秒。使用proteon软件将结合和解离曲线拟合至1:1langmiur结合模型。结果显示a5的亲和力常数kd值为1.82e-11,表明其与gpc3的亲和力非常高。
80.3.抗体稳定性的检测
81.利用nano temper公司的prometheus nt.48测定a5的稳定性:将抗体浓度稀释成50ug/ml,然后上样,1.5℃/min的速度,40min钟内温度从25℃上升到95℃。最后得出抗体的tm值。结果显示a5的tm值为69.1℃,说明a5的热稳定性好。
82.实施例3facs检测本发明所述抗体与gpc3阳性细胞系的结合
83.将a431,g1(超表达gpc3的a431细胞系)(phung yet al.mabs 2012;4:592-599)和肝癌细胞系hepg2、hep3b、huh-7以贴壁方式培养,所用培养基为dmem培养基(invitrogen,carlsbad,ca)并添加10%胎牛血清(hyclone,logan,ut)、1%l-谷氨酰胺和1%青霉素-链霉素(invitrogen,carlsbad,ca)。收获细胞后,将实施例1制得的抗体分别与a431,g1,hepg2,hep3b,huh7细胞进行结合,加入apc标记的羊抗人的二抗,检测结合至细胞表面上的抗体。结果如图1所示,实施例1制得的抗体能很强的结合g1细胞和hepg2,hep3b,huh7细胞,但不结合gpc3阴性的a431细胞,说明实施例1制得的抗体能特异性地识别并结合细胞表面的gpc3蛋白。
84.实施例4抗gpc3抗体的鸡重链和轻链可变区的人源化
85.本实施例以a5抗体为例,将其重链和轻链可变区(vh,seq id no:21和vl,seq id no:22)用连接肽g4s连接,形成scfv的结构。基于scfv的结构,根据其整体序列相似性和cdr环分类,从人种系抗体文库中选择最相关的框架区:重链可变区的框架区1、2和3选自人种系vh基因3-23*02。重链可变区的框架区4选自人种系基因j3*01。轻链可变区的框架区1、2和3源自人种系vl基因3-25*02。轻链可变区的框架区4选自人种系基因j7*01。
86.人源化方案一:将鸡重链可变区和轻链可变区的框架区1、2、3、4全部替换为人源化框架区,所述抗体的重链可变区具有seq id no:1的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:2的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区。将此方案得到的抗体序列命名为hua5.1。
87.人源化方案二:参照文献资料(leeying wu,j immunol 2012;188:322-333),将鸡重链可变区和轻链可变区的框架区1、2、3、4中突变率高的位置,替换为人源化框架区对应位置的氨基酸,所述抗体的重链可变区具有seq id no:3的1-25位、35-49位、67-98位和116-126位氨基酸残基所示的框架区;所述抗体的轻链可变区具有seq id no:4的1-22位、30-45位、53-84和98-107位氨基酸残基所示的框架区;。将此方案得到的抗体序列命名为hua5.2。
88.人源化方案三:在人源化方案二的基础上,对鸡重链可变区和轻链可变区的框架区1、2、3、4中突变率低,也就是比较保守的鸡序列逐个将替换成人的序列。参照kabat和imgt编号规则,分别将hua5.2重链可变区35位g突变成s,67位a突变成f,78位v突变成l。分
别将hua5.2轻链可变区36位f变成y,57位d变成g,60位s变成d,66位a变成s,69位s变成n。将此方案得到的抗体序列分别命名为h-g35s,h-a67f,h-v78l,l-f36y,l-d57g,l-s60d,l-a66s,l-s69n。
89.共得到10条不同序列的人源化抗体。所述抗体重链和轻链序列如表2所示,其可变区的框架区如表3所示。所述抗体重链可变区的框架区和互补决定区的序列比对差异如图2所示。所述抗体轻链可变区的框架区和互补决定区的序列比对差异如图3所示。
90.表2. 10个人源化抗体的可变区氨基酸序列
91.[0092][0093]
表3. 10个人源化抗体的fr氨基酸序列(根据kabat和imtg数据库)
[0094]
[0095][0096]
实施例5表达实施例4中的人源化抗体并检测其纯度
[0097]
委托金斯瑞公司合成实施例1中抗体对应的的核酸片段,然后将抗体的序列c末端额外加上6个组氨酸(6x his),构建相应抗体的pet28a表达载体后,转化bl21大肠杆菌,然后将菌株接种到2l的2yt培养基中,37℃培养4-5h后od
600
达到0.9,加入1mm iptg诱导,30℃的条件下表达10h。收集菌体,高压破碎菌体后离心,过滤处理上清液,然后通过镍柱进行纯化。其中,hua5.1抗体无法表达,其余抗体均能表达纯化。结果表明,将框架区全部替换成人源框架后,抗体的构象发生很大变化,最终导致抗体无法纯化。最后将其余纯化后的蛋白经过sds-page检测其纯度。实施例4制得的抗体的大小约为50kd,如图4所示,条带大小正确,其中4个抗体纯度比较高,剩余5个抗体纯度一般,但均满足后续实验的要求。
[0098]
实施例6elisa检测实施例5制备得到的人源化抗体结合gpc3的活性
[0099]
将gpc3蛋白包被在elisa板底,然后将实施例4中的抗体蛋白分别以20μg/ml开始1:3梯度稀释后加入孔内,然后加入hrp-mouse anti his抗体,最后加入底物显色。如图5所示,所有抗体hua5.2、h-g35s,h-a67f,h-v78l,l-f36y,l-d57g,l-s60d,l-a66s,l-s69n均能显著地与gpc3抗体进行结合。根据elisa地结果计算抗体地亲和力常数kd值,如表4所示,其中hua5.2的亲和力最高,kd值达到了0.02051。结果表明hua5.2在人源化后,亲和力损失最少。
[0100]
表4实施例5中的抗体结合gpc3蛋白的亲和力ec50值
[0101][0102]
实施例7 293细胞表达hua5.2蛋白并检测纯度
[0103]
考虑后续要检测hua5.2抗体的免疫原性,在哺乳动物细胞表达系统中表达hua5.2,避免大肠杆菌表达系统额外引入的免疫原。在hua5.2的序列的c端加上额外的hfc标签,构建哺乳动物细胞表达载体,然后将构建成功的载体瞬转293f细胞,悬浮培养7天后收集细胞上清,过滤后用proteina层析柱纯化。利用sds-page检测其纯度。hua5.2抗体的大小约为100kd,还原后大小约为50kd,如图6所示,蛋白的条带大小均正确。
[0104]
实施例8比较hua5.2和a5结合gpc3的亲和力差异
[0105]
将gpc3抗原蛋白(sino biological,cat:10088-h02h2)包被在elisa板底,然后将hua5.2和鸡抗a5分别以首孔20nm的浓度以1:3梯度稀释后加入孔内,然后加入hrp-羊抗人抗体,最后显色。如图7所示,hua5.2的ec50值为0.08628,而a5的ec50值为0.0961,说明hua5.2与gpc3蛋白的结合能力相比a5来说并没有降低,甚至亲和力更高。
[0106]
实施例9elispot检测hua5.2抗体的免疫原性
[0107]
human ifn-γprecoated elispot kit购自于达科为有限公司,货号为cat#.211005(strips),实验方法参见试剂盒的说明书。简单来说,就是将抗体与pnmc在elispot板上共孵育,然后通过板底已经固定的ifn-γ抗体捕获pbmc分泌的ifn-γ,然后显色在板底形成斑点,通过统计斑点数目的多少来判断hua5.2的免疫原性的高低。斑点数越多,说明pbmc分泌的ifn-γ越多,对所检蛋白的免疫反应越强,也就是免疫原性越大,反之亦然。如图8所示,hua5.2的斑点数明显少于a5,这表明hua5.2刺激t细胞产生的ifn-γ更少,免疫原性更低。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1