检测基因甲基化的试剂在宫颈癌诊断中的应用以及试剂盒的制作方法
1.本发明涉及肿瘤诊断技术领域,具体而言,涉及检测基因甲基化的试剂在宫颈癌诊断中的应用以及试剂盒。
背景技术:
2.宫颈癌是世界上最常见的妇科恶性肿瘤之一。在女性恶性肿瘤中,它仅次于乳腺癌。全世界每年约有50多万例新病例,有20多万例死亡。科学研究已经证实,高危乳头瘤病毒(hrhpv)的持续感染是宫颈癌的主要病因。从最初的病毒感染到浸润性宫颈癌的发展需要数十年的时间。只有定期进行身体检查,才能发现和预防超过90%的宫颈癌。因此,选择合适有效的诊断方法对宫颈癌的预防和治疗具有重要意义。目前,宫颈癌的常规筛查方法是细胞学检查、hpv dna检测和阴道镜检查。阴道镜检查具有较高的特异性,但需要高素质的操作人员,细胞学检查具有较高的特异性和较低的灵敏度,而hpv dna检测具有较高的灵敏度但具有较低的特异性。hpv感染多数是暂时性的,hpv dna检测的阳性结果对妇女造成不必要的恐慌并浪费医疗资源。只有真正hpv持续感染的高风险女性才需要接受随访。目前,科学家已经做出了很多努力来确定宫颈上皮内瘤样形成2+(cin2+)的新生物标志物,从而将良性感染的妇女与需要加强治疗的妇女区分开来以实现筛查后的分流。
3.dna甲基化是重要的表观遗传修饰,在不改变dna序列的情况下对调节基因表达模式和基因组稳定性起着重要作用。大多数研究表明,相关基因的甲基化水平随宫颈病变的严重程度而增加,可以用作筛选宫颈癌和癌前病变的生物标志物。
4.但目前,用于宫颈癌的生物标志物其灵敏度和特异性仍需提高。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供检测基因甲基化的试剂在宫颈癌诊断中的应用以及试剂盒。本发明发现了可用于宫颈癌或其癌前病变的诊断的新的甲基化基因:c12orf42、cntnap5、dpp6、ferd3l、foxg1-as1、gpr26、gria2、gria4、itga8、neto1和pabpc5,检测这些基因的甲基化以诊断宫颈癌或其癌前病变,具有更高和特异性;另外,检测这些甲基化基因的试剂同样具有新的用途,例如制备成宫颈癌或其癌前病变诊断试剂盒。本发明为宫颈癌和其癌前病变的诊断提供了新的标志物和诊断策略。
7.基于此,第一方面,本发明提供检测目标基因甲基化的试剂在制备用于宫颈癌或其癌前病变诊断的试剂盒中的应用,所述目标基因选自如下基因中的至少一种:c12orf42、cntnap5、dpp6、ferd3l、foxg1-as1、gpr26、gria2、gria4、itga8、neto1和pabpc5。
8.本发明提出了新的可以作为宫颈癌或其癌前病变诊断的标志物,即上述发生甲基化的基因,本发明的研究显示,这些基因在宫颈癌或其癌前病中发生有不同程度的甲基化,在宫颈癌中,甲基化阳性率达到90%以上,具有作为诊断或筛选宫颈癌的标志物的潜力和前景。基于此,检测上述基因甲基化的试剂具有了新的用途,用于制备用于宫颈癌或其癌前
病变诊断的试剂盒。
9.在可选的实施方案中,所述目标基因选自如下基因中的至少一种:dpp6、gpr26、neto1和pabpc5。
10.本发明的研究发现,以dpp6、gpr26、neto1和pabpc5基因甲基化单独对宫颈癌或癌前病变进行诊断,其具有更高的和特异性。
11.在可选的实施方案中,所述目标基因选自如下基因组合的任意一种:
12.dpp6+gpr26、dpp6+neto1、dpp6+pabpc5、gpr26+neto1、gpr26+pabpc5以及neto1+pabpc5。
13.以上述基因甲基化组合的形式对宫颈癌或癌前病变进行诊断,能够明显提高和特异性,尤其是以dpp6+neto1、gpr26+neto1、gpr26+pabpc5和neto1+pabpc的组合方式诊断宫颈癌,其敏感性基本可以达到100%,且特异性在90%以上。
14.在可选的实施方案中,所述试剂通过如下方法对所述目标基因进行甲基化检测:甲基化特异性pcr法、methylight法、亚硫酸氢盐测序法、甲基化特异性微阵列法、全基因组甲基化测序法、焦磷酸测序法、甲基化特异性高效液相层析法、数字pcr法、甲基化特异性高分辨率溶解曲线法、甲基化敏感性限制性内切酶法或flap endonuclease法。
15.需要说明的是,实现基因甲基化的检测手段是本领域技术人员熟知的,例如包括但不限于甲基化特异性pcr法、methylight法、亚硫酸氢盐测序法、甲基化特异性微阵列法、全基因组甲基化测序法、焦磷酸测序法、甲基化特异性高效液相层析法、数字pcr法、甲基化特异性高分辨率溶解曲线法、甲基化敏感性限制性内切酶法以及flap endonuclease法等,采用这些方法均可以实现目标基因的甲基化检测。基于此,适用于上述方法的试剂均可以制备成宫颈癌或其癌前病变诊断的试剂盒。
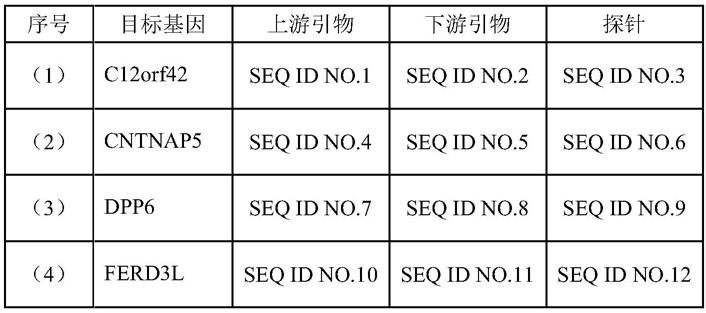
16.在可选的实施方案中,所述试剂通过甲基化特异性pcr法对所述目标基因进行甲基化检测,所述试剂包括表中第(1)-(11)项中至少一项所示的引物和探针:
17.18.。
19.采用上表所示引物和探针检测对应基因的甲基化,对宫颈癌或其癌前病变进行判断时,具有更高的和特异性。但需要说明的是,在采用甲基化特异性法对上述基因进行甲基化检测时,各基因所用的引物和探针包括但不限于上述表中所示的引物和探针序列,本领域技术人员根据本发明所公开的基因,可以设计或选择上表所示范围之外的其他引物和探针,因此,无论以何种引物探针实现上述基因甲基化的检测,其均属于本发明的保护范围。
20.在可选的实施方案中,进行基因甲基化检测的样本为宫颈癌组织样本或宫颈来源的细胞样本。
21.第二方面,本发明提供一种用于宫颈癌或其癌前病变诊断的试剂盒,其包括:用于检测目标基因甲基化的试剂;
22.所述目标基因选自如下基因中的至少一种:c12orf42、cntnap5、dpp6、ferd3l、foxg1-as1、gpr26、gria2、gria4、itga8、neto1和pabpc5。
23.在可选的实施方案中,所述目标基因选自如下基因中的至少一种:dpp6、gpr26、neto1和pabpc5。
24.在可选的实施方案中,所述目标基因选自如下基因组合的任意一种:dpp6+gpr26、dpp6+neto1、dpp6+pabpc5、gpr26+neto1、gpr26+pabpc5以及neto1+pabpc5。
25.在可选的实施方案中,所述试剂通过如下方法对所述目标基因进行甲基化检测:甲基化特异性pcr法、methylight法、亚硫酸氢盐测序法、甲基化特异性微阵列法、全基因组甲基化测序法、焦磷酸测序法、甲基化特异性高效液相层析法、数字pcr法、甲基化特异性高分辨率溶解曲线法、甲基化敏感性限制性内切酶法或flap endonuclease法。
26.在可选的实施方案中,所述试剂包括表中第(1)-(11)项中至少一项所示的引物和探针:
27.28.。
29.第三方面,本发明提供用于宫颈癌或其癌前病变诊断的试剂盒的制备方法,其包括:将检测目标基因甲基化的试剂作为主要原料:
30.所述目标基因选自如下基因中的至少一种:c12orf42、cntnap5、dpp6、ferd3l、foxg1-as1、gpr26、gria2、gria4、itga8、neto1和pabpc5。
31.在可选的实施方案中,所述目标基因选自如下基因中的至少一种:dpp6、gpr26、neto1和pabpc5。
32.在可选的实施方案中,所述目标基因选自如下基因组合的任意一种:dpp6+gpr26、dpp6+neto1、dpp6+pabpc5、gpr26+neto1、gpr26+pabpc5以及neto1+pabpc5。
33.在可选的实施方案中,所述试剂通过如下方法对所述目标基因进行甲基化检测:甲基化特异性pcr法、亚硫酸氢盐测序法、甲基化特异性微阵列法、全基因组甲基化测序法、methylight法、焦磷酸测序法、甲基化特异性高效液相层析法、数字pcr法、甲基化特异性高分辨率溶解曲线法、甲基化敏感性限制性内切酶法或flap endonuclease法。
34.在可选的实施方案中,所述试剂包括表中第(1)-(11)项中至少一项所示的引物和探针:
35.36.。
具体实施方式
37.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
38.以下结合实施例对本发明的特征和性能作进一步的详细描述。
39.实施例1
40.本实施例提供宫颈癌或其癌前病变的诊断方法,该方法通过甲基化特异性pcr(methylation-specific pcr,msp)检测样本中如下基因中的一种或两种的甲基化进行诊断:
41.c12orf42、cntnap5、dpp6、ferd3l、foxg1-as1、gpr26、gria2、gria4、itga8、neto1和pabpc5。
42.具体步骤包括:
43.(1)细胞dna提取
44.对来自待测患者的宫颈细胞样本进行dna提取。细胞dna提取试剂盒可以是qiaamp dna mini kit(qiagen,货号51304),具体实验操作参见厂家说明书。用nanodrop 2000分光光度计对dna浓度和od260/od280进行测定,od260/od280的值应在1.8-2.0之间。
45.(2)亚硫酸盐转化
46.所用核酸转化试剂盒为zymo research的ez dna methylation-gold tm kit,具体实验操作参见厂家说明书。在本过程中,未甲基化的胞嘧啶(c)被转化成尿嘧啶(u),甲基化的胞嘧啶不变,尿嘧啶在后续的pcr步骤中与腺嘌呤(a)配对,胞嘧啶与鸟嘌呤(g)配对,以此实现甲基化与未甲基化序列的区分。
47.(3)msp
48.针对每个基因甲基化标记物,用特异性的taqman引物和探针进行pcr,引物和探针序列如下表1;
49.表1
[0050][0051]
以β-actin作为内参基因,其中β-actin正向引物为:caagatgagattggcatggct;β-actin反向引物为:tgtgaactttgggggatgctc;β-actin探针为:ccagtttttaaatcctgagtcaagc。
[0052]
各基因对应的引物和探针对应的序列标识符(seq id no.)见下表2:
[0053]
表2
[0054]
[0055][0056]
(a)单重pcr
[0057]
pcr反应体系如下:
[0058]
[0059][0060]
其中标记物探针5’端的报告基团为fam,3’端猝灭基团为mgb,β-actin探针5’端的报告基团为vic,3’端猝灭基团为bhq1。
[0061]
(b)双重pcr
[0062]
pcr反应体系如下:
[0063]
组分规格体积(μl)缓冲液5
×
5dntps各2.5mm2标记物1正向引物10μm1标记物1反向引物10μm1标记物1探针10μm1标记物2正向引物10μm1标记物2反向引物10μm1标记物2探针10μm1β-actin正向引物10μm1β-actin反向引物10μm1β-actin探针10μm1dna酶5u/μl0.5待测样本dna/5纯化水/补至25
[0064]
在双重pcr体系中,标记物1探针5’端的报告基团为fam,3’端猝灭基团为mgb,标记物2探针5’端的报告基团为rox,3’端猝灭基团为mgb,β-actin探针5’端的报告基团为vic,3’端猝灭基团为bhq1。
[0065]
本领域技术人员根据实际需要选自合适的两个基因进行组合,在双重pcr体系中加入表1中对应的引物探针即可。
[0066]
(c)上述单重和双重pcr反应条件如下:
[0067][0068]
ct值读取:pcr完成后,调整基线,将阈值设置在扩增曲线的指数增长期,得到每个样本各个基因的ct值。
[0069]
质量控制:在每次检测时对阴性对照和阳性对照进行同步检测,阴性对照为纯化水,阳性对照为包含有β-actin基因中待扩增区段的人工合成质粒和包含有目标基因中待扩增区段的人工合成质粒混合而成,浓度均为103拷贝/微升,阴性对照要无扩增,阳性对照
要有明显的指数增长期,且阳性对照中内参基因和目标基因的ct值均应在26-30之间。待检样本的内参基因β-actin的ct值应小于36,阴性对照、阳性对照及待检样本的内参基因均满足上述要求后,表明本次实验有效,可进行下一步样本结果的判定。否则,当次实验无效,须重新进行检测。
[0070]
结果分析:在单重pcr体系中,若标记物的ct值<38,则该样本为甲基化阳性;在二重pcr体系中,若至少一个标记物的ct值<38,则该样本为甲基化阳性。
[0071]
如果甲基化为阳性,表示受检者取样时患有宫颈癌或癌前病变的可能性较高,建议进行临床确诊;若待测样本检测结果为阴性,表示受检者取样时患有宫颈癌或癌前病变的可能性较低,建议定期进行筛查。
[0072]
敏感性和特异性的计算:
[0073]
敏感性(sensitivity)=真阳性人数/(真阳性人数+假阴性人数)*100%;
[0074]
特异性(specificity)=真阴性人数/(真阴性人数+假阳性人数)*100%。
[0075]
实验例1
[0076]
选择232例有组织活检结果的患者的宫颈细胞样本,其中30例为宫颈炎症样本,32例来自于宫颈上皮内瘤样形成2(cin2)的个体,35例来自于宫颈上皮内瘤样形成3(cin3)的个体,62例来自于宫颈癌样本,其中34例为宫颈鳞癌样本,23例宫颈腺癌样本,5例其他类型宫颈癌样本。
[0077]
(1)采用实施例1的方法,在单重pcr条件下,检测上述基因标记物在30例宫颈炎症样本,32例cin2样本,35例cin3样本和62例宫颈癌样本中的甲基化阳性个数、计算敏感性和特异性,结果见下表3。
[0078]
表3
[0079][0080]
由上述结果可以看出,11个甲基化基因标记物在宫颈炎症样本中的甲基化阳性率均不超过15%,即这11个甲基化基因标记物的检测特异性均不低于85%,除foxg-as1外,其他10个基因的特异性均不低于90%。此外,这些标记物在宫颈癌样本中的甲基化敏感性均不低于90%。
[0081]
这11个甲基化基因标记物在cin2和cin3中的甲基化阳性率差别比较明显,综合来看,dpp6、gpr26、neto1和pabpc5这四个甲基化基因标记物的表现最好,其在cin2和cin3中的敏感性分别为21.88%和71.43%、21.88%和68.57%、15.63%和65.71%及18.75%和71.43%。
[0082]
(2)在二重pcr条件下,采用实施例1的方法,检测dpp6、gpr26、neto1和pabpc5这四个标记物的两两组合在30例宫颈炎症样本,32例cin2样本,35例cin3样本和62例宫颈癌样本中的甲基化阳性个数、计算敏感性和特异性,结果见表4。
[0083]
表4
[0084]
[0085][0086]
由上述结果可以看出,当这四个甲基化基因标记物两两组合时,其在cin2、cin3和宫颈癌样本中的甲基化阳性率均有明显的提升,cin2中的敏感性均在20%以上,cin3中的敏感性均在70%以上,有四组甲基化基因的组合(dpp6+neto1、gpr26+neto1、gpr26+pabpc5和neto1+pabpc)在宫颈癌样本中的敏感性达到100%。值得注意的是,这六组基因组合标记物在宫颈癌炎症样本中的阳性率仍然小于10%,说明其特异性均不低于90%。
[0087]
综上所述,可以看出,以上甲基化基因标记物或其组合能很好的区分宫颈癌炎症样本和病变样本,可用于制备用于宫颈癌及癌前病变诊断的试剂盒。
[0088]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1