寡核苷酸及其在抗乙型肝炎和丁型肝炎病毒中的应用的制作方法
1.本发明属于生物医药领域,具体涉及一种反义寡核苷酸及其抗乙型肝炎和丁型肝炎病毒的应用。
背景技术:
2.乙型肝炎(hepatitis b)是一种由乙肝病毒(hbv)感染引起的病毒性疾病,主要传播途径包括血液传播、性传播和母婴传播。世界卫生组织(world health organization)估计,2015年全球有超过2亿人慢性感染hbv,有88.7万人因hbv感染引起的并发症而死亡。感染hbv的成年人90%能够自愈,但是婴幼儿感染hbv后,90%会发展成为慢性肝炎。慢性hbv感染可能会导致肝纤维化,进一步发展为肝硬化和肝细胞癌(hcc)。另外,有研究表明乙肝会增加胰腺癌风险。
3.丁型肝炎病毒(丁肝病毒,hdv)是hbv的卫星病毒,依赖乙肝表面抗原(hbsag)形成其完整的具有感染性的hdv病毒颗粒,hdv感染仅可在伴随hbv感染的患者中发生。hdv/hbv共感染并发症显著并且还显著增加了肝纤维化至肝硬化的进展速率。对于hdv慢性感染的患者,目前仅有干扰素治疗一种干预手段,无直接靶向hdv病毒的上市药物,现有治疗方法疗效不佳,副作用显著。
4.hbv通过低亲和力受体粘附到肝细胞表面,再借助于肝细胞膜上的特异性受体通过内吞作用进入肝细胞内。核衣壳解体并将rcdna导入宿主细胞核。在细胞核内,rcdna通过细胞的dna修复机制转化成共价闭合环状dna(cccdna)。cccdna为hbv遗传物质在细胞内的存储形式,也是hbv的主要转录模板。宿主细胞识别cccdna上的启动子和增强子转录出3.5kb,2.4kb,2.1kb及0.7kb的mrna,其中3.5kb的为前基因组rna(pgrna)。mrna进入细胞质翻译为病毒蛋白,包括核心抗原(hbcag),e抗原(hbeag),表面抗原(hbsag),x蛋白(hbx)和多聚酶(polymerase)。在polymerase的作用下以pgrna为模板逆转录合成hbv dna的负义链,然后以负义链为模板进一步合成部分正义链,形成rcdna。同时,hbcag组装成核衣壳将rcdna包裹其中形成病毒核心颗粒。hbsag合成后在内质网中多聚化并转运至高尔基体以包装病毒核心颗粒,装配好的病毒颗粒最后以出芽的方式分泌至细胞外。
5.hbv感染人肝细胞后主要产生两种不同的颗粒,一种是dane颗粒,也就是完整的hbv病毒本身,包括由乙肝核心抗原(hbcag)和病毒核酸(rcdna)组装而成的病毒核衣壳,且具有由乙肝表面抗原(hbsag)组成的病毒包膜;另一种是亚病毒颗粒(svp),其是由脂质、胆固醇、胆固醇酯和乙肝表面抗原(hbsag)组成的非感染性颗粒。svp所包含的乙肝表面抗原占患者血液中乙肝表面抗原的绝大多数(》99.9%)。hbv感染的肝细胞还分泌一种e-抗原(hbeag)到血液中。乙肝表面抗原(hbsag)、乙肝表面抗体(hbsab)、乙肝核心抗体(hbcab)、乙肝e抗原(hbeag)以及乙肝e抗体(hbeab)是评价药物对病毒干预情况的重要分子标记物。
6.hbv慢性感染患者血液中大量的以亚病毒颗粒(svp)形式存在的乙肝表面抗原(hbsag)可以中和b淋巴细胞分泌的特异性乙肝表面抗体(hbsab),进而导致免疫耐受,而仅占少数的hbv病毒颗粒则能够逃逸免疫检查,这可能是hbv保持慢性感染的重要原因之一。
乙肝表面抗原(hbsag)的血清学转换(hbsag从血液中清除,游离的hbsab的出现)是治疗时,病毒感染获得功能性控制的公认的预后指标。hbv保持慢性感染特征的另一关键原因是其在感染的肝细胞的细胞核中借助宿主dna修复酶合成了稳定的环状dna存储库,即hbv共价闭合环状dna(cccdna)。cccdna可在肝细胞中长期稳定存在,并能够持续获得补充,其可通过转录和逆转录产生hbv病毒的核酸rcdna及编码全部病毒抗原所需的mrna。cccdna的转录抑制或清除对于治愈或功能性治愈hbv感染是至关重要的。核苷(酸)类似物长期治疗并不能彻底清除cccdna,也不能抑制其转录,因此乙肝表面抗原(hbsag)表达水平几乎不受核苷(酸)类药物的影响。免疫调节可介导体液和细胞免疫,进而抑制cccdna转录或者清除被感染的细胞,但大的抗原负荷会极大的抑制该免疫过程,因此大幅降低抗原,尤其是乙肝表面抗原(hbsag),结合免疫调节是帮助患者获得持久免疫控制的有效手段。
7.临床上用于治疗乙型肝炎的药物主要有干扰素类和核苷(酸)类药物。干扰素类药物有普通干扰素和聚乙二醇修饰的长效干扰素,后者包括派罗欣(peg-ifnα-2a)和佩乐能(peg-ifnα-2b)。核苷(酸)类药物包括拉米夫定、替比夫定、阿德福韦酯、富马酸替诺福韦二吡呋酯(tdf)、富马酸替诺福韦艾拉酚胺(taf)、恩替卡韦等。这些核苷类药物能有效的控制病毒的复制,改善肝功能,因而应用最为广泛。干扰素需要注射给药,个体反应差异大,不良反应明显,且疗效不佳。核苷类药物仅作用于病毒从pgrna到rcdna的复制过程,对乙肝病毒生命周期中其他的环节没有抑制作用。长期治疗,乙肝e抗原(hbeag)转阴率仍然较低,极少数患者乙肝表面抗原(hbsag)能够转阴。恩替卡韦(354例)和替诺福韦(176例)治疗48周,在乙肝e抗原(hbeag)阳性的患者中乙肝表面抗原(hbsag)转阴率分别为2%和3.2%,在乙肝e抗原(hbeag)阴性的患者中乙肝表面抗原(hbsag)转阴率分别为0.3%和0%。由于现有的治疗方案不能治愈乙肝,需要患者长期服药,可能使患者面临重大副作用,例如长期服用阿德福韦酯和富马酸替诺福韦二吡呋酯均可导致肾毒性和骨毒性。现有药物的疗法或组合疗法除了在小部分患者(《3%)外,无法引起能够提供感染的持久控制或者功能性治愈的有效免疫反应或hbsag的血清学转换。治愈或功能性治愈hbv慢性感染是巨大的未满足的临床需求。
8.综上所述,本领域迫切需要发现和开发新的抗病毒治疗方法。尤其迫切需要能够有效抑制乙肝病毒抗原hbsag和/或hbeag提高其血清学转换率的新疗法。
技术实现要素:
9.本发明的目的就是提供一种用于抗乙型肝炎病毒/丁型肝炎病毒治疗的新化合物。
10.在本发明的第一方面中,提供了一种化合物,或其药学上可接受的盐、水合物或溶剂化物,其中,所述的化合物为修饰或未修饰的寡核苷酸,且所述的寡核苷酸的长度为24-40nt,较佳地26-38nt,更佳地30-36nt;
11.并且,所述的寡核苷酸具有seq id no.1所示的核心序列
12.gtgcagaggtgaax1x2x3aagtgcac(seq id no.1)
13.式中,x1x2x3为gcg、ccg或cct;并且核心序列中的每个t可以各自独立地被u取代;
14.其中,所述的修饰为选自下组的一种或多种修饰:
15.(i)核苷的修饰;所述核苷的修饰包括2'-o-甲基化糖基修饰、2'-o-甲氧基乙基化
糖基修饰、和/或胞嘧啶的5位甲基化修饰;
16.(ii)核苷间键的修饰;所述核苷间键的修饰为所述的寡核苷酸中的部分或全部核苷间键被硫代磷酸酯核苷间键和/或二硫代磷酸酯键核苷间键取代。
17.在另一优选例中,x1x2x3为gcg。
18.在另一优选例中,所述的寡核苷酸具有式i结构:
19.z1-z2-z3
ꢀꢀꢀ(i)20.式中,
21.z1为位于核心序列5’端的左延伸序列,并且所述左延伸序列的长度l1为0-10nt;并且当l1≥1时,所述左延伸序列依次包括5
’-
tccatgcgac-3’中第11-l1位至第10位的核苷酸(即,l1=1时,z1为c;l1=2时,z1为ac;
……
;l1=10时,z1为5
’-
tccatgcgac-3’);
22.z2为所述的核心序列;
23.z3为位于核心序列3’端的右延伸序列,并且所述右延伸序列的长度l2为0-12nt,并且当l2≥1时,所述右延伸序列依次包括5
’-
acggtccggcag-3’中第1位至第l2位的核苷酸(即,l2=1时,z3为a;l2=2时,z1为ac;
……
;l2=12时,z1为5
’-
acggtccggcag-3’);
24.并且寡核苷酸中每个t可以各自独立地被u取代。
25.在另一优选例中,l1为0、1、2、3、4、5、6、7、8、9、或10。
26.在另一优选例中,l2为0、1、2、3、4、5、6、7、8、9、10、11、或12。
27.在另一优选例中,l1+l2等于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、或16。
28.在另一优选例中,所述寡核苷酸中全部核苷间键被硫代磷酸酯核苷间键取代。
29.在另一优选例中,所述寡核苷酸有一个或多个核苷酸存在核苷修饰。
30.在另一优选例中,所述寡核苷酸在选自下组的区域存在核苷修饰:5’端的2-6个nt、x1x2x3中的2-3个nt、3’端的2-6个nt、或其组合。
31.在另一优选例中,所述的5’端的2-6个nt是指自5’端起2-6个连续核苷酸。
32.在另一优选例中,所述的3’端的2-6个nt是指自3’端起2-6个连续核苷酸。
33.在另一优选例中,所述x1x2x3中的2-3个nt是指其中2-3个连续核苷酸。
34.在另一优选例中,所述寡核苷酸还任选地在自x1x2x3的3’端和/或5’端延伸的1、2或3存在修饰,并且这些修饰于x1x2x3中2-3个修饰的nt是连续的。
35.在另一优选例中,自x1x2x3的3’端和/或5’端延伸的1、2或3存在修饰与x1x2x3中的修饰的2-3个nt是连续的。
36.在另一优选例中,所述寡核苷酸5’端的2-6个nt、x1x2x3中的2-3个nt和3’端的2-6个nt均存在核苷修饰。
37.在另一优选例中,在5’端的2-6个存在核苷修饰的区域与x1x2x3之间的间隔区域gap1不存在核苷修饰,或存在部分或全部的核苷修饰。
38.在另一优选例中,在x1x2x3和3’端的2-6个存在核苷修饰的区域之间的间隔区域gap2不存在核苷修饰,或存在部分或全部的核苷修饰。
39.在另一优选例中,所述的间隔区域gap1中至少包括l
g1
个无核苷修饰的连续核苷酸,其中l
g1
为5-14的正整数,较佳地为8、9、10、11、12、13或14;更佳地,为10、11、12或13。
40.在另一优选例中,所述的间隔区域gap2中至少包括l
g2
个无核苷修饰的连续核苷酸,其中l
g1
为5-11的正整数,较佳地为8-10,更佳地为8、9或10。
41.在另一优选例中,所述的寡核苷酸与如seq id no.25所示的序列互补或与如seq id no.25所示的序列具有至少96%(较佳地,至少98%;更佳地,100%)同源性的碱基序列可以完全互补。
42.在另一优选例中,所述的寡核苷酸为如seq id no.3-6中任一所示的寡核苷酸,或者如seq id no.3-6中任一所示的寡核苷酸中的一个或多个t被u所取代的寡核苷酸。
43.在另一优选例中,所述的寡核苷酸为如seq id no.6中所示的寡核苷酸,或者为如seq id no.6中所示的寡核苷酸中的一个或多个t被u所取代的寡核苷酸。
44.在另一优选例中,所述的寡核苷酸如seq id no.2所示(即将如seq id no.6所示寡核苷酸的3'端的t替换为u)或seq id no.6。
45.在另一优选例中,所述核苷间键的修饰是指将寡核苷酸中的部分或全部的(较佳地,至少90%的;更佳地,全部的)磷酸二酯键(-op(oh)(=o)o-或-op(o-)(=o)o-)替换为硫代磷酸酯键(-op(oh)(=s)o-或-op(o-)(=s)o-)或二硫代磷酸酯键(较佳地,硫代磷酸酯键)。
46.在另一优选例中,修饰的寡核苷酸的核苷间键为硫代磷酸酯键或二硫代磷酸酯键。
47.在另一优选例中,修饰的寡核苷酸的核苷间键均为硫代磷酸酯键。
48.在另一优选例中,所述核苷的修饰为糖基的修饰以及任选的碱基的修饰;其中所述的糖为核糖或脱氧核糖。
49.在另一优选例中,所述2'-o-甲基化糖基修饰是指糖基的2位基团为-o-甲基(即2'-o-甲基)。
50.在另一优选例中,所述2'-o-甲氧基乙基化糖基修饰是指糖基的2位基团为-o-甲氧基乙基(即2'-o-甲氧基乙基)。
51.在另一优选例中,所述的寡核苷酸是修饰的,且所述寡核苷酸按5'至3'的顺序依次分为s1段、s2段、s3段、s4段和s5段,即修饰的寡核苷酸如5'-s1-s2-s3-s4-s5-3'所示;
52.其中,
53.s1段、s3段和s5段中每个核苷均为修饰的核苷(较佳地,所述修饰的核苷包含修饰的糖和修饰或未修饰的碱基);
54.s2段和s4段中每个核苷均为未修饰的核苷;
55.所述的寡核苷酸的各个核苷部分之间各自独立地通过磷酸二酯键或硫代磷酸酯键连接(较佳地,均通过硫代磷酸酯键连接)。
56.在另一优选例中,所述的修饰的寡核苷酸中核苷间键至少部分地为经修饰的核苷间键(即硫代磷酸酯核苷间键)。
57.在另一优选例中,所述的修饰的寡核苷酸中核苷间键全部为经修饰的核苷间键(即硫代磷酸酯核苷间键)。
58.在另一优选例中,所述s1段对应于存在修饰的5’端的2-6个nt的区域。
59.在另一优选例中,所述s2段对应于所述间隔区域gap1中包括l
g1
个无核苷修饰的连续核苷酸。
60.在另一优选例中,所述s3段对应于在x1x2x3中的2-3个nt存在的修饰和在自任选地在自x1x2x3的3’端和/或5’端延伸的1、2或3存在修饰。
61.在另一优选例中,所述s4段对应于间隔区域gap2中包括l
g2
个无核苷修饰的连续核苷酸,其中l
g1
为5-11的正整数,较佳地为8-10,更佳地为8、9或10。
62.在另一优选例中,所述s5段对应与3’端的2-6个nt的区域。
63.在另一优选例中,s1段长度为3、4或5nt,s2段长度为8、9、10、11、12、13或14nt,s3段为长度为1、2、3、或4nt,s4段长度为8、9或10nt,和/或s5段长度为3、4或5nt。
64.在另一优选例中,所述寡核苷酸为如seq id no.3-6中任一所示的寡核苷酸或如seq id no.3-6中任一所示的寡核苷酸中各个t任选地被u取代的寡核苷酸;其中,s1段长度为3、4或5nt,s2段长度为8、9、10、11、12或13nt,s3段长度为2、3、或4nt,s4段长度为8、9或10nt,和/或s5段长度为4或5nt。
65.在另一优选例中,所述的寡核苷酸如seq id no.6所示的寡核苷酸琥或如seq id no.6中所示的寡核苷酸中各个t任选地被u取代的寡核苷酸,其中,s1段长度为4nt,s2段长度为13nt,s3段为长度为2nt,s4段长度为9nt,和/或s5段长度为4nt。
66.在另一优选例中,s1段、s3段和s5段中,经修饰的核苷各自独立地为糖基经修饰的核苷,或糖基和碱基均经修饰的核苷。
67.在另一优选例中,所述为糖基经修饰的核苷是指糖基含2'-o-甲基基团的核苷。
68.在另一优选例中,所述糖基和碱基均经修饰的核苷是指糖基含2'-o-甲基基团且碱基为5-甲基胞嘧啶的核苷。
69.在另一优选例中,所述的寡核苷酸如seq id no.2所示(即将如seq id no.6所示寡核苷酸的3'端的t替换为u);并且
70.s1段长度为4nt,且其中的各核苷为修饰的核苷;
71.s2段长度为13nt,且其中的各核苷为未经修饰的核苷;
72.s3段长度为2nt,且其中的各核苷为修饰的核苷;
73.s4段长度为9nt,且其中各核苷为未修饰的核苷;和/或
74.s5段长度为4nt,且其中各核苷为修饰的核苷。
75.在另一优选例中,s1段、s3段和s5段中,修饰的核苷各自独立地为糖基经修饰的核苷,或当碱基为胞嘧啶时糖基和碱基均经修饰的核苷部分;
76.其中,所述为糖基经修饰的核苷是指糖基含2'-o-甲基基团的核苷,和所述糖基和碱基均经修饰的核苷是指糖基含2'-o-甲基基团且碱基为5-甲基胞嘧啶的核苷。
77.在另一优选例中,所述的化合物为修饰的寡核苷酸,并且所述的化合物选自下组:
78.mg*ma*mc*mg*t*g*c*a*g*a*g*g*t*g*a*a*g*mc*mg*a*a*g*t*g*c*a*c*a*mc*mg*mg*mu(pa0020);或者
79.mg*ma*(5me-mc)*mg*t*g*c*a*g*a*g*g*t*g*a*a*g*(5me-mc)*mg*a*a*g*t*g*c*a*c*a*(5me-mc)*mg*mg*mu(pa0020c)
80.其中,a、t、g和c表示未修饰的核苷;ma、mu、mg和mc表示经2'-o-甲基化修饰的核苷;*表示硫代磷酸酯键;和(5me-mc)表示2'-甲氧基-5-甲基胞苷。
81.在本发明的第二方面中,提供了一种药物组合物,所述的药物组合物包括如第一方面所述的化合物,或其药学上可接受的盐、水合物或溶剂化物,以及药学上可接受的载体。
82.在本发明的第三方面中,提供了一种如第一方面所述的化合物,或其药学上可接
受的盐、水合物或溶剂化物,或者如第二方面所述的药物组合物在制备用于治疗和/或预防与乙型肝炎病毒或丁型肝炎病毒相关的疾病中的用途。
83.在另一优选例中,所述的疾病包括下述的一种或多种疾病:乙型肝炎病毒感染相关的疾病、乙型肝炎病毒和丁型肝炎病毒共感染相关的疾病。
84.在另一优选例中,所述的疾病可以是急性疾病或慢性疾病。
85.在另一优选例中,所述的疾病包括乙型病毒性肝炎、丁型病毒性肝炎、肝纤维化、肝硬化、肝细胞癌(hcc),或其组合。
86.在另一优选例中,所述的疾病包括急性或慢性肝脏疾病。
87.在本发明的第四方面中,提供了一种治疗和/或预防乙型肝炎病毒或丁型肝炎病毒相关的疾病的方法,所述方法包括步骤:向需要的对象施用安全有效量的如第一方面所述的化合物,或其药学上可接受的盐、水合物或溶剂化物,或者如第二方面所述的药物组合物。
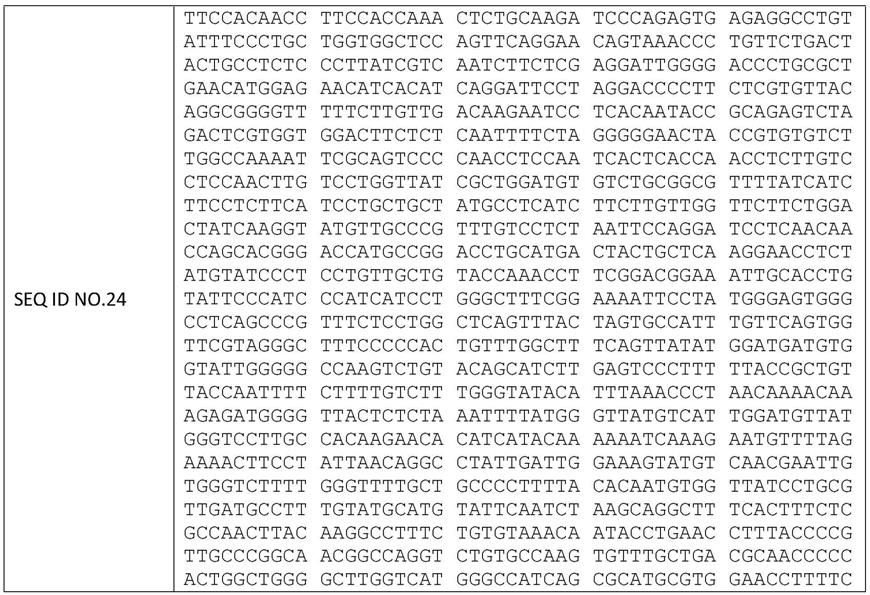
88.在另一优选例中,所述的疾病如第三方面中定义。
89.在另一优选例中,所述的方法通过静脉注射和/或皮下注射向需要的对象施用安全有效量的如第一方面所述的化合物,或其药学上可接受的盐、水合物或溶剂化物,或者如第二方面所述的药物组合物。
90.在另一优选例中,所述的对象为哺乳动物;较佳地,所述的对象选自人、大鼠、小鼠,或其组合。
91.在本发明的第五方面中,提供了一种调节hbv dna/rna、hbsag和/或hbeag表达的方法,所述方法包括步骤:使对象与如第一方面所述的化合物,或其药学上可接受的盐、水合物或溶剂化物接触,从而调节hbv dna/rna、hbsag和/或hbeag表达。
92.在另一优选例中,所述方法是体外非治疗性的。
93.在另一优选例中,所述的对象是细胞。
94.在另一优选例中,所述的调节是指抑制hbv dna/rna、hbsag和/或hbeag的表达,或者降低细胞外(如细胞的培养基)中hbv rna和/或hbeag的水平。
95.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
96.图1显示了脂质体转染不同序列的反义寡核苷酸在hepg2.2.1.5细胞系中的抗病毒效果,在测试结束时通过检测细胞上清中分泌的hbsag浓度来评价。
97.图2显示了脂质体转染不同浓度的反义寡核苷酸pa0020和pa0021在hepg2.2.1.5细胞系中的抗病毒效果,在测试结束时通过检测细胞上清中分泌的hbsag浓度来评价。
98.图3显示了每周一次腹腔注射30mg/kg,60mg/kg,90mg/kg递增剂量的pa0020在aav-hbv小鼠模型中的抗病毒作用,在治疗结束时通过qpcr检测血清hbv-dna,通过elisa检测血清hbsag和hbeag来评价。
99.图4显示了每周一次腹腔注射90mg/kg的pa0020c在aav-hbv小鼠模型中的抗病毒作用,在治疗结束时通过qpcr检测血清hbv-dna,通过elisa检测血清hbsag来评价。
100.图5显示了不同gap修饰模式的反义寡核苷酸对hepg2.2.1.5表达分泌hbsag的相对抑制率。
具体实施方式
101.本发明人经过长期而深入的研究,意外地发现能够与乙肝病毒泛基因型的保守序列互补的长度仅为24-40nt的反义寡核苷酸a(即包括如seq id no.1所示的核心序列的寡核苷酸)具有显著优异的抗病毒活性。尤其是,序列为seq id no.6(或其中t被u取代)的double-gap反义寡核苷酸(即经过本文所述的特定修饰方式修饰的寡核苷酸)在动物水平同样能够显著抑制乙肝病毒dna复制并且同时显著降低血清中hbsag和hbeag的浓度。本发明反义寡核苷酸能够明确靶向病毒rna,进而在转录水平减少病毒基因产物的表达,十分适合联合本领域的其他抗病毒疗法,并具有乙型肝炎的功能性治愈的前景。基于上述发现,发明人完成了本发明。
102.术语
103.术语“寡核苷酸”是指核糖核酸(rna)和/或脱氧核糖核酸(dna)中的核苷酸的低聚物。该术语包括由修饰或未修饰的核碱基、修饰或未修饰糖(核糖或脱氧核糖)和修饰或未修饰的核苷间键(磷酸二酯键)构成的寡核苷酸,以及所述寡核苷酸中一个或多个碱基可任选地被替换(如将t替换为修饰或未修饰的u),以及具有非天然存在的部分的功能类似的寡核苷酸。特别地修饰或取代的寡核苷酸可以由于诸如以下的期望的性质而优于自然形式:例如,免疫反应性降低、细胞摄取增强、对核酸靶标的亲和力增强和/或对核酸酶介导的降解的稳定性提高。在本发明中,寡核苷酸可以是单链或双链的,包括单链分子,诸如反义寡核苷酸(aso)、和适配体和mirna等,以及双链分子,诸如小干扰rna(sirna)或小发夹rna(shrna)。寡核苷酸可以包括各种修饰,例如稳定修饰,并且因此可以在磷酸二酯键(部分或全部)和/或在糖和/或碱基上进行至少一种修饰或包括至少一种修饰基团。例如,寡核苷酸可进行包括但不限于,一种或多种修饰,或可完全经修饰以便含有具有所述的修饰的所有键或糖或碱基(也就是说,组成该寡核苷酸的每个磷酸二酯键、糖和碱基均为未修饰的,或者部分被修饰或者全部被修饰)。在本发明中,经过修饰的核苷间键可以是硫代磷酸酯键和/或二硫代磷酸酯键。对本发明有用的其他修饰包括但不限于,在糖的2'位置的修饰,包括2'-o-烷基修饰(诸如2'o-甲基修饰、2'o-甲氧基乙基(2'moe))、2'-氨基修饰、2'-卤素修饰(诸如2'-氟取代);无环核苷酸类似物。其他2'位修饰也是本领域中熟知的并且可加以使用,诸如锁核酸。具体地,寡核苷酸具有遍及各处的经修饰的键或具有经修饰的每个键,例如,硫代磷酸酯;具有3'-帽和/或5'-帽:包括末端3'-5'键。碱基修饰可包括胞嘧啶碱基的5'甲基化(5'甲基胞嘧啶)和/或尿嘧啶碱基的4'硫基化(4'硫尿嘧啶)。当合成条件是化学相容的时候,则可组合不同的化学相容的修饰的键,例如具有带有硫代磷酸酯键、2'核糖修饰(例如2'o-甲基化)和经修饰的碱基(例如5'甲基胞嘧啶)的寡核苷酸。可利用所有这些不同的修饰(例如每个硫代磷酸酯化键、每个2'修饰的核糖和每个经修饰的碱基)进一步完全修饰寡核苷酸。
104.为了简洁起见,除非特别说明,在本文中以dna/rna序列形式表示或以例如如seq id no.6所示的方式的限定的寡核苷酸包括具有该序列的寡核苷酸的修饰或未修饰的情况。
105.术语“反义寡核苷酸”是指具有允许与目标核酸相应区段杂交的核酸碱基序列的单链寡核苷酸。
106.如本文所用,术语“nt”是指核苷酸。
107.术语“互补”是指反义寡核苷酸的核酸碱基序列与目标核酸中相应核酸碱基碱基序列进行准确碱基配对的能力,且由相应核酸碱基之间的氢键结合介导,例如腺嘌呤碱基与胸腺嘧啶(或尿嘧啶)配对,鸟嘌呤与胞嘧啶配对。
108.本发明中,术语“含有”、“包括”或“包含”表示各种成分可以一起应用于本发明的混合物或组合物中。因此,术语“主要由...组成”和“由...组成”包含在术语“含有”中。
109.本发明中,术语“药学上可接受的”成分是指适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应),即有合理的效益/风险比的物质。
110.本发明中,术语“有效量”指治疗剂治疗、缓解或预防目标疾病或状况的量,或是表现出可检测的治疗或预防效果的量。对于某一对象的精确有效量取决于该对象的体型和健康状况、病症的性质和程度、以及选择给予的治疗剂和/或治疗剂的组合。因此,预先指定准确的有效量是没用的。然而,对于某给定的状况而言,可以用常规实验来确定该有效量,临床医师是能够判断出来的。
111.如本文所用,术语“药学上可接受的盐”指本发明化合物与碱所形成的适合用作药物的盐。
112.除非特别说明,本发明中,所有出现的化合物均意在包括所有可能的光学异构体,如单一手性的化合物,或各种不同手性化合物的混合物(即外消旋体)。本发明的所有化合物之中,各手性碳原子可以任选地为r构型或s构型,或r构型和s构型的混合物。
113.本发明中的一些化合物可能用水或各种有机溶剂结晶或重结晶,在这种情况下,可能形成各种溶剂化物。本发明的溶剂合物包括化学计量的溶剂化物如水合物等,也包括在用低压升华干燥法制备时形成的包含可变量水的化合物。
114.本发明提供调节hbv dna/rna及hbsag、hbeag表达的方法、化合物及组合物。在实施方案中,适用于调节hbv dna/rna及hbsag、hbeag表达的化合物为反义寡核苷酸。
115.在某些实施方案中,可在细胞中进行调节。在某些实施方案中,在动物体内进行调节。在某些实施方案中,动物为人。在某些实施方案中hbv rna水平降低。在某些实施方案中hbv-dna水平降低。在某些实施方案中hbsag水平降低。在某些实施方案中hbeag水平降低。所述降低以剂量和时间依赖性方式出现。
116.还提供适用于预防、治疗及改善疾病、病症及病状的方法、化合物及组合物。在某些实施方案中,所述hbv相关疾病、病症及病状为急性或慢性肝脏疾病。在某些实施方案中,所述肝脏疾病、病症及病状包括乙型病毒性肝炎、丁型病毒性肝炎、肝纤维化、肝硬化、肝细胞癌(hcc)等。
117.在某些实施方案中,治疗方法包括向有需要的个体通过静脉注射或者皮下注射施用hbv反义寡核苷酸。
118.寡核苷酸(反义寡核苷酸)
119.本发明意外发现了能够抑制乙型病毒dna/rna以及乙型肝炎病毒(hbv)表面抗原(hbsag)和e抗原(hbeag)等病毒蛋白质表达的寡核苷酸(或称为反义寡核苷酸)。典型地,本发明提供的反义寡核苷酸能够与乙肝病毒基因组的一段泛基因型保守序列互补。例如,本
发明提供的反义寡核苷酸能够与,例如,如seq id no.24所示的乙肝病毒基因组(基因型d)中如seq id no.25所示的段泛基因型保守序列或与该序列具有96%以上,98%以上同源性的序列互补。
120.[0121][0122]
此外,本发明还提供了修饰的反义寡核苷酸。本发明提供的优选的修饰的反义寡核苷酸为硫代磷酸酯修饰的寡核苷酸,其中硫代修饰提高了寡核苷酸在体内的稳定性,增强了血浆蛋白结合,利于寡核苷酸分布至肝脏等靶组织。本发明提供的更优选的修饰的反义寡核苷酸通过gapmer设计即对寡核苷酸的5'和3'端核苷酸的核糖进行修饰,提高了与靶rna的亲和力,增强了药效,可降低起效剂量,增大安全窗;同时两端的核糖修饰进一步提高了寡核苷酸的稳定性。本发明提供的最优选的反义寡核苷酸是双gap反义寡核苷酸,其在寡核苷酸的5'和3'端和序列中间进行了核苷酸核糖部分的修饰,并对cpg序列(即胞嘧啶(c)—磷酸(p)—鸟嘌呤(g))中的胞嘧啶核苷酸的碱基进行了修饰,从而进一步提高寡核苷酸的亲和力,降低其激活固有免疫toll样受体所导致的脱靶毒性。
[0123]
在一个具体实施例中,提供了一种化合物,其包含修饰或未修饰的寡核苷酸。本发明提供的寡核苷酸的长度为24-40nt(如25-38nt)(即该寡核苷酸由25至38个连接的核苷组成)。
[0124]
在另一优选例中,所述寡核苷酸包括如seq id no.1所示的核心序列
[0125]
5'-gtgcagaggtgaax1x2x3aagtgcac-3'(seq id no.1)。
[0126]
在另一优选例中,所述寡核苷酸的修饰可以是核苷的修饰,例如,2'-o-甲基化糖基修饰、2'-o-甲氧基乙基化糖基修饰、胞嘧啶的5位甲基化修饰中的一种或多种。
[0127]
在另一优选例中,所述寡核苷酸的修饰可以是核苷间键的修饰,例如所述的寡核苷酸中的部分或全部核苷间键被硫代磷酸酯核苷间键和/或二硫代磷酸酯键核苷间键取代。
[0128]
在另一优选例中,所述寡核苷酸与seq id no.25中的至少一部分片段互补。
[0129]
在另一优选例中,所述寡核苷酸与seq id no.25中的至少一部分互补同时与seq id no.24的至少一部分互补。
[0130]
在另一优选例中,所述寡核苷酸与seq id no.25至少96%互补。
[0131]
在另一优选例中,其所述的寡核苷酸由单链的修饰的寡核苷酸组成。
[0132]
在另一优选例中,所述的寡核苷酸的核苷间键为硫代磷酸酯核苷间键。
[0133]
在另一优选例中,所述的寡核苷酸中至少3个不相邻核苷包含修饰的糖。
[0134]
在另一优选例中,所述修饰的糖包含2'-o-甲基。
[0135]
在另一优选例中,所述修饰的糖包含2'-o-甲氧基乙基
[0136]
在另一优选例中,所述的寡核苷酸中包含修饰的核酸碱基(较佳地,所述修饰的核酸碱基包括5-甲基胞嘧啶)。
[0137]
在另一优选例中,所述的寡核苷酸按5'至3'的顺序依次包含5段s1-s2-s3-s4-s5。其中s1段、s3段和s5段由连接的核苷组成,并且其中每个核苷均包含修饰的糖和任选地修饰的碱基;其中s2段和s4段由连接的脱氧核苷组成
[0138]
在另一优选例中,所述的寡核苷酸序列为seq id no.3-6,其中s1段由3个、4个或5个连接的包含修饰的糖基和任选修饰的碱基的核苷组成,其中s2段由8个、9个、10个、11个、12个或13个连接的脱氧核苷组成,其中s3段由2个、3个或4个连接的包含修饰的糖基和任选修饰的碱基的核苷组成,其中s4段由8个、9个或10个连接的脱氧核苷组成,其中s5段由4个或5个连接的包含修饰的糖基和任选修饰的碱基的核苷组成。
[0139]
在另一优选例中,所述的寡核苷酸的序列为seq id no.2或seq id no.6,其中s1段由4个连接的包含修饰的糖基的核苷组成,其中s2段由13个连接的脱氧核苷组成,其中s3段由2个连接的包含修饰糖的核苷组成,其中s4段由9个连接的脱氧核苷组成,其中s5段由4个连接的修饰糖的核苷组成。
[0140]
在另一优选例中,所述s1段、s3段、s5段包含的糖修饰是指2'-o-甲基化修饰。
[0141]
在另一优选例中,所述的寡核苷酸的序列为seq id no.6,其中s1段由4个连接的包含修饰糖和修饰的碱基的核苷组成,其中s2段由13个连接的未修饰的脱氧核苷组成,其中s3段由2个连接的包含修饰的糖基和任选修饰的碱基的核苷组成,其中s4段由9个连接的未修饰的脱氧核苷组成,其中s5段由4个连接的包含修饰修饰糖和修饰的碱基的核苷组成。
[0142]
在另一优选例中,所述s1段、s3段、s5段包含的糖修饰是指2'-o-甲基化修饰,修饰的碱基是指5-甲基胞嘧啶。
[0143]
在另一个具体实施例中,本发明提供了一种寡核苷酸,或其光学异构体、药学上可接受的盐、水合物、或溶剂化物,所述反义寡核苷酸序列选自:seq id no.3-6,并且其中一个或多个t可任选地被u取代。
[0144]
seq id no.3acgtgcagaggtgaagcgaagtgcacacggtccggcagseq id no.4tccatgcgacgtgcagaggtgaagcgaagtgcacacggseq id no.5acgtgcagaggtgaagcgaagtgcacacggseq id no.6gacgtgcagaggtgaagcgaagtgcacacggt
[0145]
在另一优选例中,所述修饰的寡核苷酸为pa0020,其序列为seq id no.2,即将seq id no.6中的3'端t替换为同样可以碱基配对的mu,糖修饰和碱基修饰为:mg*ma*mc*mg*t*g*c*a*g*a*g*g*t*g*a*a*g*mc*mg*a*a*g*t*g*c*a*c*a*mc*mg*mg*mu,其中a/t/g/c表示常规无修饰dna;ma/mu/mg/mc表示2'甲氧基修饰,*为硫代磷酸骨架。
[0146]
在另一优选例中,所述修饰的寡核苷酸为pa0020c,其序列为seq id no.2,即将seq id no.6中的3'端t替换为同样可以碱基配对的mu,糖修饰和碱基修饰为:mg*ma*(5me-mc)*mg*t*g*c*a*g*a*g*g*t*g*a*a*g*(5me-mc)*mg*a*a*g*t*g*c*a*c*a*(5me-mc)*mg*mg*mu,其中a/t/g/c表示常规无修饰dna;ma/mu/mg/mc表示2'甲氧基修饰,*为硫代磷酸骨架,(5me-mc)为2'-甲氧基-5-甲基胞嘧啶。
[0147]
反义寡核苷酸的制备
[0148]
本发明中的反义寡核苷酸可以用寡核酸工业的常规合成方法进行制备合成。例如硫代磷酸酯键可以在ge op100这种设备上用标准的亚磷酰胺化学合成法进行合成,并使用1,2-苯并二硫醇-3-酮-1,1-二氧化物替代碘作为氧化试剂。
[0149]
药物组合物和施用方法
[0150]
由于本发明的化合物(或者修饰或未修饰的本发明的寡核苷酸)具有优异的对抑制乙肝病毒dna复制的能力,因此本发明的化合物及异构体(如光学异构体)、晶型、溶剂化物,药学上可接受的无机,以及含有本发明的化合物为主要活性成分的药物组合物可用于治疗、预防以及缓解与乙肝病毒(即乙型肝炎病毒)感染相关或导致的疾病或乙肝病毒和丁型肝炎病毒共感染相关或导致的疾病。这些疾病可以是急性的或者是慢性的。根据现有技术,本发明化合物可用于治疗以下疾病:乙型肝炎;胰腺癌、肝硬化和肝细胞癌等(如由慢性乙肝引起的胰腺癌、肝硬化和肝细胞)。
[0151]
本发明提供的药物组合物包含安全有效量范围内的本发明的化合物或其药理上可接受的其他形式(如其光学异构体、药学上可接受的盐、水合物或溶剂化物),及药学上可接受的辅助剂、稀释剂或载体。其中“安全有效量”指的是:化合物的量足以明显改善病情,而不至于产生严重的副作用。通常,药物组合物含有1-2000mg本发明化合物/剂,更佳地,含有10-500mg本发明化合物/剂。较佳地,所述的“一剂”为一个安剖瓶或西林瓶。
[0152]“药学上可以接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
[0153]
施用方法
[0154]
本发明的化合物和含其的组合物可通过任何合适的手段来施用,例如,经口摄入;
经口吸入;通过皮下、静脉注射或输注。本发明的化合物或含其的组合物可以以在含有无毒性的药学上可接受的载体或稀释剂的剂量单位制剂的形式;或者可以是立即释放或缓释的制剂的形式来施用。
[0155]
针对本发明的反义寡核苷酸的药剂施用于人体的提示性有效的给药方案;遵循通常用于其他反义寡核苷酸的给药方案;本领域中充分确立每周胃肠外施用100-500mg化合物的常规使用。
[0156]
根据本文中所呈现的公开内容,利用药学上可接受的反义寡核苷酸制剂治疗具有hbv感染或hbv/hdv共感染的对象是有用的。
[0157]
本发明的主要优点包括:
[0158]
(a)本发明提供的化合物或寡核苷酸能够在体外在转录水平上有效抑制病毒基因产物,进而显著抑制乙肝病毒抗原(如hbsag和hbeag)。
[0159]
(b)本发明提供的化合物或寡核苷酸能够在体内同样显示出了优异的抑制乙肝病毒抗原(如hbsag和hbeag)的能力。
[0160]
(c)本发明提供的经修饰的寡核苷酸在通过修饰提升体内稳定性的同时,具有与未修饰的寡核苷酸相当的抑制乙肝病毒抗原(如hbsag和hbeag)的能力。
[0161]
(d)本发明提供的化合物能够在体内显著降低血清中hbsag以及表面抗原。
[0162]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0163]
应当理解,本领域技术人员能够根据在实施例中记载的序列以及相应的修饰,根据现有技术中的常规技术(如标准固相合成方法)并用可市售获得的或者按照现有技术方法合成的原料(如修饰或未修饰的核苷)来获得实施例中所用的寡核苷酸。
[0164]
实施例1
[0165]
不同序列的反义寡核苷酸在hepg2.2.1.5细胞系中的抗病毒效果
[0166]
hepg2.2.1.5细胞株稳定表达复制hbv病毒,并分泌hbv病毒颗粒、hbsag和hbeag至细胞上清中。使用含10%fbs(gibico)和400ug/ml g418的dmem培养基(hyclone)培养hepg2.2.1.5细胞,传至三代以后以2x104细胞/孔铺96孔板,6小时后用ribofect
tm
cp(广州锐博)转染试剂转染寡核苷酸至终浓度100nm,48小时吸弃培养基,加入pbs静置5分钟后换新鲜的培养基,换液6小时后取细胞上清培养基用elisa试剂盒(达安基因)检测hbsag。所用的各反义寡核苷酸如表1所示。
[0167]
表1用于实施例i中的寡核苷酸的描述
[0168][0169][0170]
检测结果如图1所示,pa103,pa10332,pa10330,pa10325,pa102,pa10236,pa10234,pa10232,pa10225均显著降低了细胞上清培养基中的hbsgag,抑制率为30%~50%。
[0171]
实施例2
[0172]
双gap反义寡核苷酸在hepg2.2.15细胞系中的抗病毒效果
[0173]
hepg2.2.1.5细胞株稳定表达复制hbv病毒,并分泌hbv病毒颗粒、hbsag和hbeag至细胞上清中。使用含10%fbs(gibico)和400ug/ml g418的dmem培养基(hyclone)培养
hepg2.2.1.5细胞,传至三代以后以2x104细胞/孔铺96孔板,6小时后用ribofect
tm
cp(广州锐博)转染试剂转染寡核苷酸pa0020和pa0021至终浓度10nm和30nm,48小时吸弃培养基,加入pbs静置5分钟后换新鲜的培养基,换液6小时后取细胞上清培养基用elisa试剂盒(达安基因)检测hbsag。所用的反义寡核苷酸如表2所示。
[0174]
表2用于实施例ii中的寡核苷酸的描述
[0175][0176]
注:a/t/g/c表示常规无修饰的脱氧核糖核苷;ma/mu/mg/mc表示核苷中糖基包括2'-o-甲基修饰基团,*为硫代磷酸骨架修饰
[0177]
检测结果如图2所示,未转染反义寡核苷酸(blank)和仅加入转染(ctrl)试剂时细胞上清中hbsag浓度无显著差异,转染pa0020和pa0021均显著降低了细胞上清培养基中的hbsgag,且呈浓度依赖性,30nm浓度时抑制率可达50%左右。
[0178]
实施例3
[0179]
双gap反义寡核苷酸pa0020在aav-hbv小鼠模型中的抗病毒效果
[0180]
在感染携带hbv1.3倍体的腺相关病毒(aav-hbv,五加和)并持续复制hbv-dna及表达hbv抗原的c57小鼠中剂量递增的反义寡核苷酸pa0020,来评价其抗病毒活性的剂量依赖关系。所用的寡核苷酸pa0020如表3所示。
[0181]
表3用于实施例3中的寡核苷酸的描述
[0182][0183]
注:a/t/g/c表示常规无修饰的的脱氧核糖核苷;ma/mu/mg/mc表示核苷中糖基包括2'-o-甲基修饰基团,*为硫代磷酸骨架修饰
[0184]
用5x10
10
个raav8-1.3hbv(五加和)通过尾静脉注射雄性c57bl/6小鼠,制备持续性乙肝感染小鼠模型。确定hbv病毒稳定复制后按体重随机分为3组(每组5只),第一组为对照组(vehicle)每天灌胃生理盐水,第二组灌胃给予1mg/kg/天恩替卡韦(etv),第三组每周一次腹腔注射pa0020,第0天,第7天,第14天注射剂量分别为30mg/kg,60mg/kg,90mg/kg。每周取血两次,qpcr方法分析血清中乙肝病毒核酸(hbv-dna)载量,elisa方法分析血清中hbsag和hbeag浓度,绘制曲线图3。
[0185]
如图3所示,对照组的动物血清中hbsag和hbv-dna呈现平稳的波动;恩替卡韦组动物血清中hbv-dna持续下降,第20天较第0天降幅》2log
10
,即降低》99%;pa0020组的动物血清hbv-dna持续下降,且随着剂量的升高下降幅度越来越大,第20天较第0天降幅》2log
10
,即降低》99%。pa0020组的动物血清中hbsag和hbeag从第6天开始持续下降,第20天较第0天降幅》1log
10
,即降低》90%。
[0186]
实施例4
[0187]
双gap反义寡核苷酸pa0020c在aav-hbv小鼠模型中的抗病毒效果
[0188]
在感染携带hbv1.3倍体的腺相关病毒(aav-hbv,五加和)并持续复制hbv-dna及表达hbv抗原的c57小鼠中剂量递增的反义寡核苷酸pa0020c,来评价其抗病毒活性的剂量依赖关系。所用的寡核苷酸pa0020c如表4所述。
[0189]
表4用于实施例4中的寡核苷酸的描述
[0190][0191]
注:a/t/g/c表示常规无修饰dna;ma/mu/mg/mc表示2'-o-甲基修饰,*为硫代磷酸骨架修饰,(5me-mc)为2'-甲氧基-5-甲基胞嘧啶
[0192]
用5x10
10
个raav8-1.3hbv(五加和)通过尾静脉注射雄性c57bl/6小鼠,制备持续性乙肝感染小鼠模型。确定hbv病毒稳定复制后按体重随机分为2组(对照组5只,给药组6只),第一组为对照组(vehicle)每天腹腔注射生理盐水,第二组每周一次腹腔注射pa0020c,第0天,第7天,第14天注射剂量为90mg/kg。每周取血两次,qpcr方法分析血清中乙肝病毒核酸(hbv-dna)载量,elisa方法分析血清中hbsag,绘制曲线图4。
[0193]
如图4所示,对照组的动物血清中hbsag和hbv-dna呈现平稳的波动;pa0020c组的动物血清hbv-dna持续下降,给药结束较第0天降幅》3log
10
,即降低》99.9%。pa0020c组的动物血清中hbsag从第0天开始持续下降,给药结束较第0天降幅》2log
10
,即降低》90%。所以,pa0020c不但能降低hbv-dna,还能降低表面抗原,将来临床上,有希望能达到功能性治愈乙肝的目的。
[0194]
实施例5不同gap修饰模式的反义寡核苷酸在hepg2.2.15细胞系中的抗病毒效果
[0195]
hepg2.2.1.5细胞株稳定表达复制hbv病毒,并分泌hbv病毒颗粒、hbsag和hbeag至细胞上清中。使用含10%fbs(gibico)和400ug/ml g418的dmem培养基(hyclone)培养hepg2.2.1.5细胞,传至三代以后以2x104细胞/孔铺96孔板,6小时后用ribofecttmcp(广州锐博)转染试剂转染寡核苷酸至终浓度30nm,48小时吸弃培养基,加入pbs静置5分钟后换新鲜的培养基,换液6小时后取细胞上清培养基用elisa试剂盒(达安基因)检测hbsag。所用的反义寡核苷酸如表5所示。
[0196]
表5用于实施例5中的寡核苷酸的描述
[0197]
[0198][0199]
a/t/g/c表示常规无修饰脱氧核糖核苷酸残基;ma/mu/mg/mc表示2'-o-甲基修饰的核苷酸碱基;*为硫代磷酸骨架修饰。
[0200]
转染的反义寡核苷酸对hepg2.2.1.5表达分泌hbsag的相对抑制率计算公式为:
[0201]
相对抑制率=100%*[1-(处理组hbsag浓度/空白组hbsag浓度)]
[0202]
各反义寡核苷酸处理组的相对抑制率如表6所示
[0203]
表6实施例5中的寡核苷酸对hepg2.2.1.5表达分泌hbsag的相对抑制率
[0204]
[0205][0206]
由表6和图5可知,与完全没有加gap修饰模式的反义寡核苷酸pa0064比,加了gap修饰都有助于提高hbsag的相对抑制率。综合两次实验结果显示,pa0020和pa0054的加权平均优于其他gap修饰模式的反义寡核苷酸。
[0207]
实施例5表明,pa0020和pa0054的双gap修饰模式是较佳的修饰模式。
[0208]
特别的,pa0020核酸序列中的cpg均有2'-o-甲基修饰。pa0020c在pa0020的基础上,对cpg序列的胞嘧啶碱基进行了进一步的甲基化修饰,即使用2'-甲氧基-5-甲基胞嘧啶替换了胞嘧啶,以降低其激活toll样受体(tlrs),特别是tlr9的可能性,从而减少其免疫脱靶毒性风险。
[0209]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1