一种抗小鹅瘟病毒的单链抗体及其制备方法与流程
[0001]
本发明涉及一种抗小鹅瘟病毒的单链抗体及其制备方法,属于基因工程技术领域。
背景技术:
[0002]
小鹅瘟(goslingplague)是由小鹅瘟病毒(goslingplaguevirus,gpv),也称为鹅细小病毒引起的雏鹅急性或亚急性的败血性传染病。本病主要侵害4~20日龄的易感雏鹅,具有传播快、发病率高和致死率高的特点。随着雏鹅日龄增长,其发病率和致死率下降。
[0003]
雏鹅卵黄抗体接种是预防、控制小鹅瘟的主要措施之一。但传统的卵黄抗体生产不仅生产成本较高、生产周期较长,而且鸡胚生产工艺还会造成较大的环保危害。
[0004]
单链抗体是一种基因工程抗体,以其分子量小、特异性高、穿透力强、易于改造等特点,显示了巨大的应用潜力,越来越受到人们的重视。因此研制一种生产成本低、生产效率高的抗小鹅瘟病毒抗体的生产方法具有重要的现实意义。
技术实现要素:
[0005]
[技术问题]
[0006]
现有技术中缺少抗小鹅瘟病毒的单链抗体及相应的高效的生产方法。
[0007]
[技术方案]
[0008]
本发明提供了一种抗小鹅瘟病毒的单链抗体,该单链抗体能够与小鹅瘟病毒特异性结合,可用于阻断小鹅瘟病毒的感染和入侵。
[0009]
所述抗小鹅瘟病毒的单链抗体,具有如seq id no.1所示氨基酸序列的轻链可变区vl、如seq id no.2所示氨基酸序列的重链可变区vh和位于轻链可变区vl与重链可变区vh之间的中间连接肽linker,所述中间连接肽linker为ggggsggggsggggs(seq id no.5)。所述抗小鹅瘟病毒的单链抗体具有如seq id no.3所示的氨基酸序列。
[0010]
本发明还提供一种编码上述抗小鹅瘟病毒的单链抗体的基因,其具有seq id no.4所示的核苷酸序列。
[0011]
本发明还提供一种表达上述的单链抗体的载体,所述载体为原核表达载体。优选的,所述原核表达载体为pet-28a-gpv-scfv载体。
[0012]
本发明还提供一种上述小鹅瘟病毒的单链抗体的制备方法,具体步骤如下:
[0013]
(1)采用rt-pcr直接从抗小鹅瘟病毒的单克隆细胞株的rna中扩增出抗体编码基因的重链可变区vh基因和轻链可变区vl基因;
[0014]
(2)利用overlap-pcr法将连接肽linker与vh基因和vl基因相连构建单链抗体基因;
[0015]
(3)将步骤(2)的单链抗体基因克隆到pet-28a载体中构建重组质粒pet-28a-gpv-scfv;
[0016]
(4)将步骤(3)的重组质粒pet-28a-gpv-scfv化入e.colibl21(de3)感受态细胞,
获得能够表达抗小鹅瘟病毒的单链抗体重组菌株,利用重组菌株制备单链抗体;
[0017]
(5)将步骤(4)获得的单链抗体用以小鹅瘟病毒作为包被抗原进行elisa鉴定,确定重组单链抗体的活性。
[0018]
本发明还涉及编码所述抗小鹅瘟病毒的抗体的基因。例如,具有seq id no.4所示的核苷酸序列。
[0019]
本发明还涉及携带编码所述抗小鹅瘟病毒的抗体的基因的载体或细胞。
[0020]
本发明还涉及药物组合物,其包含药物有效量的所述的抗小鹅瘟病毒的抗体。
[0021]
本发明的技术原理是采用rt-pcr直接从抗小鹅瘟病毒单克隆细胞rna中扩增出抗体编码基因的重链可变区(vh)基因和轻链可变区(vl)基因。利用soe-pcr(重组链延伸反应)法将linker与vh基因和vl基因相连构建单链抗体(scfv)基因,并将其克隆到表达载体pet-28a中,elisa确定抗单链抗体的活性。
[0022]
[有益效果]
[0023]
单克隆抗体是针对特定抗原、特定表位的抗体,不同的抗原所对应的单克隆抗体的基因序列是不一致的,对病毒的中和能力也不一样。
[0024]
本发明筛选到能够对小鹅瘟病毒具有中和效应的单克隆抗体,并进一步制备得到抗小鹅瘟病毒的单链抗体,该单链抗体能与小鹅瘟病毒特异性结合,gpv感染后18~42h后,采用抗小鹅瘟病毒的单链抗体处理组的病毒滴度显著低于pbs和阴性scfv处理组(p<0.05),说明本发明所涉及的scfv具有较为显著的中和小鹅瘟病毒的活性,能够用于小鹅瘟病毒的预防和治疗。
附图说明
[0025]
图1为vh-linker-vlpcr电泳图:m为5000bp dna ladder marker;1为阴性对照;2为vh-linker-vl基因pcr产物。
[0026]
图2为pet-28a-gpv-scfv双酶切鉴定图;m为5000bp dna ladder marker;1为空载质粒经bamhi和hindiii双酶切;2为重组质粒经bamhi和hindiii双酶切。
[0027]
图3为抗小鹅瘟病毒单链抗体的纯化电泳图;m为预染蛋白marker;1为纯化后的单链抗体。
[0028]
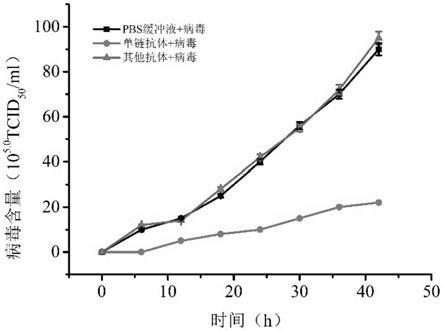
图4为单链抗体对小鹅瘟病毒的体外中和效果图示。
具体实施方式
[0029]
实施例1:抗小鹅瘟病毒的单链抗体的制备
[0030]
1、cdna合成:鼠源抗小鹅瘟单克隆细胞株由扬州优邦研发部制备,并保存。用trizol法(trizolreagent购自美国invitrogen公司)提取总rna。以提取的总rna为模版,采用oligoprimer,根据反转录试剂盒(cdna第1链合成试剂盒购自takara公司)的产品说明操作步骤,合成第1链cdna;
[0031]
2、引物设计与合成:对genbank已公布的鼠抗体编码基因重链可变区序列和轻链可变区序列设计扩增抗体轻、重链的引物(表1),其中vh1f分别与vh1r、vh2r用于扩增vh区;vl1f、vl2f、vl3f和vl1r用于扩增vl区;vh3f、vh3r用于vh基因加入酶切位点和linker序列;vl4f、vl5f、vl6f在vl1f、vl2f、vl3f扩增的vl基因基础上加入酶切位点,vl2r用于vl基因加
入linker序列。其中,vh3f含有bamhi酶切位点,vl2r含有hindiii酶切位点;vh3r、vl4f、vl5f、vl6f含互补的linker序列(酶切位点和linker序列在表1中用下划线标示出)。linker采用(ggggs)3,其对应的编码核苷酸序列为seq id no.18:ggtggcggtggctcgggcggtggtggatccggtggcggcgggtct。引物由上海生工生物工程技术服务有限公司合成。
[0032]
表1
[0033][0034]
3、vh和vl基因的扩增
[0035]
以cdna为模版,vh1f、vh1r为引物扩增vh基因。引物vl1f、vl2f、vl3f分别与引物vl1r配对,扩增vl基因。pcr反应体系为25μl:2
×
pcr mix 12.5μl,模版cdna2μl,上下游引物(10μm)各1μl,ddh2o 8.5μl。扩增程序如下:95℃预变性3min;94℃变性40s,50℃退火40s,72℃延伸1min,30个循环;最后72℃延伸10min。1.5%琼脂糖凝胶电泳鉴定产物并回收目的基因(根据赛默飞公司提供的胶回收说明书操作)。(2)目的片段胶回收:将pcr产物经1%琼脂糖凝胶电泳,在紫外灯下切胶回收目的片段。具体操作参照胶回收试剂盒说明书进行。
[0036]
4、scfv基因的获得:以vh2f、vl2r为引物,通过重组链延伸反应(overlap-pcr)将含有linker序列的vh和vl基因连接为scfv基因,并加入bamh i和hind iii酶切位点,vh-linker-vl扩增产物大小为768bp(见图1)。分别以vh和vl基因为模板,vh2f、vh2r为引物pcr扩增带有linker的重链可变区基因,vh4f、vl5f、vl6f分别与vl2r配对,pcr扩增带有linker的轻链可变区基因,pcr条件同上。扩增产物经1%琼脂糖凝胶电泳鉴定后回收目的基因(含有linker序列的vh和vl基因)。
[0037]
5、scfv的诱导表达:将vh-linker-vl基因克隆到pet-28a载体中构建重组质粒pet-28a-gpv-scfv;将重组质粒pet-28a-gpv-scfv化入e.coli bl21(de3)感受态细胞,获得能够表达抗小鹅瘟病毒的单链抗体重组菌株,挑取阳性scfv菌落至含卡那霉素抗生素(终浓度为100μg/ml)的2
×
yt液体培养基中,37℃振摇培养,菌液od
600
至0.6时,在菌液中加入iptg(终浓度100μm),于30℃诱导过夜,离心收集菌液。用pbs悬浮菌液,超声波裂解,离心后收集上清。采用镍柱亲和层析纯化scfv,纯化过程参照江苏千纯生物科技有限公司ni-ntapurose6fastflow填料说明书(http://www.qianchunbio.com/productview.asp?id=
205)。纯化后的样品进行sds-page电泳(见图3)。
[0038]
实施例2:单链抗体对小鹅瘟病毒的中和活性分析
[0039]
首先,采用reed-muench方法检测gpv感染gef细胞(鹅胚成纤维细胞)的tcid
50
。tcid
50
的测定在96孔中进行,将5
×
105个/孔gef细胞接种到96孔细胞培养板,37℃、5%co2细胞培养箱中培养至细胞密度为80%;在1.5ml eppendorf管中将病毒液分别从10-1
到10-10
作连续10倍梯度稀释;以无血清培养基洗涤细胞3次后将稀释好的病毒液分别入96孔板中,每一个稀释梯度接种一个纵排,每孔加入100μl病毒稀释液,最后一孔加入空白培养基作为阴性对照;37℃培养1h后,每孔补加一滴含10%胎牛血清的m199培养基;放置于37℃细胞培养箱中培养,逐日观察细胞病变情况,结果按照reed-muench法计算。公式如下:
[0040]
距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)
[0041]
lgtcid
50
=距离比例
×
稀释度对数之间的差+高于50%病变率的稀释度的对数
[0042]
然后,测定单链抗体的体外中和活性,分为三组。单链抗体处理组,将100μl纯化的单链抗体(100ng/μl)与100μl 1moi病毒混合,预先作用60min,然后感染细胞;无关单链抗体处理组(证实不与gpv结合的单链抗体),将100μl纯化的所述单链抗体(100ng/μl)与100μl 1moi病毒混合,预先作用60min,然后感染细胞;病毒处理组,将100μl pbs与1moi病毒混合,预先作用60min,然后感染细胞;每组三个重复,分别在感染后6、12、18、24、30、36、42h收集细胞上清,测定病毒滴度,分析单链抗体的中和效果(见图4)。从结果可以看出,gpv感染后18~42h,单链抗体处理组的病毒滴度显著低于pbs和阴性scfv处理组(p<0.05),说明本发明所涉及的scfv具有较为显著的中和小鹅瘟病毒的活性。
[0043]
序列表
[0044]
seq id no.1轻链可变区(vl)氨基酸序列
[0045]
masmtggqqmgrgsmevklqqsgaelvkpgasvklsckasgytftsywmhwmkqrpgqglewigeinpsnghtnynekfknkatltvdrssntiyiqlnsltsedsavyycargdywgqgttvtvss
[0046]
seq id no.2重链可变区(vh)氨基酸序列
[0047]
dieltqspaslavslgqratisckasqsvdydgdsymnwfqqkpgqppklliytasnlqsgiparfsgsgsgtdftlnihpveeedsatyycqqgyegrtfgggtkleikrle
[0048]
seq id no.3:抗小鹅瘟单链抗体(scfv)氨基酸序列
[0049]
masmtggqqmgrgsmevklqqsgaelvkpgasvklsckasgytftsywmhwmkqrpgqglewigeinpsnghtnynekfknkatltvdrssntiyiqlnsltsedsavyycargdywgqgttvtvssggggsggggsggggsdieltqspaslavslgqratisckasqsvdydgdsymnwfqqkpgqppklliytasnlqsgiparfsgsgsgtdftlnihpveeedsatyycqqgyegrtfgggtkleikrle
[0050]
seq id no.4:抗小鹅瘟单链抗体(scfv)核苷酸序列
[0051]
atggctagcatgactggtggacagcaaatgggtcgcggatccatggaagtgaaactgcagcaaagcggtgcggagctggtgaagccgggtgcgagcgttaaactgagctgcaaggcgagcggttacaccttcaccagctattggatgcactggatgaaacagcgtccgggccaaggtctggaatggatcggcgagattaacccgagcaacggccacaccaactacaacgaaaagtttaaaaacaaggcgaccctgaccgtggatcgtagcagcaacaccatctatattcagctgaacagcctgaccagcgaggatagcgcggtttactattgcgcgcgtggtgactactggggccaaggtaccaccgttaccgttagcagcggtggcggtggcagcggtggcggtggcagcggtggcggtggcagcgacatcgaactgacccagagcccggcga
gcctggctgtgagcctgggtcagcgtgcgaccattagctgcaaggcgagccaaagcgttgactacgatggtgacagctatatgaactggttccagcaaaaaccgggccagccgccgaagctgctgatctacaccgcgagcaacctgcaaagcggtattccggcgcgtttcagcggcagcggtagcggtaccgattttaccctgaacatccacccggttgaggaagaggacagcgcgacctactattgccagcaaggttatgaaggccgtacctttggtggcggtaccaaactggagattaagcgtctcgagtaa
[0052]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1