一种利用单细胞转录组测序技术检测不同疾病的方法与流程
[0001]
本发明属于医疗诊断技术领域,尤其是涉及一种利用单细胞转录组测序技术检测不同疾病的方法。
技术背景
[0002]
单细胞转录组测序技术作为本世纪新兴的生物技术之一,在相当长一段时间里被认为是用于探索细胞间异质性的重要研究手段。单细胞测序技术的兴起也组学研究提供了全新的思路。由tang等人开发的单细胞转录组测序技术在2009年问世,这种方法能够检测的基因数量远远超过了基因微阵列,可以更彻底地对发育阶段的转录表征进行检测。这些方法极大扩展了人类对生命活动的认知,加速了人类探索生命科学的进程。在随后的研究中,各种改进和创新的方法被陆续研发出来,包括smart-seq2,mars-seq,cel-seq2,以及drop-seq等。其中,根据建库方式的不同,我们可粗略地将这些方法归为两类,一类是全长转录组测序方法,另一类是基于独立分子标记(umi)的测序方法,两类方法各有优劣。全长转录组测序的主要代表是smart-seq以及smart-seq2等,这类方法的优点是3’端偏好较低,测序深度较高。然而由于建库过程需要人为地将细胞分离至单独的管中,因而该类方法的建库过程繁琐且通量较低。而基于umi的测序方法因其流程较前一种方法而言更为简化,因而可通过机器分选的方式进行单细胞建库。以drop-seq为代表的umi测序方法可在短时间内将数万个细胞分选为单个细胞的悬液,并将反转录的相关试剂共同包裹至单细胞液滴中,从而实现了快速且高通量的测序。
[0003]
在疾病发生的过程中,血液中的相关因子会随疾病的发生而不断变化。这些变化的因子对临床检测具有极为重要的预测意义。通过检测因子的变化情况,可以监测疾病发展的情况,并利用医学手段对疾病进行必要的干预,从而达到抑制疾病的发展的目的。然而常规的血液检测方法,仅能对少量的因子进行检测,无法对大量病理指标进行批量筛查,这造成了在大多数情况下无法对复杂的病因进行综合判断,大大增大了误判、错判的几率。而单细胞转录组测序技术凭借其通量大、耗时短的特点,结合生物信息学分析手段,可在短时间内对大量病理指标进行全面的筛查,为临床医生提供了全新的诊疗方案。同时,血液中细胞大小适中,丰度高,采集方便,在制备单细胞悬液方面成功率较高。然而如何更高效的构建单细胞转录组测序文库以及单细胞转录组测序文库是否具有新的应用仍是本领域技术人员亟需克服的难题。目前国内还没公开任何关于利用单细胞转录组测序技术预测、诊断不同疾病的方法。
技术实现要素:
[0004]
针对技术背景指出的现有检测血液内病理指标诊断疾病的局限性,本发明旨在提供一种利用单细胞转录组测序技术诊断不同疾病的方法。该方法利用了单细胞转录组测序技术通量大、灵敏度高、耗时短的特点,同时结合生物信息学技术,可以在短时间内对大量病理指标进行深入筛查,从而对疾病预测、诊断起到决定性的作用。
[0005]
技术方案要点如下:
[0006]
1.收集受试者外周血,并利用单细胞转录组测序技术对细胞进行转录组测序;
[0007]
2.对所得细胞进行亚群分析,鉴定细胞类型,并结合不同病理指标对受试者体内微环境进行深入分析,对受试者进行病理预测与诊断。
[0008]
具体的,本发明的技术方案如下:
[0009]
本发明第一个方面公开了一种单细胞转录组文库的制备方法,包括:
[0010]
s1:制备得到单细胞悬液,所述单细胞悬液为外周血细胞;
[0011]
s2:将条形珠溶液离心后用缓冲液重悬后备用;
[0012]
s3:采用自动化单细胞处理系统处理,依次加入单细胞悬液、重悬后的条形珠溶液、洗涤缓冲液1和裂解缓冲液和pbs缓冲液后,启动系统得到产物;
[0013]
s4:将s3得到的产物离心后,只留下条形珠,然后加入rt mix后置于金属浴中反应后,依次使用洗涤缓冲液2、洗涤缓冲液3和无核酸酶水洗涤后,加入pcr mix后进行pcr扩增得到扩增产物;
[0014]
s5:收集扩增产物后加入纯化磁珠后离心得到上清液,上清液中加入乙醇漂洗后的纯化磁珠后再次离心,构建pcr体系后进行扩增后利用xnovangs测序平台进行测序,得到单细胞转录组文库。
[0015]
优选的,在s3之前,采用无水乙醇预处理自动化单细胞处理系统,具体步骤包括:将100%无水乙醇注入芯片进样口,并移除出样口多余的液体;重复2-3次,直至芯片中不再出现气泡。
[0016]
优选的,在s4中,所述金属浴的反应条件为:反应温度42℃,转速1000rpm,反应90min。
[0017]
优选的,在s5中,所述纯化磁珠为ampure xp纯化磁珠;更优选的,将所述ampure xp纯化磁珠提前30min从4℃取出,使其恢复至室温。
[0018]
优选的,在s5中,往扩增产物总加入纯化磁珠,所述纯化磁珠与扩增产物的体积为0.6:1,将两者混匀后室温孵育4-6min,离心后静置4-6min至液体透明澄清,移除上清至新的容器中得到上清液。
[0019]
优选的于,在s5中,上清液中加入80%乙醇漂洗纯化磁珠,室温孵育30s,移除上清后重复本步骤一次。
[0020]
优选的,所述自动化单细胞处理系统为singleron matrix仪器系统。
[0021]
本发明第二个方面公开了根据上述的方法得到的单细胞转录组文库。
[0022]
本发明第三个方面公开了一种单细胞转录组测序方法,包括:采用上述的单细胞转录组文库进行测序。
[0023]
本发明第四个方面公开了如下应用:
[0024]
(a)上述的单细胞转录组文库用于分析细胞亚群并鉴定细胞类型;
[0025]
(b)上述的单细胞转录组测序方法用于检测不同的疾病。
[0026]
与现有技术相比,本发明至少具有以下区别技术特征:
[0027]
本发明公开的单细胞转录组测序技术具有通量大、灵敏度高和耗时短等特点,同时结合生物信息学技术,可以在短时间内对大量病理指标进行深入筛查,从而对疾病预测、诊断起到决定性的作用。
具体实施方式
[0028]
下面通过详细的实施例对本申请进行进一步的阐述,应该理解,下述实施例仅是为了用于说明本申请,并不对发明内容进行限定。
[0029]
实施例中所用仪器、设备、试剂均可通过各种渠道获得,例如购买得到,或可以制备而得。
[0030]
实施例1
[0031]
本实施例公开了一种利用单细胞转录组测序方法进行外周血细胞功能分析的方法,具体包括:
[0032]
1.外周血的采集
[0033]
1)用酒精棉球擦拭被采集人手肘静脉处。
[0034]
2)待自然晾干后,用采血针轻刺指尖皮肤表面,用无肝素真空采血管采集外周血2ml。将外周血进行分离纯化,得到外周血细胞。
[0035]
2.单细胞转录组文库制备及测序
[0036]
2.1单细胞悬液制备
[0037]
1)操作前,检查实验环境,确认设备和试剂信息,并按规定将所需耗材和器械传递入细胞制备车间无菌区。
[0038]
2)超净台开启通风,待指示灯变绿,并用含75%酒精的无菌纱布均匀擦拭整个超净台,所需器具、耗材等需经75%酒精消毒后方可放入超净台。
[0039]
3)从培养箱中取出需要传代的间充质干细胞,放入超净台,用移液器吸取培养皿中培养液弃于废液缸中。
[0040]
4)每个培养皿用0.9%生理盐水清洗。
[0041]
5)每个培养皿中加入胰酶,37℃消化。
[0042]
6)待所有培养皿中细胞消化完成后,加入终止液终止消化。
[0043]
本实施例使用单细胞转录组建库试剂盒singleron matrix。
[0044]
2.2单细胞转录组文库制备与测序
[0045]
1)实验开始前,用rnase away喷擦实验台桌面。并在实验过程中,使用rnaseaway喷擦实验台桌面(多次)。本实验中所用的耗材均需无菌、无核酸酶。
[0046]
2)吸取900μl barcode beads(条形珠)于1.5ml离心管内,置于磁力架上,待溶液澄清后,小心移除上清。
[0047]
3)取下离心管,加入1ml pbs,混匀并瞬离,置于磁力架上,待溶液澄清后,小心移除上清,重复两次。
[0048]
4)取下离心管,加入40μl pbs,重悬并置于4℃冰箱待用。
[0049]
5)分离后的细胞重悬于预冷的pbs内(细胞浓度为1
×
105个/毫升),
[0050]
6)将200μl的100%无水乙醇缓慢注入芯片进样口(10秒注入200μl)并移除出样口多余液体(重复步骤冲洗过程2-3次,直至芯片中不再出现气泡)。
[0051]
7)将200μl的0.02%pbst(pbs中包含0.02%tween-20,现配)注入芯片进样口(10秒)(重复步骤冲洗过程2次),并移除出样口多余液体,室温静置30min。
[0052]
8)打开singleron matrix仪器电源,确认电源绿色指示灯正常亮起,显示屏正常显示界面内容。轻推仪器上盖卡扣,打开仪器上盖,使用移液枪,根据标号在连接模块槽-1
加入500μl wash buffer 1(新格元(南京)生物科技有限公司,货号#1100011),使用移液枪,根据标号在连接模块槽-2加入100μl处理好的细胞悬液,使用移液枪,根据标号在连接模块槽-3加入40μl barcode beads,使用移液枪,根据标号在连接模块槽-4加入100μl lysis buffer(新格元(南京)生物科技有限公司,货号#1100011),使用移液枪,根据标号在连接模块槽-5加入1400μl pbs buffer。
[0053]
9)确认样品及试剂皆已放入连接模块后,点击仪器屏幕上的“初始化”按钮,此时仪器会进入初始化过程,底部显示灯显示“初始化中”,等待初始化完成(约10秒),显示灯图示会从“初始化中”转换成“运行”。初始化完成后,系统自动切换到运行页面,此时,轻盖仪器上盖,听到仪器上盖卡扣合起声音后确认合盖完成。点击屏幕样本制备,仪器开始运行,进行样本制备,运行时长约34min。
[0054]
10)运行约34min后,屏幕显示“完成”,提示已完成mrna捕获。
[0055]
11)产物回收至预冷的1.5ml离心管内,并用200μl的移液枪吸取200μl wash buffer 1重复冲洗产物槽2-3次,直至产物槽内磁珠取干净,置于冰上,等待进行后续反应。
[0056]
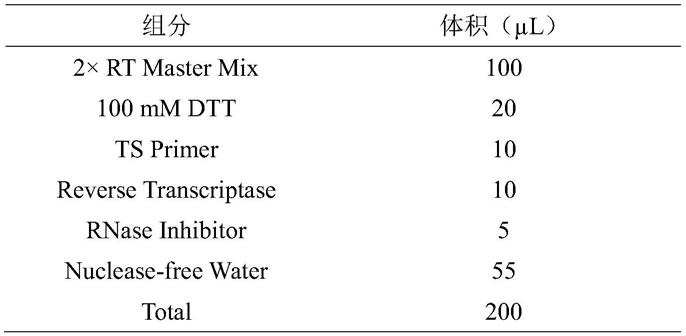
12)在冰上按照如下表1配制rt mix,涡旋混匀并短暂离心,以下试剂货号均采购自新格元(南京)生物科技有限公司,货号为#1100011。
[0057]
表1
[0058][0059]
13)将步骤10中收集的产物的离心管置于磁力架上,待溶液澄清后,小心移除上清。从磁力架上取下离心管,加入1ml wash buffer 1混匀后短暂离心,置于磁力架上,待溶液澄清后小心移除上清。
[0060]
14)从磁力架上取下离心管,加入500μl 1
×
wash buffer(提前用nuclease-free water水稀释10
×
wash buffer至1
×
,新格元(南京)生物科技有限公司,货号#1100011)混匀后短暂离心,置于磁力架上,待溶液澄清后小心移除上清。
[0061]
15)离心管瞬离,尽可能吸净液体,只留下离心管底部的barcode beads。在装有barcode beads的离心管内加入200μl配好的rt mix,置于提前设置好的金属浴中,42℃,转速1000rpm,反应90min。
[0062]
16)反应结束后瞬离,将离心管置于磁力架上,待溶液澄清后小心移除上清。
[0063]
17)将离心管从磁力架上取下,加入1ml wash buffer 2(新格元(南京)生物科技有限公司,货号#1100011)混匀后短暂离心,置于磁力架上,待溶液澄清后小心移除上清。
[0064]
18)将离心管从磁力架上取下,加入1ml wash buffer 3(新格元(南京)生物科技有限公司,货号#1100011)混匀后短暂离心,置于磁力架上,待溶液澄清后小心移除上清。
[0065]
19)将离心管从磁力架上取下,加入1ml nuclease-free water,颠倒混匀后短暂离心,置于磁力架上,待溶液澄清后小心移除上清。重复1次,将离心管瞬离,尽可能吸干净液体,只留下离心管底部的barcode beads。
[0066]
20)按照如下表2在冰上配制pcr mix,涡旋混匀并短暂离心,将pcr mix加入上一步留有barcode beads的离心管中,边吹打混匀,边加入8联排管中,每个样本分为8管进行扩增,即每管液体体积为50μl,以下试剂货号均采购自新格元(南京)生物科技有限公司,货号为#1100011。
[0067]
表2
[0068][0069]
21)盖好管盖,置于pcr仪中进行扩增,pcr程序见下表3。pcr程序结束后,可将产物在4℃保存48h,或者直接进行cdna扩增纯化。
[0070]
表3
[0071][0072]
22)ampure xp纯化磁珠提前30min从4℃中取出,恢复室温。
[0073]
注:磁珠使用前需混匀。
[0074]
23)将8联排管中的液体收集到1.5ml离心管中,瞬离,计算体积。加入240μl ampure xp纯化磁珠(0.6
×
产物体积),吹打混匀后,室温孵育5min,短暂离心,置于磁力架上静置5min;至液体透明澄清,小心移除上清至新的1.5ml离心管中,暂留。
[0075]
24)保持pcr管始终处于磁力架上,加入800μl新配制的80%乙醇漂洗ampure xp纯化磁珠。室温孵育30s,小心移除上清,重复本步骤1次。
[0076]
25)取下离心管,短暂离心,再次置于磁力架上,吸去多余酒精,晾干。
[0077]
26)取下离心管,加入20μl buffer eb,吹打混匀ampure xp纯化磁珠,室温孵育5min,短暂离心后静置于磁力架上,至液体透明澄清。吸取上清并转移至新的ep管中,即为
纯化产物。
[0078]
27)取1μl样品进行qubit浓度检测,取2μl样品进行片段大小的检测。
[0079]
28)室温解冻fr buffer,混匀后备用,在灭菌的pcr管中配置如下表4反应体系,以下试剂货号均采购自新格元(南京)生物科技有限公司,货号为#1100011。
[0080]
表4
[0081][0082]
29)用移液器轻柔吹吸混匀,55℃孵育10分钟。
[0083]
30)将片段化的产物纯化,步骤同22-26。
[0084]
31)将片段化产物扩增、纯化后,利用xnovangs测序平台对转录组进行测序。
[0085]
3.间充质干细胞功能分析及亚群鉴定
[0086]
1)打开rstudio(r版本4.0.2),安装seurat单细胞分析包以及期依赖包。
[0087]
2)将测序后定量得到的基因表达矩阵读入r环境。
[0088]
3)根据官方提供的代码计算间充质干细胞之间的差异,并获得不同细胞簇的标记基因。
[0089]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
[0090]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1