一种链霉菌及其发酵产乐普霉素B的方法与流程
一种链霉菌及其发酵产乐普霉素b的方法
技术领域
1.本发明涉及工业微生物发酵技术领域,具体涉及一种链霉菌及其发酵产乐普霉素b的方法。
背景技术:
2.乐普霉素b(leptomycin b)(cas号:87081-35-4)是一种不饱和支链脂肪酸,分子式是c
33h48
o6,分子量为540.73,化学结构式如图4所示。
3.乐普霉素b最初发现于链霉菌streptomyces sp.ats1287的发酵液中(hamamoto t,gunji s,tsuji h,beppu t.leptomycins a and b,new antifungal antibiotics.i. taxonomy of the producing strain and their fermentation,purification and characterization.jantibiot(tokyo).1983;36(6):639-645.doi:10.7164/antibiotics.36.639),被鉴定为具有抗真菌活性的不饱和支链脂肪酸。
4.乐普霉素b作为一种常用的出核转运抑制剂,可以通透细胞,抑制细胞核向细胞浆的蛋白转运,其抑制出核转运的机理为乐普霉素b可以直接与crm1 (chromosome maintenance protein 1,一种参与细胞主动运输的核出口受体)结合,抑制crm1与靶输出蛋白的核定位信号相互作用,从而抑制crm1和带有出核信号的蛋白结合,最终导致由crm1介导的出核转运的抑制。
5.近年来,随着研究的深入,发现该化合物具有显著的抗肿瘤活性,因此,乐普霉素b在抗恶性肿瘤方面也成为一种潜在的靶向性药物。2017年lorenzobrunetti等人在《blood》杂志上发表的文章中表明,乐普霉素b通过抑制突变型npm1蛋白出核,从而诱导急性髓细胞白血病(aml)m2亚型患者白血病细胞分化(brunetti,lorenzo et al acute myeloid leukemia with mutated npm1 isdependent on the cytoplasmic localization of npm1c,[j]blood,2017,877.)。2018 年殷倩倩等人在《中国病理生理杂志》发表的文章中表明,通过抑制runx3蛋白出核转运,lmb可明显降低乳腺癌细胞的活力并抑制乳腺癌细胞的增殖(殷倩倩,马东慎,魏瑜,刘慧.不同分子亚型乳腺癌细胞系中runx3蛋白表达及定位研究[j].中国病理生理杂志,2018,34(09):1603-1609.)。
[0006]
乐普霉素b发酵方面,现有的技术中,hamamoto t等人报道了通过培养链霉菌streptomyces sp.ats1287并经分离纯化后,可获得一定量的乐普霉素b,但是,发酵液中乐普霉素b在菌丝体中的最高效价约40mg/l,发酵水平较低,菌种较为原始,不适于工业化的应用(hamamoto t,gunji s,tsuji h,beppu t. leptomycins a and b,new antifungal antibiotics.i.taxonomy of the producing strainand their fermentation,purification and characterization.j antibiot(tokyo). 1983;36(6):639-645.doi:10.7164/antibiotics.36.639)。因此,寻找一种新的可高效发酵获得乐普霉素b的菌种具有重要的意义。
技术实现要素:
[0007]
本发明的目的之一在于提供一种链霉菌(streptomyces sp.)hdcc00025,该微生物菌种于2020年10月14日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏编号为cgmcc no.20886,,并登记在册,证明存活。
[0008]
本发明的目的还在于提供了一种链霉菌(streptomyces sp.)hdcc00025 (cgmcc no.20886)在制备乐普霉素b或者含有乐普霉素b的药物组合物的应用。
[0009]
本发明还提供了一种乐普霉素b的制备方法,该方法包括采用链霉菌 (streptomyces sp.)hdcc00025(cgmcc no.20886)在含有可同化的碳源和/或氮源的营养培养基里,进行有氧发酵的步骤。
[0010]
在优选的实施方案中,上述可同化的碳源选自玉米淀粉、麦芽糊精、葡萄糖、蔗糖、乳糖、麦芽糖、工业糖蜜、甘油、豆油、山梨醇、甘露醇之一或者上述物质的组合,优选玉米淀粉、麦芽糊精、葡萄糖、蔗糖、豆油之一或任意几种的组合。
[0011]
在优选的实施方案中,上述可同化的氮源选自酵母抽提粉、酵母粉、酵母膏、大豆卵磷脂、黄豆饼粉、棉籽饼粉、花生饼粉、麸质粉、玉米浆干粉、豆粕、蛋白胨、尿素、铵盐之一或者上述物质的组合,优选黄豆饼粉、大豆卵磷脂、酵母抽提粉、酵母粉之一或任意几种的组合。
[0012]
在优选的实施方案中,上述营养培养基还包括无机盐,所述无机盐选自柠檬酸三钠、磷酸二氢钾、磷酸氢二钾、硫酸铵、碳酸钙、硫酸亚铁、硫酸锌、硫酸铜、氯化钠、氯化钾、氯化钙、硫酸镁、氯化铁、硫酸锰之一或上述物质的组合,优选碳酸钙、磷酸氢二钾、硫酸镁、氯化钾。
[0013]
在优选的实施方案中,所述营养培养基含有玉米淀粉10-50g/l、麦芽糊精 10-50g/l、豆油5-20g/l、酵母抽提粉1-15g/l、大豆卵磷脂5-20g/l、黄豆饼粉5-20g/l、酵母膏5-20g/l、硫酸镁1-10g/l、磷酸氢二钾2-8g/l、碳酸钙0-50 g/l。
[0014]
在优选的实施方案中,所述有氧发酵的温度为20-35℃,优选23-30℃;培养基ph为5.0-8.0,优选5.0-7.0;培养时间为24-240小时,优选72-168小时;通氧量为0.1-2.0vvm,优选0.5-2.0vvm。
[0015]
在优选的实施方案中,所述链霉菌(streptomyces sp.)hdcc00025(cgmccno.20886)是通过种子液接种至所述营养培养基中进行所述发酵培养的;其中,所述种子液是将链霉菌(streptomyces sp.)hdcc00025(cgmcc no.20886)在种子培养基里进行种子培养得到的;所述种子培养的条件为:种子培养的温度为 20℃-30℃,优选23℃-28℃;培养基ph为5.0-8.0,优选5.0-7.0;培养时间为 24-80小时,优选24-60小时。
[0016]
在优选的实施方案中,所述的种子培养基含有葡萄糖5-20g/l、玉米淀粉5-20 g/l、黄豆饼粉5-20g/l、酵母抽提粉1-10g/l、碳酸钙1-20g/l,硫酸镁1-10g/l,磷酸氢二钾1-10g/l。
[0017]
本发明乐普霉素b通过以下条件进行hplc检测:
[0018]
色谱柱:agilent poroshell 120ec-c18(4.6
×
50mm,2.7μm)
[0019]
柱温:30℃;
[0020]
进样体积:2μl;
[0021]
流速:0.5ml/min;
[0022]
检测波长:225nm;
[0023]
分析时间:10min;
[0024]
流动相:
[0025]
流动相a:0.1%(体积百分比)磷酸水溶液;
[0026]
流动相b:0.1%(体积百分比)磷酸乙腈溶液;
[0027]
时间(min)07.58.58.610流动相a(%)3810103838流动相b(%)6290906262
[0028]
本发明链霉菌(streptomyces sp.)hdcc00025(cgmcc no.20886)主要生物学特征为:菌落形态圆整,表面凸起,菌落直径大小约7~15mm,菌落表面有沟纹,中间偶稍凹陷,基质菌丝发达,与培养基结合紧密,不易挑起,颜色呈米色或淡黄色,气生菌丝白色,产孢丰富,前期淡黄色,后期转浅青色、灰色,无可溶性色素。
[0029]
本发明菌株(streptomyces sp.)hdcc00025(cgmcc no.20886)为一株全新的乐普霉素b产生菌,生产能力高,其产生乐普霉素b的能力比现有技术中其他菌种有了大幅度的提高,乐普霉素b的效价可维持在1200mg/l以上,有利于实现工业化生产。
附图说明
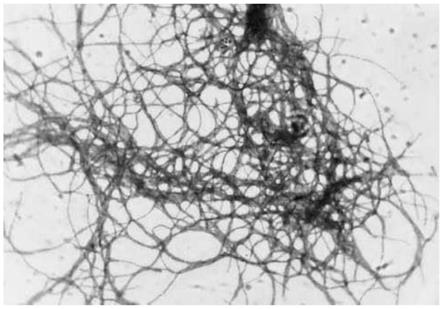
[0030]
图1为菌株hdcc00025(cgmcc no.20886)在isp2培养基上的显微镜检图 (400
×
)。
[0031]
图2为菌株hdcc00025(cgmcc no.20886)在isp2培养基上的菌落特征图。
[0032]
图3为菌株hdcc00025(cgmcc no.20886)通过发酵培养后,对菌体进行分离提取,经hplc检测的乐普霉素b图谱。
[0033]
图4乐普霉素b(leptomycin b)化学结构式。
具体实施方式
[0034]
下述实施例中所用的实验方法如无特殊说明,均为常规方法。
[0035]
下述实施例中采用的材料、试剂等如无特殊说明,皆为普通市售品,皆可于市场购得。
[0036]
其中所用放线菌dna提取试剂盒购自北京三博远志生物技术有限责任公司;
[0037]
pcr产物纯化回收所用的sanprep柱式pcr产物纯化试剂盒购自生工生物工程(上海)股份有限公司。
[0038]
以下结合具体实施例,对本发明作进一步说明,应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
[0039]
实施例1:菌株来源
[0040]
链霉菌(streptomyces sp.)hdcc00025(cgmcc no.20886)是从中国浙江省湖州市莫干山某山坡的土壤中分离得到。
[0041]
在莫干山区域土壤进行交叉采样,随机取5个采样点,每个点取土壤样品 10g,放入锥形瓶中,混合均匀后取样品10g,加入到一个装入90ml无菌水的锥形瓶中(瓶中有一个磁力搅拌器),漩涡搅拌30分钟,使其充分混匀制成悬浊液,即为10-1
菌悬液。用稀释涂布平
板法将上述悬浊液与无菌水按照体积比1: 9稀释成10-2
,10-3
,10-4
,10-5
浓度,取不同稀释倍数菌悬液0.1ml,涂布于isp2 培养基平板中,用无菌涂布棒在培养基表面轻轻涂布,室温下静置30分钟后置于28℃恒温培养箱。待菌落长出后,观察记录菌落颜色、透明度、菌落表面、边缘形态。最终挑取1000株菌株接种于isp2培养基制成斜面,并进行发酵验证。用接种环挑取斜面培养的菌体一环,分别接种于含有20ml种子培养基的250 ml锥形瓶中,于28℃条件下震荡培养1天后,再吸取1ml移种于含有20ml 发酵培养基的250ml锥形瓶中,于28℃条件下震荡培养3天后,经hplc检测所得发酵液中乐普霉素b的含量,挑选出最高产菌株即链霉菌(streptomyces sp.) hdcc00025(cgmcc no.20886)。
[0042]
种子培养基配方(g/l):葡萄糖10g/l,淀粉10g/l,黄豆饼粉10g/l,酵母抽提粉5g/l,碳酸钙15g/l,硫酸镁1.5g/l,磷酸二氢钾1g/l,加水定容至1000 ml,ph 7.0
±
0.1。
[0043]
发酵培养基配方(g/l):玉米淀粉40g/l,麦芽糊精20g/l,酵母抽提粉5g/l,酵母粉10g/l,酵母膏10g/l,碳酸钙30g/l,加水定容至1000ml,ph 7.0
±
0.1。
[0044]
实施例2:链霉菌(streptomyces sp.)hdcc00025(cgmcc no.20886)的形态学、培养学特征、生理生化特征。
[0045]
参照《链霉菌鉴定手册》、《放线菌的分类与鉴定》、《常见细菌系统鉴定手册》等书中的有关内容进行实验:颜色的判断参照ral k7色卡中的颜色进行对照。
[0046]
1、菌株的形态学特征:将菌株hdcc00025(cgmcc no.20886)接种于isp2 培养基中进行插片培养,28℃培养3-5天后取盖玻片于载片中,在光学显微镜下 400
×
倍观察,结果见图1。
[0047]
2、菌株培养学特征:菌株hdcc00025(cgmcc no.20886)在isp2培养基上28℃条件下培养7~10天后,菌落形态椭圆形,有放射状条纹,表面凸起,菌落直径大小约7~15mm,菌落表面有沟纹,中间偶稍凹陷,基质菌丝发达,与培养基结合紧密,不易挑起,颜色呈米白色,气生菌丝白色,产孢丰富,前期浅黄色,后期转浅灰色,无可溶性色素,结果见图2。
[0048]
其他培养学特征则采用isp1、isp3、isp4、isp5、苹果酸钙、高氏一号、营养琼脂7种培养基,28℃条件下培养7~10天后,观察其菌落、菌丝、孢子及色素产生情况,结果如表1所述。
[0049]
表1菌株hdcc00025(cgmcc no.20886)在7种培养基上的培养特征
[0050][0051]
3、生理生化特征试验:结果表2~表7。
[0052]
a)碳源的利用:采用isp9作为基础培养基,各种碳源的终浓度均为1.0%,见表2。
[0053]
b)无机氮源的利用:采用isp9作为基础培养基,硝酸钾和硫酸铵的浓度均为0.1%,见表2。
[0054]
c)降解试验和nacl耐受实验采用基础培养基为gyea(ph6.8),各种降解物的浓度及降解试验结果见表3;nacl耐受实验结果见表7。
[0055]
d)过氧化氢酶试验、ph试验和温度试验均采用isp2培养基。过氧化氢酶试验结果见表4,ph试验结果见表5,温度试验结果见表6。
[0056]
e)m.r、v-p等实验采用《常见细菌系统鉴定手册》方法,结果见表4。
[0057]
f)除温度实验外,均为28℃培养7~10天。
[0058]
表2菌株hdcc00025的碳源和氮源的利用情况
[0059]
碳源生长情况碳源生长情况无机氮源生长情况d-葡萄糖4水杨苷2硫酸铵+d-棉子糖1d-乳糖4硝酸钾-d-木糖1半乳糖2
ꢀꢀ
d-山梨醇3肌醇1
ꢀꢀ
l-阿拉伯糖2甘露醇3
ꢀꢀ
甘油3甘氨酸1
ꢀꢀ
麦芽糖4木聚糖2
ꢀꢀ
d-果糖3菊粉3
ꢀꢀ
d-蔗糖3鼠李糖3
ꢀꢀ
[0060]
表3菌株菌株hdcc00025的降解试验结果
[0061]
降解物降解物浓度结果降解物降解物浓度结果腺嘌呤0.5%3,+酪蛋白1%4,+鸟嘌呤0.5%4,-酪氨酸1%3,-黄嘌呤0.4%3,-tween-401%4,-木聚糖0.4%3,-tween-601%3,-次黄嘌呤0.4%4,+tween-801%3,-[0062]
表4菌株hdcc00025主要的生理生化特征
[0063][0064][0065]
表5菌株hdcc00025生长的ph试验
[0066][0067]
表6菌株hdcc00025生长的温度试验
[0068]
温度(℃)714283745生长情况12420
[0069]
表7菌株hdcc00025对nacl的耐受性
[0070]
nacl浓度1%4%7%10%菌株生长情况3100
[0071]
备注:表2-7中,0:无生长;1:生长很弱;2:能生长,有少量孢子;3:生长良好,有大量孢子;4:生长最好,有丰富孢子;+:阳性;-:阴性。
[0072]
实施例3菌种鉴定
[0073]
1、链霉菌hdcc00025(cgmcc no.20886)的16s rdna序列分析
[0074]
参照《分子克隆实验指南》书中的有关内容进行实验。收集菌丝体,然后用放线菌
dna提取试剂盒抽提总dna。采用通用引物27f(2 7 f:5
’‑
a g a g tt t g a t c c t g g c t c a g-3’)/1495r(1 4 9 2r:5
’ꢀ‑
tacggctaccttgttacgactt-3’)进行16srdna序列扩增,扩增体系和pcr 反应程序如表8所示,pcr产物检测采用0.8%琼脂糖凝胶电泳,pcr产物纯化回收采用sanprep柱式pcr纯化产物试剂盒,纯化后的pcr产物直接送南京金斯瑞生物科技有限公司进行序列测定。
[0075]
表8 pcr扩增体系和反应程序
[0076][0077]
菌株hdcc00025(cgmcc no.20886)所测的16s rdna的序列经校对后,与 genbank数据库中相关种、属的序列进行同源序列blast比较,以确定该菌株的分类地位。
[0078]
菌株hdcc00025(cgmcc no.20886)所测得到的16s rdna序列(seq idno:3),提交ncbi与genbank中相关序列进行blast比较,结果见表9(表中只列出同源性较高的模式菌株)。
[0079]
表9菌株hdcc00025(cgmcc no.20886)和典型模式菌株的同源性
[0080][0081]
通过对菌株hdcc00025 16s rdna区域进行测序,与genbank数据库中相关种、属的
序列进行同源序列blast比较,发现其与streptomyces scabrisporusstrain、streptomyces sp.等同源性均高达99.72%及以上,同时对菌株hdcc00025 进行表观特征试验,发现该菌株和链霉菌属(streptomyces sp.)分类相关参数非常接近,故将菌株hdcc00025鉴定为链霉菌属(streptomyces sp.)菌株。
[0082]
2、本发明链霉菌hdcc00025与其他乐普霉素b产生菌的比较如下:
[0083]
hamamoto t等人报道了链霉菌streptomyces sp.ats1287,该菌株在文献中描述的各种培养基中显示的菌落形态和孢子颜色,均与本发明的链霉菌hdcc00025 有较大不同。
[0084]
结合前述本发明的链霉菌hdcc00025的形态学、培养特征、生理生化特征和16s rdna序列鉴定结果,可知本发明的菌株hdcc00025属于链霉菌属 (streptomyces sp.)菌株,且不同于其他已知的乐普霉素b产生菌,故本发明的链霉菌hdcc00025是一株全新的乐普霉素b产生菌菌种。
[0085]
实施例4制备乐普霉素b发酵液
[0086]
(1)斜面孢子的制备与培养:
[0087]
斜面培养基配方(g/l):酵母抽提粉4.0g/l,麦芽抽提物10.0g/l,葡萄糖4.0 g/l,琼脂20.0g/l,消前ph 7.2~7.4,试管30
×
200mm,装量15ml,经121℃灭菌20min,冷却至55-60℃左右摆斜面,待冷却凝固后,接种一环孢子或菌丝体至斜面,28
±
1℃培养7~10天后,孢子成熟。
[0088]
(2)种子液的制备与培养:
[0089]
种子培养基配方(g/l):葡萄糖5g/l、玉米淀粉5g/l、黄豆饼粉20g/l、酵母抽提粉10g/l、碳酸钙1g/l,硫酸镁1g/l,磷酸氢二钾1g/l。消前ph 7.0; 250ml规格的三角摇瓶,装量50ml,121℃灭菌20min。接种107~108cfu/ml 至种子培养基中,28
±
1℃,250rpm振荡培养24小时,此时培养液ph 6.8-7.2,菌丝体浓度8%(体积百分比)。
[0090]
(3)发酵培养基的制备与培养:
[0091]
发酵培养基配方(g/l):
[0092]
玉米淀粉10g/l、麦芽糊精10g/l、豆油5g/l、酵母抽提粉15g/l、大豆卵磷脂5g/l、黄豆饼粉5g/l、酵母膏5g/l、硫酸镁1g/l、磷酸氢二钾2g/l、碳酸钙0g/l。消前ph 5.0。250ml规格的三角摇瓶,装量20ml,121℃灭菌 20min。将种子液以5%(体积比)的接种量接入。在28
±
1℃,250rpm振荡培养 120小时。
[0093]
经hplc方法检测发酵液中乐普霉素b的含量,测得为1174ug/ml。
[0094]
实施例5制备乐普霉素b发酵液
[0095]
(1)斜面培养基配方及培养条件同实施例4中步骤(1)
[0096]
(2)种子培养基配方及培养条件同实施例4中步骤(2)
[0097]
(3)发酵培养基的制备与培养:
[0098]
玉米淀粉20g/l、麦芽糊精20g/l、豆油10g/l、酵母抽提粉10g/l、大豆卵磷脂10g/l、黄豆饼粉10g/l、酵母膏10g/l、硫酸镁5g/l、磷酸氢二钾5g/l、碳酸钙20g/l。消前ph 6.0。250ml规格的三角摇瓶,装量20ml,121℃灭菌 20min。将种子液以8%(体积比)的接种量接入。在23
±
1℃,250rpm振荡培养 72小时。
[0099]
经hplc方法检测发酵液中乐普霉素b的含量,测得为986ug/ml。
[0100]
实施例6制备乐普霉素b发酵液
[0101]
(1)斜面培养基配方及培养条件同实施例4中步骤(1);一级种子培养基配方及培养条件同实施例4中步骤(2)。
[0102]
(2)种子罐种子液的制备:
[0103]
种子罐中种子液培养基配方同实施例4中步骤(2)中种子培养基;
[0104]
在15l的种子罐中投入10l的种子培养基,用蒸汽灭菌,121℃灭菌20min,待冷却至28℃后接入一级的摇瓶种子液200ml。搅拌转速200rpm,通气量1.0 vvm,28
±
1℃培养24小时,此时种子液ph 7.4,菌丝浓度15%(体积比)。
[0105]
(3)发酵罐发酵液的制备:
[0106]
发酵培养基的配方
[0107]
玉米淀粉50g/l、麦芽糊精50g/l、豆油20g/l、酵母抽提粉15g/l、大豆卵磷脂20g/l、黄豆饼粉20g/l、酵母膏20g/l、硫酸镁10g/l、磷酸氢二钾8g/l、碳酸钙50g/l。消前ph 7.0。
[0108]
发酵罐体积50l,投料体积30l,用蒸汽灭菌,121℃,20min,待冷却至 28℃后接入种子罐种子液3l。搅拌转速300-600rpm(转速在前3天逐渐从300 rpm升至600rpm),通气量2.0vvm,30℃培养168小时。
[0109]
经hplc方法检测发酵液中的乐普霉素b的含量为1218ug/ml。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1