含有支化醚链的有机共轭分子及其制备和应用
1.本发明涉及一类含有支化醚链作为侧链的有机共轭分子及其制备方法,以及这类有机共轭分子作为有机半导体材料的应用,属于有机高分子功能材料领域。
背景技术:
2.有机共轭分子是一类可溶液加工,柔性,结构易于调控修饰的材料。近年来,由于合成方法学的发展与器件加工工艺的改进,有机共轭分子在有机太阳能电池(opv)、有机发光二极管(oled)和有机场效应晶体管(ofet)等领域取得了一系列令人瞩目的成果,正在逐步从科学研究阶段迈向产业化。
3.有机共轭分子的溶液可加工性源于可化学修饰的侧链。疏水的烷基侧链可以提高材料在有机溶剂中的溶解度和可加工性,以满足卷对卷印刷、喷墨打印等生产方式的需求。基于传统烷基侧链的有机共轭分子虽然可以采用大面积溶液加工的生产方式,但是由于烷基链本身的疏水特性和较低的极性,往往需要溶解在有毒的氯代有机溶剂中,例如氯仿、氯苯、氯萘等,这为器件的绿色加工和应用安全带来了极大的阻碍和挑战,也是目前有机共轭分子产业化过程中亟需解决的关键问题之一。
4.此外,近年来,随着生物电子领域的快速发展,有机共轭分子的离子传导特性越来越受到人们的广泛关注。同时具有离子、电子导体性质的有机共轭分子已经实现了将离子信号转化为光电信号的功能,例如有机电化学电池(olec)、有机电化学晶体管(oect)等,并应用于发光、代谢物检测、神经信号检测、类神经计算等领域中。开发同时具有良好离子、电子传导特性的分子,对于生物电子领域的应用具有重要意义。但是,传统的有机共轭分子为了增加溶解性会修饰疏水的烷基侧链,水-有机层界面处的离子很难渗入其中并保证良好的移动,从而无法将离子信号高效地转化为电信号。
5.为了保证有机共轭分子的溶液加工特性以及离子传输特性,疏水低极性的烷基侧链需要被修饰替换为亲水高极性的基团。人们尝试引入了羧基、磺酸基、聚乙二醇醚等,以此增加有机共轭分子的离子亲和性和渗透性。其中,以聚乙二醇醚为代表的醚类侧链由于其具有亲水性、高极性、高柔性以及离子导电性,获得了人们的广泛关注(meng,b.;liu,j.;wang,l.polymer chemistry 2020,11,1261)。由此,人们开发了一系列基于直聚醚侧链的有机共轭聚合物,应用于有机太阳能电池、有机热电、有机电化学晶体管等领域,获得了较为优异的性能。但是,对于具有较大共轭骨架的体系,特别是给受体型共轭聚合物来说,直链含醚侧链可能无法满足实际应用的需要:基于短链的分子溶解度较差,无法保证足够的溶液可加工性和离子渗透性;而过长的含醚链则会在液态环境下导致体系过度的溶胀以及电子迁移路径的破坏,使器件性能不够理想(savva,a.;hallani,r.;cendra,c.;surgailis,j.;hidalgo,t.c.;wustoni,s.;sheelamanthula,r.;chen,x.;kirkus,m.;giovannitti,a.,et al.adv.funct.mater.2020,1907657)。因此,设计合成一种新型的具有良好的增溶性能并且不显著阻碍材料电子迁移的侧链在有机共轭聚合物的研究中非常重要。
6.为了解决侧链的溶解度以及分子排列问题,有研究报道了调节支化烷基链分叉位点的方法,这对于有机场效应晶体管的迁移率具有很好的改善作用(裴坚,雷霆,窦锦虎.一种分叉烷基链及其制备和在有机共轭分子中的应用[p].北京:cn102775273a,2012-11-14.)。但是,这一方法仅适用于传统烷基链,对于以聚醚为代表的侧链体系,需要开发新的合成方法。此外,就加工方法而言,理论上含醚侧链的聚合物可以采用低毒性的极性溶剂甚至水溶液进行加工,但目前含醚侧链溶剂加工方法的研究相对较少。有机电化学晶体管相关的研究显示,传统的卤代溶剂(如氯仿)加工,往往需要滴涂工艺才能获得较好的器件性能(nielsen,c.b.;giovannitti a.;sbircea,d.t.;,bandiello,e.;niazi,m.r.;hanifi,d.a.;sessolo,m.;amassian,a.;malliaras,g.g.;rivnay,j.;mcculloch,i.j.am.chem.soc.2016,138,10252.),这为保证大面积加工的均匀性带来了极大的挑战。因此,开发新型含有支化含醚侧链的有机共轭分子的合成和加工方法,对于有机共轭分子的绿色加工,以及离子传输等相关领域的应用,具有重要意义。
[0007]
为了调控含醚侧链聚合物的加工,新型的溶剂条件是必要的。我们发现,氟代的醇类溶剂与含醚侧链有着非常强烈的配位作用,在前期的研究中已经证明了,六氟异丙醇-四氢呋喃的复合物沸点可以高达100摄氏度(berkessel,a.;adrio,j.a.;huttenhain,d.;neudorfl,j.m.j.am.chem.soc.2006,128,8421),并且,氟代的醇类可以用于调控蛋白质的二级结构(othon,c.m.;kwon,o.h.;lin,m.m.;zewail,a.h.proc.natl.acad.sci.u.s.a.2009,106,12593),被广泛地应用于生物领域。我们认为,含醚侧链的有机共轭分子具有高极性的特点,利用氟代溶剂加工这类聚合物可以充分利用氟代醇类与聚醚形成强氢键的特点,调控侧链的取向,从而调控共轭聚合物的高级结构,借以优化其光电性能。
技术实现要素:
[0008]
针对目前广泛存在的有机共轭分子的加工溶剂毒性大、离子传输能力不足等缺点,本发明的目的在于提供一种新型的支化含醚侧链,并将其应用于有机共轭分子,特别是有机共轭高分子的制备中。相比普通烷基链和直链含醚侧链,这类支化含醚侧链可以提供更大的德拜长度和空间位阻,因而具有更高的极性和柔性。因此,支化含醚侧链一方面能够保障高分子量材料的溶液可加工性,另一方面保障了离子亲和性和在材料中的迁移速率。同时,支化含醚侧链的较高的极性可以一定程度稳定阳离子,使得材料本身更易发生掺杂,并维持掺杂体系的稳定性。此外,对于支化位点的调节可以进一步调节材料的堆积状态、薄膜形貌、电子离子传输性能以及器件性能。支化含醚侧链结构的高度可调性可以为有机共轭分子及其相关应用领域带来许多新的可能。另外,针对含醚侧链,本发明应用了一系列质子性氟代醇类溶剂进行有机薄膜的加工,包括三氟乙醇(tfe)、六氟异丙醇(hfip)、苯基三氟乙醇(phtfe)等,提高了有机半导体材料加工的环境友好性。
[0009]
在本发明的第一方面,提供如下式(i)所示的含醚侧链结构:
[0010]
[0011]
式(i)中,m是大于1的整数;r1为卤原子、羟基、氨基、甲磺酸基、三氟甲磺酸基、对甲苯磺酸基、叠氮基团、氰基、烯基、炔基或烷氧基;r2和r3相同或不同,独立选自含醚取代基、含羰基取代基、烷基、卤素取代的烷基、烯基和炔基。
[0012]
式(i)中,m优选为2-18的整数;更优选为2-10的整数。
[0013]
作为r1取代基的烯基,优选为c2-c6的烯基,更优选c2-c4的烯基,最优选乙烯基。
[0014]
作为r1取代基的炔基,优选为c2-c6的炔基,更优选c2-c4的炔基,最优选乙炔基。
[0015]
作为r1取代基的烷氧基,优选为c1-c36的直链或支链烷氧基,更优选为c1-c18的直链或支链烷氧基。
[0016]
作为r2、r3取代基的含醚取代基,优选为聚乙二醇的1-12寡聚体,更优选为聚乙二醇1-5的寡聚体。
[0017]
作为r2、r3取代基的含羰基取代基,优选c1-c36烷烃链的酰基与含醚的酰基,更优选为含醚的酰基。
[0018]
作为r2、r3取代基的烷基,优选为c1-c36的直链或支链烷基,更优选为c1-c18的直链或支链烷基。
[0019]
作为r2、r3取代基的卤素取代的烷基,优选为c1-c36的直链或支链的卤素取代的烷基,更优选为c1-c18的直链或支链的卤素取代的烷基。
[0020]
作为r2和r3取代基的烯基,优选c2-c18的烯基,更优选c2-c10的烯基,最优选c2-c6的烯基。
[0021]
作为r2、r3取代基的炔基,优选c2-c18的炔基,更优选c2-c10的炔基,最优选c2-c6的炔基。
[0022]
下面给出几个分叉含醚链的例子。
[0023]
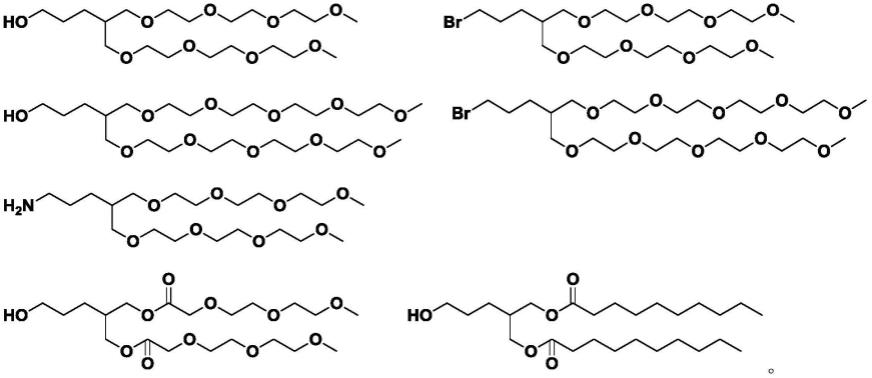
当r1为羟基,m=3,r2和r3由三乙二醇单甲醚缩合得到时,给出如下所示的结构:
[0024][0025]
这一键线式可以简写为下面的式子:
[0026][0027]
当r1为卤素原子,m=3,r2和r3由三乙二醇单甲醚缩合得到时,给出如下所示的结构:
[0028][0029]
这一键线式可以简写为下面的式子:
[0030][0031]
当r1为羟基,m=3,r2和r3由四乙二醇单甲醚缩合得到时,给出如下所示的结构:
[0032]
[0033]
这一键线式可以简写为下面的式子:
[0034][0035]
当r1为卤素,m=3,r2和r3由四乙二醇单甲醚缩合得到时,给出如下所示的结构:
[0036][0037]
这一键线式可以简写为下面的式子:
[0038][0039]
当r1为氨基,m=3,r2和r3由三乙二醇单甲醚缩合得到时时,给出如下所示的结构:
[0040][0041]
这一键线式可以简写为下面的式子:
[0042][0043]
当r1为羟基,m=3,r2和r3含羰基的取代基时,可以具有以下的结构:
[0044][0045]
式(i)化合物的制备方法包括如下步骤:
[0046]
1)从卤代醇出发,将羟基进行保护,具体的保护基pg可以是苄基、甲氧基甲基等,如下所示:
[0047][0048]
2)由丙二酸酯出发,通过与式(a)所示的羟基保护的卤代烷缩合反应得到式(b)所示的结构;
[0049][0050]
这一反应也可以是丙二酸酯和其他对碱稳定的卤代烃进行反应,例如下面的反应式所示,先引入烯烃基团,再在后续过程中通过硼氢化氧化还原反应得到端位的羟基,在这一方法中,只能制备m≥2的目标产物:
[0051][0052]
3)对酯基进行还原反应得到式(c)所示的二醇;
[0053][0054]
4)引入r2和r3基团的方法有以下四种:
[0055]
4a)将式(c)所示的二醇用强碱(这里的强碱可以是氢化钠、叔丁醇钾等)转化为醇盐,并进行亲核取代反应,引入r2和r3基团。
[0056][0057]
这里,r2与r3的引入可以分步进行,如下所示:
[0058]
[0059]
4b)将式(c)所示的二醇进行酯化反应,引入含酰基的r2与r3基团。
[0060][0061]
其中,r'2和r'3相同或不同,独立选自含醚取代基、含羰基取代基、烷基、卤素取代的烷基、烯基和炔基。
[0062]
4c)通过缩合反应引入r2和r3基团,在这里,缩合反应可以用硫酸氢钠等酸性催化剂催化反应进行。
[0063][0064]
4d)可以将二醇的羟基转化为离去基团lg,再与醇盐反应同样生成式(f)所示的化合物,这里的离去基团lg可以是对甲苯磺酸基团、甲磺酸基团、卤素原子等。
[0065][0066]
5)脱除保护基生成相应的醇,脱除保护基的方法对应于步骤(i)中保护基的类型,例如当pg为苄基时,采用钯催化氢气还原的条件脱除,当pg为甲氧基甲基时,采用酸催化脱除保护基pg;
[0067][0068]
当式(i)中的r1不为羟基时,对式(g)化合物中的羟基进行取代反应转化为其他的官能团。
[0069]
5a)r1为卤素时,采用如下反应之一得到相应式(i)化合物:
[0070][0071]
5b)r1为对甲苯磺酸基、甲磺酸基或是三氟甲磺酸基时,先通过碱与醇羟基反应生成氧负离子,随后与tscl、mscl、tf2o进行亲核取代反应得到相应式(i)化合物;
[0072][0073]
5c)r1为叠氮基团时,用叠氮钠与卤素、甲磺酸基或对甲苯磺酸基进行亲核取代反应得到r1为叠氮基团的式(i)化合物:
[0074][0075]
上述反应式中,x'代表卤原子、甲磺酸基或对甲苯磺酸基;
[0076]
5d)r1为氰基时,用氰化物与卤素、甲磺酸基或对甲苯磺酸基进行亲核取代反应得到r1为氰基的式(i)化合物:
[0077][0078]
上述反应式中,x'代表卤原子、甲磺酸基、对甲苯磺酸基;
[0079]
5e)r1为氨基时,将叠氮或氰基还原为氨基,或者通过盖布瑞尔氨基制备反应得到
r1为氨基的式(i)化合物:
[0080][0081]
上述反应式中,x'代表卤原子、甲磺酸基或对甲苯磺酸基;
[0082]
5f)r1为烯基或炔基时,用烯基或炔基的亲核试剂对r1为卤原子的式(i)化合物进行亲核取代反应,得到r1为烯基或炔基的式(i)化合物。这些亲核试剂可以是烃基的金属试剂,这里以烯基或炔基的锌试剂为例:
[0083][0084]
本发明进一步提供了式(ii)所示带分叉烷基链的芳香化合物:
[0085][0086]
其中,ar1代表芳香母核;波浪线表示利用该芳香化合物进行聚合反应所需要的官能团;m是大于1的整数;r2和r3相同或不同,独立选自含醚取代基、含羰基取代基、烷基、卤素取代的烷基、烯基和炔基。
[0087]
式(ii)所示芳香化合物是通过亲核取代反应等将式(i)化合物的支化含醚侧链结构引入到芳香母核上。下面举几个典型例子进行式(ii)化合物合成的描述。
[0088]
6)式(ii)所示芳香化合物的合成方法有如下三种:
[0089]
6a)当芳香母核与分叉烷基链的连接处具有内酰胺结构或者亚胺结构时,例如异靛青分子、靛红分子、吡咯并吡咯二酮、咔唑等,可以通过下述的亲核反应引入式(i)单元:
[0090][0091]
6b)当芳香母核与分叉烷基链的连接处具有酰亚胺结构时,例如萘二酰亚胺、苝二酰亚胺等,可以通过如下所示的缩合反应引入式(i)单元:
[0092][0093]
6c)当芳香母核通过碳原子与式(i)中的分叉烷基链结合时,可以采用negishi反应等方法,如下所示:
[0094][0095]
下列式ii-1至ii-16给出了一些典型结构的式(ii)芳香化合物:
[0096]
[0097][0098]
上述式ii-1至ii-16中,r4、r5、r6和r7代表芳环上的取代基,各自独立选自氢原子、卤原子、硝基、氨基、氰基、烷基、烯基、炔基、烷氧基、卤素取代的烷基和卤素取代的烷氧基;r8和r9代表芳环上的一个或多个取代基,这些取代基各自独立选自氢原子、卤原子、硝基、氨基、氰基、烷基、烯基、炔基、烷氧基、卤素取代的烷基和卤素取代的烷氧基;a和a’独立选自以下结构:—s—,—o—,—se—,—nr
10
—;b、b’、c和c’独立选自以下结构:—n=,=n—,—cr
10
=,=cr
10
—,其中r
10
代表氢原子、烷基、烯基、炔基、烷氧基、卤素取代的烷基、卤素取代的烷氧基、芳基或杂环芳基。
[0099]
其中,所述烷基优选为c1-c12烷基,所述烯基优选为c2-c12烯基,所述炔基优选为c2-c12炔基,所述烷氧基优选为c1-c12烷氧基,所述芳基优选为苯基、邻位和/或对位取代的苯基,所述杂环芳基优选为噻吩、吡啶、呋喃、吡咯等基团。
[0100]
本发明还提供了式(iii)聚合物:
[0101][0102]
其中,ar1和ar2代表不同的芳香化合物片段;n为整数,代表聚合物的聚合度;m是大于1的整数;r2和r3相同或不同,独立选自含醚取代基、含羰基取代基、烷基、卤素取代的烷基、烯基和炔基。这些聚合物由式(ii)所示结构的芳香化合物单体和ar2芳香化合物单体聚合而成,作为有机半导体材料应用在晶体管器件与热电器件中。
[0103]
式(iii)中,m优选为2-18的整数。式(iii)聚合物的分子量优选在20kda
–
200kda之间,pdi为2左右。
[0104]
下面是式(iii)所示聚合物分子的一些典型例子:
[0105][0106]
在本发明的第二方面,上述式(iii)所示具有支化含醚侧链的聚合物作为有机半导体材料应用于有机电化学晶体管等光电器件中。此类聚合物可以用六氟异丙醇、三氟乙
醇等氟代醇类溶剂进行加工,减弱溶剂加工过程中的毒性,这些溶剂包含但不仅限于六氟异丙醇、三氟乙醇、苯基六氟异丙醇等(如下面的化学式所示)。这类含有支化含醚侧链的聚合物以及醇类溶剂的加工方式,可以同时保证材料的高电子迁移率和体积电容,从而获得优异的器件灵敏度、稳定性和响应速度。
[0107][0108]
本发明设计了一类新颖的支化含醚侧链和其有机共轭分子体系,并提出了该类体系的有效合成路径和溶剂加工方式。本发明还证明了在有机共轭分子体系上引入支化含醚侧链,改变了聚合物的溶解度和离子亲和性,并同时保障了材料的电子传输和离子传输通道,实现了高跨导和高响应速度。因而这一成果可以广泛的应用于有机电子学领域,包括有机电化学晶体管(oect)、有机电化学电池(olec)、有机热致发电电池等领域。
附图说明
[0109]
图1为本发明的式(i)所示支化含醚侧链结构和式(iii)所示具有支化含醚侧链的聚合物的结构式。
[0110]
图2为应用本发明的聚合物作为活性层材料制作成的有机电化学晶体管的器件结构示意图;
[0111]
图3为活性材料为聚合物p4的图2所示器件的转移特性曲线图(其中v
ds
为源漏电压,i
ds
为源漏电流,v
gs
为栅极电压);
[0112]
图4为活性材料为聚合物p4的图2所示器件的输出特性曲线图(其中v
ds
为源漏电压,i
ds
为源漏电流,v
gs
为栅极电压)。
[0113]
图5为活性材料为聚合物p4的图2所示器件的开关测试曲线(其中v
ds
为源漏电压,i
ds
为源漏电流,v
gs
为栅极电压,τ为响应时间)。
[0114]
图6为活性材料为聚合物p4的图2所示器件的开关稳定性测试结果(其中v
ds
为源漏电压,i
ds
为源漏电流,v
gs
为栅极电压)。
[0115]
图7为六氟异丙醇溶剂加工的聚合物p4薄膜(右图)和氯仿溶剂加工的聚合物p4薄膜(左图)的原子力显微镜下的照片。
具体实施方式
[0116]
下面结合附图,通过实施例对本发明做进一步详细描述,但不以任何方式限制本发明的范围。
[0117]
实施实例1
[0118][0119]
化合物1合成过程:在250ml干燥的双口瓶中加入5.24g 60%含量矿物油包裹的氢化钠,将体系的氛围置换为氮气,打入120ml干燥的四氢呋喃,缓慢滴加27.4g丙二酸二甲酯,待气体生成完毕,滴入25.0g苄基溴丙酯,升温到90℃反应5h。反应结束后,停止加热,冷却体系到室温,加入50ml水淬灭反应,用乙醚(50ml
×
3)萃取体系,有机相用无水硫酸镁干燥,过滤,旋蒸除去溶剂。减压蒸馏得到30.2g无色透明油状液体,产率为99%。1h nmr(400mhz,chloroform-d)δ7.27-7.37(m,5h),4.49(s,2h),3.73(s,6h),3.49(t,j=6.3hz,2h),3.41(t,j=7.5hz,1h),1.98-2.05(m,2h),1.61-1.69(m,2h).
[0120]
实施实例2
[0121][0122]
化合物2合成路径:250ml干燥的双口瓶中加入0.84g氢化铝锂,将体系置换为氮气。打入干燥的40ml四氢呋喃,冰浴下缓慢滴加2.56g化合物1,室温反应12h。反应结束,在冰浴下滴加10ml硫酸钠的饱和溶液,将体系过硅藻土,用乙酸乙酯冲洗沉淀,收集母液,用无水硫酸钠干燥,过滤,旋蒸除去溶剂,以乙酸乙酯:二氯甲烷=8:1体积比的展开剂柱色谱分离得到1.69g无色透明油状产物,产率为82%。1h nmr(400mhz,chloroform-d)δ7.41
–
7.27(m,5h),4.49(s,2h),3.81
–
3.55(m,4h),3.47(t,j=6.4hz,2h),2.80
–
2.55(br,2h),1.72(s,1h),1.70
–
1.56(m,2h),1.40
–
1.25(m,2h).
[0123]
实施实例3
[0124][0125]
化合物3合成路径:在250ml干燥的双口瓶中加入0.45g 60%含量矿物油包裹的的氢化钠,将体系置换为氮气氛围,打入30ml四氢呋喃,缓慢滴加含有1.06g化合物2的四氢呋喃溶液,待体系不再有气体产生,滴入4.50g mpeg3-ots(对甲苯磺酸三乙二醇单甲醚酯),90℃反应12h。反应结束停止加热,将体系冷却到室温,加水淬灭反应,体系用乙醚萃取(50ml
×
3),富集有机相,用无水硫酸镁干燥,过滤,旋蒸除去溶剂,剩余物柱色谱分离,展开剂为乙酸乙酯:甲醇=40:1(体积比),分离得到0.80g无色透明油状物,产率33%。1h nmr(400mhz,chloroform-d)δ7.27
–
7.37(m,5h),4.49(s,2h),3.68
–
3.60(m,16h),3.56(m,8h),3.47(m,2h),3.38(m,8h),1.92
–
1.82(m,1h),1.60
–
1.70(m,2h),1.35
–
1.45(m,2h).
[0126]
实施实例4
[0127][0128]
化合物4合成路径:在250ml干燥的双口瓶中加入0.14g 10%的钯碳(干)催化剂,将体系置换为氮气氛围。打入100ml干燥的乙酸乙酯,将体系置换为氢气,打入1.45g原料3,室温搅拌24h。反应结束,将体系过硅藻土,旋干得到无色透明油状液体,质量为1.11g,产率为93%。1h nmr(400mhz,chloroform-d)δ3.68
–
3.60(m,18h),3.56(m,8h),3.47(m,2h),3.38(m,8h),1.92(m,1h),1.67
–
1.55(m,2h),1.44(m,2h).
[0129]
实施实例5
[0130][0131]
化合物5合成路径:在250ml干燥的双口瓶中加入1.11g化合物4,0.91g四溴化碳,将体系置换为氮气,打入20ml干燥的二氯甲烷,冰浴下缓慢滴入含有0.72g三苯基膦的10ml二氯甲烷溶液,室温反应4h。反应结束,加入5ml去离子水淬灭,有机相用二氯甲烷萃取,合并后用无水硫酸钠干燥,旋蒸除去溶剂,用20ml无水乙醚溶解残余物,滤去不溶物,保留母液,重复5次,旋干,柱色谱分离,展开剂为乙酸乙酯:二氯甲烷=8:1(体积比),分离得到无色透明油状液体,质量为1.07g,产率为85%。1h nmr(400mhz,chloroform-d)δ3.64
–
3.55(m,16h),3.51(m,8h),3.42
–
3.30(m,12h),1.91
–
1.76(m,3h),1.48
–
1.38(m,2h).
[0132]
实施实例6
[0133][0134]
化合物6合成路径:25ml干燥的双口瓶中加入128mg二溴代噻吩吡咯并吡咯烷酮(6a),59mg碳酸钾,300mg化合物5,309mg四丁基溴化铵,将体系置换为氮气,打入10ml干燥的n,n-二甲基甲酰胺,升温到125℃反应7h。反应结束,冷却体系到室温,加入水淬灭,有机相用二氯甲烷萃取(50ml
×
3),合并有机相,用1mol/l的稀盐酸(50ml
×
3)洗涤有机相,用50ml饱和碳酸氢钠溶液洗涤有机相,最后用50ml饱和食盐水洗涤有机相,有机相用无水硫酸钠干燥,旋蒸除去溶剂。剩余物用柱色谱分离,展开剂为乙酸乙酯:甲醇=40:1(体积比),分离得到深紫色固体质量为149mg,产率为41%。1h nmr(400mhz,chloroform-d)δ8.65(d,j=4.2hz,2h),7.25(d,j=4.3hz,2h),3.96(t,j=7.9hz,4h),3.69
–
3.58(m,32h),3.58
–
3.51(m,16h),3.48
–
3.33(m,20h),1.90(m,2h),1.81
–
1.71(m,4h),1.48(m,j=7.5hz,4h).
[0135]
实施实例7
[0136][0137]
化合物8合成路径:25ml干燥的双口瓶中加入100mg化合物7,59mg碳酸钾,300mg化合物5,206mg四丁基溴化铵,将体系置换为氮气,打入5ml干燥的n,n-二甲基甲酰胺,升温到125℃反应7h。反应结束,冷却体系到室温,加入水淬灭,有机相用二氯甲烷萃取(50ml
×
3),合并有机相,用1mol/l的稀盐酸(50ml
×
3)洗涤有机相,用50ml饱和碳酸氢钠溶液洗涤有机相,最后用50ml饱和食盐水洗涤有机相,有机相用无水硫酸钠干燥,旋蒸除去溶剂。剩余物用柱色谱分离,展开剂为乙酸乙酯:甲醇=40:1(体积比),分离得到深紫色固体8,质量为229mg,产率为70%。1h nmr(400mhz,chloroform-d)δ8.58(d,j=1.7hz,2h),6.64(d,j=1.6hz,2h),3.99(t,j=8.0hz,4h),3.89(s,6h),3.68
–
3.48(m,48h),3.48
–
3.32(m,20h),1.88(m,2h),1.75(m,4h),1.51
–
1.39(m,4h).
[0138]
实施实例8
[0139][0140]
化合物9合成路径:50ml干燥的双口瓶中加入203mg化合物8,用20ml二氯甲烷将固体8溶解,冰浴下缓慢加入65mg n-溴代丁二酰亚胺固体,回温到室温,避光反应4个小时。反应结束,加入10ml去离子水淬灭,有机相用二氯甲烷萃取(10ml
×
3),合并有机相,有机相用10ml饱和碳酸氢钠洗涤,去离子水洗涤(10ml
×
3),饱和食盐水洗涤,分液,有机相用无水硫酸钠干燥,过滤,旋干。剩余物柱色谱分离,展开剂为乙酸乙酯:甲醇=40:1(体积比),得到198mg深紫色固体9,产率为86%。1h nmr(400mhz,chloroform-d)δ8.90(s,2h),4.06(s,
6h),3.97(t,j=8.1hz,4h),3.68
–
3.51(m,48h),3.47
–
3.33(m,20h),1.97
–
1.86(m,2h),1.85
–
1.70(m,4h),1.54
–
1.43(m,4h).
[0141]
实施实例9
[0142][0143]
化合物10合成路径:在250ml干燥的双口瓶中加入1.35g 60%含量矿物油包裹的氢化钠,将体系置换为氮气氛围,打入30ml四氢呋喃,缓慢滴加含有2.50g化合物2的四氢呋喃溶液,待体系不再有气体产生,滴入8.50g mpeg4-ots(对甲苯磺酸四乙二醇单甲醚酯),90℃反应12h。反应结束停止加热,将体系冷却到室温,加水淬灭反应,体系用乙醚萃取(50ml
×
3),富集有机相,用无水硫酸镁干燥,过滤,旋蒸除去溶剂,剩余物柱色谱分离,展开剂为乙酸乙酯:甲醇=10:1(体积比),分离得到5.54g无色透明油状物10,产率82%。1h nmr(400mhz,chloroform-d)δ7.36
–
7.26(m,5h),4.48(s,2h),3.63(m,24h),3.57
–
3.52(m,8h),3.48
–
3.38(m,6h),3.37(s,6h),1.86(m,1h),1.70
–
1.55(m,2h),1.47
–
1.31(m,2h).
[0144]
实施实例10
[0145][0146]
化合物11合成路径:在250ml干燥的双口瓶中加入10%的钯碳(干)催化剂,将体系置换为氮气氛围。打入100ml干燥的乙酸乙酯,将体系置换为氢气,打入2.02g原料10,室温搅拌24h。反应结束,将体系过硅藻土,旋干得到无色透明油状液体11,质量为1.62g,产率为94%。1h nmr(400mhz,chloroform-d)δ3.66
–
3.59(m,26h),3.55(m,8h),3.48
–
3.35(m,10h),2.12
–
2.24(br,1h),1.94
–
1.88(m,1h),1.60(m,2h),1.43(m,2h).
[0147]
实施实例11
[0148][0149]
化合物12合成路径:在250ml干燥的双口瓶中加入1.00g化合物11,1.40g四溴化碳,将体系置换为氮气,打入干燥的10ml二氯甲烷,冰浴下缓慢滴入含1.20g三苯基膦的5ml二氯甲烷溶液,室温反应4h。反应结束,加入5ml去离子水淬灭,有机相用二氯甲烷萃取,合并后用无水硫酸钠干燥,旋蒸除去溶剂,用无水乙醚重结晶,滤去不溶物,保留母液,重复5次,旋干,柱色谱分离,洗脱剂为乙酸乙酯:甲醇=10:1(体积比),分离得到无色透明油状液体12,质量为0.71g,产率为63%。1h nmr(400mhz,chloroform-d)δ3.68
–
3.59(m,24h),3.55(m,8h),3.47
–
3.35(m,12h),1.89(m,3h),1.53
–
1.42(m,2h).
[0150]
实施实例12
[0151][0152]
化合物14合成路径:25ml干燥的双口瓶中加入50.0mg化合物13,25.2mg碳酸钾,128mg化合物5,132mg四丁基溴化铵,将体系置换为氮气,打入1ml干燥的n,n-二甲基甲酰胺,升温到100℃反应7h。反应结束,冷却体系到室温,加入水淬灭,有机相用二氯甲烷萃取(50ml
×
3),合并有机相,用1mol/l的稀盐酸(50ml
×
3)洗涤有机相,用50ml饱和碳酸氢钠溶液洗涤有机相,最后用50ml饱和食盐水洗涤有机相,有机相用无水硫酸钠干燥,旋蒸除去溶剂。剩余物用柱色谱分离,展开剂为乙酸乙酯:甲醇=40:1(体积比),分离得到深紫色固体14,质量为131mg,产率为89%。1h nmr(400mhz,chloroform-d)δ9.08(d,j=8.6hz,2h),7.17(dd,j=8.6,1.9hz,2h),6.96(d,j=1.9hz,2h),3.72(t,j=7.5hz,4h),3.67
–
3.59(m,32h),3.55(m,16h),3.49
–
3.35(m,20h),1.92(m,2h),1.74(m,4h),1.46(m,4h).
[0153]
实施实例13
[0154][0155]
聚合物p1合成路径:25ml干燥的schlenk管中加入40.0mg化合物6,17.7mg甲氧基联二噻吩双锡试剂(化合物15),0.88mg二氯二(三苯基膦)钯,0.24mg碘化亚铜,1ml干燥氯苯和1ml干燥n,n-二甲基甲酰胺,冻抽三次,升温到135℃反应48小时。反应结束停止加热,冷却体系到室温,加入5mg除钯配体(e)-n,n-二乙基-2-苯基偶氮-1-硫代甲酰胺,升温到80℃反应4h,冷却到室温,将体系倒入到正己烷中沉降,沉淀物进行索氏提取,使用的溶剂为正己烷、甲醇、丙酮、氯仿,最后用氯仿提取得到产品,产品为墨绿色固体p1,质量为24.4mg,产率为58%。
[0156]
实施实例14
[0157][0158]
聚合物p2合成路径:25ml干燥的schlenk管中加入30.0mg化合物9,11.23mg联二噻吩双锡试剂(化合物16),0.65mg二氯二(三苯基膦)钯,0.17mg碘化亚铜,1ml干燥氯苯和1ml干燥n,n-二甲基甲酰胺,冻抽三次,升温到135℃反应48小时。反应结束停止加热,冷却体系到室温,加入5mg除钯配体(e)-n,n-二乙基-2-苯基偶氮-1-硫代甲酰胺,升温到80℃反应4h,冷却到室温,将体系倒入到正己烷中沉降,沉淀物进行索氏提取,使用的溶剂为正己烷、甲醇、丙酮、氯仿,最后用氯仿提取得到产品,产品为墨绿色固体p2,质量为27.2mg,产率为90%。
[0159]
实施实例15
[0160][0161]
聚合物p3合成路径:25ml干燥的schlenk管中加入21.35mg化合物14,9.53mg甲氧基联二噻吩双锡试剂(化合物15),0.32mg pd2(dba)2,0.42mg邻甲苯基膦,2ml干燥甲苯,冻抽三次,升温到100℃反应48小时。反应结束停止加热,冷却体系到室温,加入5mg除钯配体(e)-n,n-二乙基-2-苯基偶氮-1-硫代甲酰胺,升温到80℃反应4h,冷却到室温,将体系倒入到正己烷中沉降,沉淀物进行索氏提取,使用的溶剂为正己烷、甲醇、丙酮、氯仿,丙酮提取得到大量墨绿色固体,最后用氯仿提取得到产品,产品为墨绿色固体p3,质量为6.5mg,产率为29%。
[0162]
实施实例16
[0163][0164]
聚合物p4合成路径:25ml干燥的schlenk管中加入47.4mg化合物17,20.9mg甲氧基联二噻吩双锡试剂(化合物15),1.36mg二氯二(三苯基膦)钯,0.37mg碘化亚铜,1ml干燥氯苯和1ml干燥n,n-二甲基甲酰胺,冻抽三次,升温到135℃反应48小时。反应结束停止加热,冷却体系到室温,加入5mg除钯配体(e)-n,n-二乙基-2-苯基偶氮-1-硫代甲酰胺,升温到80℃反应4h,冷却到室温,将体系倒入到正己烷中沉降,沉淀物进行索氏提取,使用的溶剂为正己烷、甲醇、丙酮、氯仿,最后用氯仿提取得到产品,产品为墨绿色固体p4,质量为41.1mg,产率为84%。
[0165]
实施实例17
[0166][0167]
聚合物p5合成路径:25ml干燥的schlenk管中加入30.7mg化合物18,20.0mg甲氧基联二噻吩双锡试剂(化合物15),1.20mg二氯二(三苯基膦)钯,0.30mg碘化亚铜,1ml干燥氯苯和1ml干燥n,n-二甲基甲酰胺,冻抽三次,升温到135℃反应48小时。反应结束停止加热,冷却体系到室温,加入5mg除钯配体(e)-n,n-二乙基-2-苯基偶氮-1-硫代甲酰胺,升温到80℃反应4h,冷却到室温,将体系倒入到正己烷中沉降,沉淀物进行索氏提取,使用的溶剂为正己烷、甲醇、丙酮、氯仿,最后用氯仿提取得到产品与大量不溶物,产品为墨绿色固体p5,质量为11.2mg,产率为26%。
[0168]
实施实例18
[0169]
有机电化学晶体管(oect)器件(图2)的加工和跨导、电子迁移率、体积电容的测定方法如下:使用二氧化硅或玻璃作为衬底,利用光刻方法得到金电极作为源漏电极;基底依次使用丙酮、去污剂、水和异丙醇进行清洗后,用氮气吹干;通过两层聚对二甲苯的沉积和刻蚀对沟道进行图案化,然后将聚合物(或小分子)的氯仿或六氟异丙醇溶液旋涂于基底之上,并于不同温度退火;随后,撕下牺牲层的聚对二甲苯,沟道内的聚合物薄膜得以保留。聚合物的转移曲线、输出曲线以及响应时间测试在keithley 4200半导体测试仪上进行,体积电容在biologic science instruments sp-300电化学工作站测试,由此推算材料的迁移率。
[0170]
下表为聚合物p1-p5的有机电化学晶体管器件的参数指标。其中采用六氟异丙醇/p4加工的器件性能参数见说明书附图。
[0171]
表1
[0172][0173]
a:大部分产品在提纯时被丙酮溶解,产率下降;b:大部分产品无法用氯仿溶解,产率下降。
[0174]
从对应聚合物p4转移曲线和输出曲线的图3和图4可知,六氟异丙醇加工的聚合物p4的有机电化学晶体管器件表现出理想的电流放大特性,并且在正反电压扫描的过程中几乎没有迟滞,表现出优异的电子离子传输性能。此外,图5的脉冲开关测试表现出器件具有良好的开关性能,响应速度很快,对应于表1中的微秒级的开关时间。图6的开关稳定性测试可以说明该器件具有优异的开关稳定性,在2000个循环中源漏电流的基本保持不变。
[0175]
在电化学晶体管器件中,材料的优劣由归一化的跨导(跨导)衡量,而μc*值就是衡量归一化跨导的一个参数,μc*值高的材料具有更好的电化学晶体管器件性能。由聚合物p4的两种溶剂加工器件的性能对比可知,六氟异丙醇加工的器件,迁移率与体积电容均比氯仿加工的器件有较大程度的提高,μc*值为氯仿加工器件的近5倍。从图7可以说明,氯仿对于含有醚链的聚合物溶解度有限,溶液加工过程中易形成大量团簇结构,从而影响器件的性能,而六氟异丙醇加工的薄膜不仅表面更为平整,而且易于形成网状结构,利于电荷传输的同时,有利于离子的进出,因此表现出更好的器件性能。
[0176]
从表格可知,聚合物p1-p5聚合用六氟异丙醇作为溶剂加工的器件均表现出优异的性能,目前均在有机电化学晶体管材料领域名列前茅。我们认为有以下两方面原因。一方面,支化醚链的引入提高了聚合物的溶剂加工性,采用的合成方法对于不同聚合物骨架结构具有普适性;另一方面,含氟溶剂可以调控含醚链的聚合物形成特殊的薄膜形貌,有利于电荷和离子的传输;适宜的合成和加工方法共同了收获了优异的有机电化学晶体管器件性能。因此,本发明提出的含有支化醚链聚合物的合成方法及溶液加工方式,在有机半导体领域具有显著的效果和重要意义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1