一种多重实时荧光PCR法检测人DMD基因拷贝数的相对定量方法及试剂盒与流程
一种多重实时荧光pcr法检测人dmd基因拷贝数的相对定量方法及试剂盒
技术领域
[0001]
本发明涉及生物检测技术领域,具体来说,涉及一种多重实时荧光pcr法检测人dmd基因拷贝数的相对定量方法及试剂盒。
背景技术:
[0002]
杜氏/贝氏肌营养不良症(duchenne/beckman muscμlar dystrophy;dmd/bmd)是dmd基因变异导致dystrophin蛋白缺陷所引起的一种x连锁隐性遗传的、以进行性肌无力和肌肉萎缩为特点的遗传性肌肉病变。其临床特征包括:肌痉挛、肌痛、股四头肌肌病、无症状高肌酸激酶血症、x-连锁扩张型心肌病等。
[0003]
女性dmd基因缺陷携带者临床表现差异较大,重者可为典型dmd表现,轻者表现为轻度近端肌无力、腓肠肌假性肥大,也可表现为肌肉功能基本正常。dmd在男婴中的发病率约为1/3500-1/4000,多于5-6岁起病,表现走路慢,易摔倒,走路姿势异常,多数在13周岁之前丧失独立行走能力,20-30岁死于心肺功能衰竭。bmd在男性中发病率约为1/8000-1/10000,临床症状出现较dmd晚,可保持行走能力到16岁,病情进展相对缓慢,寿命较长,寿命可达40-50岁。儿童期或青年期bmd患者可表现为肌肉痛性痉挛肌痛或无症状高肌酶血症。本病目前尚无具有普适性有效治疗方案。
[0004]
杜氏/贝氏肌营养不良症的致病原因为dmd基因缺陷。dmd基因是至今已发现的最大的基因,定位于xp21.2,包含79个外显子,7种组织特异性启动子,2200000个碱基对。dmd基因所编码的dystrophin蛋白分子量426kd,由3685个氨基酸组成,分为4个区域:1.与细胞内肌动蛋白(f-actin)相互作用的氨基端区(14-240氨基酸):包括第1-8个外显子;2.由24个三聚螺旋状重复结构组成的中央棒状区(253-3040氨基酸):包括9-63号外显子,与α肌动蛋白(α-actin)和血影蛋白同源;3.与肌膜上糖蛋白复合体相互作用的富含半胱氨酸区域(3080-3360氨基酸):包括64-68外显子;4.与细胞内的syntrophins蛋白相互作用的羧基端区域(3361-3685氨基酸):包括68-79号外显子。
[0005]
dmd基因编码的dystrophin蛋白具有连接细胞骨架与基底膜的功能,并与其他蛋白(dystroglycan、sarcoglycan)形成dystrophin蛋白复合体以维持细胞膜稳定性。dmd基因的变异可破坏其mrna开放读码框,严重影响dystrophin蛋白合成和功能,导致dystrophin蛋白复合体破坏,使肌细胞膜脆性增加、稳定性降低,强烈的肌肉收缩加剧肌细胞膜破裂,并使钙离子内流加速肌纤维的破坏,从而导致杜氏/贝氏肌营养不良症的临床表现。
[0006]
目前杜氏/贝氏肌营养不良症的临床治疗主要以保存患者运动功能、防治并发症为治疗目的,包括:糖皮质激素治疗、适当康复锻炼及外科矫形等。虽然在基因编辑、外显子跨越、ptc蛋白修复等治疗策略上取得重要进展,但目前尚无有效的根治方法,遗传阻断仍是最好的应对策略。杜氏/贝氏肌营养不良症的临床表现具有明显异质性的特点。
[0007]
dmd基因变异多样,主要包含4类。1:外显子拷贝数变异(cnv),包括外显子缺失
(deletion)和外显子重复(duplication)。2:外显子的点突变(substitution);3:外显子的小插入和小缺失(indels);4:未知变异(unknown):主要是影响剪接的内含子突变。根据dmd专业数据库lovd收录的dmd基因变异案例,上述各类变异的频率统计如表1所示:
[0008]
表1.dmd基因变异类型及相应比例
[0009]
变异类型deletionduplicationsubstitutionindelsunknown在所有变异中的比例56%11%31%0.7%1.3%在致病性变异中的比例66%12%20%0.9%1.1%
[0010]
从上述的dmd基因变异类型及相应比例中可以得出结论,在dmd基因的致病性变异中,片段缺失或重复变异,占比达到78%左右,是导致杜氏/贝氏肌营养不良症的主要变异类型。
[0011]
目前临床上dmd基因的拷贝数检测多使用荷兰mrc公司生产的多重连接探针扩增(multiple ligation-dependent probe amplification,mlpa)检测技术,dmd的mlpa检测试剂盒设计了p034探针组和p035探针组,其中p034探针组包括了用于检测dmd 40个外显子的40对探针和9个内参基因的9对探针;p035探针组包括了用于检测dmd 40个外显子的40对探针和8个内参基因的8对探针。每对探针与样本dna杂交后,探针对中的两条探针首尾相连,在连接酶的作用下,可以连接成一条完整的dna模板。p034的49对探针及p035的48对探针在完成连接后,使用通用引物进行pcr扩增,每个探针对连接产物扩增产生的pcr片段大小各不相同(每对探针中的两条探针5’端或3’端带有通用引物序列。使用填充序列使得pcr产物大小不一,产物大小为预先设定),然后使用毛细管电泳进行片段筛选区分各个大小不同的pcr产物,根据pcr产物的长度(bp数),判断扩增产物片段所代表的dmd外显子编号,根据dmd外显子pcr产物与内参基因pcr产物的丰度比率,判断dmd基因各外显子是否发生缺失或重复。
[0012]
dmd基因的mlpa检测技术具有良好的准确性,但是,mlpa检测技术试剂成本较高,片段筛选使用的毛细管电泳设备,如abi 3130或3500等,价格昂贵。另外,mlpa检测技术流程中环节较多,主要包括杂交过夜、探针连接、pcr扩增、片段筛选四个主要步骤,较多的环节对操作人员的实验技能及熟练程度提出了较高的要求,也增加了rq值出现较大波动、样本编号出错的可能性。此外,dmd基因的拷贝数检测最有价值的应用是女性携带者筛查,这样,就需要进行大样本量检测,mlpa检测技术由于其技术环节较多,在应对大样本量的检测时具有一定的实际操作困难性。
[0013]
鉴于dmd基因的mlpa检测技术的上述问题,本发明使用多重荧光定量pcr技术,对dmd基因的外显子缺失或重复进行定量检测。荧光定量pcr技术使用实时扩增中的
△△
ct法进行拷贝数定量,较mlpa技术的片段扩增丰度相对比率定量具有更好的准确性;另外,所需主要设备仅为荧光实时pcr仪,设备价格远低于mlpa技术所使用的片段筛选设备如abi3130或3500等,便于检验机构或医院配置使用;此外,荧光定量pcr检测技术操作非常简单,实验者仅需在96孔板中加入样本dna和反应混合液,即可上机运行并完成检测,因此,对实验者操作技能要求不高;易于获得稳定的检测结果;易于实现大样本筛选操作;且试剂成本低廉。
[0014]
尽管多重荧光定量pcr技术具有上述优势,但是,dmd基因的427m转录本具有79个外显子,如果对79个外显子都进行荧光定量检测,则将无法操作,上述所有的优势也将荡然
无存。dmd基因虽然具有79个外显子,但是,外显子的缺失或重复变异并不是随机分布的,而是存在突变热点。具体为:外显子的缺失具有两个热点,分别为近端热点(位于exon 3-20)和远端热点(位于exon 44-53),而外显子的重复最常发生的区域为exon3-11和exon21-31。为了尽可能覆盖dmd片段缺失类型,我们分析了umd数据库中收录的1441例dmd基因拷贝数发生变异的患者的外显子缺失或重复区域,经过频率统计,发现如果只检测外显子4;8;17;45;47;48;50;51;52这9个外显子,可以覆盖总数1441例中的1306例,拷贝数变异的检测覆盖度可以达到86%左右。对于杜氏/贝氏肌营养不良症这种罕见病来说,1441例的统计结果,应该已经具有相当的代表性,能达到86%的变异检测覆盖度,也已经具有相当的应用价值。而9个外显子的荧光定量pcr检测,也具有方便的可操作性。这样,本发明在提高操作便利性的同时也可达到理想的拷贝数变异检测覆盖度,特别适合于片段缺失男性患者的辅助诊断。
技术实现要素:
[0015]
针对相关技术中的上述技术问题,本发明提出一种多重实时荧光pcr法检测人dmd基因拷贝数的相对定量方法及试剂盒,能够克服现有技术的上述不足。
[0016]
为实现上述技术目的,本发明的技术方案是这样实现的:
[0017]
一种多重实时荧光pcr法检测人dmd基因拷贝数的试剂盒,包括外显子反应液一、外显子反应液二、外显子反应液三、主反应混合液、阳性对照品、阴性对照品二和空白对照品;
[0018]
所述外显子反应液一为含有针对dmd基因第4、17、45外显子的特异性引物及探针和针对cftr1基因的特异性引物及探针的溶液;
[0019]
所述外显子反应液二为含有针对dmd基因第8、50、52外显子的特异性引物及探针和针对cftr2基因的特异性引物及探针的溶液;
[0020]
所述外显子反应液三为含有针对dmd基因第47、48、51外显子的特异性引物及探针和针对cftr1基因的特异性引物及探针的溶液;
[0021]
所述主反应混合液包含pcr反应缓冲液、dntps、mg
2+
、热启动taq酶、ung酶、rox荧光参比染料;
[0022]
所述阳性对照品为含cftr基因序列的质粒dna溶液;
[0023]
所述阴性对照品为含cftr基因序列及dmd基因序列的质粒dna溶液;
[0024]
所述空白对照品为经过除菌处理的去离子水。
[0025]
进一步地,所述外显子反应液一、外显子反应液二、外显子反应液三的装量均为500μl,所述主反应混合液的装量为1ml,所述阳性对照品的装量为15μl,所述阴性对照品的装量为30μl,所述空白对照品的装量为1ml。
[0026]
进一步地,所述外显子反应液一中dmd基因第4、17、45外显子的特异性引物及探针序列为:
[0027]
第4外显子的上游引物序列:5
’-
aaggcactgcgggttttg-3’,如seq id no.1所示,
[0028]
第4外显子的下游引物序列:5
’-
gtcacagcatccagaccttgtc-3’,如seq id no.2所示,
[0029]
第4外显子的探针序列:
[0030]5’-
fam-agaacaataatgtaagtagtaccc-3
’-
mgb-nfq,如seq id no.3所示,
[0031]
第17外显子的上游引物序列:5
’-
tgacctctgtttcaatacttctcaca-3’,如seq id no.4所示,
[0032]
第17外显子的下游引物序列:5
’-
gtcaccgtagttactgtttccattaca-3’,如seq id no.5所示,
[0033]
第17外显子的探针序列:
[0034]5’-
aby-accaccactcagccatcactaacacagaca-3
’-
qsy,如seq id no.6所示,
[0035]
第45外显子的上游引物序列:5
’-
tcttccccagttgcattcaat-3’,如seq id no.7所示,
[0036]
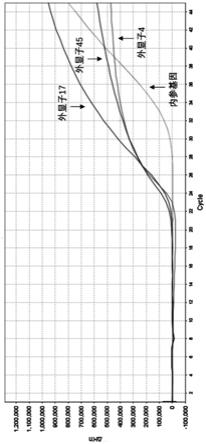
第45外显子的下游引物序列:5
’-
caggaactccaggatggcatt-3’,如seq id no.8所示,
[0037]
第45外显子的探针序列:
[0038]5’-
vic-ttctgacaacagtttgccgctgcc-3
’–
qsy,如seq id no.9所示;
[0039]
所述外显子反应液一中cftr1基因的特异性引物及探针序列为:
[0040]
上游引物序列:5
’-
ttgtgcctgttgcagcttct-3’,如seq id no.10所示,
[0041]
下游引物序列:5
’-
tggagttacagaaaggcctcatg-3’,如seq id no.11所示,
[0042]
探针序列:5
’-
cy5-cgaatggcaccaccttctcggtgt-3
’-
qsy,如seq id no.12所示;
[0043]
所述外显子反应液一中dmd基因第4、17、45外显子特异性上游引物、下游引物浓度均为100~800nmol/l,优选为400nmol/l,第4、17、45外显子特异性探针浓度为50~300nmol/l,优选为200nmol/l;所述外显子反应液一中内参照cftr1基因的上游引物、下游引物浓度均为100~800nmol/l,优选为400nmol/l,内参照cftr1基因的探针浓度为50~300nmol/l,优选为200nmol/l。
[0044]
进一步地,所述外显子反应液二中dmd基因第8、50、52外显子的特异性引物及探针序列为:
[0045]
第8外显子的上游引物序列:
[0046]5’-
tgtacatcacatcactcttccaagttt-3’,如seq id no.13所示,
[0047]
第8外显子的下游引物序列:5
’-
ccttggcaacatttccacttc-3’,如seq id no.14所示,
[0048]
第8外显子的探针序列:
[0049]5’-
fam-ctcaacaagtgagcattgaagccatcca-3
’-
qsy,如seq id no.15所示,
[0050]
第50外显子的上游引物序列:5
’-
gctggctggatcaggaataca-3’,如seq id no.16所示,
[0051]
第50外显子的下游引物序列:5
’-
cgcaggagccctacatctg-3’,如seq id no.17所示,
[0052]
第50外显子的探针序列:
[0053]5’-
aby-aggcccactgcctgcaattcagg-3
’-
qsy,如seq id no.18所示,
[0054]
第52外显子的上游引物序列:5
’-
gcggtaatgagttcttccaactg-3’,如seq id no.19所示,
[0055]
第52外显子的下游引物序列:5
’-
caacgctgaagaaccctgatact-3’,如seq id no.20
所示,
[0056]
第52外显子的探针序列:
[0057]5’-
vic-cgcctctgttccaaatcctgcattg-3
’-
qsy,如seq id no.21所示;
[0058]
所述外显子反应液二中cftr2基因的特异性引物及探针序列为:
[0059]
上游引物序列:5
’-
tgtttgtacagcccagggaaa-3’,如seq id no.22所示,
[0060]
下游引物序列:5
’-
caccatctcattctgcattgttc-3’,如seq id no.23所示,
[0061]
探针序列:5
’-
cy5-ccgagtgaccgccatgcgc-3
’-
qsy,如seq id no.24所示;
[0062]
所述外显子反应液二中dmd基因第8、50、52外显子特异性上游引物、下游引物浓度均为100~800nmol/l,优选为400nmol/l,第8、50、52外显子特异性探针浓度为50~300nmol/l,优选为200nmol/l;所述外显子反应液二中内参照cftr2基因的上游引物、下游引物浓度均为100~800nmol/l,优选为400nmol/l,内参照cftr2基因的探针浓度为50~300nmol/l,优选为200nmol/l。
[0063]
进一步地,所述外显子反应液三中dmd基因第47、48、51外显子的特异性引物及探针序列为:
[0064]
第47外显子的上游引物序列:5
’-
aacgttgttgcatttgtctgtttc-3’,如seq id no.25所示,
[0065]
第47外显子的下游引物序列:5
’-
cgggtcctccagtttcatttaa-3’,如seq id no.26所示,
[0066]
第47外显子的探针序列:
[0067]5’-
fam-cctgcgccagggaattctcaaaca-3
’-
qsy,如seq id no.27所示,
[0068]
第48外显子的上游引物序列:5
’-
ctataaattcctacttccactgtgctgta-3’,如seq id no.28所示,
[0069]
第48外显子的下游引物序列:5
’-
gggaccactgcaatggagtatt-3’,如seq id no.29所示,
[0070]
第48外显子的探针序列:
[0071]5’-
aby-ttgagcccaatctctctctatccaacctcc-3
’-
qsy,如seq id no.30所示,
[0072]
第51外显子的上游引物序列:5
’-
gaaatgccatcttccttgatgtt-3’,如seq id no.31所示,
[0073]
第51外显子的下游引物序列:5
’-
agaaagccagtcggtaagttctgt-3’,如seq id no.32所示,
[0074]
第51外显子的探针序列:
[0075]
t5
’-
vic-acctgctctggcagatttcaaccgg-3
’-
qsy,如seq id no.33所示;
[0076]
所述外显子反应液三中cftr1基因的特异性引物及探针序列为:
[0077]
上游引物序列:5
’-
ttgtgcctgttgcagcttct-3’,如seq id no.10所示,
[0078]
下游引物序列:5
’-
tggagttacagaaaggcctcatg-3’,如seq id no.11所示,
[0079]
探针序列:5
’-
cy5-cgaatggcaccaccttctcggtgt-3
’-
qsy,如seq id no.12所示;
[0080]
所述外显子反应液三中dmd基因第47、48、51外显子特异性上游引物、下游引物浓度均为100~800nmol/l,优选为400nmol/l,第47、48、51外显子特异性探针浓度为50~300nmol/l,优选为200nmol/l;所述外显子反应液三中内参照cftr1基因的上游引物、下游
引物浓度均为100~800nmol/l,内参照cftr1基因的探针浓度为50~300nmol/l,优选为200nmol/l。
[0081]
进一步地,所述对阴性照品中的质粒序列如seq id no.34所示,所述阳性对照品中的质粒序列如seq id no.35所示。
[0082]
根据本发明的另一方面,提供了采用上述试剂盒检测人dmd基因拷贝数的方法,该方法包括以下步骤:
[0083]
(1)提取人细胞基因组dna,用微量紫外分光亮度计测定核酸浓度并调整至20ng/μl;
[0084]
(2)对照品准备:阳性对照品、阴性对照品、空白对照品溶化备用;配制多重pcr反应体系,总反应体积20μl;
[0085]
(3)样本检测:将阳性对照品、阴性对照品、空白对照品及待测gdna样本依序加入反应孔位,加样体积均为5μl;
[0086]
(4)pcr反应程序:50℃2分钟、95℃10分钟;进入以下循环:95℃15秒、60℃1分钟,共40循环,每一循环实时采集fam、vic、aby、cy5荧光信号;其中,fam、vic、aby荧光信号代表的基因靶标为dmd基因各个外显子,cy5荧光信号代表的基因靶标为cftr内参基因;
[0087]
(5)结果分析:采用
△△
ct值法相对定量方式,对dmd基因9个外显子进行拷贝数定量。
[0088]
本发明的有益效果:本发明的多重实时荧光pcr法检测人dmd基因拷贝数的相对定量方法及试剂盒具有以下优点:
[0089]
(1)可为临床筛查提供快速的结果参考,检测结果可实现dmd携带者、dmd患者与正常人的区分;
[0090]
(2)检测结果可靠且重复性好:大样本验证的结果显示,正常女性9个外显子rq值的平均值(av)为0.99-1.03,方差(rq)≤0.05;正常男性9个外显子rq值的平均值(av)为0.47-0.51,方差(rq)≤0.03,男女性rq平均值分别接近0.5和1.0,且波动性小;
[0091]
(3)检测方法对检测设备的要求低,主要设备为abi 7500荧光定量pcr仪,便于检测机构购置使用;
[0092]
(4)检测方法操作简单,仅需加入样本dna、反应液、pcr混合液三种成份,即可上机完成检测,对操作人员技能要求低,且可有效防止样本混淆;
[0093]
(5)可靠性好、操作简单、设备要求低、试剂成本低廉,特别适合多中心、高通量的dmd女性携带者筛查,而女性携带者筛查是dmd基因检测的重中之重;
[0094]
(6)仅检测dmd基因9个外显子,即可达到覆盖86%左右的dmd患者中的拷贝数变异,达到了检测覆盖度和检测外显子数量之间的良好平衡。
附图说明
[0095]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0096]
图1是根据本发明实施例所述的外显子反应液一对阳性对照品的检测结果;
[0097]
图2是根据本发明实施例所述的阴性对照品检测结果;
[0098]
图3是根据本发明实施例所述的空白对照品检测结果。
具体实施方式
[0099]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
[0100]
实施例1
[0101]
本实施例的多重实时荧光pcr法检测人dmd基因拷贝数的试剂盒(100反应/盒)包含组分如表2所示:
[0102]
表2.试剂盒组分
[0103][0104]
外显子反应液一为针对dmd基因的第4、17、45外显子拷贝数的相对定量检测引物探针:
[0105]
d4f:5
’-
aaggcactgcgggttttg-3’,
[0106]
d4r:5
’-
gtcacagcatccagaccttgtc-3’,
[0107]
d4p:5
’-
fam-agaacaataatgtaagtagtaccc-3
’-
mgb-nfq,
[0108]
d17f:5
’-
tgacctctgtttcaatacttctcaca-3’,
[0109]
d17r:5
’-
gtcaccgtagttactgtttccattaca-3’,
[0110]
d17p:5
’-
aby-accaccactcagccatcactaacacagaca-3
’-
qsy,
[0111]
d45 f:5
’-
tcttccccagttgcattcaat-3’,
[0112]
d45 r:5
’-
caggaactccaggatggcatt-3’,
[0113]
d45 p:5
’-
vic-ttctgacaacagtttgccgctgcc-3
’–
qsy,
[0114]
cftr1 f:5
’-
ttgtgcctgttgcagcttct-3’,
[0115]
cftr1 r:5
’-
tggagttacagaaaggcctcatg-3’,
[0116]
cftr1 p:5
’-
cy5-cgaatggcaccaccttctcggtgt-3
’-
qsy,
[0117]
其中,以cftr作为内参照基因。4号外显子检测探针采用taqman mgb-nfq探针,其余探针采用taqman qsy探针。
[0118]
外显子反应液二为针对dmd基因的第8、50、52外显子拷贝数的相对定量检测的引
物探针:
[0119]
d8 f:5
’-
tgtacatcacatcactcttccaagttt-3’,
[0120]
d8 r:5
’-
ccttggcaacatttccacttc-3’,
[0121]
d8 p:5
’-
fam-ctcaacaagtgagcattgaagccatcca-3
’-
qsy,
[0122]
d50 f:5
’-
gctggctggatcaggaataca-3’,
[0123]
d50 r:5
’-
cgcaggagccctacatctg-3’,
[0124]
d50 p:5
’-
aby-aggcccactgcctgcaattcagg-3
’-
qsy,
[0125]
d52 f:5
’-
gcggtaatgagttcttccaactg-3’,
[0126]
d52 r:5
’-
caacgctgaagaaccctgatact-3’,
[0127]
d52 p:5
’-
vic-cgcctctgttccaaatcctgcattg-3
’-
qsy,
[0128]
cftr2 f:5
’-
tgtttgtacagcccagggaaa-3’,
[0129]
cftr2 r:5
’-
caccatctcattctgcattgttc-3’,
[0130]
cftr2 p:5
’-
cy5-ccgagtgaccgccatgcgc-3
’-
qsy,
[0131]
其中,以cftr作为内参照基因。反应孔所有探针均采用taqman qsy探针。
[0132]
外显子反应液三为针对dmd基因的第47、48、51外显子拷贝数的相对定量检测引物和探针:
[0133]
d47 f:5
’-
aacgttgttgcatttgtctgtttc-3’,
[0134]
d47 r:5
’-
cgggtcctccagtttcatttaa-3’,
[0135]
d47 p:5
’-
fam-cctgcgccagggaattctcaaaca-3
’-
qsy,
[0136]
d48 f:5
’-
ctataaattcctacttccactgtgctgta-3’,
[0137]
d48 r:5
’-
gggaccactgcaatggagtatt-3’,
[0138]
d48 p:5
’-
aby-ttgagcccaatctctctctatccaacctcc-3
’-
qsy,
[0139]
d51 f:5
’-
gaaatgccatcttccttgatgtt-3’,
[0140]
d51 r:5
’-
agaaagccagtcggtaagttctgt-3’,
[0141]
d51 p:t5
’-
vic-acctgctctggcagatttcaaccgg-3
’-
qsy,
[0142]
cftr1 f:5
’-
ttgtgcctgttgcagcttct-3’,
[0143]
cftr1 r:5
’-
tggagttacagaaaggcctcatg-3’,
[0144]
cftr1 p:5
’-
cy5-cgaatggcaccaccttctcggtgt-3
’-
qsy,
[0145]
其中,该反应孔以cftr作为内参照基因。所有探针均采用taqman qsy探针。
[0146]
主反应混合液:购自南京诺唯赞生物科技有限公司,cat no:q113-03。包含热启动taq酶、ung酶、4种dntp、pcr反应缓冲液、rox荧光参比染料。
[0147]
阴性对照品:包含特异性质粒1(为seq id no.34所示核苷酸序列)及水。特异性质粒1为内参照cftr基因的人工合成dna序列,对照溶液中质粒1终浓度为0.04pg/μl。
[0148]
阳性对照品:包含特异性质粒2(为seq id no.35所示核苷酸序列)及水。特异性质粒2为内参照cftr基因的人工合成dna序列、dmd基因4;8;17;45;47;48;50;51;52共9个外显子的人工合成dna序列,对照溶液质粒终浓度为0.06pg/μl。
[0149]
空白对照品为去离子水。
[0150]
各组分配方为:
[0151]
外显子反应液一(第一反应液)配方:dmd基因第4、17、45外显子特异性上游、下游
引物浓度100~800nmol/l,优选为400nmol/l。第4、17、45外显子特异性探针浓度50~300nmol/l,优选为200nmol/l。内参照cftr1上游、下游引物浓度100~800nmol/l,优选为400nmol/l。内参照探针浓度50~300nmol/l,优选为200nmol/l。
[0152]
外显子反应液二(第二反应液)配方:dmd基因第8、50、52外显子特异性上游、下游引物浓度100~800nmol/l,优选为400nmol/l。第8、50、52外显子特异性探针浓度50~300nmol/l,优选为200nmol/l。内参照cftr2上游、下游引物浓度100~800nmol/l,优选为400nmol/l。内参照探针浓度50~300nmol/l,优选为200nmol/l。
[0153]
外显子反应液三(第三反应液)配方:dmd基因第47、48、51外显子特异性上游、下游引物浓度100~800nmol/l,优选为400nmol/l。第47、48、51外显子特异性探针浓度50~300nmol/l,优选为200nmol/l。内参照cftr1上游、下游引物浓度100~800nmol/l,优选为400nmol/l。内参照探针浓度50~300nmol/l,优选为200nmol/l。
[0154]
实施例2
[0155]
采用实施例1所述的试剂盒利用人外周血游离dna或gdna对人类杜氏/贝氏肌营养不良症致病基因dmd拷贝数变异进行定量分子检测:
[0156]
(1)核酸提取:
[0157]
临床诊断为dmd的患儿1例,产下临床诊断为dmd患儿的女性携带者2例,另外包含正常女性3例,正常男性2例的全血样本。使用天隆全自动核酸提取仪(np968-3s)及配套使用的天隆全血基因组dna提取试剂盒,提取edta抗凝管所采集的全血样本,提取后用微量紫外分光亮度计测定核酸纯度及浓度,其od
260/280
在1.6-2.0之间;用灭菌双蒸馏水稀释基因组dna浓度至20ng/μl备用。
[0158]
(2)对照品稀释:
[0159]
将阳性对照品、阴性对照品、空白对照品溶解待用。
[0160]
(3)pcr反应体系配制,总反应体积20μl,如表3所示:
[0161]
表3.pcr反应体系
[0162][0163]
(4)样本检测:
[0164]
将阴性对照品、阳性对照品、空白对照品、待测样本gdna依序加入反应孔位,加样体积均为5μl。
[0165]
(5)pcr反应程序:
[0166]
50℃2分钟、95℃10分钟;进入以下循环:95℃15秒、60℃1分钟(信号采集),共40循环。反应所使用仪器为abi 7500,每一循环实时采集fam、vic、aby、cy5荧光信号,各个反应下,fam、vic、aby荧光信号代表的基因靶标为dmd基因各个外显子,cy5荧光信号代表的基因靶标为cftr内参基因。
[0167]
外显子反应液一对阳性对照品的检测结果如图1所示,阴性对照品检测结果如图2
所示,空白对照品检测结果如图3所示。
[0168]
(6)结果分析:采用
△△
ct值法相对定量方式,对dmd基因9个外显子进行拷贝数定量。
[0169]
以下为拷贝数定量中的4个pcr反应的质量控制要求,前3个质控指标不合格,判断该次实验失败,需重新进行实验,第4个指标不合格,判断该样本实验失败,需重新对该样本进行检测:
[0170]
阳性对照品的fam、vic、aby荧光通道ct值≤33,cy5荧光通道ct值≤31;
[0171]
阴性对照品fam、vic、aby荧光通道应皆无信号,cy5荧光通道ct值≤31;
[0172]
空白对照fam、vic、aby、cy5荧光通道应皆无信号。
[0173]
待检样本cy5荧光通道ct值≦31。
[0174]
以下为相对表达量(rq值)的计算方法:
[0175]
阳性对照品
△
ct的计算:
[0176]
阳性对照品在外显子4;8;17;45;47;48;50;51;52反应中目的基因与内参基因间的
△
ct值,
△
ct=ct
fam/vic/aby
–
ct
cy5
。计算每个反应中正常对照品三个浓度梯度的
△
ct的平均值,记为
△
ct
a
。
[0177]
分别计算待测样本9个目的基因与相应反应孔中内参基因间的
△
ct值,
△
ct=ct
fam/vic/aby
–
ct
cy5
,记为
△
ct
s
。
[0178]
待测样本靶基因
△△
ct=待测样本靶基因
△
ct
s
-△
ct
a
;
[0179]
待测样本相对表达量(rq值)=待测样本目标基因相对拷贝数=2
-△△
ct
;
[0180]
结果判断:以dmd基因各外显子、内参照基因cftr均为2拷贝作为正常对照样本,结果判定于表4。
[0181]
表4.结果判定
[0182][0183]
实验结果满足数据分析的通用要求,如下:
[0184]
阳性对照品fam、vic、aby荧光通道ct值≤33;cy5荧光通道ct值≤31;
[0185]
空白对照品fam、vic、aby、cy5荧光通道无明显扩增信号。
[0186]
1例dmd患儿、2例女性携带者、3例正常女性、2例正常男性dmd基因第4;8;17;45;47;48;50;51;52的rq值、拷贝数见表5。
[0187]
表5. 8例样本检测结果
[0188][0189]
注:fc1:女性携带者1;fc2:女性携带者2;mf1:男性患者1;fn1-3:正常女性1-3;mn1-2:正常男性1-2。表格中数值为rq值/拷贝数。
[0190]
(7)结果分析验证:同时应用荷兰mrc公司的p034和p035 dmd probemix 100rxn检测试剂盒对上述1例男性患儿、2例女性携带者进行平行检测,结果见表6。
[0191]
表6.平行检测结果
[0192][0193]
对于1例男性患儿、2例女性携带者样本,本试剂盒所检测的9个外显子的拷贝数,与mlpa的检测结果符合率100%。
[0194]
实施例3
[0195]
试剂特异性验证:临床常见病原体交叉反应。
[0196]
(1)实验样本
[0197]
采取4份特异性样本对试剂的特异性进行验证,乙型肝炎病毒(107copies/ml)、丙型肝炎病毒(105copies/ml)、人巨细胞病毒(104copies/ml)、肠道病毒71型(104copies/ml)。
[0198]
(2)实验过程
[0199]
用第一反应液至第三反应液分别检测以上4份特异性样本,分析检测结果,验证试剂的特异性。
[0200]
(3)实验结果
[0201]
3种反应液检测4份特异性样本皆为undetermined,表明特异性好,无交叉反应的情况,具体结果见表7。
[0202]
表7. 3种反应液与临床常见病原体交叉反应结果(ud=undetermined)
[0203][0204][0205]
综上所述,借助于本发明的上述技术方案,通过3个独立pcr反应分别对dmd基因第4、17、45外显子(反应液一);8、50、52外显子(反应液二);47、48、51外显子(反应液三)进行扩增。3种反应液均包含4个荧光通道(其中3个荧光通道为靶基因,最后一个荧光通道为内参基因),从而实现对dmd基因的4、8、17、45、47、48、50、51、52外显子拷贝数的定量检测。
[0206]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1