基因OsPIN10b的基因工程应用的制作方法
基因ospin10b的基因工程应用
技术领域
[0001]
本发明涉及植物生长发育分子生物学领域,具体而言,涉及基因ospin10b的基因工程应用。
背景技术:
[0002]
生长素是唯一明确有极性运输性质的植物激素,需要依赖生长素输入载体和输出载体协助方能进出细胞。aux家族蛋白属于输入载体,影响着生长素向胞内的输送,而pin家族蛋白属生长素输出载体,负责将生长素从胞内运输到胞外(rutschow et al.,2014;zhou et al.,2018),它们极性运输所形成的生长素浓度梯度可影响植物的许多生理过程,包括根的生长发育及向性生长(woodward et al.,2005;vanneste et al.,2009)。生长素在植物组织中的极性运输很大程度上归功于高度调控的、极性定位的pin家族蛋白(friml et al.,2002)。在拟南芥中,pin家族基因一共克隆到了8个基因(benkova et al.,2003);水稻中预测到12个pin的同源基因(wang et al.,2009);在玉米中也报道有12个pin同源基因(forestan et al.,2012);在大豆、野樱桃和杨树等植物中也发现了其同源基因(zazimalova et al.,2007)。生长素极性运输转运蛋白pin1参与植物茎端生长素的向基运输及根的向顶运输(blilou et al.,2005),因此,pin1在转录及蛋白水平表达的上调可促进茎端生长素向根尖的转运,这可能是导致根部生长素升高的原因之一。定位于小柱细胞的pin3和pin7具有横向运输生长素以及维持该区域生长素浓度梯度的功能(petr
á
sek et al.,2009;ganguly et al.,2010),而表达于根尖静止中心及下方细胞的pin4具有维持该区域细胞生长素水平及其浓度梯度,参与根尖分生组织发育调控的作用(friml et al.,2002)。因此pin家族基因在水稻生长发育过程中发挥十分重要的调控作用。水稻中pin家族的基因功能有待进一步发现。
技术实现要素:
[0003]
水稻ospin10b同拟南芥中的pin1同源,编码592氨基酸,分子量为62.93124kd。通过克隆到ospin10b基因,连接过表达载体获得转基因株系研究发现,根系发育、叶夹角、叶长、株高发生显著地变化,表现为根系长度增加、侧根数目明显减少、根系角度增加、叶夹角增加、叶长变短、株高降低等性状,说明ospin10b基因在水稻根系、叶夹角以及株高的生长发育过程中发挥重要的调控功能。
[0004]
本发明的第一方面提供了以下技术方案:
[0005]
基因ospin10b的基因工程应用,所述基因ospin10b具有seq id no:1所示的核苷酸序列,所述基因ospin10b在调控植物根系发育、叶片发育、株高中的至少一种性状中的应用。
[0006]
进一步地,所述根系发育包括根系长度、根系角度和侧根数量中的任一种或多种;
[0007]
所述叶片发育包括叶夹角和叶片长度中的任一种或两种。
[0008]
本发明通过克隆基因ospin10b,构建转基因载体,获得过表达和敲除转基因材料,
对转基因材料进行表型性状测量,得到不同材料中根系形态发生显著地变化。与敲除转基因材料和野生水稻材料相比,一方面,过表达材料表现为根系长度和角度增加、侧根数目明显减少等性状,说明ospin10b基因在水稻根系生长发育过程中发挥重要的调控功能;另一方面,过表达材料叶夹角、叶长也出现了明显变化,与敲除转基因材料和野生水稻材料相比,过表达材料表现为叶夹角增大、叶长变短,说明ospin10b基因在水稻叶片生长发育过程中也发挥重要的调控功能;第三方面,株高也出现表型的明显变化,与敲除转基因材料和野生水稻材料相比,过表达材料的株高显著降低,说明ospin10b基因在水稻株高的生长发育过程中起重要作用。
[0009]
此外,利用转基因材料,对ospin10b基因的组织定位进行了检测,发现,ospin10b基因分别在萌发的种子、根的中柱鞘、成熟期侧根、根茎结合处、维管束、叶脉、幼穗、花药以及灌浆期的种子中表达。
[0010]
进一步地,所述基因ospin10b的过表达促进根系伸长、降低侧根数目、增加根系角度、增大叶夹角、叶长变短、降低株高。
[0011]
本发明中涉及的基因ospin10b对植物根系发育具有明显的作用,说明基因ospin10b与植物根系发育密切相关,特别是最长种子根长度和最长种子根角度以及侧根数量。因此,在实际应用中,可以通过过表达基因ospin10b来达到改变植物根系长度和角度以及侧根数量的目的。
[0012]
本发明中涉及的基因ospin10b对植物叶夹角、叶长发育具有明显的作用,说明基因ospin10b与植物叶夹角、叶长发育密切相关。因此,在实际应用中,可以通过过表达基因ospin10b来达到改变植物叶夹角、叶长的目的。
[0013]
本发明中涉及的基因ospin10b对植物株高发育具有明显的作用,也就是说,基因ospin10b与植物株高发育密切相关。因此,在实际应用中,可以通过过表达基因ospin10b来达到改变植物株高的目的。
[0014]
本发明中,基因ospin10b的基因工程应用可以是基因ospin10b作为植物根系发育、叶夹角、叶长、株高发育的分子标记,即通过检测植物是否具有基因ospin10b的表达来相对的说明植物的根系发育、叶夹角、叶长、株高方面的情况,进而为植物育种提供良好的技术支撑。
[0015]
本发明中,所述植物包括单子叶植物和双子叶植物;
[0016]
所述单子叶植物包括水稻、玉米、小麦;
[0017]
所述双子叶植物包括大豆、棉花、烟草。
[0018]
本发明的第二方面提供了一种植物根系发育、叶夹角、叶长、株高性能的检测方法,检测待检测样品的基因ospin10b表达情况,来则判断其根系发育、叶夹角、叶长、株高性能;
[0019]
所述根系发育包括根系长度和角度以及侧根数量。
[0020]
即通过待测样品的基因ospin10b表达情况,来判断目标植物的根系长度和角度、侧根数量、叶夹角、叶长和株高的情况。
[0021]
其中,本发明检测待检测样品是否含有基因ospin10b可以通过多种方式进行,如可以直接检测是否含有基因ospin10b本身,也可以检测由基因ospin10b产生的产物,产物包括直接产物或间接产物或次生产物等,产物可以是基因,也可以是蛋白,也可以是某种化
合物等。
[0022]
直接检测基因ospin10b,可以用基因ospin10b的特异性引物对检测,也可以用针对基因ospin10b设计的探针或芯片进行检测。进一步地,通过基因ospin10b的引物对或探针或芯片对待检测样品进行检测。
[0023]
本发明中涉及的针对基因ospin10b的引物对或探针或芯片,按常规方法设计即可。
[0024]
进一步地,所述引物对的核酸序列如seq id no.2和seq id no.3所示。
[0025]
但检测基因ospin10b本身的方式并不限于此,任何在分子生物学上可实现的方式均在本发明的保护范围内。
[0026]
同样地,检测由基因ospin10b产生的产物也可以通过多种手段进行,如多种的elisa检测试剂盒等。
[0027]
进一步地,所述待检测样品包括适宜于有性繁殖、无性繁殖或可再生的细胞的组织培养的材料。
[0028]
这些待检测样品可以是适宜于有性繁殖的材料,如选自花粉、子房、胚珠、胚囊等;
[0029]
适宜于无性繁殖的材料如可以选自根、茎、插枝、原生质体等;
[0030]
适宜于可再生的细胞的组织培养的材料如可以选自叶、花粉、分生组织细胞、根、根端、种子、胚、子叶、下胚轴和茎等。
[0031]
具体地,所述待检测样本包括以下材料中的任一种:叶、根、茎、胚根、胚芽、种子。
[0032]
其中,植物包括单子叶植物和双子叶植物;如单子叶植物包括水稻、玉米、小麦;双子叶植物包括大豆、棉花、烟草。
[0033]
本发明的第三方面还提供了基因ospin10b在植物种群遗传多样性研究中的应用。
[0034]
其中,植物包括单子叶植物和双子叶植物;如单子叶植物包括水稻、玉米、小麦;双子叶植物包括大豆、棉花、烟草。
[0035]
与现有技术相比,本发明的有益效果至少包括如下方面:
[0036]
(1)本发明通过系统研究,首次提供了基因ospin10b的生物学功能。
[0037]
(2)本发明通过构建ospin10b基因的过表达材料和敲除材料,研究发现,过表达ospin10b基因对根系长度和角度以及侧根数目、叶夹角、叶长以及株高有明显影响。
[0038]
(3)本发明提供的ospin10b基因可应用于植物根系发育、叶夹角、叶长和株高性能方面,涉及的植物包括水稻、玉米、小麦、大豆、棉花、烟草等。
附图说明
[0039]
为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0040]
图1为本发明实施例1中ospin10b基因过表达材料分子检测结果图;
[0041]
图2为本发明实施例2中ospin10b基因敲除材料分子检测示意图;
[0042]
图3为本发明实施例中转基因材料以及野生型材料的根系表型图;
[0043]
图4为本发明实施例中转基因材料以及野生型材料的根系长度统计柱形图;
[0044]
图5为本发明实施例中转基因材料以及野生型材料的不定根数目统计柱形图;
[0045]
图6为本发明实施例中转基因材料以及野生型材料的株高统计柱形图;
[0046]
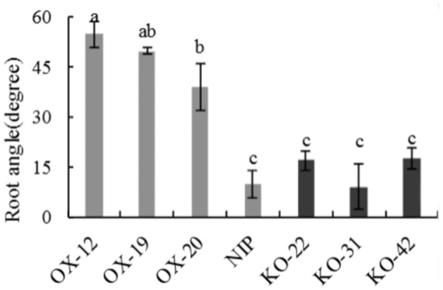
图7为本发明实施例中转基因材料以及野生型材料的根系角度测量结果柱形图;
[0047]
图8为本发明实施例中转基因材料以及野生型材料的根系表型图;
[0048]
图9为本发明实施例中转基因材料以及野生型材料的侧根数目统计柱形图;
[0049]
图10为本发明实施例中转基因材料以及野生型材料的单位长度侧根数目统计柱形图;
[0050]
图11为本发明实施例中转基因材料以及野生型材料的成熟期表型图;
[0051]
图12为本发明实施例中转基因材料以及野生型材料的成熟期株高柱形图;
[0052]
图13为本发明实施例中转基因材料以及野生型材料的四周大苗期叶夹角表型图;
[0053]
图14为本发明实施例中转基因材料以及野生型材料的四周大苗期叶夹角柱形图;
[0054]
图15为本发明实施例中转基因材料以及野生型材料的四周大苗期叶长表型图;
[0055]
图16为本发明实施例中转基因材料以及野生型材料的四周大苗期叶长柱形图。
具体实施方式
[0056]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0057]
实施例1
[0058]
转基因植物的获得,包括以下步骤:
[0059]
1)总rna的提取
[0060]
水稻日本晴种子经质量浓度30%naclo消毒,催芽,培养到二叶一心时,挑选出大小一致的水稻植株,去掉胚乳后移栽至ph5.5的1/2国际水稻所irri营养液中,四叶一心时换为国际水稻所irri全营养液(mao d r.the methods of plant nutrition research.beijing:beijing agricultural university press,1994),培养一周后,取根及叶片迅速置于液氮中冷冻保存,称取0.1g左右样品,用液氮研碎,研磨充分加入1.5ml离心管,迅速加入1ml trizol试剂,加入0.2ml氯仿,离心后吸取上清,加入0.5ml异丙醇,离心后弃上清,加入70%乙醇洗涤沉淀,rna溶于depc水中(体积比为1
‰
),用质量比为1.0%的琼脂糖凝胶电泳检测rna质量,并用分光光度计检测总rna的浓度和纯度。合格后进入下一步骤。
[0061]
2)总cdna合成
[0062]
每个rna样品2μg,加入50μmol
·
l-1
oligo dt18,加1
‰
depc水补足10μl,70℃下水浴5min,冰上放置5min后,依次加入rnase inhibitor 0.5μl和5xrt buffer5μl,10mm dntps 2.5μl,m-mlv反转录酶1μl,1
‰
depc水补足25μl,42℃水浴60min后,70℃水浴10min终止反应(oligo dt18由南京金斯瑞公司合成;反转录试剂盒购自fermentas公司,canada)。
[0063]
3)ospin10b基因的cdna全长的获得
[0064]
用以上获得的水稻日本晴总cdna为模板,设计pcr引物,其pcr产物包含完整的ospin10b阅读框(从起始密码子atg至tag),引物序列为:
[0065]
ospin10b-f:5
’-
atgatatcgtggcacgagc-3’;
[0066]
ospin10b-r:5
’-
tcatagtagcccaagaataat-3’[0067]
pcr程序如下:95℃预变性3min,95℃变性30s,56℃退火45s 72℃复性延伸2min,35个循环后,72℃7min,扩增的pcr产物通过1%琼脂糖凝胶电泳检测,其大小为1776bp片段。将目的pcr产物经琼脂糖电泳分离后切胶回收,将回收的片段与p-easy blunt载体连接,酶连体系总体积5μl(包含1μl载体,4μl的pcr纯化产物),加完样后混合均匀,离心甩至管底,28℃放置15min;
[0068]
将酶连体系42℃热击转入大肠杆菌dh5α感受态细胞中,加500-700μl不含抗生素的lb液体培养基摇菌1h,然后低速离心,富集菌体,将其涂在含有卡那100μg
·
ml-1
的lb固体培养基上生长12h-14h后,挑取阳性菌落进行dna测序,ospin10b基因登录号为ak240660,ospin10b的开放阅读框(orf)全长1776bp;将测序正确的菌液加入等体积50%甘油于-70℃保存备用,将含有ospin10b的开放阅读框的p载体命名为pospin10binp。
[0069]
4)超量表达载体pubi-ospin10b的构建
[0070]
根据水稻生长素运输蛋白基因ospin10b的cdna序列,设计pcr引物,其pcr产物包含完整的ospin10b基因阅读框(从起始密码子atg至终止密码tag),并在上游和下游引物上分别引入限制性内切酶位点kpni和spei,引物序列为:
[0071]
overospin10b-f:5
’-
gaggtacc atgatatcgtggcacgagc-3’kpni
[0072]
overospin10b-r:5
’-
atactagt tcatagtagcccaagaataat-3’spei
[0073]
用以上获得的pospin10binp质粒为模板,pcr程序如下:95℃预变性1min,95℃变性30s,56℃退火,72℃复性延伸1min20s,30个循环后,72℃7min,扩增的pcr产物通过1%琼脂糖凝胶电泳检测,pcr产物大小约为1800bp。将目的pcr产物经琼脂糖电泳分离后切胶回收,回收产物用限制性内切酶kpni和spei进行酶切回收,同时用kpni和spei双酶切植物过量表达载体ptck303质粒,然后分别回收酶切过的pcr片段和载体,将载体进行去磷酸化后再次回收;回收后通过t4连接酶将线性化的载体与酶切过的pcr片段在16℃下连接过夜,转化到大肠杆菌dh5a感受态细胞中,涂在含有卡那霉素50μg
·
ml-1
的lb固体培养基上生长12h后,挑取阳性菌落,提取质粒经kpni和spei酶切验证片段大小无误后,将该菌液进行dna测序,将含有测序正确克隆的菌液加入等体积50%甘油于-70℃保存,提取阳性克隆质粒命名为pubi-ospin10b;
[0074]
最后通过电击法将pubi-ospin10b质粒转化至根癌农杆菌eha105的感受态细胞中,涂在含有卡那霉素和链霉素均为50μg
·
ml-1
的yep固体培养基上生长48h后,挑取阳性菌落,提取质粒,经kpni和spei双酶切验证无误后,菌液加入等体积50%甘油于-70℃保存,转基因备用;
[0075]
5)转基因植株的获得
[0076]
为了避免转基因过程产生的植物细胞质基因突变,我们进行了不同批次的转基因实验。分别于2018年7月-2018年10月和2018年12月-2019年2月将以上获得的转有pubi-ospin10b质粒的农杆菌,侵染水稻愈伤组织,共培养3天,经过抗性愈伤组织的选择培养、分化、生根、炼苗得到不同年份不同批次的t0代转基因植株。为了避免植株性状的改变是由于非基因组插入导致的细胞质嵌合体造成的,我们在对所有转基因材料都进行了两次扩繁,得到了稳定遗传的t2代并对稳定遗传的t2代材料进行的生理测定。
[0077]
转基因植株的具体制备如下:
[0078]
5.1)农杆菌介导的水稻转化
[0079]
诱导愈伤组织:去皮的水稻种子(一盘14粒)入三角瓶,用70%乙醇浸泡1min(淹没种子),倒掉70%乙醇,灭菌水清洗5-6次,用30%次氯酸钠浸泡30min,然后用灭菌水清洗5-6次直至清亮。用镊子把种子拨到灭菌的滤纸上,吸干水分,最后把种子置于诱导培养基上,在32℃光照培养箱培养5d。
[0080]
农杆菌的准备:带相应载体的农杆菌eha105菌株,划线于ab培养基(50mg/l kan),28℃暗培养3天。用灭菌勺子刮掉农杆菌菌落悬浮于aam培养液(含as),od600约为0.1。
[0081]
侵染愈伤组织和共培养:将水稻愈伤组织从继代培养基中挑出放入离心管中,愈伤组织的数量没过50ml离心管锥形部位即可(选择淡黄圆润有韧性的愈伤组织)。取培养好的菌液1ml于1.5ml离心管中,4℃,5000rpm,离心l min,去上清。用含200μmo1
·
l-1
乙酰丁香酮(as)的30ml感菌液将收集的菌体制成悬浮液,此悬浮液倒入挑好的愈伤组织中,侵染5min。倒掉液体,将愈伤组织取出,置于无菌的含吸水纸的培养皿上沥干30-40min。将愈伤组织置于共培养培养基上(上面垫上一层9cm无菌滤纸),25℃暗培养3天。
[0082]
洗菌和抗生素筛选培养:将愈伤组织从共培养培养基中取出,用无菌水清5次,每次不停的振荡5min。再用含500mg
·
l-1
羧苄青霉素(car)的无菌水浸泡40-60min。最后置于无菌滤纸上沥干2h。第一轮筛选:将晾干的愈伤组织转入含400mg
·
l-1
羧苄青霉素(car)和50mg
·
l-1
潮霉素(hyg)的选择培养基上进行第一次选择,32℃,光照培养两周;
[0083]
第二轮筛选:将生长旺盛的愈伤转移到含50mg/l潮霉素b和250mg/l羧苄的分化培养基上诱导分化,28℃持续光照两周左右。
[0084]
抗性愈伤组织的诱导分化和生根:挑取颜色鲜黄的抗性愈伤组织移入装有分化培养基的分化灌中,放入恒温培养室中,等待分化成苗(30d左右,组培室培养条件为24-30℃,14h光/8h暗),待苗长至5cm左右,放入生根培养基中壮苗。
[0085]
转基因苗的锻炼和移栽:将苗根部和茎叶分化得较完好的试管挑出(苗长至试管顶部,就要及时开盖),打开封口膜,加入适量无菌水(防止培养基长菌),炼苗3d至7d左右,然后洗去琼脂,移栽到温室进行水培或土培生长、检测。
[0086]
5.2)潮霉素快速检测转基因幼苗得到t0代植株
[0087]
剪取并收集待检测苗1cm左右长的新鲜绿色叶片(两端均留有切口),平放于含潮霉素(80mg
·
l-1
)培养基上,30℃,16h/8h(光/暗)培养48h叶片依旧保持鲜绿的即为阳性植株,而阴性幼苗的叶片出现块状坏死(郑晔.水稻高效转基因体系的建立及其应用.2008)。通过潮霉素筛选得到阳性t0植株60个株系。2019年4月到11月在河南农业大学温室进行对过表达材料的种植得到t0代种子。
[0088]
5.3)ospin10b过表达株系的分子鉴定
[0089]
t0代种子发芽后得到t1代转基因苗,分别在转基因材料ox-ospin0b以及野生型材料日本晴的分蘖始期,取剑叶抽取rna,反转录之后做qrt-pcr,进行定量pcr鉴定,结果如图1所示,得到稳定遗传的ox-12、ox-19、ox-20转基因株系。
[0090]
实施例2
[0091]
基因ospin10b敲除植株的获得:
[0092]
1)选定靶标:
[0093]
根据ncbi ospin10b基因序列,在基因的第一个外显子处设计两个靶位点
[0094]
靶标1:gaggacgccccaccaccgcacgg
[0095]
靶标2:gccggagtaagggccgtacatgg
[0096]
2)构建中间载体
[0097]
2.1中间载体引物合成
[0098]
koospin10b-y1引物:
[0099]
koospin10b
--
y1+:cagtggtctcatgcagaggacgccccaccaccgca
[0100]
koospin10b
--
y1-:cagtggtctcaaaactgcggtggtggggcgtcctc
[0101]
koospin10b
--
b1引物:
[0102]
koospin10b
--
b1+:cagtggtctcatgcagccggagtaagggccgtaca
[0103]
koospin10b
--
:cagtggtctcaaaactgtacggcccttactccggc
[0104]
引物变性、退火,得到grna片段,pcr反应体系如下:正反引物分别5μl,加入40μl的水补齐到40μl。pcr反应程序如下:变性95℃10min,退火55℃10min,14℃降温5min。
[0105]
2.2酶切连接构建中间载体
[0106]
koospin10b-y1酶切连接体系如下:grna片段:2μl;空载1(pbwa(v)hu-cas9yl):1.5μl;eco31i:0.5μl;t4-ligase:0.5μl;t4-buffer:1μl;h2o:4.5μl。
[0107]
koospin10b
--
b1酶切连接体系如下:grna片段:2μl;空载2(pbwd(lb)dnai):1.5μl;eco31i:0.5μl;t4-ligase:0.5μl;t4-buffer:1μl;h2o:4.5μl。
[0108]
把配置好的体系置于37℃培养箱反应2h。
[0109]
将连接体系转化到大肠杆菌dh5α感受态细胞中转化,挑取阳性菌落,提取质粒进行dna测序。测序正确的质粒分别命名为koospin10by1-1、koospin10bb1-1。
[0110]
3)构建双靶标酶切连接
[0111]
将测序正确的质粒用于双靶标酶切连接,酶切连接体系如下:koospin10b y1-1(质粒):1μl;koospin10bb1-1(质粒):1.5μl;lgui:0.5μl;t4-ligase:0.5μl;t4-buffer:1μl;h2o:5.5μl。把配置好的体系置于37℃培养箱2h,转化之后菌检。菌检体系如下:2*mix:10μl;pyl-r(正向检测引物):1μl;pbw2-(反向检测引物):1μl;h20:8μl;菌检引物序列如下pyl-r:accggtaaggcgcgccgtagt pbw2-:gcgattaagttgggtaacgccaggg。挑取菌检大小在1000bp左右的条带摇菌,提取质粒,酶切验证之后测序。正确质粒命名为pyl-hu-ospin10b,转化农杆菌,将阳性的农杆菌侵染水稻愈伤获得ospin10b的基因敲除材料。转化步骤同实例一。
[0112]
4)基因敲除材料鉴定
[0113]
取转基因材料以及野生型材料日本晴苗期叶片,抽取dna之后,根据靶位点(靶标1gaggacgccccaccaccgcacgg;靶标2gccggagtaagggccgtacatgg)两端设计正反引物,ko-ospin10b-f:caacacactaatcgcacgct
[0114]
ko-ospin10b-r:acgagctgatcgagtagatctc
[0115]
pcr扩增产物进行sanger一代测序,测序结果与日本晴扩增产物测序结果比对,确定基因敲除是否成功。
[0116]
检测结果如图2所示。
[0117]
为了避免植株性状的改变是由于非基因组插入导致的细胞质嵌合体造成的,对获得的所有t0代转基因敲除植株都进行了两次扩繁,得到了稳定遗传的t2代,并对稳定遗传
的t2代材料进行的生理测定。
[0118]
试验例
[0119]
1、t2代转基因材料以及野生型材料日本晴消毒之后28℃催芽1天,之后16h光照、8h黑暗,28℃培养五天,之后利用根系扫描仪统计苗期的根系表型。每个株系八个重复。结果如图3-6所示。
[0120]
从图3-5可以看出,t2代ospin10b基因过表达材料(ox-12、ox-19、ox-20)与野生型(日本晴)相比不定根数目变化不明显,最长种子根长度有明显增加。从图3和图6可以看出,短期培养的t2代ospin10b基因过表达材料(ox-12、ox-19、ox-20)与野生型(日本晴)相比株高变化不明显。
[0121]
对图3中的最长种子根采用量角器测量最长种子根偏离竖直方向的角度,结果如图7所示。从图7可以看出,过表达材料(ox-12、ox-19、ox-20)的根角度显著大于野生型(日本晴)和敲除材料(ko-42、ko-31、ko-42)。说明ospin10b基因对种子根的角度有明显影响。
[0122]
2、对上述材料中的最长种子根剥离,进行进一步检测。
[0123]
结果如图8-10所示。
[0124]
图9中示出了每个样本最长种子根中侧根的数目。从图8和图9可以看出,ospin10b过表达材料(ox-12、ox-19、ox-20)相比于野生型(日本晴)和敲除材料(ko-42、ko-31、ko-42),侧根数目明显减少。
[0125]
对单位长度的侧根数目进行计算,得到的结果如图10所示。单位长度最长种子根长度上,ospin10b过表达材料(ox-12、ox-19、ox-20)的侧根数目显著小于野生型(日本晴)和敲除材料(ko-42、ko-31、ko-42),其中,敲除材料(ko-42、ko-31、ko-42)比野生型有所增加。
[0126]
上述内容说明ospin10b基因对侧根的数目有明显影响。
[0127]
本发明中,种子根由胚根发育而来,不定根出自根茎结合处(茎基),侧根起始于特定的中柱鞘细胞。
[0128]
3、对水稻成熟期农艺学性状统计分析
[0129]
花后35天,对大田种植的t2代ospin10b转基因以及过表达材料株高进行统计分析,利用米尺测量地上部分的株高,每个株系八个重复。
[0130]
结果如图11-12所示。
[0131]
图12中表示ospin10b过表达材料(ox-12、ox-19、ox-20)相比于野生型(日本晴)和敲除材料(ko-22、ko-31、ko-42)株高显著降低。
[0132]
4、对过表达以及敲除材料叶夹角进行分析
[0133]
t2代转基因材料以及野生型材料日本晴消毒之后28℃催芽1天,之后16h光照、8h黑暗,28℃培养四周,采用量角器测量从上面数第二片完全展开叶片偏离竖直方向的角度,每个株系八个重复。结果如图13和图14显示,ospin10b过表达材料(ox-12、ox-19、ox-20)相比于野生型(日本晴)和敲除材料(ko-22、ko-31、ko-42)叶夹角显著增加。
[0134]
5、对过表达以及敲除材料剑叶叶长进行分析
[0135]
t2代转基因材料以及野生型材料日本晴消毒之后28℃催芽1天,之后16h光照、8h黑暗,28℃培养四周,采用直尺测量从上面数第一片完全展开叶长,每个株系八个重复。结果如图15-16显示,ospin10b过表达材料(ox-12、ox-19、ox-20)相比于野生型(日本晴)和敲
除材料(ko-22、ko-31、ko-42)叶长明显变短。
[0136]
综上可知,ospin10b基因对根系发育、株高、叶夹角、叶长和叶长有明显影响。
[0137]
本发明中,nip为野生型(日本晴)。
[0138]
本发明中,涉及的试剂和溶液如下:
[0139]
1、诱导培养基
[0140][0141]
ph5.8,115℃高压灭菌20min。
[0142]
2、共培养培养基
[0143][0144]
ph5.2,115℃高压灭菌20min。
[0145]
3、选择培养基
[0146][0147]
ph5.8,115℃高压灭菌20min。
[0148]
4、分化培养基
[0149][0150][0151]
ph5.8,115℃高压灭菌20min。
[0152]
5、生根培养基
[0153][0154]
ph5.8,115℃高压灭菌20min。
[0155]
6、aam培养液
[0156][0157][0158]
ph5.2,115℃高压灭菌20min。
[0159]
7、ab培养基
[0160][0161]
ph7.2,115℃高压灭菌20min。
[0162]
8、培养基母液配方:
[0163]
n6大量元素(20x)
[0164][0165]
将上述试剂逐一溶解,然后室温下用蒸馏水定容,标好配制人和配制日期,4℃保存。
[0166]
n6微量元素(1000x)
[0167][0168]
将上述试剂在室温下溶解并用蒸馏水定容,标好配制人和配制日期,4℃保存。
[0169]
n6有机物(100x)
[0170][0171]
加蒸馏水定容,标好配制人和配制日期,4℃保存不超过1个月。
[0172]
ms大量元素(20x)
[0173][0174]
将上述试剂逐一溶解,然后室温下用蒸馏水定容,标好配制人和配制日期,4℃保存。
[0175]
ms微量元素(1000x)
[0176][0177][0178]
将上述试剂在室温下溶解并用蒸馏水定容,标好配制人和配制日期,4℃保存。
[0179]
ms有机物(100x)
[0180][0181]
加蒸馏水定容,标好配制人和配制日期,4℃保存不超过1个月。
[0182][0183][0184][0185][0186][0187]
其中,铁盐(100x):将3.73g乙二铵四乙酸二钠(na2edta
·
2h2o)和2.78g feso4·
7h2o分别溶解,混合并用。蒸馏水定容至1000ml,70℃温浴2小时,冷却后标好配制人和配制日期,4℃保存。
[0188]
50mg/ml肌醇(myo-inositol):5g肌醇定容至100ml蒸馏水中,标好浓度、配制人和配制日期,4℃保存。
[0189]
5mg/ml硫酸铜(cuso4·
5h2o):0.5g cuso4·
5h2o定容至100ml,标好浓度、配制人
和配制日期,4℃保存。
[0190]
5mg/ml氯化钴(cocl2·
6h2o):0.5g cocl2·
6h2o定容至100ml,标好浓度、配制人和配制日期,4℃保存。
[0191]
2,4-d(1mg/ml):100mg 2,4-d置于100ml烧杯中,先加20ml水,然后加入3ml 1n koh,完全溶解后加水定容至100ml,标好浓度、配制人和配制日期,4℃保存。
[0192]
kt(1mg/ml):100mg kinetin(简称kt)置于100ml烧杯中,先加20ml水,然后加入5ml 1n hcl,完全溶解后加水定容至100ml,标好浓度、配制人和配制日期,分装-20℃保存。
[0193]
naa(1mg/ml):100mg naa置于100ml烧杯中,先加20ml水,然后加入3ml 1n koh,完全溶解后加水定容至100ml,标好浓度、配制人和配制日期,4℃保存。
[0194]
1n koh:5.6g koh溶于100ml水,标好浓度、配制人和配制日期,室温保存。
[0195]
1n naoh:4g naoh溶于100ml水,标好浓度、配制人和配制日期,室温保存。
[0196]
1n hcl:12.5ml浓盐酸加水定容至100ml,标好浓度、配制人和配制日期,室温保存。
[0197]
kan(50mg/ml):无菌水溶解kanamycin(简称kan),50mg/ml,过滤除菌,标好浓度、配制人和配制日期,-20℃保存。
[0198]
rif(50mg/ml):利福平(rif)用dmso配成50mg/ml的母液,标好浓度、配制人和配制日期,-20℃保存。
[0199]
cb(500mg/ml):超净台内1g羧苄青霉素(carbenicillin)溶于2ml无菌水中,过滤除菌,标好浓度、配制人和配制日期,-20℃保存。
[0200]
as(100mm):0.196g as溶于10ml dmso中,分成1ml小管,标好浓度、配制人和配制日期,-20℃保存。
[0201]
本发明中培养基所用到的英文所写缩写表示如下:cb(carbenicillin,羧苄青霉素);naa(napthalene acetic acid,萘乙酸);2,4-d(2,4-dichlorophenoxyacetic acid,2,4-二氯苯氧乙酸);as(acetosringone,乙酰丁香酮);ch(casein enzymatic hydrolysate,水解酪蛋白);l-pro(l-脯氨酸);l-glu(l-谷氨酰胺);mes(2-(n-morpholino)ethanesulfonic acid);n6(n6大量元素成份溶液);b5(b5微量元素成份溶液)。
[0202]
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1