一种4AA非对映异构体的制备方法与流程
一种4aa非对映异构体的制备方法
技术领域
1.本发明涉及一种4aa非对映异构体的制备方法。
背景技术:
2.4aa化学名为(3r,4r)-4-乙酸基-3-[(r)-(叔丁基二甲基硅)氧基]-2-氮杂环丁酮,是合成青霉烯和碳青霉烯抗生素母环的关键起始原料,主要用于合成各类培南类抗生素,如亚胺培南、比阿培南、美罗培南和法罗培南等,
[0003][0004]
4-aa有三个手性中心和一个β-内酰胺环,合成难度大,其合成过程中会产生多种非对映异构体,为了对4aa制备过程中进行质量控制,需要制备4aa的非对映异构体,并对4aa非对映异构体的制备和分析研究,对提高4aa制备的产率和纯度有着重要的作用,且对合成的4aa产品的品质把控有着至关重要的作用。
技术实现要素:
[0005]
为解决现有技术中4aa非对映异构体制备过程中异构体选择性较差、纯化困难、需要用到剧毒、杂质结构确认较难的问题,本发明提供了一种4aa非对映异构体(即化合物i)的制备方法,其从商业化4aa出发,通过定向合成得到预定的非对映异构体,反应路线短,收率高。
[0006]
本发明通过下述方案解决上述技术问题。
[0007]
本发明提供了一种化合物a5的制备方法,其包括以下步骤:溶剂中,在还原剂和路易斯酸的作用下,化合物a3进行还原反应,得化合物a5;
[0008][0009]
所述还原反应中,所述溶剂可为本领域常规,较佳地,所述溶剂为1,4-二氧六环、四氢呋喃、乙二醇二甲醚、甲基叔丁基醚、乙醚、氯仿和二氯甲烷中的一种或多种;例如四氢呋喃。
[0010]
所述还原反应中,所述溶剂的用量可为本领域常规,较佳地,所述溶剂与所述化合物a3的质量比为(5~20):1;例如10:1。
[0011]
所述还原反应中,所述还原剂可为本领域常规,较佳地,所述还原剂硼氢化钠、四氢铝锂和硼氢化钾中的一种或多种,例如硼氢化钠和/或四氢铝锂;更佳地,所述还原剂为硼氢化钠。
[0012]
所述还原反应中,所述还原剂的用量可为本领域常规,较佳地,所述还原剂与所述化合物a3的质量比为1:(3~4);例如1:3.75。
[0013]
所述还原反应中,较佳地,所述路易斯酸为mgcl2和/或zncl2;更佳地,所述路易斯酸为mgcl2。
[0014]
所述还原反应中,所述路易斯酸的用量可为本领域常规,较佳地,所述路易斯酸与所述化合物a3的质量比为1:(0.01~0.5);例如1:0.05。
[0015]
所述还原反应中,所述还原反应的温度可为本领域常规,较佳地,所述还原反应的温度为-20~40℃;例如0~20℃。
[0016]
所述还原反应中,所述还原反应可采用本领域常规的监测方法,例如hplc或tlc,一般以所述化合物a3消失或不再反应时作为反应终点,停止反应。较佳地,所述还原反应的时间为0.5~7小时;例如1或5小时。
[0017]
在某一个实施方案中,所述还原反应通过以下步骤进行:所述溶剂、所述路易斯酸和所述化合物a3混合后,在-20~10℃(例如-20~0或0~10℃)下加入所述还原剂,在0~20℃反应0.5~7h,得化合物a5。
[0018]
所述还原反应中,较佳地,还包含以下后处理步骤:浓缩,萃取,浓缩。
[0019]
所述化合物a5的制备方法中,还可进一步包含以下步骤:
[0020]
溶剂中,在氧化剂的作用下,化合物a2进行氧化反应,得化合物a3;
[0021][0022]
所述氧化反应中,所述溶剂可为本领域常规,较佳地,所述溶剂为1,4-二氧六环、四氢呋喃、乙二醇二甲醚、甲基叔丁基醚、乙醚、氯仿和二氯甲烷中的一种或多种;例如二氯甲烷和/或四氢呋喃。
[0023]
所述氧化反应中,所述溶剂的用量可为本领域常规,较佳地,所述溶剂与所述化合物a2的质量比为1:(0.01~0.1);例如,1:0.03。
[0024]
所述氧化反应中,所述氧化剂可为本领域常规,较佳地,所述氧化剂为戴斯-马丁试剂、双氧水、次氯酸钠、高锰酸钾和二氧化锰中的一种或多种;例如戴斯-马丁试剂和/或次氯酸钠。
[0025]
所述氧化反应中,较佳地,当所述氧化剂为次氯酸钠时,还进一步添加2,2,6,6-四甲基哌啶氧化物(tempo)和溴化钾;较佳地,2,2,6,6-四甲基哌啶氧化物与所述化合物a2的质量比为1:(20~40);例如1:30;较佳地,溴化钾与所述化合物a2的质量比为1:(0.5~0.8);例如1:0.6。
[0026]
所述氧化反应中,所述氧化剂的用量可为本领域常规,较佳地,所述氧化剂与所述化合物a2的质量比1:(0.1~0.4);例如1:0.12或1:0.25。
[0027]
所述氧化反应中,所述氧化反应的温度可为本领域常规,较佳地,所述氧化反应的
温度为-10~40℃,例如30℃或35℃。
[0028]
所述氧化反应中,所述氧化反应可采用本领域常规的监测方法,例如hplc或tlc,一般以所述化合物a2消失或不再反应时作为反应终点,停止反应。较佳地,所述氧化反应的时间为2~8小时。
[0029]
在某一个实施方案中,所述氧化反应通过以下步骤进行:所述溶剂和所述化合物a2混合后,在0~10℃下加入所述氧化剂,于1~3h内升温至25~35℃并保温0.5~2h,得化合物a3。
[0030]
所述氧化反应中,较佳地,还包含以下后处理步骤:加入冰水,分液,浓缩有机相。
[0031]
所述化合物a5的制备方法中,还可进一步包含以下步骤:溶剂中,在脱保护试剂的作用下,化合物4aa进行脱保护反应,得所述化合物a2;
[0032]
所述脱保护试剂为四丁基氟化铵(tbaf)或盐酸;
[0033][0034]
所述脱保护反应中,所述溶剂可为本领域常规,较佳地,所述溶剂为所述溶剂为甲醇、1,4-二氧六环、四氢呋喃、乙二醇二甲醚、甲基叔丁基醚、乙醚、氯仿和二氯甲烷中的一种或多种;例如四氢呋喃和/或甲醇。
[0035]
所述脱保护反应中,所述溶剂的用量可为本领域常规,较佳地,所述溶剂与所述化合物4aa的质量摩尔比为(1000~3000)g/mol;例如1500g/mol或2000g/mol。
[0036]
所述脱保护反应中,所述脱保护试剂的用量可为本领域常规,较佳地,所述脱保护试剂与所述化合物4aa的摩尔比为(1~1.5):1;例如1.15:1。
[0037]
所述脱保护反应中,所述脱保护反应的温度可为本领域常规,较佳地,所述脱保护反应的温度为20~60℃,例如30℃或40℃。
[0038]
所述脱保护反应中,所述脱保护反应可采用本领域常规的监测方法,例如hplc或tlc,一般以所述化合物4aa消失或不再反应时作为反应终点,停止反应。较佳地,所述脱保护反应的时间为10~25小时,例如12或20小时。
[0039]
所述脱保护反应中,较佳地,还包含以下后处理步骤:萃取,分离。
[0040]
所述脱保护反应中,所述后处理步骤的分离可为本领域常规操作,较佳地,所述分离为柱层析。
[0041]
本发明还提供了一种化合物i的制备方法,其包括以下步骤:
[0042]
(1)溶剂中,在脱保护试剂的作用下,化合物4aa进行脱保护反应,得所述化合物a2;
[0043]
所述脱保护试剂为四丁基氟化铵(tbaf)或盐酸;
[0044]
[0045]
(2)溶剂中,在氧化剂的作用下,化合物a2进行氧化反应,得化合物a3;
[0046][0047]
(3)溶剂中,在还原剂和路易斯酸的作用下,化合物a3进行还原反应,得化合物a5;
[0048][0049]
(4)溶剂中,在碱的作用下,化合物a5与叔丁基二甲基氯硅烷(tbscl)进行羟基保护反应,得所述化合物i;
[0050][0051]
所述化合物i的制备方法中,所述脱保护反应、所述氧化反应和所述还原反应中各条件和操作如上述任一方案所述。
[0052]
所述羟基保护反应中,所述溶剂可为本领域常规,较佳地,所述溶剂为1,4-二氧六环、四氢呋喃、乙二醇二甲醚、甲基叔丁基醚、乙醚、氯仿和二氯甲烷中的一种或多种;例如二氯甲烷和/或四氢呋喃。
[0053]
所述羟基保护反应中,所述溶剂的用量可为本领域常规,较佳地,所述溶剂与所述化合物a5的质量比为(5~20):1;例如10:1。
[0054]
所述羟基保护反应中,所述碱可为本领域常规,较佳地,所述碱为咪唑和/或三乙胺;更佳地,所述碱为咪唑。
[0055]
所述羟基保护反应中,所述碱的用量可为本领域常规,较佳地,所述碱与所述化合物a5的质量比为(1~1.2):1;例如1.07:1。
[0056]
所述羟基保护反应中,叔丁基二甲基氯硅烷的用量可为本领域常规,较佳地,叔丁基二甲基氯硅烷与所述化合物a5的质量比为(1~1.2):1;例如1.07:1。
[0057]
所述羟基保护反应中,所述羟基保护反应的温度可为本领域常规,较佳地,所述羟基保护反应的温度为-10~50℃;例如0~10℃。
[0058]
所述羟基保护反应中,所述羟基保护反应可采用本领域常规的监测方法,例如hplc或tlc,一般以所述化合物a5消失或不再反应时作为反应终点,停止反应。较佳地,所述羟基保护反应的时间为10~15小时;例如12小时。
[0059]
在某一个实施方案中,所述羟基保护反应通过以下步骤进行:所述溶剂、所述碱和所述化合物a5混合后,在0~10℃下加入叔丁基二甲基氯硅烷,在0~10℃反应10~15h,得化合物i。
[0060]
所述羟基保护反应中,较佳地,还包含以下后处理步骤:浓缩,分离。
[0061]
所述羟基保护反应中,所述后处理步骤的分离可为本领域常规操作,较佳地,所述分离为柱层析。
[0062]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0063]
本发明所用试剂和原料均市售可得。
[0064]
本发明的积极进步效果在于:通过定向合成得到预定的非对映异构体,反应路线短,收率高,选择性好。
附图说明
[0065]
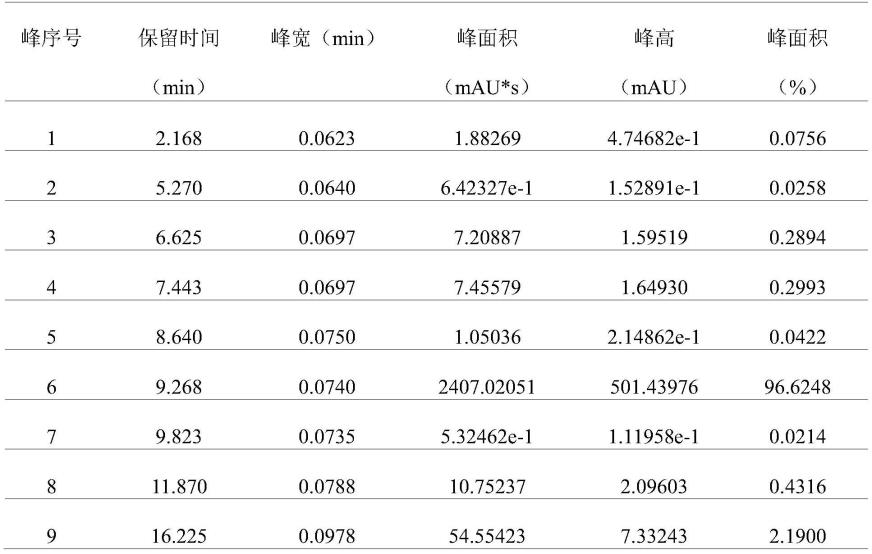
图1为实施例4中化合物i的hplc图。
具体实施方式
[0066]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0067]
实施例1
[0068]
20℃下向500ml的三口瓶中加入200g四氢呋喃,28.7g的4aa和30g四丁基氟化铵。体系在40℃下搅拌反应12h,tlc显示原料4aa全部消耗。体系冷却到20℃并浓缩除去四氢呋喃,再向浓缩物中加入200g乙酸乙酯和100g冰水,分液,上层有机相浓缩至干得到中间体a2粗品,柱层析纯化一次得到a2纯品10.1g,收率58.4%,纯度98.7%。
[0069]
实施例2
[0070]
20℃下向500ml的三口瓶中加入200g二氯甲烷,10g溴化钾和0.2g的2,2,6,6-四甲基哌啶氧化物,6g实施例1制备的中间体a2。体系冷却到0~10℃,开始滴加50g的有效含量(以cl计)为11%的次氯酸钠溶液。滴加完毕,体系在2h内升温到30℃并保温1h,tlc显示原料a2完全消耗。向体系中加入100g冰水,分液;上层水相再用100g的二氯甲烷萃取一次,合并有机相用5%的亚硫酸钠(50g)洗涤一次,有机相干燥后减压浓缩得到中间体a3,重量:4.7g,收率78.5%,纯度93.2%,直接用于下一步还原。
[0071]
实施例3
[0072]
20℃下向250ml的三口瓶中加入30g四氢呋喃、和3g实施例2制备的中间体a3和150mg mgcl2。体系冷却到0~10℃,分批加入0.8g的硼氢化钠,体系在0~20℃搅拌3h.tlc显示a3完全消耗,40℃以下浓缩除去四氢呋喃,所得浓缩物分散到100g乙酸乙酯和50g冰水的混合物,分液,有机相用饱和碳酸氢钠20g洗涤一次,有机相再用5g无水硫酸钠干燥2h,过滤所得滤液在40℃以下减压浓缩得到2.8g产物,其中,占22%,目标异构
体占78%。
[0073]
实施例4
[0074]
0~10℃下,向250ml的三口瓶中加入28g二氯甲烷、3g咪唑和2.8g实施例3得到的产物。分批加入1.6g的tbscl,体系在0~10℃搅拌12h。tlc显示化合物a5完全消耗,40℃以下浓缩除去二氯甲烷,所得浓缩物经柱层析纯化为非对映异构体柱层析得到1.3g白色固体。收率:43.0%,纯度96.6%。
[0075]
hplc测试:
[0076]
色谱条件:
[0077]
色谱柱:waters xterra ms c18(50*4.6mm,2.5μm);
[0078]
流动相a:1.5%乙腈的7.8mm的磷酸盐溶液
[0079]
流动相b:20%乙腈的7.8mm的磷酸盐溶液
[0080]
检测波长:200nm
[0081]
流速:1.0ml/min
[0082]
进样体积:10μl
[0083]
浓度:1mg/ml
[0084]
hplc测试结果如表1和图1所示:
[0085]
表1
[0086]
[0087]
h nmr(cdcl3,400m):6.24(br,1h),5.71(br,1h),4.23~4.19(s,1h),2.13(s,3h),1.25(s,3h),0.88(s,9h),0.07~0.06(s,6h);
[0088]
lc-ms计算值:287.16,实测值:288.2。
[0089]
实施例5
[0090]
30℃下向500ml的三口瓶中加入150g甲醇,28.7g的4aa和5g浓盐酸。体系在30℃下搅拌反应20h,tlc显示原料4aa全部消耗。向体系中加入500g冰水和150g二氯甲烷并搅拌10min,分液,上层水相再用150g二氯甲烷萃取一次,合并有机相用150g的饱和碳酸氢钠洗涤一次后有机相用硫酸钠干燥并浓缩除去有机溶剂,所得有机相浓缩至干得到中间体a2粗品,柱层析纯化一次得到a2纯品10.6g,收率61.3%,纯度93.6%。
[0091]
实施例6
[0092]
20℃下向500ml的三口瓶中加入200g四氢呋喃和6g实施例1制备的中间体a2。体系冷却到0~10℃,分5批向体系中加入24g戴斯-马丁试剂(商业化的氧化剂,dess-martin reaction),每批间隔30min,加料完毕,体系在1h内升温到35℃并保温2h,tlc显示原料a2完全消耗。向体系中加入100g冰水,分液;上层水相再用100g的二氯甲烷萃取一次,合并有机相用5%的亚硫酸钠(50g)洗涤一次,有机相干燥后减压浓缩得到中间体a3,重量:4.6g,收率76.1%,纯度92.7%,直接用于下一步还原。
[0093]
实施例7
[0094]
20℃下向250ml的三口瓶中加入30g四氢呋喃、和3g实施例2制备的中间体a3和150mg mgcl2。体系冷却到-20~0℃,分批加入0.8g的四氢铝锂,体系在0~20℃搅拌1h.tlc显示a3完全消耗,30℃以下浓缩除去四氢呋喃,所得浓缩物分散到100g乙酸乙酯和50g冰水的混合物,分液,有机相用饱和碳酸氢钠20g洗涤一次,有机相再用5g无水硫酸钠干燥2h,过滤所得滤液在40℃以下减压浓缩得到2.7g产物,其中,占33%,目标异构体占67%。
[0095]
实施例8
[0096]
20℃下向250ml的三口瓶中加入30g四氢呋喃、和3g实施例2制备的中间体a3和150mg zncl2。体系冷却到-20~0℃,分批加入0.8g的硼氢化钠,体系在0~20℃搅拌1h.tlc显示a3完全消耗,30℃以下浓缩除去四氢呋喃,所得浓缩物分散到100g乙酸乙酯和50g冰水的混合物,分液,有机相用饱和碳酸氢钠20g洗涤一次,有机相再用5g无水硫酸钠干燥2h,过滤所得滤液在40℃以下减压浓缩得到2.7g产物,其中,占40%,目标异构
体占60%。
[0097]
实施例9
[0098]
20℃下向250ml的三口瓶中加入30g四氢呋喃、和3g实施例2制备的中间体a3。体系冷却到0~10℃,分批加入0.8g的硼氢化钠和150mg zncl2,体系在0~20℃搅拌5h.tlc显示a3完全消耗,40℃以下浓缩除去四氢呋喃,所得浓缩物分散到100g乙酸乙酯和50g冰水的混合物,分液,有机相用饱和碳酸氢钠20g洗涤一次,有机相再用5g无水硫酸钠干燥2h,过滤所得滤液在40℃以下减压浓缩得到2.5g,产物,其中,占27%,目标异构体为73%。
[0099]
实施例11
[0100]
0~10℃下,向250ml的三口瓶中加入28g四氢呋喃、3g三乙胺和2.8g实施例3得到的产物。分批加入1.6g的tbscl,体系在0~10℃搅拌12h。tlc显示a5完全消耗,40℃以下浓缩除去二氯甲烷,所得浓缩物经柱层析纯化为非对映异构体柱层析得到1.0g白色固体。收率:33.1%,纯度98.1%。
[0101]
对比例1
[0102]
20℃下向250ml的三口瓶中加入30g四氢呋喃、和3g实施例2制备的中间体a3。体系冷却到0~10℃,分批加入0.8g的硼氢化钠,体系在0~20℃搅拌5h.tlc显示a3完全消耗,40℃以下浓缩除去四氢呋喃,所得浓缩物分散到100g乙酸乙酯和50g冰水的混合物,分液,有机相用饱和碳酸氢钠20g洗涤一次,有机相再用5g无水硫酸钠干燥2h,过滤所得滤液在40℃以下减压浓缩得到2.8g产物,其中占84%,目标异构体
为16%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1