OX40的靶向抗体及其制备方法和应用与流程
ox40的靶向抗体及其制备方法和应用
技术领域
1.本发明涉及生物医药领域,尤其涉及一种ox40的靶向抗体及其制备方法和应用。
背景技术:
2.ox40(cd134,tnfrsf4),最初被定义为t细胞活化标记物,后发现其是具有共激活功能的ngfr/tnfr超家族成员,主要在活化的效应t细胞(teffs)和调节性t细胞(tregs)上表达,也在nkt细胞、nk细胞和嗜中性粒细胞上表达(d.j.paterson,et al.,“antigens of activated rat t lymphocytes including a molecule of 50,000m(r)detected only on cd4positive t blasts,”molecular immunology.1987;24(12):1281
–
1290)。ox40与配体ox40l(cd252,tnfsf4)结合传递共刺激信号。ox40l可在抗原提呈细胞(apc),如:b细胞、树突细胞、巨噬细胞上表达;另外在其它细胞类型如langerhans细胞、内皮细胞、平滑肌细胞、肥大细胞、和nk细胞也可诱导表达(flynn s,et al.,cd4 t cell cytokine differentiation:the b cell activation molecule,ox40 ligand,instructs cd4 t cells to express interleukin 4and upregulates expression of the chemokine receptor,blr-1.j exp med.1998;188:297
–
304.);(ohshima y,et al.,expression and function of ox40 ligand on human dendritic cells.j immunol.1997;159:3838
–
3848)。可见ox40和ox40l的结合参与了t细胞与淋巴细胞和非淋巴细胞之间多种生理反应。当ox40与其配体ox40l结合时,增加效应t细胞和记忆t细胞的存活和扩增,增加细胞因子(例如il-2、il-4、il-5、ifn-γ)的分泌;降低tregs的免疫抑制活性,进一步放大t细胞活化效应(gramaglia i,et al.,ox-40ligand:a potent costimulatory molecule for sustaining primary cd4 t cell responses.j immunol.1998;161:6510
–
6517.);(ohshima y,et al.ox40 costimulation enhances interleukin-4(il-4)expression at priming and promotes the differentiation of naive human cd4(+)t cells into high il-4-producing effectors.blood.1998;92:3338
–
3345.);(ruby ce,et al.,il-12is required for anti-ox40-mediated cd4 t cell survival.j immunol.2008;180:2140
–
2148)。在肿瘤微环境中,免疫激活可导致ox40表达。可增强效应t细胞的活化和增殖,并抑制tregs,从而导致复杂的抗肿瘤免疫反应(reviewed in jensen sm,et al.,semin oncol.2010oct;37(5):524-32)。
3.部分具有激活功能的ox40抗体可以模仿其配体ox40l,激活ox40信号通路,从而增强效应t细胞的活化和增殖。目前肿瘤免疫领域将pd1抑制剂的作用比作为对免疫系统「松开刹车」,而将抗ox40激动型抗体比作对免疫系统「踩下油门」(linch sn,et al.,front oncol.2015;16;5:34)。
4.ox40是一型膜蛋白,几乎所有现有技术中的抗ox40抗体都是用ox40的胞外域融合蛋白作为免疫抗原去免疫动物。然而细胞膜上的ox40是以三聚体形式与其配体结合并激活信号通路的。用单体形式的胞外域融合蛋白作为免疫抗原去免疫动物显然不是最佳方案。首先,单体ox40暴露了大量在三聚体状态下被遮蔽的免疫原,这些免疫原产生的抗体通常
有阻碍三聚体形成的作用,即所谓拮抗抗体;其次,单体ox40缺失了那些只有三聚体形式才具有的特殊构象免疫原,这些免疫原产生的抗体通常有稳定三聚体形成的作用,即所谓激活抗体。目前多种抗ox40抗体药物正在用于针对肿瘤及免疫系统疾病的临床试验。用于对照的是该靶点处于临床研究阶段的罗氏的vonlerolizumab,该抗体现处于临床ii期试验,但2019年多项临床实验宣告终止,并且没有公布原因。可能由于vonlerolizumab激活ox40信号通路的能力较弱,较难达到药效和副作用之间的平衡。
5.因此,仍然需要开发新的抗ox40抗体,其与现有技术中已知的抗ox40抗体相比,具有同等亲和力和特异性的情况下,还具有适中的激活ox40信号通路的能力从而后期用于临床时更能够达到药效和副作用之间的平衡等。
技术实现要素:
6.本发明所要解决的技术问题是为了克服现有技术中缺乏亲和力更高、内吞活性更高的ox40的靶向抗体的缺陷,提供了一种ox40(cd134/tnfrsf4)的靶向抗体或其抗原结合片段及其制备方法和应用。
7.本发明中,所述ox40的靶向抗体或其抗原结合片段是通过使用瞬转ox40蛋白的表达细胞作为免疫原来免疫动物所得,而并非是用ox40的胞外域融合蛋白作为免疫抗原去免疫所得。因此在获得了较强的亲和力和特异性的同时,还具有优异的激活ox40信号通路能力的ox40的靶向抗体或其抗原结合片段。
8.为了解决上述技术问题,本发明第一方面提供了一种ox40的靶向抗体或其抗原结合片段,其包含重链可变区(vh)和/或轻链可变区(vl),
9.所述vh包含以下的互补决定区(cdr):如seq id no:1的氨基酸序列所示的vh cdr1;和/或,如seq id no:2的氨基酸序列所示的vh cdr2;和/或,如seq id no:3的氨基酸序列所示的vh cdr3;
10.所述vl包含以下的cdr:如seq id no:4的氨基酸序列所示的vl cdr1;和/或,如seq id no:5的氨基酸序列所示的vl cdr2;和/或,如seq id no:6的氨基酸序列所示的vl cdr3;
11.或者,所述vh在所述的vh cdr1、vh cdr2、vh cdr3的氨基酸序列上分别具有3、2或1个氨基酸突变,和/或,所述vl在所述的vl cdr1、vl cdr2、vl cdr3的氨基酸序列上分别具有3、2或1个氨基酸突变。
12.在类似“具有3、2或1个氨基酸突变”中“氨基酸突变”是指相较于原氨基酸序列而言,变体的序列存在氨基酸的突变,包括在原氨基酸序列的基础上发生氨基酸的插入、缺失或替换。示例性的解释是对cdr的突变可以包含3个、2个或1个氨基酸的突变,这些cdr之间可以任选地选择相同或不同数目的氨基酸残基进行突变,例如可以是对cdr1进行1个氨基酸的突变,对cdr2和cdr3不进行氨基酸突变。
13.本发明中,所述突变可以包括目前如本领域技术人员公知的突变,例如在抗体的生产或者应用过程中对抗体进行的一些突变,例如对可能存在的,特别是cdr区的转录后修饰(potential post-translational modifications,ptms)的位点进行突变,包括抗体的聚集、脱酰胺基敏感(asparagine deamidation)位点(ng,ns,nh等)、天冬氨酸异构(dg,dp)敏感位点、n糖基化(n-{p}s/t)敏感位点及氧化敏感位点等相关突变。
14.在本技术中,上述所列cdr的氨基酸序列均是按照imgt定义规则所示出的(本发明的权利要求中也是按照imgt定义规则所示出的序列,可在http://www.imgt.org/3dstructure-db/cgi/domaingapalign.cgi#opennewwindow中进行分析)。但是,本领域人员公知,在本领域中可以通过多种方法来定义抗体的cdr,例如基于序列可变性的kabat定义规则(参见,kabat等人,免疫学的蛋白质序列,第五版,美国国立卫生研究院,贝塞斯达,马里兰州(1991))和基于结构环区域位置的chothia定义规则(参见jmol biol 273:927-48,1997)。本领域技术人员应当理解的是,除非另有规定,否则术语给定抗体或其区(例如可变区)的“cdr”及“互补决定区”应了解为涵盖如通过本发明描述的上述已知方案中的任何一种界定的互补决定区。虽然本发明的权利要求中请求保护的范围是基于imgt定义规则所示出的序列,但是根据其他cdr的定义规则所对应的氨基酸序列也应当落在本发明的保护范围中(这些定义规则还可参见https://qinqianshan.com/biology/antibody/antibody-numbering-description/)。
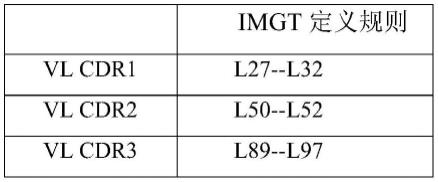
15.表1-1本技术抗体cdr定义方法
[0016][0017][0018]
其中,laa-lbb可以指从抗体轻链的n端开始,第aa位至第bb位的氨基酸序列;haa-hbb可以指从抗体重链的n端开始,第aa位至第bb位的氨基酸序列。例如,l27-l32可以指从抗体轻链n端开始,按照imgt编码规则的从第27位至第32位的氨基酸序列;h26-h33可以指从抗体重链n端开始,按照imgt编码规则的从第26位至第33位的氨基酸序列。本领域技术人员公知,在用上述这些编码规则编码cdr时,有些位置会有插入位点的情况。
[0019]
优选地,所述ox40的靶向抗体或其抗原结合片段为鼠源抗体或其抗原结合片段。
[0020]
更优选地,所述鼠源抗体的vh还包括重链可变区框架区(vh fwr),和/或,所述鼠源抗体的vl还包括轻链可变区框架区(vl fwr)。所述vh fwr选自1)种系ighv1s81*02,ighv1-53*01,ighv1-69*02,ighv1-64*01,ighv1-74*04中的fr1、fr2和fr3区,以及2)种系ighj2*01中的fr4区,或其回复突变;和/或,所述vl fwr选自1)种系igkv10-96*01、igkv10-96*02、igkv10-96*03、igkv10-96*04、igkv10-96*05中的fr1、fr2和fr3区,以及2)种系igkj5*01的中fr4区,或其回复突变。
[0021]
进一步更优选地,所述vh fwr包括如seq id no:11、29或其突变所示的vh fwr1,如seq id no:12、30或其突变所示的vh fwr2,如seq id no:13、31或其突变所示的vh fwr3,和如seq id no:14、32或其突变所示的vh fwr4;和/或,所述vl fwr包括如seq id no:15、33或其突变所示的vl fwr1,如seq id no:16、34或其突变所示的vl fwr2,如seq id no:17、35或其突变所示的vl fwr3,和如seq id no:18、36或其突变所示的vl fwr4。
[0022]
进一步更优选地,所述鼠源抗体的vh的氨基酸序列为如seq id no:7或其突变所示的氨基酸序列;和/或,所述vl的氨基酸序列为如seq id no:8或其突变所示的氨基酸序列;所述突变为所述vh和/或所述vl的氨基酸序列上发生了一个或多个氨基酸残基的缺失、取代或添加,且所述突变的氨基酸序列与所述seq id no:7和/或所述seq id no:8的氨基酸序列具有至少85%序列同一性,并保持或改善了所述抗体与ox40的结合;所述至少85%序列同一性优选为至少90%序列同一性,更优选为至少95%序列同一性,最优选为至少99%序列同一性。
[0023]
进一步更优选地,所述鼠源抗体的vh的核苷酸序列为如seq id no:9所示的氨基酸序列;和/或,所述vl的核苷酸序列为如seq id no:10所示的氨基酸序列。
[0024]
优选地,所述ox40的靶向抗体或其抗原结合片段还包括鼠抗体恒定区或人抗体恒定区;所述鼠抗体恒定区包括鼠igg1、igg2a、igg2b3或igg3的重链恒定区或其突变以及κ或λ型的轻链恒定区或其突变,所述人抗体恒定区包括人igg1、igg2、igg3或igg4的重链恒定区或其突变以及κ或λ型的轻链恒定区或其突变。
[0025]
优选地,所述ox40的靶向抗体或其抗原结合片段为人源化抗体或其抗原结合片段;
[0026]
更优选地,所述人源化抗体的可变区的框架区包括人抗体重链可变区的框架区和人抗体轻链可变区的框架区;所述人抗体轻链可变区的框架区选自1)种系ighv1-46*01、ighv1-46*02、ighv1-46*03、ighv1-46*04、ighv1-2*06中的fr1、fr2和fr3区,以及2)种系ighj4*01、ighj4*01、ighj4*01中的fr4区,或其回复突变;和/或,所述人抗体重链可变区的框架区选自1)种系igkv1-33*01、igkv1d-33*01、igkv1-39*01、igkv1d-39*01、igkv1-27*01中的fr1、fr2和fr3区,以及2)种系igkj2*01、igkj2*02中的fr4区,或其回复突变;所述回复突变的氨基酸位点数目为0-10个;
[0027]
优选地,所述抗体的轻链包含人抗体κ或λ型轻链恒定区或其突变;和/或,所述抗体的重链包含人igg1、igg2、igg3和igg4的重链恒定区或其突变。
[0028]
优选地,所述ox40的靶向抗体或其抗原结合片段包括全长抗体、fab、fab’、f(ab’)2、fv、scfv、vhh、hcab、双特异性抗体、多特异性抗体,或由上述抗体制得的单克隆抗体或多克隆抗体。
[0029]
本发明中,“fab片段”由一条轻链和一条重链的ch1及可变区组成。fab分子的重链不能与另一个重链分子形成二硫键。“fc”区含有包含抗体的ch1和ch2结构域的两个重链片段。两个重链片段由两个或多个二硫键并通过ch3结构域的疏水作用保持在一起。“fab’片段”含有一条轻链和包含vh结构域和ch1结构域以及ch1和ch2结构域之间区域的一条重链的部分,由此可在两个fab’片段的两条重链之间形成链间二硫键以形成f(ab’)2分子。“f(ab’)2片段”含有两条轻链和两条包含ch1和ch2结构域之间的恒定区的部分的重链,由此在两条重链间形成链间二硫键。因此f(ab’)2片段由通过两条重链间的二硫键保持在一起的两个fab’片段组成。术语“fv”意指向抗体的单臂的vl和vh结构域组成的抗体片段,但缺少恒定区。
[0030]
本发明中,所述的scfv(single chain antibody fragment,单链抗体)可为本领域常规的单链抗体,其包括重链可变区、轻链可变区和15~20个氨基酸的短肽。其中vl和vh结构域通过使其能够产生为单个多肽链的连接体配对形成单价分子[参见,例如,bird等
人,science 242:423-426(1988)和huston等人,proc.natl.acad.sci.usa 85:5879-5883(1988)]。此类scfv分子可具有一般结构:nh2-vl-接头-vh-cooh或nh2-vh-接头-vl-cooh。合适的现有技术接头由重复的g4s氨基酸序列或其变体组成。例如,可使用具有氨基酸序列(g4s)4或(g4s)3接头,但也可使用其变体。
[0031]
术语“多特异性抗体”按其最广义使用,涵盖具有多表位特异性的抗体。这些多特异性抗体包括但不限于:包含重链可变区(vh)和轻链可变区(vl)的抗体,其中该vh-vl单元具有多表位特异性;具有两个或多个vl和vh区的抗体,每个vh-vl单元与不同的靶点或同一个靶点的不同表位结合;具有两个或更多个单可变区的抗体,每个单可变区与不同的靶点或同一个靶点的不同的表位结合;全长抗体、抗体片段、双特异性抗体(diabodies)、和三抗体(triabodies)、共价或非共价连接在一起的抗体片段等。
[0032]
本发明的抗体包括单克隆抗体。本发明所述的单克隆抗体或mab或ab,指由单一的克隆细胞株得到的抗体,所述的细胞株不限于真核的,原核的或噬菌体的克隆细胞株。所述单克隆抗体可以由多种途径和技术进行研制,包括杂交瘤技术、噬菌体展示技术、单淋巴细胞基因克隆技术等,主流是通过杂交瘤技术从野生型或转基因小鼠制备单克隆抗体。
[0033]
本技术中,所述的“重链抗体”指的是只包含一个重链可变区(vhh)和两个常规的ch2与ch3区的抗体,又称为hcab。
[0034]“单域抗体”,又称为“纳米抗体”,指的是从重链抗体中克隆出来的vhh结构,是已知的可结合目标抗原的最小单位。
[0035]
为了解决上述技术问题,本发明第二方面提供了一种双特异性抗体,其包括第一蛋白功能区和第二蛋白功能区,所述第一蛋白功能区为如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段;所述第二蛋白功能区为靶向非ox40抗原的抗体。
[0036]
优选地,所述非ox40抗原为免疫检查点抗原或肿瘤治疗靶点,所述免疫检查点抗原优选包括pd-1、pd-l1、pd-l2、4-1bb、cd40、cd73、tim3、lag3或cd47,所述肿瘤治疗靶点优选包括ox40。
[0037]
为了解决上述技术问题,本发明第三方面提供了一种分离的核酸,其编码如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段。
[0038]
所述核酸的制备方法为本领域常规的制备方法,较佳地,包括以下的步骤:通过基因克隆技术获得编码上述抗体的核酸分子,或者通过人工全序列合成的方法得到编码上述抗体的核酸分子。
[0039]
本领域技术人员知晓,编码上述抗体的氨基酸序列的碱基序列可以适当引入替换、缺失、改变、插入或增加来提供一个多聚核苷酸的同系物。本发明中多聚核苷酸的同系物可以通过对编码该抗体序列基因的一个或多个碱基在保持抗体活性范围内进行替换、缺失或增加来制得。
[0040]
为了解决上述技术问题,本发明第四方面提供了一种表达载体,其包含如本发明第三方面所述的分离的核酸。
[0041]
优选地,所述表达载体为质粒、粘粒、噬菌体或病毒载体,所述病毒载体优选逆转录病毒载体、慢病毒载体、腺病毒载体或腺相关病毒载体。
[0042]
为了解决上述技术问题,本发明第五方面提供了一种转化体,其在宿主细胞中包含如本发明第四方面所述的重组表达载体。
[0043]
优选地,所述宿主细胞为e.coli tg1、bl21细胞,或者cho-k1细胞。
[0044]
为了解决上述技术问题,本发明第六方面提供了一种ox40的靶向抗体或其抗原结合片段的制备方法,其包含培养如本发明第五方面所述的转化体,从培养物中获得ox40的靶向抗体或其抗原结合片段。
[0045]
为了解决上述技术问题,本发明第七方面提供了一种嵌合抗原受体,其包含如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段。
[0046]
为了解决上述技术问题,本发明第八方面提供了一种基因修饰的细胞,其包含如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段、或如本发明第七方面所述的嵌合抗原受体。
[0047]
优选地,所述基因修饰的细胞为真核细胞,更优选分离的人细胞;进一步更优选免疫细胞如t细胞,或nk细胞如nk92细胞系。
[0048]
为了解决上述技术问题,本发明第九方面提供了一种抗体药物偶联物,其包含细胞毒性剂,以及如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段。
[0049]
为了解决上述技术问题,本发明第十方面提供了一种药物组合(例如可以是以套装药盒的形式如抗体组合、抗体对等,或者可以是以药物组合物的形式),其包含如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段、如本发明第二方面所述的双特异性抗体、如本发明第七方面所述的嵌合抗原受体、如本发明第八方面所述的基因修饰的细胞和/或如本发明第九方面所述的抗体药物偶联物。
[0050]
当以套装药盒的形式存在时,其可以是包含药盒a和药盒b,所述的药盒a包含如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段、如本发明第二方面所述的双特异性抗体、如本发明第七方面所述的嵌合抗原受体、如本发明第八方面所述的基因修饰的细胞、如本发明第九方面所述的抗体药物偶联物、如本发明第十方面所述的药物组合、和/或、如本发明第十一方面所述的试剂盒。所述的药盒b为其他抗肿瘤抗体或者包含所述其他抗肿瘤抗体的药物组合物(例如本发明中所提及的抗体1g10-9-13-11)。所述的药盒a和药盒b可以同时使用,也可以先使用药盒a再使用药盒b,还可以先使用药盒b再使用药盒a,可以根据具体应用时的实际需求而定。
[0051]
当以药物组合物的形式存在时,还可以包括药物上可接受的溶剂和(或)载体和(或)辅料。所述的药学上可接受的载体可为本领域常规的载体,所述的载体可以为任意合适的生理学或药学上可接受的药物辅料。所述的药物辅料为本领域常规的药物辅料,优选地包括药学上可接受的赋形剂、填充剂或稀释剂等。更优选地,所述的药物组合物包括0.01~99.99%的所述ox40的靶向抗体或其抗原结合片段、上述双特异性抗体、嵌合抗原受体、基因修饰的细胞、抗体药物偶联物,和0.01~99.99%的药用载体,所述百分比为占所述药物组合物的质量百分比。
[0052]
所述的药物组合物较佳地还包括其他抗肿瘤抗体作为活性成分。较佳地,所述的药物组合物是抗肿瘤的药物。更佳地为治疗ox40阳性肿瘤的药物,例如治疗肺癌、肝癌、胃癌、乳腺癌、头颈癌和/或结肠癌等的药物。
[0053]
本发明所述的药物组合物的给药途径较佳地为肠胃外施用、注射给药或口服给药。所述注射给药较佳地包括静脉注射、肌肉注射、腹腔注射、皮内注射或皮下注射等途径。所述的药物组合物为本领域常规的各种剂型,较佳地为固体、半固体或液体的形式,即可以
为水溶液、非水溶液或混悬液,更佳的为片剂、胶囊、颗粒剂、注射剂或输注剂等。更佳地为经由血管内、皮下、腹膜内或肌内施用。较佳地,所述药物组合物还可以作为气雾剂或粗喷雾剂施用,即经鼻施用;或者,鞘内、髓内或心室内施用。更佳地,所述的药物组合物还可以透皮、经皮、局部、肠内、阴道内、舌下或经直肠施用。
[0054]
本发明所述的药物组合物的给药剂量水平可以根据达到所需诊断或治疗结果的组合物量而调整。施用方案也可以为单次注射或多次注射,或进行调整。所选择的剂量水平和方案依赖于包括所述药物组合物的活性和稳定性(即,半衰期)、制剂、施用途径、与其他药物或治疗的组合、待检测和/或治疗的疾病或病症、以及待治疗的受试者的健康状况和先前医疗史等各种因素而进行合理地调整。
[0055]
对于本发明的所述药物组合物的治疗有效剂量可以最初在细胞培养实验或动物模型例如啮齿类动物、兔、犬、猪和/或灵长类动物中进行估计。动物模型也可以用于测定合适的施用浓度范围和途径。随后可以用于确定在人中施用的有用剂量和途径。一般地,施用有效量或剂量的确定和调整以及何时和如何进行此类调整的评估为本领域技术人员已知。
[0056]
对于组合疗法,所述ox40的靶向抗体或其抗原结合片段、上述双特异性抗体、嵌合抗原受体、基因修饰的细胞、抗体药物偶联物、药物组合、试剂盒和/或另外的治疗或诊断剂可以各自作为单一药剂,在适合于执行预期治疗或诊断的任何时间范围内进行使用。因此,这些单一药剂可以基本上同时(即作为单一制剂或在数分钟或数小时内)或以按顺序连续施用。例如,这些单一药剂可以在一年内,或10、8、6、4或2个月内,或4、3、2、或1周内,或5、4、3、2或1天内施用。
[0057]
关于制剂、剂量、施用方案和可测量的治疗结果的另外指导,参见berkow等人(2000)the merck manual of medical information(merck医学信息手册)和merck&co.inc.,whitehouse station,new jersey;ebadi(1998)crc desk reference of clinical pharmacology(临床药理学手册)等著作。
[0058]
为了解决上述技术问题,本发明第十一方面提供了一种试剂盒,其包括如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段、如本发明第二方面所述的双特异性抗体、如本发明第七方面所述的嵌合抗原受体、如本发明第八方面所述的基因修饰的细胞、如本发明第九方面所述的抗体药物偶联物、和/或、如本发明第十方面所述的药物组合。
[0059]
优选地,所述试剂盒还包括(i)施用抗体或其抗原结合片段或抗体药物偶联物或药物组合物的装置;和/或(ii)使用说明。
[0060]
为了解决上述技术问题,本发明第十二方面提供了如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段、如本发明第二方面所述的双特异性抗体、如本发明第七方面所述的嵌合抗原受体、如本发明第八方面所述的基因修饰的细胞、如本发明第九方面所述的抗体药物偶联物、如本发明第十方面所述的药物组合、和/或、如本发明第十一方面所述的试剂盒在制备诊断、预防和/或治疗肿瘤的药物中的应用。
[0061]
优选地,所述肿瘤为ox40阳性肿瘤;例如肺癌、肝癌、胃癌、乳腺癌、头颈癌和/或结肠癌等。
[0062]
为解决上述技术问题,本发明还提供了如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段、如本发明第二方面所述的双特异性抗体、如本发明第七方面所述的嵌合抗原受体、如本发明第八方面所述的基因修饰的细胞、如本发明第九方面所述的抗体药
物偶联物、如本发明第十方面所述的药物组合、和/或、如本发明第十一方面所述的试剂盒在诊断、预防和/或治疗肿瘤中的应用。所述肿瘤优选如上所述。
[0063]
本发明某一方面还提供了一种检测待检样品中是否表达ox40蛋白的方法,其包括如下的步骤:如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段与待检样品在体外接触,检测如本发明第一方面所述的ox40的靶向抗体或其抗原结合片段与所述待检样品的结合即可。
[0064]
在本发明中,除非另有说明,否则本发明中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本发明中所用的细胞培养、分子遗传学、核酸化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
[0065]
在本发明中,ox40、ox-40和ox-40代表一样的意思。
[0066]
本发明所用氨基酸三字母代码和单字母代码如本领域技术人员知晓,或j.biol.chem,243,p3558(1968)中所述。
[0067]
如本发明使用的,术语“包括”或“包含”旨在表示组合物和方法包括所述的元素但不排除其他元素,但根据上下文的理解,也包括“由
……
组成”的情况。
[0068]
在本发明中,术语“可变”通常是指这样的事实,即抗体的可变结构域的序列的某些部分变化强烈,它形成各种特定抗体对其特定抗原的结合和特异性。然而,变异性并非均匀地分布在抗体的整个可变区中。它集中在轻链和重链可变区中的三个区段,被称为互补决定区(cdr)或高变区(hvr)。可变域中更高度保守的部分被称为框架(fwr)。天然重链和轻链的可变结构域各自包含四个fwr区,大部分采用β-折叠构型,通过三个cdrs连接,形成环连接,并且在一些情况下形成β-折叠结构的一部分。每条链中的cdrs通过fwr区紧密靠近在一起,并与来自另一条链的cdr一起形成抗体的抗原结合位点,恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。
[0069]
术语“表位”指抗原(例如,ox40)中与抗体分子特异性相互作用的部分。术语“竞争”在本发明中指抗体分子干扰抗ox40抗体分子与靶(例如,ox40)结合的能力。对结合作用的干扰可以是直接或间接的(例如,通过抗体分子或靶的变构调节作用)。可以使用竞争结合测定法(例如,facs测定法、elisa或biacore测定法)确定抗体分子是否能够干扰另一种抗体分子与其靶结合的程度。
[0070]
本发明所述的术语“抗体”包括免疫球蛋白,是由两条相同的重链和两条相同的轻链通过链间二硫键连接而成的四肽链结构。免疫球蛋白重链恒定区的氨基酸组成和排列顺序不同,故其抗原性也不同。据此,可将免疫球蛋白分为五类,或称为免疫球蛋白的同种型,即igm、igd、igg、iga和ige,其相应的重链分别为μ链、δ链、γ链、α链和ε链。同一类ig根据其铰链区氨基酸组成和重链二硫键的数目和位置的差别,又可分为不同的亚类,如igg可分为igg1、igg2、igg3和igg4。轻链通过恒定区的不同分为κ链或λ链。五类ig中第每类ig都可以有κ链或λ链。
[0071]
如本发明中所使用的,术语“分离的”指的是从天然状态下经人工手段获得的。如果自然界中出现某一种“分离的”物质或成分,那么可能是其所处的天然环境发生了改变,或从天然环境下分离出该物质,或二者情况均有发生。例如,某一活体动物体内天然存在某种未被分离的多聚核苷酸或多肽,而从这种天然状态下分离出来的高纯度的相同的多聚核
苷酸或多肽即称之为“分离的”。术语“分离的”不排除混有人工或合成的物质,也不排除存在不影响物质活性的其它不纯物质。
[0072]
如本发明中所使用的,术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌等原核细胞,如酵母细胞等的真菌细胞,如s2果蝇细胞或sf9等的昆虫细胞,或者如纤维原细胞,cho细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek 293细胞或人细胞等的动物细胞。
[0073]
术语“鼠源抗体”在本发明中为根据本领域知识和技能制备的对ox40的单克隆抗体。制备时用ox40抗原注射试验对象,然后分离表达具有所需序列或功能特性的抗体的杂交瘤。在本发明一个优选的实施方案中,所述的鼠源ox40抗体或其抗原结合片段,可进一步包含鼠源κ、λ链或其变体的轻链恒定区,或进一步包含鼠源igg1、igg2、igg3或igg4或其变体的重链恒定区。
[0074]
术语“人源化抗体”包括具有人种系免疫球蛋白序列的可变和恒定区的抗体。本发明的人抗体可包括不由人种系免疫球蛋白序列编码的氨基酸残基(如通过体外随机或位点特异性诱变或通过体内体细胞突变所引入的突变)。然而,术语“人抗体”不包括这样的抗体,即其中已将衍生自另一种哺乳动物物种(诸如小鼠)种系的cdr序列移植到人骨架序列上(即“人源化抗体”)。
[0075]
如本发明所用,关于抗体的术语“特异性”意指识别特异性抗原但基本上不识别或结合样品中的其他分子的抗体。例如,特异性结合来自一个物种的抗原的抗体也可以结合来自一个或更多个物种的该抗原。但是,这种种间交叉反应性本身不改变抗体根据特异性的分类。在另一个实例中,特异性结合抗原的抗体也可以结合该抗原的不同等位基因形式。然而,这种交叉反应性本身不改变抗体根据特异性的分类。在一些情况下,术语“特异性”可用于指抗体、蛋白质或肽与第二化学物质的相互作用,意味着该相互作用取决于化学物质上特定结构(例如,抗原决定簇或表位)的存在;例如,抗体一般识别并结合特定的蛋白质结构,而不是蛋白质。如果抗体对表位“a”具有特异性,则在含有经标记的“a”和抗体的反应中,含有表位a的分子(或游离的,未标记的a)的存在将减少结合于抗体的标记的a的量。
[0076]“同一性”、“突变”是指两个多核苷酸序列之间或两个多肽之间的序列相似性。当两个比较序列中的位置均被相同碱基或氨基酸单体亚基占据时,例如如果两个dna分子的每一个位置都被腺嘌呤占据时,那么所述分子在该位置是同源的。两个序列之间的同一性百分率是两个序列共有的匹配或同源位置数除以比较的位置数
×
100的函数。例如,在序列最佳比对时,如果两个序列中的10个位置有6个匹配或同源,那么两个序列为60%同源。一般而言,当比对两个序列而得到最大的同一性百分率时进行比较。“优化”指保持或改善了所述抗体与抗原结合的突变,在本发明中,指保持、维持或改善了与cldn18.2的结合的突变。
[0077]
术语“多肽”、“肽”和“蛋白质”(如果为单链)在本发明中互换地使用。术语“核酸”、“核酸序列”,“核苷酸序列”或“多核苷酸序列”和“多核苷酸”互换使用。
[0078]
术语“突变”包括氨基酸或核苷酸的取代、添加和/或缺失,“氨基酸取代”和“保守性氨基酸取代”分别是其中氨基酸残基以另一种氨基酸残基置换和以具有相似侧链的氨基酸残基置换。
[0079]
本发明所使用的“慢病毒”是指逆转录病毒科(retroviridae family)的属。慢病
毒在逆转录病毒中是独特的,其能够感染非分裂细胞;它们可以将显著量的遗传信息递送到宿主细胞的dna中,因此它们是基因递送载体的一种最有效方法。hiv、siv和fiv都是慢病毒的实例。来自慢病毒的载体提供了在体内实现显著水平基因转移的手段。
[0080]
本发明使用的术语“载体”是包含分离的核酸并可用于将分离的核酸递送至细胞内部的组合物。在本领域中已知许多载体,包括但不限于线性多核苷酸、与离子或两亲化合物相关的多核苷酸、质粒和病毒。因此,术语“载体”包括自主复制的质粒或病毒。该术语还应被解释为包括促进核酸转移到细胞中的非质粒和非病毒化合物,例如聚赖氨酸化合物、脂质体等。病毒载体的实例包括但不限于腺病毒载体、腺相关病毒载体、逆转录病毒载体等。
[0081]
本发明使用的表述“细胞”、“细胞系”可互换使用,并且所有这类名称都包括后代。术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌等原核细胞,如酵母细胞等的真菌细胞,或者如纤维原细胞、cho细胞、cos细胞、nso细胞、hela细胞、bhk细胞、hek 293细胞或人细胞等的动物细胞。
[0082]
术语“转染”是指将外源核酸引入真核细胞。转染可以通过本领域已知的各种手段来实现,包括磷酸钙-dna共沉淀、deae-葡聚糖介导的转染、聚凝胺介导的转染、电穿孔、显微注射、脂质体融合、脂质转染、原生质体融合、逆转录病毒感染和生物弹道技术(biolistics)。
[0083]
术语“免疫细胞”指可以引发免疫应答的细胞,“免疫细胞”及其语法上的其他形式可以指任何来源的免疫细胞。“免疫细胞”包括例如衍生自在骨髓中产生的造血干细胞(hsc)的白血细胞(白细胞)、淋巴细胞(t细胞、b细胞、自然杀伤(nk)细胞和骨髓来源的细胞(嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、巨噬细胞、树突状细胞)。术语“免疫细胞”也可以是人或非人的。
[0084]
如本发明中所使用的,术语ec
50
是指半最大效应浓度(concentration for 50%of maximal effect),即能引起50%最大效应的浓度。
[0085]
本发明的药物组合物可根据需要制成各种剂型,并可由医师根据患者种类、年龄、体重和大致疾病状况、给药方式等因素确定对病人有益的剂量进行施用。给药方式例如可以采用注射或其它治疗方式。
[0086]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0087]
本发明所用试剂和原料均市售可得。
[0088]
本发明的积极进步效果在于:与现有技术抗体相比,本发明的抗体在亲和力和特异性相当的情况下,还具有优异的激活ox40信号通路的能力,从而后期用于临床时更能够达到药效和副作用之间的平衡。在本发明某一较佳实施例中,本发明的抗体激活可以强力激活ox40信号通路,其半数有效浓度(ec50)为633ng/ml。
附图说明
[0089]
图1为实施例4中抗ox40抗体分别与ox40和4-1bb融合蛋白的结合活性。
[0090]
图2为实施例4中抗ox40抗体与细胞表面ox40蛋白的结合活性。
[0091]
图3为实施例4中不同阳性细胞株的nf-κb转录活性。
[0092]
图4为实施例4中抗体的浓度-刺激活性效应曲线。
具体实施方式
[0093]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0094]
实施例1抗原制备、小鼠免疫及杂交瘤制备
[0095]
a.抗原(瞬转ox40的表达细胞)制备
[0096]
采用293f细胞作为转染细胞,将商品化ox40质粒(义翘神州,hg0481-ut)瞬时转染进293f细胞,经培养48小时后,取细胞作为免疫原。具体步骤如下:准备293f细胞,在转染当天,细胞密度达到1.0-1.2
×
106个/ml;计数细胞,并在6孔板内加入1.0
×
106个细胞/ml,2ml/孔,共4孔;准备dna转染体系。取640μl opti-mem,加入8ugdna质粒,温和混匀;再加入16μl pei,温和混匀,室温静置20分钟;将dna-293pei混合物加入293f细胞中,放入infors摇床,115rpm,37℃,5%co2培养环境,培养2天;样品收集。收集全部样品,1500rpm离心,3分钟;取细胞,pbs重悬后,1500rpm,3分钟清洗两次。最终重悬至5
×
106个/ml,即得抗原(即,瞬转ox40的表达细胞或ox40-293f细胞)用于免疫。
[0097]
b.免疫
[0098]
从上述制得的瞬转ox40的表达细胞作为免疫原去免疫动物(小鼠和兔子)。
[0099]
细胞收集后,用于细胞免疫六周龄小鼠(杭州师范大学动物中心)。动物免疫由杭州师范大学动物中心进行操作。免疫部位为皮下多点免疫,每次免疫5
×
106个细胞/只小鼠;共进行4次免疫(首免后,21天后进行二免,之后每隔14天,进行加免一次)。4免后用elisa(与下述elisa步骤类似)进行血清滴度检测。血清滴度合格的小鼠会进行加强免疫,并取脾进行保存或融合。
[0100]
c.融合
[0101]
首先取4周小鼠(杭州师范大学动物中心)的胸腺细胞,将胸腺细胞重悬于imdm培养基中,作为饲养细胞;将生长状态良好的sp2/0重悬于imdm培养基,作为融合细胞。随后准备脾细胞如下:取上述加强免疫后的小鼠脾脏,将脾脏放入无菌的10cm平皿,剪去多余的粘连组织,将脾脏置于细胞滤网中,用无菌的2ml注射器的芯研磨脾脏。收集分离的脾脏细胞,并用imdm培养基洗两遍,作为融合细胞备用。准备细胞融合时将sp2/0细胞与脾细胞按细胞沉淀的体积1:1比例混匀,加入imdm培养基,使得管中液体为30ml,1500rpm离心5分钟,弃去上清。细胞沉淀小心敲散,将离心管中的细胞置于含37℃温水的烧杯中。在1min内将1ml peg匀速逐滴加入到细胞中,37℃水浴静置30s;将10ml imdm培养基加入到融合的细胞中,随后及时加入培养基使得总体积为30ml。1200rpm离心3分钟,弃去上清;细胞沉淀轻轻敲起,缓慢转移至杂交瘤选择培养基中,并往选择培养基中加入饲养细胞,轻轻混匀融合细胞和饲养细胞。按200μl/well的量铺板,总共铺20块板;置于37℃,5%co2的培养条件下培养7天后取杂交瘤上清进行检测筛选。
[0102]
实施例2抗体筛选及测序
[0103]
1、抗体筛选
[0104]
elisa筛选:首先用包被液将抗原ox40融合蛋白(ox40融合蛋白购于杭州华安生物
技术有限公司)稀释至1μg/ml,按每孔50μl加入到96孔酶标板内。将酶标板盖好盖子后,放入4度冷柜过夜;封闭后将实施例1中所得杂交瘤上清用移液器按每孔50μl加入到酶标板内,振匀后,放入恒温培养箱,静置1小时;用tbst洗3次后,将稀释好的二抗(羊抗鼠igg-hrp,pierce,31430)用移液器按每孔50μl加入到酶标板内,放到恒温培养箱,静置30分钟;用tbst洗3次后用hrp显色液显色。显色结束后,用h2so4(tmb)终止反应,读板并分析数据。根据阳性孔od值的高低,筛选阳性克隆。
[0105]
elisa阳性的克隆用实施例1中所得ox40-293f细胞进行流式(facs)筛选,从而筛选到双阳性克隆:收集瞬转的ox40-293f细胞,将细胞按50000个每孔加入96孔v型板,用1%bsa/pbs封闭,4度放置30分钟;将elisa阳性的杂交瘤上清50μl每孔加入细胞孔,放在4度冷柜,1小时;洗涤后,将稀释后抗鼠-fitc(羊抗鼠igg-fitc,jackson,115-095-003)加入细胞,50μl每孔,放在4度冷柜,30分钟;孵育后的细胞经洗涤重悬,于流式分选仪检测并记录mfi。阳性克隆被挑选出来,并进行亚克隆。
[0106]
亚克隆:将筛选到的双阳性克隆进行亚克隆,通过检测,挑选单克隆,用于后期研发。本实施例采用两种方法进行亚克隆。有限稀释法和计数铺板。均用本领域常规操作即可。
[0107]
亚克隆筛选:亚克隆筛选方法和上述杂交瘤上清的筛选方法相同,都是利用elisa方法和facs方法进行检测,最终挑选双阳性的单克隆作为最后的克隆,进行抗体重组,获取序列。
[0108]
2、测序
[0109]
将上述阳性杂交瘤细胞裂解后,通过rt(反转录)和重轻链的pcr,获得序列并测序验证。
[0110]
rt的条件如下表1所示。
[0111]
表1
[0112][0113]
[0114]
重链pcr的反应体系和反应程序如下表2和表3所示。
[0115]
表2 pcr反应体系
[0116]
试剂10μl反应体系终浓度1
×
max mixture9.6μl1
×
forward primer 1,10μm0.1μl0.1μmreverse primer(m12h-r/m2a-r),10μm0.1μl0.1μmcdna0.2μl [0117]
表3 pcr反应程序
[0118][0119]
轻链pcr的反应体系和反应程序如下表4和表5所示。
[0120]
表4 pcr反应体系
[0121][0122]
表5 pcr反应程序
[0123]
[0124][0125]
所得pcr产物送测序,测序公司为杭州有康生物技术有限公司。
[0126]
3、抗体序列信息
[0127]
抗体常用的有kabat、chothia和imgt等编号体系,本实施例中采用的是imgt编号体系。本发明抗体cdr的氨基酸序列见下表6。
[0128]
表6本发明抗体cdr的氨基酸序列
[0129][0130]
表7为其中一优选的框架区序列组合。
[0131]
表7框架区序列组合
[0132]
[0133][0134]
本发明获得的抗体及对照抗体的轻链可变区和重链可变区可以为如下表8所示。
[0135]
表8轻链可变区和重链可变区的氨基酸序列
[0136][0137]
上述抗体5a3-6-15的vh的核苷酸序列可以优选(seq id no:9)为:
[0138]
cagatccagttggtgcagtctggacctgagctggtaaagcctggggcttcagtgaagatgtcctgcaaggcttctggatacacattcactagctatattatgcactgggtgaagcagaagcctgagcagggccttgagtggattggatatattaatccttacaatgatggttctaagtacaatgagaacttcaaaggcaaggccacactgacttcagacaaatcctccagcacagcctacatggagctcagcagcctgacctctgaggactctgcggtcttttactgtgcaaggggggcctacggttctagttacaactttgactactggggccaaggcaccactctcacagtctcctca
[0139]
上述抗体5a3-6-15的vl的核苷酸序列可以优选(seq id no:10)为:
[0140]
gatatccagatgacacagactacttcctccctgtctgcctctctgggagacagagtcaccatcagttgcagtgcaagtcagggcattagcaattatttaaactggtatcagcagaaaccagatggaactgttaaactcctgatctattacacatcaagtttacactcaggagtcccatcaaggttcagtggcagtgggtctgggacagattattctctcaccatcagcaacctggaacctgaagatattgccacttattattgtcagcagtatagtaagcttccgtacacgttcggaggggggaccaagctgaaataaaac
[0141]
上述抗体1g10-9-13-11的vh的核苷酸序列可以优选(seq id no:27)为:
[0142]
gaggttcagctgcagcagtctggggctgaactggtgaagcctggggcttcagtgaagctgtcctgcaaggcttctggctacaccttcaccaactactggatacactgggtgaagcagaggcctggacaaggccttgagtggattggagagattaatcctagcaacggtcgtactaactccaatgagaagttcaagaacaaggccacactgactgtagacaaatcctccagcacagcctacatgcaactcagcagcctgacatctgaggactctgcggtctattactgtgcagaggcggtgccgtactactttgtctactggggccaaggcaccactctcacagtctcctca;
[0143]
上述抗体1g10-9-13-11的vl的核苷酸序列可以优选(seq id no:28)为:
[0144]
gatattgtgatgacgcaggctgcatcctccctgtctgcctctctgggagacagggtcaccatcagttgtagggcaagtcaggacattaacaattatttaaactggtatcagcagaaacctgatggaactgttaaactcctgatcta
cttcacatcaggattacgctcaggagtcccatcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggagcaagaagatattgccacttacttttgccaacagggtaatacgcttcctctcacgttcggtgctgggaccaagctggagctaaac
[0145]
抗体轻链恒定区和重链恒定区的选择:本发明抗体ox40的轻链恒定区和重链恒定区可以为鼠源、兔源、人源的等等,例如所述重链恒定区和轻链恒定区为鼠源恒定区。
[0146]
实施例3抗体生产、纯化
[0147]
本发明的抗体是通过小鼠腹水纯化抗体。操作步骤均为本领域常规,主要是将杂交瘤细胞培养扩大后,直接接种于预致敏的小鼠腹腔内。10天后收集腹水,并经prog纯化,纯化后的抗体进行定量和sds-page染色。
[0148]
实施例4效果鉴定
[0149]
1、ox40结合亲和力和特异性鉴定
[0150]
1.1 ox40和特异性对照(4-1bb)融合蛋白的构建
[0151]
ox40基因片段购自义翘神州,以购买的基因片段为模板,通过pcr方法获得ox40胞外区片段,并构建到ptt5载体上,用于蛋白表达。其中ox40-rfc融合蛋白(用本领域常规方法制得)的酶切位点是ecori和xhoi,ox40-his融合蛋白(用本领域常规方法制得)的酶切位点为ecori和nhei。构建成功后,质粒转染到293f细胞中进行表达,并进行纯化,即得ox40-rfc融合蛋白和ox40-his融合蛋白。
[0152]
4-1bb基因(4-1bb是与ox40同一基因家族的另一个分子,但是序列完全不同,因此作为结合特异性的实验对照)片段购自义翘神州,以购买的基因片段为模板,通过pcr方法获得4-1bb胞外区片段,并构建到ptt5载体上,用于蛋白表达。其中4-1bb-rfc融合蛋白的酶切位点是ecori和xhoi,4-1bb-his融合蛋白的酶切位点为ecori和nhei。构建成功后,质粒转染到293f细胞中进行表达,并进行纯化,即得4-1bb-rfc融合蛋白和4-1bb-his融合蛋白。
[0153]
1.2结合亲和力和特异性鉴定
[0154]
结合亲和力和特异性鉴定分别是用elisa和facs两种方法鉴定的。
[0155]
首先用elisa鉴定阳性抗体(即vonlerolizumab)和ox40-rfc融合蛋白和ox40-his融合蛋白的结合亲和力,并用4-1bb-rfc融合蛋白和4-1bb-his融合蛋白做对照来鉴定抗体的结合特异性。
[0156]
用包被液将抗原ox40融合蛋白或4-1bb融合蛋白稀释至1μg/ml,按每孔50μl加入到96孔酶标板内。将酶标板盖好盖子后,放入4℃冷柜过夜;封闭后将上述纯化的抗体(1μg/ml)加入到酶标板内,振匀后,放入恒温培养箱,静置1小时;用tbst洗3次后,将稀释好的二抗用移液器按每孔50μl加入到酶标板内,放到恒温培养箱,静置30分钟;用tbst洗3次后用hrp显色液显色。显色结束后,用h2so4(tmb)终止反应,读板并分析数据。
[0157]
实验结果如图1所示。由图中可以看出,1g0-9-13-11和5a3-6-15抗体均可特异性识别ox40融合蛋白,而不识别4-1bb融合蛋白。其中,ox40正对照抗体为根据罗氏在临床试验的vonlerolizumab的序列合成表达的抗ox40抗体;4-1bb正对照抗体为根据辉瑞在临床试验的utomilumab的序列合成表达的抗4-1bb抗体(购于冠科生物技术有限公司)。可见,本发明抗ox40抗体可特异性识别ox40融合蛋白,而不识别4-1bb融合蛋白,结合能力与阳性对照抗体vonlerolizumab相当。
[0158]
2、与表达ox40的细胞结合的结合亲和力和特异性鉴定
[0159]
2.1 ox40-表达细胞和特异性对照(4-1bb)细胞的构建
[0160]
ox40/4-1bb表达载体购自义翘神州(ox-40:hg10481-ut)。该表达载体可直接进行转染(转染步骤为本领域常规,具体如下:准备cho-k1细胞,在转染当天,细胞密度达到1.0-1.2
×
106个/ml;计数细胞,并在6孔板内加入1.0
×
106个细胞/ml,2ml/孔,共4孔;准备dna转染体系。取640μl opti-mem,加入8μgdna质粒,温和混匀;再加入16μlpei,温和混匀,室温静置20分钟;将dna-pei混合物加入cho-k1细胞中,放入infors摇床,115rpm,37℃,5%co2培养环境,培养2天;样品收集。收集全部样品,1500rpm离心,3分钟;取细胞,pbs重悬后,1500rpm,3分钟清洗两次,准备facs实验)。通过cho-k1细胞转染鉴定后,确认该载体能在cho-k1细胞表面正确表达ox40和4-1bb分子,即成功获得ox40-cho-k1细胞和4-1bb-cho-k1细胞。
[0161]
2.2结合亲和力和特异性鉴定
[0162]
本发明抗ox40抗体用上述所得ox40-cho-k1细胞进行流式(facs)进一步鉴定:收集瞬转的ox40-cho-k1细胞,将细胞按50000个每孔加入96孔v型板,用1%bsa/pbs封闭,4℃放置30分钟;将elisa阳性抗体从10μg/ml进行3倍倍比稀释,稀释抗体50μl每孔加入细胞孔,放在4度冷柜,1小时;洗涤后,将稀释后抗鼠-fitc加入细胞,50μl每孔,放在4℃冷柜,30分钟;孵育后的细胞经洗涤重悬,于流式分选仪检测,记录mfi并分析数据。
[0163]
实验结果如图2所示,由图中可以看出,1g10-9-13-11和5a3-6-15抗体均可识别ox40-cho-k1细胞。由于阳性对照抗体是人源化的抗体(即罗氏vonlerolizumab),而本发明抗ox40抗体是小鼠抗体,检测时使用的二抗是完全不同的二抗(羊抗人igg-hrp,abcam,ab98595;羊抗人igg-r-pe,southern biotech,204009),因此,最后的mfi读值也又较大的区别。
[0164]
3、特异性激活ox40信号通路
[0165]
3.1 ox40信号通路汇报细胞系构建
[0166]
报告基因载体pgl4.32[luc2p/nf-κb-re/hygro]购自promega,用报告基因载体转染hek293细胞(上海冠导生物工程#c028),并用hygromycin进行筛选(常规筛选步骤即可),挑选耐药性较强的阳性细胞株,用tnfα刺激阳性细胞激活nf-κb信号通路,并用单荧光素酶报告基因检测试剂盒(北京原平皓生物#lf102-01)处理样品,通过多功能酶标仪测定rlu来检测luciferase的转录活性,最终选出了转录活性最高的三株阳性细胞株1c2-2、1c6-3、1b1-2(表9)。
[0167]
ox40表达载体购自义翘神州,用ox40表达质粒转染上述三株阳性细胞株,并用hygromycin加g418进行筛选,挑选耐药性较强的阳性细胞株。分别用facs检测(具体实验步骤除检测样品不同外,其余均同上述2.2)细胞株表面ox40的表达量;用多功能酶标仪检测分析抗ox40抗体与不同阳性细胞表面ox40结合后激活nf-κb信号通路的能力。facs显示,各阳性细胞株ox40的表达水平无显著差异,其中19b3细胞株的nf-κb转录活性最强(图3)。因此,选择阳性细胞株19b3作为ox40信号通路报告细胞系。
[0168]
表9不同阳性细胞株中nf-κb转录活性
[0169]
[0170][0171]
3.2特异性激活ox40信号通路鉴定
[0172]
将上述得到的阳性细胞株19b3细胞接种至96孔板,置co2培养箱中孵育过夜。ox40抗体1g10-9-13-11和5a3-6-15进行梯度稀释后加入到相应孔中,置co2培养箱孵育5小时,然后用单荧光素酶报告基因检测试剂盒处理,通过多功能酶标仪读取相对发光单位(rlu),并通过分析软件按四参数逻辑方程拟合抗体的浓度-刺激活性效应曲线。
[0173]
如图4所示,1g10-9-13-11和5a3-6-15抗体均可以有效激活ox40信号通路,其半数有效浓度(ec50)分别为833.9ng/ml和633.0ng/ml,而且随着抗体浓度的递增,在相同浓度下5a3-6-15抗体的激活能力要远大于1g10-9-13-11抗体;相比之下,在相同条件下正对照抗体只表现出相对微弱的激活能力以至于ec50不可有效拟合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1