聚合酶至导电通道的附接的制作方法
聚合酶至导电通道的附接
1.对相关申请的交叉引用
2.本申请要求于2019年6月18日提交的美国临时专利申请号62/862,767的优先权,其全部内容通过引用并入本文中。
背景技术:
3.当前的测序、基因分型和相关平台中的大多数使用“边合成边测序”(sds)技术和基于荧光的方法进行检测。期望有可实现更具成本效益、快速和方便的测序和核酸检测的替代测序方法来作为对sbs的补充。基于电荷的测序是一种有吸引力的方法。针对相关的方法和系统,可控地将聚合酶结合至基质(例如检测核酸掺入的基质)并从其释放聚合酶的能力可以是有益的。
技术实现要素:
4.在一个方面中,提供了一种装置,其包括导电通道和附接至所述导电通道的一定数量的聚合酶分子,其中所述数量在一至五个之间,并且所述导电通道用于检测包含电荷标签的核苷酸通过所述聚合酶至新生多核苷酸中的掺入,并且所述一个或多个聚合酶分子中的每一个包含组氨酸标签,所述导电通道包含镍
‑
次氮基三乙酸络合物,并且所述组氨酸标签结合所述镍
‑
次氮基三乙酸络合物。
5.在一个实例中,连接至所述导电通道的聚合酶分子的数量是五个或更少,例如五个、四个、三个、两个或一个。在一个不同的实例中,所述数量可以是大于五个。在另一个实例中,镍
‑
次氮基三乙酸络合物包含九个镍
‑
次氮基三乙酸基团。在另一个实例中,所述导电通道包含纳米线,所述纳米线具有约10nm至约100nm之间的直径和约50nm至约300nm之间的长度。在另一个实例中,所述纳米线具有约30nm的直径和约100nm至约150nm之间的长度。在一个进一步的实例中,所述导电通道的表面进一步包含多个不直接结合次氮基三乙酸基团的络合物的聚乙二醇部分。
6.在另一方面中,提供了一种方法,其包括将一至五个镍
‑
次氮基三乙酸络合物附接至导电通道,和将包含组氨酸标签的聚合酶附接至所述镍
‑
次氮基三乙酸络合物中的一个或多个,其中所述导电通道用于检测包含电荷标签的核苷酸通过所述聚合酶至新生多核苷酸中的掺入。
7.在一个实例中,附接至所述导电通道的聚合酶分子的数量是五个或更少,例如五个、四个、三个、两个或一个。在一个不同的实例中,所述数量可以是大于五个。在另一个实例中,镍
‑
次氮基三乙酸络合物包含九个镍
‑
次氮基三乙酸基团。在另一个实例中,所述导电通道包含纳米线,所述纳米线具有约10nm至约100nm之间的直径和约50nm至约300nm之间的长度。在另一个实例中,所述纳米线具有约30nm的直径和约100nm至约150nm之间的长度。在一个进一步的实例中,所述导电通道的表面进一步包含多个不直接结合次氮基三乙酸基团的络合物的聚乙二醇部分。在又一个进一步的实例中,所述方法进一步包括从所述一至五个镍
‑
次氮基三乙酸络合物洗脱所述聚合酶,其中洗脱包括用乙二胺四乙酸或咪唑螯合镍。
在又一个进一步的实例中,所述方法进一步包括用镍重新装载所述次氮基三乙酸部分以重新形成镍
‑
次氮基三乙酸络合物和将聚合酶结合至重新形成的镍
‑
次氮基三乙酸络合物。
8.在另一方面中,提供了一种方法,其包括检测一个或多个核苷酸使用一定数量的聚合酶至与一个或多个模板核苷酸链互补的一个或多个新生核苷酸链中的掺入,其中所述一个或多个聚合酶各自附接至导电通道,所述一个或多个核苷酸中的一个或多个包含电荷标签并且所述导电通道将在所述掺入过程中检测所述电荷标签,其中所述一个或多个聚合酶的每一个均包含组氨酸标签,所述导电通道包含镍
‑
次氮基三乙酸络合物,并且所述组氨酸标签结合所述镍
‑
次氮基三乙酸络合物。
9.在一个实例中,附接至所述导电通道的聚合酶分子的数量是五个或更少,例如五个、四个、三个、两个或一个。在一个不同的实例中,数量可以是大于五个。在另一个实例中,所述镍
‑
次氮基三乙酸络合物包含九个镍
‑
次氮基三乙酸基团。在又一个实例中,所述导电通道包含纳米线,所述纳米线具有约10nm至约100nm之间的直径和约50nm至约300nm之间的长度。在另一个实例中,所述纳米线具有约30nm的直径和约100nm至约150nm之间的长度。在一个进一步的实例中,所述导电通道的表面进一步包含多个不直接结合次氮基三乙酸基团的络合物的聚乙二醇部分。
附图说明
10.当参考附图阅读以下详细描述时,将更好地理解本公开的这些和其他特征、方面和优点,其中:
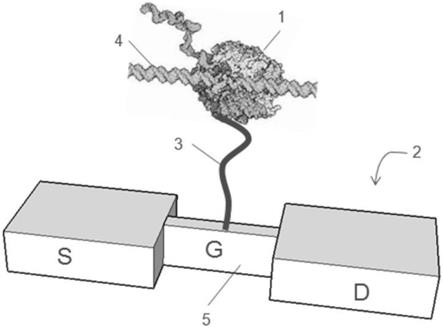
11.图1显示了附接至电荷传感器的聚合酶。
12.图2显示了附接至多聚组氨酸标签的ni
‑
nta。
13.图3显示了nta基团附接至表面的实例。
14.图4显示了用于将nta基团附接至表面的过程的实例。
15.图5a和图5b显示了根据本公开的方面所述的方法的工作流程的实例。
16.图6是展示了对组氨酸标签蛋白的测量的图,用ni
‑
nta络合物作为附接部分将所述组氨酸标签蛋白附接至表面。
具体实施方式
17.目前需要用于在这种方法中实时检测聚合酶掺入的核苷酸的改进装置、系统和方法。一种有吸引力的选择是通过使用导电通道检测聚合酶介导的核苷酸掺入,其中聚合酶被栓系至导电通道并且核苷酸包含带电荷的标签。在聚合酶介导的掺入过程中的核苷酸与互补模板核苷酸的配对过程中,导电通道检测到掺入的核苷酸的带电荷标签的存在,从而检测到掺入的核苷酸的身份。
18.本文中公开的是一种用于控制被栓系至给定导电通道的聚合酶分子的数量的方法。本公开提供了可控地将足够少数量的聚合酶栓系至导电通道以避免检测到太多,包括多个不同的核苷酸掺入事件。还提供了的是用足够的键合强度将聚合酶栓系至导电通道,使得聚合酶可以保持与导电通道的键合持续期望的时间。
19.本公开提供了将核苷酸聚合酶固定或附接至装置表面以检测核苷酸至新生核苷酸链或与模板互补的引物中的掺入,从而确定模板中一个或多个核苷酸身份的实例。在一
个实例中,附接足够牢固或持久以防止聚合酶从基质不想要的分离,例如在一个或多个过程中作为用于鉴定模板中一个或多个核苷酸的测序、基因分型或相关方法的一部分。附接也可以是可逆的。例如,如果聚合酶的保真度、选择性、效率、聚合酶活性或其他特征变差或有变差的风险,如本文中所公开的,聚合酶可可控地从基质释放并且新的聚合酶可附接至基质。
20.还如本文中所公开的,可以控制固定或附接至基质的多核苷酸的数量。在一些边合成边测序或相关的方法中,如本文中所公开的,获得了预先确定的、低的或通常可控的数量的附接或连接至基质的聚合酶分子。例如,在一些边合成边测序或相关的方法中,模板分子中核苷酸的身份(例如其是否包含腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶、尿嘧啶作为它的含氮碱基)是通过鉴定由聚合酶掺入到与模板杂交的新生多核苷酸链或引物中的与其互补的核苷酸来确定的。因此,用于通过聚合酶添加至新生链或模板的核苷酸可以带有或包含表示其身份的标记或标签。通过聚合酶掺入的核苷酸的检测从而间接指示模板的互补核苷酸的身份。
21.例如,通过聚合酶掺入的核苷酸可以包含或包括带电荷的标签或电荷标签。当在聚合过程中通过聚合酶将这种电荷标签的核苷酸及其互补碱基整合到模板中时,电荷标签可由固定或附接聚合酶的基质感测,其中所述基质包括导电通道。用于检测包含电荷的修饰核苷酸的导电通道可以响应于周围电场。通过将具有电荷的修饰核苷酸定位在导电通道表面的附近来调节该电场。在某些情况下,例如如果溶液中的盐或其他离子可屏蔽导电通道检测到的电荷,电荷标签与表面的紧密接近会很重要。一个典型的屏蔽长度称为德拜长度,超过该长度,导电通道无法检测到电荷。
22.例如,导电通道可以是纳米结构的晶体管,例如纳米线或其他纳米级的、电荷栅控的、半导电的纳米结构。纳米线可以具有约10nm至约100nm之间的直径和约50nm至约300nm之间的长度。例如,纳米线可以具有约30nm的直径和约100nm至约150nm之间(例如约130nm)的长度。在其他实例中,纳米线的长度可以是5nm至5μm,中的任何长度,例如约50nm至约100nm(长度约50nm、约60nm、约70nm、约80nm、约90nm或长度约100nm),或约100nm至约150nm(长度约100nm、约110nm、约120nm、约130nm、约140nm或长度约150nm),或约150nm至约200nm(长度约150nm、约160nm、约170nm、约180nm、约190nm或长度约200nm),或约200nm至约250nm(长度约200nm、约210nm、约220nm、约230nm、约240nm或长度约250nm),或约250nm至约300nm(长度约250nm、约260nm、约270nm、约280nm、约290nm或长度约300nm),或约300nm至约350nm(长度约300nm、约310nm、约320nm、约330nm、约340nm或长度约350nm),或约350nm至约400nm(长度约350nm、约360nm、约370nm、约380nm、约390nm或长度约400nm),或约400nm至约500nm(长度约400nm、约410nm、约420nm、约430nm、约440nm或长度约450nm),或约500nm至约750nm(长度约500nm、约550nm、约600nm、约650nm、约700nm或长度约750nm),或约750nm至约1μm(长度约750nm、约800nm、约850nm、约900nm、约950nm或长度约1μm),或约1μm至约1.5μm(长度约1μm、约1.1μm、约1.2μm、约1.3μm、约1.4μm或长度约1.5μm),或约1.5μm至约2μm(长度约1.5μm、约1.6μm、约1.7μm、约1.8μm、约1.9μm或长度约2.0μm),或约2.0μm至约2.5μm(长度约2.0μm、约2.1μm、约2.2μm、约2.3μm、约2.4μm或长度约2.5μm),或约2.5μm至约3.0μm(长度约2.5μm、约2.6μm、约2.7μm、约2.8μm、约2.9μm或长度约3.0μm),或约3.0μm至约3.5μm(长度约3.0μm、约3.1μm、约3.2μm、约3.3μm、约3.4μm或长度约3.5μm),或约3.5μm至约4.0μm(长度约
479,329
‑
337(2011);其每一个的全部内容均通过引用并入本文中)。在美国专利公开号2013/0078622a1中阐述了可在本公开的方法和装置中使用的fet和swnt导电通道的实例,其全部内容通过引用并入本文中。
28.图1的端子s、d可以包含任何合适的导电材料。合适的源极和漏级材料的实例包括钴、硅化钴、镍、硅化镍、铝、钨、铜、钛、钼、铟锡氧化物(ito)、铟锌氧化物、金、铂、碳等。
29.导电通道5可以包含能够氧化或还原氧化还原活性电荷标签的任何全导电或半导电的材料。所述材料可以包含有机材料、无机材料或两者。合适的通道材料的一些实例包括硅,碳(例如玻璃碳、石墨烯等),聚合物(例如导电聚合物(例如聚吡咯、聚苯胺、聚噻吩、掺杂有聚(4
‑
苯乙烯磺酸盐)的聚(3,4
‑
乙烯二氧噻吩)(pedot
‑
pss)等))、金属、生物分子等。电力导电通道5可以将反应组分(例如标记核苷酸)的到达或离开转换为电信号。本文中公开的实例中,电力导电通道5还可以通过其与标记核苷酸的氧化还原活性电荷标签的相互作用将两个反应组分(模板核酸和标记核苷酸的核苷酸)之间的相互作用转化为可检测的信号。
30.在一些实例中,导电通道5还可以是纳米结构,其具有至少一个纳米级的尺寸(范围从1nm至小于1μm)。在一个实例中,该尺寸指最大尺寸。作为实例,电力导电通道5是半导体结构纳米结构、石墨烯纳米结构、金属纳米结构和导电聚合物纳米结构。纳米结构可以是多璧或单璧纳米管、纳米线、纳米带等。
31.在特定实例中,本公开的装置或方法可以使用深度缩放的finfet晶体管作为单分子导电通道。finfet导电通道得益于领先的半导体制造商已在开发的技术。此外,可以使用先前公布的组分,其包括但不限于(1)如choi等,science,335,319(2012)中描述的用于将溶菌酶固定在cnt上以实时观察酶持续合成能力的那些;(2)如olsen等,j.amer.chem.soc.,135,7885(2013)中描述的用于将pol1klenow片段固定在cnt上并实时观察dna持续合成能力的那些;(3)如chi等,nanolett 13,625(2013)中描述的用于阐明由于蛋白质变构运动引起的带电残基移动的转导机制的那些。本方法还可以采用美国专利公开号2013/0078622 a1中所述的装置、装置的组件和方法。上述参考文献的每一个的全部内容均通过引用并入本文中。
32.如在本文中所使用的,当用于项目集合时,术语“每个/每一个(each)”旨在说明集合中的单个项目,但不一定指集合中的每个项目。如果明确的公开或上下文清楚表明另有规定,则可发生例外。
33.如在本文中所使用的,当用于数量、尺寸或测量时,术语“约”包括可以与后面跟着的数字最多相差5%的值,例如“约100”表示“95至105”。
34.如在本文中所使用的,当用于反应组分时,术语“标记”旨在表示可检测的反应组分或反应组分的可检测部分。有用的标记是可以被导电通道检测的电荷标记(也称为电荷标签)。标记可以是待检测的反应组分所固有的(例如聚合酶的带电氨基酸)或标记可以是反应组分以外的(例如氨基酸的非天然存在的修饰)。在一些实例中,标记可包括具有单独功能的多个部分。例如,标记可包含接头组分(例如核酸)和电荷标签组分。
35.如在本文中所使用的,术语“核酸”旨在与其在本领域中的使用相一致,并且包含天然存在的核酸或其功能类似物。特别有用的功能类似物能够以序列特异性的方式与核酸杂交,或能够用作特定核苷酸序列的复制的模板。天然存在的核酸通常具有包含磷酸二酯
键的主链。类似物结构可具有替代的主链链接,其包括本领域已知的各种主链,例如肽核酸(pna)或锁核酸(lna)。天然存在的核酸通常具有脱氧核糖(例如在脱氧核糖核酸(dna)中发现的)或核糖(例如在核糖核酸(rna)中发现的)。
36.核酸可包含本领域已知的这些糖部分的各种类似物中的任何一种。核酸可包含天然或非天然碱基。在这方面中,天然脱氧核糖核酸可具有一个或多个选自腺嘌呤、胸腺嘧啶、胞嘧啶或尿嘧啶的碱基,而核糖核酸可具有一个或多个选自尿嘧啶、腺嘧啶、胞嘧啶或鸟嘌呤的碱基。可以包含在核酸中的有用的非天然碱基是本领域已知的。
37.如在本文中所使用的,术语“核苷酸”旨在包括天然核苷酸、其类似物、核糖核苷酸、脱氧核糖核苷酸、双脱氧核糖核苷酸以及其他被称为核苷酸的分子。该术语可用于指存在于聚合物中的单体单元,例如以识别存在于dna或rna链中的亚基。该术语还可用于指不一定存在于聚合物中的分子,例如能够通过聚合酶以模板依赖性方式掺入多核苷酸中的分子。该术语可以指在5'碳上具有例如0、1、2、3或更多磷酸酯的核苷单元。例如,四磷酸核苷酸、五磷酸核苷酸和六磷酸核苷酸可以特别有用,在5'碳上具有6个以上磷酸酯(例如7、8、9、10或更多个磷酸酯)的核苷酸也可以特别有用。示例性天然核苷酸包括但不限于atp、utp、ctp和gtp(统称为ntp),和adp、udp、cdp和gdp(统称为nmp),或datp、dttp、dctp和dgtp(统称为dntp),和dadp、dtdp、dcdp和dgdp(统称为dndp),和damp、dcmp、dcmp和dgmp(dnmp)。示例性核苷酸可无例外地包括任何nmp、dnmp、ndp、dndp、ntp、dntp和其他nxp和dnxp(其中x代表2至10的数字)(统称为npp)。
38.非天然核苷酸在本文中也称为核苷酸类似物,其包括不存在于天然生物系统中或基本上不通过聚合酶在其天然环境中(例如在表达该聚合酶的非重组细胞中)掺入至多核苷酸中的那些。特别有用的非天然核苷酸包括那些以比另一个核苷酸(例如与同一watson
‑
crick互补碱基碱基配对的天然核苷酸)通过聚合酶掺入至多核苷酸链中的速率实质更快或更慢的速率,通过聚合酶掺入至多核苷酸链中的那些。作为这种实质更快或更慢速率的实例,非天然核苷酸可以以相比于天然核苷酸的掺入速率至少相差约2倍(例如至少相差约5倍、相差约10倍、相差约25倍、相差约50倍、相差约100倍、相差约1000倍、相差约10000倍或更多)的速率掺入。非天然核苷酸可以在掺入至多核苷酸中后进一步延伸。实例包括具有3'羟基的核苷酸类似物或在3'位具有可逆终止子部分的核苷酸类似物,所述可逆终止子部分可以被去除以允许掺入核苷酸类似物的多核苷酸的进一步的延伸。可以使用的可逆终止子部分的实例描述于例如美国专利号7,427,673、7,414,116和7,057,026和pct公开号wo 91/06678和wo 07/123744中,其每一个的全部内容均通过引用并入本文中。应当理解,在一些实例中,具有3'终止子部分或缺乏3'羟基的核苷酸类似物(例如双脱氧核苷酸类似物)可以在掺入核苷酸类似物的多核苷酸不进一步延伸的条件下使用。在一些实例中,核苷酸可不包含可逆终止子部分,或者核苷酸将不包含不可逆终止子部分或者核苷酸将完全不包含任何终止子部分。在5'位处具有修饰的核苷酸类似物也是有用的。
39.如在本文中所使用的,术语“反应组分”旨在表示参与反应的分子。实例包括在反应中消耗的反应物、由反应产生的产物、促进反应的催化剂(例如酶)、溶剂、盐、缓冲液和其他分子。
40.如在本文中所使用的,当用于核苷酸时,术语“终止子部分”指抑制或阻止核苷酸形成与第二核苷酸的共价链接的核苷酸的一部分。例如,在核苷酸具有戊糖部分的情况下,
终止子部分可以阻止在核苷酸的3'氧与第二核苷酸的5'磷酸之间形成磷酸二酯键。终止子部分可以是作为存在于核苷酸聚合物中的单体单元的核苷酸的一部分,或者终止子部分可以是游离核苷酸(例如核苷酸三磷酸)的一部分。作为核苷酸的一部分的终止子部分可以是可逆的,从而可以修饰终止子部分以使核苷酸能够与第二核苷酸形成共价链接。在特定实例中,终止子部分(例如可逆终止子部分)可以附接至核苷酸类似物的戊糖部分的3'位置或2'位置。
41.多种聚合酶中的任何一种均可用于本文所述的方法或组合物中,包括例如从生物系统及其功能变体中分离出的基于蛋白质的酶。除非另有说明,否则对特定聚合酶的引用(例如以下示例的那些)应理解为包含其功能变体。聚合酶的特别有用的功能是使用现有的核酸作为模板来催化核酸链的聚合。有用的其他功能在本文中的其他地方描述。有用的聚合酶的实例包括dna聚合酶和rna聚合酶,其功能片段和包含它们的重组融合肽。示例性dna聚合酶包括已经通过结构同源性被分类为标记为a、b、c、d、x、y和rt的家族的那些。在家族a中的dna聚合酶包括例如t7 dna聚合酶、真核线粒体dna聚合酶γ、大肠杆菌dna pol i(包括klenow片段)、水生栖热菌pol i和嗜热脂肪芽孢杆菌pol i。在家族b中的dna聚合酶包括例如真核dna聚合酶a、6和e,dna聚合酶c,t4 dna聚合酶,phi29 dna聚合酶,9
°
n
tm
和rb69噬菌体dna聚合酶。家族c包括例如大肠杆菌dna聚合酶iiα亚基。家族d包括例如衍生自古细菌的广古菌门亚域(euryarchaeota subdomain)的聚合酶。在家族x中的dna聚合酶包括例如真核聚合酶polβ、polσ、polλ、和pol mu,和酿酒酵母pol4。在家族y中的dna聚合酶包括例如polη、polι(pol iota)、polκ、大肠杆菌pol iv(dinb)和大肠杆菌pol v(umud'2c)。dna聚合酶的rt(逆转录酶)家族包括例如逆转录病毒逆转录酶和真核端粒酶。rna聚合酶的实例包括但不限于病毒rna聚合酶(例如t7 rna聚合酶),真核rna聚合酶(例如rna聚合酶i、rna聚合酶ii、rna聚合酶iii、rna聚合酶iv和rna聚合酶v)和古细菌rna聚合酶。在美国专利号8,460,910(其全部内容并入本文中)中公开的其他的聚合酶也被包括于本文中提及的聚合酶中,任何其他功能性聚合酶(包括具有通过与上述聚合酶中的任何一种进行比较而修饰的序列的聚合酶)也被包括于其中,所述聚合酶仅作为非限制性实例的清单提供。
42.会期望在聚合酶和导电通道之间形成足够牢固的附接以在测序或其他反应过程中(例如在连续给药和去除含有各种反应溶剂的溶液的过程中)维持重复的洗涤或加工过程。sbs和相关技术的各种应用采用固态基质和溶液承载试剂的运动和/或溶液中的试剂的微流体流、正压或负压流、被动流或其他流体运动以支持试剂至适当部位的结合和在试剂使用和清洗步骤中对缓冲液、反应组分、试剂和其他化合物的彻底分配或去除。聚合酶至导电通道的附接可以是有利地足够稳定的以承受导电通道相对于反应溶液的这种运动或仅是时间的流逝,而聚合酶不会从导电通道分离。
43.如本文中所公开的,聚合酶可以通过结合部分的添加来修饰,并且附接部分可以结合至导电通道,使得聚合酶可以附接或结合至导电通道。结合部分和附接部分之间的附接可以是适当牢固的以承受如上所述的潜在破坏。在一些实例中,结合部分可包含聚合物或一个或多个亚基的其他重复,其中所述聚合物比单体更牢固地或更有效地结合至所述附接部分。在进一步的实例中,聚合酶可包含形成结合部分络合物的多种聚合物。类似地,附接部分可包含能够与聚合酶的结合部分形成附接的化学组合物。所述化学组合物可包含可以一起附接或结合至结合部分的官能团的集合。在一些实例中,导电通道可以包括多个附
接部分的络合物(例如单个附接部分的多个拷贝)以加强或增强与聚合酶的结合部分的结合。
44.在一些实例中,导电通道的一个或多个附接部分与聚合酶的一个或多个结合部分的附接或键合可以通过或需要金属或其他离子或结合辅助因子的存在而增强,否则聚合酶和导电通道将只能彼此微弱地附接或结合或根本无法附接或结合。在这样的实例中,可以将这样的结合辅助因子添加至导电通道和聚合酶,使得它们的附接部分和结合部分可以彼此附接。随后,如果期望从导电通道去除聚合酶,则可以去除金属或其他离子或结合辅助因子,从而破坏或切断导电通道和聚合酶之间的附接。例如,可以施用螯合剂,其中所述螯合剂隔离金属或其他离子或结合辅助因子,从而防止其与附接部分和结合部分结合。
45.在另一个实例中,如果期望从导电通道去除聚合酶,则可以添加与导电通道的附接部分竞争至聚合酶的结合部分的结合或与聚合酶的结合部分竞争至导电通道的附接部分的结合的分子,从而破坏附接部分和结合部分之间的结合。因此,在导电通道包括与聚合酶中包含的结合部分b结合的附接部分a的情况下,过量添加的未结合至导电通道的游离分子a可以在与导电通道附接部分的部分a竞争至聚合酶的结合部分b的结合中胜出。然后,聚合酶的结合部分b将结合至游离部分a(而非导电通道附接部分的部分a),从而从导电通道分离。或者,过量添加的未结合至导电通道的游离分子b可以在与聚合酶结合部分的部分b竞争至导电通道的附接部分a的结合中胜出。然后,导电通道的附接部分a将结合至游离部分b(而非聚合酶结合部分的部分b),从而使得聚合酶从导电通道分离。
46.在聚合酶从导电通道分离后,无论是通过去除或螯合金属离子或其他离子或其他结合辅助因子,还是通过引入过量的游离附接部分或结合部分分子,聚合酶随后都可以与导电通道再次附接。例如,金属离子或其他离子或其他结合辅助因子可以被置换或其螯合剂可以被去除,或游离附接部分或游离结合部分分子可以被去除,使得在重新引入包含结合部分的聚合酶时可以附接至导电通道的附接部分。
47.附接部分和结合部分的非限制性实例示于图2中。在该实例中,附接部分包含次氮基三乙酸(nta),也称为n,n
‑
双(羧甲基)甘氨酸:
[0048][0049]
nta在镍离子的存在下形成与多聚组氨酸的附接,例如含有六个连续组氨酸氨基酸的六肽标签(6
‑
his)。其他实例可包含更多或更少组氨酸残基作为结合部分。图2显示了支撑物(例如导电通道),其包含nta附接部分,所述nta附接部分与键合至6
‑
his结合部分的镍离子络合(ni
‑
nta)。根据这样的实例,导电通道可以包括一个或多个nta部分,并且聚合酶分子可以包含组氨酸标签(例如6
‑
his标签)。如本文所公开的,一个或多个附接分子(例如nta部分)可以共价地或非共价地键合至导电通道,用于共价地或非共价地结合至一个或多个结合部分,例如共价地或非共价地键合至聚合酶的组氨酸残基。
[0050]
在该实例中,在镍螯合剂(例如edta)的存在下,ni
‑
nta与6
‑
his标签的结合可被破
坏。通过添加edta而达成的镍螯合破坏了nta至6
‑
his的附接,从而导致聚合酶从导电通道分离。在另一个实例中,可以添加过量游离咪唑或包含咪唑基团的游离化合物。如图2所示,组氨酸包含结合至ni
‑
nta的咪唑基团。过量的游离咪唑可在与组氨酸咪唑基团竞争至导电通道的ni
‑
nta的结合中胜出,从而使聚合酶从导电通道分离。
[0051]
在一些应用中,会期望增加每个聚合酶的附接部分
‑
结合部分键数,以便增强聚合酶与导电通道的结合。每个导电通道的附接部分数量的增加可以允许聚合酶更牢固地附接至导电通道,使得无意的或不需要的分离的可能性降至最低。实现此目的的一种方法可以是不加区别地增加单独地附接至导电通道的附接部分的数量。在附接部分(例如nta部分)单独地结合至导电通道的一个实例中,只要增加键合至导电通道的nta部分的密度就可导致结合部分(例如多聚组氨酸标签)与导电通道的更多附接点。
[0052]
但是,这种方法会有几个不利的缺点。一个缺点可以是,将单个附接部分(例如nta)单独地结合至导电通道的表面可导致其在空间上彼此分离的nta部分,使得它们不会有助于增加组氨酸标签的结合强度。以这种方式在空间上彼此分开的nta部分可各自结合至聚合酶的组氨酸标签,但不允许每个导电通道结合多个nta部分以与聚合酶的给定组氨酸标签结合。因此,仅通过增加每个导电通道的单独结合的附接部分(例如nta)的数量,不能获得或不能最大化加强聚合酶和导电通道之间的键合的预期益处。
[0053]
试图只通过增加每个导电通道单独结合的附接部分(例如多聚组氨酸标签)的数量来增加聚合酶与导电通道的结合强度的另一个可能的缺点可以是失去对每个导电通道可能结合的一定数量的聚合酶分子的控制。在一些实例中,会期望每个导电通道仅结合一个聚合酶分子。如上所述,通过导电通道确定一个或多个模板分子的身份可能是由于聚合酶将核苷酸与模板相关联并将核苷酸附接至新生链而产生的。核苷酸上的电荷标签可以被导电通道感测到,从而改变通过所述通道的电流。在一些实例中,不同类型的核苷酸可具有不同于彼此的电荷标签,使得导电通道不同地响应,所述不同响应取决于哪种类型的核苷酸正被聚合酶掺入至生长的新生链中。通过外推法来检测以这种方式掺入的核苷酸的类型允许模板的互补核苷酸的识别。
[0054]
对于这种方法,如果每个导电通道结合一个以上的活性聚合酶,则在核苷酸掺入的检测中会有增加的噪音。如果每个导电通道结合两个或更多活性聚合酶,则其每一个都可以结合模板分子并催化互补新生链的形成。在这样的实例中,一种聚合酶可以掺入与模板的一种核苷酸互补的一种类型的核苷酸,而另一种聚合酶掺入与另一模板分子的另一核苷酸互补的另一类型的核苷酸。导电通道可检测两种核苷酸,或者核苷酸的电荷标签会相互干扰,并导致导电通道的读数不正确或读数相互矛盾。为了避免这样的结果,会期望防止每个导电通道中多于一个的聚合酶的结合。如果多个附接部分(例如nta)独立地结合至导电通道,则其中一些可结合至不同的聚合酶分子,而不是每个导电通道的所有这些结合的附接部分均与相同的聚合酶结合。因此,每个导电通道可以结合一个以上的聚合酶,而非无法实现或最小化聚合酶和导电通道之间键合的预期增强。
[0055]
本文公开了一种导电通道,以及用于制造和使用这种导电通道的方法,其中所述导电通道包括络合物中与其结合的多个附接部分。每个导电通道附接的多个附接部分的络合物可以克服多个附接部分单独地连接至导电通道的上述缺点。在一个实例中,多个附接部分的单个络合物可以结合每个导电通道。以这种方式,附接部分的络合物中的多个附接
部分可以彼此足够接近地存在,使得它们将共同地结合至彼此相通的聚合酶的一个或多个结合部分。附接部分的络合物与导电通道的结合可以获得增强聚合酶对导电通道的结合的益处。此外,控制每个导电通道结合的许多附接部分的络合物可以最小化,或者在一种情况下完全防止过多的聚合酶或比期望更多的聚合酶非理想地结合至导电通道。
[0056]
尽管在一些实例中会期望每个导电通道有一种活性聚合酶,但在其他实例中,会期望每个导电通道结合多于一种聚合酶。例如,在每个导电通道只有一个模板分子可用于聚合酶反应的条件下,可以最小化或避免来自每个导电通道的多个聚合酶反应受到干扰的风险,每个导电通道结合了多于一个的聚合酶分子。并且在一些实例中,会期望每个导电通道结合多于一种的聚合酶。例如,在每个导电通道只有一个模板分子可用于聚合酶反应的情况下,期望每个导电通道结合多于一种的活性聚合酶以增强模板分子与聚合酶结合的可能性,从而发生聚合酶反应。在其他实例中,会期望多于一种聚合酶与导电通道结合,例如在存在大量聚合酶并且一定比例的聚合酶可能是无活性的或者低效率或生产力的情况下。在这种情况下,会期望每个导电通道结合多于一种聚合酶,以在不牺牲信噪比的情况下,在每个导电通道上达到所期望的水平。从以下内容可以清楚地看出,根据本公开,如在给定情况下所期望的,控制每个导电通道的附接部分的络合物的数量,每个导电通道多于一种聚合酶可允许每个导电通道结合一种或更多的聚合酶。例如,一个、两个、三个、四个、五个或更多聚合酶分子可以根据本公开以受控的方式与导电通道结合。但是如果控制每个导电通道结合的附接部分的数量,则每簇可由于其包含彼此足够接近的多个附接部分的性质而导致每个聚合酶的结合强度增强,所述性质使得它们中的每一个或大多数结合至同一聚合酶的一个或多个结合部分。
[0057]
附接部分的络合物可以通过构建分支的树状或树枝状大分子结构附接至导电通道。在一个实例中,作为第一代nta,nta可以结合至导电通道。第二代nta部分可以附接至第一代nta的羧酸基团。从第一代nta的单一附接点开始,第二代nta的添加会导致组氨酸标签的三个潜在的ni
‑
nta附接位点。然后可以将第三代nta部分附接至第二代nta的羧酸基团。从第一代nta的单一附接点开始,第二代至第三代nta的添加会导致组氨酸标签的九个潜在的ni
‑
nta附接位点。然后可以将更多代的nta添加到最后一代中,从而逐步地增加每个导电通道的附接部分的数量,以增强聚合酶的结合强度。可以添加四、五或更多代的nta,每个附接部分络合物产生27、81或三倍的nta部分。
[0058]
可以使用将第一代nta附接至导电通道的任何合适的方法。附接至固体基质300(例如导电通道的表面)的附接部分的示例性实例在图3中示出。基质310可以是导电通道的表面或导电通道的修饰表面。可以与聚合酶附接的导电通道的表面中可以包含多种材料,其包含如上所述的表面通道的可能的组分。实例可以包括氮氧化硅(sion)、二氧化硅(sio2)或二氧化铪(hfo2)。
[0059]
可以通过表面修饰剂320来修饰基质310的表面,该表面修饰剂允许接头330附接至表面310。接头320可在其每一端上具有反应性官能团,例如在基质310附近的近端x和基质远端的远端y。可以选择接头330的反应性基团x以便与表面修饰剂320反应。然后将附接部分340附接至接头330。附接部分340可以具有反应性基团z,其可与接头330的远端反应性基团y反应。通过用表面修饰剂320修饰表面310,可以将接头330附接至其上,并且附接部分340附接至接头330,从而形成从附接部分340至表面310的桥。在一些实例中,可以没有接头
330,并且附接至附接部分340的反应性基团z可以替代地直接结合至导电通道310的接头320。可以使用表面活性剂320和接头基团330的近端反应性基团x和接头330的远端反应性基团y和附接至附接部分340的反应性基团z的许多合适的配对。可能配对的非排他性列表在表1中给出。
[0060]
表1:用于将附接部分附接至导电通道的反应性基团的配对的非限制性实例
[0061]
[0062]
[0063][0064]
aptms=(3
‑
氨基丙基)三甲氧基硅烷;aptes=(3
‑
氨基丙基)三乙氧基硅烷;c3
‑
叠氮基硅烷=3
‑
叠氮丙基三乙氧基硅烷;c11
‑
叠氮基硅烷=11
‑
叠氮二甲基三甲氧基硅烷;pditc=对苯二异硫氰酸酯;dbco=二苯并环辛炔;tco=反式环辛烯。
[0065]
在一些实例中,接头330可以在一个步骤中结合至表面修饰剂320,随后在另一个步骤中将附接部分340附接至接头330。在另一个实例中,接头330可以在一个步骤中结合至附接部分340,然后在另一个步骤中将接头结合至表面修饰剂320。在另一个实例中,接头330可以在同一步骤中结合至表面修饰剂320和附接部分340。
[0066]
在一个实例中,可以通过用(3
‑
氨基丙基)三甲氧基硅烷(aptms)进行气相硅烷化将氨基作为表面修饰剂添加至导电通道的表面。随后,可以孵育双功能n
‑
羟基丁二酰亚胺
‑
聚乙二醇马来酰亚胺(nhs
‑
peg
n
‑
马来酰亚胺)接头以允许nhs的反应与导电通道表面上的氨基反应并形成键,因此导致nhs
‑
peg
n
‑
马来酰亚胺接头的马来酰亚胺基团附接至导电通道的表面。随后的硫醇
‑
nta的孵育将导致硫醇
‑
马来酰亚胺反应,从而导致nta基团作为第一代nta与nhs
‑
peg
n
‑
马来酰亚胺接头共价地附接。在一些实例中,可以进行酰胺化的导电通道表面与nhs
‑
peg
n
‑
马来酰亚胺接头和硫醇
‑
nta的共孵育,以减少加工步骤的数量。
[0067]
然后可以通过用羰基二咪唑(cdi)活化nta的羧酸基团,将第二代nta加入到第一代nta中,从而导致每个nta附接三个咪唑基团。随后与nta
‑
胺共孵育会导致咪唑基团发生亲核取代,并且另一个nta占据每个咪唑位点。因此,可以从第一代nta形成第二代nta,其包含三个nta附接部分的络合物。下面显示了代表上述步骤的示例性方案。
[0068][0069]
在该实例中,如上所述,(3
‑
氨基丙基)三甲氧基硅烷(aptms)的气相硅烷化添加胺基到导电通道表面的羟基上。与nhs
‑
peg
n
‑
马来酰亚胺接头和硫醇
‑
nta的单锅孵育导致第一代nta附接至导电通道的表面。
[0070]
然后,可按上文描述的和下文说明的来进行第二代nta的添加。
[0071]
1)羧酸基的cdi活化
[0072][0073]
2)nta
‑
胺对咪唑的亲核取代
[0074][0075]
在上述步骤1)中,第一代nta的羧酸基团通过cdi在dmso中室温下孵育过夜来活化,释放出咪唑基团和二氧化碳,并在第一代nta的每个羧酸基团上连接一个咪唑基团。在第二步2)中,nta
‑
胺在ph 8.5的naco3存在下与室温反应过夜,导致咪唑基团被nta胺的胺取代并导致将三个第二代nta基团附接于第一代nta基团。在该实例中,重复上述步骤1)和2)导致第二代nta的形成,从而产生九个nta附接部分的络合物。
[0076]
第二代、第三代和随后的nta的产生也可以通过碳二亚胺交联化学来完成。例如,可以使用二环己基碳二亚胺(dcc),n,n
’‑
二异丙基碳二亚胺(dic)或1
‑
乙基
‑3‑
(3
‑
二甲基氨基丙基)碳二亚胺(edc)在nhs或磺基
‑
nhs的存在下活化第一代nta上的羧酸基团,以形成半稳定的胺反应性nhs酯,然后可将其与胺
‑
nta反应生成第二代nta。如本文所公开的,可以重复该过程以形成多代nta用于附接部分络合物的形成。可以使用前述用于添加多代nta的化学物质的不同组合,例如其中一种化学物质用于将一代nta添加到前一代nta,而另一种化学物质可用于形成下一代nta。
[0077]
可以通过修饰添加的一定数量的第一代nta基团来修饰每个导电通道的一定数量的附接部分络合物。例如,在上述方案中,加入的马来酰亚胺基团的数量可通过与具有不同量的nhs
‑
peg
n
‑
马来酰亚胺双功能接头的nsh
‑
peg
n
单功能接头一起孵育来修饰。对于具有较低浓度的nsh
‑
peg
n
‑
马来酰亚胺双功能接头而言,更多的胺基会与缺少马来酰亚胺基团的peg分子反应并结合,因此在随后与硫醇
‑
nta的孵育过程中不会与硫醇基团反应,从而导致每个固体基质或导电通道附接的nta附接部分络合物数量减少。相反,相对于nhs
‑
peg
n
单功能接头,增加nhs
‑
peg
n
‑
马来酰亚胺双功能接头的浓度增加导致与马来酰亚胺基团结合的peg分子占据更多的胺基,并且因此在随后与硫醇
‑
nta的孵育后,每个固体基质或导电通道具有更高数量的nta附接部分络合物。
[0078]
将附接部分附接至导电通道400的过程显示于图4中。基质410的表面(例如导电通道的固体表面)被硅烷化并添加反应性基团作为表面修饰剂420。然后表面修饰剂420与单功能接头分子430和双功能接头分子440的混合物反应。单功能接头430和双功能接头440各自具有近端官能团,其可以与表面修饰剂420反应以形成键合并附接至基质410。双功能接头440还具有远端官能团,其可以与附接部分分子450的反应性基团反应从而形成键并与其附接,单功能接头430中可以不存在远端官能团。通过改变与表面修饰剂420的反应中所包括的单功能接头430和双功能接头440的相对浓度,可以获得不同浓度或数量的附接部分到导电通道表面410的起始附接,在其上进一步形成附接部分络合物。
[0079]
根据本公开的方面所述的方法的工作流程示于图5a中。在该实例中,一至五个镍
‑
次氮基三乙酸络合物附接至导电通道。导电通道用于检测聚合酶将包含电荷标签的核苷酸掺入新生多核苷酸中。该实例还包括将包含组氨酸标签的聚合酶附接至一个或多个镍
‑
次氮基三乙酸络合物。另一个实例示于图5b中。在该实例中,一至五个镍
‑
次氮基三乙酸络合物附接至导电通道。导电通道用于检测聚合酶将包含电荷标签的核苷酸掺入新生多核苷酸中。该实例还包括将包含组氨酸标签的聚合酶附接至一个或多个镍
‑
次氮基三乙酸络合物。该实例还包括从一至五个镍
‑
次氮基三乙酸络合物中洗脱聚合酶。洗脱可以包括用乙二胺四乙酸或咪唑螯合镍。
[0080]
在一些实例中,在与nhs
‑
peg
n
‑
马来酰亚胺双功能接头的反应步骤中包括nhs
‑
peg
n
单功能接头时,nhs
‑
peg
n
‑
马来酰亚胺双功能接头与nhs
‑
peg
n
单功能接头的比例可以在1:5至1:100,000之间。
[0081]
如本文进一步公开的,可以有利地实现附接部分和导电通道表面之间不同长度的接头。作为非限制性的代表实例,nhs
‑
peg
n
‑
马来酰亚胺双功能接头包含大量peg残基以延长附接部分(例如nta)和导电通道表面之间的距离,而包含更少的peg残基以缩短附接部分和导电通道表面之间的距离。例如,对于nhs
‑
peg
n
‑
马来酰亚胺,n可以是0至约200之间的任何数,其包括0至约23、或约5、约6、约7、约8、约9、约10、约11、约12、约13、约14、约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约30、约35、约40、约45、约50、约55、约60、约65、约70、约75、约80、约85、约90、约95、约100、约110、约120、约130、约140、约150、约160、约170、约180、约190或约200。nhs
‑
peg
n
‑
马来酰亚胺双功能接头和nhs
‑
peg
n
单功能接头中,peg长度可以不同。可以基于多个特征来选择聚合酶和导电通道之间的距离,所述特征包括附接的聚合酶的所需迁移率或聚合酶与导电通道反应所需的距离。对于后者,例如,电荷标签从核苷酸延伸以通过聚合酶掺入新生链中的长度或距离可以与聚合酶与导电通道的优选距离有关。聚合酶与导电通道的距离可以是约1nm至约20nm之间,其包括约3至约10nm、或约1nm、约2nm、约3nm、约4nm、约5nm、约6nm、约7nm、约8nm、约9nm、约10nm、约11nm、约12nm、约13nm、约14nm、约15nm、约16nm、约17nm、约18nm、约19nm、或约20nm。
[0082]
在其他实例中,导电通道和附接部分之间的链接可以包括增强或促进通过导电通道对其的检测,所述化学特征在聚合过程中增强或促进核苷酸的电荷标签与导电通道的近端关联。在一些实例中,基于与模板链的互补性,电荷标签附接于核苷酸以通过聚合酶由所述链接掺入到新生链中。此外,附接部分和导电通道之间的附接可包括或可被称为系绳。为了增加、增强或促进电荷标签与导电通道之间的近端关联,例如增强通过导电通道对电荷标签的检测,核苷酸和系绳的链接可以包括对彼此具有静电吸引的化学特征。
[0083]
例如,系绳可包含被称为受体区域的多核苷酸序列,以及电荷标签与核苷酸之间的链接可以包含被称为特异性区域的多核苷酸序列。受体区域可进一步地与特异性区域互补或有一些互补,例如通过在可杂交的序列中包含核苷酸。在这样的实例中,在测序或其他过程中将电荷标签核苷酸掺入新生链中的过程中,特异性区域和受体区域之间的静电吸引可用于使电荷标签与导电通道紧密接近以通过导电通道促进、增强、加强或以其他方式有益于电荷标签的检测。包含在特异性区域和受体区域中的配对化学的实例(包括互补核苷酸(例如a、t、g或c或肌苷(可以与dna的所有四个天然核苷酸配对的通用碱基)的序列)在其他地方公开,例如在国际专利申请pct/us/2019/018565中公开,其全部内容通过引用并入本文。
[0084]
如应当理解的,其他附接化学可用于将附接部分附接至导电通道。上文给出的胺
‑
nhs和马来酰亚胺
‑
硫醇的实例只是代表性实例,并且可以使用其他已知的附接化学,例如上文表1中公开的那些或其他。这些或其他同样合适的附接化学中的任一个可用于将附接部分附接至导电通道的表面。
[0085]
可以通过掺入缺乏马来酰亚胺基团的nhs
‑
peg来产生nta以控制表面锚定点的数量。这产生了具有可控的nta官能团的第一代ni
‑
nta表面(图3)。第二代nta表面是通过以下步骤生成的:首先对第一代nta的羧酸基团进行羰基二咪唑(cdi)活化,然后与胺
‑
nta反应(图4)。可以重复此操作以生成第三代或甚至更高代的树枝状nta表面。第一代nta可以通过各种不同方式中的任何一种附接至导电通道的表面。
[0086]
可以根据以上定义来理解下文和权利要求书中阐述的实施例。
[0087]
实施例
[0088]
以下说明了根据本公开的方面所述的特定的非限制性实施例,但绝不旨在限制其范围。
[0089]
在一个实施例中,如所公开的,一代、二代或三代的nta作为测试的附接部分络合物在基质上形成,然后将其结合至含有6
‑
his作为如本文所公开的结合部分的绿色荧光蛋白(gfp)(具有包含peg2的接头)。然后在室温下保存不同的时间(长达一周)后,对荧光进行定量。为了附接6
‑
his标签的gfp,将nta表面先用40mm naoh或100mm nahco3洗涤,然后用水洗涤,确保cooh去质子化。为了加载ni,将表面在室温下用1%niso4孵育30min或1小时,然后用水洗涤3次,然后用蛋白质固定缓冲液(hepes缓冲液:50mm hepes,ph 7.5,500mm nacl,0.05%吐温
‑
20)洗涤2次。高盐浓度和去污剂有助于减少his标签蛋白的非特异性结合。然后将表面与所需浓度(例如1或10μg/ml)的6
‑
his
‑
gfp在固定缓冲液中孵育1小时,然后用缓冲液洗涤5次。
[0090]
使用fitc通道在typhoon扫描下对gfp中的荧光进行成像。通过以下步骤定量gfp的浓度:首先使用咪唑(100
‑
500mm)或edta(100
‑
500mm)从表面洗脱gfp,然后使用读板器测量板中洗脱的gfp的荧光强度,并用已知的gfp浓度绘制校准曲线。
[0091]
结果示于图6中。在附接至一代nta(左)、二代nta(中间)或三代nta(右)时测量gfp水平。在每组中,在用固定缓冲液冲洗后的不同时间后,测量荧光,如下所示(图6中展示的条形图中的每组条形,从左到右展示):0小时、1小时、3.5小时、1天、2天、5天和7天。包含引起的第三代ni
‑
nta的附接部分络合物导致6his
‑
gfp的最高结合,其在7天的时间段内也是最稳定的。从0至1小时之间的即刻下降可能是由于小百分比的不稳定地结合的gfp,而从2小时至7天存在的gfp水平代表了稳定的特异性结合。
[0092]
尽管本文已详细描述了实例,对于相关领域的技术人员将想而易见的是,在不背离本公开的精神的情况下,可以进行各种修改、添加、置换等,因此,这些被认为是在如所附权利要求书所限定的本公开的范围内。
[0093]
应当理解,本文中更详细讨论的前述概念或附加概念的所有组合(假设这样的概念并不相互矛盾)被认为是本公开的发明主题的一部分。特别地,出现在本公开结尾处的要求保护的主题的所有组合被认为是本文公开的发明主题的一部分。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1