联芳膦的制备方法与流程
1.本发明涉及适用作布赫瓦尔德(buchwald)膦配体的联芳膦的制备方法。
背景技术:
2.麻省理工学院的布赫瓦尔德教授课题组提出了一系列富含电子且体积大的膦(例如,专利文献1至5)。这些被称为布赫瓦尔德膦,其控制诸如c
‑
c、c
‑
n和c
‑
o键的各种键的形成的功能一直受到关注。
3.作为布赫瓦尔德膦配体,已知联芳膦,诸如t
‑
bubretphos、rockphoss和brettphos。
4.作为这些联芳膦的制备方法,例如,在以下专利文献5、非专利文献1和非专利文献2中,提出了包括根据反应流程1与格氏(grignard)试剂反应的步骤的方法。
5.rcaction schcmc(1)
[0006][0007]
reaction scheme(1):反应流程(1)
[0008]
libr or not:libr或无
[0009]
x=br or i:x=br或i
[0010]
r’=t
‑
bu or cy:r’=t
‑
bu或cy
[0011]
然而,由于在专利文献5、非专利文献1、非专利文献2中使用格氏试剂,因此需要单独调整试剂的步骤,使得反应和副产物处理复杂,这在工业上没有优势。此外,为了去除副产物以提高纯度,必须一次分离中间体(反应流程1中的化合物6)。
[0012]
引用列表
[0013]
专利文献
[0014]
专利文献1:国际公开号wo2000/02887
[0015]
专利文献2:国际公开号wo2002/085838
[0016]
专利文献3:国际公开号wo2004/052939
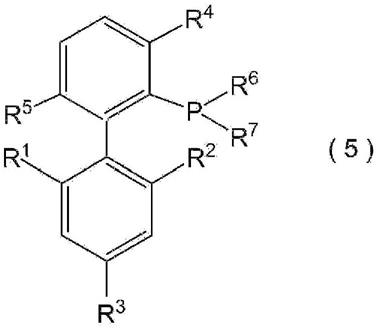
[0017]
专利文献4:国际公开号wo2006/074315
[0018]
专利文献5:国际公开号wo2009/076622
[0019]
非专利文献
[0020]
非专利文献1:先进合成与催化(advanced synthesis catalysis),2012,354,2031
‑
2037
[0021]
非专利文献2:美国化学学会杂志(journal of the american chemical society),2008,130,13552
‑
s.i.
技术实现要素:
[0022]
要解决的技术问题
[0023]
因此,本发明的一个目的是提供一种通过更方便和工业上有利的工艺,适用作布赫瓦尔德膦配体的联芳膦的制备方法。
[0024]
解决问题的技术方案
[0025]
作为针对这些问题的深入研究的结果,本发明人发现,通过进行一系列步骤,其至少包括使通过由以下通式(1)表示的卤代苯衍生物的锂化获得的锂化产物与由以下通式(2)表示的苯衍生物反应的步骤,可以以高纯度获得由以下通式(5)表示的目标联芳膦,从而完成了本发明。
[0026]
因此,本发明提供的第一项发明涉及一种联芳膦的制备方法,其包括:
[0027]
步骤a,使通过由下式(1)表示的卤代苯衍生物的锂化获得的锂化产物
[0028][0029]
其中r1至r3表示烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基或氨基,并且该烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基可以被烷基、环烷基、卤素基团、烷氧基取代;r1至r3可以是相同的基团或不同的基团;并且x1表示卤原子;
[0030]
与由以下通式(2)表示的苯衍生物反应:
[0031][0032]
其中r4至r5表示烷基、烷氧基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基或氨基;并且该烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基可以被烷基、环烷基、卤
素基团、烷氧基取代;r4至r5可以是相同的基团或不同的基团;并且x2表示卤原子;
[0033]
以获得由以下通式(3)表示的联苯衍生物:
[0034][0035]
其中r1至r5与上述相同;
[0036]
和后续步骤b,使联苯衍生物与由以下通式(4)表示的卤代膦反应:
[0037]
(r6)(r7)px3ꢀꢀꢀ
(4)
[0038]
其中r6至r7表示烷基、环烷基、芳基、杂芳基、芳烷基或杂芳烷基;并且r6至r7可以是相同的基团或不同的基团;该烷基、环烷基、芳基、杂芳基、芳烷基和杂芳烷基可以被烷基、环烷基、卤素基团、烷氧基取代;并且x3表示卤原子;
[0039]
联芳膦由下式(5)表示:
[0040][0041]
其中r1至r7与上述相同。
[0042]
本发明提供的第二项发明涉及一种联芳膦的制备方法,其包括:
[0043]
步骤a,使通过由下式(1)表示的卤代苯衍生物的锂化获得的锂化产物
[0044][0045]
其中r1至r3表示烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基或氨基,并且烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基可以被烷基、环烷基、卤素
基团或烷氧基取代;r1至r3可以是相同的基团或不同的基团;并且x1表示卤原子;
[0046]
与由以下通式(2)表示的苯衍生物反应:
[0047][0048]
其中r4至r5表示烷基、烷氧基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基或氨基;并且烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基可以被烷基、环烷基、卤素基团或烷氧基取代;r4至r5可以是相同的基团或不同的基团;并且x2表示卤原子;
[0049]
以获得由以下通式(3)表示的联苯衍生物:
[0050][0051]
其中r1至r5与上述相同;
[0052]
后续步骤c,使联苯衍生物与溴化剂或碘化剂反应,以获得由以下通式(6)表示的卤代联苯衍生物:
[0053][0054]
其中r1至r5与上述相同,并且a表示溴原子或碘原子;
[0055]
和后续步骤d,使通过卤代联苯衍生物的锂化获得的锂化产物与由以下通式(4)表示的卤代膦反应:
[0056]
(r6)(r7)px3(4)
[0057]
其中r6至r7表示烷基、环烷基、芳基、杂芳基、芳烷基或杂芳烷基;并且r6至r7可以
是相同的基团或不同的基团;烷基、环烷基、芳基、杂芳基、芳烷基和杂芳烷基可以被烷基、环烷基、卤素基团或烷氧基取代;并且x3表示卤原子;
[0058]
联芳膦由下式(5)表示:
[0059][0060]
其中r1至r7与上述相同。
[0061]
本发明提供的第三项发明涉及一种卤代联苯衍生物的制备方法,其包括:
[0062]
步骤a,使通过由下式(1)表示的卤代苯衍生物的锂化获得的锂化产物
[0063][0064]
其中r1至r3表示烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基或氨基,并且烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基可以被烷基、环烷基、卤素基团或烷氧基取代;r1至r3可以是相同的基团或不同的基团;并且x1表示卤原子;
[0065]
与由以下通式(2)表示的苯衍生物反应:
[0066][0067]
其中r4至r5表示烷基、烷氧基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基或氨基;并且烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基可以被烷基、环烷基、卤素基团或烷氧基取代;r4至r5可以是相同的基团或不同的基团;并且x2表示卤原子;
[0068]
以获得由以下通式(3)表示的联苯衍生物:
[0069][0070]
其中r1至r5与上述相同;
[0071]
以及后续步骤d,使联苯衍生物与溴化剂或碘化剂反应;
[0072]
卤代联苯衍生物由下式(6)表示:
[0073][0074]
其中r1至r5与上述相同,并且a表示溴原子或碘原子。
[0075]
发明的有益效果
[0076]
根据本发明,可以通过工业上有利的工艺以良好的纯度获得适用作布赫瓦尔德膦配体的联芳膦。
具体实施方式
[0077]
本发明基于其优选实施方式描述如下。
[0078]
本发明中的步骤a是使通过由通式(1)表示的卤代苯衍生物的锂化获得的锂化产物与由通式(2)表示的苯衍生物反应以获得由通式(3)表示的联苯衍生物。
[0079]
通式(1)中r1至r3的示例包括烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基。
[0080]
烷基的示例包括具有优选1至12个碳原子、更优选1至8个碳原子的直链或支链烷基。具体示例包括甲基、乙基、正丙基、异丙基、正丁基、2
‑
丁基、异丁基、叔丁基、正戊基、2
‑
戊基、叔戊基、2
‑
甲基丁基、3
‑
甲基丁基、2,2
‑
二甲基丙基、正己基、2
‑
己基、3
‑
己基、叔己基、2
‑
甲基戊基、3
‑
甲基戊基、4
‑
甲基戊基和5
‑
甲基戊基。
[0081]
环烷基的示例包括具有3至16个碳原子的环烷基。具体示例包括环丙基、环丁基、环戊基、环己基、2
‑
甲基环戊基、3
‑
甲基环戊基、环庚基、2
‑
甲基环己基、3
‑
甲基环己基和4
‑
甲基环己基。环烷基还包括多环烷基。其示例包括薄荷基、冰片基、降冰片基和金刚烷基。
[0082]
芳基的示例包括具有6至16个碳原子的苯基。其具体示例包括苯基、4
‑
甲基苯基、3
‑
甲基苯基、2
‑
甲基苯基和萘基。
[0083]
杂芳基的优选示例包括5元或6元单环芳族杂环基和多环芳族杂环基。杂芳基的示例包括含有1至3个杂原子诸如氮原子、氧原子和/或硫原子的芳族杂环基。其具体示例包括吡啶基、咪唑基、噻唑基、糠基、吡喃基、呋喃基、苯并呋喃基和噻吩基。
[0084]
芳烷基的示例包括具有7至12个碳原子的芳烷基。具体示例包括苄基、2
‑
苯基乙基、1
‑
苯基丙基、2
‑
苯基丙基、3
‑
苯基丙基、1
‑
苯基丁基、2
‑
苯基丁基、3
‑
苯基丁基、4
‑
苯基丁基、1
‑
苯基戊基、2
‑
苯基戊基、3
‑
苯基戊基、4
‑
苯基戊基、5
‑
苯基戊基、1
‑
苯基己基、2
‑
苯基己基、3
‑
苯基己基、4
‑
苯基己基、5
‑
苯基己基和6
‑
苯基己基。
[0085]
杂芳烷基具有其中烷基与杂芳基键合的结构。杂芳烷基的示例包括具有6至16个碳原子的杂芳烷基。其具体示例包括2
‑
吡啶基甲基、4
‑
吡啶基甲基、咪唑基甲基和噻唑基乙基。
[0086]
烷氧基是其中上述烷基、环烷基、芳基、杂芳基、芳烷基或杂芳烷基通过氧键合而成的基团。其示例包括甲氧基、乙氧基、苯氧基、苄氧基和对甲氧基苄氧基。
[0087]
烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基可以进一步具有取代基。取代基的示例包括烷基、环烷基、卤素基团和烷氧基。作为取代基的烷基、环烷基、卤素基团和烷氧基的示例包括与上述r1至r3的类型相似的那些。其中,优选具有1至10个碳原子的直链或支链烷基作为取代基。
[0088]
通式(1)中r1至r3各自可以是相同的基团或可以是不同的基团。优选的是,r1至r3是相同的基团。特别地,在本制备方法中,从制备适用作布赫瓦尔德膦配体的联芳膦的观点来看,优选但是r1至r3为异丙基。通式(1)中的x1类型的示例包括卤原子诸如氟、氯和溴。
[0089]
通式(2)中r4至r5的示例包括烷基、烷氧基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基和氨基。
[0090]
烷基的示例包括具有优选1至12个碳原子、更优选1至8个碳原子的直链或支链烷基。其具体示例包括甲基、乙基、正丙基、异丙基、正丁基、2
‑
丁基、异丁基、叔丁基、正戊基、2
‑
戊基、叔戊基、2
‑
甲基丁基、3
‑
甲基丁基、2,2
‑
二甲基丙基、正己基、2
‑
己基、3
‑
己基、叔己基、2
‑
甲基戊基、3
‑
甲基戊基、4
‑
甲基戊基和5
‑
甲基戊基。
[0091]
环烷基的示例包括具有3至16个碳原子的环烷基。其具体示例包括环丙基、环丁基、环戊基、环己基、2
‑
甲基环戊基、3
‑
甲基环戊基、环庚基、2
‑
甲基环己基、3
‑
甲基环己基和4
‑
甲基环己基。环烷基还包括多环烷基。其示例包括薄荷基、冰片基、降冰片基和金刚烷基。
[0092]
芳基的示例包括具有6至16个碳原子的苯基。其具体示例包括苯基、4
‑
甲基苯基、3
‑
甲基苯基、2
‑
甲基苯基和萘基。
[0093]
杂芳基的优选示例包括5元或6元单环芳族杂环基或多环芳族杂环基。杂芳基的示例包括含有1至3个杂原子诸如氮原子、氧原子和/或硫原子的芳族杂环基。其具体示例包括吡啶基、咪唑基、噻唑基、糠基、吡喃基、呋喃基、苯并呋喃基和噻吩基。
[0094]
芳烷基的示例包括具有7至12个碳原子的芳烷基。其具体示例包括苄基、2
‑
苯基乙基、1
‑
苯基丙基、2
‑
苯基丙基、3
‑
苯基丙基、1
‑
苯基丁基、2
‑
苯基丁基、3
‑
苯基丁基、4
‑
苯基丁基、1
‑
苯基戊基、2
‑
苯基戊基、3
‑
苯基戊基、4
‑
苯基戊基、5
‑
苯基戊基、1
‑
苯基己基、2
‑
苯基己基、3
‑
苯基己基、4
‑
苯基己基、5
‑
苯基己基和6
‑
苯基己基。
[0095]
杂芳烷基的示例包括具有6至16个碳原子的杂芳烷基,并且其具体示例包括2
‑
吡啶基甲基、4
‑
吡啶基甲基、咪唑基甲基和噻唑基乙基。
[0096]
烷氧基是其中上述烷基、环烷基、芳基、杂芳基、芳烷基或杂芳烷基通过氧键合而成的基团,并且其示例包括甲氧基、乙氧基和苯氧基。其示例包括苄氧基和对甲氧基苄氧基。
[0097]
烷基、环烷基、芳基、杂芳基、芳烷基、杂芳烷基、烷氧基和氨基可以进一步具有取代基。取代基的示例包括烷基、环烷基、卤素基团和烷氧基。顺便说一句,作为取代基的烷基、环烷基、卤素基团和烷氧基的示例包括与上述r4至r5的类型相似的那些。其中,优选具有1至10个碳原子的直链或支链烷基作为取代基。
[0098]
通式(2)中的r4至r5可以是相同的基团或不同的基团。特别地,在本制备方法中,从制备适用作布赫瓦尔德膦配体的联芳膦的观点来看,优选的是r4至r5为甲基或甲氧基。从类似的观点来看,优选的是r4至r5是相同的基团。通式(2)中的x2的类型的示例包括卤原子诸如氟、氯和溴。
[0099]
在步骤a的反应操作中,将由通式(1)表示的卤代苯衍生物锂化以制备含有所得锂化产物的溶液(下文中,在某些情况下也称为“液体a”)。此外,与液体a分开,制备了含有由通式(2)表示的苯衍生物的溶液(下文中,在某些情况下也称为“液体b”)。优选的是,通过将液体b添加到液体a中或通过将液体a添加到液体b中来随后进行反应。
[0100]
液体a是含有通过将锂化剂添加到含有由通式(1)表示的卤代苯衍生物的液体中而获得的含有卤代苯衍生物的锂化产物的溶液。从提高反应性的观点和控制副产物的观点来看,优选的是在液体a中由通式(1)表示的卤代苯衍生物的浓度为1质量%至30质量%,特别是5质量%至20质量%。
[0101]
作为液体a的锂化剂,例如,使用有机锂化合物。有机锂化合物的示例包括甲基锂、乙基锂、正丙基锂、仲丙基锂、正丁基锂、仲丁基锂和叔丁基锂。其中,从适当的碱性和充分的反应性的观点来看,优选正丁基锂。
[0102]
从经济性和反应性的观点来看,优选的是,就锂化剂与由通式(1)表示的卤代苯衍生物的摩尔比而言,锂化剂的添加量为2.0至7.0,特别是2.1至6.5。
[0103]
液体a中可以使用的溶剂没有特别限制,只要它是能够溶解由通式(1)表示的卤代苯衍生物和要产生的锂化产物且对反应呈惰性的溶剂即可。溶剂的示例包括四氢呋喃、环戊基甲基醚、叔丁基甲基醚、1,2
‑
二甲氧基乙烷、n,n
‑
二甲基甲酰胺、乙醚、二丁醚、二恶烷、己烷和甲苯。这些溶剂可以单独使用或作为混合溶剂使用。特别地,从锂化产物的溶解性的观点来看,优选四氢呋喃。
[0104]
从控制副产物的观点来看,锂化剂的添加温度优选地设定在
‑
80至20℃,更优选
‑
80至
‑
10℃。通过将锂化剂添加到含有由通式(1)表示的卤代苯衍生物的液体中,由通式(1)表示的卤代苯衍生物迅速锂化。根据需要,可以在锂化剂添加完成后继续进行老化反应,以完成锂化反应。
[0105]
液体b是将由通式(2)表示的苯衍生物溶解在溶剂中的溶液。从反应性和控制副产物的观点来看,优选的是,将液体b中由通式(2)表示的苯衍生物的浓度设定为5质量%至90质量%,特别是10质量%至50质量%。
[0106]
可用于液体b的溶剂没有特别限制,只要它是能够溶解由通式(2)表示的苯衍生物
且对反应呈惰性的溶剂即可。溶剂的示例包括四氢呋喃、环戊基甲基醚、叔丁基甲基醚、1,2
‑
二甲氧基乙烷、n,n
‑
二甲基甲酰胺、乙醚、二丁醚、二恶烷、己烷和甲苯。这些溶剂可以单独使用或作为混合溶剂使用。特别地,从极性和溶解性的观点来看,优选四氢呋喃。
[0107]
从提高收率同时控制副产物的观点来看,优选的是,进行液体a和液体b的混合使得液体a中由通式(1)表示的卤代苯衍生物与液体b中由通式(2)表示的苯衍生物的进料摩尔比设定为1.0至5.0。
[0108]
特别地,在根据下述“制备方法(1)”进行本制备方法的情况下,从提高收率和经济性的观点来看,优选的是添加液体a和液体b使得液体a中由通式(1)表示的卤代苯衍生物与液体b中由通式(2)表示的苯衍生物的进料摩尔比控制在1.0至5.0,特别是1.0至3.0,尤其是1.2至2.5。
[0109]
另外,在根据下述“制备方法(2)”进行本制备方法的情况下,从提高收率和经济性的观点来看,优选的是以相同方式进行添加,使得液体a中由通式(1)表示的卤代苯衍生物与液体b中由通式(2)表示的苯衍生物的进料摩尔比控制在1.0至5.0,特别是1.0至3.0,尤其是1.2至2.5。
[0110]
液体a和/或液体b的添加速率没有特别限制。从获得质量稳定的目标产物的观点来看,优选的是在恒定速率下进行添加。液体a和/或液体b的添加可以是连续的或间歇的。优选的是在液体a和液体b的混合期间,将混合液体的内部温度维持在下述的液体a和液体b的添加温度的优选范围内。
[0111]
从以高收率获得高纯度目标产物的观点来看,优选的是液体a和液体b的添加温度各自独立地控制在
‑
80至20℃,特别是
‑
80至
‑
10℃。
[0112]
在将液体a和液体b混合之后,根据需要,可以继续进行老化反应以完成反应。从加速反应和控制副产物的观点来看,优选的是老化反应的温度设定在
‑
80至20℃,特别是
‑
80至
‑
10℃。老化反应的完成可以通过气相色谱分析通过由(2)表示的苯衍生物的存在或不存在来确认。获得满意的目标产物的反应时间通常为1小时或更长,优选3至12小时,但取决于反应条件等。
[0113]
在本制备方法中,在步骤a之后,进行包括步骤b的以下(1)(下文中,在某些情况下称为“制备方法(1)”)或包括步骤c至d的以下(2)(下文中,在某些情况下称为“制备方法(2)”)以制备作为本制备方法的目标产物的由通式(5)表示的联芳膦。
[0114]
<制备方法(1)>
[0115]
步骤b是根据以下反应流程2通过使在步骤a中获得的联苯衍生物与由通式(4)表示的卤代膦反应制备由通式(5)表示的目标联芳膦的步骤:
[0116]
reaction scheme(2)
[0117][0118]
reaction scheme(2):反应流程(2)
[0119]
其中r1至r7和x3与上述相同。
[0120]
在本制备方法中,步骤b可以是与步骤a接续的反应,或在步骤a完成之后,从反应液中回收的由通式(3)表示的联苯衍生物可以根据需要进行纯化,然后进行步骤b。
[0121]
由通式(4)表示的卤代膦的式中的r6和r7表示烷基、环烷基、芳基、杂芳基、芳烷基或杂芳烷基。
[0122]
烷基的示例包括优选具有1至12个碳原子、更优选1至8个碳原子的直链或支链烷基。其具体示例包括甲基、乙基、正丙基、异丙基、正丁基、2
‑
丁基、异丁基、叔丁基、正戊基、2
‑
戊基、叔戊基、2
‑
甲基丁基、3
‑
甲基丁基、2,2
‑
二甲基丙基、正己基、2
‑
己基、3
‑
己基、叔己基、2
‑
甲基戊基、3
‑
甲基戊基、4
‑
甲基戊基和5
‑
甲基戊基。
[0123]
环烷基的示例包括具有3至16个碳原子的环烷基。其具体示例包括环丙基、环丁基、环戊基、环己基、2
‑
甲基环戊基、3
‑
甲基环戊基、环庚基、2
‑
甲基环己基、3
‑
甲基环己基和4
‑
甲基环己基。环烷基还包括多环烷基。其示例包括薄荷基、冰片基、降冰片基和金刚烷基。
[0124]
芳基的示例包括具有6至16个碳原子的苯基。其具体示例包括苯基、4
‑
甲基苯基、3
‑
甲基苯基、2
‑
甲基苯基和萘基。
[0125]
杂芳基的优选示例包括5元或6元单环芳族杂环基或多环芳族杂环基。杂芳基的示例包括含有1至3个杂原子诸如氮原子、氧原子和/或硫原子的芳族杂环基。其具体示例包括吡啶基、咪唑基、噻唑基、糠基、吡喃基、呋喃基、苯并呋喃基和噻吩基。
[0126]
芳烷基的示例包括具有7至12个碳原子的芳烷基。其具体示例包括苄基、2
‑
苯基乙基、1
‑
苯基丙基、2
‑
苯基丙基、3
‑
苯基丙基、1
‑
苯基丁基、2
‑
苯基丁基、3
‑
苯基丁基、4
‑
苯基丁基、1
‑
苯基戊基、2
‑
苯基戊基、3
‑
苯基戊基、4
‑
苯基戊基、5
‑
苯基戊基、1
‑
苯基己基、2
‑
苯基己基、3
‑
苯基己基、4
‑
苯基己基、5
‑
苯基己基和6
‑
苯基己基。
[0127]
杂芳烷基的示例包括具有6至16个碳原子的杂芳烷基,并且其具体示例包括2
‑
吡啶基甲基、4
‑
吡啶基甲基、咪唑基甲基和噻唑基乙基。
[0128]
烷基、环烷基、芳基、杂芳基、芳烷基和杂芳烷基可以进一步具有取代基。取代基的示例包括烷基、环烷基、卤素基团和烷氧基。作为取代基的烷基、环烷基、卤素基团和烷氧基的示例包括与上述r6和r4的类型相似的那些。特别地,优选的是,取代基是具有1至10个碳原子的直链或支链烷基。作为取代基的烷基、环烷基、卤素基团和烷氧基的示例包括与上述r6和r7的类型相似的那些。特别地,优选的是,取代基是具有1至10个碳原子的直链或支链烷基。
[0129]
通式(4)中的r6至r7可以是相同的基团或不同的基团。优选的是,r6至r7是相同的基团。特别地,在本制备方法中,从制备适用作布赫瓦尔德膦配体的联芳膦的观点来看,优选的是,r6至r7是金刚烷基、叔丁基或环己基。通式(1)中x3的类型的示例包括卤原子诸如氟、氯和溴。
[0130]
在步骤b中,优选的是使步骤a中获得的联苯衍生物与由通式(4)表示的卤代膦在溶剂中反应。b步骤中可以使用的溶剂没有特别限制,只要它是能够溶解由通式(3)表示的联苯衍生物且对通式(4)的卤代膦和由通式(5)表示的联芳膦呈惰性的溶剂即可。溶剂的示例包括四氢呋喃、环戊基甲基醚、叔丁基甲基醚、1,2
‑
二甲氧基乙烷、n,n
‑
二甲基甲酰胺、乙醚、二丁醚、二恶烷、己烷和甲苯。这些溶剂可以单独使用或作为混合溶剂使用。特别地,从极性和溶解性的观点来看,优选四氢呋喃。
[0131]
从经济性和反应性的观点来看,就通式(4)的卤代膦与由通式(3)表示的联苯衍生物的摩尔比而言,通式(4)的卤代膦的添加量设定为1.0至3.0,优选1.0至1.5。
[0132]
从加速反应和控制副产物的观点来看,步骤b中的反应温度优选设定为
‑
50至80℃,特别是
‑
30至50℃。
[0133]
步骤b中反应的完成可以通过气相色谱分析通过由(3)表示的联苯衍生物的存在或不存在来确认。获得满意的目标产物的反应时间通常为1小时或更长,优选1至10小时,但取决于反应条件等。
[0134]
在步骤b的反应完成之后,可以根据需要对所得的由通式(5)表示的联芳膦进行纯化,诸如重结晶、柱层析、萃取。
[0135]
<制备方法(2)>
[0136]
步骤c是根据以下反应流程3通过使在步骤a中获得的联苯衍生物与溴化剂或碘化剂反应而获得由通式(6)表示的卤代联苯衍生物的步骤:
[0137]
reaction scheme(3)
[0138][0139]
reaction scheme(3):反应流程(3)
[0140]
其中r1至r5与上述相同,并且a表示溴原子或碘原子。
[0141]
在本制备方法中,优选的是,步骤c是与步骤a接续进行的反应。
[0142]
根据步骤c的碘化剂的示例包括碘、n
‑
碘代琥珀酰亚胺、碘化钠、碘化钾等,其中,从原料通用且低成本的观点来看,优选使用碘。溴化剂的示例包括溴、n
‑
溴代琥珀酰亚胺、三溴化磷和溴化钾,其中,从原料通用且低成本的观点来看,优选使用溴。
[0143]
从经济性和反应性的观点来看,优选的是,就溴化剂或碘化剂与由通式(3)表示的联苯衍生物的摩尔比而言,溴化剂或碘化剂的添加量设定为1.0至5.0,特别是1.0至2.0。
[0144]
在步骤c中,优选的是,使在步骤a中获得的联苯衍生物与溴化剂或碘化剂在溶剂中反应。步骤c中可使用的溶剂没有特别限制,只要该溶剂能够溶解由通式(3)表示的联苯衍生物且对由通式(3)表示的联苯衍生物和由通式(6)表示的联苯衍生物呈惰性即可。溶剂的示例包括四氢呋喃、环戊基甲基醚、叔丁基甲基醚、1,2
‑
二甲氧基乙烷、n,n
‑
二甲基甲酰胺、乙醚、二丁醚、二恶烷、己烷和甲苯。这些溶剂可以单独使用或作为混合溶剂使用。其中,从反应性的观点来看,特别优选四氢呋喃。
[0145]
从控制反应性和副反应的观点来看,步骤c中的反应温度优选为
‑
80至50℃,更优选
‑
20至20℃。
[0146]
步骤c中反应的完成可以通过气相色谱分析通过由(3)表示的联苯衍生物的存在或不存在来确认。获得满意的目标产物的反应时间通常为1小时或更长,优选1至10小时,但取决于反应条件等。
[0147]
步骤d是根据以下反应流程4,通过将步骤c中获得的联苯溴衍生物或联苯碘衍生物用锂化剂锂化,并且然后使锂化产物与由通式(4)表示的卤代膦反应来制备由通式(5)表示的目标联芳膦的步骤:
[0148]
reaction scheme(4)
[0149][0150]
reaction scheme(4):反应流程(4)
[0151]
其中r1至r7、x3和a与上述相同。
[0152]
本制备方法中,步骤d可以是与步骤c接续的反应,或在步骤c完成之后,从反应液中回收的由通式(6)表示的卤代联苯衍生物可以根据需要进行纯化,并且然后进行步骤d。
[0153]
作为由通式(4)表示的卤代膦的式中的r6和r7,可以使用与上述步骤b中相同的那些。
[0154]
作为用于由通式(6)表示的联苯衍生物的锂化剂,例如,使用有机锂化合物。有机锂化合物的示例包括甲基锂、乙基锂、正丙基锂、仲丙基锂、正丁基锂、仲丁基锂和叔丁基锂。其中,从适当的碱性和充分的反应性的观点来看,优选正丁基锂。
[0155]
从经济性和反应性的观点来看,就锂化剂与由通式(6)表示的联苯衍生物的摩尔比而言,锂化剂的添加量设定为1.0至2.0,特别是1.1至1.5。
[0156]
优选的是,由通式(6)表示的联苯衍生物的锂化物与由通式(4)表示的卤代膦之间的反应在溶剂中进行。可用溶剂没有特别限制,只要它能够溶解由通式(6)表示的卤代联苯衍生物及其锂化产物且对由通式(4)表示的卤代膦和由通式(5)表示的联芳膦呈惰性即可。溶剂的示例包括四氢呋喃、环戊基甲基醚、叔丁基甲基醚、1,2
‑
二甲氧基乙烷、n,n
‑
二甲基甲酰胺、乙醚、二丁醚、二恶烷、己烷和甲苯。这些溶剂可以单独使用或作为混合溶剂使用。其中,从极性和溶解性的观点来看,特别优选四氢呋喃。
[0157]
从经济性和反应性的观点来看,优选的是,就由通式(4)表示的卤代膦与由通式(6)表示的卤代联苯衍生物的摩尔比而言,由通式(4)表示的卤代膦的添加量设定为1.0至3.0,特别是1.0至1.5。
[0158]
从加速反应和控制副产物的观点来看,优选的是,步骤d中的反应温度设定在
‑
50至80℃,特别是
‑
30至50℃。
[0159]
步骤d中反应的完成可以通过气相色谱分析通过由(3)表示的联苯衍生物的存在或不存在来确认。获得满意的目标产物的反应时间通常为1小时或更长,优选1至10小时,但取决于反应条件等。
[0160]
在步骤d中的反应完成之后,所得的由通式(5)表示的联芳膦可以根据需要进行纯化,诸如重结晶、柱层析和萃取。
[0161]
在本制备方法中获得的由通式(5)表示的联芳膦特别适用作布赫瓦尔德膦配体。另外,在本制备方法中获得的由通式(6)表示的中间体卤代联苯衍生物适用作联芳膦的中间体原料。
[0162]
实施例
[0163]
参照如下实施例描述本发明,但本发明不限于此。
[0164]
{实施例1}
[0165][0166]
<步骤a>
[0167]
用氮气吹扫过的完全干燥的1l四颈烧瓶装入2,4,6
‑
三异丙基溴苯(a1)(56.1g,198mmol)和四氢呋喃(450ml)。在氮气氛下冷却到
‑
78℃之后,在1小时内向其中逐滴添加15质量%的正丁基锂(140.9g,330mmol)的己烷溶液。然后将混合物在
‑
78℃下老化1小时,从而制备液体a。
[0168]
在另一个用氮气吹扫过的完全干燥的300ml四颈烧瓶中,将1
‑
氯
‑
2,5
‑
二甲氧基苯(a2)(22.7g,132mmol)溶解在四氢呋喃(120ml)中,从而制备液体b。在1小时内将液体b连续添加到液体a中,使得内部温度保持在约
‑
80℃(反应温度a)。将混合物逐渐加热到
‑
10℃的温度并老化8小时,从而获得黄色透明液体。
[0169]
<步骤b>
[0170]
在30分钟内将氯二环己基膦(cy2pcl,30.7g,132mmol)连续添加到步骤a获得的液体中,使得内部温保持在约
‑
10℃。随后,将混合物在
‑
10℃下老化5小时。
[0171]
当添加50g水以停止反应时,液体变成橙色且透明。使用真空泵蒸发溶剂直到液体体积达到500ml,并且依次用400ml的0.9质量%的小苏打和450ml水洗涤反应液,并且弃去水层。随后,当使用真空泵蒸发溶剂时,沉淀出橙色固体。为溶解沉淀物,添加100ml乙酸乙酯,并将温度升高到60℃。此外,在将内部温度保持在约55℃的同时,连续添加300ml甲醇。
当液体逐渐冷却时,晶体在约50℃开始析出。液体进一步冷却到5℃。随后,将沉淀物通过玻璃过滤器过滤,用冷甲醇冲洗,然后减压干燥,以获得2
‑
二环己基膦基
‑
3,6
‑
二甲氧基
‑
2',4',6'
‑
三异丙基
‑
1,1'
‑
联苯(brettphos)(30.7g,收率:42.4%)。在
31
p nmr的测定中纯度为99%或更高,在气相色谱法的测定中纯度也为99%或更高。
[0172]
(brettphos的鉴定数据)
[0173]
熔点:193至194℃
[0174]1h nmr(500.15mhz,cdcl3):δ0.95(d,j=6.8hz,6h),1.22(d,j=6.8hz,6h),1.33(d,j=7.0hz,6h),1.43
‑
0.94(m,10h),1.73
‑
1.63(m,6h),1.85
‑
1.81(m,2h),2.25
‑
2.17(m,2h),2.44(七重峰,j=6.8hz,2h),2.95(七重峰,j=7.0hz,1h),3.56(s,3h),3.83(s,3h),6.80(d,j=8.8hz,1h),6.86(d,j=8.8hz,1h),6.89(s,2h);
[0175]
13
c nmr(125.76mhz,cdcl3):δ23.5,23.9,25.0,26.50,26.51,27.4,27.6,27.8,27.9,30.4,30.8,30.9,32.7,32.9,33.7,36.5,36.6,54.5,55.0,108.5,110.6,120.0,126.5,126.8,132.5,132.6,138.8,139.1,145.8,145.9,146.8,152.1,152.3,156.2,156.3;
[0176]
31
p nmr(202.46mhz,cdcl3):δ1.6
[0177]
{实施例2}
[0178]
以与实施例1相同的方式合成brettphos,不同之处在于在液体a中,将2,4,6
‑
三异丙基溴苯(a1)的量改为93.5g(330mmol),并且在液体a中,将15质量%的正丁基锂的己烷溶液改为197.3g(462mmol)。(38.7g,收率:54.7%)。
[0179]
{实施例3}
[0180]
以与实施例1相同的方式合成brettphos,不同之处在于在步骤a中,2,4,6
‑
三异丙基溴苯(a1)的锂化产物与1
‑
氯
‑
2,5
‑
二甲氧基苯(a2)之间的反应温度a设定为
‑
30℃。(26.6g,收率:37.6%)。
[0181]
{实施例4}
[0182][0183]
以与实施例1相同的方式合成brettphos,不同之处在于将示例1中所用液体b中的1
‑
氯
‑
2,5
‑
二甲氧基苯(a2)改为1
‑
氟
‑
2,5
‑
二甲氧基苯(a2)(20.6g,0.132mmol)。(35.1g,收率:49.6%)。
[0184]
[表1]
[0185][0186]
{实施例5}
[0187][0188]
biaryl
‑
i:联芳碘
[0189]
<步骤a>
[0190]
用氮气吹扫过的完全干燥的1l四颈烧瓶装入2,4,6
‑
三异丙基溴苯(a1)(93.5g,330mmol)和四氢呋喃(450ml)。在氮气氛下冷却到
‑
78℃之后,在1小时内向其中逐滴添加15质量%的正丁基锂(197.3g,462mmol)的己烷溶液。然后将混合物在
‑
78℃下老化1小时,从而制备液体a。
[0191]
在另一个用氮气吹扫过的完全干燥的300ml四颈烧瓶中,将1
‑
氯
‑
2,5
‑
二甲氧基苯(a2)(22.7g,132mmol)溶解在四氢呋喃(120ml)中,从而制备液体b。在1小时内将液体b连续添加到液体a中,使得内部温度保持在约
‑
80℃(反应温度a)。将混合物逐渐加热到
‑
10℃的温度并老化8小时,从而获得黄色透明液体。
[0192]
<步骤c>
[0193]
将碘(67.0g,264mmol)预先溶解在叔丁基甲基醚(200ml)中,并且在
‑
10℃下将碘的叔丁基甲基醚溶液缓慢逐滴添加到步骤a中获得的液体中。然后,将混合物原样搅拌6小时。有机层用250ml的10质量%的亚硫酸氢钠水溶液洗涤2次,然后用250ml纯水洗涤,并且用无水硫酸镁干燥。在减压蒸发溶剂之后,用乙酸和甲醇(1:1)的混合溶剂进行重结晶。所得晶体用冷甲醇冲洗并减压干燥,以获得2
‑
碘
‑
3,6
‑
二甲氧基
‑
2',4',6'
‑
三异丙基
‑
1,1'
‑
联苯(碘中间体)(42.3g,90.5mmol,68.6%)。在气相色谱法的测定中,纯度为99%或更高。
[0194]
(联芳碘的鉴定数据)
[0195]
熔点:199至200℃
[0196]1h nmr(500.15mhz,cdcl3):δ0.99(d,j=6.9hz,6h),1.17(d,j=6.9hz,6h),1.31(d,j=6.9hz,6h),2.36(七重峰,j=6.9hz,2h),2.95(七重峰,j=6.9hz,1h),3.65(s,3h),3.89(s,3h),6.80(d,j=8.9hz,1h),6.89(d,j=8.9hz,1h),7.04(s,2h);
[0197]
13
c nmr(125.76mhz,cdcl3):δ23.6,24.0,24.5,30.8,34.1,55.5,56.8,96.4,
109.2,110.0,120.7,135.9,136.2,145.7,148.2,152.3,152.5。
[0198]
{实施例6}
[0199][0200]
biaryl
‑
i:联芳碘
[0201]
<步骤d>
[0202]
用氮气吹扫过的完全干燥的1l四颈烧瓶装入在实施例5的步骤c中获得的2
‑
碘
‑
3,6
‑
二甲氧基
‑
2',4',6'
‑
三异丙基
‑
1,1'
‑
联苯(碘中间体)(19.3g,41.3mmol)以及环戊基甲基醚(200ml),并且在氮气氛下将混合物冷却到
‑
30℃。随后,在1小时内向其中逐滴添加15质量%的正丁基锂(18.0g,42.1mmol)的己烷溶液。然后将混合物在
‑
30℃下老化1小时,然后在30分钟内向其中连续添加氯二环己基膦(cy2pcl,9.6g,41.3mmol),使得内部温度保持在约
‑
10℃。然后,将混合物在
‑
10℃下老化10小时。
[0203]
在添加20g水以停止反应之后,将反应液依次用100ml的5质量%小苏打和150ml水洗涤,并弃去水层。随后,当使用真空泵蒸发溶剂时,沉淀出橙色固体。为了溶解沉淀物,添加55ml乙酸乙酯,并且将温度升高到60℃。此外,在将内部温度保持在约55℃的同时,连续添加165ml甲醇。当液体逐渐冷却时,晶体在约50℃开始析出。液体进一步冷却到5℃。随后,将沉淀物通过玻璃过滤器过滤,用冷甲醇冲洗,然后减压干燥,获得2
‑
二环己基膦基
‑
3,6
‑
二甲氧基
‑
2',4',6'
‑
三异丙基
‑
1,1'
‑
联苯(brettphos)(16.9g,收率:76.3%)。在
31
p nmr的测定中纯度为99%或更高,在气相色谱法的测定中纯度也为99%或更高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1