长效GLP-2类似物的制作方法
colitis."american journal of physiology
‑
gastrointestinal and liver physiology 276.1(1999):g79
‑
g91)。也有证据表明,glp
‑
2可在乳糜泻的粘膜愈合和维持机制中发挥作用(caddy、grant r.等人,"plasma concentrations of glucagon
‑
like peptide
‑
2in adult patients with treated and untreated coeliac disease."european journal of gastroenterology&hepatology 18.2(2006):195
‑
202)。
7.glp
‑
2已显示在脊椎动物中维持肠营养活性,诸如小肠生长、胰岛生长和/或隐窝/绒毛高度的增加。glp
‑
2对小肠的作用还表现为隐窝加绒毛轴高度的增加。此类活性在本文中称为“肠营养”活性。响应于glp
‑
2,还可检测到隐窝细胞增殖的增加和/或小肠上皮细胞凋亡的减少。这些细胞作用相对于空肠(包括近端空肠、远端空肠)和远端回肠最显著地注意到,并且在远端回肠中也注意到。
8.由于蛋白水解酶dpp
‑
iv的广泛的肾清除率和快速降解,循环的天然glp
‑
2的生物半衰期相对较短,在人体中为约7分钟。因此,唯一可获得的商业glp
‑
2治疗的与glp
‑
2天然序列的不同之处在于在n
‑
末端的第二位置处用丙氨酸取代甘氨酸(在天然glp
‑
2中)(替度鲁肽(tedugutide))。这种单个氨基酸取代提供了对通过二肽基蛋白酶
‑
iv(dpp
‑
iv)体内降解替度鲁肽的某些抗性,从而导致延长的半衰期(参见例如wo 97/39031)。然而,用进行sbs治疗需要基于每日注射的限制性注射方案和在每次注射之前需要溶解的粉末配方。
9.glp
‑
2肽和类似物的一个关键缺点是它们在体内的半衰期非常短,从而需要输注或频繁注射。glp
‑
2清除的主要代谢途径是通过酶降解。glp
‑
2已显示通过由二肽基肽酶
‑
iv(dpp
‑
iv)去除其两个n端氨基酸而被快速降解,这代表了主要限制,因为它导致肽的完全失活。天然glp
‑
2的体内半衰期为约7分钟。的体内半衰期为约2小时至3小时。
10.先前描述了称为可逆聚乙二醇化的新概念方法(pct公开号wo98/05361;gershonov等人,2000),用于延长蛋白质和肽的半衰期。根据该技术,通过使药物衍生化具有对ph条件敏感并且在天然至碱性条件诸如生理条件下可去除的官能团来制备前药。衍生化包括用接头诸如9
‑
芴基甲氧基羰基(fmoc)和2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)取代药物分子的至少一个氨基、羟基、巯基和/或羧基基团,peg部分的基团附接到该接头。peg部分与药物之间的连接不是直接的,而是两个残基都连接到对ph条件高度敏感的支架fms或fmoc结构的不同位置。本发明涉及其中利用肽序列优化和可逆聚乙二醇化技术延长肽半衰期的glp
‑
2衍生物。
11.不仅对于sbs患者,而且对于在整个本技术中体现的其他适应症,都需要具有更长半衰期、改善的功效和更方便的药物。
技术实现要素:
12.在一个方面中,公开了下式的化合物:l
‑
glp
‑
2,其中l为接头基团;并且glp
‑
2为与野生型glp
‑
2相比具有一个或多个特定氨基酸突变的glp
‑
2类似物或变体。
13.在相关方面,化合物中的接头基团为2
‑
甲氧基
‑9‑
芴基甲氧基羰基(meofmoc)、2,5
‑
二氧代吡咯烷
‑1‑
基
‑3‑
(2
‑
(3
‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)丙酰胺基)
‑
9h
‑
芴
‑9‑
基)丙酸酯(“nrfmoc”)、9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、fmoc
‑
osu、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或fms
‑
osu。
14.在一个方面,公开了选自以下式中的一者的化合物:
[0015][0016][0017]
在一个方面中,公开了选自以下中的一者的化合物:
[0018][0019]
在相关方面,含有马来酰亚胺基团的接头与含硫醇分子进一步反应。在另一方面,含硫醇分子为半胱氨酸或半胱胺。在相关方面,与含硫醇分子的反应导致mal
‑
接头
‑
glp
‑
2的还原诸如马来酰亚胺氢化,和/或含硫醇分子与接头
‑
glp
‑
2的偶联。
[0020]
在一个方面,公开了还包含式x
‑
l
‑
glp
‑
2的化合物,其中x选自聚合化合物。在一个相关方面,x为聚乙二醇聚合物(“peg”)。在一个相关方面,peg为peg2、peg10、peg20、peg30、peg40或peg60。在一个相关方面,peg具有在2,000da至50,000da范围内的分子量。
[0021]
在一个方面,本文公开了具有根据下式的氨基酸序列的glp
‑
2类似物或变体:r1
‑
his1
‑
x2
‑
x3
‑
gly4
‑
ser5
‑
phe6
‑
ser7
‑
asp8
‑
glu9
‑
x10
‑
x11
‑
thr12
‑
ile13
‑
leu14
‑
asp15
‑
x16
‑
leu17
‑
ala18
‑
ala19
‑
arg20
‑
asp21
‑
phe22
‑
ile23
‑
asn24
‑
trp25
‑
leu26
‑
ile27
‑
gln28
‑
thr29
‑
lys30
‑
ile31
‑
thr32
‑
asp33
‑
r2,其中r1可以为oh、cooh、nh2、conh2或conhnh2;x2可以为ala或gly;x3可以为asp或glu;x10可以为met或nle;x11可以为asn、d
‑
phe或d
‑
his;x16可以为asn、leu或tyr;r2可以为oh、cooh、nh2、conh2或conhnh2。在一个相关方面,glp
‑
2类似物或变体具有根据seq id no:1至seq id no:16中任一者的氨基酸序列。
[0022]
在一个方面中,公开了下式的化合物:
[0023][0024]
其中peg为聚乙二醇聚合物;r2为h、o
‑
ch3或so3h;并且glp2为与野生型glp
‑
2相比具有一个或多个特定氨基酸突变的glp2类似物或变体。在一个相关方面,glp
‑
2类似物或变体具有根据seq id no:1至seq id no:16中任一者的氨基酸序列。
[0025]
在一个方面,公开了一种药物组合物,其包含本文公开的任何化合物或其盐或衍生物与载体的混合物。
[0026]
在一个方面,公开了一种用于治疗肠道疾病、小肠综合征、炎性肠综合征、结肠炎(包括胶原性结肠炎、放射性结肠炎、溃疡性结肠炎)、慢性放射性肠炎、非热带(麸质不耐受)和热带口炎性腹泻、乳糜泻(麸质敏感性肠病)、血管阻塞或创伤后的组织损害、腹泻(例如旅行者腹泻和感染后腹泻)、慢性肠道功能障碍、脱水、菌血症、脓毒症、神经性厌食症、化疗后的组织损害(例如化疗引起的肠粘膜炎)、早产儿(包括早产儿的肠道衰竭)、出生前婴儿(包括出生前婴儿的肠道衰竭)、硬皮病、胃炎(包括萎缩性胃炎、窦切除术后萎缩性胃炎和幽门螺旋杆菌胃炎)、胰腺炎、全身脓毒性休克溃疡、肠炎、盲管(cul
‑
de
‑
sac)、淋巴管梗阻、血管疾病和移植物抗宿主病、外科手术后愈合、放射后萎缩和化疗、帕金森氏病体重减轻、外科手术后肠道适应、肠道外营养引起的粘膜萎缩(例如全肠道外营养(tpn)引起的粘膜萎缩)和骨相关障碍(包括骨质疏松症、恶性肿瘤高钙血症、骨转移引起的骨质减少)、牙周病、甲状旁腺功能亢进、类风湿性关节炎的关节周糜烂、佩吉特氏病、骨营养不良、骨化性肌炎、别赫捷列夫氏病、恶性高钙血症、骨转移产生的溶骨性病变、固定引起的骨丢失、性类固醇激素缺乏引起的骨丢失、类固醇激素治疗引起的骨异常、由癌症治疗引起的骨异常、骨软化症、白塞氏病、骨软化症、骨质增生、骨硬化症、转移性骨病、固定引起的骨质减少、或糖皮质激素引起的骨质疏松症的方法,该方法包括施用治疗或预防有效量的本文公开的组合物。
[0027]
一种用于治疗酸引起的肠道损伤、精氨酸缺乏症、自身免疫疾病、细菌性腹膜炎、肠缺血、肠创伤、烧伤引起的肠道损害、分解代谢疾病、乳糜泻、化疗相关菌血症、化疗引起的肠炎、胃肠动力下降、糖尿病、腹泻疾病、脂肪吸收不良、发热性中性粒细胞减少症、食物过敏、胃溃疡、胃肠屏障障碍、胃肠损伤、低血糖、特发性精子减少、炎性肠病、肠道衰竭、肠道功能不全、肠易激综合征、局部缺血、营养不良、肠系膜缺血、粘膜炎、坏死性小肠结肠炎、坏死性胰腺炎、新生儿喂养不耐受、新生儿营养不足、nsaid引起的胃肠损害、营养不足、肥胖症、隐窝炎、放射引起的肠炎、放射引起的肠损伤、脂肪泻、中风或全肠道外营养对胃肠道的损害的方法,该方法包括施用治疗或预防有效量的本文公开的组合物。
[0028]
一种用于增加患者的隐窝加绒毛深度和长度的方法,该方法包括施用治疗或预防有效量的本文公开的组合物。
附图说明
[0029]
以下附图形成本说明书的一部分,并且被包括以进一步展示本公开的某些方面,通过结合本文呈现的具体实施方案的详细描述参考这些附图中的一者或多者,可更好地理解本公开的发明。专利或申请文件包含至少一张彩色附图。具有彩色附图的本专利或专利申请公开的副本将由官方在请求并支付必要的费用后提供。
[0030]
图1示出了不同glp
‑
2变体#4缀合物的药理学作用,如通过其相对于媒介物的相应隐窝加绒毛长度增加百分比所测量的。
[0031]
图2示出了不同glp
‑
2变体#4缀合物的药理学作用,如通过其相对于媒介物的相应隐窝加绒毛长度增加百分比所测量的。
[0032]
图3示出了glp
‑
2变体#4与可逆mal
‑
fms
‑
v4缀合物之间的剂量依赖性药理学比较,如通过其相对于媒介物的相应隐窝加绒毛长度增加百分比所测量的。
[0033]
图4描述了显示从树脂上裂解后和酸处理后的fms偶联肽的rp
‑
hplc色谱图。
[0034]
图5描述了纯化的偶联肽和半胱氨酸化fms
‑
肽的rp
‑
色谱图,其中半胱氨酸与马来酰亚胺基团共价反应以产生cys
‑
fms
‑
v4。
[0035]
图6描述了预期mw为3335的cys
‑
fms
‑
v4的maldi
‑
tof分析,其由4214g/mol和从与半胱氨酸(121g/mol)共价反应获得的121g/mol的mal
‑
fms
‑
v4 mw组成。
[0036]
图7示出了mal
‑
fmoc
‑
nhs和mal
‑
fms
‑
nhs接头的合成方案。
[0037]
图8示出了mal
‑
fmoc
‑
nhs接头的合成方案。
[0038]
图9示出了合成的不同同质和异质产物:peg
‑
接头
‑
(n端)
‑
(glp
‑
2变体)和peg
‑
接头
‑
(lys30)
‑
(glp变体)。
[0039]
图10示出了fmoc
‑
osu
‑
(glp
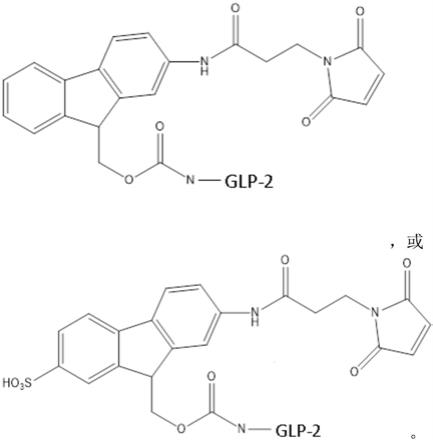
‑
2变体#4)的结构,其中附接的fmoc
‑
osu接头被认为是能够与肽单一共价结合的单官能接头。
[0040]
图11示出了fms
‑
osu
‑
(glp
‑
2变体#4)的结构,其中附接的fms
‑
osu接头被认为是能够与肽单一共价结合的单官能接头。
[0041]
图12示出了v4和不同v4
‑
缀合物与阿帕鲁肽(apraglutide)和格帕鲁肽(glepaglutide)相比的药理学作用,如通过其相对于媒介物的相应小肠重量增加百分比所测量的。
[0042]
图13示出了v4和不同v4
‑
缀合物与阿帕鲁肽和格帕鲁肽相比的药理学作用,如通
过其相对于媒介物的相应隐窝加绒毛长度增加百分比所测量的。
[0043]
图14示出了v4和cys/osu
‑
fms
‑
v4与阿帕鲁肽、格帕鲁肽和gattex相比的药理学作用,如通过在长达14天内其相对于媒介物的相应隐窝加绒毛长度增加百分比所测量的。
[0044]
图15示出了v4和cys
‑
fms
‑
v4的急性和长效剂量依赖性药理学作用,如通过其相对于媒介物的相应小肠重量增加百分比所测量的。
[0045]
图16示出了v4和cys
‑
fms
‑
v4的急性和长效剂量依赖性药理学作用,如通过其相对于媒介物的相应隐窝加绒毛长度增加百分比所测量的。
[0046]
图17示出了在单次2mg/kg sc注射后v4、cys
‑
fms
‑
v4和阿帕鲁肽在大鼠中的pk曲线。
[0047]
图18示出了在单次2mg/kg iv注射后v4和cys
‑
fms
‑
v4在大鼠中的pk曲线。
[0048]
图19示出了用于分析观察到的v4和cys
‑
fms
‑
v4的pk曲线的pk模型。
[0049]
图20示出了基于pk曲线和分析的大鼠中v4和阿帕鲁肽血浆浓度的时程的模拟。
具体实施方式
[0050]
在一个实施方案中,“氨基酸”或“多个氨基酸”被理解为包括20种天然存在的氨基酸;通常在体内翻译后修饰的那些氨基酸,包括例如羟脯氨酸、磷酸丝氨酸和磷酸苏氨酸;和其他异常氨基酸,包括但不限于2
‑
氨基己二酸、羟赖氨酸、异锁链赖氨素、正缬氨酸、正亮氨酸和鸟氨酸。在整个说明书和权利要求书中,使用天然氨基酸的常规单字母和三字母代码,以及普遍接受的其他α
‑
氨基酸的三个字母代码,诸如肌氨酸(sar)、正亮氨酸(nle)和α
‑
氨基异丁酸(aib)。
[0051]
在一个实施方案中,“氨基酸”包括d
‑
氨基酸和l
‑
氨基酸两者。应当理解,也可使用其他合成或修饰的氨基酸。
[0052]
在一个实施方案中,术语“类似物(analog、analogue)”、或“变体”意在包括包含具有与天然序列诸如glp
‑
2序列不同的氨基酸序列但具有类似或相当活性的肽的氨基酸序列。
[0053]
在另一个实施方案中,短语“长效glp
‑
2类似物”用于指与野生型glp
‑
2相比具有特定氨基酸突变的glp
‑
2类似物;具有附接到glp
‑
2类似物的一个或多个氨基酸位置的9
‑
芴基甲氧基羰基(fmoc)、fmoc的马来酰亚胺部分(mal
‑
fmoc)、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、fms的马来酰亚胺部分(mal
‑
fms)、2
‑
甲氧基
‑9‑
芴基甲氧基羰基(meofmoc)或2,5
‑
二氧代吡咯烷
‑1‑
基
‑3‑
(2
‑
(3
‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)丙酰胺基)
‑
9h
‑
芴
‑9‑
基)丙酸酯(nrfmoc)的glp
‑
2类似物;可逆聚乙二醇化glp
‑
2类似物;或在glp
‑
2类似物连接到nrfmoc接头的情况下的不可逆聚乙二醇化gpl
‑
2。
[0054]
本发明的glp
‑
2类似物与天然glp
‑
2相比具有一个或多个氨基酸取代、缺失、倒位或添加,并且如上文所定义。该定义还包括同义术语glp
‑
2模拟物和/或glp
‑
2激动剂。
[0055]
本发明的化合物具有至少一种glp
‑
2生物活性,特别是在引起肠生长方面。这可在体内测定中评估,例如如实施例中所述,其中在测试动物或脊椎动物已被治疗或暴露于长效glp
‑
2类似物之后确定肠或其一部分的质量或肠隐窝或绒毛长度的增加。
[0056]
在一个实施方案中,本发明的化合物增加患者隐窝加绒毛轴的高度或增加隐窝细胞增殖或减少小肠上皮细胞凋亡。
[0057]
在一个实施方案中,本发明的化合物增加隐窝/绒毛高度。在另一个实施方案中,本发明的化合物增加空肠(包括近端空肠、远端空肠)和远端回肠中的隐窝/绒毛高度。
[0058]
在一个实施方案中,本发明的化合物增加隐窝细胞增殖或减少小肠上皮细胞凋亡。
[0059]
本发明包括以下在下面的实验部分中进一步描述的肽。
[0060]
glp
‑2‑
gly2:nh2
‑
hgdgsfsdemntildnlaardfinwliqtkitd
‑
cooh(seq id no:1)。
[0061]
glp
‑
2变体#2:nh2
‑
hgegsfsde(nle)(d
‑
f)tildnlaardfinwliqtkitd
‑
nh2(seq id no:2)。
[0062]
glp
‑
2变体#3:nh2
‑
hgegsfsde(nle)(d
‑
h)tildnlaardfinwliqtkitd
‑
nh2(seq id no:3)。
[0063]
glp
‑
2变体#4:nh2
‑
hgegsfsde(nle)ntildllaardfinwliqtkitd
‑
nh2(seq id no:4)。
[0064]
glp
‑
2变体#5:nh2
‑
hgegsfsde(nle)ntildylaardfinwliqtkitd
‑
nh2(seq id no:5)。
[0065]
glp
‑
2变体#6:nh2
‑
hgegsfsde(nle)ntildllaardfinwliqtkitd
‑
cooh(seq id no:6)。
[0066]
glp
‑
2变体#7:nh2
‑
hgegsfsde(nle)ntildylaardfinwliqtkitd
‑
cooh(seq id no:7)。
[0067]
已知人glp
‑
2具有以下序列:nh2
‑
hadgsfsdemntildnlaardfinwliqtkitd
‑
cooh(seq id no:8)。
[0068]
在一个实施方案中,名称“替度鲁肽”用于指由33个氨基酸组成的胰高血糖素样肽
‑
2(glp
‑
2)类似物,其与glp
‑
2相差一个氨基酸(aa位置2处的丙氨酸被甘氨酸取代)。在一个实施方案中,由于其对来自二肽基肽酶
‑
4的蛋白水解的抗性增加,该取代导致与内源glp
‑
2相比更长的作用。
[0069]
已在文献中描述了各种有用的活性glp
‑
2类似物和衍生物,如以下专利中所揭示:2000年6月20日发布的美国专利5,789,379和1997年10月23日公布的相关wo97/39031,其教导了位点特异性glp
‑
2类似物;2003年8月27日公布的wo02/066511,其教导了白蛋白衍生形式的glp
‑
2和类似物;1999年10月14日公布的wo99/43361、2004年4月29日公布的wo04/035624和2004年10月7日公布的wo04/085471,其描述了亲脂性衍生形式的glp
‑
2和类似物;以及2015年6月23日发布的美国专利9,060,992,其描述了glp
‑
2类似物。glp
‑
2类似物还在美国专利8,642,727、美国专利9,453,064、美国专利8,580,918、wo 2013/183052、wo 2016/193969和wo2012/167251中有所描述。
[0070]
在一些实施方案中,glp
‑
2类似物由以下式表示:
[0071]
r1
‑
his
‑
x2
‑
x3
‑
gly
‑
x5
‑
phe
‑
x7
‑
x8
‑
x9
‑
x10
‑
x11
‑
x12
‑
x13
‑
x14
‑
x15
‑
x16
‑
x17
‑
ala
‑
x19
‑
x20
‑
x21
‑
phe
‑
ile
‑
x24
‑
trp
‑
leu
‑
x27
‑
x28
‑
x29
‑
x30
‑
x31
‑
x32
‑
x33
‑
r2(seq id no:9),其中:
[0072]
r1为氢、c1
‑
4烷基(例如甲基)、乙酰基、甲酰基、苯甲酰基、三氟乙酰基、oh、cooh、nh2、conh2或conhnh2;
[0073]
x2为gly、ala或aib;
[0074]
x3为glu、gln或asp;
[0075]
x5为ser或thr;
[0076]
x7为ser或thr;
[0077]
x8为asp、glu或ser;
[0078]
x9为glu或asp;
[0079]
x10为met、val、leu或tyr;
[0080]
x11为asn、ser或ala;
[0081]
x12为thr、ser或lys;
[0082]
x13为ile、leu、val、tyr、phe或gln;
[0083]
x14为leu或met;
[0084]
x15为asp或glu;
[0085]
x16为asn、gln、gly、ser、ala、glu或lys;
[0086]
x17为gln、lys、arg、his或glu;
[0087]
x19为ala或val;
[0088]
x20为arg、lys或his;
[0089]
x21为asp、glu或leu;
[0090]
x24为asn、ala、glu或lys;
[0091]
x27为ile、leu、val、glu或lys:
[0092]
x28为gln、asn、lys、ser、y1或不存在;
[0093]
x29为thr、y1或不存在;
[0094]
x30为lys、y1或不存在;
[0095]
x31为ile、pro或不存在;
[0096]
x32为thr、y1或不存在;
[0097]
x33为asp、asn、y1或不存在;
[0098]
y1为gly
‑
gly
‑
pro
‑
ser
‑
ser
‑
gly
‑
ala
‑
pro
‑
pro
‑
pro
‑
ser、或lys
‑
asn
‑
gly
‑
gly
‑
pro
‑
ser
‑
ser
‑
gly
‑
ala
‑
pro
‑
pro
‑
pro
‑
ser;并且
[0099]
r2为oh、cooh、nh2、conh2或conhnh2。
[0100]
在一些实施方案中,在seq id no:9中,x31也可以为y1;x28也可以为gly;或x29也可以为ala。另外,y1可存在于x33与r2之间。因此,可设想位置x34,其中x34为y1或不存在。
[0101]
在一些实施方案中,glp
‑
2类似物由以下式表示:
[0102]
r1
‑
z1
‑
his
‑
x2
‑
x3
‑
gly
‑
x5
‑
x6
‑
x7
‑
x8
‑
x9
‑
x10
‑
x11
‑
x12
‑
x13
‑
x14
‑
x15
‑
x16
‑
x17
‑
x18
‑
x19
‑
x20
‑
x21
‑
phe
‑
ile
‑
x24
‑
trp
‑
leu
‑
ile
‑
x28
‑
thr
‑
lys
‑
x31
‑
x32
‑
x33
‑
z2
‑
r2(seq id no:10),其中:
[0103]
r1为氢、c1
‑
4烷基(例如甲基)、乙酰基、甲酰基、苯甲酰基或三氟乙酰基;
[0104]
x2为gly、ala或sar;
[0105]
x3为glu或asp;
[0106]
x5为ser或thr;
[0107]
x6为phe或pro或保守取代;
[0108]
x7为ser或thr;
[0109]
x8为asp或ser或保守取代;
[0110]
x9为glu或asp或保守取代;
[0111]
x10为met、leu、nle或氧化稳定的met置换氨基酸;
[0112]
x11为y1;
[0113]
x12为thr或lys或保守取代;
[0114]
x13为ile、glu或gln或保守取代;
[0115]
x14为leu、met或nle或保守取代;
[0116]
x15为asp或glu或保守取代;
[0117]
x16为y2;
[0118]
x17为leu或glu或保守取代;
[0119]
x18为ala或aib或非保守取代;
[0120]
x19为ala或thr或保守取代;
[0121]
x20为y3
[0122]
x21为asp或ile或保守取代;
[0123]
x24为y4;
[0124]
x28为y5;
[0125]
x31为pro、ile或缺失;
[0126]
x32为thr或缺失;
[0127]
x33为asp、asn或缺失;
[0128]
r2为nh2或oh;并且
[0129]
z1和z2独立地不存在或为选自由ala、leu、ser、thr、tyr、asn、gln、asp、glu、lys、arg、his、met和orn组成的组的1
‑
10个氨基酸单元的肽序列。
[0130]
在一个实施方案中,glp
‑
2类似物选自由以下项组成的组:
[0131]
r1
‑
his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
nle
‑
d
‑
thi
‑
thr
‑
ile
‑
leu
‑
asp
‑
phe
‑
leu
‑
ala
‑
ala
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
r2(seq id no:11);
[0132]
r1
‑
his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
nle
‑
d
‑
phe
‑
thr
‑
ile
‑
leu
‑
asp
‑
phe
‑
leu
‑
ala
‑
ala
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
r2(seq id no:12);
[0133]
r1
‑
his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
nle
‑
d
‑
phe
‑
thr
‑
ile
‑
leu
‑
asp
‑
leu
‑
leu
‑
ala
‑
ala
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
ile
‑
thr
‑
asp
‑
r2(seq id no:13);
[0134]
r1
‑
his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
nle
‑
d
‑
thi
‑
thr
‑
ile
‑
leu
‑
asp
‑
leu
‑
leu
‑
ala
‑
thr
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
ile
‑
thr
‑
asp
‑
r2(seq id no:14);
[0135]
r1
‑
his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
nle
‑
d
‑
phe
‑
thr
‑
ile
‑
leu
‑
asp
‑
phe
‑
leu
‑
ala
‑
ala
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
ile
‑
thr
‑
asp
‑
r2(seq id no:15);或
[0136]
r1
‑
his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
nle
‑
d
‑
thi
‑
thr
‑
ile
‑
leu
‑
asp
‑
phe
‑
leu
‑
ala
‑
ala
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
ile
‑
thr
‑
asp
‑
r2(seq id no:16),其中
[0137]
r1为oh、cooh、nh2、conh2或conhnh2,并且
[0138]
r2为oh、cooh、nh2、conh2、nh
‑
异丁基或conhnh2。
[0139]
在一个实施方案中,本文提供了一种用于与天然glp
‑
2相比通过取代、缺失、倒置或添加一个或多个氨基酸来延长glp
‑
2的生物半衰期的方法。在另一个实施方案中,本文提供了一种用于通过在位置x2、x3、x10、x11和x16处包含至少一个氨基酸取代来延长glp
‑
2的生物半衰期的方法,其中该glp
‑
2类似物具有以下氨基酸序列:
[0140]
r1
‑
his1
‑
x2
‑
x3
‑
gly4
‑
ser5
‑
phe6
‑
ser7
‑
asp8
‑
glu9
‑
x10
‑
x11
‑
thr12
‑
ile13
‑
leu14
‑
asp15
‑
x16
‑
leu17
‑
ala18
‑
ala19
‑
arg20
‑
asp21
‑
phe22
‑
ile23
‑
asn24
‑
trp25
‑
leu26
‑
ile27
‑
gln28
‑
thr29
‑
lys30
‑
ile31
‑
thr32
‑
asp33
‑
r2(seq id no:17)
[0141]
在另一个实施方案中,本文提供了一种用于通过包含至少一个氨基酸取代来延长glp
‑
2的生物半衰期的方法,并且所得glp
‑
2类似物具有seq id no:17的氨基酸序列,并且
[0142]
r1为oh、cooh、nh2、conh2或conhnh2;
[0143]
x2为ala或gly;
[0144]
x3为asp或glu;
[0145]
x10为met或nle;
[0146]
x11为asn、d
‑
phe或d
‑
his;
[0147]
x16为asn、leu或tyr;
[0148]
r2为oh、cooh、nh2、conh2或conhnh2。
[0149]
在一个实施方案中,本文提供了一种用于与天然glp
‑
2相比通过取代、缺失、倒置或添加一个或多个氨基酸来降低glp
‑
2的给药频率的方法。在另一个实施方案中,本文提供了一种用于通过在位置x2、x3、x10、x11和x16处包含至少一个氨基酸取代来降低glp
‑
2的给药频率的方法,其中该glp
‑
2类似物具有seq id no:17的以下氨基酸序列
[0150]
在另一个实施方案中,本文提供了一种用于通过包含至少一个氨基酸取代来延长glp
‑
2的给药频率的方法,并且所得glp
‑
2类似物具有seq id no:17的氨基酸序列,并且
[0151]
r1为oh、cooh、nh2、conh2或conhnh2;
[0152]
x2为ala或gly;
[0153]
x3为asp或glu;
[0154]
x10为met或nle;
[0155]
x11为asn、d
‑
phe或d
‑
his;
[0156]
x16为asn、leu或tyr;或
[0157]
r2为oh、cooh、nh2、conh2或conhnh2。
[0158]
在另一个实施方案中,本文提供了一种用于通过在glp
‑
2类似物的一个或多个氨基酸位置处附接9
‑
芴基甲氧基羰基(fmoc)、fmoc的马来酰亚胺部分(mal
‑
fmoc)、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、fms的马来酰亚胺部分(mal
‑
fms)、2
‑
甲氧基
‑9‑
芴基甲氧基羰基(meofmoc)或nrfmoc来延长glp
‑
2类似物的生物半衰期的方法。在另一个实施方案中,本文提供了一种用于通过将9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms、2
‑
甲氧基
‑9‑
芴基甲氧基羰基(meofmoc)或nrfmoc附接到glp
‑
2类似物的氨基末端或第三十号位置上的赖氨酸残基(lys30)、或his(1)咪唑侧链、或它们的任何组合来延长glp
‑
2类似物的生物半衰期的方法。
[0159]
在另一个实施方案中,本文提供了一种用于通过在glp
‑
2类似物的一个或多个氨基酸位置处附接9
‑
芴基甲氧基羰基(fmoc)、fmoc的马来酰亚胺部分(mal
‑
fmoc)、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、fms的马来酰亚胺部分(mal
‑
fms)、meofmoc或nrfmoc来降低glp
‑
2类似物的给药频率的方法。在另一个实施方案中,本文提供了一种用于通过将9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧羰基(fms)、mal
‑
fms、meofmoc或nrfmoc附接到glp
‑
2类似物的氨基末端、第三十号位置上的赖氨酸残基(lys30)或his(1)咪唑侧链、或它们的任何组合来降低glp
‑
2类似物的给药频率的方法。
[0160]
在另一个实施方案中,本文提供了一种用于通过在glp
‑
2类似物的一个或多个氨基酸位置处附接9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms、meofmoc或nrfmoc来改善glp
‑
2类似物的生物功效的方法。在另一个实施方案中,本文提供了一种用于通过将9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms、meofmoc或nrfmoc附接到glp
‑
2类似物的氨基末端、第三十号位置上的赖氨酸残基(lys30)或his(1)咪唑侧链、或它们的任何组合来延长glp
‑
2类似物的生物半衰期的方法。
[0161]
在另一个实施方案中,本文提供了一种用于通过将9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms、meofmoc或nrfmoc附接到glp
‑
2类似物的氨基末端、第三十号位置上的赖氨酸残基(lys30)、第一号位置上的his残基(his1)、或任何组合来改善glp
‑
2类似物的生物功效和/或延长其生物半衰期的方法。
[0162]
在另一个实施方案中,本文提供了一种用于通过将fmoc
‑
osu接头经由潜在地位于n端的任何游离胺和/或lys 30附接到glp
‑
2类似物来降低本文所述的glp
‑
2类似物的给药频率、延长其生物半衰期或改善其生物功效的方法。fmoc
‑
osu结构在下面的式i中描述。在另一个实施方案中,fmoc
‑
osu接头被磺化。
[0163][0164]
在一个实施方案中,fmoc
‑
osu为单功能接头。在另一个实施方案中,fmoc
‑
osu接头经由氨基甲酸酯键共价结合到gpl
‑
2类似物。在另一个实施方案中,接头部分与其他生物分子之间的其他潜在相互作用(例如,疏水相互作用)为非共价的。
[0165]
在一个实施方案中,图10描述了与glp
‑
2类似物偶联后的fmoc
‑
osu接头的结构。在一个实施方案中,图11描述了与glp
‑
2类似物偶联后的fms
‑
osu接头的结构。
[0166]
在一个实施方案中,本发明的mal
‑
fmoc
‑
or由以下结构呈现。
[0167]
[0168]
在一个实施方案中,本发明的mal
‑
fms
‑
or由以下结构呈现。
[0169][0170]
在一个实施方案中,本发明的meofmoc由以下结构呈现。
[0171][0172]
在一个实施方案中,本发明的nrfmoc由以下结构呈现。
[0173][0174]
在一个实施方案中,本发明的马来酰亚胺部分mal
‑
fms
‑
nhs由以下结构呈现。
[0175][0176]
在一个实施方案中,通过将mal
‑
fmoc
‑
nhs与三氟乙酸和氯磺酸混合来制备mal
‑
fms
‑
nhs,其中将该mal
‑
fmoc
‑
nhs溶解在纯三氟乙酸中,并且将溶解在纯三氟乙酸中的过量的所述氯磺酸添加到反应混合物中。
[0177]
在一个实施方案中,本发明的马来酰亚胺部分mal
‑
fmoc
‑
nhs由以下结构呈现。
[0178][0179]
在一个方面,本发明提供了包含以下项或由其组成的组合物:经由可逆接头诸如
9
‑
芴基甲氧基羰基(fmoc)、fmoc的马来酰亚胺部分(mal
‑
fmoc)、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、fms的马来酰亚胺部分(mal
‑
fms)或meofmoc连接到一种或多种聚乙二醇聚合物(peg)的glp
‑
2类似物。在另一个实施方案中,本发明提供了包含以下项或由其组成的组合物:glp
‑
2类似物、聚乙二醇聚合物(peg聚合物)和9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc。
[0180]
在一个实施方案中,本发明提供了包含以下项或由其组成的组合物:经由不可逆接头诸如2,5
‑
二氧代吡咯烷
‑1‑
基
‑3‑
(2
‑
(3
‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)丙酰胺基)
‑
9h
‑
芴
‑9‑
基)丙酸酯(nrfmoc)连接到一种或多种聚乙二醇聚合物(peg)的glp
‑
2类似物。
[0181]
在一个实施方案中,在接头为可逆的情况下,其通过氨基甲酸酯键(即
‑
o
‑
c(=o)
‑
n(h)
‑
)结合到肽。
[0182]
在一个实施方案中,在接头为不可逆的情况下,其通过酰胺键(即c(=o)
‑
n(h)
‑
)结合到肽。
[0183]
在另一方面,本文提供了一种用于延长肽的血清半衰期的方法。该方法基于聚乙二醇(peg)链通过化学接头(称为fms、mal
‑
fms、fmoc、mal
‑
fmoc或meofmoc)与肽的可逆附接,从而导致天然肽缓慢释放到血流中。然后,释放的肽也可穿过血脑屏障进入中枢神经系统(cns)或任何其他靶器官。在一个实施方案中,fms、mal
‑
fms、fmoc、mal
‑
fmoc或meofmoc接头的独特化学结构导致肽的特定释放速率。
[0184]
因此,在另一个实施方案中,本文提供了一种用于延长glp
‑
2类似物的生物半衰期的方法。在另一个实施方案中,本文提供了一种用于延长glp
‑
2类似物在生物流体中的循环时间的方法,其中该循环时间通过缓慢释放完整的glp
‑
2类似物而延长。在另一个实施方案中,延长所述glp
‑
2类似物的所述生物半衰期或所述循环时间允许所述glp
‑
2类似物减少胃动力和胃酸分泌(参见drucker、daniel j.和bernardo yusta."physiology and pharmacology of the enteroendocrine hormone glucagon
‑
like peptide
‑
2."annual review of physiology76(2014):561
‑
583))。本领域技术人员将很好地理解,生物流体可以为血液、血清、脑脊液(csf)等。
[0185]
在一个实施方案中,本发明的长效glp
‑
2类似物由g蛋白偶联受体介导。在一个实施方案中,本发明的长效glp
‑
2类似物由glp
‑
2受体(glp
‑
2r)介导。
[0186]
在一个实施方案中,在将本发明的聚乙二醇化glp
‑
2类似物组合物施用于受试者中时,由于来自所述组合物的所述fms、mal
‑
fms、fmoc或mal
‑
fmoc接头的化学水解,glp
‑
2类似物释放到受试者的生物流体中。在另一个实施方案中,释放的glp
‑
2类似物是完整的,并且重新获得完整的glp
‑
2受体结合活性。在另一个实施方案中,化学水解所述fms、mal
‑
fms、fmoc或mal
‑
fmoc延长了所述glp
‑
2类似物在所述生物流体中的循环时间。在另一个实施方案中,延长所述glp
‑
2类似物的循环时间允许所述glp
‑
2类似物穿过血脑屏障并靶向cns。在另一个实施方案中,延长所述glp
‑
2类似物的循环时间允许所述glp
‑
2类似物穿过血脑屏障并靶向下丘脑。在另一个实施方案中,延长所述glp
‑
2类似物的循环时间允许所述glp
‑
2类似物穿过血脑屏障并靶向弓状核。
[0187]
在另一个实施方案中,本发明提供了一种组合物,其包含glp
‑
2类似物肽和经由9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc接
头与glp
‑
2类似物肽的氨基末端缀合的聚乙二醇(peg)聚合物。在另一个实施方案中,本发明涉及由glp
‑
2类似物、聚乙二醇聚合物(peg聚合物)和9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc接头组成的组合物,其中所述peg聚合物经由fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc附接到所述glp
‑
2的氨基酸序列的第三十号位置上的赖氨酸残基(lys30)。在另一个实施方案中,本发明涉及由glp
‑
2类似物、聚乙二醇聚合物(peg聚合物)和9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc接头组成的组合物,其中所述peg聚合物经由fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc附接到所述glp
‑
2的氨基酸序列的his(1)咪唑侧链。
[0188]
在一个实施方案中,本发明提供了一种异源组合物,其包含:glp
‑
2类似物,其在所述glp
‑
2的氨基酸序列的第三十号位置上的赖氨酸残基(lys30)处经由9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc接头附接到聚乙二醇聚合物(peg聚合物);以及glp
‑
2类似物肽,其在glp
‑
2类似物肽的氨基末端处经由fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc接头附接到聚乙二醇(peg)聚合物。在另一个实施方案中,本发明提供了一种异源组合物,其包含:(1)glp
‑
2类似物,其在所述glp
‑
2的氨基酸序列的第三十号位置上的赖氨酸残基(lys30)处经由9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc接头附接到聚乙二醇聚合物(peg聚合物);(2)glp
‑
2类似物肽,其在glp
‑
2类似物肽的氨基末端处经由fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc接头附接到聚乙二醇(peg)聚合物;和/或(3)glp
‑
2类似物肽,其在glp
‑
2类似物肽的his(1)咪唑侧链处经由fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc接头附接到聚乙二醇(peg)聚合物。
[0189]
在另一个实施方案中,长效glp
‑
2类似物为聚乙二醇化glp
‑
2类似物。在另一个实施方案中,长效glp
‑
2类似物为可逆聚乙二醇化glp
‑
2类似物。在另一个实施方案中,短语“长效glp
‑
2类似物”、“可逆聚乙二醇化glp
‑
2类似物”、“可逆聚乙二醇化glp
‑
2类似物”或“包含glp
‑
2类似物、聚乙二醇化聚合物(peg聚合物)和9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc、或由其组成的组合物”可互换使用。在另一个实施方案中,长效glp
‑
2类似物为经由fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc连接到peg的glp
‑
2类似物。在另一个实施方案中,长效glp
‑
2类似物经由其氨基(n’)末端连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc。在另一个实施方案中,长效glp
‑
2类似物经由其his(1)咪唑侧链连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc。
[0190]
在一个方面,本发明提供了包含经由mal
‑
fmoc或mal
‑
fms接头可逆地聚乙二醇化的glp
‑
2类似物、或由其组成的组合物。在另外的方面,经由mal
‑
fmoc或mal
‑
fms接头可逆地聚乙二醇化的glp
‑
2类似物还可与除了peg之外的另外的分子缀合。在另一个实施方案中,附加的缀合分子为含硫醇分子。在另一个实施方案中,附加的缀合分子为sh活性基团或胺、肼或酰肼。在另一个实施方案中,附加的缀合分子为cys或半胱胺。
[0191]
在另一个实施方案中,本文提供的glp
‑
2类似物具有附接到glp
‑
2类似物的一个或多个氨基酸位置的9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc。在另一个实施方案中,本文提供的glp
‑
2类似物具有附接到glp
‑
2类似物的氨基末端或第三十号位置上的赖氨酸残基(lys30)的9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc。本发明提供了一种异源组合
物,其包含:glp
‑
2类似物,其具有附接到glp
‑
2类似物的氨基末端的9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc;以及glp
‑
2类似物,其具有附接到glp
‑
2类似物的第三十号位置上的赖氨酸残基(lys30)的9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc。
[0192]
在另一个实施方案中,可逆聚乙二醇化glp
‑
2类似物为其中glp
‑
2类似物经由可逆接头连接到peg的组合物。在另一个实施方案中,可逆聚乙二醇化glp
‑
2类似物在暴露于天然至碱性环境后释放游离glp
‑
2类似物。在另一个实施方案中,可逆聚乙二醇化glp
‑
2类似物在暴露于血液或血浆后释放游离glp
‑
2类似物。在另一个实施方案中,长效glp
‑
2类似物包含不像在标准聚乙二醇化程序中那样彼此直接连接的peg和glp
‑
2类似物,而是两个残基都连接到对ph条件高度敏感且在常规生理条件下可去除的fmoc、mal
‑
fmoc、fms或mal
‑
fms的不同位置。在另一个实施方案中,常规生理条件包括生理环境,诸如血液或血浆。
[0193]
在另一个实施方案中,制备fmoc、mal
‑
fmoc、fms和mal
‑
fms的结构和过程描述于美国专利7585837中。美国专利7585837的公开内容据此全文以引用方式并入。
[0194]
在另一方面,本文提供了一种降低glp
‑
2类似物的给药频率的方法,该方法由以下步骤组成:经由9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms或meofmoc将聚乙二醇聚合物(peg聚合物)缀合到glp
‑
2类似物序列的第30号位置上的赖氨酸残基、n末端或his(1)侧链。
[0195]
在一个实施方案中,本发明的马来酰亚胺部分接头为氢化的。
[0196]
在一个实施方案中,马来酰亚胺部分接头具有一个或多个被琥珀酰亚胺基团置换的马来酰亚胺基团。
[0197]
在一个实施方案中,含有琥珀酰亚胺基团的接头具有以下结构:
[0198][0199]
在另一方面,本文提供了一种降低glp
‑
2类似物的给药频率的方法,这是由于如本文所述的长效glp
‑
2类似物的功效得到改善。在另一方面,本文提供了一种降低glp
‑
2或glp
‑
2类似物的给药频率和/或增加其功效的方法,该方法由以下步骤组成:将至少一种接头所述fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc、或nrfmoc、或它们的组合在n端、lys(30)侧链、或his(1)侧链、或它们的任何组合处缀合到glp
‑
2肽或glp
‑
2类似物,以及使用但不限于含硫醇分子(例如,半胱氨酸和半胱胺)、含胺分子和氢化进一步还原马来酰亚胺官能团。在另一个实施方案中,使含硫醇分子与glp
‑
2类似物反应导致mal
‑
接头
‑
glp
‑
2的还原诸如马来酰亚胺氢化,和/或含硫醇分子与接头
‑
glp
‑
2的偶联。
[0200]
在一个实施方案方面,本文提供了一种延长glp
‑
2类似物的半衰期的方法,该方法由以下步骤组成:将至少一种接头诸如fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc、或nrfmoc、或它们的组合在n端、lys(30)侧链、或his(1)侧链、或它们的任何组合处缀合到glp
‑
2肽或glp
‑
2肽类似物,以及使用但不限于含硫醇分子(例如,半胱氨酸(“cys”)和半胱胺)、含胺分子和氢化进一步还原马来酰亚胺官能团。
[0201]
在另一方面,本文提供了一种提高glp
‑
2类似物的曲线下面积(auc)的方法,该方法由以下步骤组成:经由9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fmoc、或meofmoc接头将聚乙二醇聚合物(peg聚合物)缀合到glp
‑
2类似物序列的第30号位置上的赖氨酸残基、n末端或his(1)咪唑侧链。
[0202]
在一个方面,本文提供了一种提高glp
‑
2类似物的曲线下面积(auc)的方法,该方法由以下步骤组成:将9
‑
芴基甲氧基羰基(fmoc)、mal
‑
fmoc、2
‑
磺酰基
‑9‑
芴基甲氧基羰基(fms)、mal
‑
fms、meofmoc或nrfmoc接头缀合到glp
‑
2类似物的第30号位置上的赖氨酸残基、n末端或his(1)咪唑侧链。
[0203]
在另一方面,本文提供了一种提高glp
‑
2类似物的曲线下面积(auc)的方法,该方法由以下步骤组成:经由nrfmoc接头将聚乙二醇聚合物(peg聚合物)不可逆地缀合到glp
‑
2类似物序列的第30号位置上的赖氨酸残基、n末端或his(1)咪唑侧链。
[0204]
在另一个实施方案中,peg为直链的。在另一个实施方案中,peg为支链的。在另一个实施方案中,peg具有在1da至200da范围内的分子量。在另一个实施方案中,peg具有在200da至200,000da范围内的分子量。在另一个实施方案中,peg具有在5,000da至80,000da范围内的分子量。在另一个实施方案中,peg具有在5,000da至40,000da范围内的分子量。在另一个实施方案中,peg具有在20,000da至40,000da范围内的分子量。在一个实施方案中,peg
20
是指平均分子量为20,000da的peg。在一个实施方案中,peg5是指平均分子量为5,000da的peg。在一个实施方案中,peg
30
是指平均分子量为30,000da的peg。peg
40
是指平均分子量为40,000da的peg。
[0205]
在一个实施方案中,peg具有约2,000da的分子量。在另一个实施方案中,peg具有约1,000da的分子量。在另一个实施方案中,peg具有约5000da的分子量。在另一个实施方案中,peg具有约100da的分子量。在另一个实施方案中,peg具有在1da至500da范围内的分子量。在另一个实施方案中,peg具有在500da至1,000da范围内的分子量。在另一个实施方案中,peg具有在1,000da至2,000da范围内的分子量。在另一个实施方案中,peg具有在2,000da至5,000da范围内的分子量。
[0206]
在另一个实施方案中,聚乙二醇为表示为(peg)m
‑
r
‑
sh的支链peg,其中r表示中心核心部分,并且m表示分支臂的数量。在一个实施方案中,peg表示为具有与多肽的仅一个可用连接的(peg)m
‑
r
‑
sh。分支臂的数量(m)可在两到一百或更多的范围内。在另一个实施方案中,羟基基团经受化学修饰。在另一个实施方案中,支链peg的平均分子量为20kd或40kd,并且表示为(peg)2
‑
r
‑
sh。
[0207]
在另一个实施方案中,支链peg表示为(peg)2
‑
r
‑
sh并且具有以下化学结构:
[0208]
.
[0209][0210]
在另一个实施方案中,peg为表示为(peg)4
‑
r
‑
sh的多臂peg。在一个实施方案中,peg为表示为(peg)4
‑
r
‑
sh的多臂peg,其中每个peg臂具有20kd或40kd的分子量。
[0211]
在另一个实施方案中,peg为由以下化学结构表示的多臂peg:
[0212][0213]
在另一个实施方案中,peg为由上式1表示的多臂peg,并且每个peg臂具有20kd或40kd的平均分子量。
[0214]
在另一个实施方案中,支链peg表示为r(peg
‑
oh)
m
,其中r表示中心核心部分诸如季戊四醇或甘油,并且m表示分支臂的数量。分支臂的数量(m)可在两到一百或更多的范围内。在另一个实施方案中,羟基基团经受化学修饰。在另一个实施方案中,支链peg分子描述于美国专利6,113,906、5,919,455、5,643,575和5,681,567,这些专利据此全文以引用方式并入。
[0215]
在另一个实施方案中,使用聚乙二醇化剂制备长效glp
‑
2类似物,该聚乙二醇化剂意指能够与存在于fmoc、mal
‑
fmoc、fms或mal
‑
fms部分的芴环上的官能团诸如但不限于nh2、oh、sh、cooh、cho、
‑
n=c=o、
‑
n=c=s、
‑
so2cl、
‑
so2ch=ch2、
‑
po2cl、
‑
(ch2)xhal反应的任何peg衍生物。在另一个实施方案中,聚乙二醇化剂通常以其单甲氧基形式使用,其中peg分子的一个末端处仅一个羟基基团可用于缀合。在另一个实施方案中,如果例如希望获得具有共价附接到单个peg部分的两个肽或蛋白质残基的缀合物,则可使用其中有两个末端可用于缀合的双功能形式的peg。
[0216]
在另一个实施方案中,本发明涉及glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc或nrfmoc的glp
‑
2类似物用于可逆或不可逆聚乙二醇化glp
‑
2类似物的治疗和相关用途,特别是用于促进小肠和/或大肠组织的生长;升高glp
‑
2衍生物的血液水平;恢复或维持胃肠功能;促进损伤或溃疡/发炎的肠粘膜愈合和再生;降低肠道疾病的风险;增强营养状况;治疗或预防营养性或胃肠障碍、并发症或疾病;减少体重减轻;减少白细胞介素
‑
1表达;增加结肠长度、结肠中的粘膜面积和完整性两者以及隐窝深度;促进患有疾病诸如乳糜泻、感染后绒毛萎缩和短肠综合征的受试者的绒毛生长;促进健康受试者或患病受试者中的小肠和大肠增殖。由长效glp
‑
2类似物引发的对生长的影响表现为相对于模拟治疗的对照的小肠重量增加。特别地,如果当在本文例示的鼠模型中评估时,长效glp
‑
2类似物介导小肠重量相对于仅接受媒介物的对照动物增加至少10%、20%或50%,则认为该类似物具有“肠营养”活性。肠营养活性相对于空肠(包括远端空肠并且特别是近端空肠)最显著地注意到,并且在回肠中也注意到。
[0217]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0218][0219]
其中v4为具有以下序列的glp
‑
2类似物变体#4:
[0220]
nh2
‑
hgegsfsde(nle)ntildllaardfinwliqtkitd
‑
nh2(seq id no:4)。在另一个实施方案中,该结构被称为mal
‑
fms
‑
v4。
[0221]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0222][0223]
其中v4为具有seq id no:4的氨基酸序列的glp
‑
2类似物变体#4。在另一个实施方案中,该结构被称为peg30
‑
fmoc
‑
v4。
[0224]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0225][0226]
其中v4为具有seq id no:4的氨基酸序列的glp
‑
2类似物变体#4。在另一个实施方案中,该结构被称为peg30
‑
nrf
‑
v4。
[0227]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0228][0229]
其中v4为具有seq id no:4的氨基酸序列的glp
‑
2类似物变体#4。在另一个实施方案中,该结构被称为peg30
‑
meof
‑
v4。
[0230]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0231]
[0232]
其中v4为具有seq id no:4的氨基酸序列的glp
‑
2类似物变体#4,并且接头在glp
‑
2类似物的赖氨酸位置30处附接glp
‑
2变体#4。在另一个实施方案中,该结构被称为peg30
‑
fms
‑
v4(lys)。
[0233]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0234][0235]
其中v4为具有seq id no:4的氨基酸序列的glp
‑
2类似物变体#4。在另一个实施方案中,该结构被称为peg30
‑
fms
‑
v4。
[0236]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0237][0238]
其中v4为具有seq id no:4的氨基酸序列的glp
‑
2类似物变体#4。在另一个实施方案中,该结构被称为peg20ma
‑
fms
‑
v4或peg20
‑
fms
‑
v4。
[0239]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0240][0241]
其中v4为具有seq id no:4的氨基酸序列的glp
‑
2类似物变体#4。在另一个实施方案中,该结构被称为peg20ma
‑
fmoc
‑
v4或peg20
‑
fmoc
‑
v4。
[0242]
在一个实施方案中,本发明的长效glp
‑
2类似物由以下结构呈现:
[0243][0244]
其中v4为具有seq id no:4的氨基酸序列的glp
‑
2类似物变体#4,并且cys为半胱氨酸。在另一个实施方案中,该结构被称为cys
‑
mal
‑
fms
‑
v4或cys
‑
fms
‑
v4。
[0245]
在一个实施方案中,本发明涉及长效glp
‑
2类似物用于治疗炎症、低度炎症或损伤的治疗和相关用途。在另一个实施方案中,本发明涉及长效glp
‑
2类似物通过改善抗炎作用用于治疗炎症、低度炎症或损伤的治疗和相关用途。在另一个实施方案中,本发明涉及长效
glp
‑
2类似物的抗炎用途。
[0246]
在一个实施方案中,术语“增加水平”或“延长”是指相对于原始、野生型、正常或对照水平增加约1%
‑
10%。在另一个实施方案中,增加为约11%
‑
20%。在另一个实施方案中,增加为约21%
‑
30%。在另一个实施方案中,增加为约31%
‑
40%。在另一个实施方案中,增加为约41%
‑
50%。在另一个实施方案中,增加为约51%
‑
60%。在另一个实施方案中,增加为约61%
‑
70%。在另一个实施方案中,增加为约71%
‑
80%。在另一个实施方案中,增加为约81%
‑
90%。在另一个实施方案中,增加为约91%
‑
95%。在另一个实施方案中,增加为约96%
‑
100%。
[0247]
在另一个实施方案中,“药物组合物”是指如本文所述的glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或非可逆聚乙二醇化glp
‑
2类似物与其他化学组分诸如生理学上合适的载体和赋形剂的制剂。药物组合物的目的是促进化合物向生物体的施用。在另一个实施方案中,glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或非可逆聚乙二醇化glp
‑
2类似物负责生物作用。
[0248]
在另一个实施方案中,可互换使用的短语“生理学上可接受的载体”和“药学上可接受的载体”是指不引起对生物体的显著刺激并且不消除所施用化合物的生物活性和特性的载体或稀释剂。佐剂包括在这些短语下。在一个实施方案中,包括在药学上可接受的载体中的成分中的一者可以为例如聚乙二醇(peg),一种在有机和含水介质两者中具有宽范围溶解度的生物相容性聚合物(mutter等人(1979))。
[0249]
对于治疗用途,将所选择的glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2类似物与药学上可接受且适于通过所选择的施用途径递送肽的载体一起配制。合适的药学上可接受的载体为那些常规用于基于肽的药物的载体,诸如稀释剂、赋形剂等。对于一般的药物配方指南,参见“remington's pharmaceutical sciences”,第17版,mack publishing company,easton,pa.,1985。在本发明的一个实施方案中,化合物被配制用于通过输注施用,例如当用作完全肠胃外营养疗法患者的液体营养补充剂时,或通过例如皮下、肌内或静脉内注射施用,并且因此以无菌和无热原形式的水溶液使用,并任选地缓冲至生理可耐受的ph,例如微酸性或生理ph。因此,化合物可在媒介物诸如蒸馏水中施用,或更理想地在盐水、磷酸盐缓冲盐水或5%右旋糖溶液中施用。如果需要,glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2的水溶性可通过包含溶解度增强剂诸如乙酸来增强。
[0250]
在另一个实施方案中,“赋形剂”是指添加到药物组合物中以进一步促进长效glp
‑
2类似物的施用的惰性物质。在一个实施方案中,赋形剂包括碳酸钙、磷酸钙、各种糖和各种类型的淀粉、纤维素衍生物、明胶、植物油、聚山梨醇酯20、聚山梨醇酯80和聚乙二醇。
[0251]
在另外的方面,本发明提供了一种用于促进有需要的患者的小肠组织生长的方法,该方法包括向患者递送肠营养量的本发明的glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2类似物的步骤。
[0252]
一般来讲,受益于小肠质量增加和随之而来的小肠粘膜功能增加的患者是用glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2类似物治疗的候选者。可用glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2类似物治疗的特定病症包括各种形式的口炎性腹泻,包括乳糜泻性腹泻,其由对来自小麦的α
‑
麦醇溶蛋白的毒性反应引起并且以小肠绒毛的大量损失为标志;热带口炎性腹泻,其由感染引起并且以绒毛的部分扁平化为标志;低丙种球蛋白血症性腹泻,其通常在具有常见的可变免疫缺陷或低丙种球蛋白血症的患者中观察到并且以绒毛高度显著降低为标志。glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2类似物治疗的治疗功效可通过肠道活检以检查绒毛形态、通过营养吸收的生化评估、通过患者体重增加、或通过与这些病症相关的症状的改善来监测。可用glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2类似物治疗、或者glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
s、meofmoc或nrfmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2类似物可用于预防的其他病症包括放射性肠炎、感染性或感染后肠炎、局限性肠炎(克罗恩氏病)、由毒性剂或其他化疗剂引起的小肠损害、由外科手术引起的肠道并发症或损害以及具有短肠综合征的患者。
[0253]
用于治疗癌症的化疗(ct)和放射疗法(rt)靶向快速分裂的细胞。由于肠隐窝(小肠的简单管状腺体)的细胞迅速增殖,ct/rt倾向于产生肠粘膜损害作为副作用。胃肠炎、腹泻、脱水以及在某些情况下,随后可能会发生菌血症和败血症。这些副作用是严重的,原因有两个:它们为疗法的剂量设定了限制,从而也为疗法的功效设定了限制,并且它们代表了潜在的危及生命的病症,这需要密集且昂贵的治疗。
[0254]
在一个实施方案中,本发明涉及本文所述的长效glp
‑
2类似物用于制备药剂的用途,该药剂用于治疗肠病、小肠综合征、炎性肠综合征、结肠炎(包括胶原性结肠炎、放射性结肠炎、溃疡性结肠炎)、慢性放射性肠炎、非热带(麸质不耐受)和热带口炎性腹泻、乳糜泻(麸质敏感性肠病)、血管阻塞或创伤后的组织损害、腹泻(例如旅行者腹泻和感染后腹泻)、慢性肠功能障碍、脱水、菌血症、脓毒症、神经性厌食症、化疗后的组织损害(例如化疗引起的肠粘膜炎)、早产儿(包括早产儿的肠道衰竭)、出生前婴儿(包括出生前婴儿的肠道衰竭)、硬皮病、胃炎(包括萎缩性胃炎、窦切除术后萎缩性胃炎和幽门螺旋杆菌胃炎)、胰腺炎、全身脓毒性休克溃疡、肠炎、盲管、淋巴管梗阻、血管疾病和移植物抗宿主病、外科手术后愈合、放射后萎缩和化疗、帕金森氏病体重减轻、外科手术后肠道适应、肠道外营养引起的粘膜萎缩(例如全肠道外营养(tpn)引起的粘膜萎缩)和骨相关障碍(包括骨质疏松症、恶性肿瘤高钙血症、骨转移引起的骨质减少)、牙周病、甲状旁腺功能亢进、类风湿性关节炎的关节周糜烂、佩吉特氏病、骨营养不良、骨化性肌炎、别赫捷列夫氏病、恶性高钙血症、骨转移产生的溶骨性病变、固定引起的骨丢失、性类固醇激素缺乏引起的骨丢失、类固醇激素治疗引起的骨异常、由癌症治疗引起的骨异常、骨软化症、白塞氏病、骨软化症、骨质增生、骨硬化症、转移性骨病、固定引起的骨质减少、或糖皮质激素引起的骨质疏松症。
[0255]
在一个实施方案中,本发明涉及本文所述的长效glp
‑
2类似物在制备药剂中的用途,该药剂用于治疗酸引起的肠道损伤、精氨酸缺乏症、自身免疫疾病、细菌性腹膜炎、肠缺血、肠创伤、烧伤引起的肠道损害、分解代谢疾病、乳糜泻、化疗相关菌血症、化疗引起的肠
炎、胃肠动力下降、糖尿病、腹泻疾病、脂肪吸收不良、发热性中性粒细胞减少症、食物过敏、胃溃疡、胃肠屏障障碍、胃肠损伤、低血糖、特发性精子减少、炎性肠病、肠道衰竭、肠道功能不全、肠易激综合征、局部缺血、营养不良、肠系膜缺血、粘膜炎、坏死性小肠结肠炎、坏死性胰腺炎、新生儿喂养不耐受、新生儿营养不足、nsaid引起的胃肠损害、营养不足、肥胖症、隐窝炎、放射引起的肠炎、放射引起的肠损伤、脂肪泻、中风或全肠道外营养对胃肠道的损害。
[0256]
在另一个实施方案中,可以用长效glp
‑
2类似物治疗的特定病症包括胃或食管的各种形式的炎性疾病,以及已经历上胃肠道的部分或亚全切除的患者。可用本发明的长效glp
‑
2类似物或其混合物治疗的包括胃和食管的上胃肠道的病症的非穷举性列表包括胃部障碍,如急性胃炎、急性出血性胃炎、急性应激性胃炎、病毒性胃炎、寄生虫性胃炎、真菌性胃炎、胃病(急性)、出血性胃病、急性幽门螺旋杆菌胃炎、a、b或c型胃炎、高分泌性胃炎、幽门螺旋杆菌继发的非特异性胃炎、幽门螺旋杆菌相关性胃炎、化学性胃炎、反应性胃炎、反流性胃炎、胆汁性胃炎、化生性萎缩性胃炎和环境化生性萎缩性胃炎、特发性全胃炎、弥漫性躯体胃炎、自身免疫性慢性胃炎和自身免疫性相关性胃炎、幽门螺杆菌以外的细菌性胃炎(人胃螺菌(gαstrospirillum hominis)、蜂窝织炎(phlegmonous)、分枝杆菌、梅毒)、窦切除术后萎缩性胃炎、嗜酸性胃炎和任何其他急性感染性胃炎、克罗恩氏病、结节病、孤立性肉芽肿性胃炎、淋巴细胞性胃炎、门内特里埃氏(menetrier)病;以及食管障碍,如由真菌如念珠菌属(尤其是白色念珠菌)、曲霉属、荚膜组织胞浆菌、皮炎芽生菌、或由病毒如单纯疱疹病毒(1型)、巨细胞病毒、水痘
‑
带状疱疹病毒、或由细菌如结核分枝杆菌、以色列放线菌、草绿色链球菌、嗜酸乳杆菌和苍白密螺旋体引起的感染性食道炎。食管的其他障碍包括但不限于非感染性食道炎、酸反流、胆汁反流、化学损伤(由药物、毒素、酸、碱等引起)、结节病、克罗恩氏病、白塞氏病、移植物抗宿主病、ajds相关感染(隐孢子虫属、微孢子虫属、贝氏等孢球虫(isospora beill)、贾第鞭毛虫、沙门氏菌属、志贺氏菌属、弯曲杆菌属、结核分枝杆菌、鸟分枝杆菌复合群(mycobacterium avium complex)、艰难梭菌、巨细胞病毒和单纯疱疹。
[0257]
在另一个实施方案中,可用长效glp
‑
2类似物治疗的其他疾病或病症包括小肠道粘膜异常,其包括溃疡和炎性障碍;先天性或获得性消化和吸收障碍,包括吸收不良综合征;以及由小肠粘膜功能丧失引起的疾病和病症,特别是在经历长期肠胃外进食的患者中或由于手术而经历了小肠切除并患有短肠综合征和盲管综合征的患者中,非常普遍将受益于小肠质量增加和随之而来的小肠粘膜功能增加的患者是用长效glp
‑
2类似物治疗的候选者。可用本发明长效glp
‑
2类似物治疗的特定病症包括各种形式的口炎性腹泻,包括乳糜泻,其由对来自小麦的麦醇溶蛋白的毒性反应引起并且以小肠绒毛的大量损失为标志;热带口炎性腹泻,其由感染引起并且以绒毛的部分扁平化为标志;低丙种球蛋白血症性腹泻,其通常在具有常见的可变免疫缺陷或低丙种球蛋白血症的患者中观察到并且以绒毛高度显著降低为标志。可用本发明长效glp
‑
2类似物治疗或它们可用于预防的其他病症包括放射性肠炎、感染性或感染后肠炎、局限性肠炎(克罗恩氏病)、由于毒性剂或其他化疗剂引起的小肠损害以及患有短肠综合征的患者。
[0258]
最适合于患者治疗的治疗剂量和方案当然将随待治疗的疾病或病症并根据患者的体重和其他参数而变化。下文呈现的结果证实,在10天内每天施用两次大概相当于约15mg/kg(或更少)的glp
‑
2肽剂量可在大鼠中产生小肠质量的非常显著的增加。预期小得多
的剂量,例如在μg/kg范围内,以及更短或更长的持续时间或治疗频率,也将产生治疗有用的结果,即统计学上显著的增加,特别是小肠质量或任何其他相关的临床有意义的结果。而且,预期治疗方案将包括施用适于使在初始治疗停止后发生的组织退化可逆的维持剂量。最适合人使用的剂量大小和给药方案由本文呈现的结果指导,并且可在适当设计的临床试验中得到证实。
[0259]
在一个实施方案中,长效glp
‑
2类似物(特定肽含量)的典型人剂量将为约10ug/kg体重/天至约10mg/kg/天、或约50ug/kg/天至约5mg/kg/天、或约100ug/kg/天至约1mg/kg/天。在另一个实施方案中,长效glp
‑
2类似物的典型剂量将为约100ng/kg体重/天至1mg/kg/天、或1μg/kg/天至500μg/kg/天、或1μg/kg/天至100μg/kg/天。
[0260]
在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每天施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每36小时施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每48小时施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每60小时施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每72小时施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每84小时施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每96小时施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每5天施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每6天施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每7天施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每8
‑
10天施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每10
‑
12天施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每12
‑
15天施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每15
‑
25天施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每周施用两次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每周施用一次。在另一个实施方案中,包含本发明的长效glp
‑
2类似物的药物组合物每隔一周施用一次。
[0261]
在另一个实施方案中,长效glp
‑
2类似物的典型人剂量为约10μg/kg体重/每周两次至约10mg/kg/每周两次、或约50μg/kg/每周两次至约5mg/kg/每周两次、或约100μg/kg/每周两次至1mg/kg/每周两次。在另一个实施方案中,长效glp
‑
2类似物的典型剂量将为约100ng/kg体重/每周两次至1mg/kg/每周两次、或1μg/kg/每周两次至500μg/kg/每周两次、或1μg/kg/每周两次至100μg/kg/每周两次。
[0262]
在一个实施方案中,长效glp
‑
2类似物的典型人剂量将为约10ug/kg体重/周至约10mg/kg/周、或约50ug/kg/周至约5mg/kg/周、或约100ug/kg/周至约1mg/kg/周。在另一个实施方案中,长效glp
‑
2类似物的典型剂量将为约100ng/kg体重/周至1mg/kg/周、或1μg/kg/周至500μg/kg/周、或1μg/kg/周至100μg/kg/周。
[0263]
在一个实施方案中,长效glp
‑
2类似物的典型人体剂量为约10μg/kg体重/每隔一周至约10mg/kg/每隔一周、或约50μg/kg/每隔一周至约5mg/kg/每隔一周、或约100μg/kg/每隔一周至1mg/kg/每隔一周。在另一个实施方案中,长效glp
‑
2类似物的典型剂量将为约100ng/kg体重/每隔一周至1mg/kg/每隔一周、或1μg/kg/每隔一周至500μg/kg/每隔一周、
或1μg/kg/每隔一周至100μg/kg/每隔一周。
[0264]
在一个实施方案中,长效glp
‑
2类似物的典型人剂量将为约50μg/kg/每周两次。在一个实施方案中,长效glp
‑
2类似物的典型人剂量将为约50μg/kg/周。在一个实施方案中,长效glp
‑
2类似物的典型人剂量将为约50ug/kg/每隔一周。
[0265]
在另一个实施方案中,偶联到接头本发明的所述fms、mal
‑
fms、fmoc、mal
‑
fmoc、或meofmoc或它们的组合的缀合物或肽通过肌内(im)注射、皮下(sc)注射或静脉内(iv)注射每周施用一次。
[0266]
在另一个实施方案中,本发明的肽的合适施用途径例如包括经口、直肠、经粘膜、经鼻、肠或肠胃外递送,包括肌内、皮下和髓内注射以及鞘内、直接脑室内、静脉内、腹膜内、鼻内或眼内注射。
[0267]
在另一个实施方案中,可向个体本身提供glp
‑
2类似物、仅连接到fmoc、mal
‑
fmoc、fms、mal
‑
fms或meofmoc的glp
‑
2类似物、或可逆或不可逆聚乙二醇化glp
‑
2类似物。在一个实施方案中,本发明可作为药物组合物的一部分提供给个体,其中本发明与药学上可接受的载体混合。
[0268]
在一个实施方案中,遵循表9中概述的以下合成方案,以产生在每列顶部列出的缀合物。在另一个实施方案中,表9中的合成方案可用于任何glp
‑
2类似物或变体。
[0269]
表9
[0270]
[0271][0272]
实施例
[0273]
实施例1:mal
‑
fmoc
‑
nhs、mal
‑
fms
‑
nhs、mal
‑
接头
‑
osu的合成及mal
‑
接头
‑
osu的操纵
[0274]
肽通过固相方法合成,在整个肽链组装中采用fmoc策略(almac sciences,scotland),并且如图7所示。
[0275]
使用以下步骤组装肽序列:
[0276]
1.封端
[0277]
使用0.5m乙酸酐(fluka)于dmf(rathburn)中的溶液将树脂封端。
[0278]
2.脱保护
[0279]
使用在dmf(rathburn)中的20%v/v哌啶(rathburn)溶液从生长肽链中去除fmoc保护基团。
[0280]
3.氨基酸偶联
[0281]
使用在dmf(rathburn)中的1m hobt(carbosynth)溶液和在dmf(rathburn)中的1m dic(carbosynth)溶液活化在dmf(rathburn)中的0.5m氨基酸(novabiochem)溶液。每次偶联使用4当量的每种氨基酸。
[0282]
将粗肽从树脂上裂解,并通过在三异丙基硅烷(fluka)、水、二甲基硫化物(aldrich)、碘化铵(aldrich)和tfa(applied biosystems)的混合物中搅拌4小时来去除保护基团。通过从冷乙醚沉淀来收集粗肽。
[0283]
肽纯化
[0284]
将粗肽溶解在乙腈(rathburn)/水(milliq)(5:95)中并加载到制备型hplc柱上。色谱参数如下:
[0285]
柱:phenomenex luna c18 250mm x 30,15μm,300a
[0286]
流动相a:水+0.1%v/v tfa(applied biosystems)
[0287]
流动相b:乙腈(rathburn)+0.1%v/v tfa(applied biosystems)
[0288]
uv检测:214nm或220nm
[0289]
梯度:超过4个柱体积的25%b至31%b
[0290]
流速43ml/min
[0291]
阶段2
‑
接头合成(图9)
[0292]
化合物2
‑
5的合成(图9)基于由albericio等人在synthetic communication,2001,31(2),225
‑
232中描述的程序。
[0293]2‑
(boc
‑
氨基)芴(2):
[0294]
在冰浴中磁力搅拌下,将2
‑
氨基芴(18g,99mmol)悬浮在二噁烷:水(2:1)(200ml)和2n naoh(60ml)的混合物中。然后添加boc2o(109mmol,1.1当量)并在rt下继续搅拌。通过tlc(rf=0.5,己烷/乙酸乙酯2:1)监测反应并通过添加2n naoh将ph维持在9
‑
10之间。在反应完成时,将悬浮液用1m khso4酸化至ph=3。将固体过滤并用冷水(50ml)、二噁烷
‑
水(2:1)洗涤,然后与甲苯共沸两次,然后将其用于下一步。
[0295]9‑
甲酰基
‑2‑
(boc
‑
氨基)芴(3):
[0296]
在3颈rbf中,将nah(在油中60%;330mmol,3.3当量)悬浮在无水thf(50ml)中,在20分钟内滴加步骤2中描述的
‑
(boc
‑
氨基)氟(28g;100mmol)于无水thf(230ml)中的溶液。观察到粘稠的黄色浆液,并将混合物在氮气下在rt下搅拌10分钟。滴加甲酸乙酯(20.1ml,250mmol,2.5当量)(注意:气体逸出)。浆液变成淡棕色溶液。将溶液搅拌20分钟。通过tlc(rf=0.5,己烷/乙酸乙酯1:1)监测反应并且当仅观察到痕量的起始物质时,将其用冰水(300ml)淬灭。将混合物减压蒸发,直到大部分thf已被去除。将所得混合物用乙酸处理至ph=5。将获得的白色沉淀溶解在乙酸乙酯中并分离有机层。将水层用乙酸乙酯萃取,并且将所有有机层合并并用饱和碳酸氢钠、盐水洗涤,并且经mgso4干燥。在过滤和去除溶剂后,得到黄色固体。将该物质用于下一步。
[0297]9‑
羟甲基
‑2‑
(boc
‑
氨基)芴(4):
[0298]
将来自上述的化合物3悬浮在meoh(200ml)中,并且在15分钟内分批添加硼氢化钠。将混合物搅拌30分钟(注意:放热反应和气体逸出)。通过tlc(rf=0.5,己烷/etoac 1:1)监测反应并已完成。添加水(500ml),并用乙酸将ph调节至5。后续工作涉及用乙酸乙酯萃取两次,将合并的有机层用碳酸氢钠和盐水洗涤,经mgso4干燥,过滤并浓缩至干。将获得的粗产物通过烧瓶色谱使用庚烷/etoac(3:1)纯化,得到黄色泡沫(36g,97.5%纯度,在1h
‑
nmr中观察到痕量的乙酸乙酯和乙醚)。
[0299]
mal
‑
fmoc
‑
nhs(7):
[0300]
在环境温度下,向具有置顶式搅拌的清洁干燥的500ml rbf中装入在无水thf(55ml)中的三光气(1.58g,0.35当量),以形成溶液。用冰/水浴将其冷却至0℃,并且在0℃下在氮气下,在10分钟内滴加nhs(0.67g,0.38当量)于无水thf(19ml)中的溶液。将所得溶液搅拌30分钟。在0℃下在10分钟内滴加另外部分的nhs(1.34g,0.77当量)的无水thf(36ml)溶液并搅拌15分钟。
[0301]
将化合物6(5.5g,1当量)、无水thf(55ml)和吡啶(3.07ml,2.5当量)一起搅拌以形成悬浮液。在0
‑
5℃下将其分批添加到nhs溶液中,然后通过移除冰浴使其进入rt。
[0302]
20小时后反应停止(起始物质仍然存在,如果反应进行到完全,则观察到二聚体杂质)。
[0303]
将反应混合物过滤,并且向滤液中添加4%盐水(200ml)和etoac(200ml)。在分离后,将有机层用5%柠檬酸(220ml)和水(220ml)洗涤。然后将有机层浓缩,得到7.67g粗的mal
‑
fmoc
‑
nhs。将该物质通过柱色谱使用梯度环己烷/etoac 70:30至40:60纯化。将含有产物的级分真空浓缩,得到3.47g(45%)的mal
‑
fmoc
‑
nhs。
[0304]
mal
‑
fms
‑
nhs
[0305]
向mal
‑
fmoc
‑
nhs(100mg,0.2mmol)于三氟乙酸(10ml)中的溶液中添加氯磺酸(0.5ml)。15分钟后,添加冰冷的乙醚(90ml)并沉淀产物。将该物质通过离心收集,用乙醚洗涤并真空干燥。得到41.3mg(35%)的米黄色固体。
[0306]
实施例2:替度鲁肽的可逆聚乙二醇化技术在sd大鼠中的药代动力学和药理学作用
[0307]
将可逆聚乙二醇化技术应用于可商购获得的glp
‑
2类似物替度鲁肽(glp
‑2‑
gly2),以便评估其在sd大鼠中的寿命和功效。以下peg重量和接头与替度鲁肽缀合:peg30
‑
fms
‑
(glp
‑2‑
gly2)、peg40
‑
fms
‑
(glp
‑2‑
gly2)、peg40
‑
fmoc
‑
(glp
‑2‑
gly2)、peg支链40
‑
fms
‑
(glp
‑2‑
gly2)、peg支链30
‑
fms
‑
(glp
‑2‑
gly2)。另外,以下不可逆聚乙二醇化缀合至glp
‑2‑
gly2:peg40
‑
emcs
‑
(glp
‑2‑
gly2)。
[0308]
在该研究中,该缀合物由含有经由接头在n末端处附接到glp
‑
2的peg和经由接头在glp
‑
2的第三十号位置上的赖氨酸残基(lys30)处附接到glp
‑
2的peg的混合物的异质产物组成。支链聚乙二醇化由(peg)2
‑
r
‑
sh表示,其中r为glp
‑
2缀合物。
[0309]
在药理学研究中,在第1天和第3天以1mg/kg(肽剂量)皮下注射缀合物两次,并在第6天进行肠称重。除聚乙二醇化缀合物之外,以相同剂量和方案注射glp
‑2‑
gly2以供比较。将每组的肠重量平均值与媒介物组的肠重量平均值进行比较。
[0310]
表1:不同缀合的glp
‑
2的肠重量研究结果
[0311][0312][0313]
a
物质剂量基于其肽含量和纯度计算
[0314]
与对照相比的平均肠重量、变异系数百分比(%cv)和肠重量百分比的增加呈现在表1中。与媒介物相比,1mg/kg的替度鲁肽的两次注射方案无效并且不增加肠重量。然而,使
用替度鲁肽的可逆聚乙二醇化技术显著改善了对大鼠肠重量的功效(p<0.001),其中肠重量增加在42%
‑
73%之间。与媒介物组相比,不可逆缀合物显示出肠重量的显著增加(p<0.01),然而,与单独使用替度鲁肽实现的作用相比,没有显著差异。三种直链聚乙二醇化缀合物(peg30
‑
fms
‑
(glp
‑2‑
gly2)、peg40
‑
fms
‑
(glp
‑2‑
gly2)和peg40
‑
fmoc
‑
(glp
‑2‑
gly2))显示出肠重量最显著的增加。另外,用替度鲁肽进行的几项研究表明,以2.5mg/kg每天注射五天导致肠重量平均增加25%。因此,glp
‑2‑
gly2的可逆聚乙二醇化不仅导致更好的疗效,而且还使用更低的肽剂量和注射频率来实现。
[0315]
为了评估可逆聚乙二醇化技术对延长替度鲁肽半衰期的潜力,除peg40
‑
fmoc
‑
(glp
‑2‑
gly2)(其以1mg/kg注射(由于物质缺乏))和peg支链40
‑
fms
‑
(glp
‑2‑
gly2)之外,将上述缀合物以2mg/kg(肽剂量)注射一次。在给药前、给药后0.5、2、4、8、12、24、48、72、96、168、216和240小时收集血浆样品。使用商业glp2 elisa试剂盒测量缀合物和游离替度鲁肽的水平。
[0316]
表2:不同缀合的glp
‑2‑
gly2的半衰期(t
1/2
)结果
[0317][0318]
t
1/2
值呈现在表2中。替度鲁肽可检测长达4小时,半衰期为0.9小时,而在168h(第7天)时,可逆缀合的替度鲁肽仍可见,其半衰期显著增加(在13.1至24.3之间)。由于肽的恒定聚乙二醇化,不可逆替度鲁肽显示出最长的半衰期(27.5h)。
[0319]
在不同的研究中,以单剂量1mg/kg注射几种聚乙二醇化替度鲁肽,并且在第6天进行肠称重。结果呈现在表3中。
[0320]
表3:第6天时不同缀合的glp
‑2‑
gly2的肠重量研究结果
[0321][0322]
a
两项研究的平均值
[0323]
实施例3:突变/修饰的glp
‑
2肽变体的构建
[0324]
进行了具有增强的药代动力学/药效学(pk/pd)曲线的glp
‑
2类似物的构建。构建的glp
‑
2类似物基于(1)它们的理化特性和它们的化学、制造和控制(cmc)考虑因素以及(2)它们的生物性能进行评估。因此,对glp
‑
2天然序列诱导点突变。旨在阐明肽在cmc特征和生物性能方面的潜力的序列突变及其特定组合呈现于表4中。表4中的变体1和10用作稳定性和生物性能的对照,并且这些变体目前正在临床开发中。
[0325]
改进的glp
‑
2类似物还可与peg和接头、或单独的接头、或与如在整个申请中所述
的具有还原的马来酰亚胺基团的接头缀合,以获得寿命和活性的优势。表4:突变的glp
‑
2变体
[0326][0327][0328]
在37℃下温育t=0、1天和48小时后,经由外观、o.d.读数(a.280和a.325)和rp
‑
hplc(纯度和峰面积)测试glp
‑
2类似物的稳定性。下表5强调了在仅一个突变不同的序列中的这些特征(在37℃下温育48小时后),但令人惊讶的是,这些glp
‑
2类似物在cmc方面表现出不同的特征(研究参考0042)。
[0329]
表5.关于aa序列突变的cmc特征(在37℃下温育48小时后)
[0330][0331][0332]
进行若干其他研究(研究参考51、55和59)以确定类似物在不同缓冲液体系(组氨酸和napi,ph在6.8至7.5之间)、肽浓度(1mg/ml
‑
10mg/ml)和温育时间(在37℃下至多3天)以及冻融应激(至多三个循环)后的溶解度和稳定性。从组合纯度和溶解度的cmc角度来看,与v4相比,变体6
‑
7显示出类似的特征,并且所有三种(变体4、6和7)都优于其余肽。
[0333]
使用最具前景的glp
‑
2变体进行药理学和药代动力学研究,以分别评估其功效和寿命。进行大鼠中的肠重量模型以通过测量相对于媒介物组经治疗动物的肠重量增加百分比来评估功效。在本研究中,在第1天和第3天以1mg/kg注射肽两次,并在第6天进行肠称重。结果总结在表6中。
[0334]
表6:修饰的肽的药理学和药代动力学结果
[0335]
[0336]
如表6中所示,变体4和6显示出改善的功效,其中肠重量百分比分别增加89%和43%。
[0337]
为了评估血清半衰期的延长,向大鼠施用15mg/kg的不同肽,在不同时间点采集血液样品,并且创建药代动力学曲线。计算的t
1/2
值总结在表6中。
[0338]
变体4和6显示出最大延长的半衰期和改善的功效,因此将它们与不同的peg和接头缀合以进一步改善寿命。
[0339]
实施例4:修饰的gglp
‑
2变体与glp
‑
2受体的结合亲和力
[0340]
通过使用基于细胞的测定(cba),在存在递增剂量的不同肽的情况下评估不同肽的体外结合亲和力。细胞过表达glp
‑
2受体,并且在肽结合时,它们给出用于计算ec
50
值的信号。ec
50
值总结在表7中。与在位置2处含有单个取代的对照glp
‑
2(glp
‑2‑
gly2,替度鲁肽)相比,突变的glp
‑
2肽已显示出较低的结合亲和力。尽管突变的变体#2
‑
7已显示出结合亲和力的相似结果(ec
50
范围在13至36之间),但仅两个变体显示出体内功效的显著改善,如通过肠重量模型所测量的(表6)。甚至与glp2试剂盒对照相比,替度鲁肽也显示出最高的结合亲和力,其中ec
50
为5.6nm。尽管具有最低的ec
50
,但glp
‑2‑
gly2显示出中等的体内功效,在6天内每天注射后肠道重量增加~25%(表1)。
[0341]
表7:不同修饰的肽的ec
50
结果
[0342][0343]
通过评估如通过对glp2
‑
受体的
体外
结合亲和力测量的ec50(nm),进行v4与其他基于glp2的药物的进一步比较。在3个独立的cba中比较v4、阿帕鲁肽、格帕鲁肽和替度鲁肽(表8)。v4与阿帕鲁肽和格帕鲁肽相比一致地显示较低的ec
50
值。甚至与glp2(discoverx)的阳性对照相比,替度鲁肽也一致地显示最低的ec
50
。平均而言,与替度鲁肽相比,v4、阿帕鲁肽和格帕鲁肽显示ec
50
分别增加了1.8倍、2.9倍和9.4倍。表7和表8之间的绝对ec
50
值不同,这很可能是由于glp
‑
2r测定试剂盒的变化,该试剂盒含有来自不同批号的细胞。尽管两个表之间的ec
50
值不同,但ec
50
趋势非常相似:v4>试剂盒对照>替度鲁肽。
[0344]
表8.基于glp2
‑
受体cba测定的v4、替度鲁肽、阿帕鲁肽和格帕鲁肽的ec
50
值。
[0345][0346]
实施例5:缀合的glp
‑
2变体的构建
[0347]
将peg(在20kda和40kda之间)和接头(fms、fmoc或meofmoc)的若干组合与所选择的glp
‑
2变体#4和#6缀合。
[0348]
使用突变肽变体#6合成三种不同的聚乙二醇化glp
‑
2变体并将其注射到大鼠中,以评估其在肠模型中的功效。在该研究中,glp
‑
2变体#6的聚乙二醇化多肽由含有经由接头在n末端处附接到变体#6的peg和经由接头在第三十号位置上的赖氨酸残基(lys30)处附接到变体#6的peg的混合物的异质产物组成。
[0349]
在第1天以1mg/kg剂量注射peg20
‑
fms
‑
v6、peg20
‑
fmoc
‑
v6和peg40
‑
fms
‑
v6一次,而在第1天和第3天还以1mg/kg剂量注射组d两次。在第6天进行肠称重。结果呈现在表9中。
[0350]
表9:可逆聚乙二醇化glp
‑
2变体6的药理学结果
[0351][0352]
表9中描述的聚乙二醇化glp
‑
2变体#4多肽的合成方法由两个步骤组成,其中接头的偶联在glp
‑
2变体肽在树脂上时对其以受控和定点方式进行。设计能够保护肽活性基团诸如但不限于n端、his侧链、lys侧链的化学保护基团导致位点导向的接头偶联,其中一个或多个接头(类型上同质或异质)可特异性连接到突变的glp
‑
2肽。在接头偶联到树脂上的肽之后,如果需要,可使用但不限于含硫醇分子(例如,半胱氨酸)来进行马来酰亚胺活性基团还原。在肽偶联后,使用本领域技术人员已知的常规方法进行从树脂的裂解和纯化。在肽
‑
接头纯化后,在mal
‑
接头
‑
肽的马来酰亚胺活性基团未被还原的情况下,用纯化的mal
‑
接头
‑
glp
‑
2变体进行聚乙二醇化。通过利用这种树脂上程序,可合成两种同质缀合变体:peg
‑
接头
‑
(n端)
‑
glp
‑
2变体、peg
‑
接头
‑
(lys30)
‑
glp
‑
2变体(图9)。
[0353]
聚乙二醇化glp
‑
2变体#4多肽的制造方法包括glp
‑
2变体肽的固相肽合成(spps)(阶段1)、fmoc接头(预接头)与fms接头的磺化(阶段2
‑
任选)、接头与spps树脂上的glp
‑
2变体的偶联、马来酰亚胺基团的还原(任选
‑
在不期望聚乙二醇化的情况下)、从树脂上裂解肽(阶段3.1)、作为关键中间体的mal
‑
接头
‑
glp
‑
2(或接头
‑
肽)变体或api(如果将不发生聚乙二醇化)的纯化(阶段3.2)、mal活性基团未被还原情况下的聚乙二醇化和纯化(阶段4)、盐交换和微过滤(阶段5)和最终冻干(阶段6)。
[0354]
在该研究中,glp
‑
2变体#4的聚乙二醇化多肽由含有经由接头在n末端处附接到变体#4的peg的同质产物组成。
[0355]
单剂量的1mg/kg的可逆聚乙二醇化变体6未显示出肠重量增加。然而,1mg/kg的两次注射显示出显著增加(p<0.001)。
[0356]
以2mg/kg(肽剂量)注射使用突变肽#4的三种不同的可逆聚乙二醇化glp
‑
2变体,每6天一次,持续12天。在第12天,对肠称重并与对照组比较。还以0.5mg/kg注射peg30
‑
fms
‑
v4,以评估功效剂量范围。结果总结在表10中。
[0357]
表10:可逆聚乙二醇化glp
‑
2变体4的药理学结果
[0358][0359]
a
物质剂量基于其肽含量和纯度计算
[0360]
可逆聚乙二醇化glp
‑
2变体4以1mg/kg给药,每6天一次,持续12天,显示出肠重量的显著增加(分别为15和29%,p<0.01或p<0.001。此外,较低剂量的peg30
‑
fms
‑
v4(0.5mg/kg)在12天的治疗后没有导致肠增加。
[0361]
实施例6:缀合变体4的不同构建体对肠上皮结构的影响
[0362]
除了已通过小肠重量评估(如实施例5中所示)评估的peg30
‑
fms
‑
v4和peg30
‑
fmoc
‑
v4之外,还合成了四种其他可逆聚乙二醇化变体4(“v4”)缀合物和两种可逆接头
‑
v4缀合物。将上述所有以2mg/kg(肽剂量)注射到6只正常sd大鼠/组一次,而在第6天时,处死动物,并对小肠称重,随后进行组织病理学评估。glp
‑
2类似物可显著增加绒毛高度和隐窝深度。因此,用苏木精和曙红对来自肠的三个区域(十二指肠、空肠和肠骨)的切片进行染色,并且测量至少7个隐窝+绒毛长度/切片。将每个治疗组(n=6)的平均绒毛+隐窝长度与媒介物组(阴性对照)进行比较,并计算为相对于媒介物的增加百分比。
[0363]
除了可逆聚乙二醇化缀合物之外,还使用不可逆聚乙二醇化v4缀合物来评估所研究的缀合物的可逆特征的优点。两个不同研究的结果总结在图1和图2以及表11中(研究15198和15202),其中对上述v4缀合物进行药理学比较。
[0364]
贯穿图1
‑
图3使用的术语“v4”是指具有以下氨基酸序列的glp
‑
2类似物变体#4:nh2
‑
hgegsfsde(nle)ntildllaardfinwliqtkitd
‑
nh2(seq id no:4)。
[0365]
贯穿图1
‑
图3使用的术语“mal
‑
fms
‑
v4”是指以下结构:
[0366][0367]
贯穿图1
‑
图3使用的术语“peg30
‑
fmoc
‑
v4”是指以下结构:
[0368][0369]
贯穿图1
‑
图3使用的术语“peg30
‑
nrf
‑
v4”是指以下结构:
[0370][0371]
贯穿图1
‑
图3使用的术语“peg30
‑
meof
‑
v4”是指以下结构:
[0372][0373]
贯穿图1
‑
图3使用的术语“peg30
‑
fms
‑
v4(lys)”是指以下结构:
[0374]
其中该接头在glp
‑
2类似物的赖氨酸位置30处附接到glp
‑
2变体#4。
[0375]
贯穿图1
‑
图3使用的术语“peg30
‑
fms
‑
v4”是指以下结构:
[0376][0377]
贯穿图1
‑
图3使用的术语“peg20ma
‑
fms
‑
v4”是指以下结构:
[0378]
贯穿图1
‑
图3使用的术语“peg20ma
‑
fmoc
‑
v4”是指以下结构:
[0379][0380]
图1示出了不同v4缀合物的药理学作用,如通过相对于媒介物的隐窝加绒毛长度增加百分比所测量的。
[0381]
表11总结了不同v4缀合物的药理学作用,如通过相对于媒介物的小肠重量增加百分比所测量的。
[0382]
在该研究中,连接到fms接头而没有peg分子的变体4(mal
‑
fms
‑
v4)相当出乎意料地显示出对肠上皮最显著的作用,然而对于小肠重量不太有效。peg30
‑
fmoc
‑
v4和peg30
‑
meof
‑
v4令人惊讶地未显示出优于mal
‑
fms
‑
v4缀合物的任何优点,但确实表现出比原样注射的v4肽对肠上皮更好的作用。然而,原样注射的v4肽对小肠重量具有最显著的作用。通过赖氨酸残基连接到肽的peg30
‑
fms显示出影响绒毛和隐窝以及小肠重量的低潜力。如所预期的,不可逆缀合物不引起肠上皮或重量的任何增加。完全缀合物(使用30kda peg和不可逆fmoc接头)不具有任何药理学作用。
[0383]
表11.如通过小肠重量增加测量的变体4和各种聚乙二醇化glp
‑
2变体4缀合物的药理学结果
[0384][0385]
图2示出了这些不同的v4缀合物的第二药理学比较,如通过相对于媒介物的隐窝加绒毛长度增加百分比所测量的(研究参考15202)。
[0386]
在该研究中,通过使用多臂(ma)20kda可逆聚乙二醇化v4、可逆接头
‑
v4和直链30kda可逆聚乙二醇化v4来进行fms和fmoc之间的头对头比较。fms和fmoc缀合物对肠上皮的药理学作用之间没有显著差异。多臂缀合物显示出与v4肽本身类似的功效,而所有其他四种缀合物显示出绒毛加隐窝长度的显著增加。
[0387]
在另一项研究(研究参考15201)中,向6只大鼠/组给药2个剂量(0.5mg/kg和2mg/kg肽剂量)的v4肽和mal
‑
fms
‑
v4一次,同时在注射后6天评估上皮。结果呈现在图3中。
[0388]
图3示出了v4肽与可逆mal
‑
fms
‑
v4缀合物之间的剂量依赖性药理学比较,如通过相对于媒介物的绒毛+隐窝长度增加百分比所测量的。
[0389]
令人惊讶的是,v4和mal
‑
fms
‑
v4缀合物均显示出对肠上皮的剂量依赖性药理学作用,而后者的显著功效与针对2mg/kg剂量的先前实验一致。0.5mg/kg剂量的可逆接头v4缀合物导致隐窝加绒毛长度的增加较小,但与对照和v4肽本身相比仍具有显著响应。
[0390]
上述研究的总结显示,用mal
‑
fms
‑
v4和变体4自身可实现对小肠重量和绒毛加隐窝长度的高效果。它们的作用与peg30
‑
meof
‑
v4的作用相当或甚至更好,但不需要聚乙二醇化,因此简化了药物的制备。因此,这两种化合物是开发工作的其余部分的焦点。
[0391]
实施例7:还原的接头
‑
肽的合成
[0392]
还原的接头
‑
肽的合成和纯化在以下实施例中给出。
[0393]
在含有特定保护基团的树脂上合成肽,这些特定保护基团允许侧引导接头偶联到肽n端、lys(30)侧链或它们两者的组合。使用本领域技术人员已知的常规方法将肽与接头偶联。接下来,将接头偶联的肽从树脂上裂解,并进一步纯化,得到纯化的接头
‑
肽。然后将纯化的接头
‑
肽冻干并储存直至使用。使用半胱氨酸、或半胱胺、或任何含硫醇分子溶液进行接头
‑
肽的溶解,该溶液允许进行mal
‑
接头
‑
肽的马来酰亚胺部分与含硫醇分子的溶解和反应两者。如果需要,可将粗反应物进一步纯化和冻干。下面描述cys
‑
接头
‑
v4的合成和纯化:
[0394]
贯穿图4
‑
图6使用的术语“cys
‑
fms
‑
v4”是指以下结构:
[0395][0396]
步骤1;将接头偶联到树脂v4肽上(在期望位置,n’端、lys30或his1侧链)。
[0397]
步骤2;将偶联的接头
‑
肽从树脂上裂解并使用rp
‑
hplc方法纯化
[0398]
步骤3;冻干纯化的接头
‑
肽
[0399]
步骤4;使用含sh的peg(例如,peg30
‑
sh)溶解和聚乙二醇化接头
‑
肽
[0400]
步骤5;使用rp
‑
hplc方法纯化peg
‑
接头
‑
肽缀合物
[0401]
步骤6;冻干纯化的peg
‑
接头
‑
肽
[0402]
图4描述了显示从树脂上裂解后和酸处理后的fms偶联肽的rp
‑
hplc色谱图。
[0403]
图5描述了纯化的偶联肽和半胱氨酸化fms
‑
肽的rp
‑
色谱图,其中半胱氨酸与马来酰亚胺基团共价反应以产生cys
‑
fms
‑
v4。
[0404]
图6描述了预期mw为3335的cys
‑
fms
‑
v4的maldi
‑
top分析,其由4214g/mol和从与半胱氨酸(121g/mol)共价反应获得的121g/mol的mal
‑
fms
‑
v4 mw组成。
[0405]
在另一个实例中,树脂上接头偶联的肽与含硫醇分子诸如但不限于半胱氨酸和半胱胺进一步反应,从而导致mal
‑
接头
‑
肽的马来酰亚胺基团还原以及含硫醇分子偶联到接头肽。接下来,将硫醇盐
‑
接头
‑
肽从树脂上裂解,并且使用本领域技术人员已知的常规方法进一步纯化。
[0406]
下面描述关于树脂合成cys
‑
接头
‑
v4和纯化的所有内容:
[0407]
步骤1;在树脂v4肽偶联上的接头偶联(在期望位置,n’端、lys30或his1侧链)。
[0408]
步骤2;在搅拌树脂上的接头
‑
肽的同时使用半胱氨酸温育进行mal官能团还原
[0409]
步骤3;将cys
‑
接头
‑
v4从树脂上裂解并使用rp
‑
hplc方法纯化
[0410]
步骤3;冻干纯化的cys
‑
接头
‑
肽。
[0411]
实施例8:变体4和缀合的变体4与阿帕鲁肽、格帕鲁肽和gattex的比较作用
[0412]
进行附加研究以评估v4肽和可逆mal
‑
fms
‑
v4的功效。在治疗后第6天和第10天时评估v4和缀合物的长效作用(研究参考15203)。在第1天时,所有测试组(n=9)以2mg/kg肽含量sc注射。在第6天和第10天时,处死动物,并且对小肠进行组织病理学评估(第6天6只动物,第10天3只动物)。图12和图13示出了不同v4缀合物和阿帕鲁肽和格帕鲁肽的药理学作用,如通过分别相对于媒介物的小肠重量和隐窝加绒毛长度增加百分比所测量的。在该研究中,对于两个时间点,v4在相对于媒介物的小肠重量增加百分比方面显示出最有利的结果,并且在相对于媒介物的隐窝加绒毛长度增加百分比方面以及与其他测试的缀合物相比显示出与cys
‑
fms
‑
v4相当的结果。令人惊讶的是,与阿帕鲁肽和格帕鲁肽相比,v4显示出对隐窝加绒毛长度相对于媒介物的最显著的作用。阿帕鲁肽显示出高于格帕鲁肽和peg30
‑
fms
‑
v4缀合物的中等作用。在该实验中,v4和cys
‑
fms
‑
v4在单次sc注射后10天显示出延长的活性。虽然v4、阿帕鲁肽和格帕鲁肽均基于glp
‑
2,但在该研究中它们展示出显著不同的药理学作用。
[0413]
进行了附加研究以评估v4和cys
‑
fms
‑
v4的功效和寿命(研究参考15204),其中在第6天(n=6)、第10天(n=4)和第14天(n=4)处死动物。该实验测量了与商业批准的sbs治疗药物gattex相比的药理学响应。此外,通过将v4与还原的osu
‑
接头和从树脂上纯化的cys
‑
fms
‑
v4缀合,测试两种新的缀合物。在第1天,向动物单次sc注射2mg/kg肽含量的v4、cys
‑
fms
‑
v4、fms
‑
osu
‑
v4、阿帕鲁肽和格帕鲁肽,而gattex以2.5mg/kg肽含量每天皮下注射。图14显示v4和cys
‑
fms
‑
v4展示出从注射开始长达14天对绒毛和隐窝长度的最显著和延长的作用。在第10天和第14天,与阿帕鲁肽和格帕鲁肽相比,参数有显著增加(相对于阿帕鲁肽,v4的p<0.001,cys
‑
fms
‑
v4的p<0.01),结果与gattex相当。v4展示出其优于阿帕鲁肽和格帕鲁肽的出乎意料的优越性,并且还证实单次2mg/kg的v4或cys
‑
fms
‑
v4注射足以在13次每日注射(累积剂量32.5mg/kg)后实现与gattex相当的作用。
[0414]
实施例9:变体4和cys
‑
fms
‑
v4的比较多剂量作用
[0415]
为了进一步评估v4和cys
‑
fms
‑
v4的药理学功效,进行实验以测试其对小肠的急性和延长作用(研究参考15205)。此外,在第1天,以3个不同剂量(0.5mg/kg、2.0mg/kg或8.0mg/kg肽含量,每组6只大鼠)以单次sc注射形式施用v4和cys
‑
fms
‑
v4,以评估剂量依赖性作用。在第3天、第7天和第14天测量对小肠重量和绒毛加隐窝长度的药理学作用,结果呈现在图15和图16中。图15示出了v4和cys
‑
fms
‑
v4两者在治疗后第3天已达到最大急性响应,如通过在所有3个剂量水平下相对于媒介物的类似小肠重量增加百分比所证实的。需注意,在所有3个剂量水平下,v4的这种急性响应高于cys
‑
fms
‑
v4。虽然在0.5mg/kg下两种测试制品的低剂量水平不足以维持在相对于媒介物的小肠重量增加百分比方面的急性作用,但2.0mg/kg剂量水平导致在治疗后7天内对相对于媒介物的小肠重量增加百分比的更显著和持续的作用。在这些条件(2mg/ml,第7天)下,v4显示出显著优于cys
‑
fms
‑
v4(p<0.01)。治疗后14天,最高剂量水平8.0mg/kg进一步展示了该作用的寿命。尽管在第7天,8.0mg/kg下的v4和cys
‑
fms
‑
v4显示出可比的作用,但在第14天,v4展示出显著优于cys
‑
fms
‑
v4(p<0.001)(图15)的优越性。有趣的是,在第7天,与2.0mg/kg组相比,v4显示出相对于媒介物的类似小
肠重量增加百分比,表明达到了响应的平台期。
[0416]
图16显示在第3天,v4和cys
‑
fms
‑
v4在所有三种剂量水平下均诱导了对绒毛和隐窝长度的相当的肠营养响应。有趣的是,在第3天长度增加的最大水平在所有剂量中是类似的,表明进入平台期模式。在第7天,v4和cys
‑
fms
‑
v4在用2mg/kg或8mg/kg处理的组中对长度增加均达到最高作用。当以8.0mg/kg肽含量向动物注射时,这种显著作用(p<0.001)在治疗后持续14天。因此,v4和cys
‑
fms
‑
v4具有与如通过绒毛加隐窝长度测量的类似的药理学作用,其中v4在小肠重量增加上具有优势。两种化合物在单次注射后表现出剂量依赖性相关性,在长达14天内观察到显著的作用。
[0417]
实施例10:v4和cys
‑
fms
‑
v4的药代动力学建模支持长效潜力
[0418]
为了支持如实施例9中详述的v4和cys
‑
fms
‑
v4的药效学作用,还进行了药代动力学分析。在该研究中(研究参考15204),所有动物在第1天sc注射2mg/kg肽含量的v4、cys
‑
fms
‑
v4和阿帕鲁肽。在给药后2、8、12、24、36、48、72、96、120小时和7、8、9、10、11、12、13和14天收集血液样品,随后进行lc
‑
ms/ms分析以确定每种化合物的血浆水平。对于cys
‑
fms
‑
v4,应用2
‑
分析物方法确定完全缀合物和由其水解的v4(水解v4)的血浆浓度。如通过使用lc
‑
ms/ms方法测量的v4肽、cys
‑
fms
‑
v4、水解的v4和阿帕鲁肽的血浆浓度(μm)呈现在图17中。pk参数总结在表12中。
[0419]
表12:sc注射后v4、cys
‑
fms
‑
v4和阿帕鲁肽的药代动力学特性
[0420][0421]
如表12和图17中所示,阿帕鲁肽具有14.5小时的表观半衰期(t
1/2
),这与hargrove等人先前公布的pk参数相当。(hargrove dm等人,pharmacological characterization of fe 203799,a novel long
‑
acting peptide analog of glucagon
‑
like peptide
‑
2(glp
‑
2).gastroenterology 2011;140(增补1):s293)。与阿帕鲁肽相比,v4和来自cys
‑
fms
‑
v4的水解v4显示出改善的寿命,表观半衰期为77小时和65.6小时。完全缀合物cys
‑
fms
‑
v4具有3.9小时的短半衰期,这可通过其在注射部位和血液中的快速水解来解释。与阿帕鲁肽相比,v4和水解v4可在晚得多的时间被检测到,长达10天(注射后240小时)。尽管阿帕鲁肽达到更高的浓度(cmax),但与v4相比其最终从血液中更快地消除,且在第6天(120小时)后不能被检测到。阿帕鲁肽具有较高的总暴露量(auc),但v4和水解v4的总分布体积(vz/f)高得多。这表明v4更显著地分布到外周组织以产生持续的储集,这可能有助于其长效功效。这转化为延长且平坦的pk曲线,其对应于如通过相对于媒介物的小肠重量和隐窝加绒毛长度增加百分比所测量的长达14天观察到的肠营养作用(参见图12
‑
图14)。
[0422]
为了评估iv施用后v4和cys
‑
fms
‑
v4的生物利用度和pk曲线,给动物iv注射2mg/kg的v4和cys
‑
fms
‑
v4(肽含量,研究参考15206)。在施用给药后0.5、2、4、8、12、24、36、48、72、
96和120小时采集血液样品。结果总结在表13中。
[0423]
表13:iv注射后v4和cys
‑
fms
‑
v4的药代动力学特性
[0424][0425]
图18示出了以2mg/kg iv施用时v4和cys
‑
fms
‑
v4的pk曲线。如表13和图18所示,iv施用后,所有化合物从血液中快速清除,如v4、水解v4(v4(cys
‑
fms
‑
v4)和cys
‑
fms
‑
v4在注射后24小时不能被检测到。v4表现出3.2小时的短半衰期(t
1/2
),但具有与水解v4相比更大的暴露量(auc),这最可能是由于快速的cys
‑
fms
‑
v4清除(分别为33.7μmol/l*h和8.3μmol/l*h)。缀合物cys
‑
fms
‑
v4释放~35%的v4(36.2/12.8=35,auc比率),并且其余以2.8小时的半衰期降解。水解v4与v4相比具有8.1小时的更长半衰期和更高的分布体积(vz,分别为0.487(μmol/kg)/(μmol/l)和0.068(μmol/kg)/(μmol/l)),其中在注射后2小时达到cmax(0.95μmol/l)。
[0426]
进行深入pk建模以解决大鼠模型中v4、cys
‑
fms
‑
v4和阿帕鲁肽之间在半衰期、分布和药理学作用方面的非预期差异。使用2
‑
室药代动力学模型,用monolix 2018r2套件进行分析。该分析中使用的数据包括来自3个独立实验的数据(数据作为其平均值呈现)。使用v4肽的药代动力学参数的值适当地描述由cys
‑
fms
‑
v4缀合物(水解肽)形成的v4的浓度对时间的数据。因此,iv和sc施用后水解v4的处置与v4肽的处置相同。药代动力学模型呈现在图19中,并且结果总结在表14和表15中。
[0427]
表14:v4和阿帕鲁肽的平均药代动力学特性
[0428][0429]
表15:cys
‑
fms
‑
v4的平均药代动力学特性
[0430]
参数单位cys
‑
fms
‑
v4f
conj
‑
0.538k
a conj
1/h0.0717
k
conje
1/h0.207k
h
1/h0.438v
conj
ml/kg119相对于v4的%%67.9t
1/2
吸收h9.67t
1/2
其他途径h3.35t
1/2
水解h1.58
[0431]
v4肽的药代动力学特征在于从sc注射位点至体循环的相对缓慢吸收,吸收半衰期为9.51小时(表14)。大约40%的v4在sc注射后达到体循环,表明在注射部位处约60%的剂量局部降解。v4的初始分布体积为62.7ml/kg,这表明进入细胞外液的有限初始渗透(大鼠血浆体积为~31.2ml/kg)。v4的分布阶段是快速的(t
1/2α
=1.29h),并且在sc施用后被吸收动力学掩盖。相比之下,在iv或sc施用后,终末半衰期比吸收和初始分布过程长得多(t
1/2β
=173h),并且导致血浆中v4的相对延长的存在(图17和图18)。v4的这种缓慢消除最可能是由于v4在血管外位置的大量积累(与v4分布的初始体积相比,v
ss
=510ml/kg,并且v
β
=3212ml/kg;分别增加~8倍和~51倍)。
[0432]
在我们的研究中,在sc施用后确定阿帕鲁肽的药代动力学。因此,为了在v4和阿帕鲁肽之间进行直接比较,假设如先前报道的,在大鼠中sc施用后阿帕鲁肽的绝对生物利用度等于74%。基于该假设,计算阿帕鲁肽的分布体积值和清除率(v
pept
、v
ss
、v
β
和cl)(表13)。表14中的阿帕鲁肽的其他参数(速率常数和半衰期)的值不取决于该假设。
[0433]
与阿帕鲁肽相比,v4生物利用度低46%(f
pept
,分别为74%和40.1%)。其特征在于从sc注射部位到体循环的吸收大约慢2倍(参见表14中k
a_pept
和t
1/2
吸收值的比率)。与阿帕鲁肽相比,v4具有较小的初始分布体积,但倾向于在外周室中更广泛地累积(参见表14中的v
pept
、k
12
、k
21
、v
ss
和v
β
比率)。这两种肽的清除率值类似。因此,v4的终末半衰期比阿帕鲁肽长得多(参见表14)。图20(上图;下图为对数标度)和表16中示出了v4和阿帕鲁肽的药代动力学行为差异的可视化呈现,作为基于大鼠中pk参数的平均值的这些化合物的时程血浆浓度的模拟(模拟并非基于关于阿帕鲁肽绝对生物利用度的假设)。该模拟呈现了5周的剂量方案,每周单次sc注射2mg/kg。在模拟中,v4显示出更平坦的pk曲线,具有更高的谷浓度(0.57μm,c
ss min
),指示其在血液中的延长存在。从安全角度来看,峰值血液浓度(0.099μm,c
ss max
)可提供优点,因为v4浓度可在延长的治疗窗内维持低水平。
[0434]
表16.基于图20中呈现的模拟的v4和阿帕鲁肽的谷、平均值和峰值稳态血浆浓度(μm)。
[0435][0436]
与v4肽相比,以cys
‑
fms
‑
v4缀合物的形式施用v4导致缀合物地吸收至中央循环(53.8%相对于40.1%),具有类似的动力学(9.67小时相对于9.51小时的吸收半衰期)(参见表14和表15)。cys
‑
fms
‑
v4缀合物的分布体积低于v4肽的稳态分布体积(119ml/kg相对于510ml/kg)。约2/3的吸收的cys
‑
fms
‑
v4水解为v4。因此,sc施用后约36.5%的cys
‑
fms
‑
v4转化为v4(53.8%sc生物利用度,67.9%水解为v4)。cys
‑
fms
‑
v4吸收和水解为v4的动力学相
当快(t
1/2
值分别为9.67小时和1.58小时),并且v4肽的消除动力学(t
1/2
β)控制sc cys
‑
fms
‑
v4施用后v4血浆浓度的时程。
[0437]
尽管v4和阿帕鲁肽仅有2个氨基酸(v4
‑
e3和n
11
,阿帕鲁肽
‑
d3和d
‑
f
11)
中不同,但它们的药代动力学参数显著且出乎意料地不同。基于建模,它们具有明确的生物利用度、吸收、半衰期和分布值,这些值导致不同的药理学作用。v4被缓慢地吸收到血液内,并且在外周组织中广泛累积,因此在肽缓慢地再吸收到主隔室中时呈现持续的释放曲线,从而解释了其超过阿帕鲁肽的长期药效学优势。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1