SGHRT编码的多肽及相关产物、方法和用途与流程
sghrt编码的多肽及相关产物、方法和用途
技术领域
1.本公开广泛地涉及一种多肽及相关产物、方法和用途。
背景技术:
2.心力衰竭(hf)仍然是导致死亡的主要原因,并且是现代社会最昂贵的医疗负担之一。在新加坡,心脏病占2014年所有死亡人数的19.3%(http://www.myheart.org.sg/article/about-the-heart-and-heart-disease/statistics/singapore/75)。hf的治疗仍然是不充分的分阶段累积添加疗法,且随着世界人口的迅速老龄化,发病率和死亡率有可能恶化。
3.大多数患者hf的根本原因是心肌细胞的损失,伴随有收缩和舒张的功能紊乱。心脏的再生能力受到终末分化的心肌细胞在生命最初几周后无法充分进行细胞分裂的限制。
4.虽然最近的研究发现成年小鼠和人类心脏中心肌细胞更新率非常低,主要由现存的心肌细胞的增殖来介导,但增殖的驱动因素仍然难以捉摸。hf药物研发中心迫切需要新型靶标,尤其是可操纵以驱动成体心肌细胞增殖的新型肽靶标。
5.因此,需要提供解决或至少改善一个或多个上述问题的多肽及相关产物、方法和用途。
技术实现要素:
6.一方面,提供了一种由sghrt编码的分离的多肽。
7.在一个实施方案中,所述多肽包含线粒体多肽。
8.在一个实施方案中,所述多肽与以下任一序列具有至少75%序列同一性:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:18和seq id no:22、seq id no:23、seq id no:24和seq id no:25。
9.在一个实施方案中,所述多肽包含微肽。
10.在一个实施方案中,所述多肽包含同源寡聚体。
11.一方面,提供了一种评估受试者的心脏功能的方法,所述方法包括:测定从所述受试者处获得的样本中所述多肽的表达水平;将所述表达水平与参考表达水平进行比较,其中如果表达水平超过参考表达水平,则认为受试者具有受损或恶化的心脏功能。
12.在一个实施方案中,所述参考表达水平包括所述多肽在健康群体中的表达水平。
13.在一个实施方案中,所述参考表达水平包括所述多肽在从受试者处获得的较早样本中的表达水平。
14.在一个实施方案中,所述方法还包括向受试者施用所述多肽的抑制剂。
15.一方面,提供了一种治疗受试者心脏功能受损的方法,所述方法包括:抑制受试者中多肽的表达。
16.一方面,提供了一种鉴定用于治疗心脏功能受损的潜在药物的方法,所述方法包括:测定所述多肽在细胞中的第一表达水平;将所述细胞暴露于候选药物;以及测定所述多
肽在所述暴露之后的第二表达水平,其中如果第二表达水平低于第一表达水平,则候选药物被鉴定为用于治疗受损心脏功能的潜在药物。
17.一方面,提供了所述多肽的抑制剂。
18.一方面,提供了用于疗法中的所述抑制剂。
19.一方面,提供了用于治疗心脏功能受损的所述抑制剂。
20.一方面,提供了所述抑制剂在制备用于治疗心脏功能受损的药物中的用途。
21.在一个实施方案中,所述心脏功能受损选自由以下组成的组:心肌梗塞、心力衰竭、冠状动脉疾病、动脉狭窄、心脏病发作、心律异常、心律失常、心力衰竭、心脏瓣膜病、先天性心脏病、心肌疾病、心肌病、心包疾病、主动脉疾病、马凡综合征、遗传性心肌病、非遗传性心肌病、心脏肥大、压力超负荷引起的心脏功能障碍和受损的心脏组织。
22.一方面,提供了一种药物组合物,其包含所述抑制剂和合适的载剂、佐剂、稀释剂和/或赋形剂。
23.一方面,提供了一种载体,其包含编码所述多肽或所述抑制剂的多核苷酸序列。
24.一方面,提供了一种用所述载体转染的宿主细胞。
25.一方面,提供了一种转基因非人受试者,其包含编码所述多肽的多核苷酸构建体。
26.一方面,提供了与可检测标记偶联的多肽。
27.一方面,提供了一种使心脏细胞去分化和/或增殖的方法,所述方法包括:抑制所述多肽在心脏细胞中的表达。
28.一方面,提供了一种通过所述方法产生的细胞,或其后代或细胞衍生物。
29.一方面,提供了一种分离的多核苷酸,其编码所述多肽。
30.定义
31.如本文所用,术语“多肽”泛指由肽键连接的氨基酸残基链。此外,该术语还涵盖了多于一种多肽亚单位的组装体或复合体,诸如多聚体或寡聚体。在一些实施方案中,多聚体或寡聚体是由相同亚单位构成的同源多聚体或同源寡聚体。多肽可以是天然存在的或合成的(例如,通过化学合成或重组dna技术产生)。“多肽”的实例包括基因产物、天然存在的肽/蛋白质、同源物、直系同源物、旁系同源物、片段及前述物质的其他等同物、变体、类似物、多聚形式或寡聚形式。术语“多肽”没有暗示具体的大小。
32.如本文所用,与多肽相关的术语“分离的”是指从其天然环境中移除的多肽。多肽可以通过将其与在自然界中与之相关的一些或所有天然存在的成分分开来“分离”。因此,“分离的”多肽通常是至少部分纯化的。
33.如本文所用,与多肽相关的术语“表达”不限于多肽的量,还包括“功能表达”或多肽执行天然功能的活性的含义。因此,“测定多肽的表达水平”包括定量、半定量或定性地测量多肽的量和/或多肽的活性。
34.如本文所用,术语“治疗(treatment)”、“治疗(treat)”和“疗法”及其同义词是指治疗性治疗和预防性或预防措施,其中目的是预防或减缓(减轻)医学病状,包括但不限于疾病(诸如心脏病或心脏功能受损)、症状和病症。医学病状还包括身体对疾病或病症的反应,例如炎症。那些需要这种治疗的包括那些已经患有医学病状的以及那些容易患上医学病状的或者那些需要预防医学病状的。
35.术语“治疗有效量”的剂将是指能够预防或至少减缓(减轻)医学病状诸如心脏病
或心脏功能受损的活性剂的量。本公开的剂、化合物、组合物和制剂的剂量和施用可由临床药理学或药代动力学领域的普通技术人员确定。参见,例如mordenti and rescigno,(1992)pharmaceutical research.9:17-25;morenti et al.,(1991)pharmaceutical research.8:1351-1359;和mordenti and chappell,"the use of interspecies scaling in toxicokinetics"in toxicokinetics and new drug development,yacobi et al.(eds)(pergamon press:ny,1989),pp.42-96。治疗上采用的本公开的活性剂的有效量将取决于例如治疗目标、施用途径和患者的状况。因此,治疗师可能需要根据需要调整剂量并更改施用途径以获得最佳治疗效果。
36.如本文所用的术语“受试者”包括患者和非患者。术语“患者”是指患有或可能患有医学病状例如心脏病状/心脏病症和/或心脏功能受损的个体,而“非患者”是指不患有且可能不患有医学病状的个体。“非患者”包括健康个体、非患病个体和/或没有医学病状的个体。术语“受试者”包括人和动物。动物包括鼠类等。“鼠类”是指来自鼠科的任何哺乳动物,诸如小鼠、大鼠等。
37.如本文所用,术语“微米”应广义地解释为包括约1微米至约1000微米的尺寸。
38.如本文所用,术语“纳米”应广义地解释为包括小于约1000nm的尺寸。
39.如本文所用,术语“颗粒”泛指离散实体或离散体。本文所述的颗粒可包括有机颗粒、无机颗粒或生物颗粒。本文所述使用的颗粒也可以是由多个亚颗粒的聚集体或小物体的片段形成的大颗粒。本公开的颗粒可以是球形的、基本球形的或非球形的,诸如不规则形颗粒或椭圆形颗粒。当用于指颗粒时,术语“大小”泛指颗粒的最大尺寸。例如,当颗粒基本是球形时,术语“大小”可以指颗粒的直径;或当颗粒基本是非球形时,术语“大小”可以指颗粒的最大长度。
40.除非另有说明,本说明书中使用的术语“偶联”或“连接”旨在涵盖直接连接或通过一个或多个中间方式连接。
41.当提及两个要素时,本文中使用的术语“与
……
相关”是指这两个要素之间的广泛关系。该关系包括但不限于物理、化学或生物关系。例如,当要素a与要素b相关时,要素a与b可以直接或间接地相互依附,或者要素a可以包含元素b,或反之亦然。
42.当提及两个要素时,本文使用的术语“相邻”是指一个要素紧邻另一要素,并且可以是但不限于彼此接触的要素,或者可进一步包括被一个或多个置于其间的另外的要素分隔开的要素。
43.术语“和/或”,例如“x和/或y”应理解为表示“x和y”或“x或y”,并且应被视为对这两种含义或任一含义提供明确支持。
44.此外,在本说明书中,无论何时使用的词语“基本(上)”应理解为包括但不限于“全部地”或“完全地”等。另外,无论何时使用的诸如“包含”、“含有”等术语旨在作为非限制性描述性语言,因为它们广泛地包括在这类术语之后列举的要素/组分,以及未明确列举的其他组分。例如,当使用“包含”时,对“一个”特征的提及也旨在是对那个特征的“至少一个”的提及。在适当的上下文中,诸如“由
……
组成的(consisting)”、“由
……
组成(consist)”等术语可被视为诸如“包含”、“含有”等术语的子集。因此,在使用诸如“包含”、“含有”等术语的本文公开的实施方案中,应理解,这些实施方案对使用诸如“由
……
组成的”、“由
……
组成”等术语为的相应实施方案提供了教导。此外,无论何时使用的诸如“约”、“大约”等术语
通常表示合理的变化,例如所公开值的+/-5%的变化、或所公开值的4%的变化、或所公开值的3%的变化、所公开值的2%的变化或所公开值的1%的变化。
45.此外,在本文的描述中,可以在一定范围内公开某些值。显示范围端点的值旨在说明优选范围。无论何时描述了范围,该范围都旨在涵盖并教导所有可能的子范围以及该范围内的各个数值。也就是说,范围的端点不应被解释为不灵活的限制。例如,对1%至5%范围的描述旨在具体公开1%至2%、1%至3%、1%至4%、2%至3%等子范围,以及单独地公开在该范围内的值,例如1%、2%、3%、4%和5%。上述具体公开的意图适用于范围的任何深度/广度。
46.另外,当描述一些实施方案时,本公开可能已经以具体步骤顺序的形式公开了方法和/或过程。然而,除非另有要求,应当理解所述方法或过程不应限于所公开的具体步骤顺序。其他步骤顺序也是可能的。本文所公开的具体步骤顺序不应被视为不当的限制。除非另有要求,本文所公开的方法和/或过程不应限于按所写顺序执行的步骤。步骤的顺序可以变化并且仍然保持在本公开的范围内。
47.此外,应当理解,虽然本公开提供了具有本文中所讨论的一个或多个特征/特性的实施方案,但是这些特征/特性中的一个或多个也可以在其他替代实施方案中被放弃,并且本公开提供对这样的放弃权项声明以及这些相关的替代实施方案的支持。
48.实施方案的说明
49.在下文中公开了多肽及相关产物、方法和用途的示例性非限制性实施方案。
50.在多个实施方案中,提供了由sghrt编码的肽或其部分/片段。在一些实施方案中,所述肽包括分离的肽。在一些实施方案中,所述肽包括寡肽。在一些实施方案中,所述肽包括多肽。因此,在一些实施方案中,提供一种由sghrt编码的分离的多肽。在多个实施方案中,sghrt对应于先前注释的1810058i24rik,或其同源物或直系同源物。
51.在多个实施方案中,所述肽包括分泌肽。
52.在多个实施方案中,所述多肽包含不超过约150、不超过约140、不超过约130、不超过约120、不超过约110、不超过约100、不超过约90、不超过约80、不超过约70个、不超过约60个、不超过约55个、不超过约50个、不超过约49个、不超过约48个或不超过约47个氨基酸的长度。在多个实施方案中,所述多肽包含约40至约50、或约45至约50个氨基酸的长度。在多个实施方案中,所述多肽包含约45、约46、约47、约48、约49或约50个氨基酸的长度。在一个实施方案中,所述多肽包含约47个氨基酸的长度。在一些实施方案中,所述多肽包含短开放阅读框编码的(sorf编码的)肽。在一些实施方案中,所述多肽包含微肽。
53.在多个实施方案中,多肽能够寡聚化或能够形成多聚体或寡聚体。在多个实施方案中,多肽能够形成同源多聚体或同源寡聚体。因此,在多个实施方案中,多肽包含多聚体、寡聚体、或多肽组装体或复合体。多肽可以是由至少约两个或至少约三个多肽亚单位或相同多肽亚单位构成的多聚体或寡聚体。在一些实例中,多肽可以是二聚体(例如同源二聚体)、三聚体(例如同源三聚体),并且在一些实例中,多肽可以是单体(例如由不超过一个多肽亚单位构成)。多肽的多聚形式或寡聚形式可以基本上耐热/耐高温和/或基本上耐乙二胺四乙酸(edta)的处理。在多个实施方案中,多聚体或寡聚体的单体或多肽亚单位不通过共价键连接(linked)/连接(joined)。
54.在多个实施方案中,所述多肽位于或定位于细胞中的线粒体中,任选地,其中所述
多肽主要位于细胞中的线粒体中。在多个实施方案中,多肽包含线粒体多肽。在多个实施方案中,多肽包含sorf编码的线粒体多肽。在多个实施方案中,多肽包含线粒体膜蛋白。在一些实施方案中,多肽包含线粒体靶向信号,任选地线粒体膜靶向信号。
55.多肽可位于或可定位于或可存在于线粒体基质中或线粒体的膜间。多肽也可位于或可定位于或可存在于细胞的胞质、细胞核或胞外区等中。
56.在一些实施方案中,多肽能够进入分泌途径。在一些实施方案中,所述多肽包含分泌信号序列,任选地,其中所述分泌信号序列包含“mlqfllgftlgnvvgmyla”或其部分(例如线性部分),或与其具有以下同一性的序列:至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%。分泌信号序列可为约15至约25个氨基酸长或约17至约23个氨基酸长。分泌信号序列可为约17、约18、约19、约20、约21、约22或约23个氨基酸长。
57.在一些实例中,基于对序列“mlqfllgftlgnvvgmyla”的亲水性分析,该序列更可能构成分泌信号序列而不是线粒体信号序列。
58.可以切割多肽的线粒体靶向信号序列和/或分泌信号序列以产生约20至约30个氨基酸长或约25至约30个氨基酸长的c端产物。c端产物可为约25、约26、约27、约28、约29或约30个氨基酸长。在多个实施方案中,所述c端产物包含序列“qnydipnlakkleeikkdldakkkppsa”或其部分(例如线性部分),或与其具有以下同一性的序列:至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%或至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%。
59.在多个实施方案中,所述多肽或其部分/片段与以下任一项中所列的序列具有至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%或至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%同一性或约100%同一性:
60.seq id no:1:
61.mlqfllgftlgnvvgmylaqnydipnlakkleeikkdldakkkppsa;
62.seq id no:2:
63.mlqfllgftlgnvvgmylaqnydipnlakkledikkdldakkkppss;
64.seq id no:3:
65.mlqfllgftlgnvvgmylaqnydipnlakkleeikkdldakkkppsc;
66.seq id no:4:
67.mlqfllgftlgnvvgmylaqnydmpnlakkleeikkdldakkkppss;
68.seq id no:5:
69.mlqfllgftwgnvvgmylaqnyempnlakkleeikkdleakkkppss;
70.seq id no:6:
71.mlqfvlgftlgnvvgmylaqnydipniakkledfkkdveakkkppsdks;
72.seq id no:7:
73.mmqfilgftlgnvvgmylaqnyevpniskkieafkkdveakkkppe;
74.seq id no:18:
75.mlqfllgftlgnvvgmyla;
76.seq id no:19:
77.mxqfxlgftxgnvvgmylaqnyxxpnxxkkxexxkkdxxakkkppx,其中x表示任何氨基酸;
78.seq id no:20:
79.gnvvgmylaqny
80.seq id no:21:
81.akkkpp;
82.seq id no:22:
83.mlqfllgftlgnvvgmy;
84.seq id no:23:
85.qnydipnlakkleeikkdldakkkppsa;
86.seq id no:24:
87.dip;
88.seq id no:25:
89.kdldakkkppsa;
90.以及
91.短跨膜线粒体蛋白1前体(stmp1)的序列或
92.其部分,任选地线性部分。
93.在一些实施方案中,多肽与以下任一序列具有至少75%序列同一性:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:18、seq id no:22、seq id no:23、seq id no:24、seq id no:25及其部分,任选地线性部分。
94.在一些实施方案中,所述多肽或其部分/片段包含序列“mxqfxlgftxgnvvgmylaqnyxxpnxxkkxexxkkdxxakkkppx”(seq id no:19)或其部分,任选地线性部分,其中x表示任何氨基酸。应当理解,每个x可表示不同的氨基酸。在一些实施方案中,每个x独立地选自由以下组成的组:a、r、n、d、c、e、q、g、h、i、l、k、m、f、p、s、t、w、y及v。在一些实施方案中,每个x独立地选自由以下组成的组:a、d、e、f、i、l、s、m、v及w。在一些实施方案中,所述多肽或其部分/片段包含序列“gnvvgmylaqny”(seq id no:20)和/或“akkkpp”(seq id no:21)或其部分,任选地线性部分。在一些实施方案中,所述多肽或其部分/片段包含序列“mlqfllgftlgnvvgmy”(seq id no:22)或其部分,任选地线性部分。
95.在一些实施方案中,多肽或其部分/片段衍生自、分离自或纯化自哺乳动物,任选地选自人、猪、大鼠和小鼠的哺乳动物。在一些实例中,所述多肽或其部分/片段在人、猪、大鼠和小鼠中的存在已通过质谱法证实。
96.在多个实施方案中,所述多肽由与seq id no:8至seq id no:15的任一项中所列的序列具有以下序列同一性的多核苷酸或核酸序列(dna/rna)编码:至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%。
97.在多个实施方案中,提供了一种编码所述多肽或其部分/片段的分离的多核苷酸或核酸序列(dna/rna)。在多个实施方案中,提供了一种由sghrt编码的分离的多核苷酸或核酸序列。在多个实施方案中,所述多核苷酸或核酸序列与seq id no:8至seq id no:15的任一项中所列出的序列具有以下序列同一性:至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%。
98.在多个实施方案中,所述分离的多核苷酸或核酸序列包含人sghrt rna序列。在多个实施方案中,人sghrt rna序列包含seq id no:14中列出的序列:
99.[0100][0101]
在一些实施方案中,分离的多核苷酸或核酸序列包含人sghrt rna序列的编码区(或cds)。在多个实施方案中,cds包含seq id no:15中列出的序列:
[0102]
atgctccagttcctgcttggatttacactgggcaacgtggttggaatgtatctggctcagaactatgatataccaaacctggctaaaaaacttgaagaaattaaaaaggacttggatgccaagaagaaaccccctagtgcatga。在一些实施方案中,分离的多核苷酸或核酸序列包含人sghrt rna序列的5’非翻译区(5’utr)。在多个实施方案中,人sghrt rna序列的5’utr包含seq id no:16中列出的序列:
[0103]
gaccggcccgcggagctgctgcagtccttcgcgccctcctcgccctccccaccgacatc。在一些实施方案中,分离的多核苷酸或核酸序列包含人sghrt rna序列的3’非翻译区(3’utr)。在多个实施方案中,人sghrt rna序列的3’utr包含seq id no:17中列出的序列:
[0104]
[0105][0106]
在多个实施方案中,所述多肽包含人sghrt分泌肽或其部分/片段。在多个实施方案中,人sghrt分泌肽包含seq id no:18中列出的序列:mlqfllgftlgnvvgmyla或seq id no:22中列出的序列:mlqfllgftlgnvvgmy或其部分,任选地线性部分。
[0107]
在多个实施方案中,所述多肽、多核苷酸或核酸序列或其部分/片段与下表1中所示的序列或其部分(任选地线性部分)具有以下序列同一性:至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%。
[0108]
表1
[0109]
[0110][0111]
在多个实施方案中,所述多肽或其部分/片段的大小/分子量/分子质量为约1kda至约30kda、约5kda至约20kda、约5kda至约15kda、约5kda至约12kda或约15kda至约20kda。在一些实施方案中,所述多肽的大小/分子量/分子质量为约5kda至约6kda、或约5kda、约5.8kda或约6kda。在一些实施方案中,其单体形式的所述多肽的大小/分子量/分子质量为约5kda至约6kda、或约5kda、约5.8kda或约6kda。在一些实施方案中,所述多肽或其部分/片段的大小/分子量/分子质量为约7kda至约9kda、或约7kda、约8kda或约9kda。在一些实施方案中,其二聚形式的所述多肽的大小/分子量/分子质量为约7kda至约9kda、或约7kda、约8kda或约9kda。在一些实施方案中,所述多肽或其部分/片段的大小/分子量/分子质量为约11kda至约13kda、或约11kda、约12kda或约13kda。在一些实施方案中,其三聚形式的多肽的大小/分子量/分子质量为约11kda至约13kda、或约11kda、约12kda或约13kda。在一些实施方案中,多肽或多肽寡聚体或其部分/片段的大小/分子量/分子质量为约15kda、约16kda、约17kda、约18kda、约19kda或约20kda。
[0112]
在一些实施方案中,所述多肽或其单体形式的多肽或其部分/片段具有不超过约6000da的大小/分子量/分子质量。在一些实施方案中,所述多肽或其单体形式的多肽或其
部分/片段具有约5000da至约6000da或约5200da至约5600da的大小/分子量/分子质量。在多个实施方案中,所述多肽或其单体形式的多肽或其部分/片段具有以下大小/分子量/分子质量:约5240da、约5250da、约5260da、约5270da、约5280da、约5290da、约5300da、约5310da、约5320da、约5380da、约5390da、约5400da、约5520da、约5530da、约5265da、约5267da、约5283da、约5313da、约5246da、约5264.87da、约5266.85da、约5282.83da、约5312.84da、约5399.85da、约5529.94da或约5245.78da。
[0113]
在一些实例中,所述多肽(或其部分/片段)作为配体或信号传导分子。在一些实例中,所述多肽(或其部分/片段)通过与一种或多种调节蛋白结合和/或调节一种或多种调节蛋白来发挥其生物学功能,所述调节蛋白包括但不限于比自身大的那些。在一些实例中,所述多肽(或其部分/片段)与线粒体呼吸复合体iii的亚单位9相互作用或结合。
[0114]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物涉及或能够调节心脏细胞的细胞分裂、细胞增殖和/或细胞去分化。
[0115]
在一些实例中,使用crispr基因编辑技术生成的atg突变胚胎干(es)细胞克隆无法使用脂肪酸生成三磷酸腺苷(atp),所述crispr基因编辑技术破坏了多肽的形成,同时仍保持其rna转录物。因此,在一些实例中,所述多肽(或其部分/片段)允许在心脏细胞中的脂肪酸利用。在一些实例中,所述多肽的rna转录物没有显示这种能力。
[0116]
小鼠心肌细胞(cm)在出生后约第七天(p7)的增殖窗口结束时退出细胞周期。在一些实例中,在小鼠心脏中,所述多肽(或其部分/片段)和/或其rna转录物的表达在p7瞬时达到峰值,并从p10开始随着年龄的增长逐渐增加,表明其在此发育阶段在调节cm细胞周期退出的潜在作用。
[0117]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物通过调节细胞周期再进入来调节细胞增殖。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物通过调节细胞周期检查点调节物来调节细胞周期再进入。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物调节以下细胞周期检查点调节物中的一种或多种:活化物、抑制剂、g1/s和/或g2/m期调节物。
[0118]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物调节一种或多种以下g1/s期调节物:cdk4、cdk6、ccne1和ccnd2。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物调节一种或多种以下g1/s期调节物:cdk6和ccnd2。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物调节一种或多种以下g2/m期调节物:ccng1、cdk1和cdc25a。
[0119]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物调节细胞周期素依赖性激酶抑制剂1(p21),其是g1/s和g2/m期细胞周期抑制剂。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物通过调节上游钙网蛋白(calr)来调节p21。在一些实例中,多肽(或其部分/片段)和/或其rna转录物调节calr以调节细胞周期再进入。
[0120]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会下调ccnd2。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会上调ccng1。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制不会显著改变nppa和/或dstn的表达。
[0121]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消
除或抑制会上调g1/s期活化剂cdk6。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会上调g2/m期活化剂cdk1和cdc25a。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会诱导或促进s期进入。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会诱导或促进m期进入。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会显著地增加极光激酶b,它是胞质分裂的标志物。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会诱导或促进胞质分裂。
[0122]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会下调g1/s和g2/m期抑制剂p21和/或上调calr。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会上调阻断p21翻译的calr。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制的作用不能仅通过p21的缺失来概括。
[0123]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会减小细胞(例如cm细胞)的横截面积或减小细胞大小。
[0124]
因此,在多个实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会在体外和体内诱导或促进细胞周期再进入。
[0125]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制不会显著改变一种或多种以下g1/s期活化剂的水平:ccne2、ccnd1和cdk2。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制不会显著改变一种或多种以下g2/m期活化剂的水平:ccnb1和cdc25b。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制不会显著增加或诱导细胞凋亡或细胞死亡。
[0126]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会增加去分化标志物诸如dab2的表达。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会产生去分化谱,诸如dab2+谱。
[0127]
在多个实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制(例如在心脏细胞中)会导致心脏细胞获取心脏祖细胞样特征(例如,与野生型心肌细胞相比,细胞显得更圆、更小和/或具有更高的核/质比,和/或细胞显示出增加的dab2+谱和/或存在组织结构丢失)。
[0128]
因此,在多个实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制(例如在心脏细胞中)会诱导或促进例如心脏细胞的去分化。
[0129]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物在横向主动脉弓缩窄(tac)应激小鼠模型中被上调。在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物在患病心脏(诸如患有扩张型心肌病、肥厚型心肌病和/或缺血性心肌病的终末期心力衰竭患者的心脏)中被上调。
[0130]
在一些实例中,所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制在tac应激小鼠模型中造成射血分数(ef%)和左心室(lv)壁厚的部分和显著挽救。在一些实例中,tac应激小鼠模型中所述多肽(或其部分/片段)和/或其rna转录物的表
达减少/表达消除或抑制会诱导心脏细胞的去分化。在一些实例中,tac应激小鼠模型中所述多肽(或其部分/片段)和/或其rna转录物的表达减少/表达消除或抑制会导致与对照小鼠相比每个心脏切片中有更多的dab2+心肌细胞(与dab2-心肌细胞相比,其可能更小且主要为单核的)。
[0131]
因此,可能需要操纵所述多肽(或其部分/片段)以破坏或抑制其天然功能,从而实现心脏细胞的增殖或去分化。例如,可以在所述多肽(或其部分/片段)中引入一个或多个突变以使其天然功能部分或完全失活。例如,可以在所述多肽(或其部分/片段)中引入功能丧失突变、无效突变、失活突变、隐性突变和显性负突变中的一种或多种。因此,在多个实施方案中,提供了包含一个或多个突变的如本文所述的多肽(或其部分/片段)。
[0132]
此外,也可以通过剂的使用来阻断或抑制所述多肽(或其部分/片段)发挥的天然生物学效应。在多个实施方案中,提供了一种剂,其能够与所述多肽(或其部分/片段)相互作用;能够干扰或阻断所述多肽(或其部分/片段)与生物分子(诸如细胞周期检查点调节物和/或calr)的相互作用;能够干扰或阻断所述多肽(或其部分/片段)的寡聚化;能够抑制/阻断rna翻译以产生所述多肽(或其部分/片段);和/或能够与编码所述多肽(或其部分/片段)的多核苷酸相互作用或抑制所述多核苷酸;从而调节心脏细胞的细胞分裂、细胞增殖和/或细胞去分化。在多个实施方案中,所述与所述多肽(或其部分/片段)的相互作用包括至少部分结合至所述多肽(或其部分/片段)和/或至少部分切割/降解/消化/水解所述多肽(或部分/片段),以使得所述多肽(或其部分/片段)不再具有生物活性或具有降低的生物活性。
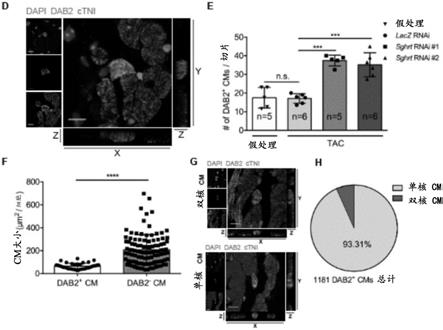
[0133]
在多个实施方案中,所述剂包含靶向所述多肽(或其部分/片段)的抑制剂。在多个实施方案中,提供了所述多肽(或其部分/片段)的抑制剂。在多个实施方案中,所述剂或抑制剂包含药学上有效的化合物、药物、小分子、纳米颗粒、肽、基本上对应于所述多肽(或其部分/片段)的肽并且还包含突变、蛋白质、蛋白酶、核酸、抗体和片段(例如抗原结合片段)及它们的组合。
[0134]
鉴定具有所需生物活性的剂或抑制剂的方法是熟练技术人员已知的。例如,可以采用化合物文库的筛选或高通量筛选来鉴定显示以下所需生物活性的先导化合物:例如对所述多肽(或其部分/片段)的结合亲和力和/或对所述多肽(或其部分/片段)的抑制/拮抗活性。可以使用基于细胞的筛选或基于细胞的测定,例如,使用心脏细胞或人es衍生的cm或工程化心脏组织(eht)系统。多细胞、共培养、3d球体,或更具体地,心脏组织和心脏类器官也可用作药物发现的平台。其他常规技术诸如合理设计、底物或配体建模和片段筛选也可以组合使用或独立使用。还可以通过用所述多肽(或其部分/片段)使动物免疫来产生抗体并例如通过诸如嵌合化或用人抗体的恒定区替换动物抗体的恒定区等策略对如此获得的抗体进行工程化以防止在受试者(例如人类受试者)中的意外免疫反应。
[0135]
在多个实施方案中,所述剂或抑制剂能够穿透线粒体、转运至线粒体或被线粒体摄取,任选地其中所述剂或抑制剂能够选择性穿透线粒体、转运至线粒体或被线粒体摄取,进一步任选地其中所述剂或抑制剂包含线粒体靶向信号,任选地,线粒体膜靶向信号。在多个实施方案中,所述剂或抑制剂偶联/缀合至能够穿透线粒体、移位至线粒体或被线粒体摄取的载剂(carrier),任选地其中所述载剂能够选择性穿透线粒体、移位至线粒体或被线粒体摄取。例如,可以穿透线粒体的载剂包括具有交替阳离子和疏水残基的短肽序列、寡聚碳
水化合物支架、基于囊泡的转运系统、阳离子脂质体等。
[0136]
在多个实施方案中,提供了用于疗法中的剂或抑制剂。在多个实施方案中,提供了用于治疗心脏功能受损的剂或抑制剂。在多个实施方案中,提供了所述剂或抑制剂或其药学上可接受的盐/衍生物在制备用于治疗心脏功能受损的药物中的用途。
[0137]
在多个实施方案中,提供了一种组合物,任选地一种药物组合物,其包含抑制剂或剂及合适的载剂、佐剂、稀释剂和/或赋形剂。
[0138]
在多个实施方案中,所述剂、抑制剂或组合物能够至少部分地挽救或改善心脏功能。在多个实施方案中,所述剂、抑制剂或组合物能够在肥大发作后至少部分地降低或改善心脏功能。在多个实施方案中,所述挽救或改善心脏功能包括至少部分挽救或改善选自由以下组成的组的以下一项或多项:射血分数、左心室壁厚度、右心室壁厚度、左心室壁应力、右心室壁应力、心室质量、收缩功能、心脏肥大、舒张末期容积、收缩末期容积、心输出量、心脏指数、肺毛细血管楔压和肺动脉压。在多个实施方案中,所述剂、抑制剂或组合物能够刺激心肌细胞修复。在多个实施方案中,所述剂、抑制剂或组合物能够刺激心脏再生和/或增殖。
[0139]
在多个实施方案中,提供了用作心脏再生剂、心脏增殖剂和/或心脏保护剂的所述剂、抑制剂或组合物。
[0140]
在多个实施方案中,所述剂、抑制剂或组合物能够诱导受试者的心脏细胞增殖。在多个实施方案中,所述剂、抑制剂或组合物能够诱导受试者的心脏细胞去分化。
[0141]
在多个实施方案中,所述剂、抑制剂或组合物包括靶向所述多肽(或其部分/片段)的第一剂、抑制剂或组合物,和靶向编码所述多肽(或其部分/片段)的多核苷酸的第二剂、抑制剂或组合物。
[0142]
在多个实施方案中,提供了一种治疗受试者心脏功能受损的方法,所述方法包括:向所述受试者施用所述剂、抑制剂或组合物。在多个实施方案中,提供了一种治疗受试者心脏功能受损的方法,所述方法包括:抑制受试者中的所述多肽(或其部分/片段)。
[0143]
在多个实施方案中,提供了一种治疗或预防有需要的受试者的心脏病或心脏功能受损的方法,所述方法包括减少/遏止/阻断/抑制/下调/调整所述多肽(或其部分/片段)的表达或所述多肽(或其部分/片段)下游或上游的生物分子的表达。在多个实施方案中,提供了一种治疗或预防有需要的受试者的心脏病或心脏功能受损的方法,所述方法包括向所述受试者施用治疗有效量的剂或抑制剂,其能够与所述多肽(或其部分/片段)结合或相互作用以减少/遏止/阻断/抑制/下调/调整所述多肽(或其部分/片段)的表达或所述多肽(或其部分/片段)下游或上游的生物分子的表达。在多个实施方案中,提供了一种治疗或预防有需要的受试者的心脏病或心脏功能受损的方法,所述方法包括减少/遏止/阻断/抑制所述多肽(或其部分/片段)的寡聚化。在一些实施方案中,减少/遏止/阻断/抑制/下调/调整多肽(或其部分/片段)的表达(例如功能表达)包括减少/遏止/阻断/抑制多肽(或其部分/片段)的寡聚化。
[0144]
在多个实施方案中,心脏病或心脏功能受损选自由以下组成的组:心肌梗塞、心力衰竭、冠状动脉疾病、动脉变窄、心脏病发作、心律异常、心律失常、心力衰竭、心脏瓣膜病、先天性心脏病、心肌疾病、心肌病(包括扩张型心肌病、肥厚型心肌病、缺血性心肌病和特发性心肌病)、心包疾病、主动脉疾病、马凡综合征、遗传性心肌病、非遗传性心肌病、心脏肥
大、压力超负荷引起的心脏功能障碍和受损的心脏组织。
[0145]
在多个实施方案中,提供了一种评估受试者的心脏功能的方法,所述方法包括:测定从受试者处获得的样本中所述多肽(或其部分/片段)的表达水平;将所述表达水平与参考表达水平进行比较,其中如果所述表达水平偏离或超过参考表达水平,则认为受试者具有受损或恶化的心脏功能。在一些实施方案中,如果样本中的表达水平偏离或超过参考表达水平,则表明受试者患有心脏病/心脏功能受损或易患心脏病/心脏功能受损。
[0146]
在一些实施方案中,参考表达水平包括所述多肽(或其部分/片段)在健康群体中的表达水平。例如,参考表达水平可以是所述多肽(或其部分/片段)在健康群体中的平均表达水平/范围。在一些实施方案中,参考表达水平包括所述多肽(或其部分/片段)在从受试者处获得的较早样本中的表达水平。
[0147]
在多个实施方案中,提供了一种监测受试者的心脏功能的方法,所述方法包括:测定在第一时间点从受试者处获得的第一样本中所述多肽(或其部分/片段)的第一表达水平;测定在第一时间点后的第二时间点从受试者处获得的第二样本中所述多肽(或其部分/片段)的第二表达水平;以及比较第一表达水平与第二表达水平,其中如果第二表达水平高于第一表达水平,则认为受试者的心脏功能已经恶化,其中如果第二表达水平低于第一表达水平,则认为受试者的心脏功能已有改善,且其中如果第二表达水平与第一表达水平基本相同,则认为受试者的心脏功能已经稳定。在一些实施方案中,如果第二表达水平低于第一表达水平,则表明受试者的预后良好。
[0148]
在多个实施方案中,测定所述多肽(或其部分/片段)的表达水平包括分析所述多肽(或其部分/片段)的浓度和/或功能活性,包括对所述多肽(或其部分/片段)使用竞争性结合测定。
[0149]
在多个实施方案中,测定多肽(或其部分/片段)的表达水平包括将样本与对多肽具有特异性的试剂接触,以便定量、半定量或定性地确定或测量多肽(或其部分/片段)的量。所述剂能够直接或间接测定和/或结合多肽(或其部分/片段)。试剂的实例包括但不限于蛋白质/探针(例如抗原结合蛋白诸如抗体或其片段,酶诸如辣根过氧化物酶和碱性磷酸酶等)、多核苷酸(例如适体)和小分子(例如金属纳米颗粒)。所述多肽(或其部分/片段)的表达水平可以通过多种常规技术测定,包括免疫组织化学、elisa、蛋白质印迹、斑点印迹、免疫沉淀、质谱等。例如,可以将特异性结合所述多肽(或其部分/片段)的试剂诸如抗体(例如标记抗体)添加到样本中以允许相对或绝对确定多肽(或其部分/片段)的量。
[0150]
样本可以包括心脏组织,任选地来自心脏组织的线粒体。因此,在多个实施方案中,所述方法还包括从心脏组织中提取线粒体。在多个实施方案中,心脏组织包括左心室心脏组织。在多个实施方案中,心脏组织包括心肌细胞。
[0151]
在多个实施方案中,受试者包括人类受试者。
[0152]
在一些实施方案中,所述方法包括预后方法。在一些实施方案中,所述方法包括诊断方法。
[0153]
在多个实施方案中,提供了一种在心脏治疗方案之前、之后或期间评估心脏组织的再生或增殖能力的预后或诊断方法,包括:测定所述心脏组织的心脏样本中所述多肽(或其部分/片段)的存在或量;并且当存在多肽(或其部分/片段)时,推断所述心脏组织的增殖能力不良;并且当不存在多肽(或其部分/片段)时,推断所述心脏组织的增殖能力良好。在
一些实施方案中,测定步骤涉及分析所述多肽(或其部分/片段)的功能活性,包括对所述多肽(或其部分/片段)使用竞争性结合测定。
[0154]
在多个实施方案中,所述方法还包括向受试者施用所述多肽(或其部分/片段)的抑制剂。在多个实施方案中,所述方法还包括向受试者施用如本文所述的剂、抑制剂或组合物。在多个实施方案中,所述方法还包括向受试者施用治疗有效量的抑制剂、剂或组合物。
[0155]
在多个实施方案中,提供了一种鉴定或筛选用于治疗心脏功能受损或心脏病的潜在药物或治疗剂的方法,所述方法包括:在存在和不存在候选药物或治疗剂的情况下分析所述多肽(或其部分/片段)的表达水平;以及基于多肽(或其部分/片段)在候选药物或治疗剂存在时和在候选药物或治疗剂不存在时的表达差异来确定所述候选药物或治疗剂是否是用于治疗或预防心脏功能受损或心脏病的有用药物或治疗剂。
[0156]
在多个实施方案中,如果所述多肽(或其部分/片段)的表达在候选药物或治疗剂存在时与在候选药物或治疗剂不存在时相比减少,则所述候选药物或治疗剂被鉴定为用于治疗或预防心脏功能受损或心脏病的有用药物或治疗剂。
[0157]
在多个实施方案中,提供了一种鉴定用于治疗心脏功能受损的潜在药物的方法,所述方法包括:测定所述多肽(或其部分/片段)在细胞中的第一表达水平;使所述细胞暴露于候选药物;以及测定所述多肽(或其部分/片段)在暴露之后的第二表达水平,其中如果第二表达水平低于第一表达水平,则所述候选药物被鉴定为用于治疗心脏功能受损的潜在药物。
[0158]
在多个实施方案中,提供了一种载体,所述载体包含编码本文所述的多肽(或其部分/片段)或剂、抑制剂或组合物的多核苷酸序列如dna/cdna序列。载体可以选自由以下组成的组:质粒、病毒颗粒、噬菌体、杆状病毒、酵母质粒、基于脂质的媒介物(vehicle)、聚合物微球、脂质体和基于细胞的媒介物、胶体金颗粒、脂多糖、多肽(或其部分/片段)、多糖、病毒媒介物、腺病毒、逆转录病毒、慢病毒、腺相关病毒、疱疹病毒、痘苗病毒、泡沫病毒、巨细胞病毒、塞姆利基森林病毒(semliki forest virus)、痘病毒、伪狂犬病病毒、rna病毒载体、dna病毒载体以及由质粒与噬菌体dna的组合衍生的载体。多核苷酸可以与表达调控序列可操作地连接以指导肽合成。载体还可包含一种或多种选择性标志物基因以提供用于选择转化的宿主细胞的表型性状。
[0159]
在多个实施方案中,提供了一种用所述载体转染的宿主细胞或包含所述载体的宿主细胞。
[0160]
在多个实施方案中,提供了一种产生所述多肽(或其部分/片段)、剂、抑制剂或组合物的方法,所述方法包括:在合适的条件下培养宿主细胞以允许产生所述多肽(或其部分/片段)、剂、抑制剂或组合物;以及回收如此产生的多肽(或其部分/片段)、剂、抑制剂或组合物。
[0161]
所述载体和/或宿主细胞可用于治疗方法中。
[0162]
在多个实施方案中,提供了一种转基因非人受试者,其包含编码所述多肽(或其部分/片段)的核酸构建体或多核苷酸构建体(例如dna/cdna序列),任选地其中所述转基因非人受试者过度表达所述多肽(或其部分/片段)。转基因非人受试者可包括选自由以下组成的组的非人哺乳动物:非人灵长类动物、啮齿动物、小鼠、兔、绵羊、奶牛和猪。
[0163]
在多个实施方案中,提供了与可检测标记偶联的所述多肽(或其部分/片段)。所述
多肽(或其部分/片段)可作为用于鉴定心脏功能受损的生物标志物。
[0164]
在多个实施方案中,提供了一种试剂盒,其包含可检测的标记或剂。可检测的标记可选自由以下组成的组:荧光标记、放射性标记、酶标记、化学发光标记、寡核苷酸、染料、胶体颗粒、氧化剂、还原剂及它们的组合。所述试剂盒可以是用于评估受试者的心脏功能或用于评估受试者是否患有心脏病或易患上心脏病的试剂盒。所述试剂盒还可包括使用说明书。
[0165]
在多个实施方案中,提供了一种用于心脏细胞的增殖、去分化或再生,或促进心脏细胞的增殖、去分化或再生的方法,所述方法包括使心脏细胞与所述剂、抑制剂、组合物或载体中的一种或多种接触。在多个实施方案中,提供了一种使心脏细胞去分化和/或增殖的方法,所述方法包括:抑制心脏细胞中所述多肽(或其部分/片段)的表达。
[0166]
在多个实施方案中,提供了一种通过所述方法产生的细胞(任选地,心脏细胞)、或其后代或细胞衍生物。在多个实施方案中,提供了用于有需要的受试者的疗法的心脏细胞、或其后代或细胞衍生物。
[0167]
在多个实施方案中,心脏细胞包括心肌细胞,进一步任选地,其中心肌细胞包括成体心肌细胞。
[0168]
在多个实施方案中,本文所述的方法是体外或体内的。
[0169]
在多个实施方案中,提供了如本文所述的产物、方法或用途。
附图说明
[0170]
图1是从大鼠心脏组织的线粒体中提取的膜蛋白的质谱结果。
[0171]
图2是图1的质谱的解卷积。
[0172]
图3是使用串联质谱(ms/ms)对肽进行测序的结果,在886.48m/z处有峰。
[0173]
图4.哺乳动物线粒体样本中stmp1的肽图和覆盖率。
[0174]
图5.初步证据指示short微肽寡聚化。a.将1ug和3ug的sghrt合成肽煮沸10分钟并在16.5%tricine凝胶中跑胶,并且将凝胶用考马斯蓝溶液染色。b.将3ug的sghrt合成肽用1mm和10mm edta处理30分钟,然后在16.5%tricine凝胶中跑胶,并且将凝胶用考马斯蓝溶液染色。c.sghrt合成肽的分析型超速离心(auc)分析表明sghrt肽的分子量在15kda至20kda范围内,且最高峰在约17kda处。d.使用flag抗体的蛋白质印迹显示,经sghrt-flag载体(其中sghrt带有c端flag标记)转染的hek细胞的蛋白质溶解产物中有12kda条带,但经flag-sghrt载体(其中sghrt带有n端flag标记或带有atg突变的sghrt-flag)转染的细胞的溶解产物中则没有。
[0175]
图6.终末期hf的人心脏中sghrt的上调。a.rna-seq轨迹显示与健康心脏相比,扩张型心肌病(dcm)、肥厚型心肌病(hcm)和缺血性心肌病(ihd)患者中sghrt的表达更高。b.rt-qpcr证实终末期hf患者的心脏组织中sghrt上调。
[0176]
图7.hesc-cm中的sghrt敲除导致dab2+cm增加。a.rna-seq数据显示d58 sghrt ko hesc-cm中dab2的mrna表达增加。b.蛋白质印迹结果显示d58 sghrt ko hesc-cm中dab2蛋白表达的增加。gapdh用作上样对照。c.代表性显微镜图像显示d58时sghrt敲除后dab2+hesc-cm增加而ctnt+hesc-cm减少。白框区域放大到40倍。d.sghrt敲除导致d58时间点时dab2+cm增加。
[0177]
图8.sghrt ko eht显示形成不良的eht谱和去分化dab2+cm的增加。a.在d16从野生型和sghrt敲除的hesc-cm生成的eht的代表性图片。b.sghrt wt和d16 eht ko的收缩力曲线。c.代表性显微镜图像显示sghrt ko d14 eht中的dab2+cm增加。
[0178]
图9.sghrt敲低导致新生(p7)小鼠的cm去分化。a.sghrt在p1至p56小鼠整个心脏中的表达。b.在p7 wt小鼠中注射aav9-ctnt-gfp-rnai以敲低sghrt。c.典型dab2+和ctni+心肌细胞的代表性图片,具有z堆叠的共聚焦图像显示dab2和ctni信号的共定位。d.对照小鼠和sghrt kd的小鼠的每个心脏切片的dab2+cm的定量(分析了每个心脏的2个切片)。e.dab2+cm及其相邻dab2-cm的细胞大小。f.双核dab2+cm(左,两个核由白色箭头表示)和单核dab2+cm(右)的代表性图片。g.图示出了双核和单核dab2+cm的百分比。****p《0.0001(student’s t检验)。
[0179]
图10.sghrt的kd在6周内挽救了tac小鼠模型中的心脏功能并诱导了cm去分化。a.单核rna-seq显示出与来自假(sham)cm的单核相比,从tac cm分离的单核中sghrt mrna表达的上调。每个点表示单个cm核。b.图解示出了对8周龄wt小鼠进行tac手术的时间线,随后是注射aav9和采集。c.图示出了假处理小鼠、具有tac的对照小鼠和具有tac的sghrt kd小鼠在注射aav9后6周的ef和fs。d.典型dab2+和ctni+细胞的代表性图片。e.每个心脏切片的dab2+cm的定量(分析了每个心脏的3个切片)。f.dab2+cm及其相邻dab2-cm的细胞大小。g.双核dab2+cm(上图)和单核ph3+cm(下图)的代表性图片。(i)图示出了双核和单核dab2+cm的百分比。n.s.p》0.05,**p《0.01,****p《0.0001(student’s t检验)。
[0180]
图11.a.代表性dna测序结果证实,成功生成了2个基于a-至-g(be19-4和be19-10)和2个基于c-至-t(be20-1和be20-2)的编辑es克隆。b.q-pcr结果显示be es克隆中的sghrt rna表达没有变化。c.使用和不使用脂肪酸处理的wt、ko和be es衍生的cm克隆中atp产生的定量。
具体实施方式
[0181]
实施例
[0182]
通过以下讨论并且如果适用,结合附图,本公开的示例性实施方案对于本领域的普通技术人员将更好地理解并且显而易见。应当理解,在不偏离本发明的范围的情况下,可以进行与结构、电学和光学改变有关的其他修改。示例性实施方案不一定是相互排斥的,因为一些实施方案可以与一个或多个实施方案组合以形成新的示例性实施方案。
[0183]
心肌细胞去分化和增殖的关键调节物
[0184]
新生哺乳动物心脏具有强大但短暂的再生能力,会在生命的最初几天后迅速丧失。心脏再生可能是由于预先存在的cm的去分化和随后的增殖。心肌细胞去分化的特征在于肌节结构的分解、线粒体的挤出、电解偶联和细胞周期进程调节物的表达。了解cm去分化和增殖的生物学对于治疗心力衰竭具有重要的临床意义。
[0185]
信号传导途径、转录因子、细胞周期调节物、表观遗传修饰剂、环境因素和细胞外基质已被鉴定为控制哺乳动物cm去分化和增殖。操纵这些途径会重新激活cm增殖并使受伤的成年哺乳动物心脏再生。在人类hf中,有限的功能恢复清楚地显示人类成年cm的再生不足。人类cm更新的证据表明,开发刺激该过程的药理学策略可以是用于cm替换的细胞移植策略的合理替代或补充。因此,了解生物学并揭示在正常心脏和衰竭心脏中介导cm去分化
和增殖的新型基因调节途径/驱动因素是重要的。
[0186]
心肌病中的长链非编码rna衍生的微肽
[0187]
长链非编码rna(lncrna)最近被鉴定为对构成正常心脏发育和疾病期间心肌重构基础的生物过程的调节的新的复杂层面。lncrna调节回路的失调与心脏病理性肥大和心力衰竭有关。lncrna代表心血管疾病的新型治疗策略的潜在目标。有趣的是,最近出现的证据表明,一些lncrna被错误地注释为非编码,且实际上含有编码功能肽的短开放阅读框(sorf)。sorf编码的肽(sep)或微肽已被证明在基本生物过程和维持细胞稳态中具有重要作用。这些小蛋白质可以作为配体或信号传导分子独立地发挥作用,或者这些小蛋白质可以通过与更大的调节蛋白结合并调节它们来发挥其生物学功能。已发现全部推定微肽中的一小部分的生物学作用,但仍有大量工作需要完成以证明它们的存在并阐明它们的功能。
[0188]
先前在从健康和衰竭的成年小鼠和人的心脏中分离出来的左心室(lv)cm上进行了单细胞核rna-seq。随后绘制了基因调控网络的图谱,其中包含调节cm亚群中去分化和细胞周期基因表达的关键节点lincrna(sghrt和gas5)。这在国际申请第pct/sg2017/050620号中也有描述,其内容通过引用全部纳入本文。
[0189]
用质谱法分析牛心脏线粒体提取物中的小肽,发现sghrt也可能是一种与“短跨膜线粒体蛋白1前体”(stmp1)具有100%同源性的微肽,并与线粒体呼吸复合体iii的亚单位9共纯化。多序列比对表明stmp1微肽序列在脊椎动物中也高度保守。由于尚无实验证据证实人和其他哺乳动物中存在sghrt微肽,因此建议对从小鼠、大鼠、猪和人的心脏以及人多能干细胞衍生的心肌细胞中分离的线粒体膜蛋白进行质谱分析。
[0190]
鉴定从大鼠心脏分离的线粒体膜蛋白中sghrt编码的微肽
[0191]
使用在线工具(http://prospector.ucsf.edu/prospector/cgi-bin/msform.cgi?form=msisotope)生成目标肽的预测质荷比(m/z)(参见以下文献中的序列:zhang d et al.,functional prediction and physiological characterization of a novel short trans-membrane protein 1as a subunit of mitochondrial respiratory complexes.physiol genomics.2012;44:1133
–
1140.doi:10.1152/physiolgenomics.00079.2012.)。m/z比允许在质谱中鉴定正确的质量峰,从而鉴定该峰的肽序列。结果示于下表2中。
[0192]
表2:不同动物物种中膜肽sghrt的预测质量和m/z
[0193][0194]
从大鼠心脏组织中提取线粒体膜蛋白并进行液相色谱-质谱(lc-ms)。使用agilent mass hunter b08软件的提取离子色谱图(eic)功能确定预测的m/z的存在。获得的质谱示于图1中。鉴定出在约9分钟洗脱的显著分子特征886.48m/z。
[0195]
然后将质谱解卷积以获得原始分子质量的估计值(图2)。显著的分子特征
886.48m/z经估算质量为5321.84,这提示了大鼠stmp1肽。
[0196]
为了确认肽的身份,使用串联质谱法(ms/ms)进行氨基酸测序。在lc-ms上重新运行样本,其中碰撞诱导解离(cid)细胞被配置成在不同的碎裂能量下对分子特征进行碎裂,并收集得到的质谱。然后通过手动匹配ms/ms谱与从http://prospector.ucsf.edu/prospector/cgi-bin/msform.cgi?form=msproduct获得的预测a、b和y系列离子来确认氨基酸序列(图3)。鉴定了几个不同的片段,包括例如包含序列“mlqfllgftl”的片段。基于所鉴定的片段,预测sghrt的全序列为“mlqfllgftlgnvvgmylaqnydipnlakkleeikkdldakkkppsa”。ms/ms谱与从大鼠sghrt的n端产生的b离子一致(参见表2中预测的大鼠sghrt的n端氨基酸)。还注意到a2和y4离子的强信号。
[0197]
在进一步的实验中进行了质谱分析,以确认和解析小鼠、大鼠、猪和人中sghrt的蛋白质序列。使用凝胶辅助样本制备(gasp)策略(fischer,r.&kessler,b.m.gel-aided sample preparation(gasp)
‑‑
a simplified method for gel-assisted proteomic sample generation from protein extracts and intactcells.proteomics 15,1224-1229,doi:10.1002/pmic.201400436(2015))制备用于蛋白质组学分析的样本。在富含线粒体的心脏样本和hes衍生的cm中进行肽图分析。为了增加蛋白质覆盖率,lc-ms/ms在未消化的、胰蛋白酶消化的以及胰凝乳蛋白酶消化的样本中进行。在有限的可用的人心脏尸体样本中检测并证实了人sghrt肽的片段,并且在大鼠和小鼠样本中实现完全覆盖(图4)。
[0198]
因此发现sghrt基因座含有sorf并编码47个氨基酸的线粒体微肽(源自线粒体长链非编码rna),这可能解释了sghrt治疗和生物标志物的潜力/价值。该微肽被命名为短跨膜线粒体蛋白1前体或stmp1。在牛心脏线粒体组分的蛋白质组筛选中分离出具有100%同源性的肽序列,并与线粒体呼吸复合体iii的亚单位9共纯化。此外,多序列比对显示stmp1微肽序列在脊椎动物中高度保守,并且斑马鱼中的吗啉靶向此序列产生了包括心脏水肿的表型。在本公开中,从小鼠、大鼠、猪和人的心脏组织提取物中鉴定出sghrt肽序列及其片段。结果表明,sghrt肽序列在不同物种之间具有高度保守性,包括哺乳动物物种之间。
[0199]
证据表明sghrt微肽的寡聚化
[0200]
sghrt微肽的预期大小为约5.8kda。然而,当sghrt合成的肽在16.5%tricine sds凝胶中跑胶时,在约5.8kda、约8kda和约12kda处观察到三个条带,其中12kda条带最为丰富(图5a)。此结果表明sghrt以寡聚体形式存在,其可以是二聚体或三聚体。sghrt寡聚体还对热处理(图5a)和edta处理(图5b)有抗性,表明共价键不负责寡聚化。为了定量分析溶液中的sghrt肽的分子量,对sghrt合成肽进行分析型超速离心(auc)分析。结果表明,sghrt肽的分子量在15-20kda范围内且最高峰再次出现在约17kda处(图5c)。为了验证sghrt寡聚化也在体内发生,用sghrt-flag或flag-sghrt载体转染hek细胞,其中sghrt分别在c端或n端用flag标记。有趣的是,当sghrt-flag被标记在c端而不是n端时,在约12kda处始终鉴定出一个强条带。作为额外的对照,此条带在用突变的sghrt(其中atg被ggg替代)转染的hek细胞中不存在(图5d)。综上所述,结果与sghrt微肽形成寡聚体的结论一致,寡聚体可以是二聚体或三聚体。
[0201]
sghrt mrna表达在终末期hf患者的左心室中上调
[0202]
可以使用papworth(cambridge)hospital tissue bank review board和cambridgeshire research ethics committee(uk)批准的现行方案采集的人lv样本。这些
样本来自因终末期缺血性和特发性心肌病而接受心脏移植的患者。基于》50个这些样本以及每月持续不断的供应,完成了差异dna甲基化和h3k36me3富集谱的全基因组图谱绘制,完成了人终末期hf中dna重复和环状rna的外形研究(landscape)。与此gap提议相关,使用人lv样本进行的rna-seq和rt-qpcr验证表明,sghrt mrna水平在一系列患病的hf心脏中上调(图6,dcm:扩张型心肌病;hcm:肥厚型心肌病;ihd:缺血性心肌病)。
[0203]
sghrt-ko hes分化和工程化心脏组织(eht)中去分化的cm增加
[0204]
为了验证sghrt是否调节人cm的分化,使用crispr/cas9技术生成sghrt敲除hes细胞系,以使sghrt基因的启动子和第一外显子特异性缺失。验证了在sghrt-ko hesc中编辑的有效且精确的基因组,完全丧失sghrt mrna表达。通过rt-qpcr、免疫染色和蛋白质印迹,证明oct4 mrna/蛋白和nanog mrna没有变化,表明sghrt-ko hesc保持了其多能性,并且干细胞特性不受sghrt ko影响。
[0205]
接下来,使用sghrt-ko hesc进行cm分化,并在d58时采集cm培养物。与wt cm相比,sghrt-ko cm(myh6-gfp报告基因阳性)显得更圆、更小且具有更高的核/质比(数据未显示),表明这些细胞可获取类似心脏祖细胞的特征。rna-seq和蛋白质印迹也证实了dab2 mrna和蛋白质增加(图7a-图7b)。sghrt-ko中dab2
+
细胞显著增加(wt中《1%,而d58 sghrt ko中有11.2%dab2
+
cm,图1c-图1d)。同样,ctnt
+
也显著减少(wt培养物中为96.0%,而d58 sghrt-ko中为71.3%)。这些结果进一步表明,去分化的cm会失去cm特征并呈现出更多类似祖细胞的特征。此外,使用实验室现在与thomas eschenhagen(hamburg)合作建立的eht系统(http://foo-lab.com/video/eht.html),使用wt和ko d14hes-cm构建的eht显示组织结构的损失(图8a-图8b)和dab2
+
cm的增加(图8c)。总之,迄今为止的结果表明,sghrt的丧失增加了成熟cm在体内和体外的去分化。
[0206]
sghrt kd在体内诱导新生小鼠心肌细胞去分化
[0207]
小鼠cm在出生后第7天(p7)的其增殖窗口结束时进入细胞周期停滞。因此,评估了正常小鼠心脏发育过程中跨越此增殖时间进程窗口的sghrt转录水平。发现sghrt表达从p10开始随着年龄增长逐渐增加(图9a)。p7增殖窗口的结束与sghrt中一个小但具有统计学意义的表达峰值相吻合。为了测试sghrt是否在体内调节cm去分化并评估体外kd结果的有效性,使用aav9-tnnt2-egfp rnai递送系统靶向p7小鼠中的cm特异性体内kd(图9b)。在p7小鼠中注射aav9-tnnt2-egfp-sghrt kd后,在p14采集心脏。sghrt-kd心脏确实具有明显更多去分化的cm(dab2
+
)(图9c、图9d)。
[0208]
接下来,用细胞大小和细胞核数量证实dab2
+
cm具有去分化cm的典型特性。dab2
+
cm(n=15)比它们相邻的dab2-cm(n=45)小(图9e)。在所有478个dab2
+
cm中,94.98%是单核的(图9f,右图和图9g),且只有极少数是双核的(图9f,左图)。这些结果表明sghrt的kd导致新生小鼠的cm去分化。
[0209]
sghrt敲除导致tac压力超负荷后成年小鼠心肌细胞去分化增加和功能恢复
[0210]
从健康和衰竭的成年小鼠左心室分离的心肌细胞上的单核rna-seq揭示sghrt在心肌细胞亚群中高度上调(图10a)。这种心肌细胞亚群是独特的,因为它们在编码细胞周期激活物和抑制物的基因中的表达模式。通过基因网络分析,sghrt作为心肌细胞应激基因程序的推定关键调节物脱颖而出。因此,决定在tac压力超负荷hf模型中进行sghrt敲除。
[0211]
tac手术后4周,小鼠被注射aav9以递送2种独特的sghrt rnai试剂(sghrt-rnai-#
1、sghrt-rnai-#2)或对照lacz序列。注射aav9后六周,在采集小鼠心脏之前通过超声心动图评估小鼠并通过免疫荧光染色评估cm去分化(图10b)。与假手术小鼠(n=3)相比,接受lacz作为对照的小鼠(n=4)显示出tac手术后心脏功能的预期显著恶化(ef%和fs%)。sghrt-rnai-#2组的小鼠心脏功能明显恢复。在sghrt-rnai-#1与对照组的ef%和fs%之间没有发现显著差异(图10c),可能是由于组内差异较大和样本量较小。
[0212]
重要的是,与对照小鼠(图10e)相比,在sghrt kd后6周,每个心脏切片发现了更多的dab2
+
心肌细胞(图10d),其中dab2已被提议作为心肌细胞去分化的真正标志物。与dab2阳性细胞中心肌细胞去分化的标志一致,dab2
+
cm(n=36个cm)总体上小于dab2-cm(n=108个cm)(图10f),并且它们也主要是单核的(图10g-图10h)。因此,结果表明sghrt kd改善衰竭小鼠心脏的心脏功能,这与sghrt抑制的心脏中成年小鼠心肌细胞的去分化增强有关。
[0213]
sghrt微肽是心肌细胞利用脂肪酸所必需的
[0214]
为了研究sghrt微肽在心肌细胞中的功能,使用基于crispr-cas的编辑技术将a或c变为g或t,从而生成atg(反向链中的tcg)突变的人胚胎干(es)细胞克隆(komor,a.c.,kim,y.b.,packer,m.s.,zuris,j.a.&liu,d.r.programmable editing of a target base in genomic dna without double-stranded dna cleavage.nature 533,420-424,doi:10.1038/nature17946(2016);gaudelli,n.m.等人programmable base editing of a*t to g*c in genomic dna without dna cleavage.nature 551,464-471,doi:10.1038/nature24644(2017)。)dna测序证实,成功生成了2个基于a-至-g(be19-4和be19-10)和2个基于c-至-t(be20-1和be20-2)的编辑es克隆(图11a)。q-pcr数据表明与wt es相比,be es克隆中的sghrt rna没有显著变化(图11b),表明sghrt dna中atg位点的变化不影响rna表达。然后这些be es克隆分化为心肌细胞(cm),并对这些用或不用脂肪酸(fa)处理的心肌细胞进行atp测定。发现与未处理的条件相比,当用fa处理时wt cm产生更多的atp,而ko和be cm克隆响应fa处理不产生更多的atp(图11c)。总之,这些结果表明sghrt是心肌细胞中利用fa所需的线粒体微肽。
[0215]
实验步骤
[0216]
组织和细胞样本
[0217]
使用papworth(cambridge)hospital tissue bank review board和cambridgeshire research ethics committee(uk)批准的现行的方案收集人心脏(左心室)样本。样本来自因终末期缺血性和特发性心肌病而接受心脏移植的患者。将组织冷冻并保存在-80℃冰箱中直至用于线粒体提取。
[0218]
分别从猪、大鼠和小鼠中收集猪、大鼠和小鼠心脏(左心室)样本,快速冷冻并保存在-80℃冰箱中直至用于线粒体提取。
[0219]
从细胞培养物中收集人es衍生的心肌细胞,快速冷冻并保存在-80℃的冰箱中直至用于提取。
[0220]
从组织中提取线粒体
[0221]
使用镊子和剪刀将组织切成小块,然后用机械搅拌器在低渗缓冲液(nacl 10mm,mgcl2 1.5mm,tris 10mm,用hcl调节至ph 7.5)中均质化。然后通过杜恩斯(douncing)使细胞破裂,直到约80%的细胞核是裸露的。然后通过如下方式使得细胞裂解产物为等渗的:通过添加浓缩的甘露醇溶液使其最终浓度为210mm甘露醇、70mm蔗糖、5mm tris、1mm edta,并
用hcl调节至ph 7.5。
[0222]
然后通过于4℃以1300g离心5分钟并弃去沉淀(三个循环)来从裂解产物中去除完整的细胞和细胞核。然后通过于4℃以8000g离心15分钟,弃去上清液,接着在等渗甘露醇溶液中重悬(两个循环)来从上清液中以沉淀形式采集线粒体。
[0223]
从线粒体中提取膜蛋白
[0224]
将有机细胞裂解缓冲液[2-丙醇:乙腈:六氟-异丙醇:水(体积比为70:25:0.56:4.44),含有20mm甲酸铵,ph 3.7]以约9:1的体积比添加到线粒体沉淀中。然后将裂解产物涡旋1分钟并在冰水浴中超声处理15分钟。然后将于4℃以21,000g离心10分钟后获得的上清液用于lc-ms。
[0225]
lc-ms
[0226]
将agilent infinity ii 6550b uplc-qtof系统用于lc-ms。uplc色谱的流动相是含有0.1%甲酸的水和含有0.1%甲酸的乙腈。使用phenomenex luna omega 1.6um polar c18 100a lc柱100
×
2.1mm进行反相分离,20分钟内线性梯度为20%至80%。洗脱液在线连接到质谱仪以获取随时间变化的质谱。
[0227]
本领域技术人员应当理解,可对本文所公开的实施方案作出其他改变和/或修改,而不背离如广泛描述的本公开的精神或范围。例如,在本文的描述中,不同示例性实施方案的特征可以在不同示例性实施方案中混合、组合、互换、合并、采用、修改、纳入等。因此本实施方案在所有方面都被视为说明性而非限制性的。
[0228]
干细胞维持和分化
[0229]
使用mtesr培养基(stemcell technologies,85850)在1:200生长因子减少的geltrex(thermo fisher,a1413202)包被的组织培养板上维持人胚胎干细胞系h1,并使用relesr(stemcell technologies,05872,一种专用于人多能干细胞的无酶解离试剂)每4-5天将其作为细胞聚集体定期传代。在开始分化前两天,使用accutase(stemcell technologies,07922)解离细胞并作为单细胞接种在geltrex包被的12孔板中(传代比1:2,在500,000-600,000个细胞之间)。分化是按照lian等人(lian et al.directed cardiomyocyte differentiation from human pluripotent stem cells by modulating wnt/beta-catenin signaling under fully defined conditions.nature protocols 8,162-175,doi:10.1038/nprot.2012.150(2013))公开的方案进行的,并做如下修改。在第0天加入10μm的chir99021(stemcell technologies,72054)并放置24小时,然后更换培养基。在第3天,添加5μm iwp2(sigma aldrich,i0536),使用新的新鲜培养基与从每个孔收集的条件培养基的混合物(50/50)并放置48小时。从第0天到第7天的培养基是rpmi1640(hyclone,sh30027.01)加上不含胰岛素的b-27无血清补充剂(gibco,a1895601)。从第7天起,使用rpmi1640和含胰岛素的b-27无血清补充剂(gibco,17504044),每2-3天更换一次。
[0230]
生成myh6-gfp报告基因系
[0231]
使用重组工程(quick&easy bac modification kit,kd-001,gene bridges gmbh)将具有卡那霉素选择的egfp盒插入到myh6的bac(rp11-834j17,bacpac)中。使用重组工程将带有氨苄青霉素选择标记的tol2转座子盒插入主链中bac的loxp位点。将一千万个h1细胞在cf1条件培养基(dmem:f12,含有20%ko血清替代物、1mml-谷氨酰胺、1%非必需氨基酸、0.1mm 2-巯基乙醇和8ng ml-1的碱性成纤维细胞生长因子)中培养6天并用
tryple
tm
express(life technologies)解离成单个细胞,并用20微克tol2转座子和100微克tol2/egfp修饰的转座子-bac进行电穿孔。电穿孔后,将细胞重悬于含有10μm rock抑制剂y276329(y27632(stemcell technology,72302)的条件培养基中。在电穿孔后的前48小时内添加rock抑制剂。电穿孔后72小时添加50μg/ml遗传霉素(gibco,10131035)用于选择阳性克隆。药物选择之后14天,挑取单集落到24孔板中进行扩增。使用未修饰的bac作为探针进行荧光原位杂交(fish)以验证bac构建体掺入es细胞的基因组中(cytogenetics services,genome institute of singapore)。进行核型分析以确认正常的染色体组型。
[0232]
使用crispr/cas9敲除生成sghrt敲除esc系
[0233]
质粒pmia3(addgene质粒#109399;http://n2t.net/addgene:109399;rrid:addgene_109399)用于crispr/cas9介导的ko。使用双重单链引导rna(sgrna)去除部分sghrt来生成两个ko hesc系。单链引导rna序列是使用基于云技术的数字dna序列编辑软件工具(benchling和crispor)设计的。对10μm有义寡核苷酸和反义寡核苷酸进行排序和退火,以生成20个核苷酸的间隔区,该间隔区定义了待修饰的基因组靶标(vhrt 5’端和3’端)。将pmia3用bsmbi消化,并按照制造商说明书,用t4 dna连接酶(new england biolabs)将sgrna间隔区克隆到人u6启动子后。使用rapidtrans
tm
化学感受态细胞(活性基序)对连接的构建体进行转化。从细菌培养物中提取质粒,纯化并进行sanger测序以确认克隆成功。在hesc靶向之前,使用egxxfp质粒(pcag-egxxfp是由masahito ikawa馈赠的,addgene质粒#50716)在hek293t上测试pmia3-sgrna质粒的切割效率。接着将sgrna的最佳组合用于hesc的最终靶向。根据制造商说明书,使用nebuilder等温组装体(new england biolabs),将最好的一对引导序列(guide)克隆到用nhei和xbai消化的单个pmia3质粒中,以制备最终的pmia3双sgrna质粒。将人esc用accutase(stemcell technologies,07922)解离,并且将约1.5
×
106个细胞重悬于100μl来自lonza(v4xp-3024)的p3原代细胞试剂盒的溶液中,并与10μgpmia3双sgrna质粒混合。为了转染hesc,在4d-nucleofector system(lonza)上使用程序cm-113进行核转染。然后将细胞铺于装有含有5μm y-27632的mtesr培养基(stemcell technologies,85850)的geltrex包被的6孔板中。培养2天后,解离细胞,facs分选rfp阳性细胞并收集到含有mtesr培养基(stemcell technologies,85850)和5μm y-27632的管中。将500至2000个细胞铺于含有上述培养基的6孔板的孔中。监测单细胞克隆,并在大量生长后,挑取集落并传代。提取基因组dna进行基因分型并筛选成功的ko。进行rt-qpcr以验证sghrt转录物的kd。
[0234]
基于crispr/cas9编辑的生成
[0235]
质粒pmia19-cbe4和pmia20-abe7用于crispr/cas9介导的基础编辑(be)以分别从atg变为ata和从atg变为acg。be hesc系是使用单链引导rna(sgrna)将sghrt的atg编辑为ata位点或将atg编辑为acg而生成的。单链引导rna序列是使用基于云技术的数字dna序列编辑软件工具(benchling和crispor)设计的。对10μm有义寡核苷酸和反义寡核苷酸进行排序和退火,以生成20个核苷酸的间隔区,该间隔区定义了要修饰的基因组靶标(vhrt 5’端和3’端)。将pmia19-cbe4和pmia20-abe7用aari消化,并按照制造商说明书,用t4 dna连接酶(new england biolabs)将所述间隔区克隆到人u6启动子后。使用rapidtrans
tm
化学感受态细胞(活性基序)对连接的构建体进行转化。从细菌培养物中提取质粒,纯化并进行sanger测序以确认克隆成功。将人esc用accutase(stemcell technologies,07922)解离,
并且将约1.5
×
106个细胞重悬于100μl来自lonza(v4xp-3024)的p3原代细胞试剂盒的溶液中,并与10μg质粒混合。为了转染hesc,在4d-nucleofector system(lonza)上使用程序cm-113进行核转染。然后将细胞铺于含有5μm y-27632的mtesr培养基(stemcell technologies,85850)的geltrex包被的6孔板中。培养2天后,解离细胞,用facs分选rfp阳性细胞并收集到含有mtesr培养基(stemcell technologies,85850)和5μm y-27632的管中。将500至2000个细胞铺于含有上述培养基的6孔板的孔中。监测单细胞克隆,并在大量生长后,挑取集落并传代。提取基因组dna进行基因分型并筛选成功的碱基编辑。进行rt-qpcr以验证sghrt转录物的表达是否有任何变化。
[0236]
免疫染色
[0237]
将细胞于室温在3.7%甲醛中固定15分钟并保存在dpbs中。将细胞在0.2%triton x-100中透化15分钟,然后用2%bsa进行20分钟的预封闭步骤。将一抗在dpbs+10%山羊血清(使用驴血清的nkx2.5除外)中在4℃孵育过夜,并将二抗在室温孵育2小时。dapi包含在最后的洗涤步骤中。所用的抗体是心肌肌钙蛋白t(lab vision,ms-295-p0,小鼠,1:500稀释)、α-dab2(santa cruz,兔,1:200稀释)、alexa fluor 594山羊抗小鼠、alexa fluor 546山羊抗兔(life technology,a-11071)、alexa fluor 568驴抗山羊(life technologies,a11057)。
[0238]
rna和dna分离
[0239]
使用direct-zol
tm
rna miniprep kit(zymo,r2060)提取rna。使用trizol试剂(thermo fisher,15596026)直接裂解细胞。使用purelink genomic dna mini kit(thermo fisher,k182001)纯化dna。所有实验均按照制造商说明书进行。
[0240]
pcr和逆转录定量pcr(rt-qpcr)
[0241]
按照制造商说明书,使用q5 high-fidelity 2x master mix(bio labs,m0492s)和靶标特异性引物(idt)对dna或质粒载体进行pcr扩增。
[0242]
使用qscript flex cdna kit(quantabio,95049-025)结合随机引物和寡核苷酸(dt),将rna(50ng-500ng)逆转录为cdna。随后,将1ul的cdna(1:10)用于仅pcr扩增特异性sghrt转录物。将剩余的cdna(1:10)与perfecta sybr green fastmix、low rox(quantabio,95074-05k)和特异性引物在384孔板上混合。使用viia 7实时pcr系统(applied biosystems)运行实时qpcr。记录平均cq并使用δδcq方法计算相对基因表达变化。将基因的表达水平针对两种管家基因gapdh和ppia进行归一化。
[0243]
横向主动脉弓缩窄(tac)模型
[0244]
在本公开中,成年小鼠的横向主动脉弓缩窄(tac)被用作心力衰竭的模型。小鼠的tac是lv压力超负荷引起的心脏肥大和心力衰竭的实验模型。在此模型中,左颈总动脉与右颈总动脉之间主动脉弓处的缩窄最初阻碍从左心室(lv)泵出的血液,导致心脏代偿性肥大和心脏收缩力的暂时增强。然而,这种对慢性lv超负荷的反应会随着时间的推移变得不适应,最终导致心脏扩张和hf,伴随着心肌内的纤维化形成。与mi模型相比,tac在心力衰竭的发展过程中提供更渐进的时间过程。
[0245]
通过超声心动图评估心力衰竭患病模型中的心脏功能
[0246]
超声心动图(echo)通过声波检测心脏的腔室和室壁,产生实时图像,并且是一种重要的非侵入性实验方法,其能够可视化小鼠和大鼠的心血管结构并且评估心脏功能。改
进的echo仪器可以准确评估多种心血管疾病小鼠模型中的lv收缩/舒张功能、腔室大小和壁厚。在本公开中,echo用于追踪tac和mi小鼠模型中的结构和功能变化。
[0247]
通过免疫荧光染色和共聚焦显微镜对去分化的cm进行定量和表征
[0248]
表征cm去分化的方法不如表征cm增殖的方法成熟,cm增殖可以通过不同细胞周期阶段的标志物来指示。基于所有与cm去分化相关的现有出版物,使用以下标准对其进行鉴定:1)收缩性和电生理特性的丧失;2)肌节分解或肌节基因表达水平降低;3)干细胞/心脏祖细胞标志物的表达,其中最常用的是失能(disabled)同源物2(dab2)。第一个标准通常用于判断单个cm的体外去分化,而不是来自心脏组织切片的cm,而最后一个标准则颇有争议。dab2是gata转录因子的靶标,并且它的增加可能反映了gata4/6表达的增加,gata4/6据报道是心脏肥大调节物。人胚胎干细胞(hesc)、心脏祖细胞(cpc)和心肌细胞的定量蛋白质组学也将dab2鉴定为关键的心脏发育调节物。然而,没有直接证据表明cm中dab2表达水平随心脏发育的变化,也没有其在其他细胞类型的去分化中的作用。第一个使用dab2来指示cm去分化的出版物也没有提供选择它作为标志物的详细理由。因此,在本公开中,免疫荧光(if)染色和共聚焦显微镜用于鉴定呈dab2免疫阳性的cm,其中基于cm肌节基因的if染色判断其肌节是否组装良好。此外,测量了dab2
+
cm的细胞大小,并计数这些cm内的细胞核数量,因为与成熟细胞相比,去分化细胞通常更小且具有更少细胞器。
[0249]
通过含有cm靶向rna干扰系统的腺相关病毒血清型9(aav9)在体内敲除(kd)cm中的sghrt
[0250]
rna干扰(rnai)是一种通过降解mrna来使靶基因沉默的方法,通过将小双链干扰rna(sirna)引入细胞质中来实现。腺相关病毒(aav)因其低免疫原性和稳定的基因表达而成为基因或sirna传递的理想载体,而aav血清型9(aav9)在小鼠和大鼠中提供全局心脏基因转移,优于其他血清型。为了实现小鼠cm中sghrt的敲除(kd),将含有心肌肌钙蛋白t(ctnt)促进的和gfp标记的靶向sghrt的sirna的aav9(aav9-ctnt-egfp-rnai)以5
×
10
13
个载体基因组(vg)/kg的剂量注射到小鼠胸腔中。
[0251]
在tac和mi小鼠模型中研究sghrt kd对cm去分化和心脏功能的影响
[0252]
为了研究体内sghrt的kd是否在hf患病模型中诱导cm去分化并挽救心脏功能,分别在tac手术后4周和mi手术后立即给小鼠注射aav9-ctnt-egfp-rnai。aav9-ctnt-egfp-lacz被注射到tac小鼠或mi小鼠中作为对照。之后每周应用echo来追踪小鼠的心脏功能,包括lv射血分数(ef)和短轴缩短率(fs)。tac手术后10周和14周,采集心脏并切片用于dab2、心肌肌钙蛋白i(ctni)和小麦胚芽凝集素(wga)的组织学研究和免疫荧光染色以区分细胞膜。dab2和ctni信号的共定位通过共聚焦显微镜的z堆叠功能进行评估。计算每个心脏切片中dab2
+
和ctni
+
细胞的数量,并使用imagej测量和分析dab2
+
cm和3个相邻dab2-cm的大小。类似地,在mi手术后4周,采集心脏用于上述相同的分析。此外,为了研究sghrt kd对出生后小鼠cm去分化的影响,给7日龄(p7)小鼠注射aav9-ctnt-egfp-rnai或aav9-ctnt-egfp-lacz,然后在注射后7天进行采集和下游分析。
[0253]
atp定量
[0254]
使用atp测定试剂盒(a22066),按照试剂盒中提供的说明书对人es-cm中的atp进行定量。
[0255]
参考文献
the national academy of sciences of the united states of america 104,14330-14335,doi:10.1073/pnas.0706817104(2007).
[0296]
41 zhang,d.et al.functional prediction and physiological characterization of a novel short trans-membrane protein 1 as a subunit of mitochondrial respiratory complexes.physiological genomics 44,1133-1140,doi:10.1152/physiolgenomics.00079.2012(2012).
[0297]
42 fischer,r.&kessler,b.m.gel-aided sample preparation(gasp)
‑‑
a simplified method for gel-assisted proteomic sample generation from protein extracts and intact cells.proteomics 15,1224-1229,doi:10.1002/pmic.201400436(2015).
[0298]
43 jiang,j.,wakimoto,h.,seidman,j.g.&seidman,c.e.allele-specific silencing of mutant myh6 transcripts in mice suppresses hypertrophic cardiomyopathy.science(new york,n.y.)342,111-114,doi:10.1126/science.1236921(2013).
[0299]
44 lian,x.et al.directed cardiomyocyte differentiation from human pluripotent stem cells by modulating wnt/beta-catenin signaling under fully defined conditions.nature protocols 8,162-175,doi:10.1038/nprot.2012150(2013).
[0300]
45 komor,a.c.,kim,y.b.,packer,m.s.,zuris,j.a.&liu,d.r.programmable editing of a target base in genomic dna without double-stranded dna cleavage,nature 533,420-424,doi:10.1038/nature17946(2016).
[0301]
46 gaudelli,n.m.et al.programmable base editing of a
*
t to g
*
c in genomic dna without dna cleavage.nature 551,464-471,doi:10.1038/nature24644(2017).
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1