色烯化合物和光致变色光学物品的制作方法
1.本发明涉及具有聚合性基团的新型色烯化合物,以及将该色烯化合物聚合而得到的新型光致变色光学物品。
背景技术:
2.光致变色是指如果对某化合物照射太阳光或水银灯的光那样的包含紫外线的光时,颜色会迅速变化,如果停止光照射并放在暗处,又会因热而恢复原颜色的可逆反应。具有该性质的光致变色化合物被用于期望通过日光而诱发的可逆变色或暗色化的用途,例如用作光致变色眼镜镜片、光致变色隐形眼镜的材料。
3.在塑料眼镜镜片所使用的光致变色化合物中,一般来说,会要求以下特性。
4.(1)照射紫外线前在可见光区域的着色度(以下,称为初期着色)较小。
5.(2)开始照射紫外线后,显色浓度到达饱和的速度快(以下,也称为显色灵敏度高)。
6.(3)停止照射紫外线后,恢复至原状态的速度(以下,称为褪色速度)快。
7.(4)该可逆作用的重复耐久性好。以及
8.(5)高浓度溶解于固化后成为主体材料的单体组合物中以提高对于所使用的主体材料的分散性。
9.另外,在对隐形眼镜赋予光致变色特性的情况下,除了上述特性以外,由于与眼睛直接接触,因此要求比眼镜镜片所使用的光致变色化合物更高的性能。例如:
10.(6)在制成隐形眼镜时,光致变色化合物不会溶出这一特性。
11.特别是,在形成隐形眼镜时,关于光致变色化合物的溶出,问题在于:由于向眼睛内部的溶出、扩散而对眼睛造成不良影响。
12.作为解决这样的问题的方法,开发了具有可以与隐形眼镜材料单体共聚的单体结构(聚合性基团)的光致变色化合物。具体而言,公开了下述式(x)、(y)、(z)表示的具有聚合性基团的色烯化合物(参照专利文献1、2和3)。这些色烯化合物由于具有聚合性基团且与其它单体共聚而掺入聚合物链内,因此在制成隐形眼镜的情况下,可以减少溶出。
[0013][0014]
现有技术文献
[0015]
专利文献
[0016]
专利文献1:国际公开wo2000/015629号小册子
[0017]
专利文献2:国际公开wo2006/110219号小册子
[0018]
专利文献3:国际公开wo2003/056390号小册子
技术实现要素:
[0019]
但是,上述现有方法在以下方面还有改善的余地。例如,上述式(x)表示的色烯化合物的聚合性基团为羟基,其它单体被限定,以及无法充分抑制溶出,在这些方面还有改善的余地。
[0020]
另外,像上述式(z)表示的色烯化合物那样在13位取代有聚合性基团的化合物虽然可以抑制溶出,但重复耐久性低,还有改善的余地。
[0021]
进而,根据本发明人等的研究,可知上述式(y)和(z)的色烯化合物中,在用于隐形眼镜用途的情况下无法充分发挥特性。即,可知在隐形眼镜用途中使用色烯化合物的情况下,需要追加以下效果。具体而言,为以下特性。
[0022]
(7)需要有在眼睛的表面温度(33~38℃)附近的高显色浓度。
[0023]
(8)在移动至隧道内等暗处时,需要有在数秒~数十秒以内褪色的快速响应性。
[0024]
但是,以上(6)、(7)和(8)的效果并不限定于隐形眼镜用途。即,如果能发挥(6)那样的效果,则即使在眼镜镜片中,由于没有光致变色化合物的溶出,因此同样可以进一步抑制对眼睛的不良影响。另外,如果能发挥(7)、(8)的效果,则在像夏天这样的炎热气候或日
照较强的地域,可以用作比现有技术更高性能的光致变色眼镜镜片。此外,如果可以快速响应,则不仅可以提高作为光致变色眼镜镜片的价值,在各种用途中使用的可能性也会提高。
[0025]
因此,本发明的目的在于提供一种色烯化合物,其可以与其它单体共聚,而且可抑制从得到的聚合物(光致变色光学物品)中溶出光致变色化合物(色烯化合物)自身,并且,具有期望的光致变色性。
[0026]
本发明人等为了解决上述课题,进行了深入研究。于是,针对色烯化合物,利用通过在茚并萘并吡喃骨架上键合各种取代基从而可发挥对应各用途的光致变色特性的见解,对各种取代基和该取代基的键合位点进行了研究。其结果,发现在取代基种类和取代位点的无数组合中,将与茚并萘并吡喃骨架(正式来说,是“茚并(2,1-f)萘并(1,2-b)吡喃结构”)的13位的碳原子键合的基团设为特定的环基,进而在3位键合具有自由基聚合性基团的基团,由此可解决上述课题,以至完成了本发明。
[0027]
即,第一本发明是由下述式(1)表示的色烯化合物。
[0028][0029]
式中,
[0030]
r1和r2各自独立地为具有自由基聚合性基团的基团、羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、杂环基、氰基、卤素原子、碳原子数1~6的烷硫基或可以具有取代基的碳原子数6~10的芳硫基,
[0031]
a为0~5的整数,b为0~5的整数,其中,a+b=1~10,
[0032]
r1和r2中至少1者为具有自由基聚合性基团的基团,
[0033]
上述具有自由基聚合性基团的基团是下述式(2)表示的基团,
[0034][0035]
(式中,
[0036]r10
为碳原子数1~10的直链状或支链状亚烷基,
[0037]
l为0~50的整数,l为2以上时,由l括住的单元的基团彼此可以相同,也可以是不同的基团,
[0038]
pg为自由基聚合性基团。)
[0039]
上述式(1)的与13位的碳原子螺键合的下述式(z)
[0040]
[0041]
表示的环z是:
[0042]
与该13位的碳原子一起构成该环的碳原子数为3~20的可以具有取代基的脂肪族环基、
[0043]
在该脂肪族环上稠合了可以具有取代基的芳香族环或芳香族杂环的稠合多环基、
[0044]
与该13位的碳原子一起构成该环的原子数为3~20的可以具有取代基的杂环基、或
[0045]
在该杂环基上稠合了可以具有取代基的芳香族环或芳香族杂环的稠合多环基;
[0046]
r3为氢原子、羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氰基、卤素原子、碳原子数1~6的烷硫基、可以具有取代基的碳原子数6~10的芳硫基、硝基、甲酰基、羟基羰基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳氧基、可以具有取代基的碳原子数6~12的芳基、可以具有取代基的碳原子数3~12的杂芳基、硫醇基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、或碳原子数3~8的环烷硫基;
[0047]
r4为氢原子、羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、杂环基、氰基、卤素原子、碳原子数1~6的烷硫基、可以具有取代基的碳原子数6~10的芳硫基、硝基、甲酰基、羟基羰基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳氧基、可以具有取代基的碳原子数6~12的芳基、可以具有取代基的碳原子数3~12的杂芳基、硫醇基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、或碳原子数3~8的环烷硫基,
[0048]
另外,r3和r4可以一起形成下述式(3)表示的环,
[0049][0050]
[式中,
[0051]
*是指6位或7位的碳原子,
[0052]
x和y的一者或两者为硫原子、亚甲基、氧原子或下述式表示的基团,
[0053][0054]
(式中,
[0055]
r9为氢原子、羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、可以具有取代基的碳原子数6~12的芳基、可以具有取代基的碳原子数3~12的杂芳基。)
[0056]
r7和r8各自独立地为羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原
子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、取代氨基、杂环基、氰基、硝基、甲酰基、羟基羰基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、卤素原子、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳基、硫醇基、碳原子数1~6的烷硫基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、碳原子数3~8的环烷硫基、或可以具有取代基的碳原子数6~10的芳硫基,
[0057]
另外,r7和r8也可以与它们所键合的碳原子一起形成脂肪族环,
[0058]
e为1~3的整数];
[0059]
r5为羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、取代氨基、杂环基、氰基、硝基、甲酰基、羟基羰基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、卤素原子、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳基、硫醇基、碳原子数1~6的烷硫基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、碳原子数3~8的环烷硫基、或可以具有取代基的碳原子数6~10的芳硫基,
[0060]
c为0~2的整数,c为2时,r5彼此可以相同,也可以是不同的基团;
[0061]
r6为羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、取代氨基、杂环基、卤素原子、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、硫醇基、碳原子数1~6的烷硫基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、碳原子数3~8的环烷硫基、或可以具有取代基的碳原子数6~10的芳硫基,
[0062]
d为0~4的整数,d为2以上时,r6彼此可以相同,也可以是不同的基团。
[0063]
第二本发明是一种光致变色固化性组合物,含有第一本发明的色烯化合物、和除此之外的聚合性单体。
[0064]
第三本发明是一种光致变色光学物品,由第一本发明的色烯化合物聚合而成。
[0065]
第四本发明是一种光致变色光学物品,由第二本发明的光致变色固化性组合物聚合而成。
[0066]
第四本发明中,优选:具有该光致变色固化性组合物聚合而成的高分子成型物作为至少一部分的构成部件的光致变色光学物品。另外,还优选:具有该光致变色固化性组合物聚合而成的高分子膜作为被覆光学基材的至少一部分的被覆层的光致变色光学物品。
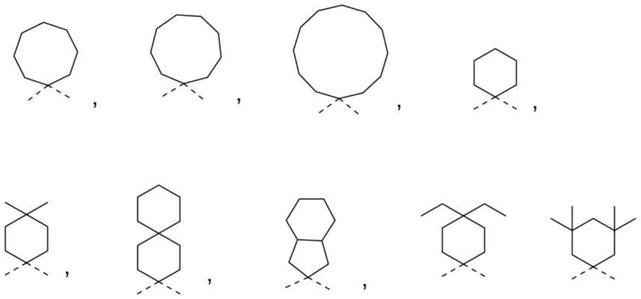
[0067]
本发明的色烯化合物通过具有特定的环z(包含13位的碳原子的环基)以及在取代于3位的苯基上具有至少1个自由基聚合性基团,从而发挥优异的效果。特别是,通过取得该结构,从而在与其它单体共聚时,聚合度高,在得到的聚合物中可抑制色烯化合物自身的溶出。此外,得到的聚合物是在特定温度范围(例如比室温高的33℃~38℃)具有高显色浓度与高褪色速度的光致变色光学物品。
[0068]
本发明的色烯化合物具有特定的环z、并在特定位置具有自由基聚合性基团,在任一基团不满足本发明要件的情况下,都无法发挥优异的特性。在现有的化合物中,不存在同时满足这2个取代基的化合物。
[0069]
因此,例如,在将本发明的色烯化合物用于光致变色隐形眼镜的情况下,可以制造光致变色化合物(色烯化合物)的溶出被抑制且即使在眼睛的表面温度附近的温度也具有
高显色浓度、高褪色速度的光致变色隐形眼镜。
[0070]
另外,在制成光致变色眼镜镜片的情况下,由于可在高温地区使用,且可应对快速响应,因此,为高附加值的眼镜镜片。
具体实施方式
[0071]
本发明的色烯化合物由下述式(1)表示,具有3,3-二苯基茚并萘并吡喃结构作为基本骨架(以下有时也简称为“茚并萘并吡喃骨架”)。
[0072][0073]
通常已知具有茚并萘并吡喃结构的色烯化合物会显示优异的光致变色特性。以下对于特定的取代基依次进行说明。
[0074]
<r1和r2>
[0075]
r1和r2均是在键合于该茚并萘并吡喃骨架的3位的碳原子的苯基上进行取代的取代基。
[0076]
r1和r2各自独立地为具有自由基聚合性基团的基团、羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、杂环基、氰基、卤素原子、或碳原子数1~6的烷硫基、可以具有取代基的碳原子数6~10的芳硫基,
[0077]
a为0~5的整数,b为0~5的整数,其中,a+b=1~10,r1和r2中至少1者为具有自由基聚合性基团的基团。应予说明,理所应当的是,如果r1和r2中至少1者为自由基聚合性基团,则在存在多个r1的情况下,可以彼此相同,也可以是不同的基团。并且,r2也同样,在存在多个r2的情况下,它们可以彼此相同,也可以是不同的基团。
[0078]
作为上述碳原子数1~6的优选烷基的例子,可举出甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、戊基、己基等。
[0079]
作为上述碳原子数1~6的卤代烷基,优选为被氟原子、氯原子或溴原子取代的烷基。作为优选的卤代烷基的例子,可举出三氟甲基、四氟乙基、氯甲基、2-氯乙基、溴甲基等。
[0080]
作为上述碳原子数3~8的环烷基的例子,可举出环丙基、环丁基、环戊基、环己基等。
[0081]
作为上述碳原子数1~6的优选烷氧基的例子,可举出甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基等。
[0082]
上述氨基不限于伯氨基(-nh2),也可以是1或2个氢原子被取代的仲氨基或叔氨基。作为该氨基具有的取代基,例如可举出碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数1~6的烷氧基、碳原子数3~7的环烷基、碳原子数6~14的芳基、碳原子数4~14的杂芳基等。作为优选氨基的例子,可举出氨基、甲氨基、二甲氨基、乙氨基、二乙氨基、苯基氨基、二苯基氨基等。
[0083]
上述杂环基例如可举出吗啉基、哌啶基、吡咯烷基、哌嗪基、n-甲基哌嗪基等脂肪
族杂环基以及二氢吲哚基等芳香族杂环基等作为优选基团。进而,该杂环基可以具有取代基。作为优选的取代基,可举出烷基。作为具有取代基的优选杂环基,例如可举出2,6-二甲基吗啉基、2,6-二甲基哌啶基和2,2,6,6-四甲基哌啶基等。
[0084]
作为上述卤素原子,例如可举出氟原子、氯原子、溴原子、碘原子。
[0085]
作为上述碳原子数1~6的烷硫基,可举出甲硫基、乙硫基、正丙硫基、异丙硫基、正丁硫基、仲丁硫基、叔丁硫基等。
[0086]
作为上述碳原子数6~10的芳硫基,可举出苯硫基、1-萘硫基、2-萘硫基等。
[0087]
上述芳硫基中,芳香族环的1~5个氢原子、特别优选1~4个氢原子可以被碳原子数1~6的烷基、碳原子数1~6的烷氧基、碳原子数3~8的环烷基或卤素原子取代。另外,上述芳硫基的碳原子数6~10不包含取代基的碳原子数。
[0088]
上述中,作为r1和r2,从发挥优异的光致变色特性的观点出发,作为具有自由基聚合性基团的基团以外的基团,优选为选自上述烷基、上述烷氧基、上述氨基、上述取代氨基、上述杂环基、上述卤素原子中的基团。如果例示特别优选的基团,则可举出甲基、甲氧基、二甲氨基、吗啉基、哌啶基、氟基等。
[0089]
作为特别优选的基团,具有自由基聚合性基团的基团以外的r1和r2的数量优选为1或0。即,具有自由基聚合性基团的基团以外的基团优选1个取代于苯基或为完全未取代的状态。在1个取代于苯基的情况下,优选在对位取代。
[0090]
<r1和r2;具有自由基聚合性基团的基团>
[0091]
作为上述具有自由基聚合性基团的基团,为下述式(2)表示的基团。
[0092][0093]
上述式(2)中,r
10
为碳原子数1~10的直链状或支链状亚烷基。优选为碳原子数1~5的亚烷基。作为碳原子数1~5的优选亚烷基的例子,可举出亚甲基、亚乙基、亚正丙基、亚异丙基、亚正丁基、亚仲丁基、亚叔丁基、亚戊基等。
[0094]
l为0~50的整数。如果考虑色烯化合物自身的生产率、发挥的效果,则l优选为1~20的整数,更优选为1~10的整数,进一步优选为1~5的整数,特别优选为1~3的整数,最优选为1。特别是,为了抑制色烯化合物自身的水解性,l优选为1~5的整数,更优选为1~3的整数,进一步优选为1。通过抑制水解,从而可抑制该色烯化合物的分解物从光致变色隐形眼镜这样的固化物渗出。l是指(-r
10
o-)的重复单元。在l为2以上的情况下,由l括住的单元的基团((-r
10
o-)基)可以彼此相同,也可以是不同的基团。
[0095]
pg为自由基聚合性基团,可举出乙烯基、1-氯乙烯基、烯丙基、苯乙烯基、(甲基)丙烯酰基、2-(甲基丙烯酰氧基)乙基氨基甲酰基、2-(甲基丙烯酰氧基)乙氧基羰基、巴豆基等。其中,如果考虑色烯化合物自身的生产率和得到的光致变色光学物品的性能,最优选(甲基)丙烯酰基。
[0096]
<r1和r2的数量以及取代位点>
[0097]
在上述式(1)中,a是指r1的数量(取代数),b是指r2的数量(取代数)。而且,a为0~5的整数,b为0~5的整数,其中,a+b=1~10,r1和r2中至少1者为上述具有自由基聚合性基团的基团。即,如果r1和r2中至少1者为上述具有自由基聚合性基团的基团,则其它可以是在上
述<r1和r2>中说明的具有自由基聚合性基团的基团以外的基团,也可以是氢原子。
[0098]
其中,最优选方式是上述具有自由基聚合性基团的基团为1个的情况。如果具有自由基聚合性基团的基团为2个以上,尽管可以抑制光致变色化合物的溶出,但有光致变色化合物交联而使光致变色特性降低的倾向。
[0099]
另外,具有自由基聚合性基团的基团所取代的位置优选为3,3-二苯基茚并萘并吡喃的苯基的对位。因此,优选的方式是在一个苯基的对位上取代有上述具有自由基聚合性基团的基团的情况。此时,另一苯基没有特别限定,但优选仍在对位存在1个取代基、或不存在取代基(对位也为氢原子)的情况。其中,优选另一苯基不存在取代基,或在对位取代有上述烷基、上述烷氧基或上述杂环基。
[0100]
<环z(基)>
[0101]
与该茚并萘并吡喃骨架的13位的碳原子螺键合的下述式(z)
[0102][0103]
表示的环z(与13位的碳原子螺键合的环基)为:
[0104]
与该13位的碳原子一起构成该环的碳原子数为3~20的可以具有取代基的脂肪族环基、
[0105]
在该脂肪族环上稠合了可以具有取代基的芳香族环或芳香族杂环的稠合多环基、
[0106]
与该13位的碳原子一起构成该环的原子数为3~20的可以具有取代基的杂环基、或
[0107]
在该杂环基上稠合了可以具有取代基的芳香族环或芳香族杂环的稠合多环基。应予说明,理所应当的是,上述环基中表示的碳原子数或原子数表示构成环的碳原子或原子的数量,不包含取代基的碳原子数或原子数。
[0108]
作为上述脂肪族环,例如可举出环戊烷环、环己烷环、环辛烷环、环庚烷环、降冰片烷环、双环壬烷环、金刚烷环。
[0109]
另外,作为上述在该脂肪族环上稠合了芳香族环或芳香族杂环的稠合多环,例如可举出菲环。
[0110]
作为上述杂环,例如可举出噻吩环、呋喃环、吡啶环。
[0111]
另外,作为在上述杂环上稠合了芳香族环或芳香族杂环的稠合多环,例如可举出苯基呋喃环、联苯基噻吩环。
[0112]
上述脂肪族环、在上述该脂肪族环上稠合了芳香族环或芳香族杂环的稠合多环、上述杂环、或在上述杂环上稠合了芳香族环或芳香族杂环的稠合多环也可以具有取代基。作为取代在该环(稠合多环)的取代基,可举出选自碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、取代氨基和卤素原子中的至少1种取代基。应予说明,作为上述烷基、上述卤代烷基、上述环烷基、上述烷氧基、上述氨基、上述取代氨基和上述卤素原子,可举出与<r1和r2>中已说明的基团同样的基团。在该环z具有的取代基中,作为本发明的色烯化合物发挥特别优异的效果的取代基,特别优选
碳原子数1~6的烷基、环烷基、碳原子数1~6的卤代烷基、碳原子数1~6的烷氧基。
[0113]
另外,本发明的色烯化合物为自身难以水解的化合物。例如,在介由酯键或酰胺键而具有聚合性基团的情况下,这些键容易水解。在这样的状况下,本发明的色烯化合物可抑制该水解。其理由尚不明确,但可以认为是由于本发明的色烯化合物具有特定的环z。即,在具有自由基聚合性基团的基团为相同基团的情况下,没有环z的化合物与具有特定环z的本发明的色烯化合物相比,本发明的色烯化合物为体积较大的化合物。其结果是,可以认为本发明的色烯化合物产生空间位阻,保护了容易水解的部分。特别是在具有(甲基)丙烯酰基、2-(甲基丙烯酰氧基)乙基氨基甲酰基和2-(甲基丙烯酰氧基)乙氧基羰基的情况下,该效果变得显著。通过抑制水解,从而可抑制该色烯化合物的分解物从光致变色隐形眼镜这样的固化物中渗出。
[0114]
上述环z中,为了具有高褪色速度且在眼睛的表面温度附近得到高显色浓度,优选构成环的碳原子数为5~16的上述脂肪族烃环基、在这些脂肪族烃环上取代有碳原子数1~6的烷基(优选为碳原子数1~3的烷基)的环基、或在这些脂肪族烃环上键合或稠合了碳原子数3~8的环烷基的环基。
[0115]
如果具体例示特别优选的环z,则是没有取代基的未取代的环己烷环基、环庚烷环基、环辛烷环基、环壬烷环基、环癸烷环基、环十一烷环基或环十二烷环基。
[0116]
另外,环z可以是环己烷环基,但在环己烷环基的情况下,优选被优选碳原子数1~3的烷基、更优选1~2的烷基取代的环己烷环基。进而,在取代有该烷基的环己烷基的情况下,烷基的取代基数优选为1~10,更优选为2~6。
[0117]
进而,为了使具有高褪色速度且在眼睛的表面温度附近也具有高显色浓度的效果变得显著,优选为下述式表示的环z。
[0118][0119]
进而,在环z为上述式表示的基团的情况下,可以认为由于环z的体积大,可以更进一步抑制色烯化合物自身的水解。通过抑制水解,从而可抑制该色烯化合物的分解物从光致变色隐形眼镜这样的固化物中渗出。
[0120]
应予说明,上述式中,具有虚线的键合位点的碳原子是13位的碳原子。
[0121]
而且,上述环基中,特别是为了更显著发挥在眼睛的表面温度附近具有高显色浓度的效果,与上述13位的碳原子一起构成该环的碳原子数优选为6~15,进一步优选碳原子数为7~12。
[0122]
在优选的环基中,在成为具有更高显色浓度的色烯化合物的情况下,或成为更高褪色速度的色烯化合物的情况下,优选采用各自的该环基。
[0123]
即,为了成为更高显色浓度、在高温下使用也更有益的色烯化合物,优选采用下述式表示的环基。
[0124][0125]
在采用以上这样的没有取代基的、碳原子数6~12的环烷烃环(包含13位的碳原子)的情况下,成为即使在高温下使用也具有特别高显色浓度的色烯化合物。
[0126]
另一方面,为了成为更高速应答性(高褪色速度)的色烯化合物,优选采用下述式表示的环基。
[0127][0128]
通过采用以上这样的基团,可成为能更高速响应的色烯化合物。
[0129]
<r3>
[0130]
r3为氢原子、羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氰基、卤素原子、碳原子数1~6的烷硫基、可以具有取代基的碳原子数6~10的芳硫基、硝基、甲酰基、羟基羰基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳氧基、可以具有取代基的碳原子数6~12的芳基、可以具有取代基的碳原子数3~12的杂芳基、硫醇基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、或碳原子数3~8的环烷硫基。
[0131]
上述基团中的碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、卤素原子、碳原子数1~6的烷硫基、可以具有取代基的碳原子数6~10的芳硫基可举出与<r1和r2>中说明的基团相同的基团,优选的基团也相同。
[0132]
作为上述碳原子数2~7的烷羰基,可举出乙酰基、乙基羰基。
[0133]
作为上述碳原子数2~7的烷氧羰基,可举出甲氧羰基、乙氧羰基。
[0134]
作为上述碳原子数7~11的芳烷基,可举出苄基、苯乙基、苯丙基、苯丁基、萘甲基等。
[0135]
作为上述碳原子数7~11的芳烷氧基,可举出苄氧基、萘基甲氧基等。
[0136]
作为上述碳原子数6~12的芳氧基,可举出苯氧基、萘氧基等。
[0137]
作为上述碳原子数6~12的芳基,可举出苯基、1-萘基、2-萘基等。
[0138]
作为上述碳原子数3~12的杂芳基,可举出噻吩基、呋喃基、吡咯基、吡啶基、苯并噻吩基、苯并呋喃基、苯并吡咯基等。
[0139]
作为上述碳原子数2~9的烷氧基烷硫基,可举出甲氧基甲硫基、甲氧基乙硫基、甲氧基正丙硫基、甲氧基正丁硫基、乙氧基乙硫基、正丙氧基丙硫基等。
[0140]
作为上述碳原子数1~6的卤代烷硫基,可举出三氟甲硫基、四氟乙硫基、氯甲硫基、2-氯乙硫基、溴甲硫基等。
[0141]
作为上述碳原子数3~8的环烷硫基,可举出环丙硫基、环丁硫基、环戊硫基、环己
硫基等。
[0142]
应予说明,上述芳烷基、上述芳烷氧基、上述芳氧基、上述芳基和上述杂芳基可以是未取代的。并且,也可以1~6个氢原子、特别优选1~4个氢原子被选自羟基、烷基、卤代烷基、环烷基、烷氧基、氨基、杂环基、氰基、硝基、卤素原子中的取代基取代。应予说明,该取代基可举出与<r1和r2>中说明的基团同样的基团。上述芳烷基、上述芳烷氧基、上述芳氧基、上述芳基和上述杂芳基中限定的碳原子数不包含取代基的碳原子数。
[0143]
<特别优选的r3>
[0144]
在以上这样的基团中,如果考虑得到的光致变色化合物的显色色调、显色浓度等,则r3优选为氢原子、上述烷基、上述烷氧基、上述芳基、上述芳硫基。
[0145]
<r4>
[0146]
r4为氢原子、羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、杂环基、氰基、卤素原子、碳原子数1~6的烷硫基、可以具有取代基的碳原子数6~10的芳硫基、硝基、甲酰基、羟基羰基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳氧基、可以具有取代基的碳原子数6~12的芳基、可以具有取代基的碳原子数3~12的杂芳基、硫醇基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、或碳原子数3~8的环烷硫基。
[0147]
对于上述碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、杂环基、氰基、卤素原子、碳原子数1~6的烷硫基、可以具有取代基的碳原子数6~10的芳硫基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳氧基、可以具有取代基的碳原子数6~12的芳基、可以具有取代基的碳原子数3~12的杂芳基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、或碳原子数3~8的环烷硫基,作为它们的具体基团,可举出上述<r1和r2>或上述<r3>中例示的具体的基团,优选的基团也相同。
[0148]
另外,r3和r4可以一起形成下述式(3)的基团。
[0149][0150]
(式中,*是指6位或7位的碳原子)。
[0151]
式中,x和y中一者或两者为硫原子、亚甲基、氧原子或以下述式
[0152][0153]
表示的基团。
[0154]
上述式中,r9为氢原子、羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、可以具有取代基的碳原子数6~12的芳基、可以具有取代基的碳原子数3~12的杂芳基。这些的具体基团,可举出上述<r1和r2>或上述<r3>中例示的具体基团,优选的基团也相同。
[0155]
另外,上述式(3)中,式中,r7和r8各自独立地为羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、取代氨基、杂环基、氰基、硝基、甲酰基、羟基羰基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、卤素原子、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳基、硫醇基、碳原子数1~6的烷硫基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、碳原子数3~8的环烷硫基、或可以具有取代基的碳原子数6~10的芳硫基。这些的具体基团,可举出上述<r1和r2>或上述<r3>中例示的具体基团,优选的基团也相同。
[0156]
另外,r7和r8也可以与它们所键合的碳原子一起形成脂肪族环。如果具体例示脂肪族环,则可以举出环戊基环、环己基环等。
[0157]
式中,e为1~3的整数。
[0158]
<特别优选的r4>
[0159]
在以上这样的基团中,如果考虑得到的光致变色化合物的显色色调、显色浓度等,则r4优选为氢原子、上述烷基、上述烷氧基、上述杂环基、上述芳基、上述芳硫基。
[0160]
<r5>
[0161]
r5为羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷基、碳原子数1~6的烷氧基、氨基、取代氨基、杂环基、氰基、硝基、甲酰基、羟基羰基、碳原子数2~7的烷羰基、碳原子数2~7的烷氧羰基、卤素原子、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、可以具有取代基的碳原子数6~12的芳基、硫醇基、碳原子数1~6的烷硫基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、碳原子数3~8的环烷硫基、或可以具有取代基的碳原子数6~10的芳硫基。
[0162]
c为0~2的整数,c为2时,r5可以彼此相同,也可以是不同的基团,
[0163]
对于上述碳原子数1~6的烷基、上述碳原子数1~6的卤代烷基、上述碳原子数3~8的环烷基、上述碳原子数1~6的烷氧基、上述氨基、上述杂环基、上述碳原子数2~7的烷羰基、上述碳原子数2~7的烷氧羰基、上述卤素原子、上述可以具有取代基的碳原子数7~11的芳烷基、上述可以具有取代基的碳原子数7~11的芳烷氧基、上述可以具有取代基的碳原子数6~12的芳基、硫醇基、碳原子数1~6的烷硫基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、碳原子数3~8的环烷硫基、或可以具有取代基的碳原子数6~10的芳硫基,作为它们的具体基团,可举出上述<r1和r2>或上述<r3>和上述<r4>中例示的具体基团,优选的基团也相同。
[0164]
<特别优选的r5>
[0165]
在以上这样的基团中,如果考虑得到的光致变色化合物的显色色调、显色浓度等,则r5为氢原子、或上述烷氧基。
[0166]
<r6>
[0167]
r6为羟基、碳原子数1~6的烷基、碳原子数1~6的卤代烷基、碳原子数3~8的环烷
基、碳原子数1~6的烷氧基、氨基、取代氨基、杂环基、卤素原子、可以具有取代基的碳原子数7~11的芳烷基、可以具有取代基的碳原子数7~11的芳烷氧基、硫醇基、碳原子数1~6的烷硫基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、碳原子数3~8的环烷硫基、或可以具有取代基的碳原子数6~10的芳硫基。
[0168]
d为0~4的整数,d为2以上时,r6可以彼此相同,也可以是不同的基团。
[0169]
对于上述碳原子数1~6的烷基、上述碳原子数1~6的卤代烷基、上述碳原子数3~8的环烷基、上述碳原子数1~6的烷氧基、上述氨基、上述杂环基、上述卤素原子、上述可以具有取代基的碳原子数7~11的芳烷基、上述可以具有取代基的碳原子数7~11的芳烷氧基、硫醇基、碳原子数1~6的烷硫基、碳原子数2~9的烷氧基烷硫基、碳原子数1~6的卤代烷硫基、碳原子数3~8的环烷硫基、或可以具有取代基的碳原子数6~10的芳硫基,它们的具体基团可举出上述<r1和r2>或上述<r3>或上述<r4>和上述<r5>中例示的具体基团,优选的基团也相同。
[0170]
<特别优选的r6>
[0171]
在以上这样的基团中,如果考虑得到的光致变色化合物的显色色调、显色浓度等,则r6为氢原子、或上述烷氧基。
[0172]
<特别优选的色烯化合物>
[0173]
本发明中,如果具体例示特别优选的色烯化合物,则可举出下述式表示的色烯化合物。
[0174][0175]
<色烯化合物的鉴定>
[0176]
一般来说,本发明的色烯化合物在常温常压下,作为无色或淡黄色、淡绿色的固体或者粘稠的液体存在,可通过以下(一)~(三)的方式确认。
[0177]
(一)通过测定质子核磁共振谱(1h-nmr),在δ:5.0~9.0ppm附近会出现基于芳香质子和烯烃质子的峰,在δ:1.0~4.0ppm附近会出现基于烷基和亚烷基的质子的峰。另外,通过相对比较各自的谱强度,可以知道各键合基团的质子个数。
[0178]
(二)通过元素分析可以确定相应的产物组成。
[0179]
(三)通过测定
13
c-核磁共振谱(
13
c-nmr),在δ:110~160ppm附近会出现基于芳香族烃基的碳的峰,在δ:80~140ppm附近会出现基于烯和炔的碳的峰,在δ:20~80ppm附近会出现基于烷基和亚烷基的碳的峰。
[0180]
<色烯化合物的制造>
[0181]
本发明的色烯化合物可通过任意的合成法来制造。对于优选的色烯化合物的制造方法的1个例子进行说明。应予说明,以下说明中,各式中的符号只要没有特别记载,则表示如上述式所说明的意义。
[0182]
通过将下述式(10)表示的萘酚化合物和下述式(11)表示的炔丙醇化合物在酸催化剂存在下反应的方法,从而可优选地制造色烯化合物。
[0183][0184]
萘酚化合物与炔丙醇化合物的反应比率优选从1:10~10:1(摩尔比)的范围内选择。另外,作为酸催化剂,例如可以使用硫酸、苯磺酸、对甲苯磺酸、酸性氧化铝等。相对于萘酚化合物与炔丙醇化合物的总和100重量份,优选在0.1~10重量份的范围中使用酸催化剂。反应温度优选为0~200℃。作为溶剂,优选为非质子性有机溶剂,例如可使用n-甲基吡咯烷酮、二甲基甲酰胺、四氢呋喃、苯、甲苯等。由该反应得到的产物的纯化方法没有特别限定。例如,可以进行硅胶柱纯化,进而通过重结晶进行产物的纯化。
[0185]
在上述式(10)表示的萘酚化合物中,优选的化合物具有可以制造上述式(1)表示的优选色烯化合物的结构。例如,作为特别优选的化合物,可举出下述式表示的化合物。
[0186][0187]
上述式(10)表示的萘酚化合物例如可按以下方式合成。萘酚化合物可基于国际公开第wo2001/60881小册子、国际公开第wo2005/028465号小册子等论文中记载的反应方法合成。具体来说,可通过以下方法制造该萘酚化合物。
[0188]
首先,使下述式(12)表示的二苯甲酮化合物进行stobbe反应、环化反应,得到下述式(13)的化合物。
[0189][0190][0191]
应予说明,上述式(13)的化合物中,r是来自stobbe反应中使用的二酯化合物的基
团,ac为乙酰基。接下来,将该化合物(13)使用碱或酸进行水解,得到下述式(14)的羧酸。
[0192][0193]
将该羧酸使用碳酸钾等碱与氯化苄基进行苄基化,接下来,使用碱或酸进行水解,得到下述式(15)表示的由苄基保护的羧酸(式(15)中bn为苄基)。
[0194][0195]
该经苄基保护的羧酸通过curtius重排、hofmann重排、lossen重排等方法转变为胺,由此,通过其自身公知的方法来制备重氮鎓盐。将该重氮鎓盐通过sandmeyer反应等转变为溴化物,将得到的溴化物与镁或锂等反应,制备有机金属化合物。将该有机金属化合物与下述式(16)表示的酮在-80~70℃、10分钟~4小时在有机溶剂中反应,
[0196][0197]
接下来,用氢和钯碳等进行脱苄基化反应,从而得到下述式(17)表示的醇。
[0198][0199]
将该醇在中性~酸性条件下,在10~120℃进行10分钟~2小时的friedel-crafts反应,可合成作为目标的上述式(10)的萘酚化合物。在该反应中,上述有机金属化合物与上
述式(12)表示的酮的反应比率优选在1:10~10:1(摩尔比)的范围内选择。反应温度优选为-80~70℃。作为溶剂,优选使用非质子性有机溶剂,例如二乙醚、四氢呋喃、苯、甲苯等。另外,上述式(17)的醇在中性~酸性条件下的friedel-crafts反应优选使用例如乙酸、盐酸、硫酸、苯磺酸、对甲苯磺酸、酸性氧化铝等酸催化剂进行。这样的酸催化剂相对于上述式(17)的醇100重量份,优选在0.1~10重量份的范围内使用。在反应时,可使用例如四氢呋喃、苯、甲苯等非质子性有机溶剂。
[0200]
另一方面,上述式(11)表示的炔丙醇化合物可通过例如使对应于上述式(12)的酮化合物与乙炔锂等金属乙炔化合物反应而容易地合成。如果以公知方法对该式(11)表示的炔丙醇化合物导入上述聚合性基团,则该丙炔醇与上述式(10)表示的萘酚化合物通过进行上述反应,从而可以制造本发明的色烯化合物。
[0201]
通过以上这样的方法,从而可以制造本发明的色烯化合物,但为了使反应更简洁并抑制副产物生成,优选按以下的方式导入上述自由基聚合性基团。具体而言,在炔丙醇化合物的欲导入自由基聚合性基团的位置上,预先取代羟基、伯氨基或仲氨基、硫醇基和氢甲硅烷基等反应性取代基。接下来,将具有该反应性取代基的炔丙醇化合物与上述式(10)表示的萘酚化合物依据上述方法进行反应,制造本发明的色烯化合物的前体。接着,通过在得到的前体的反应位点导入自由基聚合性基团,从而制造本发明的色烯化合物。
[0202]
将自由基聚合性基团导入上述反应性取代基的方法可以采用公知方法。
[0203]
例如,导入(甲基)丙烯酰基作为自由基聚合性基团时,只要在碱性催化剂存在下使具有羟基作为反应性取代基的前体与(甲基)丙烯酰氯反应即可。此外,也可通过使具有氨基或羟基的前体与(甲基)丙烯酸2-异氰酸酯基乙酯反应,从而导入自由基聚合性基团。另外,通过使用氯化铂酸作为催化剂使具有羟基作为反应性取代基的前体与甲基丙烯酸烯丙酯进行氢甲硅烷化,从而可导入自由基聚合性基团。
[0204]
另外,在导入乙烯基作为自由基聚合性基团时,通过使具有羟基作为反应性取代基的前体与氯乙烯或烯丙基溴反应,从而可导入自由基聚合性基团。
[0205]
在导入苯乙烯基作为自由基聚合性基团时,通过使具有羟基作为反应性取代基的前体与二乙烯基苯在氯化铂酸催化剂下进行氢甲硅烷基化,从而可导入自由基聚合性基团。
[0206]
以下,示出更具体的制造方法的例子。例如,以下示出:具有羟基作为反应性取代基的前体的合成方法、以及在该前体中导入丙烯酰基作为自由基聚合性基团时的转换方案。
[0207][0208]
通过使上述式(10)的萘酚化合物与具有羟基作为反应性取代基的炔丙醇化合物在酸性条件下反应,从而可得到具有羟基的前体。通过使该前体在叔胺等碱性催化剂存在下与丙烯酰氯反应,从而可以得到色烯化合物。
[0209]
<与其它光致变色化合物的组合(光致变色组合物)>
[0210]
本发明的色烯化合物在甲苯、氯仿、四氢呋喃等通常的有机溶剂中可充分溶解。在这样的溶剂中溶解上述式(1)表示的色烯化合物时,一般来说,溶液基本无色透明,呈现出良好的光致变色作用,即如果照射太阳光或紫外线则快速显色、如果阻挡光则可逆地快速恢复至原来的无色。而且,本发明的色烯化合物可根据作为目标的用途,与其它光致变色化合物组合使用。例如,为了得到作为光致变色镜片所要求的各种色调,也可以与其它光致变色化合物组合使用。所组合的光致变色化合物可以没有任何限制地来使用公知化合物。例如可举出:俘精酸酐、俘精酰胺、螺嗪、色烯等。其中,从可均匀地保持显褪色时的色调、可抑制伴随光致变色性劣化的显色时的色偏移、进而可减小初期着色的方面来看,特别优选为色烯化合物。但是,在用于隐形眼镜的情况下,其它光致变色化合物优选也具有自由基聚合性基团。并且,优选使用多种本发明的色烯化合物来调整色调。
[0211]
在包含本发明的色烯化合物与其它色烯化合物的光致变色组合物的情况下,各色烯化合物的配合比例根据所期望的色调而适宜决定。
[0212]
本发明的色烯化合物由于具有自由基聚合性基团,因此,通过单独将其聚合,从而可以制成光学物品。但是,为了用在各种用途中,优选作为以下方式使用。
[0213]
<光致变色固化性组合物>
[0214]
本发明的色烯化合物和上述光致变色组合物优选与该色烯化合物以外的聚合性单体(以下,有时也简称为“其它聚合性单体”)组合,作为光致变色固化性组合物而使用。
[0215]
在本发明中,由于取决于色烯化合物的显色强度、所选择的镜片材料和镜片厚度而无法一概而论,但是,光致变色固化性组合物优选为以下配合比例。具体而言,相对于其它聚合性单体100质量份,本发明的色烯化合物或光致变色组合物优选为0.001~10质量份。该配合量优选根据使用的用途来调整最优配合量。例如,在将该光致变色固化性组合物作为薄膜的光学物品而使用的情况下、和作为厚膜的光学物品而使用的情况下,为以下所述。
[0216]
具体而言,在将该光致变色固化性组合物制成像涂层那样的薄膜、例如100μm左右的薄膜(该光致变色固化性组合物聚合而成的高分子膜)时,相对于其它聚合性单体100质量份,使本发明的色烯化合物或光致变色组合物为0.001~10质量份来调整色调即可。
[0217]
在为厚的固化物(该光致变色固化性组合物聚合而成的高分子成型物)、例如厚1毫米以上的固化物的情况下,相对于厚的固化物或构成厚的固化物的其它聚合性单体100质量份,使本发明的色烯化合物或光致变色组合物为0.001~1质量份来调整色调即可。
[0218]
另外,在将该光致变色固化性组合物用于隐形眼镜用的情况下,优选为以下的配合。即,相对于其它聚合性单体100质量份,本发明的色烯化合物或光致变色组合物优选设为0.001~5质量份。
[0219]
<其它聚合性单体>
[0220]
本发明中使用的其它聚合性单体只要可以通过自由基聚合而与本发明的色烯化合物共聚,就没有特别限定。自由基聚合性化合物大致分类为具有(甲基)丙烯酰基的(甲基)丙烯酸系聚合性化合物、具有乙烯基的乙烯基系聚合性化合物、具有烯丙基的烯丙基系聚合性化合物、倍半硅氧烷系聚合性化合物。
[0221]
以下,示出其具体例子。
[0222]
<具有(甲基)丙烯酰基的(甲基)丙烯酸系聚合性化合物>
[0223]
作为具有(甲基)丙烯酰基的多官能(甲基)丙烯酸系聚合性化合物,可举出以下聚合性化合物。具体而言,
[0224]
可举出:选自二乙二醇二甲基丙烯酸酯、三乙二醇二甲基丙烯酸酯、四乙二醇二甲基丙烯酸酯、五乙二醇二甲基丙烯酸酯、五丙二醇二甲基丙烯酸酯、二乙二醇二丙烯酸酯、三乙二醇二丙烯酸酯、四乙二醇二丙烯酸酯、五乙二醇二丙烯酸酯、三丙二醇二丙烯酸酯、四丙二醇二丙烯酸酯、五丙二醇二丙烯酸酯、由聚丙二醇与聚乙二醇的混合物形成的二甲基丙烯酸酯(具有2个聚乙烯、2个聚丙烯的重复单元)、聚乙二醇二甲基丙烯酸酯(特别是平均分子量330)、聚乙二醇二甲基丙烯酸酯(特别是平均分子量536)、聚乙二醇二甲基丙烯酸酯(特别是平均分子量736)、三丙二醇二甲基丙烯酸酯、四丙二醇二甲基丙烯酸酯、聚丙二醇二甲基丙烯酸酯(特别是平均分子量536)、聚乙二醇二丙烯酸酯(特别是平均分子量258)、聚乙二醇二丙烯酸酯(特别是平均分子量308)、聚乙二醇二丙烯酸酯(特别是平均分子量508)、聚乙二醇二丙烯酸酯(特别是平均分子量708)、聚乙二醇甲基丙烯酸酯丙烯酸酯(特别是平均分子量536)中的二醇系2官能(甲基)丙烯酸系聚合性化合物。
[0225]
可举出:三羟甲基丙烷三甲基丙烯酸酯、三羟甲基丙烷三丙烯酸酯、四羟甲基甲烷三甲基丙烯酸酯、四羟甲基甲烷三丙烯酸酯、四羟甲基甲烷四甲基丙烯酸酯、四羟甲基甲烷四丙烯酸酯、三羟甲基丙烷三乙二醇三甲基丙烯酸酯、三羟甲基丙烷三乙二醇三丙烯酸酯、双(三羟甲基丙烷)四甲基丙烯酸酯、双(三羟甲基丙烷)四丙烯酸酯等聚烷二醇(甲基)丙烯酸酯。
[0226]
可举出:2,2-双[4-(甲基丙烯酰氧基
·
乙氧基)苯基]丙烷、2,2-双[4-(甲基丙烯酰氧基
·
二乙氧基)苯基]丙烷、2,2-双[4-(甲基丙烯酰氧基
·
聚乙氧基)苯基]丙烷、2,2-双(3,5-二溴-4-甲基丙烯酰氧基乙氧基苯基)丙烷、2,2-双(4-甲基丙烯酰氧基二丙氧基苯基)丙烷、2,2-双[4-(甲基丙烯酰氧基
·
二乙氧基)苯基]丙烷、2,2-双[4-丙烯酰氧基(聚乙氧基)苯基]丙烷、2,2-双[4-甲基丙烯酰氧基(聚乙氧基)苯基]丙烷等双酚a(甲基)丙烯酸酯。
[0227]
可举出:丙二醇、丁二醇、戊二醇、己二醇、辛二醇、壬二醇等聚烷二醇的光气化而得到的聚碳酸酯二醇(具有500~2000的数均分子量)与(甲基)丙烯酸的反应产物、
[0228]
2种以上的聚烷二醇的混合物例如丙二醇与丁二醇的混合物、丁二醇与己二醇的混合物、戊二醇与己二醇的混合物、丁二醇与辛二醇的混合物、己二醇与辛二醇的混合物等的光气化而得到的聚碳酸酯二醇(具有500~2000的数均分子量)与(甲基)丙烯酸的反应产物、
[0229]
1-甲基丙二醇的光气化而得到的聚碳酸酯二醇(具有500~2000的数均分子量)与(甲基)丙烯酸的反应产物等聚碳酸酯二醇的(甲基)丙烯酸酯。
[0230]
可举出:新中村化学工业株式会社制的u-2ppa(分子量482)、ua-122p(分子量1100)、u-122p(分子量1100)、u-108a、u-200pa、ua-511、u-412a、ua-4100、ua-4200、ua-4400、ua-2235pe、ua-160tm、ua-6100、ua-6200、u-108、ua-4000、ua-512和daicelucp公司制的eb4858(分子量454)和日本化药株式会社制ux-2201、ux3204、ux4101、6101、7101、8101、新中村化学工业株式会社制的u-4ha(分子量596,官能团数4)、u-6ha(分子量1019,官能团数6)、u-6lpa(分子量818,官能团数6)、u-15ha(分子量2300,官能团数15)等具有氨基甲酸酯键的(甲基)丙烯酸酯。
[0231]
可举出:1,6-己二醇二丙烯酸酯、1,6-己二醇二甲基丙烯酸酯、1,9-壬二醇二丙烯酸酯、1,9-壬二醇二甲基丙烯酸酯、1,10-癸二醇二丙烯酸酯、1,10-癸二醇二甲基丙烯酸酯等烷二醇二(甲基)丙烯酸酯。
[0232]
可举出:双(2-甲基丙烯酰氧基乙硫基乙基)硫醚、双(甲基丙烯酰氧基乙基)硫醚、双(丙烯酰氧基乙基)硫醚、1,2-双(甲基丙烯酰氧基乙硫基)乙烷、1,2-双(丙烯酰氧基乙基)乙烷、双(2-甲基丙烯酰氧基乙硫基乙基)硫醚、双(2-丙烯酰氧基乙硫基乙基)硫醚、1,2-双(甲基丙烯酰氧基乙硫基乙硫基)乙烷、1,2-双(丙烯酰氧基乙硫基乙硫基)乙烷、1,2-双(甲基丙烯酰氧基异丙硫基异丙基)硫醚、1,2-双(丙烯酰氧基异丙硫基异丙基)硫醚等含硫原子的(甲基)丙烯酸酯。
[0233]
可举出:4官能聚酯低聚物(分子量2500~3500,daicelucp公司,eb80等)、6官能聚酯低聚物(分子量6000~8000,daicelucp公司,eb450等)、6官能聚酯低聚物(分子量45000~55000,daicelucp公司,eb1830等)、4官能聚酯低聚物(特别是分子量10000的第一工业制药公司的gx8488b等)等聚酯(甲基)丙烯酸酯。
[0234]
另外,作为具有(甲基)丙烯酰基的单官能(甲基)丙烯酸系聚合性化合物,
[0235]
可举出:甲氧基聚乙二醇甲基丙烯酸酯(特别是平均分子量293)、甲氧基聚乙二醇甲基丙烯酸酯(特别是平均分子量468)、甲氧基聚乙二醇丙烯酸酯(特别是平均分子量218)、甲氧基聚乙二醇丙烯酸酯(特别是平均分子量454)、甲基丙烯酸硬脂酯、甲基丙烯酸月桂酯、丙烯酸甲酯、丙烯酸乙酯、丙烯酸丁酯、丙烯酸辛酯、丙烯酸月桂酯、γ-甲基丙烯酰氧基丙基三甲氧基硅烷、γ-甲基丙烯酰氧基丙基甲基二甲氧基硅烷、甲基丙烯酸缩水甘油酯等。
[0236]
<具有乙烯基的乙烯基系聚合性化合物>
[0237]
作为乙烯基系聚合性化合物,可举出以下化合物。具体而言,
[0238]
可举出:甲基乙烯基酮、乙基乙烯基酮、乙基乙烯基醚、苯乙烯、乙烯基环己烷、丁二烯、1,4-戊二烯、二乙烯基硫醚、二乙烯基砜、1,2-二乙烯基苯、1,3-二乙烯基-1,1,3,3-四甲基丙烷二硅氧烷、二乙二醇二乙烯基醚、己二酸二乙烯酯、癸二酸二乙烯酯、乙二醇二乙烯基醚、二乙烯基亚砜、二乙烯基过硫醚、二甲基二乙烯基硅烷、1,2,4-三乙烯基环己烷、甲基三乙烯基硅烷、α-甲基苯乙烯和α-甲基苯乙烯二聚物等。
[0239]
在上述例示的乙烯基系聚合性化合物中,α-甲基苯乙烯和α-甲基苯乙烯二聚物作为聚合调节剂发挥功能,使光致变色组合物的成型性提高。
[0240]
<具有烯丙基的烯丙基系聚合性化合物>
[0241]
作为烯丙基系聚合性化合物,可举出:二乙二醇双烯丙基碳酸酯、甲氧基聚乙二醇烯丙基醚(特别是平均分子量550)、甲氧基聚乙二醇烯丙基醚(特别是平均分子量350)、甲氧基聚乙二醇烯丙基醚(特别是平均分子量1500)、聚乙二醇烯丙基醚(特别是平均分子量450)、甲氧基聚乙二醇聚丙二醇烯丙基醚(特别是平均分子量750)、丁氧基聚乙二醇聚丙二醇烯丙基醚(特别是平均分子量1600)、甲基丙烯酰氧基聚乙二醇聚丙二醇烯丙基醚(特别是平均分子量560)、苯氧基聚乙二醇烯丙基醚(特别是平均分子量600)、甲基丙烯酰氧基聚乙二醇烯丙基醚(特别是平均分子量430)、丙烯酰氧基聚乙二醇烯丙基醚(特别是平均分子量420)、羟基聚乙二醇烯丙基醚(特别是平均分子量560)、苯乙烯氧基聚乙二醇烯丙基醚(特别是平均分子量650)、甲氧基聚乙二醇烯丙基硫醚(特别是平均分子量730)等。
[0242]
应予说明,通过使烯丙基系聚合性化合物作为链转移剂发挥作用,从而可以提高固化性组合物的光致变色性(显色浓度、褪色速度)。
[0243]
<倍半硅氧烷系聚合性化合物>
[0244]
作为倍半硅氧烷系聚合性化合物,取得笼状、梯状、无规的各种分子结构,并具有(甲基)丙烯酰基等自由基聚合性基团。作为这样的倍半硅氧烷聚合性化合物的例子,可举出下述式(18)表示的化合物。
[0245][0246]
式中,s为聚合度,为3~100的整数。
[0247]
多个r
12
彼此可以相同,也可以不同,其为自由基聚合性基团、含有自由基聚合性基团的有机基团、氢原子、烷基、环烷基、烷氧基或苯基,至少1个r
12
为自由基聚合性基团、或含有自由基聚合性基团的有机基团。
[0248]
其中,作为r
12
表示的自由基聚合性基团、或含有自由基聚合性基团的有机基团,可举出:(甲基)丙烯酰基;(甲基)丙烯酰氧基丙基、(3-(甲基)丙烯酰氧基丙基)二甲基硅氧基等具有(甲基)丙烯酰基的有机基团;烯丙基;烯丙基丙基、烯丙基丙基二甲基硅氧基等具有烯丙基的有机基团;乙烯基;乙烯基丙基、乙烯基二甲基硅氧基等具有乙烯基的有机基团等。
[0249]
另外,除了以上的自由基聚合性多官能单体、自由基聚合性单官能单体以外,在将本发明的色烯化合物用于隐形眼镜用途的情况下,优选与以下说明的自由基聚合性单体组合。即,优选使下述详述的其它聚合性单体与本发明的色烯化合物共聚,制造分散有本发明的色烯化合物的隐形眼镜。
[0250]
<隐形眼镜用途;其它聚合性单体>
[0251]
在使用本发明的色烯化合物来制造硬式隐形眼镜、软式隐形眼镜、硅水凝胶软式隐形眼镜时,可以制造具有优异光致变色特性的隐形眼镜。其中,包含水凝胶或硅水凝胶的软式隐形眼镜中,显示特别优异的光致变色特性。水凝胶是指具有3维状的网眼结构的高分子含水而溶胀的物质,硅水凝胶是指在构成水凝胶的单体中使用有机硅成分。水凝胶和硅水凝胶包含的水分没有特别限定,通常为20~80质量%。
[0252]
在将本发明的色烯化合物用作隐形眼镜用单体的情况下,优选制成与亲水性单体组合的光致变色固化性组合物。应予说明,亲水性单体是指在分子内具有至少1个羟基、氨基、酰胺基、醚基、环状氮、羧基的单体。
[0253]
本发明中,作为亲水性单体,具体而言,
[0254]
可举出:(甲基)丙烯酸2-羟基乙酯、(甲基)丙烯酸羟基丙酯、甲基丙烯酸甘油酯等(甲基)丙烯酸羟基烷酯;
[0255]
(甲基)丙烯酸氨基乙酯、(甲基)丙烯酸二甲氨基乙酯、(甲基)丙烯酸甲氨基乙酯、丙烯酸二乙氨基乙酯等(甲基)丙烯酸氨基烷酯。
[0256]
进而,可举出:n-乙烯基吡咯烷酮、n-乙烯基哌啶酮、n-乙烯基-n-甲基乙酰胺、n-乙烯基-n-乙基乙酰胺、n-乙烯基-n-乙基甲酰胺、n-乙烯基吡咯烷酮、n-乙烯基甲酰胺、n-2-羟基乙基乙烯基氨基甲酸酯、n-乙烯基吡啶和n-乙烯基戊二酰亚胺、n-乙烯基琥珀酰亚
胺、n-乙烯基-ε-己内酰胺等n-乙烯基类。
[0257]
进而,可举出:n-甲基(甲基)丙烯酰胺、n-异丙基(甲基)丙烯酰胺、n-二丙酮(甲基)丙烯酰胺、n,n-二甲基丙烯酰胺、n,n-二甲基氨基-甲基(甲基)丙烯酰胺、n,n-二甲基氨基乙基(甲基)丙烯酰胺、n,n-二乙基(甲基)丙烯酰胺、丙烯酰基吗啉、n,n-二丙基(甲基)丙烯酰胺、n-甲基氨基异丙基(甲基)丙烯酰胺、n-(2-羟基乙基)(甲基)丙烯酰胺等(甲基)丙烯酸的酰胺衍生物。
[0258]
进而,可举出:氨基苯乙烯、羟基苯乙烯等苯乙烯衍生物以及(甲基)丙烯酸、马来酸酐、马来酸、富马酸等不饱和羧酸。
[0259]
作为硅水凝胶配合物中可含有的有机硅成分,可举出含有机硅单体、有机硅大分子单体和预聚物,但不限定于此。
[0260]
作为含有机硅单体,可举出:含有机硅的(甲基)丙烯酸烷酯、含有机硅的苯乙烯衍生物和含有机硅的富马酸二酯等。
[0261]
作为含有机硅的(甲基)丙烯酸烷酯的例子,可举出:(甲基)丙烯酸三甲基硅氧基二甲基硅烷基甲酯、(甲基)丙烯酸三甲基硅氧基二甲基硅烷基丙酯、(甲基)丙烯酸甲基双(三甲基硅氧基)硅烷基丙酯、(甲基)丙烯酸三(三甲基硅氧基)硅烷基丙酯及其酰胺衍生物。
[0262]
此外,可举出:(甲基)丙烯酸单[甲基双(三甲基硅氧基)硅氧基]双(三甲基硅氧基)硅烷基丙酯、(甲基)丙烯酸三[甲基双(三甲基硅氧基)硅氧基]硅烷基丙酯、(甲基)丙烯酸甲基双(三甲基硅氧基)硅烷基丙基甘油酯、(甲基)丙烯酸三(三甲基硅氧基)硅烷基丙基甘油酯、(甲基)丙烯酸单[甲基双(三甲基硅氧基)硅氧基]双(三甲基硅氧基)硅烷基丙基甘油酯、(甲基)丙烯酸三甲基硅烷基乙基四甲基二硅氧基丙基甘油酯、(甲基)丙烯酸三甲基硅烷基甲酯、(甲基)丙烯酸三甲基硅烷基丙酯、(甲基)丙烯酸三甲基硅烷基丙基甘油酯、(甲基)丙烯酸三甲基硅氧基二甲基硅烷基丙基甘油酯、(甲基)丙烯酸甲基双(三甲基硅氧基)硅烷基乙基四甲基二硅氧基甲酯、(甲基)丙烯酸四甲基三异丙基环四硅氧烷基丙酯、(甲基)丙烯酸四甲基三异丙基环四硅氧基双(三甲基硅氧基)硅烷基丙酯、(3-甲基丙烯酰氧基―2-羟基丙氧基)丙基双(三甲基硅氧基)甲基硅烷等。
[0263]
作为含有机硅的苯乙烯衍生物,可举出:三(三甲基硅氧基)硅烷基苯乙烯、双(三甲基硅氧基)甲基硅烷基苯乙烯、(三甲基硅氧基)二甲基硅烷基苯乙烯、三(三甲基硅氧基)硅氧基二甲基硅烷基苯乙烯、[双(三甲基硅氧基)甲基硅氧基]二甲基硅烷基苯乙烯、(三甲基硅氧基)二甲基硅烷基苯乙烯、七甲基三硅氧烷基苯乙烯、九甲基四硅氧烷基苯乙烯、十五甲基七硅氧烷基苯乙烯、二十一甲基十硅氧烷基苯乙烯、二十七甲基十三硅氧烷基苯乙烯、三十一甲基十五硅氧烷基苯乙烯、三甲基硅氧基五甲基二硅氧基甲基硅烷基苯乙烯、三(五甲基二硅氧基)硅烷基苯乙烯、三(三甲基硅氧基)硅氧基双(三甲基硅氧基)硅烷基苯乙烯、双(七甲基三硅氧基)甲基硅烷基苯乙烯、三[甲基双(三甲基硅氧基)硅氧基]硅烷基苯乙烯、三甲基硅氧基双[三(三甲基硅氧基)硅氧基]硅烷基苯乙烯、七(三甲基硅氧基)三硅烷基苯乙烯、九甲基四硅氧基十一甲基五硅氧基甲基硅烷基苯乙烯、三[三(三甲基硅氧基)硅氧基]硅烷基苯乙烯、(三-三甲基硅氧基六甲基)四硅氧基[三(三甲基硅氧基)硅氧基]三甲基硅氧基硅烷基苯乙烯、九(三甲基硅氧基)四硅烷基苯乙烯、双(十三甲基六硅氧基)甲基硅烷基苯乙烯、七甲基环四硅氧烷基苯乙烯、七甲基环四硅氧基双(三甲基硅氧基)硅烷
基苯乙烯、三丙基四甲基环四硅氧烷基苯乙烯、三甲基硅烷基苯乙烯等。
[0264]
作为含有机硅的富马酸二酯的具体例,可举出:双(3-(三甲基硅烷基)丙基)富马酸酯、双(3-(五甲基二硅氧烷基)丙基)富马酸酯、双(三(三甲基硅氧基)硅烷基丙基)富马酸酯等。
[0265]
作为有机硅大分子单体,可举出:单官能性或二官能性聚二甲基硅氧烷、美国专利第4259467号中记载那样的以侧链亲水基而甲基丙烯酰基化的聚二甲基硅氧烷、国际公开第wo97/00274号说明书中记载那样的具有聚合性官能团的聚二甲基硅氧烷大分子单体、国际公开第wo94/15980号说明书中记载那样的掺入亲水性单体的聚硅氧烷大分子单体等。
[0266]
除了上述例示的亲水性单体、有机硅成分以外,还可使用公知的隐形眼镜用单体。例如,为了调节交联密度或柔软性、硬质性,可以添加交联剂。作为交联剂,例如可举出具有(甲基)丙烯酰基、乙烯基和烯丙基中的多个自由基聚合基团的化合物。
[0267]
作为这样的交联剂的例子,可举出:(甲基)丙烯酸烯丙酯、(甲基)丙烯酸乙烯酯、(甲基)丙烯酸4-乙烯基苄酯、(甲基)丙烯酸3-乙烯基苄酯、二乙二醇单(甲基)丙烯酸酯、丙二醇(甲基)丙烯酸酯、(甲基)丙烯酸(甲基)丙烯酰氧基乙酯、乙二醇二(甲基)丙烯酸酯、二乙二醇二(甲基)丙烯酸酯、二乙二醇二烯丙醚、三乙二醇二(甲基)丙烯酸酯、四乙二醇二(甲基)丙烯酸酯、丙二醇二(甲基)丙烯酸酯、二丙二醇二(甲基)丙烯酸酯、丁二醇二(甲基)丙烯酸酯、三羟甲基丙烷三(甲基)丙烯酸酯、2,2-双[对(甲基)丙烯酰氧基苯基]六氟丙烷、2,2-双[间(甲基)丙烯酰氧基苯基]六氟丙烷、2,2-双[邻(甲基)丙烯酰氧基苯基]六氟丙烷、2,2-双[对(甲基)丙烯酰氧基苯基]丙烷、2,2-双[间(甲基)丙烯酰氧基苯基]丙烷、2,2-双[邻(甲基)丙烯酰氧基苯基]丙烷、1,4-双[2-(甲基)丙烯酰氧基六氟异丙基]苯、1,3-双[2-(甲基)丙烯酰氧基六氟异丙基]苯、1,2-双[2-(甲基)丙烯酰氧基六氟异丙基]苯、1,4-双[2-(甲基)丙烯酰氧基异丙基]苯、1,3-双[2-(甲基)丙烯酰氧基异丙基]苯、1,2-双[2-(甲基)丙烯酰氧基异丙基]苯等。这些交联剂可以使用一种,或组合2种以上使用。
[0268]
另外,除了交联剂以外,为了调节隐形眼性的硬度、赋予期望的软质性,可以添加补强单体。
[0269]
作为这样的补强单体,作为(甲基)丙烯酸系,
[0270]
可举出:(甲基)丙烯酸甲酯、(甲基)丙烯酸乙酯、(甲基)丙烯酸异丙酯、(甲基)丙烯酸正丙酯、(甲基)丙烯酸异丁酯、(甲基)丙烯酸正丁酯、(甲基)丙烯酸2-乙基己酯、(甲基)丙烯酸正辛酯、(甲基)丙烯酸正癸酯、(甲基)丙烯酸正十二烷酯、(甲基)丙烯酸叔丁酯、(甲基)丙烯酸戊酯、(甲基)丙烯酸叔戊酯、(甲基)丙烯酸己酯、(甲基)丙烯酸庚酯、(甲基)丙烯酸壬酯、(甲基)丙烯酸硬脂酯、(甲基)丙烯酸环戊酯、(甲基)丙烯酸环己酯等直链状、支链状或环状的(甲基)丙烯酸烷酯。
[0271]
此外,可举出:(甲基)丙烯酸2-甲氧基乙酯、(甲基)丙烯酸2-乙氧基乙酯、(甲基)丙烯酸2-甲氧基乙氧基乙酯、(甲基)丙烯酸2-乙氧基乙氧基乙酯等(甲基)丙烯酸羟基烷酯的烷氧基衍生物。
[0272]
作为补强单体,作为苯乙烯系,
[0273]
可举出:苯乙烯、α-甲基苯乙烯、甲基苯乙烯、乙基苯乙烯、丙基苯乙烯、丁基苯乙烯、叔丁基苯乙烯、异丁基苯乙烯、戊基苯乙烯等烷基苯乙烯。
[0274]
此外,可举出:甲基-α-甲基苯乙烯、乙基-α-甲基苯乙烯、丙基-α-甲基苯乙烯、丁
基-α-甲基苯乙烯、叔丁基-α-甲基苯乙烯、异丁基-α-甲基苯乙烯、戊基-α-甲基苯乙烯等烷基-α-甲基苯乙烯等烷基-α-甲基苯乙烯。
[0275]
这些补强单体可以使用一种,或组合2种以上使用。
[0276]
在以上例示的具有自由基聚合性基团的其它聚合性单体中,在用于隐形眼镜用途的情况下,作为优选的单体,
[0277]
优选配合了如下化合物的光致变色固化性组合物:(甲基)丙烯酸2-羟基乙酯、n-乙烯基吡咯烷酮、n-乙烯基吡咯烷酮、n-乙烯基戊二酰亚胺、n-乙烯基-n-甲基乙酰胺、n-乙烯基吡啶、甲基丙烯酸、甘油甲基丙烯酸酯、n,n-二乙基丙烯酰胺、丙烯酰基吗啉、n,n-二甲基丙烯酰胺、n-(2-羟基乙基)(甲基)丙烯酰胺、乙二醇二(甲基)丙烯酸酯、四乙二醇二(甲基)丙烯酸酯、三(三甲基硅氧基)硅烷基苯乙烯、三(三甲基硅氧基)硅烷基丙基(甲基)丙烯酸酯及其酰胺衍生物、(3-甲基丙烯氧基-2-羟基丙氧基)丙基双(三甲基硅氧基)甲基硅烷、甲基双(三甲基硅氧基)硅烷基丙基(甲基)丙烯酸酯、二乙二醇二(甲基)丙烯酸酯等。
[0278]
另外,在将本发明的色烯化合物用于隐形眼镜用途的情况下,除了上述其它聚合性单体以外,也可以与公知的配合剂组合使用。例如,可举出粘稠化剂或清凉剂等。
[0279]
粘稠化剂可提高各单体间的相溶性,减少未反应成分,并且可调节光致变色固化性组合物的粘度。进而,可在配戴隐形眼镜时赋予对眼睛的湿润感。
[0280]
作为上述粘稠化剂,没有特别限定,可举出以下粘稠化剂。
[0281]
可举出:硫酸软骨素、玻尿酸、葡萄糖酸和它们的盐等多糖类、粘多糖类、杂多糖类等各种胶类。
[0282]
聚乙烯醇、聚-n-乙烯基吡咯烷酮、聚-n-乙烯基哌啶酮、聚乙二醇、聚丙二醇、聚丙烯酰胺、聚(甲基)丙烯酸或其盐、羧基乙烯基聚合物、聚-n-乙烯基吡咯烷酮与甲基丙烯酸二甲氨基乙酯的共聚物等合成有机高分子化合物。
[0283]
可举出:羟基乙基纤维素、羟基丙基甲基纤维素、羧甲基纤维素、甲基纤维素等纤维素衍生物。
[0284]
可举出淀粉衍生物等。
[0285]
清凉剂可提高各单体间的相溶性、减少未反应成分,并且可在配戴隐形眼镜时对眼睛赋予爽快感,可消除异物感或瘙痒。
[0286]
作为清凉剂,可举出:茴香脑、丁香油酚、樟脑、氯丁醇、牻牛儿醇、桉叶油醇、龙脑香、薄荷醇、柠烯、龙脑、茴香油、薄荷油、桂皮油、绿薄荷油、辣薄荷水、辣薄荷油、薄荷精油、香柠檬油、尤加利油、玫瑰油等。
[0287]
这些能够单独使用,也可以组合使用。
[0288]
这些成分(上述配合剂)相对于包含本发明的色烯化合物的聚合单体(本发明的色烯化合物与其它聚合性单体的合计)100质量份,优选在0.001~5质量份的范围内使用。
[0289]
本发明中,在光致变色固化性组合物中,除了本发明的色烯化合物或光致变色组合物、上述其它聚合性单体以外,也可根据需要配合稳定剂等添加剂。对于这些添加剂进行说明。
[0290]
<光致变色固化性组合物;添加剂>
[0291]
本发明中,光致变色固化性组合物通过添加下述表示的紫外线吸收剂、光稳定剂、抗氧化剂等添加剂,可以更进一步提高耐久性。
[0292]
作为紫外线吸收剂,可使用二苯甲酮系化合物、苯并三唑系化合物、氰基丙烯酸酯系化合物、三嗪系化合物、苯甲酸酯系化合物等公知的紫外线吸收剂。特别优选氰基丙烯酸酯系化合物、二苯甲酮系化合物。
[0293]
该紫外线稳定剂相对于包含本发明的色烯化合物的聚合单体(本发明的色烯化合物与其它聚合性单体的合计)100质量份,优选在0.001~5质量份的范围内使用。另外,作为光稳定剂,可使用公知的受阻胺,作为抗氧化剂,可使用公知的受阻酚。上述光稳定剂、抗氧化剂相对于包含本发明的色烯化合物的聚合单体100质量份,优选在0.01~10质量份的范围内使用。
[0294]
<光致变色固化性组合物的使用方法;光学物品>
[0295]
本发明中,光致变色固化性组合物中使用的其它聚合性单体可如上述例示那样,这些其它聚合性单体的配合比例只要根据用途适当确定即可。但是,优选的色烯化合物或光致变色组合物的配合量如上所述。
[0296]
本发明中,光致变色固化性组合物可通过混合所使用的色烯化合物(光致变色组合物)、其它聚合性单体、根据需要配合的添加剂等而准备。得到的光致变色固化性组合物可根据需要添加聚合催化剂及其它添加剂等,利用热或光进行聚合,从而制造在树脂中分散有色烯化合物的光学物品。
[0297]
本发明的色烯化合物可作为光致变色材料在广范围内利用,例如可代替银盐感光材料作为各种记忆材料、复印材料、印刷用感光体、阴极射线管用记忆材料、激光用感光材料、全息用感光材料等各种记忆材料而利用。此外,使用了本发明的色烯化合物的光致变色材料也可以作为光致变色镜片材料、光学滤光片材料、显示器材料、光量计、装饰品等材料而利用。
[0298]
例如,使用了本发明的色烯化合物的光致变色镜片的制造方法只要是能得到均匀的调光性能的方法即可,可以采用公知的方法。具体而言,可以采用将均匀分散有本发明的色烯化合物的聚合物膜夹在镜片中的方法。另外,可举出:将本发明的色烯化合物分散在上述其它聚合性单体中,制成光致变色固化性组合物,将该固化性组合物通过规定方法而聚合的方法。另外,可举出:将本发明的色烯化合物溶解在例如硅油中,在150~200℃历时10~60分钟含浸在镜片表面,进而以固化性物质被覆其表面,制成光致变色镜片的方法等。进而,也可将上述聚合物膜涂布于镜片表面,以固化性物质被覆其表面,制成光致变色镜片的方法等。
[0299]
此外,也可将由上述光致变色固化性组合物形成的涂布剂涂布在镜片基材表面,使涂膜固化。此时,镜片基材也可预先实施基于碱性溶液的表面处理或等离子体处理等表面处理,进而也可以与这些表面处理一同或不进行这些表面处理而施用底漆来提高基材与涂覆膜的密合性。由此,可以制造被分散有色烯化合物或色烯组合物的高分子膜被覆的光学物品。另外,也可通过预先在模腔内配置镜片基材,在其中流入上述光致变色固化性组合物,使该固化性组合物固化,从而可以制造上述形状的光学物品。
[0300]
另外,在制造上述隐形眼镜的情况下,优选采用以下方法。如果为得到均匀调光性能的方法,则可以采用公知的隐形眼镜制造方法。例如可举出:在适当的容器中进行光致变色固化性组合物的聚合,得到棒状、块状、板状等由光致变色固化物形成的隐形眼镜材料。之后,对得到的隐形眼镜材料实施切削加工、研磨加工等机械加工,加工成期望的隐形眼镜
形状(光致变色光学物品)的方法(机械加工法)。
[0301]
另外,也可以采用如下方法。在具有对应于期望的隐形眼镜形状的形状的成型模(铸模)中,例如使光致变色固化性组合物聚合,得到隐形眼镜形状的成型物(光致变色光学物品)。接下来,也可以采用根据需要实施精加工的方法(模制法)。
[0302]
进而,也可以采用如下方法。在具有对应于期望的隐形眼镜形状的至少一面的形状的成型模中,使光致变色固化性组合物聚合。接着,也可以采用对得到的光致变色固化物的另一面实施机械加工、得到隐形眼镜(光致变色光学物品)的组合了机械加工法与模制法的方法。
[0303]
此外,可以采用旋转浇铸法等。
[0304]
对于得到的隐形眼镜(光致变色光学物品),基于改良其表面特性的目的,可实施低温等离子体处理、大气压等离子体、电晕放电等。通过低温等离子体处理,可得到润湿性和/或耐污染性更优异的隐形眼镜。可以认为这是因为本发明的色烯化合物在13位具有规定的环z基,且3位的苯基具有规定的自由基聚合性基团,在与这些亲水性单体组合而聚合时,得到的光致变色固化物(如隐形眼镜的光学物品)发挥优异的效果。特别是可以制成在33~38℃的光致变色特性和色烯化合物自身的溶出较少的光学物品。
[0305]
实施例
[0306]
以下,通过实施例对本发明进行进一步详细的说明,但本发明不限定于这些实施例。
[0307]
实施例1
[0308]
将下述式(19)表示的萘酚化合物1.0g(2.8mmol)
[0309][0310]
与下述式(20)表示的具有反应性取代基(羟基)的炔丙醇化合物的10质量%甲基乙基酮溶液12.0g(3.4mmol)
[0311][0312]
溶解在甲苯50ml中,进而添加对甲苯磺酸0.02g,在加热回流下搅拌1小时。反应后,去除溶剂,通过利用硅胶的色谱进行纯化,得到白色粉末状的产物(前体)1.4g。收率为72%。
[0313]
将得到的前体溶解在三乙胺0.7g(6.9mmol)、二氯甲烷30ml中,进行冰冷。在其中缓慢滴加丙烯酰氯0.3g(2.9mmol)。反应后,去除溶剂,通过利用硅胶的色谱进行纯化,得到
白色粉末状的产物(色烯化合物)1.3g。收率为86%。该产物的元素分析值为c80.48%,h6.91%,n1.86%,与c
49h49
no6的计算值即c80.51%,h6.89%,n1.88%极其一致。
[0314]
另外,在测定质子核磁共振谱后,在1.0~3.0ppm附近显示基于环辛烷环的亚甲基质子和甲基的甲基质子的20h的峰,在δ3.0~5.0ppm附近显示基于亚乙氧基、吗啉基的12h的峰,在δ5.6~9.0ppm附近显示基于芳香质子和烯烃质子的19h的峰。
[0315]
进而,测定
13
c-核磁共振谱后,在δ110~220ppm附近显示基于芳香环和丙烯酰基的碳的峰,在δ80~140ppm附近显示基于烯烃的碳的峰,在δ20~75ppm显示基于烷基的碳的峰。
[0316]
根据上述结果,确认了分离产物是下述式(21)表示的化合物。
[0317][0318]
实施例2~10
[0319]
与实施例1同样地进行,使用表1~3表示的萘酚化合物与具有反应性取代基的炔丙醇化合物,合成表4~6表示的色烯前体和色烯化合物。对于得到的产物,使用与实施例1同样的结构确认方式进行结构解析,其结果,确认为表4~6所示的结构式表示的化合物。另外,表7中示出这些化合物的元素分析值、由各化合物的结构式求出的计算值和1h-nmr谱的特征性谱。
[0320]
[表1]
[0321][0322]
[表2]
[0323][0324]
[表3]
[0325]
[0326]
[表4]
[0327][0328]
[表5]
[0329][0330]
[表6]
[0331][0332]
[表7]
[0333][0334]
实施例11~22
[0335]
(制作的光致变色隐形眼镜(光致变色光学物品)的物性评价)
[0336]
作为光致变色固化性组合物,使用将作为自由基聚合性单体的甲基丙烯酸三(三甲基硅氧基)硅烷基丙酯/二甲基丙烯酰胺/甲基丙烯酸2-羟基乙酯/乙二醇二甲基丙烯酸酯分别以60质量份/30质量份/8质量份/2质量份的配合比例配合而成的组合物。相对于该自由基聚合性单体的混合物100质量份,添加1质量份的实施例1~10得到的色烯化合物no.1~10并充分混合后,添加0.3质量份的热聚合引发剂v65(2,2'-偶氮双(2,4-二甲基戊腈))并充分混合,制成光致变色固化性组合物。将得到的光致变色固化性组合物注入由玻璃板与膜厚0.1mm的聚对苯二甲酸乙二醇酯(ptfe)薄片构成的铸模中,进行注模聚合。聚合使用空气炉,在90℃保持1小时。在聚合结束后,将聚合物从铸模的玻璃模取出。使得到的光致变色固化物(厚0.1mm)在40℃蒸馏水中含水3小时以上,得到光致变色隐形眼镜(光致变色光学物品)。
[0337]
对于得到的光致变色隐形眼镜,进行下述评价。其结果示于表8。
[0338]
1)光致变色特性
[0339]
[1]极大吸收波长(λmax):是指利用大冢电子工业株式会社制的分光光度计(即时多通道光电探测器mcpd3000)求出的显色后的极大吸收波长,作为显色时的色调指标。
[0340]
[2]36℃显色浓度(a
36
):是指在上述极大吸收波长处在36℃照射180秒后的吸光度{ε(180)}与未照射光时的吸光度ε(0)的差,作为显色浓度的指标。该值越高,表示光致变色性越优异。
[0341]
[3]36℃褪色半衰期[τ1/2(sec.)]:是指在36℃照射180秒后,停止光照射,此时,试样的上述极大吸收波长处的吸光度降低至{ε(180)-ε(0)}的1/2所需的时间,作为褪色速
度的指标。该时间越短,褪色速度越快。
[0342]
[4]残存率(a
50
/a0×
100):将得到的光致变色固化物通过suga试验器株式会社制氙弧灯耐候计(xenon weather meter)x25进行促进劣化50小时。之后,在试验前后进行上述显色浓度的评价,测定试验前的显色浓度(a0)和试验后的显色浓度(a
50
),将其比值(a
50
/a0)作为残存率,作为显色的耐久性指标。残存率越高,显色的耐久性越高。
[0343]
2)溶出成分的定量
[0344]
将得到的光致变色固化物(光学物品)5.0g用甲醇进行索氏萃取48小时,萃取残留成分。对该萃取液用高效液相色谱(hplc)进行分析,算出溶出的色烯化合物的溶出率。溶出物的定量通过以菲作为标准试样的内标法求出。
[0345]
溶出率:(溶出物的定量值)/(光致变色固化物重量
×
0.01)
×
100
[0346]
应予说明,光致变色固化物重量
×
0.01是指,在制造该固化物时所使用的色烯化合物的量。
[0347]
[表8]
[0348][0349]
比较例1~3
[0350]
为了比较,使用下述式(a)~(c)表示的化合物,与实施例11同样地操作,得到光致变色隐形眼镜(光致变色光学物品),评价其特性。其结果示于表9。
[0351][0352]
[表9]
[0353][0354]
如表8和表9所示,将本发明的光致变色固化性组合物固化而得的光致变色隐形眼镜(光致变色光学物品)抑制了光致变色化合物的溶出,也具有高耐久性。另外,在体温附近
的光致变色特性也优异。
[0355]
实施例23~24
[0356]
(光致变色层叠体(光致变色固化物)的制作与评价)
[0357]
作为光致变色固化性组合物,使用将作为自由基聚合性单体的聚乙二醇二甲基丙烯酸酯(平均分子量736)/聚乙二醇二甲基丙烯酸酯(平均分子量536)/三羟甲基丙烷三甲基丙烯酸酯/γ-甲基丙烯酰氧基丙基三甲氧基硅烷/甲基丙烯酸缩水甘油酯分别以45质量份/7质量份/40质量份/2质量份/1质量份的配合比例配合而成的组合物。相对于该自由基聚合性单体的混合物100质量份,添加1质量份的实施例4或5得到的色烯化合物(化合物no.4或化合物no.5)并充分混合后,添加0.3质量份的苯基双(2,4,6-三甲基苯甲酰基)氧化膦(商品名:irgacure 819,basf公司制)、3质量份的双(1,2,2,6,6-五甲基-4-哌啶基)癸二酸酯(分子量508)、3质量份的亚乙基双(氧亚乙基)双[3-(5-叔丁基-4-羟基-间甲苯基)丙酸酯](ciba specialty chemicals公司制,irganox 245)、0.1质量份的toray dow corning co.,ltd.制商品名l7001并充分混合,制成光致变色固化性组合物。
[0358]
使用上述固化性组合物,通过层叠法得到光致变色层叠体。以下示出聚合方法。
[0359]
首先,准备中心厚为2mm且折射率为1.60的硫代氨基甲酸酯系塑料镜片作为光学基材。应予说明,对于该硫代氨基甲酸酯系塑料镜片,事先使用10%氢氧化钠水溶液在50℃进行5分钟的碱蚀刻,之后以蒸馏水实施充分清洗。
[0360]
使用旋转涂布机(1h-dx2,mikasa制),在上述塑料镜片的表面以旋转数70rpm涂布湿气固化型底漆(产品名;tr-sc-p,tokuyama株式会社制)15秒,接着以1000rpm涂布10秒。之后,将上述得到的光致变色组合物约2g以旋转数60rpm旋转涂布40秒,接着以600rpm旋转涂布10~20秒以使光致变色涂覆层的膜厚为40μm。
[0361]
在氮气环境中使用输出功率200mw/cm2的金属卤素灯,对如此在表面涂布有涂布剂的镜片照射光90秒,使涂膜固化。之后,进一步在110℃加热1小时,制作具有光致变色层的光致变色层叠体。
[0362]
对于得到的具有光致变色层的光致变色层叠体,与实施例11同样地操作,评价其特性。其结果示于表10。
[0363]
[表10]
[0364][0365]
实施例25
[0366]
第1工序
[0367]
加入4-氯,4-羟基二苯甲酮9.8g(42mmol)、碳酸钾9.9g(71.6mmol)、n,n-二甲基甲酰胺100ml,在80℃加热。在其中缓慢滴加五乙二醇单甲苯磺酸酯19.6g(50mmol)的n,n-二甲基甲酰胺100ml溶液,在80℃加热。反应结束后,冰冷,添加甲苯500ml、四氢呋喃500ml、水
500ml,进行分液。重复水清洗直至成为中性附近,在浓缩溶剂后,通过硅胶柱层析进行纯化,从而以收率85%得到下述式(22)表示的化合物。
[0368][0369]
第2工序
[0370]
添加上述式(22)表示的化合物16.2g(36mmol)、n,n-二甲基甲酰胺100ml、咪唑5.4g(79mmol),搅拌后,以冰水冷却。在其中,缓慢滴加叔丁基二甲基氯硅烷5.9g(39mmol)的n,n-二甲基甲酰胺60ml溶液。
[0371]
反应结束后,以甲苯500ml、水160ml进行分液,浓缩溶剂。在溶剂浓缩后,通过硅胶柱层析进行纯化,从而以收率98%得到下述式(23)表示的化合物。
[0372][0373]
第3工序
[0374]
添加上述式(23)表示的化合物19.8g(35mmol)、吗啉4.3g(49mmol)、叔丁醇钠4.0g(42mmol)、甲苯200ml,减压下搅拌,去除溶解氧后,添加2-二环己基膦-2',4',6'-三异丙基联苯0.33g(0.7mmol)、三(二亚苄基丙酮)二钯0.16g(0.2mmol),进行加热至80℃。反应结束后,冷却至室温,过滤不溶物。以甲苯100ml充分清洗后,在滤液中添加水300ml,进行分液。重复进行直至ph成为7-8,馏去溶剂。通过硅胶柱层析进行纯化,从而以收率89%得到下述式(24)表示的化合物。
[0375][0376]
第4工序
[0377]
添加上述式(24)的化合物19.2g(31mmol)、n,n-二甲基甲酰胺400ml,搅拌后,冷却至5-10℃。在其中缓慢添加乙炔锂的乙二胺络合物4.3g(47mmol)。
[0378]
在5-10℃反应7小时后,添加甲苯600ml、水400ml,进行分液。
[0379]
重复进行直至ph成为7-8,进行溶剂浓缩。得到下述式(25)表示的化合物。
[0380][0381]
第5工序
[0382]
添加下述式(26)表示的化合物4.6g(10mmol)、上述式(25)表示的化合物7.7g(12mmol)、对甲苯磺酸吡啶鎓0.2g(1mol)、甲苯100ml,在90℃进行反应。
[0383][0384]
在反应后,添加水100ml进行分液,重复进行直至ph为6-7。浓缩溶剂,添加四氢呋喃100ml,冷却至0-5℃后,缓慢滴加1mol/l氟化四丁基铵的四氢呋喃溶液11ml。在0-5℃搅拌直至反应结束后,添加水30ml、甲苯30ml,进行分液。重复分液直至ph成为6-7,浓缩溶剂。通过硅胶柱层析进行纯化,从而以收率85%得到下述式(27)表示的前体。
[0385][0386]
第6工序
[0387]
使用上述式(27)的前体,在实施例1中代替丙烯酰氯而使用甲基丙烯酰氯,除此以外同样地进行,以收率88%得到下述式(28)表示的色烯化合物。
[0388][0389]
该产物的元素分析值为c76.00%、h7.28%、n1.37%,与c
66h75
no
10
的计算值即c76.05%、h7.25%、n1.34%极其一致。
[0390]
另外,在测定质子核磁共振谱后,在1.0~3.0ppm附近显示基于环己烷环的亚甲基质子和甲基、乙基的21h的峰,在δ3.0~5.0ppm附近显示基于甲氧基、亚乙氧基、吗啉基的31h的峰,在δ5.6~9.0ppm附近显示基于芳香质子和烯烃质子的23h的峰。
[0391]
进而,在测定
13
c-核磁共振谱后,在δ110~220ppm附近显示基于芳香环和羰基的碳
的峰,在δ80~140ppm附近显示基于烯烃的碳的峰,在δ20~75ppm显示基于烷基的碳的峰。
[0392]
实施例26
[0393]
第1工序
[0394]
在实施例25中,代替4-氯,4-羟基二苯甲酮而使用4-羟基,4-丙氧基二苯甲酮,代替五乙二醇单甲苯磺酸酯而使用丙二醇单甲苯磺酸酯,除此以外同样地进行,合成下述式(29)表示的炔丙醇。
[0395][0396]
第2工序
[0397]
在实施例25中,代替上述式(26)的萘酚化合物而使用下述式(30),
[0398][0399]
代替上述式(25)的化合物而使用上述式(29)的化合物,除此以外同样地进行,得到下述式(31)表示的色烯化合物。
[0400][0401]
该产物的元素分析值为c77.41%、h7.24%、s3.96%,与c
52h54
o6s的计算值即c77.39%、h6.74%、s3.97%极其一致。
[0402]
另外,在测定质子核磁共振谱后,在1.0~3.0ppm附近显示基于环辛烷环的亚甲基质子和甲基、丙基的31h的峰,在δ3.0~5.0ppm附近显示基于甲氧基、亚乙氧基、丙氧基的5h的峰,在δ5.6~9.0ppm附近显示基于芳香质子和烯烃质子的18h的峰。
[0403]
进而,在测定
13
c-核磁共振谱后,在δ110~220ppm附近显示基于芳香环和羰基的碳的峰,在δ80~140ppm附近显示基于烯烃的碳的峰,在δ20~75ppm显示基于烷基的碳的峰。
[0404]
实施例27
[0405]
第1工序
[0406]
在实施例25中,代替上述式(22)的化合物而使用4-(2-羟基)乙氧基-4-甲基二苯甲酮,除此以外同样地进行,以收率95%得到下述式(32)表示的化合物。
[0407][0408]
第2工序
[0409]
实施例25中,代替上述式(23)的化合物而使用上述式(32)的化合物,代替上述式(26)的化合物而使用下述式(33)表示的化合物,
[0410][0411]
除此以外同样地进行,得到下述式(34)表示的色烯化合物。
[0412][0413]
该产物的元素分析值为c82.03%、h7.25%,与c
51h54
o5的计算值即c82.00%、h7.29%极其一致。
[0414]
另外,在测定质子核磁共振谱后,在1.0~3.0ppm附近显示基于环十二烷环的亚甲基质子和甲基的28h的峰,在δ3.0~5.0ppm附近显示基于甲氧基、亚乙氧基的7h的峰,在δ5.6~9.0ppm附近显示基于芳香质子和烯烃质子的19h的峰。
[0415]
进而,在测定
13
c-核磁共振谱后,在δ110~220ppm附近显示基于芳香环和羰基的碳的峰,在δ80~140ppm附近显示基于烯烃的碳的峰,在δ20~75ppm显示基于烷基的碳的峰。
[0416]
实施例28~37
[0417]
与实施例1同样地进行,使用表11~12表示的萘酚化合物与炔丙醇化合物,合成表13~14表示的色烯前体和色烯化合物。对于得到的产物,使用与实施例1同样的结构确认方式进行结构解析,其结果,确认为表13~14表示的结构式所示的化合物。另外,表15中示出这些化合物的元素分析值、由各化合物的结构式求出的计算值和1h-nmr谱的特征性谱。
[0418]
[表11]
[0419][0420]
[表12]
[0421][0422]
[表13]
[0423][0424]
[表14]
[0425][0426]
[表15]
[0427][0428]
实施例38~50
[0429]
与实施例11同样地进行,制作光致变色隐形眼镜并评价。
[0430]
结果记载于表16。应予说明,与表8同样地,表16中,化合物的no.与实施例的no.一致。例如,化合物no.25为实施例25中合成的色烯化合物。
[0431]
[表16]
[0432][0433]
根据表16可知,本发明的色烯化合物耐久性优异,溶出量也少。
[0434]
实施例51~52、比较例4~5
[0435]
(耐水解性的评价)
[0436]
在自由基聚合性色烯化合物(实施例27(化合物no.27)、实施例34(化合物no.34))10mg中添加2-丙醇4ml,搅拌后,添加10质量%氢氧化钠水溶液0.5ml,在室温搅拌1.5小时。
[0437]
在室温搅拌后,使用高效液相色谱(hplc)进行分析,算出色烯化合物的水解转化率。
[0438]
水解转化率:(前体色烯化合物)/(前体色烯化合物+自由基聚合性色烯化合物)
×
100
[0439]
水解转化率的值越低,表示耐水解性越优异。
[0440]
前体色烯化合物是指导入聚合性基团前的末端为羟基的化合物。其为聚合性色烯化合物的具有聚合性基团的基团水解产生的化合物。
[0441]
为了比较,使用上述式(a)和下述式(d)表示的化合物,同样地评价耐水解性。
[0442]
将这些结果汇总于表17。
[0443][0444]
[表17]
[0445][0446]
根据表17可知,本发明的色烯化合物的耐水解性也优异。特别是,根据实施例与比较例5的结果可知,在具有自由基聚合性基团的基团为相同基团的情况下,本发明的色烯化合物的耐水解性优异。这表示,通过将13位设为螺环结构,从而可以使酯键部分的空间拥挤程度变大,由此,不易引起水解。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1