用于治疗脑白质营养不良的组合物和方法以及用于鉴定治疗脑白质营养不良的有效药物的完整动物和细胞模型与流程
用于治疗脑白质营养不良的组合物和方法以及用于鉴定治疗脑白质营养不良的有效药物的完整动物和细胞模型
1.相关申请的交叉引用
2.本技术要求于2019年5月9日提交的美国临时申请号62/845,637和2019年10月23日提交的美国临时申请号62/924,910的优先权,每个前述申请的全部公开内容通过引用的方式并入本文,如同完整阐述一样。
3.以电子形式提交的材料的引用并入
4.通过efs-web提交的序列表作为名为序列表.txt.的文本文件通过引用的方式整体并入本文,该文件创建于2020年5月7日,大小为1,167字节。
技术领域
5.本发明涉及脑白质营养不良和用于改善该病症症状的改进疗法的领域。本发明还提供了用于鉴定可用于治疗或预防脑白质营养不良特别是h-abc的药剂的完整动物模型。
6.发明背景
7.在整个说明书中引用了若干出版物和专利文献,以描述本发明所属领域的现有技术。这些引用中的每一个都通过引用并入本文,如同完整阐述一样。
8.伴基底神经节和小脑萎缩的髓鞘形成不足(h-abc)是一种由tubb4a基因中偶发的突变(典型地是新发杂合突变)引起的脑白质营养不良(simons et al.,2013a)。该基因编码β微管蛋白4a蛋白,该蛋白与α微管蛋白异二聚化以组装成微管。tubb4a中的单等位基因突变导致一系列神经系统病症,从早发性脑白质病到4型成人肌张力障碍(dyt4;耳语性发音障碍)。受h-abc影响的个体在此范围内,出现在幼儿时期,通常伴有肌张力障碍(hersheson et al.,2013)、进行性步态障碍、言语和认知缺陷。通过以下特征性神经影像学特征,将它们与其他具有tubb4a突变的个体进一步区分:尾状核和壳核的髓鞘形成不足和萎缩以及小脑萎缩(van der knaap et al.,2007)。
9.在病理标本中,背侧纹状体区域和小脑颗粒层表现出神经元丢失伴有轴突肿胀和髓鞘弥漫性缺乏(simons et al.,2013a;curiel et al.,2017b)。具有h-abc典型特征的个体约占已发表病例的65%(blumkin et al.,2014;ferreira et al.,2014;miyatake et al.,2014;pizzino et al.,2014;purnell et al.,2014),并且不成比例地可能受单个常见突变p.asp249asn(166个个体队列中总突变的24.1%,以下简称为tubb4a
d249n
)影响。h-abc目前被认为是一种中间表型,介于严重影响的早期婴儿变异和青少年-成人轻度变异之间(nahhas n,2016)。
10.tubb4a在中枢神经系统(cns)中高度表达,特别是在脑的小脑和白质束中,在纹状体中的表达更为适中(hersheson et al.,2013)。在细胞水平上,tubb4a主要定位于少突胶质细胞(ol)谱系的神经元和细胞,在成熟的髓鞘化ol中表达最高(zhang et al.,2014)。尽管表达模式和相关疾病表型暗示了β微管蛋白4a蛋白在神经元和少突胶质细胞群中的功能作用,但对tubb4a突变的病理机制知之甚少。我们的小组已经在ol细胞系和小鼠小脑神经元中使用过表达研究报告了更广泛的tubb4a突变的影响。与tubb4a
wt
表达相比,在ol细胞系
中tubb4a
d249n
突变的过表达导致髓鞘基因表达降低和以更少的过程形成未成熟的ol(curiel et al.,2017b)。类似地,与tubb4a
wt
表达相比,使用导致h-abc的tubb4a
d249n
突变检查到具有较短轴突、较少树突和减少的树突分支的异常神经元表型(curiel et al.,2017b)。其他tubb4a突变突出了特异地仅在神经元和/或ol细胞系中的表型异常,表明突变特异性影响,对应于可变的临床表型。据报道,自发发生的大鼠模型,taiep大鼠,具有纯合子p.ala302thr tubb4a突变,在大脑、视神经和某些脊髓束中具有髓鞘形成不足的表型。这种特异性突变以前从未在人类中发现过。在taiep中观察到的一个有趣的特征是微管的积累,特别是在ol中以及随后的髓鞘脱失(duncan et al.,2017b)。目前没有特异性地与h-abc相关的p.asp249asn突变的动物模型。
11.显然,需要这样的模型和新治疗方法用于治疗使人衰弱的病症。
技术实现要素:
12.根据本发明,提供了h-abc的转基因小鼠模型。在一方面,该小鼠具有包含以下的基因组:在小鼠细胞中有效驱动表达的启动子,该启动子可操作地连接至编码人类突变tubb4-a蛋白的核酸,其中人类突变的tubb4蛋白在小鼠的神经元和/或少突胶质细胞中表达,并产生脑白质营养不良表型。表1提供了编码突变tubb4的核酸列表,其可用于本文所述的动物模型、细胞模型、组合物和方法。在某些实施方案中,突变的tubb4-a蛋白是tubb4a
d249n
变体。
13.本发明还提供了一种用于评估上述转基因小鼠中脑白质营养不良存在的方法,其包括:测量选自转基因小鼠的运动功能障碍、步态异常、共济失调和存活率降低中的一种或多种的脑白质营养不良症状,其中相对于缺乏变体tubb4a转基因的对照小鼠的所述症状的存在表明该小鼠患有脑白质营养不良。
14.在另一实施方案中,提供了鉴定用于治疗脑白质营养不良的候选化合物的方法。示例性方法包括将转基因小鼠或来自转基因小鼠的神经元的细胞、组织或器官与测试化合物接触;并在存在和不存在测试化合物的情况下测量与动物、细胞、组织或器官中的脑白质营养不良相关的物理参数的水平;以及将改变这些参数中的一个或多个的测试化合物鉴定为候选化合物。在某些实施方案中,与脑白质营养不良相关的物理参数选自少突胶质细胞数量减少、髓鞘形成不足、小脑颗粒神经元丢失、纹状体神经元丢失、髓鞘形成障碍、髓鞘形成延迟、步态异常、共济失调和神经元存活率降低中的一种或多种。
15.在另一方面,公开了一种鉴定用于治疗基底神经节的髓鞘形成不足和萎缩(h-abc)的候选治疗化合物的方法。示例性方法包括:将h-abc的转基因小鼠模型暴露于测试化合物;在存在和不存在测试化合物的情况下测量小鼠脑白质营养不良的一个或多个参数;以及将改善所述一个或多个参数的测试化合物鉴定为候选治疗化合物。
16.在另一方面,本发明提供了一种鉴定用于治疗基底神经节髓鞘形成不足和萎缩(h-abc)的候选治疗化合物的方法,其包括从携带tubb-4a突变的受试者和缺乏任何tubb4-a突变的对照受试者获得pbmc;重编程步骤a)中的单核细胞以产生诱导多能干细胞(ipsc);应用双重smad抑制方案以将ipsc直接分化为纹状体棘神经元,其中细胞表达一种或多种选自darpp32、ctip2、gaba和foxp1的标志物;以及将所述细胞与所述化合物接触并评估所述化合物相对于缺乏所述突变的对照细胞是否改变与脑白质营养不良表型相关的参数。在一
些实施方案中,参数选自降低的细胞存活率、改变的棘神经元标志物表达和改变的细胞形态学或信号传导中的一种或多种。可以从携带表1中列出的任何tubb-4a突变的患者中获得细胞。
17.另一种治疗h-abc的方法需要施用有效量的化合物,该化合物下调tubb4-a的整体表达,从而改善h-abc的症状。在某些方面,该化合物选自与编码突变的tubb4a的基因或mrna 充分互补的短发夹rna(shrna)、短干扰rna(sirna)、反义rna、反义dna、嵌合反义dna/rna、微小rna和核酶。
18.在另一种治疗方法中,公开了一种对tubb4a编码核酸进行基因组编辑的方法。示例性方法包括向受试者施用载体,其中所述受试者是人类,并且所述载体包含crispr介导的碱基编辑器3(be3)系统和引导rna(grna)的核酸组分,grna靶向tubb4a基因中的突变。通过碱基编辑治疗基因在治疗基因中引入修饰的密码子,其中碱基编辑由载体进行。
19.用于治疗或预防携带有突变的tubb4a基因的受试者的基底神经节髓鞘形成不足和萎缩(h-abc)脑白质营养不良的另一种方法包括施用有效量的增加野生型tubb4-a蛋白表达的化合物,从而改善h-abc的症状。在某些实施方案中,通过引入表达载体或病毒载体或包含野生型tubb4-a编码核酸的纳米颗粒,通过野生型tubb4-a的过表达来实现增加的表达。
20.最后,本发明提供了用于实施前述权利要求中任一项的方法的试剂盒。
附图说明
21.图1a
–
1m:tubb4a
d249n/d249n
小鼠表现出存活率下降、步态异常和进行性运动功能障碍(图1a)显示小鼠tubb4a基因和wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的测序图的示意图。红色箭头表示外显子4中745位核苷酸;wt显示g的一个峰,tubb4a
d249n
小鼠显示“g”和“a”各一个峰,和tubb4a
d249n/d249n
小鼠显示t的2个峰。(图1b)与wt相比,具有严重肌张力障碍和共济失调的末期(es)tubb4a
d249n/d249n
小鼠(~p35-p40)的代表性图像。(图1c)tubb4a
d249n/d249n
和tubb4a
d249n
小鼠与wt同窝仔鼠的kaplan-meier存活率曲线(gehan-breslow-wilcoxon测试,n=28)。(图1d)显示行为测试时间过程的示意图。(图1e)爬行和行走的图示:对于移动测量,对爬行和行走进行评分(见表3);在整个爬行过程中,如(#)所示整个后爪触地,并且尾巴放低或触地(红色箭头所示)。当从爬行过渡到行走时,头开始抬起。仅当后爪的脚趾触地并且脚跟抬高时才能看到行走,用[##]表示。(图1f)tubb4a
d249n/d249n
小鼠在p7、p10和p14的行走缺陷。通过双因素anova,然后进行tukey事后分析来进行统计分析,n=10。(图1g)与wt同窝仔鼠相比,tubb4a
d249n
和tubb4a
d249n/d249n
在p7、p21和p35的走动角度的代表性图像。(图1h)在p7、p14、p21、p28和p35,tubb4a
d249n
和tubb4a
d249n/d249n
与wt同窝仔鼠相比的走动角度的测量。通过双因素anova,然后进行tukey事后分析来进行统计分析,n=14。(图1i)悬挂式握力设置示意图。(图1j)与wt相比,通过tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的倒落角(inverted fall angle)测量的握力。通过单因素anova,然后进行tukey事后分析来进行统计分析,n=10。(图1k)表明tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p21、p28和p35相对于wt的下落延迟(以秒为单位)的旋转棒测试,n=14。(图1l)tubb4a
d249n
、tubb4a
d249n/d249n
和wt从p7开始的的重量测量图,n=10。(图1m)tubb4a
d249n
、tubb4a
d249n/d249n
和wt小鼠的翻正反射(righting reflex)变化,n=14。通过重复测量双因素anova,然后进行tukey事后分析来进
行统计分析,n=10。数据表示为平均值和sem。*p《0.05,**p《0.01,***p《0.001。
[0022]
图2a-2d tubb4a
d249n
小鼠在1岁时表现出髓鞘形成不足(图2a)tubb4a
d249n
小鼠与wt相比的kaplan-meier存活率曲线(gehan-breslow-wilcoxon检验,n=10)。(图2b)tubb4a
d249n
小鼠在9个月和1岁时相对于wt的旋转杆测试表现,n=7-8。(图2c)通过双因素anova,然后进行tukey事后检验来进行统计检验。(图2d)在es的wt和tubb4a
d249n
小鼠中的plp(绿色)。
[0023]
图3a
–
3z:tubb4a
d249n/d249n
小鼠表现出严重的髓鞘形成发育延迟(图3a)显示免疫组织化学试验的时间过程的示意图。(图3b)显示胼胝体(cc)和小脑(cb)分析的示意图。(图3c-3d)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
的铬花青(eri-c)染色(髓鞘[蓝色])的代表性终末期图像(es)(图3c)和量化(图3d)。比例尺=250μm(
‘
$$$’表示p21和es之间的显著差异)。(图3e-3f)wt、tubb4a
d249n
和tubb4a
d249n/d249n
在胼胝体中的eri-c染色的代表性es图像(图3e)和量化(图3f)。比例尺=1mm。(
‘
$$$’表示p21和es之间的显著差异)。(图3g-3j)在1岁tubb4a
d249n/d249n
小鼠中看到的cc中eri-c染色(图3g和图3h)和mbp免疫染色(图3i和图3j)损失的代表性图像和量化。(图3k-3l)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p14、p21和es的plp(绿色)的代表性终末期图像(图3k)和量化(图3l)。比例尺=250μm。(图3m-3n)前脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p21和es的归一化plp蛋白水平的代表性western印迹图像(图3m)和量化(图3n)。(图3o-3p)小脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p14、p21和es的plp(绿色)的代表性终末期图像(图3o)和量化(图3p)。比例尺=1mm。(图3q-3r)小脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p21和es的归一化plp蛋白水平的代表性western印迹图像(图3q)和量化(图3r)。(图3s-3t)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p14、p21和es的mbp(红色)的代表性es图像(图3s)和量化(图3t)。比例尺=250μm。(图3u-3v)前脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p21和es的归一化mbp蛋白水平的代表性western印迹图像(图3u)和量化(图3v)。(图3w-3x)小脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p14、p21和es的mbp(红色)的代表性es图像(图3w)和量化(图3x)。比例尺=1mm。(图3y-3z)前脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p21和es的归一化mbp蛋白水平的代表性western印迹图像(图3y)和量化(图3z)。通过双因素anova,然后进行tukey事后检验来进行统计检验。代表性数据,其中对于p14和p21,n=4只小鼠/组(除了对于p14时间点的tubb4a
d249n n=3),而对于es,n=3只小鼠/组。数据表示为平均值和sem。*p《0.05和***和
$$$
p《0.001。
[0024]
图4a
–
4f:脊髓的电子显微镜分析显示tubb4a
d249n
和tubb4a
d249n/d249n
小鼠表现出髓鞘形成不足和髓鞘形成障碍(图4a-f)
[0025]
来自终末期wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的腹侧脊髓的代表性电子显微镜(em)图像。比例尺=1μm。(图4a-f)脊髓的更高放大倍数显示wt、tubb4a
d249n
和tubb4a
d249n/d249n
动物的髓鞘厚度以及巨噬细胞(m)介导的tubb4a
d249/d249n
组织中轴突(蓝色星号)的吞噬作用。比例尺=800nm。
[0026]
图5a-5j:视神经的电子显微镜分析表明tubb4a
d249n
和tubb4a
d249n/d249n
小鼠表现出髓鞘形成不足和髓鞘形成障碍(图5a-5c和图5h-5j)来自终末期wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的视神经的代表性电子显微镜(em)图像。比例尺=800nm。(图5a-5c和图5h-5j)显示wt、tubb4a
d249n
和tubb4a
d249n/d249n
动物中髓鞘厚度的视神经的更高放大倍数。
红色星号=无髓鞘轴突,黑色星号=薄髓鞘轴突。比例尺=400nm。(图5d)巨噬细胞(m)介导tubb4a
d249/d249n
组织中轴突(蓝色星号)的吞噬作用。比例尺=2μm。(图5e)wt、tubb4a
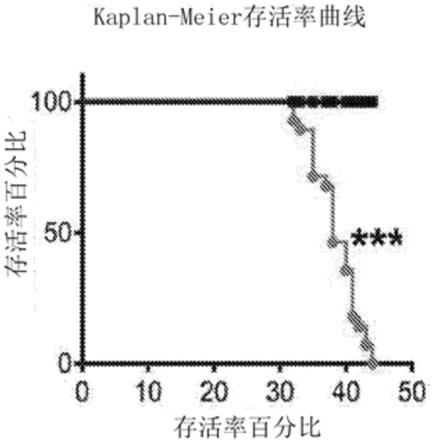
d249n
和tubb4a
d249n/d249n
组织的视神经中的g比率测量值(图5f)wt、tubb4a
d249n
和tubb4a
d249n/d249n
组织的g-比率对轴突直径的散点图。(图5g)绘制了所有组的轴突直径。每只动物计数50个轴突,每组n=3只动物,数据表示为平均值和sem。对数据集进行单因素anova,然后进行tukey事后检验。*p《0.05,***p《0.001。
[0027]
图6a
–
6g:tubb4a
d249/d249n
小鼠在p21显示髓鞘形成不足(图6a)显示免疫组织化学试验的时间过程的示意图。(图6b)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
的铬花青(eri-c)染色(髓鞘[蓝色])的代表性p21图像。比例尺=1mm。(图6c)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠plp(绿色)的代表性p21图像。比例尺=250μm。(图6d)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠mbp(红色)的代表性p21图像。比例尺=250μm。(图6e)小脑中wt、tubb4a
d249n
和终末期的tubb4a
d249n/d249n
的铬花青(eri-c)染色(髓鞘[蓝色])的代表性p21图像。比例尺=1mm。(图6f)小脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠plp(绿色)的代表性p21图像。比例尺=1mm。(图6g)小脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠mbp(红色)的代表性p21图像。比例尺=250μm。
[0028]
图7a-7j:tubb4a
d249n/d249n
小鼠显示减少的少突胶质细胞(ol)的数量(图7a)显示免疫组织化学试验的时间过程的示意图。(图7b)显示用于进行计数的胼胝体区域的示意图。(图7c)在终末期(es)的wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中aspa阳性ol的代表性图像。比例尺=2μm和25μm。(图7d)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中在p14、p21和es的aspa阳性ol计数/mm2的量化。(图7e)在es的wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中双阳性ng2+olig2+的代表性图像。比例尺=50μm和25μm。(图7f)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中在p14、p21和es的双阳性ng2+olig2+计数/mm2的量化。(图7g)两个独立实验的代表性数据,其中对于p14和p21,n=4只小鼠/组(除了对于p14时间点的tubb4a
d249n
n=3),而对于es,n=3只小鼠/组。(图7h)wt、tubb4ad249n/+和es tubb4ad249n/d249n小鼠在p14、p21和~p35-p40的双阳性ng2+半胱天冬酶细胞/mm2的定量。(图7i)在es的wt、tubb4ad249n/+和tubb4ad249n/d249n小鼠中双阳性ng2+ki-67细胞的代表性图像。(图7j)wt、tubb4ad249n/+和es tubb4ad249n/d249n小鼠在p14、p21和~p35-p40的双阳性ng2+ki-67细胞/mm2的定量。通过双因素anova,然后进行tukey事后检验来进行统计检验。数据表示为平均值和sem。*p《0.05和***p《0.001。
[0029]
图8a
–
8g:tubb4a
d249/d249n
小鼠在p14显示髓鞘形成不足(图8a)显示免疫组织化学试验的时间过程的示意图。(图8b)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
的铬花青(eri-c)染色(髓鞘[蓝色])的代表性p14图像。比例尺=1mm。(图8c)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠plp(绿色)的代表性p14图像。比例尺=250μm。(图8d)胼胝体中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠mbp(红色)的代表性p14图像。比例尺=250μm。(图8e)小脑中wt、tubb4a
d249n
和终末期的tubb4a
d249n/d249n
的铬花青(eri-c)染色(髓鞘[蓝色])的代表性p14图像。比例尺=1mm。(图8f)小脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠plp(绿色)的代表性p14图像。比例尺=1mm。(图8g)小脑中wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠mbp(红色)的代表性p14图像。比例尺=250μm。
[0030]
图9a-9j:tubb4a
d249n/d249n
小鼠表现出严重的小脑颗粒神经元丢失和显著的纹状体
神经元丢失(图9a)显示免疫组织化学试验的时间过程的示意图。(图9b)显示了wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p40的全脑支架(whole brain mount)的示意图。(图9c)wt和tubb4a
d249n/d249n
小鼠的小脑在p21和p40的nissl染色图像。比例尺=1mm。(图9d)显示wt和tubb4a
d249n/d249n
小鼠在p21和终末期(es)的小脑颗粒神经元的neun(绿色)的代表性图像。比例尺=1mm。(图9e)在p14、p21和es小脑颗粒神经元计数/mm2的量化。(图9f)wt和tubb4a
d249n/d249n
小鼠在p21和es的由neun(绿色)和裂解的半胱天冬酶3(红色)染色的双免疫阳性小脑颗粒神经元(如白色箭头所示)的代表性图像。比例尺=25μm。(图9h)显示用于量化神经元计数的区域(虚线框)的纹状体示意图。比例尺=1mm。(图9i)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在es被neun(绿色)染色的纹状体神经元的代表性图像。比例尺=100μm。(图9j)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中在p14、p21和es的纹状体神经元计数/mm2的量化。通过双因素anova,然后进行tukey事后检验来进行统计检验。两个独立实验的代表性数据,其中对于p14和p21,n=4只小鼠/组(除了对于p14时间点的tubb4a
d249n n=3),而对于es,n=3只小鼠/组。数据表示为平均值和sem。*p《0.05和***p《0.001。
[0031]
图10a
–
10c:tubb4a
d249/d249n
小鼠表现出髓鞘形成不足wt和tubb4a
d249n/d249n
在p14(图10a)、p21(图10b)和es(图10c)的矢状切片的代表性eri-c(髓鞘)染色图像(比例尺=1mm)。
[0032]
图11a-11k:来自tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的少突胶质细胞和神经元显示出减少的分支和过程(图11a-c)从wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠分离的plp标记的少突胶质细胞(ol)的代表性图像。比例尺=50μm。(图11d)在来自wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的盖玻片中对olig2标记细胞的数量进行计数,并将其绘制为wt动物中olig2+细胞的百分比。(图11e)将从wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠量化的plp+细胞总数绘制为wt动物中plp+细胞的百分比。(图11f)将来自总olig2+细胞的成熟plp+细胞数绘制为wt动物的百分比。将实验独立重复至少3次。(图11g)用tuj1(轴突标记)和map2(树突标记)染色的来自wt小鼠的皮层神经元的代表性图像。(图11h)用tuj1和map2染色的来自tubb4a
d249/d249n
小鼠的皮层神经元的代表性图像。比例尺=75μm。(图11i)接种后1周存活的神经元的数量被量化并绘制为wt神经元的百分比。(图11j)使用neurite示踪剂插件测量轴突长度并对所有组进行绘制。(图11k)使用neurite示踪剂插件测量树突长度并对所有组进行绘制。数据表示为平均值和sem。对数据集进行单因素anova,然后进行tukey事后检验。*p《0.05,***p《0.001。
[0033]
图12a-12e:tubb4a
d249/d249n
小鼠在p14和p21显示少突胶质细胞数量减少(图12a-b)在p14(图12a)和p21(图12b),wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中aspa阳性ol的代表性图像。比例尺=50μm和25μm。(图12c-12d)在p14(图12c)和p21(图12d),wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中双阳性ng+olig2+的代表性图像。比例尺=50μm和25μm。(图12e)在p14、p21和es olig2+细胞计数的量化。通过双因素anova,然后进行tukey事后检验来进行统计检验。数据表示为平均值和sem。
[0034]
图13a-13f:微管聚合在tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中受到影响(图13a)基于来自wt、tubb4a
d249n
和tubb4a
d249n/d249n
皮层神经元的eb3跟踪生成的示例性kymograph。(图13b)绘制了每100μm eb3彗星数量的图,跟踪时间为10分钟。(图13c)基于eb3运输的wt、tubb4a
d249n
和tubb4a
d249n/d249n
微管聚合的速度图。(图13d-e)对wt、tubb4a
d249n
和tubb4a
d249n
/d249n eb3彗星绘制的总运行时间(图13d)和运行时间的直方图(图13e)。(图13f)对wt、tubb4a
d249n
和tubb4a
d249/d249n eb3彗星绘制的总运行长度。数据表示为平均值和sem。对数据集进行单因素anova,然后进行tukey事后检验。*p《0.05,**p《0.001,***p《0.001。
[0035]
图14a
–
14e:tubb4a
d249/d249n
小鼠表现出类似的purkinje神经元计数(图14a)wt、tubb4a
d249n
和tubb4a
d249/d249n
小鼠在p14小脑颗粒神经元和半胱天冬酶染色的代表性图像。比例尺=50μm和25μm。(图14b)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p14和p21的纹状体神经元的代表性图像。比例尺=100μm。(图14c)wt和tubb4a
d249n/d249n
小鼠在p40的nissl染色。比例尺=1mm。(图14d)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p21和终末期被钙结合蛋白染色的purkinje神经元的代表性图像。比例尺=100μm。(图14e)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p21和终末期的purkinje神经元计数/mm2的量化。通过双因素anova,然后进行tukey事后检验来进行统计检验。数据表示为平均值和sem。
[0036]
图15a-15b:tubb4a
d249/d249n
小鼠在p14和p21显示ol细胞死亡(图15a)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p14的双阳性olig2+半胱天冬酶的代表性图像。(图15b)wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠在p21的双阳性olig2+半胱天冬酶的代表性图像。比例尺=50μm和25μm。
[0037]
图16a-16d:野生型(图16a)和tubb4a
d249/d249n
(图16b)细胞的map2和dapi染色。来自tubb4a
d249n ipsc衍生神经元的总神经元(图16c)和纹状体神经元(图16d,ctip2+神经元)与对照ipsc衍生神经元相比存活率降低,并且(图16e)tubb4a
d249n
具有增加的细胞凋亡和神经病理学。(图16f-g)crispr介导的对照患者系中tubb4a 的缺失不影响神经元的发育/形成。*p《0.05,**p《0.01,***p《0.001。
[0038]
图17a-17b:tubb4a的缺失在tubb4
ad249n msn中具有神经保护作用总神经元(图17a)和中型多棘神经元(图17b)tubb4
ad249n msn的量化。
[0039]
图18a-18c:(图18a)aso电穿孔图(图18b)aso工作原理图(图18c)aso文库筛选后两种有前景的aso的选择。***p《0.0001。
[0040]
图19:h-abc的体内全动物模型和治疗方案的示意图。
[0041]
图20a-20c:在已建立的tubb4a
d249n/d249n
小鼠模型中下调tubb4a的治疗效果。将建立的小鼠模型与tubb4a敲除(ko)小鼠杂交,这些小鼠存活且看起来正常。(图20a)tubb4a转基因小鼠杂交图。(图20b)与tubb4a
d249n/d249n
小鼠相比,所得的tubb4a
d249n/ko
小鼠表现出改善的运动功能和增加的存活率,与tubb4a
d249n/d249n
小鼠(~p35-p40)相比,tubb4a
d249n/ko
(~p108)的存活期延长。(图20c)tubb4a
d249n/ko
相较于tubb4a
d249n/d249n
的基于旋转杆表现的改善的运动功能(n=2-3,***p《0.0001)。
[0042]
图21a-21d:评估aso作为可行的治疗靶点。使用小鼠oli-neu细胞筛选aso文库。两种有效的aso(aso 1316和1851)显示出最大的tubb4a敲降。(图21a)在oli-neu细胞中通过qrt-pcr体外筛选aso文库后选择两种有前景的aso。***p《0.0001。以可变aso剂量(25、10、5、2、1和0.5μg/g剂量)单次脑室内(icv)推注施用建立了剂量反应。选择了毒性最小的最有效的aso 1316(数据未显示)。(图21b)在p1 tubb4a
d249n/d249n
小鼠中的2μg/g剂量的单次icv注射,表明与对照小鼠(pbs,加扰的aso)相比,经处理的小鼠的存活率增加。(图21c)与对照小鼠(pbs,加扰的aso)相比,用tubb4aaso处理的tubb4a
d249n/d249n
小鼠自p34-p37开始也表出癫痫发作减少。(图21d)此外,如在p28和p35通过旋转杆测量的,这些小鼠表现出运动功能
的显著改善(nc5-加扰的aso;*p《0.01,**p《0.001,***p《0.0001)。
[0043]
图22:在培养的oli-neu细胞中的gfp-wt-tubb4a的过表达导致mbp、plp和cnp mrna 水平增加,如qrt-pcr中所见(n=4-6,***p《0.05)。(空白-载体对照)
具体实施方式
[0044]
基底神经节和小脑的髓鞘形成不足和萎缩(h-abc)是一种罕见的髓鞘形成不足性脑白质营养不良,与微管蛋白α4(tubb4a)的因果变异相关;p.asp249asn(d249n)是一种在大多数受影响个体中反复出现的变异。tubb4a中的单等位基因突变还可能导致更大范围的神经系统病症,从早发性脑病到4型成人肌张力障碍(耳语性发音障碍)。h-abc在此范围内,通常始于儿童早期,其特征是肌张力障碍、共济失调、步态改变和进行性运动功能障碍,伴有在生命的第一个十年结束前丧失行走能力。迄今为止,没有可用于这种进行性和致残性儿科病症的治疗方法。为了解tubb4a突变如何导致h-abc并促进治疗策略的开发和临床前测试,我们的团队使用crispr-cas9方法开发了一种携带杂合(tubb4a
d249n
)或纯合(tubb4a
d249n/d249n
)tubb4a突变的敲入小鼠模型。
[0045]
我们现在提供第一个经典h-abc小鼠模型(tubb4a
d249n/d249n
),其表现出存活率下降、伴有震颤的渐进性运动功能障碍、步态异常和共济失调,从而囊括了该疾病的表型特征。在出生后第14天(p14)、p21和终末期p40使用免疫标记和western印迹对tubb4a
d249n/d249n
小鼠的神经病理学评估显示髓鞘形成的初始延迟,随后是最终的髓鞘脱失。随着时间的推移,髓鞘蛋白会减少,并且aspa阳性少突胶质细胞(cns中的髓鞘形成细胞)急剧减少。用于电子显微镜的超薄脑切片进一步证明了这些小鼠的脊髓和视神经髓鞘形成不足和髓鞘持续丢失。此外,对tubb4a
d249n/d249n
小鼠培养物中的少突胶质细胞的体外研究表明成熟度和髓鞘标志物降低。同样,神经病理学表明了纹状体和小脑颗粒细胞中的神经元严重丢失。此外,还注意到培养物中神经元的影响,其中来自tubb4a
d249n/d249n
小鼠的细胞中神经元存活率降低以及微管动力学不稳定。tubb4a
d249n/d249n
小鼠为h-abc提供了一种新的小鼠模型,并表明了这种病症中细胞生理学的复杂性,以及tubb4a突变引起的潜在微管不稳定性,从而导致对少突胶质细胞、纹状体神经元和小脑颗粒细胞的细胞自主影响,以及严重的神经发育表型。
[0046]
在其他研究中,我们提供了来自从h-abc患者获得的外周血样本的重编程的、诱导的多能干细胞系。这些细胞系的使用揭示了通过使用靶向该序列的核酸下调突变体tubb-4a编码核酸来治疗脑白质营养不良的新的治疗范例。在替代方法中,载体在感兴趣的位点提供过表达野生型tubb-4a。tubb-4a的过表达与增加的mbp、plp和cnp mrna水平相关,并且应该缓解需要此类治疗的受试者的h-abc症状。
[0047]
我们还开发了新的治疗性反义寡核苷酸,可有效下调tubb4a的表达,从而为治疗脑白质营养不良提供一种新方法。
[0048]
定义
[0049]
通过参考形成本公开的一部分的以下详细描述,可以更容易地理解本主题。应当理解,本发明不限于本文描述和/或示出的特定产品、方法、条件或参数,并且本文所用的术语仅用于通过示例的方式描述特定实施方案,而不旨在限制所要求保护的发明。
[0050]
除非本文另有定义,否则与本技术相关的科技术语应具有本领域普通技术人员通
常理解的含义。此外,除非上下文另有要求,单数术语应包括复数,而复数术语应包括单数。
[0051]
除非另有说明,否则在上文和本公开全文中使用的以下术语和缩写应理解为具有以下含义。
[0052]
在本公开中,单数形式“一个”、“一种”和“该”包括复数引用,并且对特定数值的引用至少包括该特定值,除非上下文另有明确指示。因此,例如,提及“一种化合物”是指本领域技术人员已知的一种或多种此类化合物及其等同物,等等。如本文所用,术语“多种”是指多于一种。当表达值的范围时,另一实施方案包括从一个特定值和/或至另一特定值。同样,当通过使用先行词“约”将值表示为近似值时,可以理解为所述特定值形成另一实施方案。所有范围都是包含性的和可组合的。
[0053]
如本文所用,术语“组分”、“组合物”、“化合物的组合物”、“化合物”、“药物”、“药物活性剂”、“活性剂”、“治疗剂”、“疗法”、“治疗”或“药物”在本文中可互换使用以指代一种或多种化合物或物质的组合物,当施用于受试者(人类或动物)时,通过局部和/或全身作用诱导所需的药理学和/或生理学效果。术语"试剂"和"测试化合物”表示化学化合物、化学化合物的混合物、生物大分子或由生物材料制成的提取物,所述生物材料例如细菌、植物、真菌或动物(尤其是哺乳动物)细胞或组织。生物大分子包括sirna、shrna、反义寡核苷酸、肽,肽/dna复合物、以及任何基于核酸的分子,其能够调节本文所述的含tubb4a的核酸或其编码的蛋白质的活性。
[0054]
如本文所用,“tubb4a”是指编码β微管蛋白家族成员的基因。β微管蛋白是异二聚化和组装形成微管的两个核心蛋白家族(α和β微管蛋白)之一。该基因的突变导致髓鞘形成性脑白质营养不良-6和常染色体显性扭转性肌张力障碍-4和h-abc,现在更常称为tubb4a相关性脑白质病。tubb4a的参考序列包括例如nm_001289123.1、nm_001289127.1、nm_001289129.1,可在genbank上找到。交替剪接导致编码不同的同种型的多个转录变体。野生型tubb4a蛋白序列见于uniprot,登录号p04350-tbb4a_human。多种已知与人类疾病相关的tubb4a变体已被鉴定并列于下表1中。本发明专注于d249n变体,然而这些发现可推广到其他现有的tubb4a突变。
[0055][0056]
表2列出了与不同形式的tubb4a相关脑白质病相关的某些氨基酸变化。
[0057]
[0058][0059]
如本文所用,术语“治疗”或“疗法”(以及其不同形式)包括预防性(例如预防的)、治愈性或姑息性治疗。如本文所用,术语“治疗”包括缓解或减少病况、疾病或病症的至少一种不利或负面影响或症状。
[0060]
术语“受试者”、“个体”和“患者”在本文中可互换使用,是指动物,例如人类,向其提供使用根据本发明的药物组合物的治疗,包括预防性治疗。如本文所用,术语“受试者”是指人类和非人类动物。术语“非人类动物”和“非人类哺乳动物”在本文中可互换使用并且包括所有脊椎动物,例如哺乳动物,例如非人类灵长类动物(特别是高等灵长类动物)、绵羊、狗、啮齿动物(例如小鼠或大鼠)、豚鼠、山羊、猪、猫、兔、牛、马和非哺乳动物,例如爬行动物、两栖动物、鸡和火鸡。
[0061]
术语“多核苷酸”、“核苷酸”、“核苷酸序列”、“核酸”和“寡核苷酸”可互换使用。它们是指任何长度的核苷酸的聚合形式,脱氧核糖核苷酸或核糖核苷酸,或其类似物。多核苷酸可包含一种或多种修饰的核苷酸,例如甲基化核苷酸和核苷酸类似物。如果存在,可以在聚合物组装之前或之后对核苷酸结构进行修饰。核苷酸序列可能被非核苷酸组分中断。聚合后可进一步修饰多核苷酸,例如通过与标记组分缀合。
[0062]
如本文所用,术语“野生型”是技术人员理解的本领域术语,是指生物体、菌株、基因或特征的典型形式,如其在自然界中出现的,有别于突变体或变体形式。如本文所用,术语“变体”应理解为具有偏离野生型或包含非天然成分的模式的品质的表现。
[0063]
术语“非自然存在的”或“工程化的”可互换使用,表示人工参与。当涉及核酸分子或多肽时,这些术语是指核酸分子或多肽至少基本上不含它们在自然界中与其天然相关并且如在自然界中存在的至少一种其他成分。
[0064]
术语“有效量”或“治疗有效量”是指足以产生有益或所需结果的药剂的量。治疗有
效量可根据以下一项或多项而变化:受治疗的受试者和疾病状况、受试者的体重和年龄、疾病状况的严重程度、施用方式等,这些可由本领域普通技术人员容易地确定。该术语还适用于将提供用于通过本文所述的任何一种成像方法进行检测的图像的剂量。具体剂量可根据以下一项或多项而变化:选择的特定药剂、要遵循的给药方案、是否与其他化合物联合施用、施用时间、要成像的组织以及携带它的物理递送系统。
[0065]
除非另有说明,否则本发明的实践采用免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna的常规技术,这些技术在本领域的技术范围内。参见sambrook,fritsch和maniatis,molecular cloning:a laboratory manual,第二版(1989);current protocols in molecular biology(f.m.ausubel等人编,(1987));the series methods in enzymology(academic press,inc.):pcr 2:apractical approach(m.j.macpherson,b.d.hames和g.r.taylor编(1995))、harlow和lane,编.(1988)antibodies,alaboratory manual,以及animal cell culture(r.i.freshney,编(1987))。
[0066]
本发明的多个方面涉及包含一种或多种载体的载体系统或载体本身。载体可以设计用于在原核或真核细胞中表达crispr转录物(例如核酸转录物、蛋白质或酶)。例如,crispr转录物可以在细菌细胞(例如大肠杆菌)、昆虫细胞(使用杆状病毒表达载体)、酵母细胞或哺乳动物细胞中表达。合适的宿主细胞还在goeddel,gene expression technology:methods in enzymology 185,academic press.san diego,calif.(1990)中进行了讨论。替代地,重组表达载体可以在体外转录和翻译,例如使用t7启动子调控序列和t7聚合酶。
[0067]
在一些实施方案中,使用哺乳动物表达载体,载体能够驱动一种或多种序列在哺乳动物细胞中的表达。哺乳动物表达载体的例子包括pcdm8(seed,1987.nature 329:840)和pmt2pc(kaufman,et al.,1987.embo j.6:187-195)。当用于哺乳动物细胞时,表达载体的控制功能通常由一个或多个调控元件提供。例如,常用的启动子来源于多瘤病毒、腺病毒2、巨细胞病毒、猿猴病毒40,以及本文公开的和本领域已知的其他启动子。对于原核细胞和真核细胞的其他合适的表达系统,参见例如第16章和第17章,sambrook,等人,molecular cloning:a laboratory manual.第二版,cold spring harbor laboratory,cold spring harbor laboratory press,cold spring harbor,n.y.,1989。
[0068]
在一些实施方案中,重组哺乳动物表达载体能够引导核酸优先在特定细胞类型中表达(例如,使用组织特异性调控元件来表达核酸)。组织特异性调控元件是本领域已知的。合适的组织特异性启动子的非限制性例子包括:白蛋白启动子(肝脏特异性;pinkert,et al.,1987.genes dev.1:268-277)、淋巴特异性启动子(calame和eaton,1988.adv.immunol.43:235-275)、特别是t细胞受体的启动子(winoto和baltimore,1989.embo j.8:729-733)和免疫球蛋白(baneiji,et al.,1983.cell 33:729-740;queen和baltimore,1983.cell 33:741-748)、神经元特异性启动子(例如,神经丝启动子;byrne和ruddle,1989.proc.natl.acad.sci.usa 86:5473-5477)、胰腺特异性启动子(edlund,et al.,1985.science 230:912-916)和乳腺特异性启动子(例如,乳清启动子,美国专利号4,873,316和欧洲申请公开号264,166)。发育调节的启动子也包括在内,例如鼠hox启动子(kessel和gruss,1990.science 249:374-379)和α-胎蛋白启动子(campes和tilghman,1989.genes dev.3:537-546)。为了获得高水平的表达,可以对tubb4-a编码核酸进行密码
子优化。
[0069]
一般而言,“crispr系统”统指参与crispr相关(“cas”)基因表达或指导其活性的转录物和其他元件,包括编码cas基因的序列、tracr(反式激活crispr)序列(例如tracrrna 或活性部分tracrrna)、tracr-mate序列(包括在内源性crispr系统背景下的“同向重复”和tracrrna处理的部分同向重复)、引导序列(在内源性crispr系统的背景下也称为“间隔序列”),或来自crispr基因座的其他序列和转录物。在一些实施方案中,crispr系统的一个或多个元件源自i型、ii型或iii型crispr系统。在一些实施方案中,crispr系统的一个或多个元件源自包含内源性crispr系统的特定生物体,例如化脓性链球菌。一般而言,crispr系统的特征在于促进在靶序列位点形成crispr复合物的元件(在内源性crispr系统的背景中也称为前间隔序列(protospacer))。在crispr复合物形成的背景中,“靶序列”是指指导序列被设计成与之具有互补性的序列,其中靶序列和指导序列之间的杂交促进了crispr复合物的形成。不一定需要完全互补,只要有足够的互补性以导致杂交并促进crispr复合物的形成。靶序列可包含任意的多核苷酸,例如dna或rna多核苷酸。在一些实施方案中,靶序列位于细胞的细胞核或细胞质中。在一些实施方案中,靶序列可以在真核细胞的细胞器内,例如线粒体或叶绿体。可用于重组到包含靶序列的靶基因座中的序列或模板被称为“编辑模板”或“编辑多核苷酸”或“编辑序列”。在本发明的方面,外源模板多核苷酸可称为编辑模板。在本发明的一个方面中,重组是同源重组。
[0070]
在一些实施方案中,将驱动crispr系统的一种或多种元件的表达的一种或多种载体引入宿主细胞,使得crispr系统的元件的表达指导crispr复合物在一个或多个靶位点处的形成。例如,cas酶、与tracr-mate序列连接的引导序列和tracr序列可以各自与单独载体上的单独调控元件可操作地连接。替代地,由相同或不同调控元件表达的两个或多个元件可以组合在单个载体中,其中一个或多个额外的载体提供未包括在第一载体中的crispr系统的任何组件。在单个载体中组合的crispr系统元件可以任何合适的取向排列,例如一个元件相对于第二个元件位于5'(“上游”)或相对于第二个元件位于3'(“下游”)。一个元件的编码序列可以位于与第二个元件的编码序列相同或相反的链上,并且取向相同或相反。在一些实施方案中,单个启动子驱动编码crispr酶的转录物的表达,和引导序列、tracr mate序列(任选地可操作地连接至指导序列)和嵌入一个或多个内含子序列中的tracr序列(例如,各自在不同的内含子中,两个或多个在至少一个内含子中,或全部在单个内含子中)的一种或多种的表达。在一些实施方案中,crispr酶、引导序列、tracr mate序列和tracr序列可操作地连接至同一启动子并从同一启动子表达。
[0071]
在一些实施方案中,载体包含一个或多个插入位点,例如限制性内切核酸酶识别序列(也称为“克隆位点”)。在一些实施方案中,一个或多个插入位点(例如约或多于约1、2、3、4、5、6、7、8、9、10或更多个插入位点)位于一个或多个载体的一个或多个序列元件的上游和/或下游。在一些实施方案中,载体包含tracr mate序列上游的插入位点,和任选地与tracr mate序列可操作地连接的调控元件的下游的插入位点,从而在将引导序列插入插入位点后并在表达时引导序列指导crispr复合物与真核细胞中的靶序列的序列特异性结合。在一些实施方案中,载体包含两个或更多个插入位点,每个插入位点位于两个tracr mate序列之间以允许在每个位点插入引导序列。在这样的排列中,两个或更多个引导序列可以包含单个引导序列的两个或更多个拷贝、两个或更多个不同的引导序列、或这些的组合。当
使用多个不同的引导序列时,可以使用单个表达构建体将crispr活性靶向细胞内的多个不同的对应靶序列。例如,单个载体可包含约或多于约1、2、3、4、5、6、7、8、9、10、15、20或更多个引导序列。在一些实施方案中,可提供约或多于约1、2、3、4、5、6、7、8、9、10或更多个此类含引导序列的载体,并任选地递送至细胞。
[0072]
在替代实施方案中,crispr介导的碱基编辑器是碱基编辑器4(be4)而不是be3。值得注意的是,碱基编辑可用于改变表1中列出的任何突变核酸。
[0073]
在一些实施方案中,该方法还包括评估窗口内的c碱基对另一个碱基的改变。在实施方案中,如果be3 pam序列(ngg)远离靶胞嘧啶碱基13-17个核苷酸,则选择grna。在特定的实施方案中,改变是在有义链上将c改变为t,并将修饰的密码子改变为无义密码子。在额外的实施方案中,改变是在反义链上将g改变为a,并将修饰的密码子改变为无义密码子。在另外的实施方案中,改变是在有义链上将c改变为t,并且这种变化是一种错义变体。在额外的实施方案中,改变是在反义链上将g改变为a,并且这种变化是一种错义变体。碱基编辑可以在疾病发作之前发生,其中疾病是由治疗基因突变引起的表型。在某些实施方案中,碱基编辑降低了患上疾病的风险。
[0074]
术语"载体"涉及可以被感染、转染或转化成细胞并独立地或在宿主细胞基因组内复制的单链或双链环状核酸分子。可以切割环状双链核酸分子,从而在用限制酶处理后线性化。载体、限制酶的种类以及限制酶靶向的核苷酸序列的知识对于本领域技术人员来说是容易获得的,并包括任何复制子(例如质粒、粘粒、杆粒、噬菌体或病毒),在其上可以连接另一个遗传序列或元件(dna或rna),从而复制所连接的序列或元件。通过用限制酶切割载体并将两个片段连接在一起,可以将本发明的核酸分子插入载体。
[0075]
在一些方面,本发明提供了包括将一种或多种多核苷酸(例如,crispr系统、反义寡核苷酸、sirna、shrna、三链核酸等),例如一种或多种如本文所述的载体、其一种或多种转录物和/或从其转录的一种或多种蛋白质递送至宿主细胞的方法。在一些方面,本发明进一步提供了通过此类方法产生的细胞,以及包含此类细胞或由此类细胞产生的生物体(例如动物、植物或真菌)。在一些实施方案中,将与引导序列组合(和任选地复合)的crispr酶递送至细胞。常规的基于病毒和非病毒的基因转移方法可用于在哺乳动物细胞或靶组织中引入核酸。此类方法可用于将编码crispr系统组分的核酸施用于培养中的细胞或宿主生物体中。非病毒载体递送系统包括dna质粒、rna(例如本文所述载体的转录物)、裸核酸和与递送载体(例如脂质体)复合的核酸。病毒载体递送系统包括dna和rna 病毒,它们在递送至细胞后具有游离基因组或整合基因组。有关基因治疗程序的综述,请参阅anderson,science 256:808-813(1992);nabel&felgner,tibtech 11:211-217(1993);mitani&caskey,tibtech11:162-166(1993);dillon,tibtech 11:167-175(1993);miller,nature357:455-460(1992);van brunt,biotechnology 6(10):1149-1154(1988);vigne,restorative neurology and neuroscience 8:35-36(1995);kremer&perricaudet,british medical bulletin 51(1):31-44(1995);haddada et al.,in current topics in microbiology and immunology doerfler and bihm(eds)(1995);和yu et al.,gene therapy 1:13-26(1994)。
[0076]
核酸的非病毒递送方法包括脂质转染、核转染、显微注射、基因枪、病毒体、脂质体、免疫脂质体、聚阳离子或脂质:核酸缀合物、裸dna、人工病毒粒子和试剂增强的dna摄
取。脂质转染描述于例如美国专利号5,049,386、4,946,787;和4,897,355并且脂质转染试剂是商业销售的(例如transfectam
tm
和lipofectin
tm
)。适用于多核苷酸的有效受体识别脂质转染的阳离子和中性脂质包括feigner、wo91/17424;wo91/16024的那些。递送可以是到细胞(例如体外或离体施用)或到靶组织(例如体内施用)的。
[0077]
脂质:核酸复合物,包括靶向脂质体如免疫脂质复合物的制备是本领域技术人员公知的(参见,crystal,science 270:404-410(1995);blaese et al.,cancer gene ther.2:291-297(1995);behr et al.,bioconjugate chem.5:382-389(1994);remy et al.,bioconjugate chem.5:647-654(1994);gao et al.,gene therapy 2:710-722(1995);ahmad et al.,cancer res.52:4817-4820(1992);美国专利号4,186,183、4,217,344、4,235,871、4,261,975、4,485,054、4,501,728、4,774,085、4,837,028和4,946,787)。
[0078]
使用基于rna或dna病毒的系统来递送核酸利用了高度进化的过程,用于将病毒靶向体内的特定细胞并将病毒有效载荷运送到细胞核。病毒载体可直接施用于患者(体内)或它们可用于体外处理细胞,并且可任选地将修饰的细胞施用于患者(离体)。常规的基于病毒的系统可以包括用于基因转移的逆转录病毒、慢病毒、腺病毒、腺相关病毒和单纯疱疹病毒载体。可以使用逆转录病毒、慢病毒和腺相关病毒基因转移方法整合到宿主基因组中,通常会导致插入的转基因长期表达。此外,在许多不同的细胞类型和靶组织中都观察到了高转导效率。
[0079]
逆转录病毒的趋向性可以通过整合外源包膜蛋白来改变,从而扩大靶细胞的潜在靶标群体。慢病毒载体是能够转导或感染非分裂细胞并通常产生高病毒滴度的逆转录病毒载体。因此,逆转录病毒基因转移系统的选择将取决于靶组织。逆转录病毒载体由顺式作用的长末端重复序列组成,其包装容量高达6-10kb的外源序列。最小的顺式作用ltr足以复制和包装载体,然后用于将治疗基因整合到靶细胞中以提供永久的转基因表达。广泛使用的逆转录病毒载体包括基于鼠白血病病毒(mulv)、长臂猿白血病病毒(galv)、猿猴免疫缺陷病毒(siv)、人类免疫缺陷病毒(hiv)及其组合的那些(参见,例如,buchscher et al.,j.virol.66:2731-2739(1992);johann et al.,j.virol.66:1635-1640(1992);sommnerfelt et al.,virol.176:58-59(1990);wilson et al.,j.virol.63:2374-2378(1989);miller et al.,j.virol.65:2220-2224(1991);pct/us94/05700)。
[0080]
在优选瞬时表达的应用中,可以使用基于腺病毒的系统。基于腺病毒的载体能够在许多细胞类型中具有非常高的转导效率并且不需要细胞分裂。使用此类载体,已获得高滴度和表达水平。该载体可以在相对简单的系统中大量生产。
[0081]
腺相关病毒(“aav”)载体也可用于用靶核酸转导细胞,例如在核酸和肽的体外生产中,以及用于体内和离体基因治疗程序(参见,例如,west et al.,virology160:38-47(1987);美国专利号4,797,368;wo 93/24641;kotin,human gene therapy 5:793-801(1994);muzyczka,j.clin.invest.94:1351(1994))。重组aav载体的构建描述于许多出版物中,包括美国专利号5,173,414;tratschin et al.,mol.cell.biol.5:3251-3260(1985);tratschin,et al.,mol.cell.biol.4:2072-2081(1984);hermonat&muzyczka,pnas 81:6466-6470(1984);和samulski et al.,j.virol.63:03822-3828(1989)。
[0082]
包装细胞通常用于形成能够感染宿主细胞的病毒颗粒。此类细胞包括包装腺病毒的293细胞和包装逆转录病毒的ψ2细胞或pa317细胞。用于基因治疗的病毒载体通常是通过
产生将核酸载体包装成病毒颗粒的细胞系来产生的。载体通常包含包装和随后整合到宿主中所需的最少病毒序列,其他病毒序列被用于要表达的多核苷酸的表达盒替换。缺失的病毒功能通常由包装细胞系反式提供。例如,用于基因治疗的aav载体通常仅具有来自aav基因组的itr序列,这些序列是包装和整合到宿主基因组中所需的。病毒dna被包装在一个细胞系中,该细胞系包含一个编码其他aav基因的辅助质粒,即rep和cap,但缺少itr序列。也可以用腺病毒作为辅助病毒来感染细胞系。辅助病毒促进aav载体的复制和辅助质粒的aav基因的表达。由于缺乏itr序列,辅助质粒没有大量包装。腺病毒的污染可以通过例如热处理来减少,腺病毒对热处理比aav更敏感。
[0083]
在一些实施方案中,将宿主细胞用本文所述的一种或多种载体瞬时或非瞬时转染。在一些实施方案中,将细胞转染,如其在受试者中自然发生的那样。在一些实施方案中,被转染的细胞取自受试者。在一些实施方案中,细胞来源于取自受试者的细胞,例如细胞系。
[0084]
在一方面,本发明提供了在真核细胞中修饰靶多核苷酸的方法,所述真核细胞可以在体内、离体或体外。在一些实施方案中,该方法包括从人类或非人类动物取样细胞或细胞群,并修饰细胞。培养可以在离体的任何阶段进行。可以将一个或多个细胞重新引入人类或非人类动物。
[0085]
在一方面,本发明提供了在真核细胞中修饰靶多核苷酸的方法。在一些实施方案中,该方法包括使crispr复合物与靶多核苷酸结合以实现所述靶多核苷酸的切割,从而修饰把靶多核苷酸,其中该crispr复合物包含与引导序列复合的crispr酶,该引导序列与所述靶多核苷酸内的靶序列杂交,其中所述引导序列与tracr mate序列连接,而tracr mate序列又与tracr序列杂交。
[0086]
在一方面,本发明提供了包含上述方法和组合物中公开的任何一种或多种元件的试剂盒。在一些实施方案中,该试剂盒包含载体系统或替代递送系统的组分,例如上述那些和使用该试剂盒的说明。在一些实施方案中,载体或递送系统包含(a)与tracr mate序列可操作地连接的第一调控元件和用于在tracr mate序列上游插入引导序列的一个或多个插入位点,其中当表达时,引导序列在真核细胞中指导crispr复合物与靶序列的序列特异性结合,其中crispr复合物包含与(1)与靶序列杂交的引导序列和(2)与tracr序列杂交的tracr mate序列复合的crispr酶;和/或(b)与编码所述crispr酶的酶编码序列可操作地连接的第二调控元件,所述酶编码序列包含核定位序列。元件可以单独提供或组合提供,并且可以提供在任何合适的容器(例如小瓶、瓶或管)中。在一些实施方案中,试剂盒包括一种或多种语言的说明书,例如多于一种语言的说明书。
[0087]
在一些实施方案中,试剂盒包含一种或多种试剂,用于利用本文所述的一种或多种元件的方法。试剂可以提供在任何合适的容器中。例如,试剂盒可提供一种或多种反应或储存缓冲液。试剂可以以可用于特定试验的形式提供,或以在使用前需要添加一种或多种其他组分的形式(例如以浓缩物或冻干形式)提供。缓冲液可以是任何缓冲液,包括但不限于碳酸钠缓冲液、碳酸氢钠缓冲液、硼酸盐缓冲液、tris缓冲液、mops缓冲液、hepes缓冲液及其组合。在一些实施方案中,缓冲液是碱性的。在一些实施方案中,缓冲液具有约7至约10的ph。在一些实施方案中,该试剂盒包含一种或多种对应于引导序列的寡核苷酸,用于插入载体中以便可操作地连接引导序列和调控元件。在一些实施方案中,试剂盒包含同源重组
模板多核苷酸。
[0088]
下调或抑制性核酸包括但不限于反义分子、适体、核酶、三链体形成分子、rna干扰(rnai)、crispr(规律间隔成簇短回文重复序列)rna(crrna)和外部引导序列。这些核酸分子可以作为靶分子所具有的特定活性的影响剂(affector)、抑制剂、调节剂和刺激剂,或者功能性核酸分子可以具有独立于任何其他分子的新发活性。在某些实施方案中,使用抑制性核酸。
[0089]
反义分子被设计为通过规范或非规范碱基配对与靶核酸分子相互作用。反义分子和靶分子的相互作用旨在通过例如rnase h介导的rna-dna杂交降解促进靶分子的破坏。替代地,反义分子被设计为中断通常发生在靶分子上的加工功能,例如转录或复制。可以根据靶分子的序列设计反义分子。存在通过发现靶分子的最容易接近的区域来优化反义效率的多种方法。示例性方法是使用dms和depc的体外选择实验和dna 修饰研究。优选地,反义分子以小于或等于10-6
、10-8
、10-10
或10-12
的解离常数(kd)结合靶分子。有助于设计和使用反义分子的方法和技术的代表性示例可以在美国专利号5,135,917、5,294,533、5,627,158、5,641,754、5,691,317、5,780,607、5,786,138、5,849,903、5,856,103、5,919,772、5,955,590、5,990,088、5,994,320、5,998,602、6,005,095、6,007,995、6,013,522、6,017,898、6,018,042、6,025,198、6,033,910、6,040,296、6,046,004、6,046,319和6,057,437中找到。
[0090]
形成三链体的功能性核酸分子是可以与双链或单链核酸相互作用的分子。当三链体分子与靶区域相互作用时,就会形成称为三链体的结构,其中存在依赖于watson-crick和hoogsteen碱基配对形成复合物的三股dna。三链体分子是优选的,因为它们可以以高亲和力和特异性结合靶区域。优选地,三链体形成分子以小于10-6
、10-8
、10-10
或10-12
的kd结合靶分子。关于如何制备和使用三链体形成分子来结合多种不同靶分子的代表性实例可以在美国专利号5,176,996、5,645,985、5,650,316、5,683,874、5,693,773、5,834,185、5,869,246、5,874,566和5,962,426中找到。基因表达也可以通过rna干扰(rnai)以高度特异性的方式有效地沉默。这种沉默最初是通过添加双链rna(dsrna)观察到的(fire,a.,et al.,nature,391:806-11(1998);napoli,c.,et al.,plant cell,2:279-89(1990);hannon,g.j.,nature,418:244-51(2002))。一旦dsrna进入细胞,它就会被rnase iii样酶,即dicer酶,切割成长度为21-23个核苷酸的双链小干扰rna(sirna),其在3'端包含2个核苷酸突出端(elbashir,s.m.,et al.,genes dev.,15:188-200(2001);bernstein,e.,et al.,nature,409:363-6(2001);hammond,s.m.,et al.,nature,404:293-6(2000))。在依赖atp的步骤中,sirna被整合到多亚基蛋白复合物中,通常称为rnai诱导沉默复合物(risc),它将sirna引导至靶rna 序列(nykanen,a.,et al.,cell,107:309-21(2001))。在某些时候,sirna双链体解开,反义链似乎仍然与risc结合,并通过内切和外切核酸酶的组合指导互补mrna序列的降解(martinez,j.,et al.,cell,110:563-74(2002))。然而,rnai或sirna 的效果或它们的使用不限于任何类型的机制。
[0091]
小干扰rna(sirna)是一种双链rna,可以诱导序列特异性转录后基因沉默,从而降低甚至抑制基因表达。在一个实例中,sirna在sirna和靶rna之间的序列同一性区域内触发同源rna分子(例如mrna)的特异性降解。例如,wo 02/44321公开了当与3'突出端碱基配对时能够序列特异性降解靶mrna的sirna,这些sirna的制备方法以引用方式并入本文。可以使用合成的短双链rna模拟dicer酶产生的sirna,在哺乳动物细胞中实现序列特异性基因
沉默,sirna可以是化学合成或体外合成的,也可以是短双链发夹样rna(shrna)在细胞内加工到sirna中的结果(elbashir,s.m.,et al.,nature,411:494498(2001);ui-tei,k.,et al.,febs lett,479:79-82(2000))。合成sirna通常使用算法和传统的dna/rna合成仪设计。供应商包括ambion(austin,tex.)、chemgenes(ashland,mass.)、dharmacon(lafayette,colo.)、glen research(sterling,va.)、mwb biotech(esbersberg,德国),proligo(boulder,colo.)和qiagen(vento,荷兰)。还可以使用试剂盒,如ambion的silencer.rtm sirna 构建试剂盒,在体外合成sirna。
[0092]
与rnai类似,crispr(规律间隔成簇短回文重复序列)干扰是一种强大的方法,通过选择性dna切割,用于减少内源性表达蛋白的基因表达。crispr是包含由独特间隔序列分隔的同向重复序列的基因元件,其中许多与在噬菌体和其他外源基因元件中发现的序列相同。最近的工作证明了crispr在适应性免疫中的作用,并表明源自crispr的小rna(crrna)作为归巢寡核苷酸实施,用于靶向干扰外源dna(jinek et al.,science,337:816-821(2012))。crrna被用于在基因水平上选择性切割dna。
[0093]
术语shrna是指短发夹rna,即形成紧密发夹转角的一种rna结构,其可用于通过rna干扰使基因表达沉默。shrna发夹结构被细胞机制切割成小干扰rna(sirna),然后与rna诱导的沉默复合物(risc)结合。该复合物结合并切割mrna,该mrna与与其结合的sirna相匹配。
[0094]
如本文所用,当涉及在宿主细胞中产生蛋白质时,术语“过表达”是指蛋白质的产生量大于其在其天然存在环境中产生的量。
[0095]
如本文所用,术语“遗传改变”是指一种或多种核酸分子相对于野生型或参考序列的改变。遗传改变包括但不限于已知序列的核酸分子的碱基对取代、添加和缺失至少一个核苷酸。
[0096]
如本文所用,术语“固体基质”是指任何形式,例如珠、微粒、微阵列、微量滴定孔或试管的表面、浸棒或过滤器。所述基质的材料可以是聚苯乙烯、纤维素、乳胶、硝化纤维、尼龙、聚丙烯酰胺、葡聚糖或琼脂糖。
[0097]
当涉及特定核苷酸或氨基酸时,短语“基本上由
……
组成”是指具有给定seq id no.的特性的序列。例如,当涉及氨基酸序列使用时,该短语包括序列本身和不会影响该序列的功能和新特性的分子修饰。
[0098]
如本文所用,"靶核酸”是指存在于复杂核酸混合物中的核酸的先前限定的区域,其中所述限定的野生型区域包含至少一种已知的与脑白质营养不良相关的核苷酸变异。可以通过cdna克隆或消减杂交或手动合成从天然来源分离所述核酸分子。可以通过三酯合成方法或通过使用自动dna合成仪来人工合成所述核酸分子。
[0099]
术语“互补的”描述了可以彼此形成多种有利相互作用的两个核苷酸。例如,腺嘌呤与胸腺嘧啶互补,因为它们可以形成两个氢键。同样,鸟嘌呤和胞嘧啶是互补的,因为它们可以形成三个氢键。因此,如果核酸序列包含以下碱基序列:胸腺嘧啶、腺嘌呤、鸟嘌呤和胞嘧啶,该核酸分子的“补体”是包含替代胸腺嘧啶的腺嘌呤、替代腺嘌呤的胸腺嘧啶、替代鸟嘌呤的胞嘧啶和替代胞嘧啶的鸟嘌呤的分子。因为补体可以包含与亲本核酸分子形成最佳相互作用的核酸序列,所以这样的补体可以与其亲本分子以高亲和力结合。
[0100]
术语“启动子元件”描述了掺入载体中的核苷酸序列,该核苷酸序列一旦进入适当
的细胞,便可以促进转录因子和/或聚合酶的结合以及随后将载体dna的部分转录成mrna。在一个实施方案中,本发明的启动子元件在脑白质营养不良特异性标志物核酸分子的5'端之前,使得后者被转录成mrna。然后宿主细胞机制将mrna翻译成多肽。
[0101]
本领域技术人员将认识到,核酸载体可以包含除启动子元件和脑白质营养不良特异性标志物基因核酸分子以外的核酸元件。这些其他核酸元件包括但不限于复制起点、核糖体结合位点、编码抗药性酶或氨基酸代谢酶的核酸序列以及编码分泌信号、定位信号或对多肽纯化有用的信号的核酸序列。
[0102]“复制子”是能够在很大程度上在其自身控制下复制的任何遗传元件,例如质粒、粘粒、杆粒、质体、噬菌体或病毒。复制子可以是rna或dna,并且可以是单链或双链。
[0103]“操纵子”是指可以具有转录和翻译控制序列的核酸片段,所述转录和翻译控制序列例如启动子、增强子、翻译起始信号(例如atg或aug密码子)、聚腺苷酸化信号,终止子等,并且其促进多肽编码序列在宿主细胞或生物中的表达。
[0104]
如本文所用,术语“报告子”、“报告子系统”、“报告子基因”或“报告子基因产物”应表示可操作的遗传系统,其中核酸包含编码产物的基因,所述产物表达后可产生(例如通过生物测定、免疫测定、放射免疫测定、或通过比色、荧光、化学发光或其他方法)易于测量的报告子信号。所述核酸可以是rna或dna、线性的或环状的、单链的或双链的、反义或有义极性的,并且可操作地连接至必要的控制元件以表达报道子基因产物。所需的控制元件将根据报道子系统的性质而有所不同,并且无论所述报道子基因是dna还是rna形式,但是其可以包括但不限于,如启动子、增强子、翻译控制序列、聚a附加信号、转录终止信号等的元件。
[0105]
如上所述,所引入的核酸可以或可以不整合(共价连接)到受体细胞或生物的核酸中。例如,在细菌、酵母、植物和哺乳动物细胞中,所导入的核酸可以保持为游离基因元件或独立的复制子,例如质粒。或者,所引入的核酸可以整合到受体细胞或生物的核酸中,并稳定地维持在该细胞或生物中,并进一步传递或遗传给受体细胞或生物的后代细胞或生物。最后,所引入的核酸可能仅短暂地存在于受体细胞或宿主生物中。
[0106]
术语“可操作地连接”是指将编码序列表达所必需的调节序列置于dna分子中相对于编码序列的适当位置,以实现编码序列的表达。这种相同的定义有时适用于表达载体中转录单元和其他转录控制元件(例如,增强子)的排列。
[0107]
短语“修饰的主链连接”包括但不限于:硫代磷酸酯连接、甲基膦酸酯连接、乙基膦酸酯连接、硼酸磷酸酯连接、磺酰胺、羰基酰胺、二氨基磷酸酯、包含带正电荷的侧基的二氨基磷酸酯连接、二硫代磷酸酯、氨基乙基甘氨酸、磷酸三酯、氨基烷基磷酸三酯;3'-亚烷基膦酸酯;5'-亚烷基膦酸酯、手性膦酸酯、次膦酸酯、3'-氨基氨基磷酸酯、氨基烷基氨基磷酸酯、硫代氨基磷酸酯;硫酰烷基-膦酸酯、硫酰烷基磷酸三酯、硒代磷酸酯、2-5'连接的硼酰膦酸酯类似物、极性倒转的连接、无碱基连接、短链烷基连接、环烷基核苷间连接、混合杂原子和烷基或环烷基核苷间连接、具有硅氧烷主链的短链杂原子或杂环核苷间连接、硫化物、亚砜、砜、甲乙酰基连接、硫甲乙酰连接、亚甲基甲乙酰连接、硫甲乙酰连接、核糖乙酰连接、烯烃连接、氨基磺酸酯主链、亚甲基亚氨基连接、亚甲基肼连接、磺酸酯连接和酰胺连接。
[0108]
短语“修饰糖”包括但不限于,2'氟、2'氟取代的核糖、2'-氟-d-阿拉伯糖核酸(fana)、2'-o-甲氧基乙基核糖、2'-o-甲氧基乙基脱氧核糖、2'-o-甲基取代的核糖、吗啉、哌嗪和锁核酸(lna)。
[0109]“特异性结合对”包括特异性结合成员(sbm)和结合伴侣(bp),它们彼此具有特定的特异性,并且在正常条件下优先于其他分子彼此结合。特异性结合对的实例是抗原和抗体、配体和受体以及互补核苷酸序列。技术人员知道许多其他实例。此外,术语“特异性结合对”也适用于特异性结合成员和结合伴侣之一或两者均包含一部分大分子的情况。在其中特异性结合对包含核酸序列的实施方案中,它们将具有在试验条件下彼此杂交的长度,优选大于10个核苷酸长,更优选大于15或20个核苷酸长。
[0110]“样品”或“患者样品”或“生物样品”通常是指可以测试特定分子的样品,所述分子优选脑白质营养不良特异性标志物分子,例如下表中所示的标志物。样品可以包括但不限于细胞、体液,包括血液、血清、血浆、尿液、唾液、脑脊液、眼泪、胸水等。
[0111]
生产的试剂盒和制品
[0112]
任何上述产品都可以被并入试剂盒中,该试剂盒可以在药学上可接受的载体中包含定向下调核酸的tubb-4a。核酸可以或可以不位于能够转导哺乳动物细胞的载体中。在其他方面,该试剂盒包含表达人类野生型tubb-4a和/或突变体tubb4a编码核酸的载体,用于在感兴趣的靶细胞中过表达相同的核酸。该试剂盒可任选地包括纳米颗粒或脂质体制剂,其有助于将核酸递送到细胞中。该试剂盒还可包含用于施用的使用说明、容器、器皿、试验底物或其任意组合。
[0113]
治疗剂的开发和筛选方法
[0114]
由于本文鉴定的tubb4-a的遗传改变与h-abc的病因有关,因此确认调节突变基因及其编码产物活性的试剂的方法应该导致产生用于治疗脑白质营养不良,特别是h-abc的有效治疗剂。
[0115]
分子建模应有助于根据功能所需的构象或关键氨基酸残基确认具有与改变的tubb4-a蛋白的活性位点结合的能力的特定有机分子。将使用组合化学方法来确认具有最大活性的分子,然后将开发这些分子的迭代以用于进一步的筛选循环。
[0116]
用于药物筛选试验的多肽或片段可以在溶液中游离、固定至固体支持物上或固定在细胞内。一种药物筛选方法利用真核或原核宿主细胞,其优选地在竞争性结合试验用表达所述多肽或片段的重组多核苷酸稳定转化。活细胞或固定形式的此类细胞可用于标准结合试验。例如,可以确定多肽或片段与被测试剂之间的复合物的形成,或者检查多肽或片段与已知底物之间的复合物的形成受被测试剂干扰的程度。
[0117]
另一种药物筛选技术为对编码的多肽具有合适结合亲和力的化合物提供高通量筛选,并详细描述于geysen,pct公开申请wo 84/03564,1984年9月13日公开。简言之,大量不同的小肽测试化合物,例如上述那些,是在固体基质(例如塑料针(plastic pins)或一些其他表面)上合成的。将肽测试化合物与靶多肽反应并洗涤。然后通过本领域公知的方法检测结合的多肽。
[0118]
另一种药物筛选技术涉及使用具有非功能性或改变的tubb4-a相关基因的宿主真核细胞系或细胞(如上文所述)。这些宿主细胞系或细胞在多肽水平上是有缺陷的。所述宿主细胞系或细胞在药物化合物存在下生长。测量宿主细胞的细胞代谢速率以确定该化合物是否能够调节缺陷细胞中的细胞代谢。如上所述,引入dna分子的方法也是本领域普通技术人员公知的。
[0119]
表达本发明的与h-abc相关的核酸或其功能片段的宿主细胞提供了一种系统,在
该系统中筛选具有调节脑白质营养不良发展的能力的潜在化合物或试剂。因此,在一个实施方案中,本发明的核酸分子可用于产生重组细胞系,用于在试验中确认调节与神经元信号传导和神经元细胞通讯和结构相关的细胞代谢方面的药剂。本文还提供了筛选化合物的方法,所述化合物能够调节由含tubb4-a的核酸编码的蛋白质的功能。
[0120]
另一方法需要使用工程改造的(engineered)噬菌体展示文库,以在噬菌体表面表达由改变的tubb4-a核酸编码的多肽片段。然后在可检测到表达的肽与化学文库组分之间的结合亲和力的条件下,使此类文库与组合化学文库接触。美国专利号6,057,098和5,965,456提供了进行这种试验的方法和设备。此类化合物文库可从许多公司购买,包括但不限于maybridge chemical co.,(trevillet,cornwall,英国)、comgenex(princeton,n.j.)、microsour(new milford,conn.)aldrich(milwaukee,wis.)akos consulting and solutions gmbh(巴塞尔,瑞士)、ambinter(巴黎,法国)、asinex(莫斯科,俄罗斯)、aurora(graz,奥地利)、biofocus dpi(瑞士)、bionet(camelford,英国)、chembridge(san diego,calif.)、chem div(san diego,calif.)。技术人员知道其他来源并且可以很容易地购买相同的设备。一旦在本文所述的筛选试验中鉴定出治疗有效的化合物,它们就可以被配制成药物组合物并用于治疗h-abc。
[0121]
合理药物设计的目标是产生感兴趣的生物活性多肽或与之相互作用的小分子的结构类似物(例如,激动剂、拮抗剂、抑制剂),以形成药物,其是例如更高活性或稳定形式的多肽,或例如在体内增强或干扰多肽的功能。参见,例如hodgson,(1991)bio/technology 9:19-21。在上面讨论的一种方法中,感兴趣的蛋白质或例如蛋白质-底物复合物的三维结构通过以下方法解析:x射线晶体学、核磁共振、计算机建模或最通常地,方法的组合。较少情况下,可以通过基于同源蛋白质结构的建模获得关于多肽结构的有用信息。合理药物设计的一个例子是hiv蛋白酶抑制剂的开发(合理药物设计的一个例子是hiv蛋白酶抑制剂的开发)。此外,肽可以通过丙氨酸扫描进行分析(wells,(1991)meth.enzym.202:390-411)。在该技术中,氨基酸残基被ala取代,并确定其对肽活性的影响。以这种方式分析肽的每个氨基酸残基以确定肽的重要区域。
[0122]
也可以分离出一种目标特异性抗体,通过功能试验选择,然后解析其晶体结构。原则上,这种方法产生的药核(pharmacore)可以作为后续药物设计的基础。
[0123]
人们可以通过产生针对功能性、药理学活性抗体的抗独特型抗体(anti-ids)来完全绕过蛋白质晶体学。作为镜像的镜像,anti-ids的结合位点应该是原始分子的类似物。然后可以使用anti-id从化学或生物产生的肽库中识别和分离肽。选定的肽将被用作药核。
[0124]
在另一个实施方案中,改变的tubb-4a核酸的可用性能够产生携带本发明的脑白质营养不良相关的tubb4-a核酸的实验室小鼠品系。表达本发明的与脑白质营养不良相关的核酸的转基因小鼠提供了模型系统,其中可以检查由g核酸编码的突变tubb4-a蛋白在脑白质营养不良的发展和进展中的作用。在实验室小鼠中引入转基因的方法是本领域技术人员已知的并且在下文中描述。三种常见方法包括:1.将编码目的外源基因的逆转录病毒载体整合到早期胚胎中;2.将dna注入新受精卵的原核;以及3.将经过基因处理的胚胎干细胞整合到早期胚胎中。上述转基因小鼠的产生将有助于对靶蛋白在各种细胞代谢和神经元过程中的作用进行分子阐明。这样的小鼠在整个动物模型中提供了研究推定的治疗药物的体内筛选工具,并且被本发明涵盖。
[0125]
本文使用的术语“动物”包括人类以外的所有脊椎动物。它还包括处于各个发育阶段(包括胚胎和胎儿阶段)的个体动物。“转基因动物”是指任何含有一个或多个带有遗传信息的细胞的动物,这些遗传信息通过在亚细胞水平上的有意遗传操作(例如通过靶向重组、显微注射或重组病毒感染)而直接或间接地被改变或接收。术语“转基因动物”旨在涵盖经典的杂交或体外受精,而是旨在涵盖其中一个或多个细胞被重组dna分子改变或接受重组dna分子的动物。该分子可以被特异性靶向特定的遗传基因座,被随机整合在染色体中,或者它也可以是染色体外复制的dna。术语“生殖细胞系转基因动物”是指这样的转基因动物,其中将遗传改变或遗传信息引入生殖细胞,从而赋予将遗传信息转移给后代的能力。如果这些后代实际上拥有某些或全部这种改变或遗传信息,那么它们也是转基因动物。
[0126]
用于改变靶基因的dna可以通过多种技术获得,包括但不限于从基因组来源分离、从分离的mrna模板制备cdna、直接合成或其组合。
[0127]
用于转基因导入的靶细胞的优选的类型是胚胎干细胞(es)。es细胞可以从体外培养的植入前胚胎中获得(evans等人,(1981)nature 292:154-156;bradley等人,(1984)nature 309:255-258;gossler等人,(1986)proc.natl.acad.sci.83:9065-9069)。可以通过标准技术(例如dna转染)或通过逆转录病毒介导的转导将转基因有效地引入es细胞。此后,可以将所得的转化的es细胞与来自非人类动物的胚泡合并。此后,引入的es细胞定植在胚胎中并有助于所得嵌合体动物的种系。
[0128]
技术可用于失活或改变任何遗传区域为所需的突变。
[0129]
如本文所用,敲入动物是其中例如内源鼠基因已被本发明的人类脑白质营养不良相关的tubb4-a基因替代的动物。这种敲入动物为研究脑白质营养不良的发展提供了理想的模型系统。还创建了敲除动物。
[0130]
如本文所用,可以使用载体以“组织特异性方式”或“细胞类型特异性方式”靶向脑白质营养不良相关核酸及其片段的表达,其中编码全部或部分脑白质营养不良相关的核酸的核酸序列可操纵地连接至调节序列(例如,启动子和/或增强子),所述调节序列指导特定组织或细胞类型中所编码的蛋白的表达。这样的调节元件可以有利地用于体外和体内应用。指导组织特异性蛋白的启动子是本领域众所周知的,并在本文中进行了描述。
[0131]
本文还提供了本发明的转基因小鼠的使用方法。例如,已经向其中引入了包含脑白质营养不良相关的tubb4-a的核酸或其编码的蛋白质的转基因小鼠,可用于开发筛选方法以筛选治疗剂以确认能够调节脑白质营养不良的发生的那些。
[0132]
药物和肽疗法
[0133]
对本文所述的脑白质营养不良相关cnv/snp在神经元信号传导和脑结构中所起作用的阐明促进了可用于治疗和诊断脑白质营养不良的药物组合物的开发。除了上述物质之一之外,这些组合物还可包含药学上可接受的赋形剂、载体、缓冲剂、稳定剂或本领域技术人员熟知的其他材料。此类材料应是无毒的,并且不应干扰活性成分的功效。载体或其他材料的确切性质可以取决于施用途径,例如口服、静脉内、皮肤或皮下、鼻腔、肌内、腹膜内途径。
[0134]
药物组合物
[0135]
含有治疗剂、预防剂或诊断剂衍生物(例如功能性核酸衍生物)的药物组合物可以肠胃外施用于需要这种治疗的受试者。肠胃外施用可以借助注射器,任选地笔状注射器,通
过皮下、肌内或静脉内注射进行。或者,可以通过输液泵进行肠胃外施用。其他的选择是经鼻或经肺施用专门为此目的而设计的治疗剂、预防剂或诊断剂,优选以组合物、粉末或液体的形式。
[0136]
治疗剂、预防剂或诊断剂衍生物的可注射组合物可以使用制药工业的常规技术来制备,包括适当地溶解和混合成分以得到所需的最终产品。因此,根据一种方法,可以将治疗剂、预防剂或诊断剂衍生物溶于一定量的水中,该量略小于待制备的组合物的最终体积。可根据需要加入等渗剂、防腐剂和缓冲剂,并在必要时使用酸(例如,盐酸)或碱(例如,氢氧化钠水溶液)调节溶液的ph值。最后,可以用水调节溶液的体积以提供所需的成分浓度。
[0137]
在一些实施方案中,缓冲剂可以选自由以下组成的组:醋酸钠、碳酸钠、柠檬酸盐、甘氨酰甘氨酸、组氨酸、甘氨酸、赖氨酸、精氨酸、磷酸二氢钠、磷酸氢二钠、磷酸钠,和tris(羟甲基)-氨基甲烷、二辛酸、三辛酸、苹果酸、琥珀酸、马来酸、富马酸、酒石酸、天冬氨酸或其混合物。这些特定缓冲剂中的每一个以及它们的组合构成一个替代实施方案。
[0138]
提供以下材料和方法以帮助进行实施本发明。
[0139]
小鼠模型的生成
[0140]
通过在tubb4a基因的外显子4中插入p.asp249asn(c.745g》a)突变,使用规律间隔成簇短回文重复序列(crispr)-cas-9技术生成杂合tubb4a
d249n
小鼠。小鼠tubb4a基因位于由4个外显子组成的17号染色体上。将cas9 mrna、grna和寡核苷酸(带有靶向序列,两侧结合有120bp同源物)共同注射到受精卵中。由此产生的crispr敲入小鼠模型在tubb4a基因的一个等位基因(tubb4a
d249n
)中具有c.745g》a的杂合点突变。除了杂合的tubb4a
d249n
动物外,这些杂合小鼠被培育成纯合的tubb4a
d249n/d249n
小鼠,这与在taeip大鼠模型中看到的纯合突变(li et al.,2003)保持一致。所有分析均包括野生型(wt)、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠。在所有实验步骤对动物进行基因分型。小鼠在12小时光照:12小时黑暗循环下保持在清洁设施中,并可以自由获取食物和水。方法和研究方案得到费城儿童医院机构动物护理和使用委员会的完全批准,并符合修订后的美国国立卫生研究院实验室动物福利政策。
[0141]
行为分析
[0142]
在定义的发育时间间隔评估走动角度、行走、悬垂握力、翻正反射rota rod和旋转棒(rota rod)(shiotsuki et al.,2010)(图1)。对于行为测试,每种情况包括至少10只动物的队列。
[0143]
组织处理
[0144]
根据体重使用90-150mg/kg氯胺酮和7.5-16mg/kg甲苯噻嗪的混合物将小鼠深度麻醉,用1x pbs初始冲洗后,用1x磷酸盐缓冲盐水(pbs)中的4%多聚甲醛(pfa)(thermo fisher scientific,美国)经心脏灌注。收集大脑并用1xpbs中的4%pfa 后固定过夜,然后将组织在1x pbs中的30%蔗糖中脱水。将大脑嵌入最佳切割温度化合物(o.c.t.compound,sakura,4583,美国)中,然后在低温切片机(cm 3050s,leica biosystems,美国)上切成冠状或矢状(50μm)切片。
[0145]
免疫组织化学和图像采集:
[0146]
根据先前公布的方案(sahinkaya et al.,2014),髓鞘定量和神经丝染色是通过铬花青(eri-c)染色进行的。
[0147]
对于nissl染色,将冷冻切片用0.1%甲酚紫染色15分钟,用pbs冲洗,用梯度的醇
(70-100%)脱水,然后进行二甲苯处理并用permount封固。对于免疫荧光染色,将自由浮动切片在室温下用2%牛血清白蛋白(bsa)和0.1%triton(tx)-100封闭1小时,然后依次与一抗在4℃下孵育过夜,与荧光二抗在室温下孵育1小时。一抗包括:大鼠抗含蛋白脂质蛋白(plp)(iddrc杂交瘤,由judith grinspan博士提供)、兔抗髓鞘碱性蛋白(mbp)(1:250,abcam,cat:ab40389)、兔抗ng2(1:250,us biological,cat:c5067-70d)、小鼠抗olig2(1:100,millipore,mabn50)、小鼠抗神经元核(neun)(1:1000,millipore,cat:mab377);兔抗天冬氨酸酰化酶(aspa)(1:1000,millipore,cat:gtx110699)、兔抗裂解半胱天冬酶(1:200,细胞信号传导;cat:#9579);兔抗钙结合蛋白(1:250,swant,cat:cb38)。所使用的二抗为:alexa fluor-488-与alexa fluor-647偶联的抗兔、小鼠或大鼠的二抗(1:1000;invitrogen)。细胞核用dapi复染。
[0148]
免疫印迹:
[0149]
为了确定关键髓鞘蛋白的蛋白质水平、小脑和前脑中p14、p21和末期的plp和mbp水平,在蛋白酶和磷酸酶抑制剂(sigma-aldrich,usa)存在的情况下,在ripa缓冲液(thermo fischer scientific,usa)中裂解相应的脑组织。样品在laemmli缓冲液中煮沸,并在还原条件下在sds-page凝胶(4-15%mini-protean预制凝胶,biorad,美国)上进行电泳。通过电印迹将蛋白质转移到硝酸纤维素膜(trans-blot turbo transfer system,biorad,美国)上。将该膜通过在tris缓冲盐水(tbst)中的0.05%tween 20中制备的封闭缓冲液(1%脱脂乳,biorad)封闭,随后在4℃下与在封闭缓冲液中稀释的抗大鼠抗plp(1:1000,iddrc杂交瘤,由judith grinspan博士提供)和兔抗mbp(1:2000,abcam,cat:ab40389)的一抗一起孵育过夜。将该膜用tbst洗涤5次,在封闭缓冲液中在hrp偶联的山羊抗兔(1:5000,santa cruz,catalogue#sc2357)或山羊抗大鼠(1:5000,thermofisher scientific,catalogue#31470)二抗中孵育1小时,并在tbst中洗涤并根据制造商的说明使用标准ecl方案(pierce ecl,thermofisher scientific)进行显影。图像通过image j软件进行扫描和分析。为了使用上样内参(loading control)进行归一化,按照制造商的说明(一分钟蛋白质印迹剥离缓冲液,gm biosciences)在剥离后使用小鼠抗肌动蛋白(公司,1:4000)和小鼠抗黏着斑蛋白(公司,1:2000)。
[0150]
电子显微镜:
[0151]
通过使用电子显微镜(em)进行结构分析的超薄切片进一步评估髓鞘形成。在终末期(~第35天)用盐水然后是0.1m pb(pb;ph 7.4)中的2%pfa和2%戊二醛通过心脏灌注一组单独的小鼠(n=3只/组)(lancaster et al.,2018)。解剖每只小鼠并分离它们的视神经、颈脊髓和小脑(小脑蚓体)。将组织后固定24小时,在0.1m pb中冲洗,然后转移到0.1m pb中的2%oso4中1小时,然后处理以嵌入环氧树脂(epon)(lancaster et al.,2018)。切割半薄切片并用碱性甲苯胺蓝染色并使用光学显微镜(lecia dmr)交互式软件(徕卡应用套件)进行可视化。切割超薄切片(70nm),用柠檬酸铅和醋酸双氧铀染色,并使用jeol-1010透射电子显微镜(tem)成像。使用image j软件评估从视神经以100x拍摄的em切片图像,并测量内部和外部轴突面积以进行g比分析,并在每只动物50个轴突中进行量化,每组n=3,如先前公布的(lancaster et al.,2018)。
[0152]
少突胶质细胞培养:
[0153]
通过从培养的wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中分离少突胶质细胞来评估
突变的细胞自主效应。如补充方法中所述,使用miltenyl anti-o4微珠在出生后第p4-p7天之间从皮层中分离出原代少突胶质细胞前体细胞(opc)。将o4+细胞在24孔板铺板,密度为每孔20000个opc。使细胞增殖5-7天,然后使它们在不含pdgf和bfgf以及含有甲状腺素t4(20μg/ml;sigma t0397)的培养基中再分化5天。然后用4%pfa固定细胞并使用标准免疫化学方案染色。简言之,将盖玻片用1x pbs洗涤两次,用0.2%tx-100透化,然后在10%正常山羊血清(ngs)溶液中封闭1小时。在5%ngs中制备一抗,并在4℃下孵育过夜。所用的一抗是少突胶质细胞标志物兔olig2(1:800;emd millipore ab9610)、成熟髓鞘标志物大鼠plp(1:1)和大鼠mbp(1:1)(iddrc杂交瘤,由judith grinspan博士提供),第二天在pbs中洗涤3次,并与适当的二级荧光抗体一起孵育(1:500;抗大鼠igg alexa fluor 488、抗兔igg alexa fluor 647)。然后使用prolong金抗褪色试剂(thermo fisher scientific)固定细胞并使用尼康显微镜成像,其中以20x或40x物镜拍摄图像以分析细胞计数。
[0154]
皮质神经元培养:
[0155]
通过从培养的wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中分离神经元来评估突变的细胞自主效应。原代皮质神经元是从e15.5胚胎中分离出来的,如前所述(guedes-dias et al.,2019)。简言之,从每个胚胎上解剖出皮质并用hbss洗涤,然后将2.5%胰蛋白酶添加到每个样品中,并在37℃下孵育7分钟。去除胰蛋白酶并用新鲜温热的hbss洗涤四次,然后重新悬浮在附着培养基(mem培养基、1%丙酮酸钠、1%马血清、葡萄糖和氯化钠)中。使用移液管研磨细胞直至其为均质的单细胞溶液。对细胞进行计数并在pll包被的matek板上(仅在中心)铺板,密度为24孔板的150,000个细胞/板和100,000个细胞/孔。4小时后将培养基更换为预平衡的维持培养基(neurobasal培养基、1%谷氨酰胺、1%青霉素/链霉素、葡萄糖、氯化钠和2%b27溶液)。3天后,去除20-30%的培养基,然后向神经元补充含有有丝分裂抑制剂arac的新鲜培养基。对在24孔板中铺板的神经元进行细胞存活分析、轴突和树突长度测量。将神经元用map2(1:200)和tuj1(1:200)染色以分别标记树突和细胞体/轴突,并以20x或40x物镜成像,用于细胞计数和测量轴突和树突长度。使用fiji软件中的neurite示踪插件测量轴突和树突长度。
[0156]
eb3动力学的实时成像
[0157]
微管动力学通过eb3-mcherry的活细胞成像进行评估,其中末端结合蛋白3(eb3)标记微管生长的正端。在体外(div)第6天,使用lipofectamine 2000(invitrogen)用eb3-mcherry转染皮质神经元。转染后20-24小时,将维持培养基更换为补充有2%b27和2mm glutamax的低荧光hibernate e成像培养基(brainbits)。神经元在37℃的环境室中在perkinelmer ultraview vox spinning disk共聚焦系统上成像,使用nikon eclipse ti倒置显微镜,使用plan apochromat 60x 1.40na油浸物镜。使用由volocity软件(perkinelmer)驱动的hamamatsu emccd c9100-50相机以每帧2秒的帧速率采集图像,持续600秒。如前所述(guedes-dias et al.,2019)进行eb3动力学的量化。imagej宏工具集kymoclear用于生成转筒记波器(kymographs)(mangeol et al.,2016)。kymoclear工具集通过原转筒记波器上的傅立叶滤波器,允许自动区分顺行、逆行或静态分量,并在不影响数据定量分析的情况下提高eb3彗星的信噪比。使用自定义matlab gui(kymograph suite)手动追踪个体eb3彗星的轨迹,并用于确定每颗彗星的运行长度、运行时间和速度。研究人员在图像采集和转筒记波器分析期间对神经元基因型不知情。
[0158]
统计分析
[0159]
所有图形数据均表示为平均值
±
标准误差平均值(sem)。除非另有说明,文本中的“n”代表每个实验使用的小鼠数量。步态异常、翻正反射、旋转棒和体重评估通过双因素anova与重复测量然后进行事后tukey检验进行分析。对于握力和行走,进行单因素anova以及事后tukey检验。通过kaplan-meier方法分析存活率,组间差异采用gehan-breslow-wilcoxon检验估计。髓鞘定量、neun、aspa、ng2、olig2和裂解的半胱天冬酶3计数和荧光强度的比较通过普通双因素anova和多重比较事后tukey检验进行分析。使用单因素anova与事后tukey检验比较神经元存活、轴突和树突长度以及体外检查的ol标志物的评估。使用单因素anova或双因素anova与重复测量分析神经元中的eb3动力学。所有统计分析均使用prism 7.0(graphpad软件)进行,其中p《0.05被认为具有统计学意义。
[0160]
小鼠基因分型:
[0161]
使用先前发表的hotshot方法(truett et al.,2000)从尾部提取dna。使用taq-takara系统以扩增541bp的pcr产物,使用正向引物5’ccgagaggagtttccagacagacaggatc3’(seq id no:3)和反向引物5’gctctgcacacttaacatctgctcg 3’(seq id no:4)。对扩增产物进行测序以鉴定小鼠基因型。
[0162]
行为测试:
[0163]
走动角度:通过测量行走/后肢足角来确定步态异常。对走动角度进行了一些修改(feather-schussler and ferguson,2016)。每周在p7、p14、p21、p28和p35测量走动角度。仅当幼仔在双脚平放在地面上进行完整的直线行走时,才使用数据进行了三次测量。
[0164]
行走:如前所述,使用一些修改后检测到行走缺陷(feather-schussler and ferguson,2016)。在p7、10和14评估行走行为。基于这些爬行和行走的策略,我们检查了转基因小鼠是否比它们的wt同窝仔更晚获得它们的爬行/行走技能。使用单一试验对小鼠在直线行走期间的爬行、步态对称性和肢爪移动进行评分(图1和表3)。
[0165][0166]
如图1e所示,在整个爬行过程中,整个后爪接触地面,如(#)所示,并且尾巴低或接触地面。当从爬行过渡到行走时头开始抬起。仅当后爪的脚趾触地并且脚跟抬高时才能看到行走,用[##]表示(feather-schussler and ferguson,2016)。对称肢体运动被描述为在每一步期间后爪与前爪相遇,并且每一步平滑地过渡到下一步。一只表现出不对称肢体运
动的小鼠的爪子位置不一致,并且从一个步骤到下一个步骤的过渡并不顺利。
[0167]
悬垂握力:前爪和后爪的抓握能力通过悬垂握力来确定。如上文所述feather-schussler and ferguson,2016进行悬垂握力。试验重复3次并计算平均角度。使用13”x 9.5”金属丝网在p14进行悬垂握力。量角器与金属丝网平行放置,以测量幼仔落下的角度。将小鼠放置在金属丝上,并允许适应这种新环境约10秒。将金属丝缓慢倒转至180度,并记录幼仔落下时屏幕的大致角度。试验重复3次并计算平均角度。
[0168]
翻正反射:翻正反射测试小鼠躯干控制和运动协调。如上文所述feather-schussler and ferguson,2016进行翻正反射。从p7、p14、p21、p28、p35每周进行翻正反射测试,然后在tubb4a
d249n/d249n
小鼠表现出运动障碍时每天进行。进行了三次试验,如果需要,每次试验总共给予1分钟。从p7、14、21、28、35每周进行翻正反射测试,然后在tubb4a
d249n/d249n
小鼠表现出运动障碍时每天进行。将小鼠仰卧放在工作台垫上并保持原位5秒。释放小鼠并记录返回平伏位置所需的时间。进行了三次试验,如果需要,每次试验总共给予1分钟。
[0169]
旋转棒:使用旋转棒(ugo basile s.r.l,gemonio,意大利)评估运动协调、力量和平衡。在每次试验中,记录训练期(p21)后三个测试试验的从旋转棒跌落的潜伏期,并使用平均值进行分析。为了评估渐进性运动丧失,在p28和p35进行了旋转棒测试,并使用小鼠年龄之间的跌落潜伏期平均值进行统计分析。为了适应该装置,在第1天,将小鼠置于以5rpm恒速旋转的圆柱形棒上100秒。第二天,将小鼠以5到30rpm的加速速度放置300秒,每天进行3次试验,其中试验间间隔约为20分钟。在第3天,以5-30rpm的加速速度进行了三个测试试验,持续300秒。
[0170]
免疫组织化学、图像分析和定量
[0171]
髓鞘定量和神经丝染色:
[0172]
自由漂浮的切片用10%过氧化氢的甲醇溶液处理20分钟,然后用封闭缓冲液(在1x pbs中的4%牛血清白蛋白(bsa),含有0.1%triton-x(tx)-100)封闭1小时,然后在相同的封闭缓冲液中加入1:500鸡抗nf(1:500,aves,cat:nfh),在4℃下过夜。一抗孵育后,将切片与生物素化抗鸡二抗(1:1000,aves,cat:b-1005)孵育1小时,并由elite avidin生物素偶联物(载体)显色,并用dab底物可视化。将载玻片在自来水中漂洗,用丙酮处理,在自来水中漂洗并浸入铬花青(eri-c)溶液30分钟。切片在5%iron alum中分化,用自来水冲洗并在硼砂铁氰化物中分化。将切片脱水、清洁、用permount(fisher scientific,usa)固定并盖上盖玻片。对于胼胝体和小脑中的髓鞘定量(每只小鼠3-4个切片,对于pnd 14、p21和末期,n=至少3只),在keyence bz-x-700数字显微镜中以明场模式捕获图像。使用keyence bz-x软件以10倍放大率平铺捕获的图像。染色面积用image j软件测量,然后与总白质相关。
[0173]
neun和半胱天冬酶计数:对于纹状体和小脑切片(每只小鼠3-4个切片,对于p14、p21和终末期,n=3-4只),通过使用leica dm6000b荧光显微镜,使用z光学切片以1-2μm的间隔分别以20x和63x捕获图像。使用image j软件通过dapi对neun+细胞进行计数。分析是盲进行的,计数报告为情况图/mm2。
[0174]
aspa和olig2/ng2计数:该协议遵循先前发布的内容(lee et al.,1985),并进行了一些修改。使用标记为aspa和ng2+/olig2+并用dapi复染的切片以量化胼胝体中aspa和ng2+/olig2+细胞的总数。所有图像均在olympus激光扫描共聚焦显微镜上通过使用0.5-1μm光学间隔的z-堆栈以40x油浸透镜拍摄。使用image j软件并在感兴趣的区域放置一个标
准化的样本框(0.01mm2)。阳性标记的细胞被鉴定为与dapi核叠加的aspa+或ng2+/olig2+或olig2+细胞。最终计数报告为情况图/mm2。
[0175]
荧光密度和面积量化:为了量化荧光阳性面积和密度,使用leica dm6000b荧光显微镜以10倍放大率捕获图像。使用image j软件,选择感兴趣的区域并计算积分面积密度和灰度值。使用以下公式以计算荧光。
[0176]
校正后的总荧光=积分密度
–
(所选细胞的面积x背景读数的平均荧光)。少突胶质细胞分离:
[0177]
简言之,从每只小鼠的大脑中显微解剖和分离皮层,并去除脑膜以避免污染培养物。将皮层切成小块并使用神经解离试剂盒(miltenyi biotec(p),130-092-628)进行解离,并且按照方案,将每个样品与酶混合物1(酶p和缓冲液x)在37℃下孵育15分钟。接着,加入酶混合物2,使用火抛光的巴斯德吸管机械分离组织,并在37℃温育10分钟。将该过程再重复两次以获得单细胞溶液,将其施加到70μm过滤器上并以300xg离心10分钟。将细胞沉淀重悬于90μl含有0.5%牛血清白蛋白的pbs缓冲液(ph 7.2)中。将10μl抗-o4微珠添加到细胞沉淀中,混合并在冰箱中孵育15分钟。然后用1-2ml缓冲液洗涤细胞并以300xg离心10分钟。吸出上清液,将细胞重悬于500μl缓冲液中。将ms macs柱置于磁场中,用500μl缓冲液冲洗,然后将细胞悬液加到磁柱上。收集含有未标记细胞的流出液(flow-through),并用500μl缓冲液冲洗柱3次。然后将柱从分离器中取出并放置在合适的收集管上,其中加入适量的培养基,并通过将活塞推入柱中立即进行冲洗。该级分是悬浮在含有neurobasal培养基的培养基中的o4+细胞,所述neurobasal培养基含2%b27、1%青霉素链霉素、1%谷氨酰胺和生长因子人bfgf(100μg/ml;r&d233-fb/cf)、人pdgf-aa(100μg/ml;peprotech 100-13a)和人nt3(100μg/ml;peprotech 450-03)。
[0178]
反义寡核苷酸合成
[0179]
由integrated dna technologies合成11个aso。我们对这些aso进行了体外筛选,以确定最佳的aso设计。在nepa21电穿孔系统(nepa gene,美国)上,在具有100,000个细胞/孔的100μl培养基中以150v的电压对具有1μm、5μm和10μm的aso浓度的小鼠oli-neu细胞进行电穿孔。电穿孔后,将细胞转移到聚-l-鸟氨酸包被的板上并置于培养箱中。处理后48小时,用pbs洗涤细胞,然后使用purelink
tm rna mini kit(thermofisher scientific,cat:12183018a)根据制造商的说明进行rna提取。用dnaase(invitrogen)处理后,使用superscript
tm iv第一链合成系统(thermofisher scientific,cat:18091200)将200ng rna 用于cdna。在applied biosystems quanta flex 7(thermofisher scientific,美国)上使用实时pcr分析(taqman chemistry)量化tubb4a,以及编码剪接因子的内源管家基因的mrna 表达水平,以富含精氨酸/丝氨酸-9(sfrs9)作为参照。使用δδct方法分析结果。
[0180]
提供以下实施例以说明本发明的某些实施方案。它们不意图以任何方式限制本发明。
[0181]
实施例i
[0182]
h-abc疾病的小鼠模型
[0183]
在本实施例中,我们将生成具有tubb4a
d249n/d249n
突变的敲入小鼠作为h-abc模型,该模型囊括了人类疾病的特征,包括肌张力障碍、运动功能丧失和步态异常。小鼠模型的组织病理学特征包括在患者组织中观察到的纹状体和小脑中的神经元丢失以及大脑和脊髓
中的髓鞘形成不足(curiel et al.,2017b)。我们还使用tubb4a
d249n/d249n
小鼠在神经元和少突胶质细胞中探索了突变微管蛋白对微管聚合的功能后果以及tubb4a突变的细胞自主作用。这项研究使用最常见的突变为h-abc提供了一个有前景的第一模型,这是理解这种破坏性疾病的潜在机制和开发疗法的关键。
[0184]
tubb4a
d249n crispr敲入小鼠的产生
[0185]
为了了解具有p.asp249asn(p.745g》a)突变的经典h-abc的分子机制和疾病进程,使用crispr生成了敲入小鼠模型tubb4a
d249n
。此外,培育这些tubb4a
d249n
小鼠以获得纯合的tubb4a
d249n/d249n
小鼠集落(图1a)。与tubb4a
d249n
小鼠平行研究纯合小鼠,类似于先前在tubb4a突变的啮齿动物模型中的表型的早期表达所需的纯合表达(13),尽管在受h-abc影响的个体中存在杂合突变。
[0186]
tubb4a
d249n/d249n
小鼠表现出疾病早期发作和存活率下降
[0187]
为了确定tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的表型,出生后每天检查小鼠。从出生到出生后第8天(p8),wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的发育似乎相似。然而,在~p9,tubb4a
d249n/d249n
小鼠开始表现出颤抖的行为。这种表型随着年龄的增长而逐渐恶化,并且随着时间的推移,小鼠会变得严重共济失调和肌张力障碍。在~p35-p40,小鼠无法自己进食,显示出缓慢的翻正能力,这个时间点被描述为它们的“终末期”(同情终点)(p《0.001,图1b和1c)。此外,体重测量表明,tubb4a
d249n/d249n
小鼠的体重从p35开始逐渐减轻,在~p37显著减轻(15.02
±
0.67),与tubb4a
d249n
(18.57
±
0.38)和wt(17.44
±
0.43)小鼠相比(p《0.001,图1l)。
[0188]
tubb4a
d249n
小鼠表现正常,没有表现出任何明显的行为表型。tubb4a
d249n
小鼠的存活率与其wt同窝小鼠相似,并且主要由于高龄而死亡(kaplan-meier存活率曲线,图2a)。
[0189]
tubb4a
d249n/d249n
小鼠表现出步态异常
[0190]
鉴于受h-abc影响的个体表现出行走延迟、共济失调、步态异常和进行性运动功能障碍,我们决定对tubb4a
d249n
和tubb4a
d249n/d249n
小鼠进行全面的行为分析,以查看小鼠是否同样概括了h-abc的行为表型(图1d)(1,10,20)。
[0191]
为了研究tubb4a
d249n
和tubb4a
d249n/d249n
小鼠是否表现出异常的步态,确定了走动角度或后肢足部角度。从p14开始,tubb4a
d249n
小鼠行走时没有走动角度缺陷,而tubb4a
d249n/d249n
小鼠与其wt同窝小鼠相比显示出明显更宽的走动角度(p《0.001,图1g和1h;p14
–
71.82
±
4.26vs 43.16
±
2.46、p21-84.00
±
7.56vs 61.96
±
2.93和p35
–
81.03
±
5.367vs 5.367)。tubb4a
d249n/d249n
小鼠的宽的走动角度与在这些年龄段看到的步态不稳定是一致的,因为幼鼠和成年小鼠需要增加后爪的角度来稳定步态并支持他们的平衡和协调(14)。
[0192]
在wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中,当小鼠从爬行过渡到行走时,在较早的发育时间点评估了走动(走动评分见表3)。在p7,tubb4a
d249n
和tubb4a
d249n/d249n
小鼠表现出与wt对照相似的不对称爬行(图1e)。在p10,tubb4a
d249n/d249n
小鼠仍然表现出不对称的肢体运动和爬行步态,如年轻幼崽所见,另外还显示相对于wt同窝小鼠对照的震颤(p10-1.20
±
0.13vs 2.20
±
0.25)(p《0.05,图1e和1f),而tubb4a
d249n
具有更对称的肢体运动和爬行/行走步态。包括tubb4a
d249n/d249n
小鼠在内的所有小鼠都在p14获得步行技能,然而,纯合的tubb4a
d249n/d249n
小鼠仍然继续表现出震颤。
[0193]
tubb4a
d249n/d249n
小鼠表现进行性运动功能障碍
[0194]
为了评估tubb4a
d249n
和tubb4a
d249n/d249n
小鼠是否在运动发育方面表现出额外的缺陷,通过在p14进行悬垂握力来确定它们的抓握能力。用所有四只爪子抓握对于老鼠攀爬和穿过不平坦的表面至关重要(14),握力表现不佳表明老鼠的运动能力受损。tubb4a
d249n
小鼠与其wt同窝小鼠相比,显示出相似的握力,而tubb4a
d249n/d249n
小鼠的下落角度明显小于wt(86.40
±
2.51vs 103.9
±
1.84;p《0.001,图1i和1j)。
[0195]
为了评估疾病是否是进行性的以及幼鼠tubb4a的突变是否影响协调和平衡,我们评估了这些小鼠在p21、p28和p35的旋转棒上的表现。与wt同窝小鼠相比,杂合tubb4a
d249n
小鼠的表现(通过以秒为单位下降的延迟来衡量)之间没有显著差异,而纯合tubb4a
d249n/d249n
小鼠在p21(107.1
±
7.58vs 213.8
±
15.16秒)、p28(101.0
±
10.30vs 239.0
±
10.76秒)和p35(20.69
±
6.71vs 257.9
±
11.40秒)的加速旋转棒上的潜伏期持续时间较短,随着时间的推移逐渐恶化(p《0.001,图1k)。
[0196]
为了测试tubb4a
d249n
小鼠是否在后期出现行为缺陷,在9个月和1岁的年龄进行了旋转棒测试,并且没有显示相对于wt小鼠的任何变化(图2b)。
[0197]
最后,从tubb4a
d249n/d249n
小鼠的p7到p35每周评估翻正反射,然后从p35到终末期每天评估。表面翻正能力测试小鼠躯干的控制和协调能力(14)。此外,将自己翻正的能力对于自我保健和喂养是必要的,并且在本研究中被用作伦理终点(21,22)。到p14,所有小鼠都能够立即自行翻正,然而,在第38天后,tubb4a
d249n/d249n
小鼠与其wt同窝小鼠相比显示出显著受损的翻正能力(p《0.001,图1l)。
[0198]
tubb4a
d249n/d249n
小鼠表现出严重的髓鞘发育延迟,tubb4a
d249n
和tubb4a
d249n/d249n
小鼠最终都表现出髓鞘形成缺失
[0199]
tubb4a
d249n
和tubb4a
d249n/d249n
小鼠概括了通常在受h-abc影响的个体中看到的髓鞘异常(3,10),而tubb4a
d249n/d249n
小鼠表现出髓鞘的发育性或退行性丧失。小鼠的髓鞘形成于出生时在脊髓中开始,并在p21时具有接近成年小鼠的模式(23)。如在p14和p21在胼胝体和小脑中通过免疫组织化学(eri-c)进行测量的,相对于wt同窝仔鼠,tubb4a
d249n/d249n
小鼠表现出严重缺乏典型的髓鞘发育。tubb4ad249n/d249n小鼠表现出髓鞘形成的初始延迟(p14
–
p《0.001,p21
–
p《0.001,图6b),和在终末期损失之前实现的髓鞘形成(胼胝体-0.053
±
0.004vs 0.948
±
0.009和对于小脑-0.037
±
0.001vs 0.854
±
0.033)(p《0.001,图3c-3f)。为了评估tubb4a
d249n
小鼠中髓鞘表型的较晚发作,在1岁时进行了eri-c染色,结果显示髓鞘染色降低(p《0.001,图3g和3h)。
[0200]
此外,tubb4a
d249n/d249n
小鼠通过免疫染色显示缺乏主要髓鞘蛋白。在tubb4a
d249n/d249n
小鼠中,mbp和plp表达在p14时在胼胝体和小脑中没有变化(图6c-6g),但在p21(p《0.001,图8c-8g)和终末期在胼胝体(p《0.001,图3k-3l和图3s-3t;plp
–
27.99
±
3.02vs 113.46
±
16.18和mbp
–
25.73
±
3.42vs 92.40
±
5.76)和小脑中(p《0.001,图3o-3p和图3w-3x;plp-11.11
±
1.17vs 58.90
±
8.19和mbp-12.65
±
2.98vs 69.79
±
1.20)显著降低。tubb4a
d249n
小鼠在胼胝体和小脑中的mbp和plp表达与在p21的wt和tubb4a
d249n/d249n
小鼠的终末期表现相当。然而,到1岁时,与wt相比,tubb4a
d249n
小鼠的plp(p《0.05,图2c-2d)和mbp(p《0.05,图3i-3j)水平降低。
[0201]
在tubb4a
d249n/d249n
小鼠中,使用wstern印迹,在p21(p《0.05)和终末期(p《0.001)在前脑(plp
–
0.286
±
0.08vs 1.101
±
0.01,图3m-3n和mbp
–
0.605
±
0.06vs 2.615
±
0.09,图
3u-3v)和小脑(plp
–
0.123
±
0.03vs 0.860
±
0.12,图3q-3r和mbp
–
1.307
±
0.178vs 2.306
±
0.14,图3y-3z)中检测到plp和mbp水平的类似降低。
[0202]
tubb4a
d249n/d249n
小鼠少突胶质细胞严重丧失
[0203]
鉴于tubb4a
d249n
和tubb4a
d249n/d249n
中髓鞘形成的发育和退行性异常,我们评估了少突胶质细胞(ol)和少突胶质细胞前体细胞(opc)的计数(23)。在p14、p21和终末期使用aspa(一种ol标记物)通过免疫染色计数在胼胝体中检查ol。
[0204]
在p14、p21和终末期(图7c-d),与wt同窝小鼠相比,tubb4a
d249n/d249n
小鼠中aspa阳性ol的数量在胼胝体中大大减少(p《0.001,166
±
32.34vs681
±
38.45)。为了评估opc的数量是否有变化,我们计数了胼胝体中双阳性ng2+olig2+(泛ol谱系标记物)细胞。tubb4a
d249n/d249n
小鼠在p14、p21(图12a-b)和终末期(图7e-f)的ng2+olig2+计数没有变化。此外,olig2+细胞计数在tubb4a
d249n/d249n
小鼠中在p14、p21和终末期时间点是相当的(图12c-e),这表明所有ol谱系细胞的数量没有变化。
[0205]
为了检查ol谱系细胞是否正在经历细胞凋亡,使用半胱天冬酶(一种细胞凋亡标记物)和olig2(一种ol谱系标记物)进行双重免疫染色。我们发现tubb4a
d249n/d249n
小鼠胼胝体中双阳性半胱天冬酶和ol(aspa)细胞的数量在p14、p21(图15a-d)和终末期(p《0.001,图7g-h)显著增加。由于opc和olig2细胞计数在tubb4a
d249n/d249n
小鼠中得以保留,我们可以推测tubb4a中的突变最有可能对成熟ol造成毒性作用,导致成熟ol丧失。
[0206]
超微结构分析证实了tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的髓鞘形成缺陷
[0207]
视神经切片的电子显微镜检查证实了,与wt对照小鼠相比,tubb4a
d249n/d249n
小鼠的无髓鞘形成和髓鞘形成不足的轴突从p21开始(数据未示出),并且在终末期恶化(图5a-3c和5h-5j),如星号所示,在更高的放大倍数下尤其明显(图5j)。此外,在终末期的tubb4a
d249n/d249n
组织中观察到被巨噬细胞吞噬的空泡化和退化轴突(蓝色星号)(图5d)。有趣的是,与wt小鼠(图5e,0.802
±
0.005)相比,衡量轴突髓鞘厚度的g比率不仅在tubb4a
d249n/d249n
小鼠中显著不同(p《0.001;0.914
±
0.004),而且在tubb4a
d249n
视神经中也显著不同(p《0.001;0.859
±
0.006)。通过绘制作为轴突直径的函数的g比率测量的髓鞘厚度的量化(图5f)表明髓鞘发育在tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中停滞。此外,与对照小鼠(0.945
±
0.024)相比,tubb4a
d249n/d249n
视神经组织中的轴突管径显著降低(图5g,p《0.05;0.87
±
0.034)表明终末期的tubb4a
d249n/d249n
小鼠中较大的轴突的丧失。脊髓的tem切片还显示,随着轴突被巨噬细胞持续吞噬(图4f),tubb4a
d249n/d249n
小鼠的髓鞘在腹侧白质中显著丧失(图4a-4f)。然而,在不同组之间的脊髓腹角中没有检查到大运动神经元的损失(数据未显示)。
[0208]
tubb4a
d249n/d249n
小鼠在终末期表现出纹状体和小脑的神经元损失。
[0209]
来自受h-abc影响的个体的病理标本表明了基底神经节和小脑颗粒细胞层中的神经元损失(4,10)。tubb4a
d249n
和tubb4a
d249n/d249n
小鼠通过在p14(图14a)、p21和终末期(图9c)用neun和nissl染色进行免疫染色,显示纹状体和小脑中神经元丢失的迹象。
[0210]
在p14和p21时间点(图14d),tubb4a
d249n
和tubb4a
d249n/d249n
的纹状体中neun计数与wt对照相当,然而,tubb4a
d249n/d249n
小鼠在终末期表现出显著的纹状体神经元损失(p《0.01,图9j;183
±
8.44对246
±
28.51)。tubb4a
d249n/d249n
小鼠小脑切片上的nissl染色显示颗粒神经元层从p21到终末期严重进行性丢失,并且小脑体积显著减少(图9c)。与wt小鼠相比,
tubb4a
d249n/d249n
小鼠在p14显示出相当的颗粒神经元计数(图14b),然而,在p21(212
±
6.71对312
±
4.30)和终末期(p《0.001,图9d-e;57
±
4.7对262
±
14.85)观察到显著的和进行性的颗粒神经元丢失。此外,与neun共定位的半胱天冬酶3阳性细胞数量显著增加发生在p21(11
±
3.99vs 0.3
±
0.16)和终末期(13.5
±
0.38vs 0.75
±
0.38),这表明了细胞凋亡(p《0.001,图9f-g)。此外,为了评估小脑中其他神经元群是否丢失,我们通过钙结合蛋白免疫染色评估了purkinje神经元,但tubb4a
d249n/d249n
和wt小鼠相似(图14c和14d)。
[0211]
tubb4a
d249n
和tubb4a
d249n/d249n
突变在少突胶质细胞中的细胞自主效应
[0212]
我们使用源自wt对照、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的体外培养物研究了tubb4a突变在ol中的细胞自主效应。从这些小鼠中分离出o4+(髓鞘形成前标记物)opcs,然后向ol目标分化。检查细胞中作为成熟ol标记物的plp,其与olig2(泛ol谱系标记物)共定位。与源自wt小鼠的成熟ol相比(图11e),在tubb4a
d249n
小鼠(p《0.05,72.12%
±
8.99)和tubb4a
d249n/d249n
小鼠(p《0.01,55.23%
±
4.97)中检查到成熟plp+ol数量的显著减少(图11a-c)。然而,所有组中olig2+细胞的总数相似(图11d),导致tubb4a
d249n
(p《0.05,55.34%
±
6.83)和tubb4a
d249n/d249n
(p《0.05,56.04%
±
5.39)小鼠与wt小鼠(p《0.05,90.5%
±
14.18)相比,来自总细胞的成熟ol占ol谱系比例显著降低(plp+/olig2细胞,图11f)。这些结果总体上反映了小鼠组织中体内观察到的类似变化,并支持tubb4a
d249n
突变对ol谱系细胞发育的细胞自主贡献。
[0213]
tubb4a
d249n/d249n
突变在神经元中的细胞自主效应
[0214]
我们使用源自wt对照、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的体外培养物还检查了tubb4a突变在皮层神经元中的细胞自主效应。我们在接种后一周分析了用tuj1和map2染色标记的神经元数量进行存活率分析,并观察到tubb4a
d249n/d249n
神经元相对于wt神经元的存活率显著降低(图11g、6h、6i,p《0.01;69.53%
±
4.8)。与wt神经元相比,tubb4a
d249n
神经元在神经元存活率方面没有任何差异。接下来,评估了神经元健康和形态是否因微管蛋白突变对轴突生长和树突分支的影响而改变。tubb4a
d249n
小鼠神经元的轴突长度比wt神经元短(图11j,155.8
±
24.42μm vs 187.5
±
23.29μm),而tubb4a
d249n/d249n
神经元的轴突长度明显短于wt神经突长度(p《0.05,117.7
±
10.18μm)。类似地,我们研究了神经元中的树突分支(图11k)并观察到tubb4a
d249n/d249n
神经元的总树突长度明显短于wt神经元(p《0.001,27.43
±
1.53μm vs 41.26
±
4.01μm),而tubb4a
d249n
神经元没有显著变化(31.31
±
3.81μm)。这些形态学研究表明h-abc相关的tubb4a
d249n/d249n
影响神经元结构和形成。
[0215]
tubb4a
d249n
和tubb4a
d249n/d249n
导致神经元微管动力学不稳定
[0216]
除了形态学研究外,我们还进行了功能研究,以评估tubb4a突变是否影响源自wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的皮层神经元中的微管(mt)动力学。用mt加末端结合蛋白eb3-mcherry转染神经元,以在铺板后1周对mt的生长末端进行成像。转筒记波器从延时视频中生成,以评估远端轴突中的eb3彗星(图13a)。虽然eb3彗星的数量在来自wt、tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的神经元中没有显著差异(图13b),有趣的是,tubb4a
d249n/d249n
神经元显示出不同的群体具有高和低的eb3彗星的表达数量(图13c)。eb3彗星在神经元中的整体速度在不同组之间相当相似(图13d;wt-0.25
±
0.049μm/s,tubb4a
d249n-0.241
±
0.055μm/s,tubb4a
d249n/d249n-0.254
±
0.066μm/s),这表明聚合速率相似。
[0217]
与wt神经元(29.67
±
0.79秒)和tubb4a
d249n
神经元(28.55
±
0.58秒)相比,这些eb3彗星在tubb4a
d249n/d249n
神经元中的平均运行时间(图13e)显著缩短(p《0.001,24.86
±
0.59秒)。同样,tubb4a
d249n/d249n
神经元(6.0
±
0.146μm)和tubb4a
d249n
神经元(6.7
±
0.14μm)中eb3彗星的平均运行长度明显短于wt神经元(7.20
±
0.19μm,p《0.001,图13f)。因此,tubb4a
d249n/d249n
神经元中的mt动力学发生了巨大而显著的改变,证实了由于tubb4a基因中存在突变而导致在神经元中的功能性细胞自主效应。
[0218]
讨论:
[0219]
本文描述的小鼠模型囊括了h-abc的行为表型特征,并展现出运动功能和步态缺陷。我们还验证了该模型的组织学表型,其包括h-abc的标志性病理学,包括髓鞘发育性丧失、严重的小脑萎缩和纹状体神经元丧失。
[0220]
在2013(24)中,由于tubb4a突变与h-abc相关,因此已鉴定出tubb4a基因中的许多其他突变(10,20)。p.asp249asn(d249n)变体与h-abc的经典特征密切相关,具有与其他突变相关的更广泛的表型。不幸的是,迄今为止,还没有可用的治疗方法。据报道,taeip大鼠模型携带tubb4a突变(纯合p.ala302thr),然而,该模型缺乏小脑和纹状体萎缩(13,25)。在这项研究中,我们试图通过开发经典突变(tubb4a
d249n
)的crispr-cas9转基因模型来完全模拟h-abc。值得注意的是,这种方法可以适用于编码表1中列出的突变tubb4a的任何核酸。纯合小鼠,如在taeip大鼠中,是显示早发表型所必需的,然而,存在于人类中的杂合突变还显示晚发疾病。物种差异的一个潜在解释是剂量敏感性,导致不同的表型外显率。这已经对于taiep大鼠模型进行了报道(13);此外,还有多个另外报道的基因,例如gata3(26)、tbx1(27)、gli3(28),其中杂合突变存在于人类中,但纯合小鼠具有与人类疾病相似的表型表达。
[0221]
tubb4a
d249n/d249n
小鼠从~p9开始表现出颤抖行为,并展现出运动发育技能和步态缺陷,与受h-abc影响个体中所见的小脑共济失调和震颤一致。随着时间的推移,他们的运动功能严重下降,与肌张力障碍的发作一致。tubb4a
d249n/d249n
小鼠在~p37时体重和存活率显著下降,大概是因为它们由于严重的肌张力障碍和痉挛性共济失调而无法进食。杂合tubb4a
d249n
小鼠没有早期证据表明在纯合小鼠中观察到严重的行为和神经病理学表型,但一年后髓鞘丧失,没有可辨别的行为表型。
[0222]
在神经病理学中,tubb4a
d249n/d249n
小鼠表现出髓鞘的减少和渐进性发育损失,这与随着时间的推移的混合的髓鞘形成不足和髓鞘形成障碍一致,这可能导致如在shiverer(29)、shimild(30)和jimpy(31)小鼠中所见的早发性震颤。tubb4a
d249n/d249n
小鼠在p14显示了严重的少突胶质细胞(ol)丧失。髓鞘丧失可能归因于ol死亡,这可以通过基于组织学的ol数量减少来证明。此外,基于tubb4a在ol中的高表达(11)和半胱天冬酶染色,我们提出tubb4a中的突变导致ol死亡。opc计数在tubb4a
d249n/d249n
小鼠中似乎是不变的,这表明tubb4a中的突变也可能影响opc分化为ol。总之,这两种机制都有助于在该模型中看到的组合的髓鞘形成不足和髓鞘形成障碍。tubb4a
d249n/d249n
小鼠也显示出在p21时小脑颗粒神经元严重丧失和~p37后显著的纹状体神经元变性的证据。这与报道的受h-abc影响的个体的病理学一致(9,32)。然而,purkinje神经元似乎完好无损。随着时间的推移,剧烈的小脑变化可能是该小鼠模型和受影响个体中出现的进行性步态异常、共济失调和运动功能障碍的基础。纹状体神经元稍微轻微的缺陷可能与tubb4a的可变表达有关,其中tubb4a在小脑中的
表达相对高于纹状体(2)。随着越来越多的tubb4a突变被报道(9,33,34),人们逐渐认识到,在纹状体、髓鞘细胞和小脑的独立参与下,突变特异性细胞效应可能是造成这种情况下广泛表型变异的原因(4,9)。
[0223]
tubb4a
d249n/d249n
小鼠提供了第一模型,可以完全实现对h-abc中受影响的相关细胞亚型的分子解剖。在神经元和ol中观察到的细胞效应可能作为独立的贡献发生,或者这些可能是附加的非细胞自主效应。检查每个细胞群的易感性对于为h-abc患者开发有效的治疗方案非常重要。
[0224]
为了剖析这一点,我们使用简化细胞培养模型研究了神经元和ol的细胞自主效应。与wt对照小鼠相比,从tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中分离的opc分化为ol的效率较低,这证实了tubb4a
d249n
在ol中的细胞自主效应,也在体内观察到的髓鞘形成不足和髓鞘形成异常中有所反映。由于olig2标记细胞的总数相似,但tubb4a
d249n
和tubb4a
d249n/d249n
小鼠中成熟ol的数量减少,这表明由于tubb4a突变,opc向成熟ol目标的分化存在缺陷。tubb4a突变的非细胞自主效应的进一步描述将需要使用条件转基因小鼠模型进行全面的基因探索。
[0225]
由于tubb4a突变导致的微管(mt)功能障碍和相关ol成熟的一些证据来自在taeip大鼠模型中进行的研究。taeip大鼠显示ol中微管的积累以及plp、mag和mbp髓鞘基因的rna核周定位,这还归因于ol中用于mbp运输的运动蛋白动力蛋白的活性增加(35)。这些关键的髓鞘蛋白需要沿着mt从ol细胞体运输到外周以进行髓鞘合成。鉴于ol过程和髓鞘发育的复杂性,可以预见,沿mt的货物运输效率低下会导致tubb4a
d249n/d249n ol的成熟度和复杂性降低。
[0226]
为了剖析神经元的细胞自主效应,我们类似地研究了来自tubb4a
d249n
和tubb4a
d249n/d249n
小鼠的皮层神经元培养物,证明存活率降低和轴突和树突分支发育不良。功能研究揭示了mt加末端聚合的距离和时间较短,表明含有tubb4a
d249n
和tubb4a
d249n/d249n
突变的神经元中不稳定的mt动力学。mt是神经元发育和功能不可或缺的一部分,其有助于神经元结构、极性、生长锥动力学、细胞内运输(36),并且突变tubb4a蛋白可能影响这些关键功能。α-微管蛋白和β-微管蛋白的许多突变归因于一系列以神经元迁移、分化和轴突引导缺陷为特征的神经系统疾病(37-39)。与我们的研究类似,小鼠皮层神经元和酵母中的tubb3突变显示出改变的mt动力学并破坏了mt与驱动蛋白马达的相互作用(40)。帕金森病(41)和als(42)的研究表明,改变的mt动力学损害了对主动运输至关重要的轴突运输,并且可行的是,tubb4a
d249n/d249n
导致低效的mt动力学,阻碍了轴突伸长和树突分支所需的货物运输。虽然这些研究是在来自tubb4a
d249n/d249n
小鼠的皮层神经元中进行的,但在纹状体或小脑颗粒神经元中预计会有类似或更显著的效果。
[0227]
mt表面的特定残基可调节许多蛋白质相互作用,并且这些残基的变化会影响其功能,从而导致一系列神经系统疾病(39)。mt动力学可以由于赋予mt稳定性的翻译后修饰(ptm)改变,例如酪氨酸化、乙酰化、多胺化、谷氨酰化、甘氨酰化和谷胱甘肽化(43)。由于tubb4a功能结构域中p.asp249asn突变的位置被认为会影响组装微管的稳定性(4),因此可行的是,ptm的变化可能是tubb4a
d249n
介导的mt异常的一个促成因素。ptm可以进一步改变运动蛋白的结合,例如驱动蛋白、动力蛋白和mt相关蛋白(map),例如对细胞器和货物分子运输至关重要的tau和双皮质蛋白(36)。然而,tubb4a突变影响微管功能的确切机制仍然未
atrophy of the basal ganglia and cerebellum(h-abc).am j med genet a.2014;164a(7):1802-7.
[0237]
7.purnell sm,bleyl sb,and bonkowsky jl.clinical exome sequencing identifies a novel tubb4a mutation in a child with static hypomyelinating leukodystrophy.pediatr neurol.2014;50(6):608-11.
[0238]
8.miyatake s,osaka h,shiina m,sasaki m,takanashi j,haginoya k,wada t,morimoto m,ando n,ikuta y,et al.expanding the phenotypic spectrum of tubb4a-associated hypomyelinating leukoencephalopathies.neurology.2014;82(24):2230-7.
[0239]
9.pizzino a,pierson tm,guo y,helman g,fortini s,guerrero k,saitta s,murphy jl,padiath q,xie y,et al.tubb4a de novo mutations cause isolated hypomyelination.neurology.2014;83(10):898-902.
[0240]
10.nahhas n ca,hamilton a,curiel j,simons c,van der knaap ms and vanderver a.in:adam mp ah,pagon ra ed.[internet].seattle(wa):university of washington,seattle;2016.
[0241]
11.zhang y,chen k,sloan sa,bennett ml,scholze ar,o'keeffe s,phatnani hp,guarnieri p,caneda c,ruderisch n,et al.an rna-sequencing transcriptome and splicing database of glia,neurons,and vascular cells of the cerebral cortex.j neurosci.2014;34(36):11929-47.
[0242]
12.duncan id,bugiani m,radcliff ab,moran jj,lopez-anido c,duong p,august bk,wolf ni,van der knaap ms,and svaren j.a mutation in the tubb4a gene leads to microtubule accumulation with hypomyelination and demyelination.ann neurol.2017;81(5):690-702.
[0243]
13.li fy,song j,and duncan id.mapping of taiep rat phenotype to rat chromosome 9.mamm genome.2003;14(10):703-5.
[0244]
14.feather-schussler dn,and ferguson ts.a battery of motor tests in a neonatal mouse model of cerebral palsy.j vis exp.2016117).
[0245]
15.shiotsuki h,yoshimi k,shimo y,funayama m,takamatsu y,ikeda k,takahashi r,kitazawa s,and hattori n.a rotarod test for evaluation of motor skill learning.j neurosci methods.2010;189(2):180-5.
[0246]
16.sahinkaya fr,milich lm,and mctigue dm.changes in ng2 cells and oligodendrocytes in a new model of intraspinal hemorrhage.exp neurol.2014;255(113-26.
[0247]
17.lancaster e,li j,hanania t,liem r,scheideler ma,and scherer ss.myelinated axons fail to develop properly in a genetically authentic mouse model of charcot-marie-tooth disease type 2e.exp neurol.2018;308(13-25.
[0248]
18.guedes-dias p,nirschl jj,abreu n,tokito mk,janke c,magiera mm,and holzbaur elf.kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse.curr biol.2019;29(2):268-82 e8.
neuroprotective in amyotrophic lateral sclerosis.j biol chem.2007;282(32):23465-72.
[0273]
43.janke c.the tubulin code:molecular components,readout mechanisms,and functions.j cell biol.2014;206(4):461-72.
[0274]
44.skarnes wc,rosen b,west ap,koutsourakis m,bushell w,iyer v,mujica ao,thomas m,harrow j,cox t,et al.a conditional knockout resource for the genome-wide study of mouse gene function.nature.2011;474(7351):337-42.
[0275]
45.curiel j,rodriguez bey g,takanohashi a,bugiani m,fu x,wolf ni,nmezi b,schiffmann r,bugaighis m,pierson t,et al.tubb4a mutations result in specific neuronal and oligodendrocytic defects that closely match clinically distinct phenotypes.human molecular genetics.2017;26(22):4506-18.
[0276]
46.vulinovic f,krajka v,hausrat tj,seibler p,alvarez-fischer d,madoev h,park js,kumar kr,sue cm,lohmann k,et al.motor protein binding and mitochondrial transport are altered by pathogenic tubb4a variants.human mutation.2018;39(12):1901-15.
[0277]
47.truett ge,heeger p,mynatt rl,truett aa,walker ja,and warman ml.preparation of pcr-quality mouse genomic dna with hot sodium hydroxide and tris(hotshot).biotechniques.2000;29(1):52,4.
[0278]
48.lee yw,mirocha cj,shroeder dj,and walser mm.tdp-1,a toxic component causing tibial dyschondroplasia in broiler chickens,and trichothecenes from fusarium roseum'graminearum'.appl environ microbiol.1985;50(1):102-7.
[0279]
提供以下材料和方法以帮助进行实施例ii。
[0280]
ips培养方法:
[0281]
从具有tubb4a突变的个体和未受影响的个体(对照)中分离的外周血单核细胞(pbmc)被重新编程为诱导多能干细胞(ipsc)。使用流式细胞术和dna指纹识别确认了所有ipsc系的多能性标记物,以确认ipsc系的遗传完整性(maguire et.al 2019)。ipsc克隆在整个连续传代过程中表现出正常的核型,并且对所有品系进行的支原体检测均为阴性。
[0282]
ipsc的神经元分化:
[0283]
使用先前发表的双重smad抑制方案(telezhkin 2016)对纹状体中棘神经元(msn)命运进行神经诱导。简而言之,ipsc在含有tgf-β和bfgf的essential 8培养基中生长,直到它们达到70%汇合。用pbs和神经诱导sli培养基洗涤细胞,该培养基在不含视黄酸(ra)的neurobasal培养基中含有10μm sb431542、1.5μm ldn 193189、1.5μm iwr1。在第4天,将汇合的培养物以1:2的分流比传代到新鲜的matrigel包被的板上。在第8天,将培养物按1:2传代并在l1培养基中培养,该培养基在不含ra的neurobasal培养基中含有200nm ldn193189、1.5μm iwr1,每天更换培养基。d16 ipsc衍生的神经祖细胞(npcs)或直接用于神经元分化,或冷冻用于以后的分化。在npc上进行流式细胞术以寻找分化的早期标记物,例如sox2、pax6、foxg1和巢蛋白(nestin)。
[0284]
对于神经元分化,使用细胞消化液(accutase)将npc分离,并以每孔100,000个细
胞接种在涂有matrigel和100μg/ml聚-l-赖氨酸(pll)的24孔板中。d16 npc在前7天被接种在scm1培养基中,该培养基中含有advanced dmemf12、2μm pd0332991、10μm dapt、0.6mm cacl2、200μm抗坏血酸、10μm毛喉素、3μm chir99021和300μm gaba。
[0285]
在接种npc后第8天(或总共23天后),将npc在scm2培养基中培养,该培养基含有1:1advanced dmem/f-12:neurobasal a(含ra)、2μmpd0332991、3μm chir99021、0.3mm cacl2、200μm抗坏血酸、10ng/ml bdnf。每三天更换一次培养基,直到它们达到第38天,之后细胞就可以进行实验了。
[0286]
神经元细胞存活率和分析:
[0287]
在盖玻片上生长的神经元用4%pfa固定20分钟,并对tuj1(神经元标记物)、map2(树突标记物)和msn的特异性标记物(如darpp32、ctip2、gaba和foxp1)染色。将细胞在成熟后的不同时间点(第38天、第45天、第52天)固定,以通过染色来进行存活率和神经病理学分析,并使用leica显微镜对盖玻片进行成像。以盲法分析数据,并使用graphpad棱镜进行统计分析。所有的分析都是使用单因素或双因素anova和tukey事后检验完成的。*p《0.05,**p《0.01,***p《0.01。
[0288]
实施例ii
[0289]
tubb4a人类ips细胞
[0290]
正如在前面的实施例中所讨论的,基底神经节和小脑的髓鞘形成不足(h-abc)是一种罕见的脑白质营养不良,我们的小组已确定其是由tubb4a基因中的偶发的新生杂合突变引起的(simons et al.2013)。tubb4a中的单等位基因突变可能导致一系列的神经系统病症,从早发性脑病到4型成人肌张力障碍(耳语性发音障碍)。受h-abc影响的个体在此范围内,出现在幼儿时期,通常伴有肌张力障碍(hersheson et al.2013)、进行性步态障碍、言语和认知缺陷。通过以下特征性神经影像学特征,将它们与其他具有tubb4a突变的个体进一步区分:髓鞘形成低下和尾状核和壳核萎缩以及小脑萎缩(van der knaap et al.2007)。在病理标本中,背侧纹状体区域和小脑颗粒层表现出神经元丢失伴有轴突肿胀和髓鞘弥漫性缺乏(curiel et al.2017;simons et al.2013)。患有h-abc的个体约占已发表的tubb4a突变的65%,并且受单个常见突变p.asp249asn(以下简称d249n)影响的可能性更大
[0291]
在本实施例中,我们描述了来自外周血单核细胞(pbmc)的重编程诱导多能干细胞(ipsc)系,这些单核细胞是从具有h-abc和chop干细胞核心处具有其他tubb4a突变的个体中分离的(见表1)。在h-abc的背景下,我们特定重新编程了tubb4a
d249n
系的3个系,以将它们向纹状体中型多棘神经元目标分化并检查它们的病理。迄今为止获得的数据表明,与来自对照患者的神经元(黑条)相比,从tubb4a
d249n ipsc(红条)分化的中型多棘神经元的存活率降低(图16a-d,**p《0.01,***p《0.001)并且神经病理学明显(图16e,*p《0.05)。为了测试与tubb4a相关的病理是通过功能的丧失还是获得,我们在对照患者ipsc系中使用crispr删除了tubb4a,以测试敲除(tubb4ako)系是否发育正常并有效分化为纹状体神经元。事实上,我们观察到对照与对照tubb4ako ipsc的分化是相当的(图16f、g),表明tubb4a在纹状体神经元的生成中没有发育作用。
[0292]
由于tubb4a 缺失不会导致功能丧失,我们接下来测试了tubb4a
d249n
患者ipsc中tubb4a的缺失是否可以通过在患者ipsc(tubb4a
d249n ko)中产生tubb4ako来挽救病理和神
经元死亡(如图16所示)。我们进一步将tubb4a
d249n ko ipscs向神经元目标进行了分化,并观察到,与tubb4a
d249n
神经元相比,tubb4a
d249n ko中的神经元总数(图17;*p《0.05,67.10
±
4.76vs 41.55
±
5.82)和ctip2+msn(图16b;**p《0.01,43.14
±
3.38vs 17.38
±
2.01)都有显著的挽救。
[0293]
这些发现为采用下调突变体或增加野生型tubb4a的表达的措施以治疗h-abc和相关的tubb4a-相关脑白质营养不良提供了概念验证。采用这种方法的治疗方法可能包括反义寡核苷酸、rna沉默方法或通过野生型tubb4a的过表达来对抗突变tubb4a。
[0294]
实施例iii
[0295]
用于下调靶tubb4a基因的反义分子
[0296]
本发明人开发了一系列反义寡核苷酸,其可有效下调tubb4a基因表达的总体水平。下面描述的方法能够下调目标靶细胞中的野生型和突变tubb4-a表达。
[0297]
由integrated dna technologies合成11个aso。我们对这些aso进行了体外筛选,以确定最佳的aso设计。在nepa21电穿孔系统(nepa gene,美国)上,在具有100,000个细胞/孔的100μl培养基中以150v的电压对具有1μm、5μm和10μm的aso浓度的小鼠oli-neu细胞进行电穿孔。电穿孔后,将细胞转移到聚-l-鸟氨酸包被的板上并置于培养箱中。处理后48小时,用pbs洗涤细胞,然后使用purelink
tm rna mini kit(thermofisher scientific,cat:12183018a)根据制造商的说明进行rna 提取。用dnaase(invitrogen)处理后,使用superscript
tm iv第一链合成系统(thermofisher scientific,cat:18091200)将200ng rna 用于cdna。在applied biosystems quanta flex 7(thermofisher scientific,美国)上使用实时pcr分析(taqman chemistry)量化tubb4a,以及编码剪接因子的内源管家基因的mrna 表达水平,以富含精氨酸/丝氨酸-9(sfrs9)作为参照。使用δδct方法分析结果。
[0298]
反义寡核苷酸(aso)序列:电穿孔后,以下aso序列显示tubb4a在10μm时的最大下调。参见图18和图21a。
[0299]
aso 1316:序列:5’+a*+c*+a*t*a*c*g*g*c*t*g*t*c*+t*+t*+g 3’(seq id no:1)
[0300]
aso 1851:序列:5’+g*+a*+t*c*t*a*a*g*a*a*g*g*t*+g*+g*+a 3’(seq id no:2)
[0301]
*熔解tm没有使用mg2+或dntp浓度评估
[0302]
+lna修饰
[0303]
上面列出的每个序列可以任选地包括一个或多个修饰的骨架连接和/或修饰的糖。这些aso是用于下调tubb4a的可行治疗靶点。(图21)这些aso显示可在0.5μm、1μm、2μm、5μm、10μm和25μm有效下调tubb4a,且毒性最小。(图21a)事实上,当用aso治疗时,受试者显示出增加的存活率(图21b)、减少的癫痫发作(图21c)和显著改善的运动功能(图21d)。
[0304]
图19显示了使用本发明的反义寡核苷酸体内进行全动物治疗的示意图。
[0305]
图20显示了在建立的tubb4a
d249n/d249n
小鼠模型中通过将其与存活且看起来正常的tubb4a敲除(ko)小鼠杂交而下调tubb4a的治疗功效。所得的tubb4a
d249n/ko
小鼠表现出改善的运动功能、增加和延长的存活率(图20b)以及改善的运动功能(图20c)。
[0306]
实施例iv
[0307]
wt tubb4a的过表达
[0308]
本文以上信息可用于通过野生型微管蛋白的过表达来挽救与微管蛋白突变相关的表型。
[0309]
将α和β-微管蛋白与不同的微管蛋白同工型进行二聚化和交叉二聚化。虽然微管蛋白突变会导致发育性脑缺陷,但在果蝇和秀丽隐杆线虫(c.elegans)中,野生型(wt)微管蛋白的过表达胜过突变型β-微管蛋白,并挽救了相关的表型。
[0310]
在优选的实施方案中,我们证明过表达wt tubb4a增加了ol细胞系中髓鞘基因的表达(图22)。因此,使用表达载体(例如,腺相关病毒(aav))过表达wt tubb4a 将克服功能获得性tubb4a突变的毒性并挽救tubb4a
d249n/d249n
小鼠的表型。aav递送只是将感兴趣的核酸递送至细胞的一种方式。递送所需的多种额外方法和试剂描述于上文。
[0311]
wt微管蛋白过表达可以挽救突变微管蛋白模型。因此,通过在受影响细胞中相对于突变的tubb4a增加wt来改变微管蛋白的化学计量,将阻止h-abc中的神经变性。在优选的实施方案中,专有衣壳将有效地靶向灵长类动物模型中我们感兴趣的细胞。在替代实施方案中,新型病毒载体将靶向sn、cgc和/或ol以在体外过表达wt tubb4a并挽救表型。针对这些载体将改进针对相关细胞类型(ol、纹状体神经元和小脑颗粒神经元)的治疗方法。
[0312]
虽然本文已经描述了本发明的某些特征,但是本领域的普通技术人员现在将想到许多修改、替换、变化和等同物。因此,应当理解,所附权利要求旨在涵盖落入本发明的真正精神内的所有此类修改和变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1