对CD38具有特异性的抗体及其用途
对cd38具有特异性的抗体及其用途
技术领域
1.本发明属于医学领域,特别是属于肿瘤学领域。
背景技术:
2.cd38是一种ii型跨膜糖蛋白。cd38的功能包括粘附和信号事件中的受体介导以及酶活性。cd38通常存在于造血细胞和实体组织中。对于造血细胞,大多数髓质胸腺细胞是cd38
+
,静息和循环的t细胞和b细胞是cd38-,活化细胞是cd38
+
。cd38也在大约80%的静息nk细胞和单核细胞以及淋巴结生发中心淋巴母细胞、血浆b细胞和一些滤泡内细胞上表达。cd38也可以由树突细胞表达。很大比例的正常骨髓细胞,特别是前体细胞,表达cd38。此外,50-80%的脐带血细胞是cd38+,并且在生命的前两到三年内一直存在于人类血液中。除了淋巴样前体细胞外,cd38也在红细胞和血小板上表达。对于实体组织,cd38在肠道中由上皮内细胞和固有层淋巴细胞表达,在大脑中由浦肯野细胞(purkinje cells)和神经纤维缠结(neurofibrillary tangles)表达,在前列腺中由上皮细胞表达,在胰腺中由β细胞表达,在骨骼中由破骨细胞表达,在眼睛中由视网膜细胞表达,在平滑肌和横纹肌的肌膜上表达。
3.cd38也在多种恶性血液病中表达,包括多发性骨髓瘤(multiplemyeloma)、b细胞慢性淋巴细胞白血病(b-cell chronic lymphocytic leukemia)、b细胞急性淋巴细胞白血病(b-cell acute lymphocytic leukemia)、华氏巨球蛋白血症(macroglobulinemia)、原发性系统性淀粉样变性(primary systemic amyloidosis)、套细胞淋巴瘤(mantle-cell lymphoma)、前淋巴细胞/髓细胞白血病(pro-lymphocytic/myelocytic leukemia)、急性髓细胞白血病(acute myeloid leukemia)、慢性髓细胞白血病(chronic myeloid leukemia)、滤泡性淋巴瘤(follicular lymphoma)、nk-细胞白血病(nk-cell leukemia)和浆细胞白血病(plasma-cell leukemia)。例如,多发性骨髓瘤(mm)是一种异质性血液系统恶性肿瘤,其特征是在患者骨髓中积累了分泌单克隆免疫球蛋白的肿瘤浆细胞,以及溶骨性病变1。目前的治疗方法已将中位总生存期提高到6年左右,而最近开发的单克隆抗体(mab),如埃罗妥珠单抗(elotuzumab)(抗-slamf7)和达雷妥尤单抗(daratumumab)(抗cd38)进一步改善了结果
2-4
。然而,蛋白酶体抑制剂(pis)、免疫调节剂(imid)和mab治疗后,复发疾病患者的总生存率仍然极低,mm仍然是一种无法治愈的疾病。因此,需要新的治疗策略来改善患者护理,并最终开发出治愈性的治疗方法。
4.文献中描述了几种抗cd38抗体,例如lande r等人,《细胞免疫学》220(1),30-8(2002);ausiello c m等人,《组织抗原》.56(6),539-47(2000);以及cotner t等人,《国际免疫药理学杂志》3(3),255-68(1981)。例如,wo2006099875描述了几种人类抗cd38抗体。
技术实现要素:
5.发明概述:
6.如权利要求书所定义,本发明涉及对cd38具有特异性的抗体及其用途。
7.发明详述:
8.发明人开发了一种新的抗cd38/cd3双特异性t细胞接合抗体,其在体外、离体和体内引发特异性t细胞介导的cd38阳性mm细胞裂解。这种新的抗cd38/cd3双特异性t细胞接合抗体bi 38-3介导的t细胞对mm细胞的杀伤不会受到抗cd38 mab(例如达雷妥尤单抗,一种批准用于治疗mm的抗cd-38单克隆抗体)抗性机制的影响,这与治疗性抗体与fcγr的结合有关。发明人证明,bi38-3能以相似的效率介导自体t细胞介导的对来自对诊断时和复发时患者的肿瘤浆细胞的杀伤。此外,他们证明bi38-3在体外对t、b和nk细胞没有明显影响,它很容易诱导t细胞介导杀伤mm细胞,同时保护b细胞免受t细胞的细胞毒活性的影响。他们表明,bi38-3能够在体内仅3天内引发肿瘤负荷减少6倍。因此,发明人证明了bi38-3是一种治疗mm的选择性且高效的化合物,可以在一线或复发时使用,并支持对mm患者的进一步评估。
9.主要定义:
10.如本文所用,术语“cd38”在本领域具有其一般含义并且指adp-核糖基环化酶/环状adp-核糖水解酶1。cd38的示例性氨基酸序列由seq id no:1表示。cd38的胞外结构域范围从seq id no:1中第43位的氨基酸残基到第300位的氨基酸残基。
11.seq id no:1》sp|p28907|cd38_human adp-核糖基环化酶/环状adp-核糖水解酶1
12.os=homo sapiens ox=9606 gn=cd38 pe=1 sv=2
[0013][0014]
如本文所用,术语“cd3”在本领域具有其一般含义并且指帮助激活细胞毒性t细胞(cd8+幼稚t细胞)和辅助t细胞(cd4+幼稚t细胞)的cd3(分化簇3)t细胞共受体。它由一个蛋白质复合物组成,由四条不同的链组成。在哺乳动物中,该复合物包含一条cd3γ链、一条cd3δ链和两条cd3ε链。这些链与t细胞受体(tcr)和ζ链(zeta链)结合,在t淋巴细胞中产生激活信号。tcr、ζ链和cd3分子共同构成tcr复合物。cd3ε的示例性氨基酸序列由seq id no:2表示。cd3ε的胞外结构域范围从seq id no:2中第23位的氨基酸残基到第207位的氨基酸残基。
[0015]
seq id no:2》sp|p07766|cd3e_human t细胞表面糖蛋白cd3ε链os=homo sapiens
[0016]
ox=9606 gn=cd3e pf=1 sv=
[0017][0018]
因此,如本文所用的术语“抗体”用于指任何具有抗原结合区的抗体样分子,并且该术语包括由抗原结合域组成的抗体片段,例如fab
′
、fab、f(ab
′
)2、单域抗体(dabs)、tandabs二聚体、fv、scfv(单链fv)、dsfv、ds-scfv、fd、线性抗体、小体、双体、双特异性抗体片段、双抗体、三抗体(分别为scfv-fab融合、双特异性或三特异性);sc-双抗体;κ(λ)体(scfv-cl融合);bite(双特异性t细胞接合器,scfv-scfv串联以吸引t细胞);dvd-ig(双可
变结构域抗体,双特异性格式);sip(小免疫蛋白,一种小体);smip(“小型模块化免疫药物”scfv-fc二聚体);dart(ds-稳定的双体“双重亲和重新靶向”);包含一个或多个cdr等的小型抗体模拟物。制备和使用各种基于抗体的结构体和片段的技术是本领域众所周知的(参见kabat等人,1991,具体通过引用并入本文)。具体地,双抗体在ep 404,097和wo 93/11161中进一步描述;而线性抗体在zapata等人(1995)中进一步描述。抗体可以使用常规技术片段化。例如,f(ab
′
)2片段可以通过用胃蛋白酶处理抗体而产生。产生的f(ab
′
)2片段可经处理减少二硫键以产生fab
′
片段。木瓜蛋白酶消化可导致fab片段的形成。fab、fab
′
和f(ab
′
)2、scfv、fv、dsfv、fd、dabs、tandabs、ds-scfv、二聚体、小体、双体、双特异性抗体片段和其他片段也可以通过重组技术合成,或者可以通过化学合成。生产抗体片段的技术是本领域众所周知和描述的。例如beckman等人,2006;holliger和hudson,2005;le gall等人,2004;reft和heard,2001;reiter等人,1996;已经young等人,1995中的每一个都进一步描述并实现了有效抗体片段的生产。
[0019]
在天然抗体中,两条重链通过二硫键相互连接,每条重链通过二硫键连接到轻链。轻链有两种类型,λ(1)和κ(k)。有五种决定抗体分子的功能活性的主要的重链类别(或同种型):igm、igd、igg、iga和ige。每条链都包括不同的序列结构域。轻链包括两个域,可变域(vl)和恒定域(cl)。重链包括四个(α,δ,γ)到五个(μ,ε)域,一个可变域(vh)和三到四个恒定域(ch1、ch2、ch3和ch4统称为ch)。轻链(vl)和重链(vh)的可变区决定了对抗原的结合识别和特异性。轻链(cl)和重链(ch)的恒定区域赋予重要的生物学特性,如抗体链结合、分泌、跨胎盘迁移、补体结合和与fc受体(fcr)的结合。fv片段是免疫球蛋白的fab片段的n端部分,由一条轻链和一条重链的可变部分组成。抗体的特异性在于抗体结合位点和抗原决定簇之间的结构互补性。抗体结合位点由主要来自高变区或互补决定区(cdrs)的残基组成。偶尔,来自非高变区或框架区(fr)的残基可以参与抗体结合位点或影响整体结构域,从而影响结合位点。cdrs是指共同定义天然免疫球蛋白结合位点的天然fv区的结合亲和力和特异性的氨基酸序列。一个免疫球蛋白的轻链和重链各有三个cdrs,分别命名为l-cdr1、l-cdr2、l-cdr3和h-cdr1、h-cdr2、h-cdr3。因此,一个抗原结合位点通常包括六个cdrs,包括来自重链和轻链v区中各自的cdr组。框架区(frs)是指插在cdrs之间的氨基酸序列。抗体可变域中的残基通常根据kabat等人设计的系统进行编号。该系统在kabat等人,1987,免疫学上有意义的蛋白质序列中的数据,美国卫生与公共服务部,nih,usa(以下称为“kabat等人”)中提出。在本说明书中使用该编号系统。kabat残基名称并不总是与seq id序列中氨基酸残基的线性编号直接对应。实际的线性氨基酸序列可能包含比严格的kabat编号中更少或更多的氨基酸,对应于基本可变结构域的结构组分的缩短或插入,无论是框架还是互补决定区(cdr)。残基的正确kabat编号可以通过将抗体序列中的同源残基与“标准”kabat编号序列进行比对。根据kabat编号系统,重链可变域的cdrs位于残基31-35b(vh-cdr1)、残基50-65(vh-cdr2)和残基95-102(vh-cdr3)。根据kabat编号系统,轻链可变域的cdrs位于残基24-34(vl-cdr1)、残基50-56(vl-cdr2)和残基89-97(vl-cdr3)。
[0020]
如本文所用,术语“bb51抗体”是指以seq id no:3所示的重链可变域和如seq id no:4所示的轻链可变域为特征的鼠抗体。
[0021]
seq id no:3》igh vh1.87-d1.1-j1:
[0022][0023]
seq id no:4》igk vk12.44-jk5:
[0024][0025]
如本文所用,术语“scfv”是指包含至少一个含有轻链可变区的抗体片段和至少一个含有重链可变区的抗体片段组成的融合蛋白,其中轻链可变区和重链可变区是连续连接的,例如通过合成连接子,例如短的柔性多肽连接子,并且能够做为单链多肽表达,并且其中scfv保留其衍生的完整抗体的特异性。除非另有说明,如本文所用,scfv可以具有以任意顺序的vl和vh可变区,例如,相对于多肽的n端和c端,scfv可以包括vl-连接子-vh或可以包括vh-连接子-vl。如本文所用,术语“单克隆抗体”、“单克隆ab”、“单克隆抗体组合物”、“mab”等是指单分子组合物的抗体分子的制剂。单克隆抗体组合物显示出对特定表位单一的结合特异性和亲和力。因此,术语“人单克隆抗体”是指显示出单一结合特异性的抗体,其具有源自人类种系免疫球蛋白序列的可变区和恒定区。
[0026]
如本文所用,术语“嵌合抗体”是指包含非人类抗体的vh结构域和vl结构域,以及人类抗体的ch结构域和cl结构域的抗体。在一些实施方案中,“嵌合抗体”是一种抗体分子,其中(a)恒定区(即重链和/或轻链)或其一部分被改变、替换或交换,使得抗原结合位点(可变区)连接到不同或改变的类别、效应功能和/或物种的恒定区,或赋予嵌合抗体新特性的完全不同的分子,例如酶、毒素、激素、生长因子、药物等;或(b)可变区或其一部分被具有不同或改变的抗原特异性的可变区改变、替换或交换。嵌合抗体还包括灵长类抗体,特别是人源化抗体。此外,嵌合抗体可能包括在受体抗体或供体抗体中未发现的残基。这些修饰是为了进一步完善抗体性能。更多细节参见jones等人,nature321:522-525(1986);riechmann等人,nature 332:323-329(1988);和presta,curr.op.struct.biol.2:593-596(1992).(参见美国专利第4,816,567;和morrison等人,《美国国家科学协会公报》usa,81:6851-6855(1984))。
[0027]
如本文所用,术语“人源化抗体”是指具有来自人类抗体的可变区框架和恒定区的,但保留了先前非人类抗体的cdrs的抗体。在一些实施方案中,人源化抗体含有源自非人免疫球蛋白的最小序列。在大多数情况下,人源化抗体及其抗体片段可以是人免疫球蛋白(受体抗体或抗体片段),其中来自受体的互补决定区(cdr)的残基被来自非人类物种(供体抗体)的cdr的残基取代,例如具有所需特异性、亲和性和能力的小鼠、大鼠或兔子。在一些情况下,人免疫球蛋白的fv框架区(fr)残基被相应的非人类残基所取代。此外,人源化抗体/抗体片段可包以包括既不在受体抗体中也不在导入的cdr或框架序列中发现的残基。此类抗体被设计为了保持衍生结合区的非人抗体的结合特异性,但避免针对非人抗体的免疫反应。这些修饰可以进一步细化和优化抗体或抗体片段的性能。一般而言,人源化抗体或其抗体片段将包括至少一个且通常为两个可变结构域,其中全部或基本上全部的cdr区对应于非人免疫球蛋白的区域,并且全部或相当一部分fr区域是人免疫球蛋白序列的区域。人源化抗体或抗体片段还可包括至少一部分的免疫球蛋白恒定区(fc),通常是人免疫球蛋白的恒定区。更多细节参见jones等人,nature,321:522-525,1986;reichmann等人,nature,
332:323-329,1988;presta,curr.op.struct.biol.,2:593-596,1992。
[0028]
如本文所用,在抗体与预定的抗原或表位的结合方面,文中的术语“结合”通常是以低亲和力的结合,当在biacore 3000仪器中使用可溶性抗原形式作为配体和抗体作为分析物时,通过例如表面等离子体共振(spr)技术测定时,kd为约10-6
m。(ge healthcare,piscaataway,nj)是多种表面等离子共振测定格式中的一种,这些测定格式通常用于单克隆抗体的表位宾格(epitope bin panels)。通常,抗体与预定抗原结合的亲和力对应的kd比其与非特异性抗原(例如bsa、酪蛋白)结合的kd低至少十倍,例如低至少100倍,例如低至少1000倍,例如低至少10,000倍,例如低至少100,000倍,该非特异性抗原与预定抗原不相同或不密切相关。当抗体的kd非常低(即抗体具有高亲和力)时,它与抗原结合的kd通常比非特异性抗原的kd低至少10,000倍。如果抗体与抗原或表位的结合不能被检测到,(例如,在biacore 3000仪器中使用等离子共振(spr)技术,使用可溶形式的抗原作为配体并且抗体作为分析物),或者比该抗体和具有不同化学结构或氨基酸序列的抗原或表位检测到的结合少100倍、500倍、1000倍或1000倍以上,则称其基本上不结合抗原或表位。
[0029]
如本文所用,术语“双特异性抗体”在本领域具有其一般含义并且是指具有两对不同的重链和轻链以及两个不同的抗原结合位点的人工杂合抗体。
[0030]
如本文所用,术语“双特异性t细胞接合体”或“bite”是指双特异性抗体,其是由两个灵活连接的单链抗体(scfv)组成的重组蛋白构建体。所述scfv抗体中的一个特异性结合选定的、靶细胞表达的肿瘤抗原,第二个特异性结合另一种分子,例如cd3,cd3是t细胞上t细胞受体复合物的亚单位。在一些实施方案中,bite抗体能够将t细胞短暂地与靶细胞结合,同时激活t细胞的细胞溶解活性。bite介导的t细胞活化既不需要t细胞上的特异性t细胞受体,也不需要靶细胞上的mhc i分子、肽抗原或共刺激分子。
[0031]
如本文所用,术语“car-t细胞”是指经过基因改造以表达car的t淋巴细胞。car t细胞的定义涵盖t淋巴细胞的所有类别和亚类,包括cd4+、cd8+t细胞、γδt细胞(gamma delta t cells)以及效应t细胞、记忆t细胞、调节性t细胞等。经基因修饰的t淋巴细胞可以从将接受使用基因修饰的t细胞治疗的受试者“衍生”或“获得”,或者它们可以从不同受试者“衍生”或“获得”。
[0032]
如本文所用,术语“嵌合抗原受体”或“car”是指一组多肽,在最简单的实施方案中通常为两种,当在免疫效应细胞中时,其为细胞提供对靶细胞的特异性,通常为癌细胞,并产生细胞内信号。在一些实施方案中,car至少包括细胞外抗原结合结构域、跨膜结构域和细胞质信号传导结构域(本文也称为“细胞内信号传导结构域”),该细胞质信号传导结构域包括衍生自如下定义的刺激分子和/或共刺激分子的功能性信号传导结构域。在一些方面,该组多肽彼此相邻。在一些实施方案中,该组多肽包括二聚化开关,该开关在二聚化分子存在时可将多肽彼此耦联,例如可将抗原结合域耦联至细胞内信号传导结构域。在一些实施方案中,刺激分子是与t细胞受体复合物相关的ζ链(zeta chain)。在一些实施方案中,细胞质信号传导结构域进一步包含一个或多个源自至少一种如下定义的共刺激分子的功能性信号传导结构域。在一些实施方案中,共刺激分子选自本文所述的共刺激分子,例如4-1bb(即cd137)、cd27和/或cd28。在一些实施方案中,car包括嵌合融合蛋白,所述嵌合融合蛋白包括细胞外抗原结合结构域、跨膜结构域和包含源自刺激分子的功能性信号结构域的细胞内信号结构域。在一些实施方案中,car包括嵌合融合蛋白,所述嵌合融合蛋白包含细胞外
抗原结合结构域、跨膜结构域和包括源自共刺激分子的功能性信号传导结构域和源自刺激分子的功能性信号传导结构域的细胞内信号传导结构域。在一些实施方案中,car包括嵌合融合蛋白,所述嵌合融合蛋白包括胞外抗原结合域、跨膜域和细胞内信号结构域,所述细胞内信号结构域包含源自一个或多个共刺激分子的两个功能性信号结构域和源自刺激性分子的功能性信号结构域。在一些实施方案中,car包括嵌合融合蛋白,所述嵌合融合蛋白包括胞外抗原结合域、跨膜结构域和细胞内信号结构域,所述细胞内信号结构域包括源自一个或多个共刺激分子的至少两个功能性信号域和源自于一种刺激分子的功能信号结构域。在一些实施方案中,car在car融合蛋白的氨基末端(n-ter)包括任选的引导序列。在一些实施方案中,car进一步包括在细胞外抗原结合结构域的n端的引导序列,其中在car的细胞加工和定位期间,引导序列任选地从抗原结合域(例如scfv)中裂解。在特定方面,car包括融合源自单克隆抗体的单链可变片段(scfv),融合到cd3-ζ(cd3-zeta)跨膜结构域和内结构域。在一些实施方案中,car包括用于额外共刺激信号传导的结构域,例如cd3-ζ、fcr、cd27、cd28、cd137、dap10和/或ox40。在一些实施方案中,分子可以与car共表达,包括共刺激分子、用于成像(例如用于正电子发射断层扫描)的报告基因、在加入前药后有条件地消融t细胞的基因产物、归巢受体、趋化因子、趋化因子受体、细胞因子和细胞因子受体。
[0033]
如本文所用,术语“t细胞”在本领域具有其一般含义并且代表在细胞介导的免疫中起核心作用的免疫系统的重要组成部分。t细胞被称为常规淋巴细胞,因为它们其tcr(抗原的t细胞受体)识别抗原,并通过复杂的主要组织相容性分子呈递或限制。t细胞有几个亚群,每个亚群都具有不同的功能,例如cd8+t细胞、cd4+t细胞和γδt细胞。
[0034]
如本文所用,术语“cd8+t细胞”在本领域具有其一般含义并且指在其表面表达cd8的t细胞的子集。它们是mhc i类限制性的,并作为细胞毒性t细胞发挥作用。“cd8+t细胞”也称为细胞毒性t淋巴细胞(ctl)、t杀伤细胞、细胞溶解性t细胞或杀伤性t细胞。cd8抗原是免疫球蛋白超基因家族的成员,是主要组织相容性复合体i类限制性相互作用中的缔合识别元件。如本文所用,术语“肿瘤浸润性cd8+t细胞”是指患者的cd8+t细胞库,这些细胞已经离开血流并已迁移到肿瘤中。
[0035]
如本文所用,术语“cd4+t细胞”(也称为t辅助细胞或th细胞)是指在其表面表达cd4糖蛋白的t细胞,并在免疫过程中辅助其他白细胞,包括b细胞成熟为浆细胞和记忆b细胞,以及细胞毒性t细胞和巨噬细胞的激活的t细胞。cd4+t细胞在被mhc ii类分子呈递肽抗原时被激活,mhc ii类分子在抗原呈递细胞(apc)表面表达。一旦被激活,它们就会迅速分裂并分泌调节或协助主动免疫反应的细胞因子。这些细胞可以分化为几种亚型之一,包括th1、th2、th3、th17、th9、tfh或treg,它们分泌不同的细胞因子以促进不同类型的免疫反应。来自apc的信号引导t细胞进入特定的亚型。除cd4外,本领域已知的th细胞表面生物标志物包括cxcr3(th1)、ccr4、crth2(th2)、ccr6(th17)、cxcr5(tfh)以及亚型特异性表达的细胞因子和转录因子,包括t-bet、gata3、eomes、rorγt、bcl6和foxp3。
[0036]
如本文所用,术语“γδt细胞”在本领域具有其一般含义。γδt细胞通常占健康个体(人、猴)外周血淋巴细胞的1%至5%。它们参与启动保护性免疫反应,并且已经证明它们通过与抗原的直接相互作用识别它们的抗原配体,而没有任何由抗原呈递细胞的mhc分子呈递。γ9δ2t细胞(有时也称为γ2δ2t细胞)是具有可变域vγ9和vδ2的带有tcr受体的γδt细胞。它们构成了人体血液中的大部分γδt细胞。当被激活时,γδt细胞会发挥强大的、非
mhc限制的细胞毒活性,特别有效地杀死各种类型的细胞,尤其是致病细胞。这些可能是被病毒感染的细胞((poccia等人,j.leukocyte biology,1997,62:1-5)或其他细胞内寄生虫,如分枝杆菌(constant等人,感染与免疫,1995年12月,vol.63,no.12:4628-4633)或原生动物(behr等人,感染与免疫,1996,vol.64,no.8:2892-2896)。它们也可能是癌细胞(poccia等人,免疫杂志,159:6009-6015;fournie和bonneville,免疫研究所(res.immunol.),第66届免疫学论坛,147:338-347)。因此,在体外、离体或体内调节所述细胞活性的可能性将为治疗各种疾病例,如传染病(特别是病毒或寄生虫)、癌症、过敏症,甚至自身免疫和/或炎症性疾病提供新颖的、有效的治疗方法。
[0037]
如本文所用,术语“治疗方法”或“治疗”是指预防性或预防性治疗,也指治愈性或改变疾病的治疗,包括对有感染疾病风险或疑似感染疾病的患者以及患病或被诊断患有疾病或医疗状况的患者的治疗,并包括抑制临床复发。该治疗方法可以用于患有医学疾病或最终可能获得该疾病的患者,以预防、治愈、延迟疾病的发生、降低疾病的严重性或改善疾病或复发性疾病的一种或多种症状,或为了延长患者的生存期,使其超出在没有此类治疗的情况下的预期。所谓“治疗方案”是指疾病的治疗模式,例如治疗期间使用的给药模式。治疗方案可包括诱导方案和维持方案。短语“诱导方案”或“诱导期”是指用于疾病初始治疗的治疗方案(或治疗方案的一部分)。诱导方案的一般目标是在治疗方案的初始阶段为患者提供高水平的药物。诱导方案可以采用(部分或全部)“负荷治疗(loading regimen)”,这可能包括比医生在维持方案期间使用更大剂量的药物,比医生在维持方案期间更频繁地施用药物,或两者兼而有之。短语“维持方案”或“维持期”是指用于在疾病治疗期间维持患者的治疗方案(或治疗方案的一部分),例如使患者长期处于缓解状态一段时间(几个月或几年)。维持方案可以采用连续疗法(例如定期给药,例如每周、每月、每年等)或间歇疗法(例如中断治疗、间歇治疗、复发治疗或达到特定的预定标准[例如疼痛、疾病表现等]后的治疗)。
[0038]
如本文所用,术语“癌症”在本领域具有其一般含义并且指具有自主生长能力的异常细胞,即以细胞快速增殖为特征的异常状态或状况下具有侵入或扩散到身体其他部位的潜力。该术语旨在包括所有类型的癌性的生长或致癌过程、转移组织或恶性转化的细胞、组织或器官,无论其组织病理学类型或侵袭阶段如何。术语“癌症”包括但不限于各种器官系统的恶性肿瘤,例如影响肺、乳腺、甲状腺、淋巴、胃肠道和泌尿生殖道的恶性肿瘤,以及包括大多数结肠癌、肾细胞癌、前列腺癌和/或睾丸肿瘤、胶质母细胞瘤非小细胞肺癌、小肠癌和食道癌等恶性肿瘤腺癌。术语“癌症”还包括但不限于实体瘤和血源性肿瘤。
[0039]
术语“实体癌”在本领域具有其一般含义并且指选自包括但不限于头颈部鳞状细胞癌(hnscc)、肾上腺皮质癌、肛门癌、胆管癌(如嗜周癌、远端胆管癌、肝内胆管癌)、膀胱癌、骨癌(例如成骨细胞瘤、骨软骨瘤、血管瘤、软骨粘液样纤维瘤、骨肉瘤、软骨肉瘤、纤维肉瘤、恶性纤维组织细胞瘤、骨巨细胞瘤、脊索瘤、多发性骨髓瘤)、脑和中枢神经系统癌(例如脑膜瘤、星形细胞瘤、少突胶质细胞瘤、室管膜瘤、神经胶质瘤、髓母细胞瘤、神经节胶质瘤、神经鞘瘤、生殖细胞瘤、颅咽管瘤)、乳腺癌(例如原位导管癌、浸润性导管癌、浸润性小叶癌、原位小叶癌、男性乳房发育症)、宫颈癌、结直肠癌、子宫内膜癌(例如子宫内膜腺癌、腺黄癌、乳头状浆液性腺癌、透明细胞癌)、食道癌、胆囊癌(粘液腺癌、小细胞癌)、胃肠道类癌(例如绒毛膜癌、绒毛膜腺瘤)、卡波西氏肉瘤、肾癌(例如肾细胞癌)、喉癌和下咽癌、肝癌(例如血管瘤、肝腺瘤、局灶性结节增生、肝细胞癌),肺癌(例如小细胞肺癌、非小细胞肺
癌)、间皮瘤、浆细胞瘤、鼻腔和鼻窦癌(例如感觉神经母细胞瘤、中线肉芽肿)、鼻咽癌、神经母细胞瘤、口腔和口咽癌、卵巢癌、胰腺癌、阴茎癌、垂体癌、前列腺癌、视网膜母细胞瘤、横纹肌肉瘤(例如胚胎性横纹肌肉瘤、肺泡横纹肌肉瘤、多形性横纹肌肉瘤)、唾液腺癌、皮肤癌(例如黑色素瘤、非黑色素瘤皮肤癌)、胃癌、睾丸癌(例如精原细胞瘤、非精原细胞瘤生殖细胞癌)、胸腺癌、甲状腺癌(例如滤泡癌、未分化癌、低分化癌、甲状腺髓样癌)、阴道癌、外阴癌和子宫癌(例如子宫平滑肌肉瘤)。
[0040]
术语“血源性癌症”或白血病在本领域具有其一般含义并且是指血细胞的癌症。它们从骨髓开始,骨髓是制造血细胞的骨骼中心的软组织。对于白血病,骨髓开始制造异常细胞,排挤正常血细胞。
[0041]
在一些实施方案中,癌症是cd38阳性血液恶性肿瘤。
[0042]
如本文所用,术语“cd38阳性血液恶性肿瘤”是指以存在表达cd38的肿瘤细胞为特征的血液恶性肿瘤,包括白血病、淋巴瘤和骨髓瘤。这种cd38阳性血液系统恶性肿瘤的例子包括前体b细胞淋巴细胞白血病/淋巴瘤和b细胞非霍奇金淋巴瘤;急性早幼粒细胞白血病、急性淋巴细胞白血病和成熟b细胞肿瘤,如b细胞慢性淋巴细胞白血病(cll)/小淋巴细胞淋巴瘤(sll)、b细胞急性淋巴细胞白血病、b细胞幼淋巴细胞白血病、淋巴浆细胞淋巴瘤、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)包括低级、中级和高级fl、皮肤滤泡中心淋巴瘤、边缘区b细胞淋巴瘤(malt型、淋巴结和脾型)、毛细胞白血病、弥漫性大b细胞淋巴瘤(dlbcl)、伯基特淋巴瘤(bl)、浆细胞瘤、多发性骨髓瘤、浆细胞白血病、移植后淋巴组织增生性疾病、巨球蛋白血症、浆细胞白血病和间变性大细胞淋巴瘤(alcl)。
[0043]
在一些实施方案中,cd38阳性血液恶性肿瘤是多发性骨髓瘤。
[0044]
如本文所用,术语“治疗有效量”是指在必要的剂量和时间段内达到预期治疗效果的有效量。活性剂的治疗有效量可根据诸如个体的疾病状态、年龄、性别和体重,以及活性剂在个体中引发所需反应的能力等因素而变化。治疗有效量也是其中抗体或抗体部分的任何毒性或有害影响被治疗的有益作用所抵消的量。活性剂的有效剂量和给药方案取决于待治疗的疾病或状况,并且可由本领域技术人员确定。具有本领域普通技术的医师可以容易地确定和开出所需药物组合物的有效量。例如,医生可以以低于达到预期治疗效果所需的水平开始给出药物组合物中所用活性剂的剂量,并逐渐增加剂量直至达到所需效果。通常,本发明组合物的合适剂量是化合物的量,其是根据特定给药方案产生有效治疗效果的最低剂量。这种有效剂量通常取决于上述因素。例如,用于治疗用途的治疗有效量可以通过其稳定疾病进展的能力来衡量。通常,例如可以在预测人类肿瘤功效的动物模型系统中评估化合物抑制癌症的能力。治疗化合物的治疗有效量可减小肿瘤大小,或以其他方式改善患者的症状。本领域普通技术人员将能够基于诸如患者的体型、患者症状的严重程度和所选择的特定组合物或给药途径等因素来确定所述的量。本发明抑制剂的治疗有效量的示例性非限制性范围是约0.1-100mg/kg,例如约0.1-50mg/kg,例如约0.1-20mg/kg,例如约0.1-10mg/kg,例如约0.5,例如约0.3、约1、约3mg/kg、约5mg/kg或约8mg/kg。本发明抑制剂的治疗有效量的示例性非限制性范围是0.02-100mg/kg,例如约0.02-30mg/kg,例如约0.05-10mg/kg或0.1-3mg/kg,例如约0.5-2mg/kg。给药方式可以例如是静脉内、肌肉内、腹膜内或皮下,并且例如在目标部位附近施用。调整上述治疗和使用方法中的剂量方案以提供最佳的所需反应(例如治疗反应)。例如,可以施用单次剂量,可以在一段时间内施用几个分次的
剂量,或者可以根据治疗情况的紧急情况按比例减少或增加剂量。在一些实施方案中,治疗期间例如在预定的时间点监测治疗的功效。在一些实施方案中,可以通过疾病区域的可视化,或通过本文进一步描述的其他诊断方法来监测疗效,例如,通过进行一次或多次pet-ct扫描,例如使用本发明的标记抑制剂、衍生自本发明抑制剂的片段或微型抗体。如果需要,药物组合物的每日有效剂量可以作为两次、三次、四次、五次、六次或更多的子剂量在全天中以适当的间隔分开施用,任选地,以单位剂型施用。在一些实施方案中,本发明的人单克隆抗体通过长时间缓慢连续输注施用,例如超过24小时,以最小化任何不需要的副作用。本发明的抑制剂的有效剂量也可以使用每周、每两周或每三周一次的给药期来施用。给药周期可限制在8周、12周或直到临床进展确定。作为非限制性示例,根据本发明的治疗可以作为本发明抑制剂的日剂量以约0.1-100mg/kg的量提供,例如0.2、0.5、0.9、1.0、1.1、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、45、50、60、70、80、90或100mg/kg,每天,在第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40天中的至少一天,或可选地,在开始治疗后的第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20周中的至少一个,或其任何组合,每24、12、8、6、4或2小时使用单剂量或分剂量,或其任何组合。
[0045]
本发明的抗体:
[0046]
本发明的第一个目的涉及一种对cd38胞外域具有结合特异性的单克隆抗体,其包含:
[0047]
重链,包含i)seq id no:5所示的h-cdr1,ii)seq id no:6所示的h-cdr2和iii)seq id no:7所示的h-cdr3,以及,
[0048]
轻链,包含i)seq id no:8所示的l-cdr1,ii)seq id no:9所示的l-cdr2和iii)seq id no:10所示的l-cdr3。
[0049]
seq id no:5(h-cdr1):gytftsyw
[0050]
seq id no:6(h-cdr2):iypgdgdt
[0051]
seq id no:7(h-cdr3):arerttgapryfdv
[0052]
seq id no:8(l-cdr1):eniysf
[0053]
seq id no:9(l-cdr2):ntk
[0054]
seq id no:10(l-cdr3):qhhygiplt
[0055]
在一些实施方案中,本发明的单克隆抗体,其包含与seq id no:3中所示氨基酸序列具有至少70%同一性的vh结构域。
[0056]
在一些实施方案中,本发明的单克隆抗体,其包含与seq id no:4中所示的氨基酸序列具有至少70%同一性的vl结构域。
[0057]
根据本发明,第一氨基酸序列与第二氨基酸序列具有至少70%的同一性是指第一序列与第二氨基酸序列具有70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%的同一性。根据本发明,第一氨基酸序列与第二氨基酸序列具有至少90%的同一性是指第一序列与第二氨基酸序列具有90、91、92、93、94、95、96、97、98、99或100%的同一性。序列同一性通常以同一性百分比(或相似性或同源性)来衡量;百分比越高,两个序列越相似。用于比较的序列比对方法是本领域公知
的。各种程序和比对算法描述于:smith和waterman,adv.appl.math.,2:482,1981;needleman和wunsch,j.mol.biol.,48:443,1970;pearson和lipman,《美国国家科学协会公报》,美国,85:2444,1988;higgins和sharp,《基因》,73:237-244,1988;higgins和sharp,cabios,5:151-153,1989;corpet等人,nuc.acids res.,16:10881-10890,1988;huang等人,comp.appls biosci.,8:155-165,1992;以及pearson等人,meth.mol.biol.,24:307-31,1994;altschul等人,nat.genet.,6:119-129,1994,详细介绍了序列比对方法和同源性计算。举例来说,比对工具align(myers和miller,cabios 4:11-17,1989)或lfasta(pearson和lipman,1988)可用于进行序列比较(intemet1996,w.r.pearson和弗吉尼亚大学,fasta20u63版本2.0u63,发布日期1996年12月)。align将整个序列相互比较,而lfasta比较局部相似的区域。例如,这些比对工具及其各自的教程可在互联网上找到,例如ncsa网站。或者,对于大于约30个氨基酸的氨基酸序列的比较,可以采用blast 2序列功能,使用默认的blosum62矩阵,设置为默认参数(间隙存在成本为11,每个残基间隙成本为1)。当比对短肽(少于约30个氨基酸)进行比对时,应使用blast 2序列函数,使用pam30矩阵设置为默认参数(开放间隙9,扩展间隙1)。例如,可以从ncbi网站获得blast序列比较系统;也可以参考altschul等人,j.mol.biol.,215:403-410,1990;gish.&states,nature genet.,3:266-272,1993;madden等人,meth.enzymol.,266:131-141,1996;altschul等人,nucleic acids res.,25:3389-3402,1997;以及zhang和madden,genome res.,7:649-656,1997。
[0058]
因此,本发明提供了包括bb51抗体的vl区、vh区或cdrs的一个或多个功能变体的抗体。在本发明的单克隆抗体的上下文中使用的vl、vh或cdr的功能变体仍然允许抗体保留母体抗体(即bb51抗体)的亲和力/硬度和/或特异性/选择性的很大一部分(至少约50%、60%、70%、80%、90%、95%或更多),并且在某些情况下,本发明的这种单克隆抗体可能比亲本ab具有更大的亲和力、选择性和/或特异性。此类功能变体通常保留了与亲本ab显著的序列同一性。cdr变体的序列可能与亲本抗体序列的cdr序列不同,主要是通过保守替换;例如变体中至少约35%、约50%或更多、约60%或更多、约70%或更多、约75%或更多、约80%或更多、约85%或更多、约90%或更多(例如,约65-95%,例如约92%、93%或94%)的替换是保守氨基酸残基替换。cdr变体的序列可能与亲本抗体序列的cdrs序列不同,主要是通过保守替换;例如,变体中的至少10个,例如至少9、8、7、6、5、4、3、2或1个替换是保守的氨基酸残基置换。在本发明的上下文中,保守替换可以定义为通过以下的氨基酸类别内的替换:
[0059]
脂肪族残基i、l、v和m
[0060]
环烯基相关残基f、h、w和y
[0061]
疏水残基a、c、f、g、h、i、l、m、r、t、v、w和y
[0062]
带负电荷的残基d和e
[0063]
极性残基c、d、e、h、k、n、q、r、s和t
[0064]
带正电的残基h、k和r
[0065]
小残基a、c、d、g、n、p、s、t和v
[0066]
非常小的残基a、g和s
[0067]
依次涉及a、c、d、e、g、h、k、n、q、r、s、p和形成t的残基
[0068]
灵活的残基q、t、k、s、g、p、d、e和r。
[0069]
更保守的替换分组包括:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸和天冬酰胺-谷氨酰胺。与bb51抗体的cdr相比,变体cdr在亲水/亲水特性和残基重量/大小方面的保守性也被基本保留。亲水性氨基酸指数在赋予蛋白质相互作用的生物学功能方面的重要性在本领域中是普遍理解的。公认氨基酸的相对亲水特性有助于生成蛋白质的二级结构,而二级结构又决定了蛋白质与其他分子的相互作用,例如,酶、底物、受体、dna、抗体、抗原等。根据其疏水性和电荷特性,每种氨基酸都被分配了一个亲水指数,它们是:异亮氨酸(+4.5)、缬氨酸(+4.2)、亮氨酸(+3.8)、苯丙氨酸(+2.8)、半胱氨酸/胱氨酸(+2.5)、甲硫氨酸(+1.9)、丙氨酸(+1.8)、甘氨酸(-0.4)、苏氨酸(-0.7)、丝氨酸(-0.8)、色氨酸(-0.9)、酪氨酸(-1.3)、脯氨酸(-1.6)、组氨酸(-3.2)、谷氨酸(-3.5)、谷氨酰胺(-3.5)、天冬氨酸(-3.5)、天冬酰胺(-3.5)、赖氨酸(-3.9)和精氨酸(-4.5)。相似残基的保留也可以或可替代地通过相似性评分来测量,如通过使用blast程序(例如,使用标准设置blosum62、open gap=11和extended gap=1,通过ncbi可获得的blast 2.2.8)确定的。合适的变体通常表现出与亲本多肽至少约70%的同一性。
[0070]
在一些实施方案中,本发明的单克隆抗体是嵌合抗体。在一些实施方案中,本发明的单克隆抗体是具有如seq id no:3所示的重链的嵌合抗体。在一些实施方案中,单克隆抗体是具有如seq id no:4所示的轻链的嵌合抗体。在一些实施方案中,本发明的单克隆抗体是具有如seq id no:3所示的重链和如seq id no:4所示的轻链的嵌合抗体。
[0071]
在一些实施方案中,本发明的单克隆抗体是人源化抗体。
[0072]
本发明的单克隆抗体可以以上述方面的一个或多个功能或结构特征为特征,或者以所选功能和结构特征的任意组合为特征。
[0073]
本发明的抗体可以是任何同种型。同种型的选择通常由所需的效应功能指导,例如adcc诱导。示例性的同种型是igg1、igg2、igg3和igg4。可以使用人轻链恒定区κ或λ中的任一个。如果需要,本发明的单克隆抗体的类别可以通过已知方法转换。典型的类别转换技术可用于将一个igg亚类转换为另一个亚类,例如从igg1到igg2。因此,本发明的人单克隆抗体的效应功能可以通过将同种型转换为例如用于各种治疗用途的igg1、igg2、igg3、igg4、igd、iga、ige或igm抗体而改变。在一些实施方案中,本发明的抗体是全长抗体。在一些实施方案中,全长抗体是igg1抗体。在一些实施方案中,全长抗体是igg4抗体。在一些实施方案中,igg4抗体是稳定化的igg4抗体。合适的稳定化的igg4抗体的例子是其中在人igg4的重链恒定区的409位的精氨酸,如kabat等人所述的eu指数中所示的被赖氨酸、苏氨酸、甲硫氨酸或亮氨酸取代的抗体,优选赖氨酸(描述于wo2006033386)和/或其中铰链区包含cys-pro-pro-cys序列。其他合适的稳定化igg4抗体在wo2008145142中披露,其全文通过引用并入本文。在一些实施方案中,本发明的单克隆抗体是非igg4类型的抗体,例如已突变的igg1、igg2或igg3使得介导效应功能(例如adcc)的能力降低甚至消除。例如,dall
′
acqua wf等人描述了此类突变,免疫杂志177(2):1129-1138(2006)和hezareh m,j virol.75(24):12161-12168(2001).
[0074]
除了在框架或cdr区内进行的修饰或替代之外,本发明的抗体可以被设计成包括在fc区内的修饰,通常是为了改变抗体的一种或多种功能特性,例如血清半衰期、补体固定、fc受体结合和/或抗原依赖性细胞毒性。此外,本发明的单克隆抗体可以被化学修饰(例如,一个或多个化学部分可以连接到抗体上)或被修饰一改变其糖基化,以再次改变抗体的
一个或多个功能特性。例如,应当理解,本发明提供的抗体的亲和力可以使用本领域已知的任何合适的方法来改变。因此,本发明还涉及本发明的抗体分子的变体,其对cd38具有改进的亲和力。此类变体可通过多种亲和力成熟方案获得,包括突变cdrs(yang等人,j.mol.biol.,254,392-403,1995)、链式替换(marks等人,bio/technology,10,779-783,1992)、大肠杆菌突变株的使用(low等人,j.mol.biol.,250,359-368,1996)、dna替换(patten等人,curr.opin.biotechnol.,8,724-733,1997)、噬菌体显示(thompson等人,j.mol.biol.,256,77-88,1996)和有性pcr(crameri等人,nature,391,288-291,1998)。vaughan等人(同上)讨论了这些亲和力成熟的方法。
[0075]
在一些实施方案中,通过用不同的氨基酸残基替换至少一个氨基酸残基来改变fc区,以改变抗体的效应功能。例如,一个或多个氨基酸可以被不同的氨基酸残基替换,从而使得抗体对效应配体的亲和力发生改变,但保留亲本抗体的抗原结合能力。亲和力被改变的效应配体可以是,例如fc受体或补体的ci组分。这种方法在美国专利5,624,821和5,648,260中进一步详细的描述,这两个专利号都是由winter等人撰写的。
[0076]
在一些实施方案中,选自氨基酸残基的一个或多个氨基酸可以被不同的氨基酸残基替换,从而使得抗体具有改变的clq结合和/或降低或消除的补体依赖性细胞毒性(cdc)。这种方法在美国专利号6194551中由ldusogie等人进一步详细描述了该方法。
[0077]
在一些实施方案中,改变一个或多个氨基酸残基,从而改变抗体固定补体的能力。这种方法由bodmer等人在pct出版物wo 94/29351中进一步描述。在一些实施方案中,fc区被修饰以增加抗体介导抗体依赖性细胞毒性(adcc)的能力和/或通过修饰一个或多个氨基酸增加抗体对fc受体的亲和力。这种方法在pct出版物wo 00/42072中由presta进一步描述。此外,人类igg1上fcγri、fcγrii、fcγriii和fcrn的结合位点已被绘制,并且具有改进结合的变体已被描述(参见shields,r.l等人,2001j.biol.chen.276:6591-6604,wo2010106180)。
[0078]
在一些实施方案中,抗体的糖基化被修饰。例如,可以制备非糖基化抗体(即抗体缺乏糖基化)。糖基化可以被改变,例如,增加抗体对抗原的亲和力。这种碳水化合物的修饰可以通过例如改变抗体序列内的一个或多个糖基化位点来实现。例如,可以进行一个或多个氨基酸的替代,导致一个或多个可变区框架糖基化位点的消除,从而消除该位点的糖基化。这种糖基化可以增加抗体对抗原的亲和力。这样的方法由co等人在美国专利5714350和6350861中进一步详细描述。另外或可选地,可以制备具有改变类型的糖基化的抗体,例如低岩藻糖基化或非岩藻糖基化的抗体,其岩藻糖基残基的数量减少或没有,或者具有增加的二等分glcnac结构的抗体。这种改变的糖基化模式已被证明可以增加抗体的adcc能力。此类碳水化合物修饰可通过例如在具有改变的糖基化机制的宿主细胞中表达抗体来实现。本领域中已经描述了具有改变的糖基化机制的细胞并且可以将其用作宿主细胞,在其中表达本发明的重组抗体从而产生具有改变的糖基化的抗体。例如hang等人的ep 1,176,195描述了具有功能性破坏的fut8基因的细胞系,该基因编码一种岩藻糖基转移酶,使得在此类细胞系中表达的抗体表现出低岩藻糖基化或缺乏岩藻糖基残基。因此,在一些实施方案中,本发明的人单克隆抗体可通过在表现出低岩藻糖基化或非岩藻糖基化模式的细胞系中重组表达而产生,例如,编码岩藻糖基转移酶的fut8基因表达缺陷的哺乳动物细胞系。presta出版的pct出版物wo 03/035835描述了一种变异cho细胞系,即lecl3细胞,其将岩藻糖连接
到asn(297)连接的碳水化合物的能力降低,也导致宿主细胞中表达的抗体岩藻糖基化降低(另见shields,r.l.等人,2002j.biol.chem.277:26733-26740)。umana等人的pct出版物wo 99/54342描述了设计成表达糖蛋白修饰糖基转移酶(例如β(1,4)-n乙酰葡糖胺基转移酶iii(gntiii))的细胞系,使得在设计的细胞系中表达的抗体表现出增加的二等分glcnac结构,从而导致抗体的adcc活性增加(参见umana等人,1999nat.biotech.17:176-180)。eureka therapeutics进一步描述了基因工程的cho哺乳动物细胞,该细胞能够产生不含岩藻糖残基的具有改变的哺乳动物糖基化模式的抗体(http://www.eurekainc.com/a&boutus/companyoverview.html)。或者,本发明的人单克隆抗体可以在酵母或丝状真菌中产生,所述酵母或丝状真菌被设计用于哺乳动物样糖基化模式,并且能够产生缺乏岩藻糖作为糖基化模式的抗体(参见例如ep1297172b1)。
[0079]
在一些实施方案中,抗体是抗原结合片段。抗体片段可以通过常规技术获得,例如通过全长抗体的片段化或通过在重组细胞中表达编码抗体片段的核酸(参见例如evans等人,j.immunol.meth.184,123-38(1995))。然后可以按照本文所述的全长抗体的相同方式测试或筛选片段的特性。
[0080]
在一些实施方案中,本发明的单克隆抗体是一个scfv片段,包括本发明抗体的vh和vl结构域。在一些实施方案中,本发明的scfv片段由如seq id no:11所示的氨基酸序列组成。
[0081]
seq id no:11》scfv抗体
[0082][0083]
核酸分子及其用于制造本发明抗体的用途:
[0084]
本发明的单克隆抗体可以通过本领域已知的任何技术产生,例如,不限于任何化学、生物、遗传或酶促技术,无论单独或组合生产。例如,已知所需序列的氨基酸序列,本领域技术人员可以通过用于产生多肽的标准技术容易地产生所述抗体。例如,它们可以使用众所周知的固相方法合成,优选使用可商购的肽合成仪器(例如由applied biosystems,foster city,california制造的仪器)并遵循制造商的说明。或者,本发明的抗体可以通过本领域公知的重组dna技术合成。例如,在将编码抗体的dna序列并入表达载体并将此类载体引入将合适的真核或原核宿主中之后,可以获得抗体的dna表达产物,这些宿主将表达所需的抗体,随后可使用公知技术从这些宿主中分离出所需抗体。
[0085]
因此,本发明的另一个目的涉及编码本发明的单克隆抗体的核酸序列。在一些实施方案中,核酸序列编码本发明的单克隆抗体的重链和/或轻链。
[0086]
通常,所述核酸是dna或rna分子,其可包含在任何合适的载体中。如本文所用,术语“载体”旨在指能够转运与其连接的另一种核酸的核酸分子。一种类型的载体是“质粒”,它是指环状双链dna环,附加的dna片段可以连接到该环中。另一种类型的载体是病毒载体,其中附加的dna片段可以连接到病毒基因组中。某些载体能够在其被引入的宿主细胞中自主复制(例如具有细菌复制来源的细菌载体和附加型哺乳动物载体)。其他载体(例如非附
加型哺乳动物载体)可在引入宿主细胞后整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够引导与其有效连接的基因的表达。此类载体在本文中称为“重组表达载体”(或简称为“表达载体”)。通常,在重组dna技术中有用的表达载体通常是质粒的形式。在本说明书中,“质粒”和“载体”可以互换使用,因为质粒是最常用的载体形式。然而,本发明的目的是包括此类其他形式的表达载体,例如病毒载体(例如复制缺陷型逆转录病毒、腺病毒和腺相关病毒),其功能相当。
[0087]
因此,本发明的另一个目的涉及一种包含本发明核酸的载体。
[0088]
此类载体可以包括调控元素,例如启动子、增强子、终止子等,以在施用于受试者后引起或引导所述抗体的表达。用于动物细胞的表达载体中的启动子和增强子的实例包括sv40的早期启动子和增强子(mizukami t.等人,1987),moloney小鼠白血病病毒的ltr启动子和增强子(kuwana y等人,1987),免疫球蛋白h链等的启动子(mason jo等人,1985)和增强子(gillies sd等人,1983)。只要编码人类抗体c区的基因可以插入并表达,就可以使用任何动物细胞表达载体。合适载体的示例包括page107(miyaji h等人,1990)、page103(mizukami t等人,1987)、phsg274(brady g等人,1984)、pkcr(o
′
hare k等人,1981)、psg1 β d2-4-(miyaji h等人,1990)等。质粒的其他实例包括包含复制来源的复制质粒,或整合质粒,例如puc、pcdna、pbr等。病毒载体的其他实例包括腺病毒、逆转录病毒、疱疹病毒和aav载体。此类重组病毒可以通过本领域已知的技术产生,例如通过转染包装细胞或通过辅助质粒或病毒瞬时转染。病毒包装细胞的典型例子包括pa317细胞、psicrip细胞、gpenv+细胞、293细胞等。例如,可在wo 95/14785、wo 96/22378、us 5,882,877、us 6,013,516、us 4,861,719、us 5,278,056和wo 98/1中找到生产此类复制缺陷重组病毒的详细方案。
[0089]
本发明的另一个目的涉及一种已被本发明的核酸和/或载体转染、感染或转化的宿主细胞。
[0090]
术语“转化”是指将“外源”(即外在的或细胞外的)基因、dna或rna序列引入宿主细胞,以便宿主细胞表达引入的基因或序列以产生所需物质,通常是由引入的基因或序列编码的蛋白质或酶。接收并表达引入的dna或rna的宿主细胞已被“转化”。
[0091]
本发明的核酸可用于在合适的表达系统中产生本发明的单克隆抗体。术语“表达系统”是指在合适条件下的宿主细胞和相容的载体,例如用于表达由载体携带并引入宿主细胞的外源dna编码的蛋白质。常见的表达系统包括大肠杆菌宿主细胞和质粒载体、昆虫宿主细胞和杆状病毒载体(baculo virus vectors)以及哺乳动物宿主细胞和载体。宿主细胞的其他实例包括但不限于原核细胞(例如细菌)和真核细胞(例如酵母细胞、哺乳动物细胞、昆虫细胞、植物细胞等)。具体实例包括大肠杆菌、克鲁维酵母(kluyveromyces)或酵母菌(saccharomyces yeasts)、哺乳动物细胞系(例如,vero细胞、cho细胞、3t3细胞、cos细胞等)以及原代或已建立的哺乳动物细胞培养物(例如,由淋巴母细胞、成纤维细胞产生、胚胎细胞、上皮细胞、神经细胞、脂肪细胞等产生)。示例还包括小鼠sp2/0-agl4细胞(atcc crl1581)、小鼠p3x63-ag8.653细胞(atcc crl1580)、二氢叶酸还原酶基因(以下简称“dhfr基因”)存在缺陷的cho细胞(urlaub g等人,1980),大鼠yb2/3hl.p2.g11.16ag.20细胞(atcc crl1662,以下简称“yb2/0细胞”)等。
[0092]
本发明还涉及一种制造表达本发明抗体的重组宿主细胞的方法,所述方法包括以下步骤:(i)在体外或离体将如上所述的重组核酸或载体引入感受态宿主细胞,(ii)在体外
或离体培养获得的重组宿主细胞,以及(iii)任选地,选择能够表达和/或分泌所述抗体。这种重组宿主细胞可用于产生本发明的抗体。
[0093]
本发明的多特异性抗体:
[0094]
本发明的另一个目的涉及一种多特异性抗体,包括来自本发明的单克隆抗体的第一抗原结合位点和至少一个第二抗原结合位点。
[0095]
根据本发明,本发明的多特异性抗体结合cd38的胞外结构域和另一感兴趣的抗原的胞外结构域。
[0096]
在一些实施方案中,第二抗原结合位点用于组建杀伤机制,例如通过结合人类效应细胞上的抗原或通过结合细胞毒剂或第二治疗剂。
[0097]
如本文所用,术语“效应细胞”是指参与免疫应答的效应阶段的免疫细胞,与免疫应答的认知和激活阶段相反。示例性免疫细胞包括来源于骨髓或淋巴的细胞,例如淋巴细胞(例如b细胞和t细胞,包括溶细胞性t细胞(ctl))、杀伤细胞、自然杀伤细胞、巨噬细胞、单核细胞、肥大细胞和粒细胞,例如中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞。一些效应细胞表达特定的fc受体(fcrs)并执行特定的免疫功能。在一些实施方案中,效应细胞能够诱导adcc,例如自然杀伤细胞。例如,单核细胞、巨噬细胞,它们表达fcrs,参与特异性杀伤靶细胞并将抗原呈递给免疫系统的其他成分。在一些实施方案中,效应细胞可以吞噬靶抗原或靶细胞。效应细胞上特定fcr的表达可能受体液因素如细胞因子的调节。效应细胞可以吞噬靶抗原或吞噬或裂解靶细胞。下文举例说明合适的细胞毒剂和第二治疗剂,包括毒素(例如放射性标记的肽)、化学治疗剂和前药。
[0098]
在一些实施方案中,第二抗原结合位点用于组建t细胞。在一些实施方案中,第二抗原结合位点对cd3ε的胞外结构域具有特异性。
[0099]
在一些实施方案中,本发明的多特异性抗体包含抗原结合结构域,其包括、由其组成或基本上由其组成本发明的单链可变片段(scfv)。
[0100]
在一些实施方案中,抗原结合结构域包含连接肽。该连接肽可位于轻链可变区和重链可变区之间。
[0101]
本发明的多特异性抗体分子的示例性形式包括但不限于:(i)通过化学异构交联的两种抗体,一种对cd38具有特异性,另一种对另一种抗原如cd3ε具有特异性;(ii)包含两个不同抗原结合区的单一抗体;(iii)包含两个不同抗原结合区的单链抗体,例如通过额外的连接肽串联连接的两个scfvs;(iv)双可变域抗体(dvd-ig),其中每条轻链和重链包含两个通过短肽分子连接的可变结构域(wu等,双变域免疫球蛋白(dvd-ig
tm
)分子的产生和特征,在:antibody engineering,springer berlin heidelberg(2010));(v)化学连接的双特异性(fab
′
)2片段;(vi)tandab,它是两个单链双抗体的融合,形成一个四价双特异性抗体,对每个目标抗原都有两个结合位点;(vii)柔性抗体,它是scfvs与双抗体的组合,产生多价分子;(viii)所谓的“对接和锁定”分子,基于蛋白激酶a中的“二聚化和对接结构域”的,当应用于fab时,可以产生一种由两个相同的fab片段连接到不同的fab片段组成的三价双特异性结合蛋白;(ix)所谓的蝎子分子(scorpion molecule),包括例如融合到人类fab臂两个末端的两个scfvs;和(x)双抗体。
[0102]
双特异性抗体的另一种示例性形式是具有互补ch3结构域的igg样分子,以强制异源二聚体化。此类分子可使用已知技术制备,例如被称为三单抗(triomab)/四倍体
(quadroma)(trion制药/fresenius生物技术)、knob-into-hole(基因泰克),crossmab(roche)和静电匹配(amgen)、luz-y(genentech)、链交换工程结构域体(seedbody)(emd serono)、biclonic(merus)和duobody(genmab a/s)的技术。
[0103]
在一些实施方案中,通常使用duobody技术,通过受控fab臂交换获得或可获得双特异性抗体。wo2008119353和wo2011131746(均由genmab a/s)描述了通过受控fab臂交换产生双特异性抗体的体外方法。在wo2008119353中描述的一种示例性方法中,双特异性抗体通过在还原条件下孵育两种单特异性抗体之间的“fab臂”或“半分子”交换(重链和连接的轻链的交换)形成,这两个抗体均包含igg4样ch3区域。所得产物是具有两个可包含不同序列的fab臂的双特异性抗体。在wo2011131746中描述的另一个示例性方法中,通过包括以下步骤的方法制备该发明的双特异性抗体,其中第一和第二抗体中的至少一个是该发明的抗体:a)提供包括免疫球蛋白fc区的第一抗体,所述fc区包括第一ch3区;b)提供包括免疫球蛋白fc区的第二抗体,所述fc区包括第二ch3区;其中所述第一和第二ch3区的序列不同。并且使得所述第一和第二ch3区之间的异二聚体相互作用强于所述第一和第二ch3区的每个同源二聚体相互作用;c)在还原条件下将所述第一抗体与所述第二抗体一起孵育;和d)获得所述双特异性抗体,其中第一抗体是本发明的抗体,并且第二抗体具有不同的结合特异性,反之亦然。例如,可通过添加还原剂来提供还原条件,例如,选自2-巯基乙胺、二硫苏糖醇和三(2-羧基乙基)膦。步骤d)可以进一步包括例如恢复条件,使其成为非还原性或较少的还原性,例如通过去除还原剂,例如通过脱盐。优选地,第一和第二ch3区的序列不同,仅包含少数相当保守的不对称突变,使得所述第一和第二ch3区之间的异二聚体相互作用强于所述第一和第二个ch3区域的每个同源二聚体相互作用。在wo2011131746中提供了关于这些相互作用以及如何实现它们的更多细节,其全部内容通过引用并入本文。在一些其他实施方案中,本发明的双特异性抗体是igg4类的对称双特异性抗体,其包含两条重链,每条重链包含可变结构域、chl结构域和铰链区,其中在每条重链中:ch1结构域中与轻链中的半胱氨酸形成链间二硫键的半胱氨酸被另一种氨基酸取代;以及可选地,位于上部铰链区的一个或多个氨基酸被半胱氨酸取代,其中每条重链的恒定区序列相似或相同,并且每条重链的可变区不同。所述双特异性形式抗体在国际专利申请wo2013124450中描述。在一些实施方案中,本发明的双特异性抗体是一种不对称抗体,包括两条重链或重链片段,每个重链或重链片段包括至少一个可变区、铰链区和chl结构域,其中第一重链或其片段是igg4类,并且具有a)根据kabat编号系统编号的chi结构域中第127位的链间半胱氨酸被另一个氨基酸取代;和b)任选地,位于上部铰链区的一个或多个氨基酸被半胱氨酸取代,并且其中第二重链或其片段的特征在于,该链的部分或全部至少在所述可变区(例如恒定区)之外的区域具有与所述第一重链不同的氨基酸序列。所述双特异性形式抗体在国际专利申请wo2013124451中描述。
[0104]
在一些实施方案中,本发明的多特异性抗体是一种双特异性t细胞接合器(bite)抗体。
[0105]
在一些实施方案中,本发明的多特异性抗体是一种抗体。
[0106]
在一些实施方案中,本发明的多特异性抗体包括sed iq no:12中所示的序列。
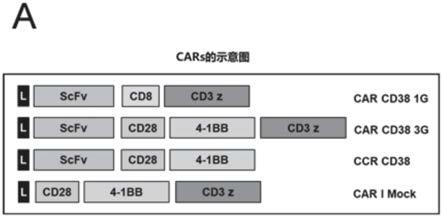
[0107]
seq id no:12》bi38-3序列
[0108][0109]
本发明还提供了一种编码本发明的多特异性抗体的核酸。在一些实施方案中,该核酸被并入如上所述的载体中。
[0110]
嵌合抗原受体(cars)及其用于制造表达所述cars的宿主细胞的用途:
[0111]
本发明还提供了嵌合抗原受体(cars),包括本发明抗体的抗原结合结构域的。
[0112]
如本文所用,术语“嵌合抗原受体”或“car”在本领域具有其一般含义,并且指人工构建的杂交蛋白质或多肽,含有与t细胞信号传导结构域相连的抗体(例如scfv)的抗原结合结构域。cars的特征包括它们能够利用单克隆抗体的抗原结合特性,以非mhc限制的方式将t细胞特异性和反应性重定向至选定靶点的能力。此外,当在t细胞中表达时,cars有利地不与内源性t细胞受体(tcr)α和β链二聚化。通常,所述嵌合抗原受体包括本发明抗体的至少一个vh和/或vl序列。本发明的嵌合抗原受体还包括细胞外铰链结构域、跨膜结构域和细胞内t细胞信号传导结构域。
[0113]
在一些实施方案中,抗原结合结构域包含连接肽。该连接肽可位于轻链可变区和重链可变区之间。
[0114]
在一些实施方案中,本发明提供包含抗原结合结构域的cars,所述抗原结合结构域包括、由或基本上由本发明的抗体的单链可变片段(scfv)组成。
[0115]
在一些实施方案中,本发明的car由如seq id no:13或seq id no:14所示的氨基酸序列组成。
[0116]
seq id no:13》car cd38 1g
[0117][0118]
seq id no:14》car cd38 3g
[0119][0120]
在一些实施方案中,car包括细胞外铰链结构域、跨膜结构域和选自由cd28、4-1bb和cd3ζ胞内结构域组成的组的胞内t细胞信号传导结构域。cd28是一种在t细胞共刺激中很重要的t细胞标志物。4-1bb向t细胞传递有效的共刺激信号,促进t淋巴细胞的分化并提高长期存活率。cd3ζ与tcrs结合产生信号,并包含基于免疫受体酪氨酸的激活基序(itam)。
[0121]
在一些实施方案中,本发明的嵌合抗原受体可以是糖基化、酰胺化、羧基化、磷酸化、酯化、n-酰基化、通过例如二硫键环化、或转化成酸加成盐和/或任选地二聚化或聚合化。
[0122]
本发明还提供了编码本发明嵌合抗原受体的核酸。在一些实施方案中,该核酸被并入如上所述的载体中。
[0123]
因此,本发明的另一个目的涉及经改造以表达上述嵌合抗原受体(car)的宿主细胞。
[0124]
在一些实施方案中,宿主细胞是细胞毒性淋巴细胞。
[0125]
如本文所用,术语“细胞毒性淋巴细胞”在本领域具有其一般含义并且指靶向破坏细胞内病原体例如病毒制剂的淋巴细胞,其中需要对受感染的靶细胞进行致命打击以限制感染的传播。根据本发明,“细胞毒性淋巴细胞”包括细胞毒性t细胞和自然杀伤细胞。
[0126]
在一些实施例中,宿主细胞是自然杀伤细胞。
[0127]
如本文所用,术语“自然杀伤细胞”在本领域具有其一般含义,是指对先天免疫系统至关重要的一类细胞毒性淋巴细胞。nk细胞的作用类似于脊椎动物适应性免疫反应中的细胞毒性t细胞。nk细胞对病毒感染细胞提供快速反应,并对肿瘤形成作出反应。
[0128]
在一些实施方案中,宿主细胞是t细胞,例如从外周血淋巴细胞(pbl)或外周血单核细胞(pbmc)中分离。在一些实施方案中,t细胞可以是任何t细胞,例如培养的t细胞,例如原代t细胞,或来自培养的t细胞系例如jurkat、suptl等的t细胞,来自哺乳动物获得的t细胞。如果从哺乳动物获得,则t细胞可从多种来源获得,包括但不限于血液、骨髓、淋巴结、胸腺或其他组织或液体。t细胞也可以被富集或纯化。t细胞可以是任何类型的t细胞并且可以是任何发育阶段的t细胞,包括但不限于cd4+/cd8+双阳性t细胞、cd4+辅助t细胞,例如th2细胞、cd8+t细胞(例如细胞毒性t细胞)、肿瘤浸润细胞、记忆t细胞、幼稚t细胞等。t细胞可以是cd8+t细胞或cd4+t细胞。
[0129]
因此,本发明的另一个目的是包含本发明的嵌合抗原受体(car)的car-t细胞。
[0130]
在一些实施方案中,宿主细胞是多能干细胞(psc)。pscs确实可以通过car进行修饰,然后可以用于衍生t细胞(例如wo 2017100403)。pscs包括胚胎干细胞(escs)和诱导多
能干细胞(ipscs)。ipscs通常可以通过将一组特定的多能性相关基因或“重编程因子”引入给定细胞类型来衍生或产生。重编程因子包括但不限于oct4(也称为“pou5fl”)、sox2、cmyc和klf4,它们也称为yamanaka因子,参见takahashi,k,yamanaka,s(2006).“通过确定的因素从小鼠胚胎和成人成纤维细胞培养物中诱导多能干细胞”。cell126(4):663-76。
[0131]
在一些实施方案中,宿主细胞是造血干细胞。如本文所用,术语“造血干细胞”或“hsc”是指具有自我更新和分化为血细胞前体能力的血细胞。这些前体细胞是不成熟的血细胞,不能自我更新,必须分化为成熟的血细胞。造血干祖细胞表现出多种表型,例如lin-cd34+cd38-cd90+cd45ra-、lin-cd34+cd38-cd90-cd45ra-、lin-cd34+cd38+il-3alocd45ra-和lin-cd34+cd38+cd10+(daley等人,focus 18:62-67,1996;pimentel,e.,ed.,《生长因子手册》第三卷:造血生长因子和细胞因子,pp.1-2,crc press,boca raton,fla.,1994)。在骨髓微环境中,干细胞自我更新并维持造血干细胞的持续生产,这些造血干细胞在整个生命过程中产生所有成熟的血细胞。在一些实施方案中,造血祖细胞或造血干细胞从外周血细胞分离。
[0132]
在一些实施方案中,如果希望优化car治疗的安全性和有效性,则可以控制car活性。可以通过多种方式对car活动进行控制。例如,使用例如与二聚化结构域融合的半胱天冬酶的诱导性细胞凋亡(参见例如di等人,n egnl.j.med.2011nov.3;365(18):1673-1683),可用作本发明的car疗法中的安全开关。
[0133]
治疗方法和药物组合物:
[0134]
本发明的抗体、多特异性抗体和car-t细胞特别适用于治疗。
[0135]
因此,本发明的另一个目的涉及对有需要的受试者进行治疗的方法,包括向受试者施用治疗有效量的本发明的抗体和/或本发明的多特异性抗体和/或本发明的car-t细胞群。
[0136]
特别地,本发明的多特异性抗体和car-t细胞特别适合治疗癌症,更特别适合治疗cd38阳性血液系统恶性肿瘤。
[0137]
因此,本发明涉及用于治疗有需要的受试者的癌症的本发明的抗体和/或本发明的多特异性抗体和/或本发明的car-t细胞群。
[0138]
在一些实施方案中,该癌症是cd38阳性癌症。
[0139]
在一些实施方案中,cd38阳性癌症是cd38阳性血液恶性肿瘤。
[0140]
在一些实施方案中,cd38阳性血液恶性肿瘤是多发性骨髓瘤。
[0141]
在一些实施方案中,该癌症是不表达或表达极低的b细胞成熟抗原(bcma)水平的癌症。
[0142]
在一些实施方案中,该癌症是不表达或表达极低的b细胞成熟抗原(bcma)水平的cd38阳性癌症。
[0143]
在一些实施方案中,该癌症是不表达或表达极低的b细胞成熟抗原(bcma)水平的cd38阳性血液恶性肿瘤。
[0144]
在一些实施方案中,本发明的多特异性抗体和/或本发明的car-t细胞群触发特异性t细胞介导的cd38阳性癌症裂解。
[0145]
在一些实施方案中,本发明的多特异性抗体和/或本发明的car-t细胞群触发特异性t细胞介导的cd38阳性癌症裂解,同时保护b细胞和nk细胞免受t细胞细胞毒性作用。
[0146]
如本文所用,术语“受试者”是指任何哺乳动物,例如啮齿动物、猫科动物、犬科动物和灵长类动物。特别地,在本发明中,受试者是患有或易患癌症的人,优选cd38阳性癌症,更优选cd38阳性血液恶性肿瘤。
[0147]
在一些实施方案中,受试者患有复发的癌症。在一些实施方案中,受试者患有复发的cd38阳性癌症。在一些实施方案中,受试者患有复发的cd38阳性血液恶性肿瘤。
[0148]
在一些实施方案中,受试者对靶向cd38的单克隆抗体(例如达雷妥尤单抗)具有抗性。
[0149]
在一些实施方案中,受试者已经接受了靶向cd38的单克隆抗体的治疗并且获得了对抗cd38单克隆抗体的抗性。
[0150]
在一个特定的实施方案中,本发明的抗体和/或本发明的多特异性抗体和/或本发明的car-t细胞群可以与抗癌疗法结合使用。
[0151]
因此,本发明涉及一种针对需要的受试者的治疗方法,包括向受试者施用治疗有效量的本发明的抗体和/或本发明的多特异性抗体和/或本发明的car-t细胞群,和ii)一种经典的治疗方法,作为治疗癌症的联合制剂。
[0152]
如本文所用,术语“抗癌疗法”在本领域具有其一般含义并且指用于治疗癌症的任何天然或合成化合物。
[0153]
在一个特定的实施方案中,抗癌疗法是指放射疗法、抗体疗法或化学疗法。
[0154]
如本文所用,术语“化学治疗剂”是指有效抑制肿瘤生长的化合物。化学治疗剂的实例包括多激酶抑制剂如索拉非尼和舒尼替尼,烷基化剂如噻替派(thiotepa)和环磷酰胺(cyclosphosphamide);烷基磺酸盐,如白消安(busulfan)、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮丙啶类,如苯并多巴(benzodopa)、卡波酮(carboquone)、美妥替哌(meturedopa)、乌瑞替派(uredopa)、乙烯亚胺(ethylenimines)和甲基胺类,包括奥曲他明、三乙烯三聚氰胺(triethylenemelamine)、三乙烯磷酰胺(trietylenephosphoramide)、三亚乙基硫代磷酰胺(triethylenethiophosphaorarnide)和三甲基三聚氰胺(trimethylolomelamine);乙酰胆碱(acetogenins)(尤其是拉它辛(bullatacin)和布拉它辛酮(bullatacinone));肉毒碱(carnptothecin)(包括合成类似物拓扑替康(topotecan));苔藓植物素(bryostatin);胼胝抑素(callystatin);cc-1065(包括阿多唑啉(adozelesin)、卡泽莱辛(carzelesin)和比泽列素(bizelesin)合成类似物);隐藻素(cryptophycins)(特别是隐藻素1和隐藻素8);多拉斯他丁(dolastatin);多卡霉素(duocarmycin)(包括合成类似物kw-2189和cbi-tmi);刺五加素(eleutherobin);潘拉司他汀(pancratistatin);肉毒杆菌素(sarcodictyin);海绵抑制素(spongistatin);氮芥类(nitrogen mustards)如苯丁酸氮芥(chlorambucil)、萘氮芥(chlornaphazine)、氯磷酰胺(cholophosphamide)、雌氮芥(estrarnustine)、异环磷酰胺(ifosfamide)、氯乙胺(mechlorethamine)、盐酸甲氯乙胺(mechlorethamine oxide hydrochloride)、苯丙氨酸氮芥(melphalan)、新恩比兴(novembichin)、胆固醇苯乙酸氮芥(phenesterine)、泼尼莫司汀(prednimus tine)、磷酰胺(trofosfamide)、尿嘧啶氮芥(uracil mustard);亚硝基脲(nitrosureas)例如卡莫司汀(carmustine)、氯唑菌素(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)、雷莫司汀(ranimustine);抗生素如烯二炔类抗生素(例如加利车霉素(calicheamicin)、尤其是加利车霉素(11和加
利车霉素211,例如请见agnew chem intl.ed.engl.33:183-186(1994));地那霉素(dynemicin)包括地那霉素a;一种埃斯培拉霉素(esperamicin)以及新制癌素发色团(neocarzinostatin chromophore)和相关色蛋白烯二炔抗生素生色团)、抑菌素(aclacinomysins)、放线菌素(actinomycin)、安曲霉素(authramycin)、氮丝氨酸(azaserine)、博来霉素类(bleomycins)、放线菌素c(cactinomycin)、卡比星(carabicin)、肉霉素(canninomycin)、嗜癌菌素(carzinophilin)、色霉素(chromomycins)、放线菌素d(dactinomycin)、道诺红菌素(daunorubicin)、地托比星(detorubicin)、6-重氮-5-氧代-l-正亮氨酸(6-diazo-5-oxo-l-norleucine)、阿霉素(doxorubicin)(包括吗啉代阿霉素(morpholino-doxorubicin)、氰基吗啉-阿霉素(cyanomorpholino-doxorubicin)、2-吡咯啉-阿霉素(2-pyrrolino-doxorubicin)和脱氧阿霉素(deoxydoxorubicin))、表柔比星(epirubicin)、依索比星(esorubicin)、伊达比星(idanrbicin)、麻西罗霉素(marcellomycin)、丝裂毒素类(mitomycins)、霉酚酸(mycophenolic acid)、诺拉霉素(nogalamycin)、橄榄霉素(olivomycins)、派来霉素(peplomycin)、腐霉素(potfiromycin)、嘌呤霉素(puromycin)、克拉霉素(quelamycin)、罗多比星(rodorubicin)、链霉素(streptomgrin)、链脲霉素(streptozocin)、结核菌素(tubercidin)、乌苯美司(ubenimex)、净司他丁(zinostatin)、佐柔比星(zorubicin);抗代谢剂如甲胺喋呤和5-氟脲嘧啶(5-fu)(5-fluorouracil(5-fu));叶酸类似物如地喋呤(denopterin)、甲胺喋呤(methotrexate)、蝶罗呤(pteropterin)、三甲氧蝶呤(trimetrexate);嘌呤类似物如氟达拉滨(fludarabine)、6-巯基嘌呤(6-mercaptopurine)、硫胺嘧啶(thiamiprine)、硫鸟嘌呤(thioguanine);嘧啶类似物如安西他滨(ancitabine)、氮杂胞苷(azacitidine)、6-氮杂尿苷(6-azauridine)、卡莫氟(carmofur)、阿糖胞苷(cytarabine)、双脱氧尿苷(dideoxyuridine)、脱氧氟尿苷(doxifluridine)、依诺他滨(enocitabine)、氟尿嘧啶脱氧核苷(floxuridine)、5-fu;雄性激素如二甲睾酮(calusterone)、丙酸屈膜斯酮(dromostanolone propionate)、环硫雄醇(epitiostanol)、环戊缩环硫雄烷(mepitiostane)、睾丸内脂(testolactone);抗肾上腺素如氨基谷氨酰胺(aminoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);叶酸补充剂如弗林酸(frolinic acid);乙酰丙酮(aceglatone);醛磷酰胺苷(aldophospharnide glycoside);氨基乙酰丙酸(aminolevulinic acid);安吖啶(amsacrine);苯丁酸苯甲酯(bestrabucil);比生群(bisantrene);依达曲沙(edatraxate);去叶黄素(defofamine);地美可辛(demecolcine);地吖醌(diaziquon);依氟鸟氨酸(elfornithine);依利醋铵(elliptinium acetate);一种埃博霉素(epothilone);乙环氧啶(etoglucid);硝酸镓水合物(gallium nitrate);羟基脲(hydroxyurea);香菇多糖(lentinan);氯尼达明(lonidamine);美登素类化合物如美登素(maytansinoids)和菌素;米托胍腙(maytansinoids);米托蒽醌(mitoxantrone);莫哌达醇(mopidamol);尼曲吖啶(nitracrine);戊糖他汀(pento statin);费纳米特(phenamet);吡柔比星(pirarubicin);鬼臼酸(podophyllinic acid);2-乙基酰肼(2-ethylhydrazide);丙卡巴肼(procarbazine);雷佐生(razoxane);根瘤菌素(rhizoxin);西佐喃(sizofiran);螺旋藻(spirogennanium);菌酮酸(tenuazonic acid);三乙烯亚胺苯醌(triaziquone);2,2
′
,2
″‑
三氯三乙胺(2,2
′
,2
″‑
trichlorotriethylarnine);单端孢霉烯
类(trichothecenes)(尤其是t-2毒素、藜芦素a(verracurin a)、杆孢菌素a(roridin a)和胍(anguidine));聚氨酯(urethan);长春酰胺(vindesine);氮烯咪胺(dacarbazine);甘露醇氮芥(mannomustine);米托溴醇(mitobromto1);米托内酯(mitolactol);哌泊溴烷(pipobroman);胞嘧啶(gacytosine);阿拉伯糖苷(arabinoside)(
″
ara-c
″
);环磷酰胺(cyclophosphamide);噻替哌(thiotepa);类紫杉醇(taxoids)类例如紫杉醇(paclitaxel)(bristol-myers squibb oncology,princeton,n)和紫杉萜(doxetaxel)(rhone-poulenc rorer,antony,france);苯丁酸氮芥(chlorambucil);吉西他滨(gemcitabine);6-硫鸟嘌呤(6-thioguanine);巯基嘌呤(mercaptopurine);甲胺喋呤(methotrexate);铂类似物如顺铂(cisp latin)和卡铂(carbop latin);长春花碱(vinblastine);铂;依托泊苷(etoposide)(vp-16);异环磷酰胺(ifosfamide);丝裂霉素c(mitomycin c;);米托蒽醌(mitoxantrone);长春新碱(vincristine);长春瑞滨(vinorelbine);诺维本(navelbine);米托蒽醌(novantrone);替尼泊苷(teniposide);柔红霉素(daunomycin);氨基喋呤(aminopterin);希罗达(xeloda);伊班膦酸(ibandronate);cpt-11;拓朴异构酶抑制剂rfs 2000(topoisomerase inhibitor rfs 2000);二氟甲基鸟氨酸(difluoromethylornithine)(dmfo);维甲酸(retinoic acid);卡培他滨(capecitabine);和药学上可接受的盐、酸或上述任何衍生物的衍生物。该定义中还包括抗激素药物,其作用是调节或抑制荷尔蒙对肿瘤的作用,例如抗雌激素,包括例如他莫昔芬(tamoxifen)、雷洛昔芬(raloxifene)、芳香化酶抑制4(5)-咪唑(4(5)-imidazoles)、4-羟基三苯氧胺(4-hydroxytamoxifen)、曲沃昔芬(trioxifene)、克昔芬(keoxifene)、ly117018、奥那司酮(onapristone)、和托瑞米芬(法乐通)(toremifene(fareston));和抗雄激素如氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、亮丙瑞林(leuprolide)、和戈舍瑞林(goserelin);以及上述任何一种的药学上可接受的盐、酸或衍生物。
[0155]
如本文所用,术语“放射疗法”在本领域具有其一般含义,并且指用电离辐射治疗癌症。电离辐射沉积能量,通过破坏其遗传物质来伤害或破坏被治疗区域(靶组织)的细胞,使这些细胞无法继续生长。一种常用的放射疗法涉及光子,例如x射线。根据它们所拥有的能量数量,这些射线可用于破坏身体表面或更深处的癌细胞。x射线束的能量越高,x射线进入靶组织的深度就越深。直线加速器和电子加速器(betatrons)产生的x射线能量越来越大。使用机器将辐射(例如x射线)聚焦在癌症部位被称为外部束放射治疗。γ射线是另一种用于放射治疗的光子形式。γ射线是在某些元素(如镭、铀和钴60)在分解或衰变时自发产生的辐射。在一些实施例中,放射疗法是外部放射疗法。外部放射疗法的实例包括但不限于传统外部束放射疗法;三维适形放射治疗(3d-crt),它从不同方向提供成型的光束以紧密贴合肿瘤的形状;调强放射治疗(imrt),例如螺旋断层放射治疗,它使放射束成形以紧密贴合肿瘤的形状,并根据肿瘤的形状改变放射剂量;适形质子束放射治疗;图像引导放射治疗(igrt),其结合扫描和放射技术,提供肿瘤的实时图像以指导放射治疗;术中放射治疗(iort),在手术过程中直接向肿瘤提供辐射;立体定向放射外科手术,可在一次疗程中向小肿瘤区域提供大而精确的辐射剂量;超分割放射治疗,例如连续超分次加速放射治疗(chart),其中每天对受试者进行一次以上的放射治疗(部分);和低分次放射治疗,其中每部分给予较大剂量的放射治疗,但分次较少。
[0156]
如本文所用,术语“免疫检查点抑制剂”是指完全或部分减少、抑制、干扰或调节一个或多个免疫检查点蛋白的分子。
[0157]
如本文所用,术语“免疫检查点蛋白”在本领域具有其一般含义,并且指由t细胞表达的分子,其中或者升高信号(刺激性检查点分子)或降低信号(抑制性检查点分子))。
[0158]
刺激检查点的例子包括cd27、cd28、cd40、cd122、cd137、ox40、gitr和icos。抑制性检查点分子的实例包括a2ar、b7-h3、b7-h4、btla、ctla-4、cd277、ido、kir、pd-1、pd-l1、lag-3、tim-3和vista。
[0159]
如本文所用,术语“联合治疗”、“联合疗法”或“治疗组合”是指使用一种以上药物的治疗。联合疗法可以是双重疗法或双重疗法。
[0160]
根据本发明,联合治疗中使用的药物同时、分开或顺序施用于受试者。
[0161]
如本文所用,术语“同时给药”是指通过相同途径并且同时或基本上同时给药2种活性成分。术语“单独给药”是指通过不同途径同时或基本同时给药2种活性成分。术语“依次给药”是指在不同时间给药2种活性成分,给药途径相同或不同
[0162]
具体地,如上所述制备的car-t细胞群可用于根据已知技术或其对本领域技术人员基于本公开内容显而易见的变体的过继性免疫疗法的方法和组合物中。例如参见grunberg等人的美国专利申请公开号2003/0170238;另见rosenberg的美国专利号4690915。目前,大多数过继性免疫疗法是针对使用患者自身免疫细胞进行治疗的自身淋巴细胞疗法(alt)。这些疗法涉及处理患者自身的淋巴细胞。通常,这些疗法是通过去除患者的淋巴细胞并将所述细胞转化为如上所述的car-t细胞群来完成的。一旦用本发明的car制备car-t细胞,这些离体细胞就会被重新融合到患者体内,以增强免疫系统对死肿瘤细胞杀伤力。在一些实施方案中,细胞的配制方法是首先将其从培养基中收获细胞,然后在适合治疗有效量的培养基和容器系统(一种“药学上可接受的”载体)中洗涤和浓缩细胞。合适的输注介质可以是任何等渗介质制剂,通常是生理盐水、normosol r(abbott)或plasma-lyte a(baxter),但也可以使用5%葡萄糖水溶液或ringer
′
s乳酸盐。该输注介质可以补充人血清白蛋白。组合物中细胞的治疗有效量取决于具有所需特异性的t细胞的相对代表性、受者的年龄和体重、靶向病症的严重程度以及靶向ags的免疫原性。这些细胞量可以低至约103/kg,优选5
×
103/kg;并且高达107/kg,优选108/kg。细胞的数量将取决于组合物的最终用途,以及其中包含的细胞类型。例如,如果需要特定ag的特异性细胞,则群体将包含大于70%,通常大于80%、85%和90-95%的此类细胞。对于本文提供的用途,细胞的体积通常为一升或更少,可以为500ml或更少,甚至250ml或100ml或更少。临床相关数量的免疫细胞可以分配到多次输注中,这些输注累计等于或超过所需细胞总量。
[0163]
对于给药,本发明的抗体被配制成药物组合物。可根据已知方法配制包含本发明抗体的药物组合物以制备药学上有用的组合物,由此将治疗分子与药学上可接受的载体混合成混合物。如果一种组合物的给药可以被接受患者耐受,则该组合物被称为“药学上可接受的载体”。无菌磷酸盐缓冲盐水是药学上可接受的载体的一个实例。其他合适的载体是本领域技术人员公知的。(例如参见gennaro(等),《雷明顿制药科学》(麦克出版公司,第9版,1995))。制剂还可包括一种或多种赋形剂、防腐剂、增溶剂、缓冲剂、白蛋白以防止小瓶表面上的蛋白质损失等。药物组合物的形式、给药途径、剂量和疗程自然取决于待治疗的病症、疾病的严重程度、患者的年龄、体重和性别等。本发明的药物组合物可以配制用于外用、口
服、肠胃外、鼻内、静脉内、肌肉内、皮下或眼内给药等。
[0164]
通常,所述药物组合物包含的载体是药物上可接受的,用于能够被注射的制剂。这些载体尤其可以是等渗的、无菌的盐溶液(磷酸一钠或磷酸二钠、钠、钾、钙或镁等或这些盐的混合物),或干燥的、尤其是冷冻干燥的组合物,根据情况加入无菌水或生理盐水,允许构成可注射溶液。
[0165]
用于给药的剂量可以根据各种参数进行调整,特别是根据所使用的给药方式、相关病理或所需的治疗持续时间进行调整。
[0166]
为了制备药物组合物,可以将有效量的抗体溶解或分散在药学上可接受的载体或水性介质中。
[0167]
适用于注射用途的药物形式包括无菌水溶液或分散液;包括芝麻油、花生油或丙二醇水溶液的制剂;以及用于临时制备无菌注射液或分散液的无菌粉末。在所有情况下,该制剂必须是无菌的,并且必须具有易于注射的程度的流动性。它在制造和储存条件下必须是稳定的,并且必须防止微生物,例如细菌和真菌的污染作用。
[0168]
作为游离碱或药学上可接受的盐的活性化合物的溶液可以在水中制备,并适当地与表面活性剂例如羟丙基纤维素混合。还可以在甘油、液体聚乙二醇及其混合物和油中制备分散体。在通常的储存和使用条件下,这些制剂含有防腐剂,以防止微生物生长。
[0169]
本发明的抗体可以配制成中性或盐形式的组合物。药学上可接受的盐包括酸加成盐(由蛋白质的游离氨基形成),并由无机酸如盐酸或磷酸,或有机酸如乙酸、草酸、酒石酸、扁桃酸等形成。与游离羧基形成的盐也可以衍生自无机碱,例如钠、钾、铵、钙或氢氧化铁,以及例如异丙胺、三甲胺、组氨酸、普鲁卡因等有机碱。
[0170]
载体还可以是包含例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、其适当的混合物和植物油的溶剂或分散介质。适当的流动性可以通过使用涂层,例如卵磷脂,在分散的情况下通过维持所需的粒子大小以及通过使用表面活性剂来保持。可以通过各种抗菌剂和抗真菌剂来防止微生物的作用,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等。在许多情况下,优选包括等渗剂,例如糖或氯化钠。通过在组合物中使用延迟吸收剂,例如单硬脂酸铝和明胶,可以延长可注射组合物的吸收时间。
[0171]
无菌可注射溶液的制备方法通过将所需量的活性化合物与上述的各种其他成分根据需要混合在合适的溶剂中,然后进行过滤除菌。通常,分散剂的制备方法是通过将各种已灭菌的活性成分掺入无菌载体中,该载体含有基本分散介质和来自上述列举的那些所需的其他成分。对于用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,从先前的无菌过滤溶液中提取活性成分粉末和任何额外的所需成分。
[0172]
还考虑制备更多或高浓度的用于直接注射的溶液,其中设想使用dmso作为溶剂会导致极快的渗透,将高浓度的活性剂输送到小肿瘤区域。
[0173]
在配制时,溶液将以与剂量制剂相容的方式并且以治疗有效的量施用。该制剂易于以多种剂型给药,例如上述可注射溶液的类型,但也可以使用药物释放胶囊等。
[0174]
对于水溶液中的肠胃外给药,例如,必要时应对溶液进行适当缓冲,并且首先使液体稀释剂与足够的盐水或葡萄糖等渗。这些特定的水溶液特别适用于静脉内、肌肉内、皮下和腹膜内给药。在这方面,根据本公开,可以使用的无菌水性介质对于本领域技术人员来说
将是已知的。例如,一个剂量可以溶解在1ml等渗nacl溶液中,然后添加到1000ml皮下裂解液中或注射到建议的输液部位(例如参见“雷明顿的制药科学”,第15版,第1035-1038页和1570-1580页)。根据治疗对象的状况,剂量必然会发生一些变化。在任何情况下,负责给药的人将确定个体受试者的适当剂量。
[0175]
本发明的抗体可在治疗混合物中配制成每剂约含有0.0001至1.0毫克,或约0.001至0.1毫克,或约0.1至1.0或甚至约10毫克左右的抗体。也可以进行多剂量给药。
[0176]
除了配制用于肠胃外给药,例如静脉内或肌肉内注射的化合物之外,其他药学上可接受的形式包括例如用于口服给药的片剂或其他固体;缓释胶囊;以及目前使用的任何其他形式。
[0177]
在一些实施方案中,考虑使用脂质体和/或纳米颗粒将抗体引入宿主细胞。脂质体和/或纳米颗粒的形成和使用是本领域技术人员已知的。
[0178]
纳米胶囊通常可以以稳定和可重复的方式捕获化合物。为了避免细胞内聚合物过载引起的副作用,这种超细颗粒(尺寸约为0.1μm)通常使用能够在体内降解的聚合物进行设计。本发明预期使用符合这些要求的可生物降解聚氰基丙烯酸烷基酯纳米颗粒,并且可以容易地制备此类颗粒。
[0179]
脂质体由分散在水性介质中并自发形成多层同心双层囊泡(也称为多细胞囊泡(mlvs))的磷脂形成。mlvs通常具有25nm至4μm的直径。mlvs的超声处理导致形成直径在200至范围内的小的单分子囊泡(suvs),在核心中含有水溶液。脂质体的物理特性取决于ph值、离子强度和二价阳离子的存在。
[0180]
本发明将通过以下附图和实施例进一步说明。然而,这些示例和图不应以任何方式解释为限制本发明的范围。
附图说明
[0181]
图1:bi38-3剂量依赖性自体t细胞介导的患者mm肿瘤细胞裂解。从患者的骨髓中纯化cd138+浆细胞,并与从pbmc中分离的自体cd3+t细胞以5:1的e:t细胞比例共培养24小时。通过facs分析培养物以监测落入活门的cd138+细胞的数量。所示为三次实验的平均值,表明4名不同患者在诊断时和3名不同患者在复发时的活cd138+细胞的百分比(相对于未治疗的情况)。直方图显示了单独的bi38-3、单独的t细胞和含有bi38-3(100ng/ml)的t细胞对5名患者诊断时(上)和3名患者复发时(下)的肿瘤浆细胞的平均影响。显示标准偏差,并使用student t检验计算p值(*p<0.05、**p<0.01、***p<0.001)。
[0182]
图2:bi38-3在mm1.slue异种移植小鼠模型中的体内活性。a.治疗时间表。nsg小鼠接种5.106mm1.slue细胞(i.v)并在第13天开始治疗,当时在所有小鼠中检测到类似水平的荧光素酶表达mm细胞。纯化的t细胞(5.106个细胞/小鼠)与bi38-3或pbs(蓝色箭头)一同静脉注射。每天重复bi38-3(0.1mg/kg)静脉注射,持续9天(黑色箭头)。在肿瘤注射后7、11、13、15、18和21(或22)天,使用ivis成像系统测量荧光素酶活性(红色箭头)。b.用于评估骨髓瘤进展/消退的连续生物发光成像。在小鼠的全身体上测量辐射。左侧图像表示接种mm.1s骨髓瘤细胞后7天和治疗开始前的发光。右侧的图像表示接种mm.1s细胞后18天和用bi38-3(上图)或载体(下图)处理后4天。辐射色标表示在右侧。c.载体(蓝线)和bi38-3(红线)处理的小鼠的纵向辐射水平。代表每组9只小鼠接种了来自2个独立供体的t细胞。在第
22天时用student t检验计算p值(***p<0.001)。
[0183]
图3:抗cd38 car-t细胞的体外活性。a.不同嵌合抗原受体(car)和共刺激受体(ccr)结构的示意图。第一代(1g)car包括cd3ζ信号域,第三代car(3g)包含cd28、4-1bb和cd3z信号域。ccr包括cd28和4-1bb信号域,但缺少cd3ζ域。car mock没有抗cd38 scfv区域。b.不同car-t对体外对表达cd38的mm(mm.1s和rpmi8226)和cd38阴性成纤维细胞(hek293)细胞系的细胞毒活性。表达荧光素酶的细胞与指定的car-t细胞以不同的效应/靶标比例(e:t)培养20小时。通过测定培养物中荧光素酶的水平来确定细胞毒活性。以4个独立实验为代表。
[0184]
图4:血细胞和骨髓造血祖细胞对bi38-3的敏感性。a.bi38-3介导的t细胞裂解treg与mm1.s细胞的相对性。在mm1.s细胞存在下,将来自健康供体(n=3)的纯化t细胞与浓度增加的bi38-3共培养24小时。b.bi38-3介导的t细胞裂解cd34+骨髓造血祖细胞与mm1.s细胞的相对性。在mm1.s细胞的存在下,从健康供体(髋关节手术)(n=4)的骨髓中纯化的配对cd34+造血祖细胞和t细胞与浓度增加的bi38-3共培养24小时。使用计数珠通过facs计算活cd20+(b细胞)、foxp3+(treg细胞)、cd34+(造血祖细胞)和cd138+(mm1.s细胞)的数量,并分别表示为与未处理对照组的比率。直方图显示了每个bi38-3浓度的b、treg、cd34+造血祖细胞和mm.1s细胞的比率,误差线表示sd。cd34+群体的正态性通过shapiro-wilk正态性检验建立,p值由未配对的student t检验确定(*p<0.05、**p<0.01、***p<0.001)。
具体实施方式
[0185]
实施例1:用于治疗多发性骨髓瘤的新型cd38/cd3双特异性t细胞接合剂。
[0186]
方法:
[0187]
bi38-3的构建和纯化。
[0188]
bi38-3是由两种来自产生抗人cd38和cd3ε(分别为bb51和okt3)的小鼠杂交瘤的scfv融合产生的,通过15个氨基酸的甘氨酸-丝氨酸(g4s1x3)间隔区连接。人cd8先导肽被基因连接到融合片段的n端,并且在c端引入myc-tag和his-tag序列。bi38-3的编码序列被克隆到pcdna3表达载体(thermofisher)中,并通过测序确认。将该载体瞬时转染到hek-293t细胞中,并使用histrap hp柱(ge)从上清液中纯化出对应于bi38-3的55.6kd蛋白质。bi38-3的完整性通过考马斯蓝染色和使用抗myc-tag抗体的western blot分析。
[0189]
细胞系
[0190]
mml.s、nci-h929和kms-11mm细胞系维持在rpmi 1640培养基中,该培养基补充有10%热灭活胎牛血清、100单位/ml青霉素、10μg/ml链霉素和2mm l-谷氨酰胺。所有细胞系都被监测到有支原体污染。表达荧光素酶的mm1.s和kms-11细胞(kms111uc和mm1.sluc)是通过慢病毒转导荧光素酶表达载体(addgene,波伦蒂巨细胞病毒puro-luc(plenti cmv puro luc)(w168-1),由from eric campeau和paul kaufman赠送)。为了产生cd38缺陷的mm1.s细胞,设计了两对rna导向物用于删除cd38基因的外显子2和3。将退火后的寡核苷酸克隆到px458载体(addgene质粒id 48138,由dr feng zhang赠送)并通过测序进行验证。对于cas9缺失,使用核子感受器ii(lonza)对2
×
106mm1.sluc细胞进行核转染,每个cas9载体2μg,在培养基中孵育24小时,对gfp阳性细胞进行facs分类,并克隆到96孔板中。通过流式细胞仪分析亚克隆的cd38表达,并选择cd38阴性克隆用于进一步分析。
[0191]
血液和骨髓样本
[0192]
健康捐赠者的外周血样本来自法国血液中心(etablissement francais du sang)(efs)。从骨髓瘤患者的骨髓抽出物的白膜层中收集新鲜肿瘤浆细胞,并使用抗cd138涂层珠(miltenyi)进一步纯化。在所有情况下,根据《赫尔辛基宣言(declaration ofhelsinki)》和圣路易斯医院内部审查委员会的批准,获得了患者和志愿者的知情同意。
[0193]
流式细胞仪和细胞毒性
[0194]
为了确定kms-11luc或mm1sluc mm细胞系的裂解,将纯化的外周t细胞(效应体)在培养基中(rpmi、10%热灭活胎牛血清、100单位/ml青霉素、10μg/ml链霉素和2mm l-谷氨酰胺)与表达荧光素酶mm1.s或kms-11细胞(靶标)一同孵育,在具有不同浓度bi38-3的平底96孔中,效应子与靶标的比率为1:5。根据制造商的说明(bright-glo
tm
荧光素酶检测系统,promega),在加入萤火虫荧光素酶底物后20分钟内,使用clariostar plus光度计读板器(bmg labtech gmbh,ortenberg,德国)测定24小时后存活的mm细胞产生的荧光素酶信号。在类似的共培养条件下,通过流式细胞仪测定t细胞对原代细胞的细胞毒性。效应t细胞与纯化的靶mm细胞和bi38-3的系列稀释液共同培养。孵育后,抗人cd138-别藻蓝蛋白(apc)(克隆44f9-miltenyi biotec)、抗cd20-brilliant violet(bv)605(克隆2h7-biolegend)、抗cd4-apc/cyanine 7(克隆rpa-t4-biolegend)和抗cd8-bv421(克隆rpa-t8-biolegend)抗体被添加到细胞中以区分靶细胞和效应细胞,并使用brightcount珠(thermofisher)通过流式细胞仪测定活细胞的数量。所有facs采集均在canto ii(beckon dickinson)上进行。增殖指数的分析和计算使用flowjo进行。
[0195]
t细胞活化和增殖测定
[0196]
为了检测活化,效应细胞(t细胞)和靶细胞(mm1.s)以5∶1的比例共培养24小时,用抗人cd4-apc-花青素7(克隆rpa-t4)、抗cd8-bv421(克隆rpa-t8)、抗cd25-藻红蛋白(pe)/花青5(克隆bc96)和抗cd69-bv711(克隆fn50)抗体(均来自biolegend)染色,并通过流式细胞仪分析。为分析增殖,t细胞用celltrace violet染料(thermofisher)标记,并用mm1.s细胞或mm1.s-cd38ko与(或不与)bi38-3(10ng/ml)刺激96小时。细胞用抗cd4-apc/cy7(克隆rpa-t4)和抗cd8-bv421(克隆rpa-t8)抗体染色,并通过流式细胞仪进行分析。
[0197]
细胞培养上清液中细胞因子的定量
[0198]
使用bd
tm cba人th1/th2细胞因子试剂盒ii(beckon dickinson)分析来自细胞毒性测定的上清液中细胞因子的浓度。在canto ii上采集数据并使用fcap array
tm
软件(beckon dickinson)进行分析。
[0199]
小鼠系统性肿瘤模型
[0200]
我们使用了6到12周龄的nod/scid/il-2rγnull小鼠(the jackson laboratory),根据机构动物护理和使用委员会(comit
éꢀd′é
thique paris-nord)批准的协议。通过尾静脉注射给小鼠接种5
×ꢀ
106mm1.sluc细胞,然后在14天后,通过输注5
×
106纯化的人t细胞(使用来自miltenyi biotec的pan t细胞分离试剂盒纯化)含有(或不含)0.08mg/kg的bi38-3。每天重复尾静脉注射bi38-3(或对照组的pbs),持续9天。没有使用随机或盲法。每3或4天进行一次生物发光成像。给小鼠腹膜内注射240μl的d-荧光素(15mg/ml)(xenolight d-荧光素钾盐,perkin e1mer),15分钟后使用ivis成像系统(perkinelmer)和living image软件(perkinelmer)在25厘米的视野中以中等分档级别和
不同曝光时间进行图像采集。接种mm细胞后22天,处死所有小鼠。
[0201]
结果:
[0202]
bi38-3的构建、生产和结合性能
[0203]
bi38-3由两个源自小鼠杂交瘤的scfv组成,产生抗人cd38和cd3ε(分别为bb51和okt3),通过15个氨基酸的甘氨酸-丝氨酸(g4s1x3)间隔连接(未显示)。表1中描述了对应于抗cd38 scfv和bi38-3的抗cd38重链和轻链可变域的氨基酸序列。
[0204]
表1:来自bb515杂交瘤(抗cd38)的免疫球蛋白(igh和igk)、相应scfv和bi38-3的氨基酸序列。
[0205][0206][0207]
抗cd38 scfv位于n端,抗cd3ε scfv位于c端,然后是myc-tag和hisx6-tag序列(未显示)。用bi38-3表达载体瞬时转染的hek-293细胞进行western blot分析,显示了一种被抗myc-tag抗体识别的独特蛋白质,其预期大小为55.6kd(数据未显示)。通过histrap hp柱(ge)从瞬时转染的hek-293细胞的培养上清中纯化bi38-3。单体bi38-3蛋白的纯度通过凝
胶电泳和考马斯蓝染色来证明(数据未显示)。bi38-3与表达cd38的mm1.s、kms11和nci-h939 mm细胞的结合通过流式细胞术用识别scfv结构域的抗fab抗体进行分析。我们观察到在mm细胞系表面检测到bi38-3,对cd38表达水平较低的kms11细胞染色不太强烈,而对显示cd38水平较高的mm1.s和nci-h929细胞的信号较强(数据未显示)。为了验证bi38-3对cd38的特异性,我们使用crispr/cas9方法灭活mm1.s细胞(mm1.s-ko)中的cd38基因(数据未显示)。facs分析显示,在cd38阴性mm1.s-ko细胞表面无法检测到bi38-3(数据未显示)。因此,纯化的bi38-3有效且特异性地识别mm细胞上的cd38。
[0208]
bi38-3在体外诱导t细胞活化和增殖以响应mm细胞
[0209]
我们接下来研究了由bi38-3触发的t细胞对mm细胞的反应。首先,我们进行了facs分析以测量紫色荧光染色的t细胞的增殖指数。在mm1.s靶细胞(t)存在下,用bi38-3刺激供体效应t细胞(e)导致强劲的增殖,4天后平均5次细胞分裂(扩增指数),略高于通过用抗cd3/cd28珠处理所诱导水平(数据未显示)。增殖需要在靶细胞上表达cd38,因为用cd38缺陷型mm1.s细胞和bi38-3培养的t淋巴细胞不增殖。此外,单独的bi38-3培养和单独的mm1.s细胞培养均未诱导显著的t细胞扩增。
[0210]
其次,我们分析了cd69和cd25早期活化标志物在供体t细胞上的表达。在与mm1.s细胞共培养过夜后,cd4和cd8 t细胞很容易以bi38-3剂量依赖性方式上调两种标记物,在最高浓度下检测到高达80%的cd69阳性t细胞(数据未显示)。相比之下,我们观察到在单独用100ng/ml bi38-3刺激时表达cd25和cd69的t细胞的百分比较弱(分别为15%和30%)。此外,单独与mm1.s靶细胞共培养不会诱导激活标记的表达(数据未显示)。与此一致的是,与与野生型mm1.s细胞的共培养相比,与mm1.sko细胞和bi38-3的共培养触发了较低的cd69和cd25诱导(数据未显示),证明靶细胞上的cd38表达增强了激活标记的上调。
[0211]
最后,我们监测了bi38-3触发的细胞因子的产生。供体t细胞与mm1.s的共培养,以bi38-3剂量依赖的方式触发了干扰素-γ(ifng)、肿瘤坏死因子-α(tnfa)、白细胞介素-2(il-2)、il-4和il-10的产生(数据未显示)。相比之下,单独用bi38-3刺激或单独与mm1.s共培养不能诱导t细胞分泌任何这些细胞因子(未显示)。总而言之,这些结果表明,bi38-3在体外对表达cd38的mm细胞作出反应,指导t细胞增殖、活化和细胞因子释放。
[0212]
bi38-3在体外诱导cd38依赖性t细胞介导的mm细胞杀伤
[0213]
为了评估bi38-3的功能,我们进行了共培养试验,以测量从健康供体的pbmc中分离的效应t细胞对表达靶标kms11和mm1.s mm细胞系的萤火虫荧光素酶的细胞毒活性。将指示剩余活mm靶细胞数量的萤光素酶水平与未处理对照中观察到的萤光素酶进行比较,以确定在不同浓度的bi38-3存在下的杀伤百分比。t细胞很容易以bi38-3剂量依赖性方式杀死kms11靶细胞,半数最大有效浓度(ec
50
)约为5ng/ml,相当于该55.6kd蛋白的0.09nm(数据未显示)。在与mm1.s细胞共培养中也观察到bi38-3介导的t细胞细胞毒活性。然而,在这种表达更高水平cd38的细胞系中,ec
50
低了十倍(0.5ng/ml),表明bi38-3的效率更高。相比之下,mm1.s或kms11mm细胞的活力不受与t细胞或bi38-3共培养的影响(数据未显示)。此外,bi38-3诱导t细胞介导的mm1.s-ko细胞杀伤效果不佳,即使在最高剂量的bi38-3(1μg/ml)下,仍有大约一半的cd38缺陷型mm1.s细胞在共培养中存活(数据未显示)。因此,bi38-3对表达cd38的mm细胞具有有效的t细胞细胞毒活性。
[0214]
bi38-3在体外诱导自体t细胞介导的肿瘤浆细胞杀伤
[0215]
我们接下来分析了bi38-3通过自体t细胞诱导mm细胞裂解的潜力。在不同浓度bi38-3存在的情况下,将诊断时从患者体内分离的靶肿瘤浆细胞与纯化的自体效应t细胞以e∶t为1∶5的比例孵育。过夜共培养物的facs分析显示,活的cd138阳性mm细胞数量以bi38-3剂量依赖性方式减少,ec
50
范围为0.5至1ng/ml,具体取决于患者(图1)。重要的是,在没有t细胞的情况下,bi38-3对新鲜的原代mm细胞没有表现出毒性。bi38-3诱导的自体t细胞的细胞毒性在复发的mm患者的肿瘤浆细胞进行了进一步研究,并证明了类似的功效,ec
50
范围为0.2至1ng/ml(图1)。因此,在这些体外实验中,bi38-3在诊断和复发时触发了自体t细胞介导的肿瘤浆细胞杀伤。
[0216]
bi38-3对cd38高表达mm细胞的体外特异性活性
[0217]
虽然cd38在浆细胞上高度表达,但它也在各种细胞类型上表达,包括造血细胞亚群。为了研究bi38-3对血细胞的影响,用不同浓度的bi38-3处理来自供体的pbmc 24小时,并通过facs分析不同的细胞群(数据未显示)。我们观察到落,入活门的cd14表达单核细胞的百分比以bi38-3剂量依赖性方式显著降低(数据未显示)。相比之下,cd4和cd8 t淋巴细胞的百分比,共同代表了pbmc群体的60%左右,随着cd14阳性细胞百分比的降低,对bi38-3的反应略有增加。同样,即使在高浓度的bi38-3(100ng/ml)下,b(cd19+)和nk(cd56+)细胞群也略微升高或保持在相似水平(分别约为10%和5%)(数据未显示)。接下来,我们研究了cd38在血细胞表面的表达是否受到bi38-3的影响。facs分析表明,在含有增加剂量的bi38-3的培养物中,t、b和nk细胞上的cd38平均荧光强度(mif)保持相似(数据未显示)。与此一致,cd14+骨髓细胞上的cd38表达并未显著降低,尽管由于没有或太少的细胞可以被检测到,在较高剂量的bi38-3(1和100ng/ml)下无法进行分析。为了比较bi38-3在cd38高(cd38hi)mm与cd38中间(cd38int)细胞的活性,我们与mm1.s表达高水平的cd38(数据未显示)、新鲜分离的b细胞、表达中等量的cd38(数据未显示)和自体t细胞进行了共培养测定。在过夜培养之后,通过流式细胞仪分析活的cd20阳性b细胞和cd138阳性mm1.s细胞的百分比。我们观察到在0.1ng/ml的bi38-3浓度下,mm1.s细胞的百分比下降,并且这种下降在较高剂量下更为显著(数据未显示)。相比之下,与未经处理的条件相比,即使在高浓度的bi38-3下,存活的cd20阳性b细胞的百分比仍然保持不变(数据未显示)。
[0218]
我们开发了一种类似的自体三重培养试验来研究bi38-3对cd34+骨髓造血祖细胞和调节性t细胞(treg)的潜在毒性作用,这两种细胞都表达低水平的cd38。虽然bi38-3在低浓度(10-2ng/ml及以上)下很容易诱导mm细胞死亡,但我们发现它对foxp3+treg没有触发显著的t细胞介导的细胞毒性(图2a)。同样,浓度低于10ng/ml时,对cd34+造血祖细胞没有显著毒性(>40%存活率),在最高浓度时具有中等毒性(图2b)。总而言之,我们的结果表明,bi38-3不损害cd38的表面表达,仅触发t细胞介导的对表达高水平cd38的细胞的杀伤,而对表达中等水平cd38的细胞,如造血祖细胞、b、t或nk细胞没有毒性或毒性有限。
[0219]
总之,我们的结果表明,bi38-3不会损害cd38的表面表达,并触发t细胞介导的cd38hi细胞杀伤,而对cd38int细胞没有显著活性。
[0220]
bi38-3控制体内mm细胞的扩增
[0221]
使用人类mm异种移植小鼠模型评估bi38-3的体内抗肿瘤活性。mm1.sluc细胞被注射到nsg小鼠的尾静脉中,每4天通过ivis成像系统测量荧光素酶水平。注射mm1.s后14天,将纯化的人t细胞静脉内移植,加入或不加入bi38-3(0.08mg/kg)。每天重复使用bi38-3或
载体进行治疗7天(图2a)。注射肿瘤细胞后11天,所有小鼠都显示出相似的辐射水平(荧光素酶),表明mm细胞在bi38-3治疗之前已有效地移植到宿主动物中(图2b)。虽然对照小鼠显示出快速的肿瘤进展,但所有bi38-3治疗的动物在bi38-3治疗的前4天内显示肿瘤生长减少了五倍(图2c)。7天后,bi38-3处理的小鼠中表达荧光素酶的mm细胞的水平仅为初始水平的十分之一,比未处理的对照组低50倍。这些结果表明bi38-3可有效控制体内mm肿瘤进展。
[0222]
过论:
[0223]
我们在此报告了bi38-3的开发,这是一种新的抗cd38/cd3双特异性t细胞接合抗体,可在体外、离体和体内触发特异性t细胞介导的cd38阳性mm细胞裂解。
[0224]
靶向cd38的单克隆抗体(mab)在治疗mm
13
方面显示出治疗效率。达雷妥尤单抗是一种被批准用于mm的抗cd38 mab,无论是单独使用
14
还是与正常标准护理方案联合使用
2,15
都显示出良好的治疗效果。这些临床数据表明,在肿瘤浆细胞上高度表达的cd38是mm免疫治疗的首选靶标。然而,尽管存活率显著提高,许多接受达雷妥尤单抗治疗的患者最终因耐药机制复发,包括fcγr依赖性下调肿瘤细胞cd38,以及抑制补体依赖性细胞毒性、抗体依赖性细胞介导的细胞毒性和抗体依赖性细胞吞噬作用
16
。bi38-3缺乏在天然免疫球蛋白上发现的fc区,并通过其抗cd3 scfv组建细胞毒性t细胞而不下调靶细胞上的cd38表达(数据未显示)。因此,bi38-3介导的t细胞杀伤mm细胞不会受到抗cd38 mab,例如达雷妥尤单抗,抗性机制的影响,这与治疗性抗体与fcγr的结合有关。同样,在复发
17
时观察到并的补体抑制剂cd55和cd59对细胞毒性细胞的上调,被认为有助于抗药性,不应在bi38-3治疗后发生。此外,mm的特点是免疫系统有缺陷,将imid和地塞米松相关联的标准护理方案可能会限制细胞毒性细胞的有效性。然而,我们的数据表明bi38-3在诊断和复发时以相似的效率介导自体t细胞介导的肿瘤浆细胞杀伤(图1)。总之,这些数据表明,bi38-3可以有效地消除对标准治疗有抵抗力的患者的mm细胞,包括那些包括达雷妥尤单抗的患者。
[0225]
因为cd38在血细胞表面表达,包括t、b和nk淋巴细胞
18
,抗cd38mab可能会靶向它们并损害它们的功能。事实上,达雷妥尤单抗被证明可以消除调节性t细胞
19
,这一过程可能与治疗起始阶段t细胞数量增加和活化有关
16
。此外,达雷妥尤单抗治疗导致nk细胞耗竭
20
,并可能有利于患者对感染的易感性
21
。我们的数据显示,bi38-3在体外对t、b和nk细胞没有显著影响(数据未显示)。我们还报告说,即使在高剂量(10ng/ml)下,它也很容易诱导t细胞介导的mm细胞杀伤,同时保护b细胞免受t细胞的细胞毒活性的影响。有趣的是,这些结果与amg424的活性形成对比,amg424是一种最近描述的抗cd38 bite,后者在体外触发t细胞对b、t和nk细胞的细胞毒性
22
。虽然需要额外的实验来评估bi38-3在体内模型中的毒性,特别是对骨髓细胞的毒性,但我们的结果表明bi38-3可以有效地诱导消除mm细胞,而不影响表达低水平cd38的细胞。
[0226]
最近,已经报道了针对fc受体样5(fcrl5或fchr5)或b细胞成熟抗原(bcma)的双特异性抗体
10,12,23
。bi 836909,一种靶向bcma和cd3ε的bite,在nci-h929小鼠异种移植模型中以0.5mg/kg的剂量被证明可以消除mm细胞
23
。类似地,em801是一种含有突变fc区的不对称双特异性抗体,在相同剂量(0.5mg/kg)
10
下有效消除免疫功能低下小鼠的nci-h929细胞。bcma的表达仅限于生发b细胞,包括记忆b细胞以及正常和恶性浆细胞
24
。然而,尽管大多数mm患者表达bcma,但6-9%的病例对该标记物呈阴性,并且肿瘤浆细胞的表达水平在患者中是异质的
25,26
。此外,在用表达抗bcma嵌合抗原受体的t细胞治疗的mm患者中,bcma在肿瘤浆
细胞
27
上被下调,这一过程可能导致肿瘤逃逸和复发。总之,这些数据强调需要识别和评估mm中的其他目标。事实上,开发高效和更安全的双特异性抗体有助于改善mm的治疗。
[0227]
我们的数据表明,在异种移植模型中用bi38-3靶向cd38的剂量为0.1mg/kg是有效的(图2),该剂量显著低于类似小鼠模型中bcma双特异性抗体报告的剂量
10,23
。因此,bi-38-3可能代表一种有吸引力的治疗选择,用于表达无bcma水平或非常低bcma水平的mm病例。
[0228]
尽管bites已证明其在多种恶性肿瘤中的疗效,但它们的临床开发受到患者半衰期短的阻碍,需要通过泵持续输注9。cd19/cd3 bite blinatumomab最近被批准用于治疗急性淋巴细胞白血病(all)的微小残留病(mrd)。有趣的是,早期2期临床试验表明,与提高生存率相关的mrd阴性可能发生在第一个治疗周期结束时
28,29
。虽然blinatumomab在mrd环境中的最佳周期数仍有待在all中进一步研究,但临床数据表明,随着时间的推移,有限的bite治疗仍可能改善mrd+患者的结果。在我们的研究中,我们表明,尽管使用了高度增殖的mm细胞系(mm1.s),bi38-3仅在3天内就能够在体内将肿瘤负荷降低6倍(图2c)。因此,这种对肿瘤浆细胞的快速而显著的活性表明,与all中的blinatumomab一样,bi38-3可以在有限的周期数后消除mm患者的mrd,并改善标准治疗后的结果。
[0229]
总之,本手稿中提供的数据表面bi38-3是一种治疗mm的选择性和高效的化合物,可用于一线或复发,并支持对mm患者的进一步评估。
[0230]
实施例2:car-t细胞的生产
[0231]
方法:
[0232]
转导car-t细胞的生产
[0233]
hek293细胞用10μg car构建体和辅助质粒(pspax2和pmd2.g)转染磷酸钙。转染后12小时,更新完全培养基(dmem,10%fvs),转染后2天,收集含有逆转录病毒颗粒的无细胞上清液,离心浓缩并用于转导。t细胞(使用来自miltenyi biotec的pan t细胞分离试剂盒纯化)在培养基(rpmi1640、10%fbs、青霉素;100u/ml、链霉素;100mg/ml)中用cd3/cd28珠(thermofisher)刺激。16小时后,将细胞转移到逆转录酶结合蛋白(takara)涂覆(retronectin-coated)的(15mg/ml)6孔板(falcon)中,并用指定的慢病毒颗粒转导过夜。转导后72小时,通过流式细胞仪测量gfp和car表达以确定转导效率。转导的car-t细胞占总细胞的80%以上,用于体外实验。
[0234]
结果:
[0235]
抗cd38 car-t细胞在体外触发mm细胞裂解。
[0236]
由于bi38-3诱导的t细胞介导了mm细胞的裂解(参见实施例1),我们研究了其抗cd38 scfv是否可以在嵌合抗原受体(car)的背景下触发转基因t细胞的直接细胞杀伤作用。我们开发了第一代抗cd38 car构建体(car cd38 1g),其中包含bb51衍生的抗cd38 scfv、人类cd8的铰链和跨膜区以及cd3ζ信号结构域(图3a)。因为cd3ζ激活区与共刺激信号域的结合被证明可以增强car的活性,我们还构建了第三代抗cd38car(car cd38 3g),由抗cd38scfv、cd28跨膜区和cd28、cd137(4-1bb)和cd3ζ的信号域依次组成(图3a)。作为对照,我们生成了一个没有scfv域的car(car mock)以及一个类似于cd38 3g但缺少cd3ζ信号域的共刺激car(ccr cd38)。在表2中描述了与这些构建体对应的蛋白质序列。将编码每个car的dna序列克隆到允许gfp共表达的慢病毒载体中,以产生病毒颗粒并转导供体t细胞。所有car构建体都在人t淋巴细胞(car-t)转导时表达,然而,car cd38 3g的表达水平低于其他
构建体(数据未显示)。尽管存在这种差异,所有转导的t细胞都可以在体外扩增超过2周,并稳定表达car,这表明对表达cd38的t细胞的潜在自相残杀效应仍然允许car-t培养(数据未显示)。为了研究效应car-t细胞(e)的细胞毒功能,我们进行了不同比例的荧光素酶表达靶细胞(t)的共培养实验。与模拟和ccr cd38阴性对照相比,表达cd38的mm1.s和rpmi8288mm细胞很容易被car cd38 1g和3g裂解(图3b)。即使在低e/t比值(<2.5)下,抗cd38 car-t也能杀死mm细胞,而ccr cd38和mock转导的t细胞显示出较差的细胞毒性。相比之下,car cd38 1g和3g不诱导或几乎不诱导cd38阴性hek293细胞裂解(图3b)。因此,在不同car构建体的背景下,源自bb51杂交瘤的抗cd38 scfv可有效驱动t细胞对mm细胞的细胞毒性。
[0237]
表2:第1代和第3代抗cd38car(分别为car cd38 1g和3g)和共刺激car(ccr cd38)的氨基酸序列。
[0238]
[0239][0240]
参考文献:
[0241]
在本技术中,各种参考文献描述了与本发明相关的现有技术。这些参考文献的公开内容在此通过引用并入本公开内容。
[0242]
1dimopoulos,m.a.,richardson,p.g.,moreau,p.&anderson,k.c.。目前复发和/或难治性多发性骨髓瘤的治疗情况。肿瘤学杂志12,42-54,doi:10.1038/nrclinonc.2014.200(2015)。
[0243]
2dimopoulos,m.a.等人。达雷妥尤单抗、来那度胺和地塞米松治疗多发性骨髓瘤。新英格兰医学杂志375,1319-1331,doi:10.1056/nejmoa1607751(2016)。
[0244]
3facon,t.等人。达雷妥尤单抗加来那度胺和地塞米松治疗未经治疗的骨髓瘤。新英格兰医学杂志380,2104-2115,doi:10.1056/nejmoa1817249(2019)。
[0245]
4moreau,p.等人。新诊断的多发性骨髓瘤自体干细胞移植前后硼替佐米、沙利度胺和地塞米松联合或不联合达雷妥尤单抗(cassiopeia):一项随机、开放标签的3期研究。柳叶刀,doi:10.1016/s0140-6736(19)31240-1(2019)。
[0246]
5bannas,p.,hambach,j.&koch-nolte,f。纳米抗体和基于纳米抗体的人重链抗体作为抗肿瘤治疗剂。前免疫8,1603,doi:10.3389/fimmu.2017.01603(2017)。
[0247]
6brischwein,k.等人。mt110:一种新型双特异性单链抗体构建体,在根除已建立的肿瘤方面具有高效能。分子免疫43,1129-1143,doi:10.1016/j.molimm.2005.07.034(2006)。
[0248]
7foster,j.b.和maude,s.l。小儿白血病免疫治疗的新进展。儿科医生30,25-29,doi:10.1097/mop.0000000000000572(2018)。
[0249]
8zimmerman,z.,maniar,t.&nagorsen,d。释放t细胞的临床力量:cd19/cd3双特异性t细胞接合剂(bite(r))抗体构建blinatumomab作为潜在疗法。国际免疫学27,31-37,doi:10.1093/intimm/dxu089(2015)。
[0250]
9velasquez,m.p.,bonifant,c.l.&gottschalk,s。用双特异性抗体将t细胞重新导向血液恶性肿瘤。血液131,30-38,doi:10.1182/blood-2017-06-741058(2018)。
[0251]
10seckinger,a.等人。bcma-t细胞双特异性抗体em801用于多发性骨髓瘤治疗的靶点表达、生成、临床前活性和药代动力学。癌细胞31,396-410,doi:10.1016/j.ccell.2017.02.002(2017)。
[0252]
11hipp,s.等人。一种用于治疗多发性骨髓瘤的新型bcma/cd3双特异性t细胞接合剂在体外和体内诱导选择性裂解。白血病31,1743-1751,doi:10.1038/leu.2016.388
(2017)。
[0253]
12li,j.等人。膜近端表位通过抗fcrh5/cd3促进有效的t细胞突触形成,是杀死骨髓瘤细胞的必要条件。癌细胞31,383-395,doi:10.1016/j.ccell.2017.02.001(2017)。
[0254]
13van de donk,n.,richardson,p.g.&malavasi,f。多发性骨髓瘤中的cd38抗体:回到未来。血液131,13-29,doi:10.1182/blood-2017-06-740944(2018)。
[0255]
14usmani,s.z.等人。达雷妥尤单抗单药治疗严重预治疗的复发或难治性多发性骨髓瘤患者的临床疗效。血液128,37-44,doi:10.1182/blood-2016-03-705210(2016)。
[0256]
15palumbo,a.等人。达雷妥尤单抗、硼替佐米和地塞米松治疗多发性骨髓瘤。新英格兰医学杂志375,754-766,doi:10.1056/nejmoa1606038(2016)。
[0257]
16van de donk,n.&usmani,s.z。多发性骨髓瘤中的cd38抗体:作用机制和耐药模式。前免疫9,2134,doi:10.3389/fimmu.2018.02134(2018)。
[0258]
17nijhof,i.s.等人。cd38表达和补体抑制剂影响骨髓瘤对达雷妥尤单抗治疗的反应和耐药性。血液128,959-970,doi:10.1182/blood-2016-03-703439(2016)。
[0259]
18deaglio,s.,aydin,s.,vaisitti,t.,bergui,l.&malavasi,f。cd38位于预后标志物和治疗靶点之间的交界处。分子医学动态14,210-218,doi:10.1016/j.molmed.2008.02.005(2008)。
[0260]
19krejcik,j.等人。daratumumab在多发性骨髓瘤中消耗cd38+免疫调节细胞,促进t细胞扩增,并扭曲t细胞库。血液128,384-394,doi:10.1182/blood-2015-12-687749(2016)。
[0261]
20casneuf,t.等人。达雷妥尤单抗对自然杀伤细胞的影响以及对复发性或难治性多发性骨髓瘤临床结果的影响。血液adv 1,2105-2114,doi:10.1182/bloodadvances.2017006866(2017)。
[0262]
21nahi,h.等人。达雷妥尤单抗治疗多发性骨髓瘤后的感染性并发症和nk细胞耗竭。公共科学图书馆
·
综合14,e0211927,doi:10.1371/journal.pone.0211927(2019)。
[0263]
22zuch de zafra,c.l.等人。amg 424靶向多发性骨髓瘤,这是一种针对细胞毒性和细胞因子释放进行优化的新型抗cd38/cd3双特异性t细胞募集抗体。临床癌症研究,doi:10.1158/1078-0432.ccr-18-2752(2019)。
[0264]
23hipp,s.等人。用于治疗多发性骨髓瘤的新型bcma/cd3双特异性t细胞接受器在体外和体内诱导选择性溶解。白血病31,2278,doi:10.1038/leu.2017.219(2017)。
[0265]
24darce,j.r.,arendt,b.k.,wu,x.&jelinek,d.f。在人类b细胞分化过程中调节baff结合受体的表达。免疫学杂志179,7276-7286,doi:10.4049/jimmunol.179.11.7276(2007)。
[0266]
25lee,l.等人。评价b细胞成熟抗原作为多发性骨髓瘤抗体-药物结合物介导细胞毒性的靶点。血液学杂志174,911-922,doi:10.1111/bjh.14145(2016)。
[0267]
26salem,d.a.等人。b细胞成熟抗原的量化,新型嵌合抗原受体t细胞治疗骨髓瘤的目标。白血病研究71,106-111,doi:10.1016/j.leukres.2018.07.015(2018)。
[0268]
27brudno,j.n.等人。表达抗b细胞成熟抗原嵌合抗原受体的转基因t细胞导致预后不佳的复发性多发性骨髓瘤的缓解。临床肿瘤学杂志36,2267-2280,doi:10.1200/jco.2018.77.8084(2018)。
[0269]
28gokbuget,n.等人。blinatumomab治疗b细胞前体急性淋巴细胞白血病成人患者的最小残留疾病。血液131,1522-1531,doi:10.1182/blood-2017-08-798322(2018)。
[0270]
29topp,m.s.等人。对b系急性淋巴细胞白血病患者的化疗难治性极小残留病症采用t细胞啮合抗体blinatumomab进行靶向治疗,反应率高,无白血病生存期延长。临床肿瘤学杂志29,2493-2498,doi:10.1200/jco.2010.32.7270(2011)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1