用于生产包含重组内肽酶的酶组合物的方法与流程
用于生产包含重组内肽酶的酶组合物的方法
发明领域
1.乳糜泻(celiac disease,cd)是由谷蛋白(gluten)引发的慢性自身免疫性肠病1。谷蛋白是不溶性蛋白的异质混合物,由醇溶蛋白和麦谷蛋白组成,存在于小麦、黑麦和大麦谷物中2;谷蛋白在很大程度上不能被人类胃肠道的蛋白酶所使用,因此大的富含脯氨酸/谷氨酰胺的肽可以到达小肠并在患有cd的患者中引发体液和t细胞介导的适应性免疫反应二者。迄今为止,已经在醇溶蛋白和麦谷蛋白中均鉴定出对胃肠消化耐受的若干t细胞刺激肽;其中,来自α-醇溶蛋白的具有序列lqlqpfpqpqlpypqpqlpypqpqlpypqpqpf (seq id no:12)的33-mer肽目前被认为是免疫原性最强的肽,因为它携带在患有cd的患者中具有免疫原性的表位的多个拷贝5。
2.终身依从严格无谷蛋白饮食(gfd)是目前用于cd患者的治疗方法6。然而,完全避免谷蛋白实际上是不可能的并且新颖的疗法已经被深入研究7,导致对被称为“谷蛋白酶(glutenases)”的新颖的酶的开发,该酶能够在胃肠环境中消化谷蛋白和谷蛋白的毒性片段。
3.wo2013083338公开了一组新颖的谷蛋白酶,即具有谷蛋白酶活性的内肽酶,由本技术的发明人在嗜酸放线菌放线异壁酸菌属(actinoallomurus)a8中鉴定出。所述放线异壁酸菌属内肽酶在将谷蛋白肽降解成无毒肽方面非常快速和有效,在胃和肠环境的整个ph范围内都是有活性的(在ph 3-6的范围内显示出酶活性,其中在ph 5达最佳),并且还能对胃肠内源酶的降解耐受。这使得这些新颖的放线异壁酸菌属内肽酶非常适用于治疗和/或预防cd和cd相关的病症。在wo2013083338中公开的所述放线异壁酸菌属内肽酶中,已经发现内肽酶40(e40)是特别令人感兴趣的。e40天然蛋白由398个氨基酸残基组成(参见seq id no:3),属于丝氨酸-羧基肽酶s53家族,其中催化三联体(triad)分别由位置156、160和329处的天冬氨酸、谷氨酸和丝氨酸形成。通过signalp 4.1服务器分析已经鉴定了位置27和28之间的n-末端信号肽,并且已经预测成熟形式从位置74开始,产生32.5kda的成熟酶,如预期的。天然e40的成熟形式是序列seq id no:1的多肽。
4.对开发制造具有谷蛋白酶活性的所述放线异壁酸菌属内肽酶(特别是包含seq id no:1或由seq id no:1组成的序列的e40)的有效且廉价的方法有浓厚的兴趣。
5.此后e40用于标识包含seq id no:1的序列的内肽酶,即由seq id no:1组成的序列的内肽酶或其具有包含seq id no:1的序列的衍生物;e40的示例性衍生物是加标签的e40,诸如具有包含seq id no:2或由seq id no:2组成的序列的内肽酶。
6.重组dna(rdna)技术提供了一套非常强大的技术平台,用于通过相对廉价的程序进行感兴趣的多肽的受控且可缩放的生产(controlled and scalable production)。重组蛋白目前在大肠杆菌(escherichia coli)、酿酒酵母(saccharomyces cerevisiae)中,在昆虫、仓鼠和哺乳动物细胞中获得。然而,有改进重组蛋白大量生产的需要;此外,当生产供人类使用的蛋白,例如用作食品补充剂和/或用作预防和/或治疗人类疾病的药物时,需要满足非常严格的要求。
7.因此,本发明旨在提供一种用于有效且廉价制造酶制品(enzyme preparation)的
改进方法,该酶制品包含作为重组蛋白的在wo2013083338中公开的至少一种放线异壁酸菌属内肽酶,所述酶制品适于人类使用,任选地在适当配制后。
8.链霉菌被认为是人类消化用蛋白的安全来源。来源于链霉菌属物种的食品酶的两个实例是:用于果糖糖浆生产的葡萄糖异构酶
12
和广泛开发的来自茂原链霉菌(s.mobaraensis)的转谷氨酰胺酶,因为转谷氨酰胺酶在改进最终食品产品诸如加工肉和鱼产品以及乳制品和焙烤食品的质地和整体质量的性质而用于食品工业中
13
。
9.本发明人已经发现,变铅青链霉菌(streptomyces lividans)是一种特别有利的用于本发明的改进方法中的宿主细胞。
10.因此,本发明提供了一种用于生产酶制品的方法,该酶制品包含变铅青链霉菌(s.lividans)宿主细胞中的有谷蛋白酶活性的至少一种重组放线异壁酸菌属内肽酶,该方法的特征在于在发酵条件下培养表达感兴趣的一种或更多种重组放线异壁酸菌属内肽酶的所述宿主细胞的阶段,随后回收包含产生的一种或更多种重组内肽酶的宿主细胞的培养基的上清液的阶段;优选地在所述回收阶段之后是从所述上清液纯化最终酶制品的阶段,所述最终酶制品包含感兴趣的具有谷蛋白酶活性的重组放线异壁酸菌属内肽酶。
11.已知变铅青链霉菌细胞是用于生产重组蛋白的有效宿主细胞,因为由所述细胞表达的重组蛋白可以直接分泌和释放在培养基中。然而,不同的蛋白在变铅青链霉菌中以非常不同的产量获得,该结果是不可预测的
12
。此外,变铅青链霉菌细胞产生高水平的次级代谢物,特别是抗生素
12
,因此损害了将变铅青链霉菌建立为用于制造旨在补充生理消化酶的酶制品的适当细胞工厂的可能性。
12.本发明的方法产生了包含大量期望重组谷蛋白酶的酶制品。令人惊讶的是,尽管在发酵条件下培养宿主细胞,通过本发明的方法获得的酶制品基本不含从变铅青链霉菌释放的潜在有害次级代谢物,诸如例如抗生素(由其对于在食品、食品补充剂或药物制剂(pharmaceutical formulations)中的人类摄取是监管不可接受的);通过本发明的方法获得的酶制品适于人类使用(任选地在适当配制酶制品后)。
13.发明简述
14.本发明涉及一种用于制造酶制品的方法,所述酶制品包含具有谷蛋白酶活性的至少一种重组放线异壁酸菌属内肽酶,该方法的特征在于在发酵条件下,在含有至少30%(重量/体积)蔗糖的培养基中培养一批能够表达重组放线异壁酸菌属内肽酶的变铅青链霉菌宿主细胞,然后从宿主细胞培养物的上清液回收和纯化酶制品。酶制品通过本发明的方法以高产率获得,并且基本不含抗生素,因此适于人类使用。术语“基本不含”抗生素意指在酶制品中检测不到抗生素,无论是在微生物测定还是定量hplc测定中。
15.本发明还涉及通过所述方法获得的所述酶制品,适于人类使用的酶制品的制剂(formulations),携带编码感兴趣的一种或更多种重组放线异壁酸菌属内肽酶的核酸的重组表达载体,以及包含所述重组表达载体并稳定表达所述一种或更多种重组放线异壁酸菌属内肽酶的变铅青链霉菌宿主细胞。此外,本发明涉及酶制品及其制剂的临床使用。优选地,具有谷蛋白酶活性的至少一种感兴趣的放线异壁酸菌属内肽酶是具有包含seq id no:1的序列的e40或其衍生物。
16.附图简述
17.图1.含有天然e40的放线异壁酸菌属a8培养物上清液级分(fraction)的活性。a:
在各种ph值对底物sucalaalaprophe-amc(sucaapf-amc)的相对活性(最佳(100%活性)是在ph 5)。b:在37℃、ph 3孵育2小时后的醇溶蛋白消化。用考马斯r250亮蓝染色的凝胶;泳道1:仅醇溶蛋白,泳道2:醇溶蛋白+含e40的上清液级分。
18.图2.携带e40编码基因的载体pij86(pij86/e40重组表达载体)的图谱。
19.图3.重组e40(seq id no:2)通过在烧瓶规模(a图-c图)或在15l生物反应器中进行的变铅青链霉菌tk24/plj86/e40深层发酵,然后纯化(d图-e图)来获得。a:从产生变铅青链霉菌tk24/plj86/e40(e40,连续线)的不同发酵时间(
◆
72,
▲
96,
●
168,
■
192发酵小时)取得的上清液样品在ph 5对底物sucaapf-amc的活性,以及从空pij 86对照菌株(对照,虚线)取得的上清液样品不存在活性。活性显示为在时间(x轴)内产生的相对荧光单位(rfu,y轴)。b:由在发酵168小时的e40上清液样品在不同ph显示的相对活性(%):最佳(100%活性)是在ph 5。c:168h e40上清液样品在ph 5的酶谱(zymography),使用与a图中相同的底物并在uv光下可视化。d:包含从15l发酵纯化的重组e40的酶制品的谱(profile);泳道1:用考马斯染色的包含重组e40的最终酶制品(箭头指示了重组e40),泳道2:如c中的酶谱,泳道3:在37℃和ph 5消化2小时后明胶水解的条带,在明胶底物的考马斯染色后可视化。e:用底物suc-ala-ala-pro-phe-pna评价纯化的酶制品中重组e40在不同ph值(2至8)的相对活性(%)。
20.图4.存在或不存在以下的情况下评估重组e40的活性:消化蛋白酶胃蛋白酶(p)于ph 4、4.5和5(a图-c图),和胰蛋白酶(t)于ph 6和7(d图-e图、e’图)。通过向包含单独的e40酶(线
①
)、酶和p(线
②
)酶和t(线
④
)的酶制品样品中添加底物,以及通过添加单独的p或t(分别地线
③
和
⑤
)开始反应。每个反应条件以一式两份进行测试,误差线代表标准偏差。e’图是e的放大。x轴:孵育时间(分钟),y轴:在410nm读取的吸光度单位。(ph 4、4.5、5、6和7时,单独e40的r2值分别为0.9948、0.9976、0.9978、0.9639、0.9994,并且e40+p/t的r2值分别为0.993、0.9975、0.9982、0.9661、0.9994)。
21.图5.在ph 5和37℃用重组e40消化33-mer肽的lc/ms谱,其中e40与33-mer肽为摩尔比1∶48。a:单独的全长肽(带三个电荷的离子[(m
+
3h
+
)
3+
=1304.68])。a=14.75;1304.63。b-e:e40活性对33-mer的裂解的时间过程。b=13.07,1010.27;c=14.84,1304.46;d=14.99,1304.50;e=15.13,1304.14;f=7.80,842.11;g=8.02,842.34;h=8.24,842.36;i=11.62,244.16;l=11.84,1086.38;m=12.38,745.13;n=13.17,956.23;o=7.52,842.38;p=11.59,1086.51;q=12.12,745.22;r=6.66,842.37;s=11.45,1086.48;t=11.93,745.23。消化期间形成的肽片段用箭头指示。f:从最终残留肽推断的e40裂解位点的示意图。
[0022]
图6.与重组e40孵育的在最长240min的不同孵育时间的醇溶蛋白的hplc分析。在时间点0,根据ω-醇溶蛋白、α-醇溶蛋白和γ-醇溶蛋白中的疏水性来洗脱醇溶蛋白。
[0023]
图7.a:从5名不同乳糜泻受试者(样品a-h)的空肠活组织检查获得的醇溶蛋白反应性t细胞系中的经e40处理的醇溶蛋白的识别。阳性对照:未处理的醇溶蛋白消化物(样品i和样品l)和植物凝集素(pha)。每张图是针对每个t细胞系进行的三个实验中的一个代表性实验。b:从六倍体小麦纯化的醇溶蛋白在用e40消化后对人类肠t细胞的免疫刺激活性,显示为在表1中指定的条件,基于未经e40处理的醇溶蛋白消化物(样品i)计算的针对用仅e40处理(样品a-b)或在存在胃肠蛋白酶的情况下用e40处理(样品c-h)的醇溶蛋白消化物
的t细胞反应百分比。通过ttg处理使醇溶蛋白的酶消化物脱酰胺,并测定其对肠t细胞的刺激能力。t细胞活化通过测量ifn-γ产生确定。所有醇溶蛋白消化物在50μg/ml和100μg/ml测定。数据是来自5名不同cd患者的t细胞系的平均反应。使用不成对学生t检验来评估统计显著性。*=p《0.05
[0024]
图8:包含重组e40的酶制品的sds-page。切下编号的条带并通过蛋白组学分析进行分析。
[0025]
图9:a:显示重组e40降解花生蛋白的sds-page;b:用重组e40(1:20酶:底物,e:s)孵育的在最长120min的不同孵育时间的花生蛋白的hplc分析;对于每个时间点,未处理样品的hplc显示在上图中,而下图显示e40处理的样品。
[0026]
图10:在存在/不存在蔗糖的情况下变铅青链霉菌中的e40产生。在不含蔗糖(
◆
,suc0)或含17%(
■
,suc17)或34%蔗糖(
▲
,suc34)的培养基中生长的变铅青链霉菌中tk24/plj86/e40培养物的上清液中测定的蛋白水解活性。样品在不同的发酵时间取得:a:120h;b:144h;c:168h。活性显示为在时间(分钟,x轴)期间产生的相对荧光单位(rfu,y轴)。
[0027]
图11:巴斯德毕赤酵母(pichia pastoris)中的e40产生。从e40表达诱导起50小时或96小时后,在重组巴斯德毕赤酵母培养物的上清液中测定的蛋白水解活性。活性显示为时间(x轴;分钟)期间吸光度(y轴;毫吸光度单位,mau)的增加。a和c:分别来自在ph 6不含或含34%蔗糖生长的培养物的样品;b和d:分别来自在ph 7在不含或含34%蔗糖的情况下生长的培养物的样品。
[0028]
图12:大肠杆菌中的e40产生。在从被转化以表达e40的大肠杆菌细胞获得的粗提取物中测定的蛋白水解活性。根据本发明生长的变铅青链霉菌tk24/plj86/e40培养物的上清液中的蛋白水解活性在图中报告以供比较。活性显示为在时间(分钟,x轴)期间产生的相对荧光单位(rfu,y轴)。
[0029]
发明详述
[0030]
本发明涉及一种用于生产酶制品的方法,该酶制品包含具有谷蛋白酶活性的至少一种重组放线异壁酸菌属内肽酶的成熟形式,该方法依次包括:在发酵条件下在培养基中培养重组变铅青链霉菌宿主细胞,优选地tk24菌株,所述重组宿主细胞包含用于所述至少一种重组放线异壁酸菌属内肽酶的异源表达的重组表达载体,所述重组表达载体包含编码所述至少一种重组放线异壁酸菌属内肽酶的多核苷酸,所述多核苷酸可操作地连接到能够指导所述至少一种重组放线异壁酸菌属内肽酶在重组宿主细胞中表达的调节序列;回收培养基的上清液并从所述上清液纯化包含至少一种重组放线异壁酸菌属内肽酶的成熟形式的酶制品。
[0031]
通过本发明的方法获得的酶制品中的至少一种重组放线异壁酸菌属内肽酶优选地选自由以下组成的组:包含seq id no:1的序列的内肽酶40(e40);e40的生物活性片段;e40的天然存在的等位基因变体;和序列与seq id no:1具有至少60%、70%、80%、90%或95%的同一性的内肽酶。
[0032]
术语“酶(或酶的)制品(enzyme(or enzymatic)preparation)”在本文中用于标识在本发明的方法结束时获得的产品,其包含(富含)具有谷蛋白酶活性的至少一种重组放线异壁酸菌属内肽酶;所述产品可以是还包括其他组分的组合物。
[0033]
术语“生物活性片段”是指维持特定谷蛋白酶活性的本发明的内肽酶的部分。
[0034]
根据本发明的内肽酶的“生物活性片段”可以通过例如以下鉴定:分离编码序列seq id no:3或4的内肽酶的片段的多核苷酸(例如,序列seq id no:5或6的多核苷酸的多核苷酸部分),表达编码的内肽酶片段(例如,通过体外重组表达),并通过合适的测定验证所述内肽酶片段是否具有与内肽酶相同的谷蛋白酶活性;合适的测定是例如本发明实施例中公开的酶活性测定中的任何一种。
[0035]
本发明的方法还包括通过将包含以下多核苷酸的重组表达载体引入到变铅青链霉菌宿主细胞中来获得包含具有谷蛋白酶活性的至少一种重组放线异壁酸菌属内肽酶的酶制品:所述多核苷酸具有的序列由于遗传密码的简并性而与核酸序列seq id no:5或6不同,并因此编码由序列seq id no:5或6的多核苷酸所编码的相同内肽酶。
[0036]
通过本发明的方法获得的内肽酶可以具有包含对内肽酶的生物活性而言不是必需的氨基酸残基变化的序列。在本文中“生物活性”是序列seq id no:3的天然放线异壁酸菌属内肽酶的天然或正常功能,例如,它是降解谷蛋白蛋白的能力。
[0037]
本发明的方法包括获得包含与seq id no:1具有至少60%、70%、80%、90%或95%的同一性的序列的至少一种重组内肽酶的酶制品。当涉及核苷酸或氨基酸序列时,术语“同一性”和“同源性”在本文中可互换使用,并指在特定的比较区域内,两个多核苷酸或多肽序列在逐个残基的基础上相同或同源的程度。可以使用本领域已知的任何合适的软件程序来确定比对和同一性百分比或同源性百分比,例如在current protocols in molecular biology(ausubel f.m.等人,“commercially available software”,current protocols in molecular,1987,附录30,第7.7.18节,表7.7.1)中描述的那些。优选的程序包括gcg pileup程序、fasta(pearson r.和lipman d.j.“improved tools for biological sequence analysis”proc.natl.,acad.sci.usa,1988,85,2444-2448),和blast(altschul s.f.,gish w.,miller w.,myers e.w.,lipman d.j.“basic local alignment search tool”j.mol.biol.,1990,215,403-410)。
[0038]
术语“等位基因变体”表示占据同一染色体基因座的基因的两种或更多种可选形式中的任一种。等位基因变异通过突变自然产生,并可以导致群体内的表型多态性。基因突变可以是沉默的(编码的多肽没有变化)或者可以编码具有改变的氨基酸序列的多肽。术语等位变体也指由基因的等位变体编码的蛋白。
[0039]
通过本发明的方法获得的酶制品的至少一种内肽酶也可以可操作地融合到另一种多肽,例如标签;优选地通过本发明的方法获得的酶制品的至少一种内肽酶是加标签的内肽酶,更优选地是加组氨酸标签的内肽酶,最优选地是在蛋白的c-末端加标签的内肽酶,诸如序列包含seq id no:2或由seq id no:2组成的内肽酶。
[0040]
注意到,通过本发明的方法获得的酶制品的至少一种放线异壁酸菌属内肽酶是成熟形式的,因为链霉菌宿主细胞能够加工表达的内肽酶并将其以成熟形式分泌在培养基中。例如,天然的e40具有序列seq id no:3,并且其成熟形式具有序列seq id no:1。根据本发明的方法,作为在变铅青链霉菌宿主细胞中产生的重组内肽酶,e40在培养基中被分泌为包含seq id no:1或由seq id no:1组成的序列的成熟e40,尽管整个编码序列(seq id no:3)被引入到宿主细胞中。
[0041]
本发明的酶制品优选地富含所述至少一种重组放线异壁酸菌属内肽酶;更优选地酶制品不包含除至少一种重组放线异壁酸菌属肽酶以外的内肽酶;例如,酶制品优选地不
包含变铅青链霉菌来源的内肽酶。
[0042]
变铅青链霉菌宿主细胞在发酵条件下在合适的培养基中培养。“发酵条件”意指适用于菌株生长并产生感兴趣的化合物(重组内肽酶)的宿主细胞菌株的培养条件(培养基组成、搅拌参数、通气和温度)。特别地,本发明的方法的发酵条件的培养基包含合适的非动物来源的营养物、碳源和氮源以及无机盐,并且其特征在于其包含至少30%(重量/体积)蔗糖(即每100ml培养基至少30g蔗糖),优选地约34%蔗糖(重量/体积)。根据本发明,发酵条件因此包括在包含至少30%(重量/体积)蔗糖的合适的培养基中培养重组宿主细胞;重组宿主细胞的发酵在25℃和30℃之间,优选地28℃和30℃之间,更优选地约30℃的温度进行;发酵优选进行到培养基的ph大于7和/或直到培养基中的葡萄糖被完全消耗和/或直到分泌到培养基中的重组蛋白具有大于8au/min/ml上清液的活性,如本文实施例5中描述地进行测量。优选地,在回收培养基上清液用于连续纯化之前,发酵进行至少48小时,优选地至少72小时。
[0043]
优选地,培养基还包含酵母提取物和大豆蛋白胨。本发明的方法中使用的特别优选的培养基是培养基p,所述培养基p包含蔗糖(约340g/l)、葡萄糖(约20g/l)、酵母提取物(约3g/l)、大豆蛋白胨(约5g/l)、麦芽提取物(约3g/l)并且具有约6.7的ph。
[0044]
优选地,本发明的方法包括在发酵条件下培养重组宿主细胞的步骤之前,在包含葡萄糖、酵母提取物和大豆蛋白胨的第一培养基中,在约30℃培养重组变铅青链霉菌宿主细胞的孢子悬浮液3-7天(优选地约4天)的第一步骤。更优选地,所述第一培养基是培养基v,所述培养基v包含葡萄糖(约20g/l)、酵母提取物(约5g/l)、大豆蛋白胨(约10g/l)、nacl(约1g/l)并且具有约6.7的ph。
[0045]
优选地,向培养基添加合适量的抗生素用于选择重组宿主细胞,优选地阿泊拉霉素(apramycin),更优选地以50mg/l添加;任选地所述抗生素仅添加到培养宿主细胞的第一步骤的培养基中,而不添加到发酵步骤的培养基中。
[0046]
宿主细胞可以在实验室或工业发酵罐中通过小规模或大规模发酵进行培养。
[0047]
重组内肽酶可以直接从培养基回收,因为它被分泌在培养基中。含有重组内肽酶的培养基的上清液可以通过本领域已知的方法回收,例如在对收获的培养物离心之后回收。
[0048]
在回收上清液之后,本发明的方法优选地包括从所述上清液纯化酶制品的一个或更多个步骤。例如,可以过滤掉培养基以分离微生物体,并且然后通过诸如以下的若干程序中的一种或更多种处理滤液以收集一种或更多种重组内肽酶:超滤、减压浓缩、盐析、通过有机溶剂沉淀、透析、凝胶过滤、吸附色谱、离子交换色谱、电聚焦和冷冻干燥。
[0049]
优选地,本发明的方法的纯化步骤至少包括通过亲和色谱从回收的上清液纯化酶制品的步骤;更优选地它还包括超滤的步骤;最优选地从培养基的上清液纯化酶制品依次包括以下的步骤:过滤上清液,优选地通过纸过滤器和/或通过具有1.0μm和0.3μm之间的标称孔径的胶囊过滤器,以获得包含感兴趣的一种或更多种重组内肽酶的澄清溶液;通过超滤浓缩澄清溶液;通过亲和色谱,优选地通过固定化金属亲和色谱(imac),纯化经超滤的澄清溶液中的酶制品,从而获得包含(富含)感兴趣的一种或更多种重组内肽酶的最终酶制品。在优选的实施方案中,纯化还包括:亲和色谱洗脱级分的脱色(优选地通过deae阴离子交换色谱),脱色样品的浓缩和脱盐(优选地通过对其超滤),从而获得包含(富含)感兴趣的
一种或更多种重组内肽酶的最终酶制品。
[0050]
下文实施例2-4和15提供了根据本发明生产重组内肽酶的优选方法的代表性实施例。
[0051]
优选地,为了表达感兴趣的内肽酶而引入宿主细胞的重组表达载体包含编码序列seq id no:1的e40或其衍生物的多核苷酸,优选地该多核苷酸具有序列seq id no:5或seq id no:6,分别编码具有由seq id no:3组成的序列的e40或具有由seq id no:4组成的序列的c-末端加组氨酸标签的e40;该多核苷酸的序列也可以具有与seq id no:5或seq id no:6具有至少60%、70%、80%、90%或95%的同一性的序列。包含所述表达载体的重组变铅青链霉菌宿主细胞能够产生感兴趣的内肽酶并将其成熟形式分泌在培养基中。例如,序列seq id no:3的e40的成熟形式是序列seq id no:1的内肽酶,并且序列seq id no:4的加组氨酸标签的e40的成熟形式是序列seq id no:2的内肽酶。
[0052]
通过本发明的方法生产包含加组氨酸标签的内肽酶诸如加组氨酸标签的e40的酶制品是特别感兴趣的。因此,在优选的实施方案中,本发明涉及根据权利要求1的方法,其中重组表达载体包含编码包含seq id no:2的序列的加组氨酸标签的e40的多核苷酸,优选地其中多核苷酸具有序列seq id no:6,并且从培养基的上清液纯化的酶制品包含序列seq id no:4的加组氨酸标签的e40的成熟形式。
[0053]
优选地,本发明的方法中使用的重组表达载体是重组pij86表达载体。因此,本发明还涉及包含具有包含seq id no:5或seq id no:6的序列的多核苷酸的重组pij86表达载体,优选地涉及具有序列seq id no:8的重组pij86表达载体。
[0054]
本发明还涉及重组变铅青链霉菌宿主细胞,优选地菌株tk24,包含所述重组表达载体;更优选地所述宿主细胞是菌株dsm 33207,根据本发明如本文所描述的获得,并根据布达佩斯条约的规定,于2019年7月17日保藏在德国莱布尼茨研究所dsmz-德国微生物保藏中心(leibniz institute dsmz-german collection of microorganisms and cell cultures gmbh),inhoffenstraβe 7b 38124 braunschweig-german。
[0055]
本发明还涉及通过本发明的方法获得的酶制品,其包含具有谷蛋白酶活性的至少一种重组放线异壁酸菌属内肽酶的成熟形式。
[0056]
在优选的实施方案中,酶制品是粉末形式。
[0057]
在优选的实施方案中,包含在酶制品中的一种或更多种重组放线异壁酸菌属内肽酶从培养基的上清液或从纯化培养基后获得的酶制品分离。然后,本发明还涉及分离的重组放线异壁酸菌属内肽酶,其从本发明的方法中的重组变铅青链霉菌宿主细胞的培养基回收的上清液获得,或者从根据本发明的方法在纯化步骤后获得的最终酶制品获得。优选地,分离的重组放线异壁酸菌属内肽酶选自由以下组成的组:包含seq id no:1的序列的内肽酶40(e40);e40的生物活性片段;e40的天然存在的等位基因变体;和序列与seq id no:1具有至少60%、70%、80%、90%或95%的同一性的内肽酶。更优选地,它是序列由seq id no:1或2组成的内肽酶,或序列与seq id no:1或2具有至少60%、70%、80%、90%或95%的同一性的内肽酶。
[0058]
任选地,通过本发明的方法获得的酶制品可以在纯化后直接口服施用于有相应需要的受试者。优选地,酶制品或分离的重组放线异壁酸菌属内肽酶被配制在适用于人类使用的药物制剂中。
[0059]
因此,本发明还涉及药物制剂,所述药物制剂包含作为活性蛋白水解成分的通过本发明的方法获得的酶制品或分离的一种或更多种重组放线异壁酸菌属内肽酶。
[0060]
优选的药物制剂与其预期施用途径相容,所述预期施用途径根据本发明优选地为口服施用。因此,本发明的药物制剂优选地为口服药物制剂。根据本发明的药物制剂可以用合适的成分制备,以产生液体形式例如溶液、乳剂形式的,或固体形式诸如片剂、胶囊、半固体或粉末的制品。酶制品的药物制剂可以以各种方式施用,包括特别适用于与食品混合的那些。药物制剂中存在的具有谷蛋白酶活性的一种或更多种重组放线异壁酸菌属内肽酶可以在摄入前或摄入期间是有活性的,并且可以通过例如合适的包封进行处理,以控制活性的时间选择(timing)。
[0061]
为了制备根据本发明的合适的药物制剂,可以使用本领域已知的用于化学或生物物质的稳定化的任何方法,包括基于辐射或温度调节或它们的组合的方法。
[0062]
本发明的药物制剂更优选地被配制以在胃液中释放其活性成分。这种类型的制剂在正确的位置提供最佳活性,例如通过在有相应需要的受试者的胃中释放本发明的酶制品。
[0063]
本发明还包括食品或食品补充剂,其包含作为活性蛋白水解成分的通过本发明的方法获得的酶制品或分离的重组放线异壁酸菌属内肽酶。
[0064]
通过本发明的方法获得的酶制品或分离的重组内肽酶也可以配制成食品补充剂,如关于本发明的领域的其他现有文献(wo2011/077359、wo2003/068170、wo2005107786)中描述地进行制备、供应和分发。例如,本发明的食品补充剂可以是颗粒状的酶包被或未包被的产品,其可以容易地与食品组分混合;可选地,本发明的食品补充剂可以形成预混合物的组分;可选地,本发明的食品补充剂可以是稳定的液体、水基或油基浆体。本发明的药物组合物或食品补充剂可以在饭前、临近饭前、随饭或饭后立即提供,使得本发明的酶组合物的内切蛋白酶在上胃肠腔中释放或活化,在那里内切蛋白酶可以补充胃酶和胰酶以使摄入的谷蛋白解毒并防止有害肽通过肠上皮细胞层。
[0065]
酶制品也可以被配制为食品;在优选的实施方案中,所述食品是已经置于与能够降解谷蛋白的所述酶制品或所述分离的重组放线异壁酸菌属内肽酶接触的谷物粉(flour)。
[0066]
可选地,本发明的酶制品和分离的重组放线异壁酸菌属内肽酶也可用于生产用于食品和/或饮料的蛋白水解物。
[0067]
优选地,本发明的酶制品、分离的重组放线异壁酸菌属内肽酶、药物制剂、食品或食品补充剂用于治疗和/或预防乳糜泻或与乳糜泻相关的病症或非乳糜泻谷蛋白敏感,优选地与序列seq id no:6的醇溶蛋白肽不耐受性相关的任何病症。与乳糜泻相关的病症包括:脂肪痢(celiac sprue)、疱疹样皮炎、乳糜泻黏膜损伤(celiac disease mucosal damage)和乳糜泻黏膜损伤引起的疾病诸如缺铁性贫血、骨质疏松症、1型糖尿病、自身免疫性甲状腺炎和肠病变相关的t细胞淋巴瘤。
[0068]
此外,具有谷蛋白酶活性的放线异壁酸菌属内肽酶也能够预防和/或治疗对坚果和/或花生的过敏和/或不耐受。因此,本发明还涉及所述用途。
[0069]
因此,可以通过向有相应需要的受试者施用有效量的酶制品或分离的重组放线异壁酸菌属内肽酶(任选地被配制成本发明的药物制剂、食品或食品补充剂,更优选地通过口
服施用)来预防和/或治疗选自由以下组成的组的病症:乳糜泻、与乳糜泻相关的病症、非乳糜泻谷蛋白敏感和对坚果和/或花生的过敏或不耐受。
[0070]
因此,本发明还涉及一种治疗和/或预防选自由以下组成的组的病症的方法:乳糜泻、与乳糜泻相关的病症、非乳糜泻谷蛋白敏感、以及对坚果和/或花生的过敏或不耐受,该方法通过向有相应需要的受试者施用有效量的所要求保护的酶制品或所要求保护的分离的重组放线异壁酸菌属内肽酶或所要求保护的药物制剂、食品或食品补充剂。根据所治疗的患者和状况以及施用途径,活性量可以是对应于每天每千克体重0.01mg至0.5mg的重组内肽酶的剂量,例如,对于普通人约20mg/天。患者中谷蛋白酶的典型剂量为至少约1mg/成人,更通常地至少约10mg;并且优选地至少约50mg;通常不多于约5g,更通常地不多于约1g,并且优选地不多于约500mg。剂量进行适当调整用于儿科制剂。在儿童中,有效剂量可以更低,例如至少约0.1mg或0.5mg。本领域技术人员将容易理解,剂量水平可以随特定的酶、症状的严重程度和受试者对副作用的易感性而变化。
实施例
[0071]
实施例中使用的试剂
[0072]
放线菌菌株放线异壁酸菌属a8来自“fondazione istituto insubrico di ricerca per la vita”的收集。n-琥珀酰基-ala-ala-pro-phe对硝基苯胺(suc-ala-ala-pro-phe-pna)和n-琥珀酰基-ala-ala-pro-phe-7-氨基甲基香豆素(suc-ala-ala-pro-phe-amc)来自bachem(bubendorf,switzerland);胃蛋白酶、胰蛋白酶、萘啶酸和阿泊拉霉素来自sigma-aldrich(milan,italy);甘露醇来自carlo erba(cornaredo,italy);大豆粉来自cargill(padova,italy);琼脂和大豆蛋白胨来自conda(madrid,spain);蔗糖和葡萄糖来自vwr(leuven,belgium);酵母和麦芽提取物分别来自bd(franklin lakes,nj,usa)和costantino(favria,to,italy);33-merα-醇溶蛋白肽由biotem(apprieu,france)合成;变铅青链霉菌菌株tk24和表达载体pij86来自john innes center(norwich,uk);酿酒酵母典型菌株x4004-3a(登录号kr348914)由l.pollegioni教授提供。
[0073]
实施例1-天然e40活性
[0074]
序列seq id no:3的天然e40从分离自土壤的放线异壁酸菌属a8培养物的上清液级分(天然e40)纯化,如wo2013083338中描述的。天然e40在ph 3-6的环境条件显示出明显的谷蛋白酶活性,在ph 5达最佳(图1,a图)。在这些条件下,醇溶蛋白被完全消化(图1,b图)。
[0075]
实施例2-将e40编码基因克隆在pij86表达载体中并插入在变铅青链霉菌tk24宿主细胞中。
[0076]
使用phusion高保真聚合酶(thermo scientific,rodano,mi,italy)和0.5μm的寡核苷酸引物(seq id no:9和10)从放线异壁酸菌属a8基因组dna扩增编码加组氨酸标签的e40的序列seq id no:6的多核苷酸,在多核苷酸序列的5’端和3’端引入了bcli和hindiii限制性位点并在内肽酶的c-末端引入了1个甘氨酸随后是6个组氨酸残基。pcr循环条件为:在98℃3分钟,然后在98℃10s、在67℃20s和在72℃50s的10个循环,在98℃10s、在72℃70s的20个循环,以及在72℃进行5分钟的最后延伸。pcr产物(seq id no:11)从琼脂糖凝胶纯化,用hindiii和bcli消化,并连接在用hindiii和bamhi消化的空pij86载体(seq id no:7)
中,以产生序列seq id no:8的重组载体pij86/e40(图2)。通过dna测序评估重组载体中不存在pcr产生的突变。在强组成型erme启动子的控制下,携带序列seq id no:6的e40的pij86/e40载体用于转化大肠杆菌et12567/puz8002。根据flett等人
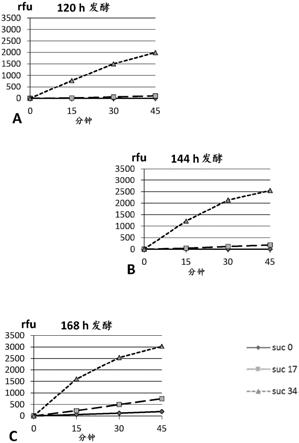
14
使用大肠杆菌et12567作为供体并使用变铅青链霉菌tk24
17
作为受体进行接合,从而获得携带e40编码基因的重组变铅青链霉菌tk24宿主细胞(tk24/pij86/e40宿主细胞)。将杂交混合物铺展在含有10mm mgcl2的甘露醇大豆粉琼脂板(甘露醇8g/l,大豆粉8g/l,琼脂8g/l,ms)上,并在28℃孵育。在16-20小时后,将含有50μg/ml萘啶酸和30μg/ml阿泊拉霉素的1ml蒸馏水加入到每块板的表面,并使用玻璃棒铺展,并在28℃进一步孵育直到出现接合后体菌落(exconjugant colonies)。将接合后体重复铺展在含有萘啶酸和阿泊拉霉素的ms琼脂上;根据kieser等人
15
制备的最终孢子悬浮液在20%甘油中在-80℃储存。
[0077]
实施例3-重组变铅青链霉菌tk24的e40的表达
[0078]
将实施例2的重组变铅青链霉菌tk24/plj86/e40宿主细胞接种在含有20ml添加有阿泊拉霉素50mg/l的培养基v(如上文定义的)的锥形烧瓶(50ml)中,并在30℃以200rpm在旋转振荡器上孵育。生长5天后,将培养物接种在一个含有100ml的添加有50mg/l阿泊拉霉素的培养基p(如上文定义的)的锥形烧瓶(500ml)中,并且在同样条件孵育8天。可选地,对于15l规模的发酵,在培养基v中生长的5天培养物首先接种在3个含有100ml的培养基v的500ml锥形烧瓶中,并在相同条件下孵育;然后,72小时后,收获烧瓶培养物,汇集并用于接种含有15升添加有50mg/l阿泊拉霉素的培养基p的发酵罐(biostat cplus,sartorius stedim,goettingen,germany)。发酵在30℃在450rpm的搅拌条件下运行,并通过测量在11000g离心6分钟后获得的培养上清液中的酶活性来监测这段时间内的重组e40产生。94小时后,当酶活性达到每毫升上清液1430u时,停止发酵(本文使用的酶活性测定参见实施例5)。
[0079]
实施例4-从变铅青链霉菌tk24/plj86/e40培养基的上清液纯化酶制品
[0080]
将实施例3的收获的变铅青链霉菌tk24/plj86/e40培养物在4120g离心90分钟,并收集回收的上清液并在rapida a纸(enrico bruno,turin,italy)上过滤,并且进一步澄清两次到聚醚砜opticap胶囊上(标称孔径1.0μm和0.5μm)(merck,vimodrone,italy)。接下来,使用pellicon 3 ultracel tff纤维素盒(10kd标称mw截止值)通过超滤系统(tff1)将澄清溶液浓缩10倍,并添加到0.5m nacl和50mm na2hpo4ph 7.2。通过使用6fast flow树脂(ge healthcare,milan,italy),通过固定化金属亲和色谱(imac)纯化酶。imac柱用5体积磷酸盐缓冲液(ph 8.0)平衡,通过5体积的250mm咪唑、50mm磷酸盐缓冲液(ph 8.0)进行洗脱,用甲酸将洗脱的级分(330ml)调节至ph 6.3,并通过deae阴离子交换色谱(ge healthcare)进行脱色。通过超滤系统(tff2,pellicon,10kd mw标称截止值)使脱色的样品浓缩并脱盐。冷冻干燥前,样品中加入甘露醇和海藻糖(分别为15mg/ml和5mg/ml),以改进结晶过程
16
。
[0081]
纯化的样品的蛋白含量为6%(通过bca测定测量),具有41000u/mg蛋白,相当于约8mg蛋白质/ml培养上清液。
[0082]
纯化过程的有效性通过sds-page展示,其中重组e40在约40kda的主条带中迁移(图3,d图,泳道1,箭头)。40kda sds-page条带的n末端序列分析证实了所预测的重组e40的成熟形式。
[0083]
实施例5
–
酶制品的酶活性。
[0084]
酶活性测定在96孔微量滴定板(透明,平底)中使用infinite 200pro板读取仪(tecan,ch)进行。将20μl包含浓度范围10-50nm的e40的样品在37℃预孵育5分钟,并且然后加入到180μl的在柠檬酸磷酸盐缓冲液(0.1m柠檬酸,0.2m磷酸氢二钠,ph 5)中的220μm suc-ala-ala-pro-phe-pna。样品在37℃孵育20分钟。在410nm处检测pna,以5分钟的间隔进行读数。
[0085]
酶活性由时间期间的吸光度线性增加确定:1活性单位(au)定义为能够在1分钟内释放1个任意吸光度单位(aau)的酶的量,并被测量为“每分钟产生的任意吸光度单位”(aau/m):
[0086][0087]
它通常以5-15分钟的间隔计算(分别地,t1=5分钟和t2=15分钟)。
[0088]
为了正确评估e40产生,必须稀释任何样品以给出吸光度随时间的线性增加;稀释度1:40用于来自于目前使用的e40生产商的上清液样品。
[0089]
e40产生以au/ml上清液表示。
[0090]
相同的e40定量方法用于由下游过程的所有步骤得到的样品,并对液体或固体样品分别表示为au/ml或au/mg。
[0091]
1单位(u)定义为每分钟释放1微摩尔pna的酶的量。在我们的测定条件:每微摩尔pna的au=0.006;1u=au/0.006。样品活性以每ml(在上清液样品的情况下)或每mg固体物质(在含有重组e40的最终粉末酶制品的情况下)的酶单位表示。
[0092]
使用相同的底物确定ph最佳值,该底物分别在ph 2的0.2m柠檬酸铵中或在ph范围3-8的柠檬酸磷酸盐缓冲液中制备。
[0093]
对于酶谱分析,含有e40的样品通过非还原sds-page(12%聚丙烯酰胺)在100v使用tetra-cell mini-protean系统(bio-rad,milan,italy)运行。凝胶用柠檬酸盐-磷酸盐/磷酸盐缓冲液(ph 5.0)洗涤两次,并且然后用包括100μm的suc-ala-ala-pro-phe-amc的相同缓冲液孵育。e40的活性在通过uv光暴露的凝胶中进行观察。
[0094]
e40的蛋白水解活性也通过使用明胶作为底物来评估,在电泳运行后,凝胶用柠檬酸盐磷酸盐缓冲液ph 5.0洗涤,并重叠在用相同缓冲液平衡10分钟的酶谱10%明胶凝胶(bio-rad)上。将两个重叠的凝胶在37℃孵育2小时,然后用考马斯亮蓝r250染色明胶凝胶。凝胶脱色后,由于从pa-凝胶扩散到酶谱凝胶的蛋白酶的蛋白水解作用,明胶消化被可视化为清晰的裂解条带。
[0095]
对实施例3中生长在烧瓶中的培养物的上清液中的酶活性的监测展示了重组e40的稳定和连续生产,发酵长达8天(图3,a图)。与天然e40一样,重组e40在ph范围3-6中是有活性的,在ph 5具有最佳值(图3,b图)。在ph 5进行的酶谱分析展示出,重组e40是培养物上清液中唯一的活性蛋白(图3,c图)。
[0096]
重组e40也是实施例4中获得的纯化的酶制品中唯一对发色底物suc-ala-ala-pro-phe-amc(图3,图d,泳道2)以及对通用蛋白底物如明胶(图3,d图,泳道3)具有活性的蛋白,因此排除了最终纯化的酶制品中除重组e40以外的任何内切蛋白酶的存在。包括重组e40酶制品的纯化的酶制品在不同ph值的活性用底物suc-ala-ala-pro-phe-pna,ph范围2
至8(图3,e图)进行评价。结果是在ph 5是活性最大的,并且在ph 3维持显著残留活性(约40%)。这些结果预测了餐后胃环境中的最佳作用,此时ph值高于3持续超过一小时
8,9
。有趣的是,重组e40在ph 6保持显著活性(约50%),表明进入餐后十二指肠区室(其中ph在饭后长时间低于6或等于6)的延长作用。总的来说,结果支持e40的天然和重组形式之间的完美相似性。在实施例4中通过根据本发明的方法获得的包含重组e40的纯化的酶制品实际上具有可与从放线异壁酸菌属菌株分离的天然e40比较的化学/物理性质和生物活性。
[0097]
实施例6-重组e40对消化蛋白酶耐受。
[0098]
使用suc-ala-ala-pro-phe-pna作为底物,进一步评价了通过本发明的方法获得的重组e40对胃(胃蛋白酶)和十二指肠(胰蛋白酶)消化蛋白酶的蛋白水解活性的耐受性(图4)。e40酶的水性溶液,单独地或与胃蛋白酶和/或胰蛋白酶(0.2mg/mle40,0.1mg/ml胃蛋白酶或胰蛋白酶)组合地,在含有suc-ala-ala-pro-phe-pna的柠檬酸盐-磷酸盐缓冲液中(对胃蛋白酶在ph4、4.5和5,并且对胰蛋白酶在ph 6和7)稀释。反应混合物中的最终浓度为:200μm底物,分别地1-4nm e40用于在ph 4至5孵育,或4nm和7nm e40用于在ph 6或7孵育(e40浓度根据最适ph进行调节)。消化蛋白酶与e40维持在比例1:2(w/w)。
[0099]
反应(96孔平底微量滴定板中200μl体积)在37℃延长110分钟。每10分钟监测吸光度用于确定酶活性。没有e40的胃蛋白酶和胰蛋白酶以相同的方式处理并在相同的条件下测试作为参考对照。每项分析以一式两份进行。
[0100]
值得注意的是,胃蛋白酶(图4,a图-c图)和胰蛋白酶(图4,d图-e图、e’图)都不使发色底物水解。值得注意的是,e40裂解活性不受胃蛋白酶/胰蛋白酶添加或酸性ph的影响。相比之下,在存在胃蛋白酶的情况下,观察到e40活性略有增强(图4,a图-c图),可能是由于胃蛋白酶揭露出(unmasking)e40催化位点。总的来说,这些发现证实了e40在生理条件对主要的人类消化蛋白酶的耐受性。
[0101]
实施例7-e40对免疫显性33-mer醇溶蛋白肽的消化。在被重组e40消化之前(图5,a图)和之后(图5,b图-e图),通过lc-ms/ms监测33-mer醇溶蛋白肽降解。消化在u型底96孔微量滴定板中进行;将33-mer在柠檬酸盐磷酸盐缓冲液(ph 5)中稀释至5mg/ml,与相同缓冲液中稀释(1:48的酶与底物的摩尔比)的包含重组e40的酶制品混合并在37℃孵育。在时间点0分钟、15分钟、30分钟和60分钟,取等分试样(10μl),并且通过煮沸3分钟停止反应,然后通过lc-ms/ms分析。
[0102]
样品通过偶联到uv检测器和ltq-xl离子阱质谱仪(thermo fisher scientific)二者的hplc系统accela instrument(thermo fisher scientific,san jose,ca)进行分析。值得注意的是,孵育一开始就观察到33-mer的轻微水解(图5,b图,0分钟);仅15分钟后天然33-mer肽信号完全消失(图5,c图)。更具体地,ms/ms谱分析展示出e40活性破坏了所有33-mer免疫毒性序列。e40裂解位点出现在醇溶蛋白的f-p和q-l残基之间,导致缺乏t细胞刺激能力的短肽(图5,f)3。这一发现也在更稀释的e40浓度(1:96,摩尔比)观察到:在这种情况下,33-mer完全降解需要30分钟(未显示)。
[0103]
实施例8-e40对完整醇溶蛋白(whole gliadin)的消化。通过hplc分析评估e40水解完整醇溶蛋白中有害肽的能力(图6)。根据mamone等人4,从普通小麦(triticum aestivum)(sagittario栽培品种)的全粉提取醇溶蛋白。将醇溶蛋白(1mg)溶解在1ml的0.1m乙酸铵ph 4中,并与e40酶(酶:底物,1:20)在37℃孵育持续不同的时间点(0分钟、15分
钟、30分钟、60分钟、120分钟、240分钟)。酶水解通过煮沸样品5分钟来停止。将样品冻干并储存在-40℃直到进行进一步的化学分析。
[0104]
sds-page在tetra-cell mini-protean系统(bio-rad,milan,italy)上进行。将消化的醇溶蛋白样品溶解在laemli缓冲液(0.125m tris-hcl ph 6.8,5%sds,20%甘油,0.02%溴酚蓝)中,并加载到预制的12%丙烯酰胺凝胶(bio-rad)上。电泳在非还原条件下进行,在laemli缓冲液中不含β-巯基乙醇。蛋白条带用银蓝(考马斯亮蓝g-250)可视化,并使用labscan扫描仪数字化(amersham bioscience/ge healthcare,uppsala,sweden)。rp-hplc使用hp 1100agilent technology模块系统(palo alto,ca,usa)在rp-hplc上进行。消化的醇溶蛋白样品悬浮在0.1%tfa中,并通过c18柱(aeris peptide,3.6μm,250
×
2.10mm i.d.,phenomenex,torrance,ca,usa)分离。洗脱液a为milli-q水中的0.1%tfa(v/v),洗脱液b为乙腈中的0.1%tfa(v/v)。柱在5%b平衡。肽经90分钟以0.2ml/min的流量应用b的线性5%-70%梯度进行分离。色谱分离在37℃进行,使用恒温柱支架。柱流出物用uv-可见光检测器在220nm和280nm监测。
[0105]
由于全醇溶蛋白为复杂混合物,用包含重组e40(1:48,摩尔比)的酶制品消化延长至240分钟的孵育(图6,b图-g图)。未消化的醇溶蛋白样品作为参考对照运行(图6,a图)。如预期的,色谱图谱急剧地变化,因为分配给α-醇溶蛋白、β-醇溶蛋白和γ-醇溶蛋白的峰在30分钟后明显减少(图6,c图),并在e40消化的60分钟和120分钟之间消失(图6,d图和e图)。消化产物在180分钟和240分钟的谱相似(图6,f图和g图),表明没有出现进一步降解。
[0106]
实施例9-体液和t细胞谷蛋白表位的e40蛋白水解降解。接下来,评价了重组e40酶活性是否有效中和:i)谷蛋白蛋白与g12抗体结合的能力,和ii)通过ifn-γ释放测量的t细胞介导的免疫反应的刺激。为了这一目的,使醇溶蛋白悬浮在1ml的0.1m乙酸铵中,并在不同的ph和时间点,用单独的e40消化或用与胃肠蛋白酶胃蛋白酶和胰蛋白酶/糜蛋白酶共孵育的e40消化,如表1中所详述。
[0107][0108][0109]
表1.
[0110]
所有的酶以w/w比1:20(酶:蛋白)加入,并在37℃在指定的ph和孵育时间孵育。通过ttg酶(ttgase)(sigma aldrich)使e40/胃蛋白酶/糜蛋白酶消化的醇溶蛋白脱酰胺,如先前描述的4。简言之,将酶促醇溶蛋白消化物(500μg/ml)与2u的豚鼠ttg(t-5398,sigma,st.louis,mo,usa)在含有1mmol/l cacl2的pbs中于37℃孵育2小时。
[0111]
为了评估e40消化对小麦免疫潜力的影响,样品a-l的谷蛋白含量通过对qpqlpy序列有特异性的单克隆抗体(elisa-g12)
10
来确定。
[0112]
与未处理的醇溶蛋白样品(样品i和样品l)相比,e40消化的样品(样品a到样品h)显示谷蛋白含量的急剧降低,远低于20ppm(表2)。
[0113]
醇溶蛋白消化物样品ppm(ng/ml)a1.72b2.26c5.23d5.42e4.09f2.68g1.68h2.05i》800l》800
[0114]
表2
[0115]
为了评价醇溶蛋白制备物激活t细胞反应的能力,对先前从cd患者
11
的肠活组织检查建立的cd4+t细胞系测定了通过ttg处理脱酰胺的不同醇溶蛋白酶消化物(图7a和7b中的样品a-l)(表3)。
[0116]
患者诊断年龄肽识别cd#1萎缩性6岁dq2,5-醇溶蛋白-γ1cd#2潜在cd2岁&7个月dq2,5-醇溶蛋白-α1,2;ω1,2cd#3萎缩性3岁&8个月dq2,5-醇溶蛋白-ω1,2;γ26mercd#4萎缩性15岁dq2,5-醇溶蛋白-ω1,2;γ26mercd#5缓解18岁dq2,5-醇溶蛋白-α1,2
[0117]
表3
[0118]
简言之,用辐照的自体外周血单个核细胞(pbmc)和脱酰胺的经胃蛋白酶-糜蛋白酶消化的从六倍体小麦提取的醇溶蛋白刺激肠单个核细胞。生长中的t细胞通过用异源辐照的pbmc和pha以及作为生长因子的il-2反复刺激而保持在培养物中。通过测定tcl对一组免疫原性谷蛋白肽的反应性来评估其肽特异性,并揭示了大量的肽识别(a large repertoire of peptide recognition)。在功能测定中,通过检测ifn-γ产生来分析tcl对醇溶蛋白酶消化物的免疫反应(样品a-l,表1和图7a和图7b)。t细胞(3
×
104个)在u型底96孔板中在200μl的完全培养基(补充5%人类血清和青霉素-链霉素抗生素的x-vivo15,所有试剂均由lonza-biowhittaker,verviers,belgium提供)中与辐照的经ebv转化的自体b-类淋巴母细胞细胞系(b-lcl,1
×
105个)共孵育。孵育48小时后,收集细胞上清液(50μl)用于ifn-γ确定。每种抗原制备物以一式两份并且以对每种t细胞系进行三次独立实验进行测定。使用从mabtech(nacka strand,sweden)购买的纯化的且生物素缀合的抗ifn-γab通过经典的夹心elisa测量ifn-γ。测定的灵敏度为32pg/ml。
[0119]
如预期的,当暴露于胃蛋白酶-糜蛋白酶/胰蛋白酶消化的醇溶蛋白时,所有的t细
胞系都产生高水平的ifn-γ(表1的样品i和l,图7a和图7b)。相反,在所检查的所有实验条件下,在暴露于e40消化的醇溶蛋白的t细胞中没有测量到可检测的ifn-γ产生(表1的样品a-h以及图7a和图7b)。
[0120]
实施例10-基于谷蛋白的食物产品(面包)的体外消化
[0121]
为了评价e40酶作为口服补充剂消除患者中的谷蛋白摄入的有效性,应用了体外经口-胃(oral-gastric)消化模型。面包(普通小麦)的消化步骤在包括口腔咀嚼和胃消化酶的存在在内的模拟生理条件下进行。消化时间根据食糜在胃区室中的平均转运时间选择。在模拟胃阶段开始时加入e40酶制品。使用单克隆抗体(elisa-r5竞争性)根据制造商指南和aoac指南测试了t细胞表位和毒性肽的破坏。
[0122]
与未经e40处理的样品相比,包括e40的消化的面包样品显示出谷蛋白含量的急剧下降,远低于20ppm(表4)。
[0123]
面包消化物样品ppm(ng/ml)经口-胃消化物303.0经口-胃-e40消化物16.2
[0124]
表4
[0125]
实施例11-用重组e40(1:20,e:s)孵育的花生蛋白的体外消化
[0126]
通过sds-page和hplc分析评估了在存在重组e40的情况下孵育的花生蛋白的降解。结果在图9(a:sds-page;b:hplc分析)中示出。
[0127]
实施例12-重组e40的蛋白组学分析。
[0128]
还进行了根据本发明的方法在变铅青链霉菌中获得的酶制品的详细蛋白组学分析。酶制品的样品在sds-page上运行(图8),然后将泳道切下并用胰蛋白酶消化,并且肽混合物通过ls-ms/ms分析。质谱通过proteome discoverer软件进行处理,其揭示了每个凝胶条带内的蛋白的身份(表5)。
[0129][0130]
表5
[0131]
蛋白组学分析证实,重组e40蛋白以约45kda的主条带迁移(图8,条带4)。sds-page
也突出显示了存在另外的但不太深的条带。这些条带被归因于在纯化过程期间没有完全消除的变铅青链霉菌蛋白。这些污染物中的一些是蛋白酶,但这些都不具有谷蛋白酶性质,证实了重组e40是最终酶制品中唯一对谷蛋白有活性的蛋白。
[0132]
实施例13-在发酵和下游工艺步骤中对酶制品粉末的微生物测定
[0133]
如已知的,变铅青链霉菌tk24可能产生放线菌紫素(actinorhodin,act)、十一烷基灵菌红素(undecylprodigiosin,udp)和钙依赖性抗生素(cda),尤其是在发酵条件下生长时。然后,使用由临床和实验室标准研究所(clinical and laboratory standards institute,clsi)标准化的肉汤微量稀释测定评估从通过本发明的方法获得的酶制品得到的样品中的抗生素存在。针对已知未显示出任何抗生素抗性的测试微生物(test-mo)进行了抗微生物活性测试:金黄色葡萄球菌(staphylococcus aureus)atcc6538(革兰氏阳性的代表);大肠杆菌l47(lepetit收集;革兰氏阴性的代表);白色念珠菌(candida albicans)l145(lepetit收集;酵母的代表)。
[0134]
在无菌96孔微孔板中对待测试的样品进行二倍系列稀释,然后在其各自的培养基(100μl/孔最终体积)中接种test-mo;每个确定以一式三份进行。然后将接种的微孔板在35℃对于大肠杆菌、金黄色葡萄球菌和白色念珠菌分别孵育18小时、20小时和24小时。未知的“抗微生物”浓度的样品的抗微生物活性测量为终点,即抑制测试菌株生长的最高稀释度;这是通过借助放大镜目视检查微孔板来确定的。
[0135]
使用测定对照标准化合物:环丙沙星(对g+和g-有活性),达托霉素(仅革兰氏阳性),两性霉素b(仅白色念珠菌);此外,因为阿泊拉霉素在发酵中使用,所以测试了阿泊拉霉素(g+和g-),并且因为咪唑可以用于从镍树脂洗脱e40,所以也测试了咪唑。
[0136]
除了咪唑以0.35mm至250mm的浓度范围使用,标准化合物在128μg/ml至0.125μg/ml的浓度范围中进行测试;它们的抗微生物活性用mic(最小抑制浓度)表示,如下表6中所示。
[0137][0138]
表6
[0139]
然后验证了3个e40酶制品粉末批次(f30、f34和f35)的活性:分析的所有3个批次在测试的最高浓度(样品稀释度1:4,对应于2.5mg/ml最终粉末浓度)未显示任何抗微生物活性,表明酶制品中不存在抗生素。含有未接种的培养基(即没有test mo)中的e40粉末样品的对照孔没有显示任何微生物生长。
[0140]
根据本发明,进一步测试了有后续纯化步骤的在15l规模的变铅青链霉菌tk24/pij86/e40的发酵运行所得到的样品的抗微生物活性(表7-表9)。
[0141][0142]
表7
[0143][0144][0145]
表8
[0146][0147]
表9
[0148]
收获(hv)培养物上清液(通过在17664g离心30分钟获得)显示出可能与十一烷基灵菌红素(udp)的存在有关的对大肠杆菌和白色念珠菌的轻微活性,如通过其已知的活性模式所预期的。通过imac洗脱的e1和deae流通物显示的抗念珠菌活性肯定是由于咪唑;imac洗脱物对大肠杆菌的低活性可能仍然是由于残留udp的存在。结果,最终渗滤的tff2样品没有任何可检测到的抗微生物活性。关于阿泊拉霉素,虽然阿泊拉霉素以50μg/ml添加到生产性培养基中并且其对金黄色葡萄球菌和大肠杆菌的mic结果为8μg/ml,但在培养物收获时阿泊拉霉素的存在并不突出。这可能是由于酶的作用而分解和/或转化。
[0149]
实施例14-测试e40酶制品和下游中间产物中的次级代谢物的存在
[0150]
对于安全性评估,寻找由变铅青链霉菌tk24产生的次级代谢物是至关重要的。因此需要在发酵上清液以及配制的产品中加入(dosing)潜在的鉴定的分子。出于定量的目的,选择hplc/ms作为评价act、udp和达托霉素(dap,属于cda类别)存在的最佳技术。应用抗生素固相萃取(spe)技术,使用diaion hp-20(苯乙烯-二乙烯基苯)树脂,允许更好的定量分析。diaion hp-20通常用于提取具有广的极性范围的小分子,如次级代谢产物、色素等。通常,树脂与水性溶液以1:20v/v的比例接触2小时,然后转移到柱中,洗涤,并用递增梯度的在水中的甲醇洗脱。将洗脱的提取物干燥,并且然后通过hplc/ms分析。使用更适合于小分子和代谢产物的柱(phenomenex luna c18,5μm,2.1
×
250mm)。收集e1(50%甲醇)、e2(100%甲醇)和e3级分(甲醇/异丙醇90:10)。达托霉素在e1和e2中洗脱,而十一烷基灵菌红素(udp)在e2和e3中洗脱。达托霉素的回收率是定量的,而udp具有与树脂、过滤器和膜紧密结合的倾向因此回收率是部分的(20%-25%)。
[0151]
因为阿泊拉霉素不与hp-20结合,因此对阿泊拉霉素应用了另一种提取方法。测试了nh4形式的amberlite irc 50弱阳离子树脂,并显示其在单个柱转移步骤中与阿泊拉霉素定量地结合。然后,用0.1m氢氧化铵洗脱,得到完全的回收率。
[0152]
luna c18 hplc柱用作用于提取的样品的默认柱,其中b相的梯度在30分钟内从5%至90%并且流量为1.0ml/min。
[0153]
用50mg的粉末e40酶制品(批次f-30、f-34、f-35)完成了最终测试,并给出了以下结果(表10):
[0154][0155]
表10(*基于对20mg最终粉末的分析)
[0156]
这些数据证实,所分析的抗生素中没有一种能在3个e40酶制品批次粉末中的任一个中以可测量的量发现。
[0157]
应用这种方法,监测发酵培养物和后续下游纯化步骤中相同抗生素的检测。以此为目的设置了命名为f-46的发酵培养物。根据本发明的方法的优选实施方案,该发酵培养物经历以下纯化步骤:
[0158]
1.离心(以17664g,30’)以回收样品hv-上清液
[0159]
2.澄清(opticap pes胶囊,1.0微米和0.5微米标称尺寸)
[0160]
3.tff1浓缩(具有10kd截止值的再生纤维素盒)
[0161]
4.基于imac镍的亲和色谱
[0162]
5.通过用deae树脂进行离子交换来脱色
[0163]
6.tff2浓缩和渗滤(10kda截止值)
[0164]
7.加入赋形剂后冻干以获得最终粉末。
[0165]
来自每个步骤的样品通过hplc-ms分析,按分子量搜索以上抗生素。以小体积进样(12.5微升)。只发现了可测量量的udp。没有检测到其他抗生素的痕迹。
[0166]
关于十一烷基灵菌红素(udp),每个步骤中的浓度通过hplc-ms定量(表11)。如预期的,udp在下游过程期间被成功去除:
[0167][0168]
表11
[0169]
总之,通过根据本发明的方法获得的包含e40的酶制品粉末不含可测量量的抗生素。
[0170]
实施例15
[0171]
根据本发明进行了两次新的15l发酵,从在烧瓶中孵育约42小时的种子培养物开始。两种培养物命名为f47和f48,分别在发酵条件下99小时和94小时后收获。收获的培养物提交至离心(beckmann j-2-21;转子ja-10;10000rpm/17700g,15min)并在纸上过滤,并且然后在3个后续阶段中(从1μm过滤开始,直至0.3μm过滤)对上清液进行微过滤(澄清步骤)。然后对澄清的溶液应用超滤(tff1),随后如前所述用镍琼脂糖凝胶6fastflow(ge healthcare)树脂进行超滤渗透物的imac-镍亲和色谱。随后进行任选的deae阴离子交换脱色色谱步骤:将来自imac的洗脱级分用甲酸调节至ph 6.3,转移至用20mm甲酸铵ph 6.3平衡的deae琼脂糖凝胶cl-6b柱中,并通过重量分析法(gravimetry)收集。设置了用于较小体积的超滤系统(tff2-渗滤)(标称mv极值:10kd)用于超滤来自deae的洗脱级分,然后将使用10mm ph 6.3的甲酸铵制备的脱盐溶液分批加入以去除剩余的咪唑。溶液可能变得浑浊,需要离心以弃去沉淀物。去除的固体不包括重组e40。这可以通过在该步骤中保持溶液更加稀释来避免。向获得的最终tff2溶液中加入对应于8微克总糖/au的3:1甘露醇和海藻糖溶液,
然后将其冷冻干燥。
[0172]
最终粉末产量为1437mg。将最终粉末的样品以10mg/ml溶解在20%etoh水性溶液中,并检查酶活性和蛋白含量,以及然后提交至sds-page。
[0173]
在该批次最终粉末中,bca总蛋白含量测定为约14%(如果排除添加的糖,则为100%)。
[0174]
e40的产量为约25mg/l上清液(约20mg/l发酵体积)。
[0175]
以上制剂的微生物活性在5mg/ml的较高浓度(在dh2o中的储备溶液为10mg/ml)和在两倍系列稀释后进行测试。f47/f48生成的粉末的活性在表12中显示:在测试的最高浓度没有显示出对所分析的test-mo中的任何一种的活性。
[0176][0177]
表12
[0178]
该结果证实最终的e40制品不含可检测到的抗生素。
[0179]
实施例16
[0180]
将实施例2的重组变铅青链霉菌tk24/plj86/e40宿主细胞接种在含有100ml添加有50mg/l阿泊拉霉素的培养基v(如上文描述的)的锥形烧瓶(500ml)中,并在30℃以200rpm在旋转振荡器上孵育。生长4天后,培养物用于接种在3个含有100ml的分别含有340g/l(suc 34)蔗糖或170g/l(suc17)蔗糖或不含有蔗糖(suc 0)的培养基p(如上文描述的)的锥形烧瓶(500ml)中。向所有烧瓶中加入阿泊拉霉素50mg/l,并在旋转振荡器上在30℃以200rpm孵育直至7天。发酵120h后,通过测量培养物上清液的酶活性每天一次监测e40产生,所述培养上清液通过在16,000g离心6分钟获得。在微量滴定孔中评估紧临测试前在测定缓冲液中以1:81稀释的上清液样品针对在柠檬酸盐0.1m-磷酸盐0.2m反应缓冲液,ph 5中的发荧光底物suc-ala-ala-pro-phe-amc(bachem l-1465;200μm)(200μl总反应体积中的20μl样品)的蛋白水解活性。孵育在37℃进行30分钟。释放的amc用fusion微量板读取仪(perkin elmer italia spa,monza,italia)在360nm的激发波长和460nm发射波长进行测量。蛋白水解活性被确定为在间隔时间0-15分钟内随时间产生的相对荧光单位(rfu/分钟)的线性增加。结果在图10中示出。
[0181]
用于发酵的培养基中蔗糖的存在对e40产生有显著影响,如图10的a图-c图所示。在含有34%蔗糖的培养基p中生长的培养物的蛋白水解活性是明显的,而在不含蔗糖的培养基中基本不存在蛋白水解活性。在存在17%蔗糖的情况下,显示出低活性,即使在168小时的发酵后也显示出低活性。表13中报告了每个样品的结果(相对荧光单位以0-15分钟孵育间隔内每1ml上清液每分钟表示(rfu/min/ml))。
[0182]
[0183]
表13
[0184]
实施例17
[0185]
酿酒酵母(saccharomyces cerevisiae,s.cerevisiae)典型菌株x4004-3a被用作异源表达e40的宿主。设计了两个不同的合成e40基因,它们因编码酶原的序列的存在或不存在而不同;在这两个基因中,e40的天然信号分泌序列被修饰的α因子前原-前导序列(prepro-leader sequence)取代
20
。此外,在两个合成基因中,通过使用codon optimization tool软件,根据酿酒酵母的密码子使用来优化密码子使用。两个基因也加入了对应于xbai和hindiii限制性位点的序列。得到的基因,一个编码非活性前体(proe40,seq id no:13)并且另一个编码成熟的酶(mate40,seq id no:14),被克隆到诱导型pembl和组成型pvt-u表达质粒(两者都携带用于酿酒酵母中营养缺陷型选择的ura3基因
19,21
)中,并且然后通过电穿孔法引入到electromax dh10b大肠杆菌细胞中。转化体在37℃孵育过夜的含有氨苄青霉素的lb琼脂板(100μg/ml)上选择。构建体的正确性通过测序确认。转化体在37℃孵育过夜的含有氨苄青霉素的lb琼脂板(100μg/ml)上选择。通过采用乙酸锂方法(elble,1992),将pembl/e40和pvt-u/e40质粒转移至宿主酿酒酵母菌株x4004-3a。将细胞铺板在选择性板(缺乏尿苷的培养基)上,并在30℃孵育5-6天。
[0186]
从选择性板挑选来自含有e40基因的酿酒酵母克隆的单个菌落,接种在100ml的基本培养基(0.68%酵母氮源基础ynb、2%葡萄糖、50mg/l的氨基酸l-lys-l-met-l-trp、67mm磷酸钾,ph 6.0)中,在30℃持续3天。
[0187]
取出细胞的等分试样并接种到500-ml烧瓶中的50ml基本培养基的最终体积中,从od600nm=0.25开始。孵育进行直到od600nm达到值0.5(6小时),然后将8ml接种到含有72ml的表达培养基(10g/l酵母提取物、20g/l蛋白胨和2%葡萄糖用于pvt-u/e40质粒或2%半乳糖用于pembl/e40诱导型表达质粒)的500ml烧瓶中持续10天。对于蛋白表达试验,细胞在30℃生长并在不同时间收获。
[0188]
培养物上清液中重组e40的表达通过在ph 5和37℃的孵育过程期间使用合成底物suc-ala-ala-pro-phe-pna、追踪410nm处的吸光度进行的活性测定来检查。酶活性以每分钟每ml的吸光度单位(au)表示。在用质粒pvt-u/mate40转化并生长6天的细胞的上清液中检测到最大活性:显示出0.9au/min/ml的值。进行了用四种构建体转化的酿酒酵母的平行发酵试验,导致相似的表达水平(0.73δabs min-1
ml-1
)。基于这些结果,对在不同时间收集的用质粒pvt-u/mate40和pembl/mate40转化的细胞的上清液进行蛋白印迹分析。蛋白印迹分析显示,当使用pembl-mate40质粒时,蛋白在生长6天后已经表达;对于pvt-u/mate40质粒,蛋白表达在3天后检测到。
[0189]
因此,酿酒酵母可以用作e40的重组生产者。然而,获得的重组e40的适度表达(对于ml上清液,少于1mg e40)使得该生产系统目前不适于工业开发。
[0190]
总之,根据本发明的方法,e40在变铅青链霉菌宿主细胞中的重组表达导致活性e40的分泌。重组谷蛋白酶维持了天然放线异壁酸菌属a8形式的所有化学-物理特征和生物性质,例如在餐后胃ph的稳定性和活性、对胃蛋白酶消化的耐受性、在广泛降解α-醇溶蛋白的最具免疫原性的肽诸如富含pro-gln的33-mer肽(seq id no:12)以及全醇溶蛋白中的高有效性。
[0191]
因此,通过本发明的方法获得的酶制品提供了高含量的活性重组e40,并且此外它
基本不含抗生素,因此适于人类使用,优选地在适当配制为药物制剂或食品补充剂后。
[0192]
实施例18
[0193]
将编码天然成熟形式的e40的合成基因(mate40,seq id no:14)克隆到表达载体中,用于在酵母巴斯德毕赤酵母中成功分泌,该表达载体携带用于甲醇诱导表达的aox1启动子变体(muts)和来自酿酒酵母的α-交配因子的不含glu-ala(eaea)重复序列的前原序列,用于指导分泌在培养基中。吉欧霉素抗性基因也作为选择标志物存在于载体中。靶基因在表达载体中的正确插入通过限制性模式分析检查,并且基因序列的真实性通过测序(lgc genomics,berlin,germany)确认。将浓度为约1μg/μl的纯化质粒用于转化到muts巴斯德毕赤酵母菌株和mut
s-pdi(过量生产蛋白二硫化物-异构酶)巴斯德毕赤酵母菌株中,后者促进蛋白的正确折叠。每种菌株(携带表达e40的载体的2种muts和2种mut
s-pdi菌株,和各自的muts模拟菌株和mut
s-pdi模拟菌株)的若干单菌落被挑选并接种到填充有复合培养基的96深孔板的单孔中。使用四种不同的条件在甲醇诱导型条件下进行生产评价:
[0194]-在ph 6.0的复合培养基
[0195]-补充有蔗糖(最终34%)的在ph 6.0的复合培养基
[0196]-在ph 7.0的复合培养基
[0197]-补充有蔗糖(最终34%)的在ph 7.0的复合培养基
[0198]
在产生生物质的初始生长阶段后,通过添加含有定义浓度的甲醇的经优化的液体混合物来诱导表达。此时,将由作为参考物质的纯化e40组成的对照样品以200μg/ml的最终浓度加标(spiked)到含有模拟菌株的若干孔中。在定义的时间点,用甲醇进行进一步诱导。
[0199]
从甲醇诱导时间起50小时后以及96小时后(过程结束)完成取样。将离心后获得的上清液样品立即调整至含有20%的etoh;在50小时获取的样品被冷冻以与在96小时采样的样品(其被直接测试)一起提交至活性评估。
[0200]
上清液样品以未稀释的形式进行活性测量,而含有加标的e40参考物质的模拟菌株上清液的对照样品在进行活性测定之前用测定缓冲液以1:20稀释。
[0201]
在微量滴定板中使用柠檬酸盐0.1m-磷酸盐0.2m反应缓冲液,ph5中的发色底物suc-ala-ala-pro-phe-pna(bachem l-1400;200μm)(200μl总反应体积中的20μl样品)来评估活性。孵育在37℃进行30分钟。蛋白水解活性被确定为吸光度(在410nm波长读取)在此期间的线性增加,并表示为毫吸光度单位/分钟(mau/分钟)。结果在图11中示出。
[0202]
对照样品(图11中的50对照和96对照)在所有条件和背景都显示出显著的蛋白水解活性(所测试的样品为5.3毫吸光度单位/分钟至6.0毫吸光度单位/分钟,具有8.3mg/l的e40浓度),而来自其他培养物中的任一种的上清液样品没有给出吸光度的增加(《0.07mau/min),对应于e40浓度≤0.1mg/l。结果在表14中报告。
disease.gastroenterology 128,s121-7(2005).
[0215]
7.ribeiro,m.,nunes,f.m.,rodriguez-quijano,m.,carrillo,j.m.,branlard,g.,igrejas,g.next-generation therapies for celiac disease:the gluten-targeted approaches.trends in food science&technology,5,56-71(2018).
[0216]
8.dressman,j.b.,berardi,r.r.,dermentzoglou,l.c.,russell,t.l.,schmaltz,s.p.,barnett,j.l.,jarvenpaa,k.m.upper gastrointestinal(gi)ph in young,healthy men and women.pharm.res.7,756-61(1990).
[0217]
9.gardner,j.d.,ciociola,a.a.,robinson m.measurement of meal-stimulated gastric acid secretion by in vivo gastric autotitration.j.appl.physiol.92,427-34(2002).
[0218]
10.mor
ó
n,b.,cebolla,a.,manyani,h.,alvarez-maqueda,m.,megias,m.,thomas mdel,c.,l
ó
pez,m.c.,sousa,c.sensitive detection of cereal fractions that are toxic to celiac disease patients by using monoclonal antibodies to a main immunogenic wheat peptide.am.j.clin.nutr.87,405-14(2008).
[0219]
11.sollid,l.m.,qiao,s.w.,anderson,r.p.,gianfrani,c.,koning,f.nomenclature and listing of celiac disease relevant gluten t-cell epitopes restricted by hla-dq molecules.immunogenetics 64,455-60(2012).
[0220]
12.ann
é
,j.,vrancken,k.,van mellaert,l.,van impe,j.,&bernaerts,k.protein secretion biotechnology in gram-positive bacteria with special emphasis on streptomyces lividans.biochimica et biophysica acta(bba)-molecular cell research.1843(8),1750-1761(2014).
[0221]
13.kieliszek,m.,&misiewicz,a.microbial transglutaminase and its application in the food industry.a review.folia microbiologica.59,241-250(2013).
[0222]
14.flett,f.,mersinias,v.,smith,c.p.high efficiency intergeneric conjugal transfer of plasmid dna from escherichia coli to methyl dna-restricting streptomycetes.fems microbiol.lett.155,223-229(1997).
[0223]
15.kieser,t.,bibb,m.j.,buttner,m.j.,chater,k.f.,hopwood,d.a.practical streptomyces in genetics,(john innes foundation,2000).
[0224]
16.jena,s.,suryanarayanan,r.,aksan,a.l mutual influence of mannitol and trehalose on crystallization behavior in frozen solutions.pharm res.33,1413-25(2016).
[0225]
17.kriegler m.
″
gene transfer and expression:a laboratory manual
″
stockton press,ny,1990.
[0226]
18.christian r
ü
ckert,andreas albersmeier,tobias busche,sebastian jaenicke,anika winkler,
ó
1afur h.fri
ǒjó
nsson,gu
ǒ
mundur
ꢀó
li hreggvi
ǒ
sson,christophe lambert,daniel badcock,kristel bernaerts,jozef anne,anastassios economou,kalinowski"complete genome sequence of streptomyces lividans tk24
″
journal of biotechnology,2015(volume 199,pages 21-22)
[0227]
19.cesarini g,murray jah.plasmid vectors carrying the replication origin of filamentous single-stranded phages.in:setlow jk,editor.genetic engineering,principles and methods.new york:plenum press,1987,pp.135-154.
[0228]
20.tonin f,melis r,cordes a,sanchez-amat a,pollegioni l,rosini e.comparison of different microbial laccases as tools for industrial uses.n biotechnol,2016,33:387-398.
[0229]
21.vernet t,dignard d,thomas dy.a family of yeast expression vectors containing the phage fl intergenic region.gene,1987,52:225-233。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1