抗菌和抗寄生虫的喹喔啉-2,3-二胺衍生物
1.本发明涉及用于治疗感染病原生物的患者的化合物。具体地,本发明涉及用于治疗人和动物寄生感染和细菌感染的化合物。
背景技术:
2.寄生虫(如多细胞蠕虫和单细胞原生动物)和细菌等病原生物对公共健康构成巨大风险,尤其是在发展中国家。例如,数十亿人被认为患有寄生虫病或面临寄生虫病风险。非常棘手的寄生虫病是由被称为血吸虫的寄生扁虫感染引起的血吸虫病,这种寄生虫病被世界卫生组织认为是仅次于疟疾的第二最具社会经济破坏性的人类寄生虫病。埃及血吸虫(schistosoma haematobium)、日本血吸虫(schistosoma japonicum)和曼氏血吸虫(schistosoma mansoni)是最普遍和最棘手的血吸虫物种,这些血吸虫造成了大部分血吸虫病病例。
3.目前的血吸虫病治疗和控制工作依赖于用吡喹酮治疗高危人群,吡喹酮仍然是唯一可用于防治血吸虫病的药物。尽管吡喹酮具有良好的疗效和耐受性,但它对血吸虫幼虫无效。依赖于单一药物来治疗如此广泛的疾病,也有可能导致这些生物产生耐药性。
4.遗憾的是,由于血吸虫病不成比例地影响发展中国家,在这一领域对新药物的研究相对较少。因此,迫切需要有助于防治血吸虫病的新药物治疗,特别是对血吸虫幼虫有效的药物。
5.另一棘手的寄生虫病是肝片吸虫病,它影响人类和动物种群。由肝片吸虫(fasciola hepatica)和大片吸虫(fasciola gigantica)引起的肝片吸虫病,每年给全球牛肉、羊肉和牛奶行业造成约32亿美元的损失。三氯苯达唑是唯一对肝吸虫幼虫和成虫有效的市售药物。遗憾的是,在非洲、亚洲、澳大利亚、欧洲、北美和南美都发现了抗三氯苯达唑的肝吸虫。正因为如此,急需能够补充和/或替代三氯苯达唑的新药。
6.疟原虫类是人类最重要的寄生虫病,疟疾,其每年导致超过50万人死亡。最致命的疟原虫类(恶性疟原虫(plasmodium falciparum))的一线化疗涉及以青蒿素为基础的联合化疗(act)。遗憾的是,疟原虫对这种一线治疗已经产生了耐药性,尤其是在东南亚。因此,人们正在寻找新药。
7.关于细菌感染,细菌中的抗微生物耐药性(amr)对人类和动物健康构成了严重且日益增长的威胁。数位评论者认为,世界可能正面临一“后抗生素”时代,社会可能不再能够依靠抗微生物药剂和药物的有效性来维持公共健康。最近的一些预测表明,到2050年,除非开发出新的有效抗微生物药剂,否则抗微生物耐药性将是世界人口死亡的主要原因,其每年造成约1000万人死亡。除了所涉及的人力成本之外,如此高的死亡率可能导致gdp每年减少2%至3.5%,相当于每年因amr而损失100万亿美元。
8.在医院获得性感染以及最近在社区获得性感染中特别流行的一种多药耐药细菌菌株是耐甲氧西林金黄色葡萄球菌(staphylococcus aureus),也称为mrsa。mrsa会导致皮肤感染,更严重的会导致血液、肺部或泌尿道感染。mrsa感染的持续增加导致住院时间延
长,同时也增加了患者的死亡率。
9.因此,迫切需要开发具有抗耐mrsa和其它革兰氏阳性菌活性的新型抗微生物药剂。
10.wo 02/20463a2公开了用于调节法尼醇x受体(fxr)的化合物,这种化合物可用于治疗如肥胖症和糖尿病的障碍。该文献中公开的一种具体化合物是化合物1:
11.
技术实现要素:
12.无论是在本文还是在别处指出,本发明的其中一个目的是提供解决了现有技术的至少一个缺点的用于治疗感染病原生物的患者(人或动物)的化合物或药物组合物,或者提供现有化合物的替代物。例如,本发明的目的可能是提供有效治疗血吸虫病和/或细菌感染的化合物。此外,本发明的目的可能是提供化合物,该化合物可以额外地或替代地有效治疗肝片吸虫病和/或疟疾。
13.根据本发明的方面,提供了如所附权利要求中阐述的化合物和用途。从从属权利要求和之后的说明书中,本发明的其它特征将变得显而易见。
14.根据本发明的第一方面,提供了用于治疗感染病原生物的患者的式(i)的化合物或其药学上可接受的盐或溶剂化物;
[0015][0016]
其中x和y各自独立地选自c、n、o和s,条件是x和y中的至少一者是n、o或s;
[0017]
其中r1和r2各自独立地选自c
1-c8烷基、c
1-c8烯基、芳基基团、杂芳基基团或烷基芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇(thiol)、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;或(co)or
13
或(co)nhr
13
基团,其中r
13
选自所述基团;
[0018]
其中z选自h、-cn、-no2、-nr3r4、-nr5(co)r6、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团;其中w是化学键、n或o,并且其中r
12
选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0019]
其中r3和r4各自独立地选自h、c
1-c6烷基(可选地形成环)、c
1-c6烯基、芳基基团,或
杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;或(co)or
14
或(co)nhr
14
基团,其中r
14
选自所述基团;
[0020]
其中r5选自h、c
1-c6烷基或c
1-c6烯基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0021]
其中r6选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;或(co)or
15
或(co)nhr
15
基团,其中r
15
选自所述基团;
[0022]
其中r7和r8各自独立地选自h或c
1-c4烷基基团;
[0023]
其中r9、r
10
和r
11
各自独立地选自h、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团;其中w是化学键、n或o,并且其中r
12
选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0024]
在结构(i)中,虚线表示根据原子x和y的特征可能存在或不存在的化学键。因此,根据原子x和y的特征,r7和r8可能存在或不存在。
[0025]
在一些实施方案中,x和y均是硫,r7和r8不存在,并且结构(ii)中所示的化学键存在。因此,根据本发明第一方面的这些实施方案,提供了用于治疗感染病原生物的患者的式(ii)的化合物或其药学上可接受的盐或溶剂化物;
[0026][0027]
其中r1、r2、r9、r
10
、r
11
和z如上定义。
[0028]
在一些实施方案中,x和y均是氮,r7和r8存在,并且结构(iii)中所示的化学键存在。因此,根据本发明第一方面的这些实施方案,提供了用于治疗感染病原生物的患者的式(iii)的化合物或其药学上可接受的盐或溶剂化物;
[0029][0030]
其中r1和r2各自独立地选自c
1-c8烷基、c
1-c8烯基、芳基基团、杂芳基基团或烷基芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0031]
其中z选自-no2、-nr3r4、-nr5(co)r6、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团;其中w是化学键、n或o,并且其中r
12
选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫
基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0032]
其中r3和r4各自独立地选自h、c
1-c6烷基(可选地形成环)、c
1-c6烯基、芳基基团,或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0033]
其中r5选自h、c
1-c6烷基或c
1-c6烯基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0034]
其中r6选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0035]
其中r7和r8各自独立地选自h或c
1-c4烷基基团;
[0036]
其中r9、r
10
和r
11
各自独立地选自h、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团;其中w是化学键、n或o,并且其中r
12
选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0037]
在第一方面的化合物中,z适宜地不是h。因此z适宜地选自-cn、-no2、-nr3r4、-nr5(co)r6、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团;其中w是化学键、n或o,并且其中r
12
选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0038]
适宜地,r9、r
10
和r
11
各自是h,因此本文第一方面的化合物可能具有如下结构(iv):
[0039][0040]
发明人已经发现,根据第一方面的化合物可用于治疗感染病原生物的患者,特别是感染例如金黄色葡萄球菌(s.aureus)、耻垢分枝杆菌(m.smegmatis)、mrsa、粪肠球菌(enterococcus faecalis)、绿脓杆菌(pseudomonas aeruginosa)、表皮葡萄球菌(s.epidermidis)和蜡样芽孢杆菌(b.cereus)的血吸虫寄生虫和细菌的患者。特别地,这方面的化合物也可以有效治疗血吸虫寄生虫的幼虫,目前的吡喹酮治疗对该寄生虫的幼虫无效。此外,根据第一方面的化合物可用于治疗感染肝片吸虫或疟原虫寄生虫的人或动物。
[0041]
此外,根据第一方面的化合物可用于治疗感染弓形虫(toxoplasma gondii)的人或动物。
[0042]
关于细菌,根据第一方面的化合物可特别用于治疗金黄色葡萄球菌、mrsa或粪肠球菌,适合于治疗金黄色葡萄球菌或mrsa。
[0043]
根据第一方面的化合物可以作为病原生物的蛋白质赖氨酸甲基转移酶的抑制剂。因此,根据第一方面的化合物可用于治疗疾病,其中抑制病原生物的蛋白质赖氨酸甲基转移酶是有益的,例如上面讨论的感染。
[0044]
适宜地,r1和r2各自独立地选自c
1-c8烷基、c
1-c8烯基、芳基基团、杂芳基基团或烷基芳基基团,其可选地选被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氟、氯、cf3、chf2或ch2f基团中的一种或多种取代;
[0045]
适宜地,r1和r2独立地选自芳基基团或烷基芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、oh、nh2、sh、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0046]
烷基芳基是指具有连接到芳基基团上的烷基链的基团,例如具有以下结构(v)的基团:
[0047][0048]
其中n是至少为1的整数,并且u和v代表上文提到的可选的取代基。
[0049]
适宜地,r1和r2具有式(v)的结构,其中n是0、1、2或3;其中u和v是在苯环上的任何位置的上述可选的取代基。
[0050]
适宜地,r1和r2独立地选自芳基基团或烷基芳基基团,其可选地被甲基、甲氧基、oh、cl、f或cf3基团中的一种或多种取代。在这种实施方案中,r1和r2基团的可选取代基可以在芳基基团(或烷基芳基基团的芳基部分)的任何碳原子上。适宜地,芳基基团是苯环。适宜地,芳基基团或烷基芳基基团被甲基、甲氧基、oh、cl、f或cf3基团中的一种或多种取代。因此,该第一方面的化合物适宜地具有结构(vi):
[0051][0052]
其中n1和n2各自独立地=0、1或2;
[0053]
其中每个u选自甲基、甲氧基、oh、cl、f或cf3;
[0054]
其中每个v可选地存在,并且当存在时,选自甲基、甲氧基、oh、cl、f或cf3;
[0055]
其中z如上定义;
[0056]
其中r7和r8各自独立地选自h或c
1-c4烷基,适宜地,其中r7和r8均是h。
[0057]
如结构(vi)所示,u和v取代基可以存在于苯环的任何碳原子上。两个苯环可以具有相同或不同的取代基。适宜地,两个苯环相同(即在相同位置具有相同的取代基)。
[0058]
适宜地,基团r1和r2相同。
[0059]
适宜地,基团r1和r2相同;n1和n2各自=0;每个u选自甲基、甲氧基、oh、cl、f或cf3;每个v可选地存在,并且当存在时,选自甲基、甲氧基、oh、cl、f或cf3;z如上定义;以及r7和r8均是h。
[0060]
适宜地,r1和r2相同,并选自:
[0061][0062]
在第一方面的化合物中,适宜地,r7和r8均是h。
[0063]
在第一方面的化合物中,z可以选自-no2、-nr3r4、-nr5(co)r6。在一些实施方案中,z是-no2。在这种实施方案中,适宜地,基团r1和r2相同;n1和n2各自=0;每个u选自甲基、甲氧基、oh、cl、f或cf3;可选地,每个v存在,并且当存在时,选自甲基、甲氧基、oh、cl、f或cf3;z如上定义;以及r7和r8均是h。
[0064]
在一些实施方案中,z是-nr3r4或-nr5(co)r6。
[0065]
在其中z是-nr3r4的实施方案中,适宜地,r3和r4各自独立地选自h、c
1-c6烷基(可选地形成环)、c
1-c6烯基、芳基基团或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0066]
适宜地,r3和r4各自独立地选自h、c
1-c6烷基(可选地形成环)、c
1-c6烯基或芳基基团,其可选地被c
1-c4烷氧基、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;适宜地,r3和r4独立地选自h、c
1-c6烷基,可选地形成环,其可选地被c
1-c2烷氧基、f、cl和cf3基团中的一种或多种取代。
[0067]
在其中z是-nr3r4并且r3和r4是形成环的c
1-c6烷基的实施方案中,z可以因此是环胺基基团,例如选自以下的基团:
[0068][0069]
在其中z是-nr5(co)r6的实施方案中,r5适宜地选自h、c
1-c6烷基或c
1-c6烯基;并且r6适宜地选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0070]
r6适宜地选自c
1-c6烷基、c
1-c6烯基、芳基基团或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、羟基、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0071]
适宜地,r5是h或甲基。
[0072]
适宜地,r6选自c
1-c6烷基、芳基基团或杂芳基基团,其可选地被c
1-c2烷基、c
1-c2烷氧基、oh、f、cl或cf3基团取代。
[0073]
适宜地,z选自:
[0074][0075]
在这种实施方案中,适宜地,基团r1和r2相同;n1和n2各自=0;每个u选自甲基、甲氧基、oh、cl、f或cf3;每个v可选地存在,并且当存在时,选自甲基、甲氧基、oh、cl、f或cf3;z如上定义;以及r7和r8均是h。
[0076]
在一些实施方案中,第一方面的化合物选自下述化合物1和4-21。
[0077]
根据第一方面,化合物或其药学上可接受的盐或溶剂化物用于治疗感染病原生物的患者。在一些实施方案中,患者感染血吸虫寄生虫,适宜地,其中血吸虫寄生虫是埃及血吸虫、日本血吸虫或曼氏血吸虫。
[0078]
在一些实施方案中,患者是感染肝吸虫寄生虫的人或动物,适宜地,其中寄生虫是肝片吸虫、大片吸虫、麝后睾吸虫(opisthorchis viverrini)或中华枝睾吸虫(clonorchis sinensis)。
[0079]
在一些实施方案中,患者是感染肝片吸虫寄生虫的人或动物,适宜地是动物。
[0080]
在一些实施例中,患者是感染疟原虫寄生虫的人或动物。
[0081]
在一些实施方案中,患者感染病原细菌,适宜地,其中病原细菌选自金黄色葡萄球菌、耻垢分枝杆菌、mrsa、粪肠球菌、绿脓杆菌、表皮葡萄球菌和蜡样芽胞杆菌,适宜地选自金黄色葡萄球菌、mrsa或粪肠球菌。适宜地选自金黄色葡萄球菌或mrsa。
[0082]
适宜地,第一方面提供了用于治疗感染病原生物的患者的如上定义的式(i)的化合物或其药学上可接受的盐或溶剂化物;其中患者感染的病原生物选自血吸虫、肝片寄生虫或疟原虫寄生虫的寄生虫,或选自金黄色葡萄球菌、mrsa或粪肠球菌的病原细菌。
[0083]
在一些实施方案中,本发明的第一方面提供了用于治疗感染病原生物的患者的式(i)的化合物或其药学上可接受的盐或溶剂化物;其中患者感染的病原生物是选自血吸虫、肝片寄生虫或疟原虫寄生虫的寄生虫,或选自金黄色葡萄球菌和mrsa的病原细菌:
[0084][0085]
其中x和y各自独立地选自c、n、o和s,条件是x和y中的至少一者是n、o或s;
[0086]
其中r1和r2各自独立地选自c
1-c8烷基、c
1-c8烯基、芳基基团、杂芳基基团或烷基芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;或(co)or
13
或(co)nhr
13
基团,其中r
13
选自所述基团;
[0087]
其中z选自-cn、-no2、-nr3r4、-nr5(co)r6、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团;其中w是化学键、n或o,并且其中r
12
选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0088]
其中r3和r4各自独立地选自h、c
1-c6烷基(可选地形成环)、c
1-c6烯基、芳基基团,或
杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;或(co)or
14
或(co)nhr
14
基团,其中r
14
选自所述基团;
[0089]
其中r5选自h、c
1-c6烷基或c
1-c6烯基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0090]
其中r6选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;或(co)or
15
或(co)nhr
15
基团,其中r
15
选自所述基团;
[0091]
其中r7和r8当存在时,各自独立地选自h或c
1-c4烷基;
[0092]
其中r9、r
10
和r
11
各自独立地选自h、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团;其中w是化学键、n或o,并且其中r
12
选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0093]
根据本发明的第二方面,提供了式(iii)的化合物或其药学上可接受的盐或溶剂化物:
[0094][0095]
其中r1和r2独立地选自c
1-c8烷基、c
1-c8烯基、芳基基团或烷基芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氟、氯、cf3、chf2或ch2f基团中的一种或多种取代;
[0096]
其中z选自-nr3r4或-nr5(co)r6;
[0097]
其中r3和r4各自独立地选自h、c
1-c6烷基(可选地形成环)、c
1-c6烯基、芳基基团或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0098]
其中r5选自h、c
1-c6烷基或c
1-c6烯基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0099]
其中r6选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代;
[0100]
其中r7和r8各自独立地选自h或c
1-c4烷基;
[0101]
其中r9、r
10
和r
11
各自独立地选自h、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团;其中w是化学键、n或o,并且其中r
12
选自c
1-c6烷基、c
1-c6烯基、芳基或杂芳基基团,其可选地被c
1-c4烷基、c
1-c4烷氧基、c
1-c4烷基氨基、c
1-c4烷硫基、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0102]
第二方面的化合物或其药学上可接受的盐或溶剂化物可以具有与第一方面讨论的相关的任何适宜的特征和优点。
[0103]
适宜地,r1和r2独立地选自芳基基团或烷基芳基基团,其可选地被c
1-c4烷氧基、羟基、氯、氟、cf3、chf2或ch2f基团中的一种或多种取代。
[0104]
适宜地,r1和r2独立地选自芳基基团或烷基芳基基团,其被甲基、甲氧基、羟基、cl、f或cf3基团中的一种或多种取代。
[0105]
根据本发明的第三方面,提供了根据第二方面的化合物,其用作药物。
[0106]
根据本发明的第四方面,提供了根据第二方面的化合物,其用于治疗感染病原生物的患者。
[0107]
第四方面的治疗可以具有与第一方面相关的任何适宜的特征。
[0108]
根据本发明的第五方面,提供了药物组合物,其包含治疗有效量的根据第一或第二方面的化合物或其药学上可接受的盐或溶剂化物,以及药学上可接受的赋形剂。
[0109]
根据本发明的第六方面,提供了治疗感染病原生物的患者的方法,该方法包括给所述患者施用治疗有效量的根据第一或第二方面的化合物或其药学上可接受的盐或溶剂化物,或根据第四方面的药物组合物。
[0110]
第六方面的治疗可以具有与第一方面相关的任何适宜的特征。
[0111]
根据本发明的第七方面,提供了根据第一或第二方面的组合物用于消毒表面的用途,所述表面例如是包含病原细菌的表面。第七方面的用途适宜地包括例如通过喷涂将化合物或包含该化合物的组合物施加到表面上。该表面适宜地是无生命的制品的表面。因此,这种用途适宜地涉及化合物或含有所述化合物的组合物在所述表面的体外应用。在一些实施方案中,在装置或植入物接触活组织之前,表面是手术装置或手术植入物的表面。
[0112]
化合物可以具有与第一和第二方面描述的相关的任何适宜的特征或优点。病原细菌可以如第一方面所述。
[0113]
一般实验细节
[0114]
试剂、溶剂和其它一般信息
[0115]
所有市售的溶剂和试剂均使用西格玛奥德里奇贸易有限公司(sigma-aldrich)、fluorochem或其它商业来源提供的溶剂和试剂,且无需进一步纯化或处理。唯一的例外是也含有化合物3(6-硝基喹喔啉-2,3-二醇,mw=207.15)的化合物2,3-二氯-6-硝基喹喔啉(产品代码49489-fluorochem,化合物2,mw=244.03)。根据nmr分析,这种fluorochem产品产生了比例为3:1的化合物2和3的混合物。
[0116][0117]
通过将500mg混合物溶解在二氯甲烷(dcm,200ml)中,并用氢氧化钠(naoh 1n,每次洗涤用20ml)洗涤四次,直到使用薄层色谱法(tlc)没有检测到痕量的化合物3,得到纯化的混合物。有机相用盐水(15ml)洗涤一次,然后用无水na2so4干燥,过滤并干燥后,得到纯化合物2(350mg)。用6n盐酸酸化碱性溶液(由萃取得到),直至ph值为5。然后用乙酸乙酯(etoac,15ml)萃取水溶液四次。用盐水洗涤合并的有机相,然后用无水na2so4干燥,过滤并干燥后,得到纯化合物3(125mg)。这些化合物的结构经nmr确认,其光谱与公开光谱数据库
中报道的数据一致。
[0118]
下列溶剂是以无水形式购买的:n,n-二甲基亚砜(dmso)和乙腈(ch3cn)。本文中使用的其它溶剂有:二氯甲烷(dcm)、乙酸乙酯(etoac)和正己烷。
[0119]
所有玻璃器皿在130℃的烘箱中干燥2小时,并在使用前冷却至室温。mwi条件(微波辐射)下的反应在cem discover微波系统中以密闭容器模式进行。
[0120]
薄层色谱法
[0121]
所有反应均在市售的默克硅胶(merck kieselgel)60f254板(105554,默克)上通过薄层色谱法(tlc)进行监测。tlc用正己烷/etoac以不同比例洗脱,具体比例取决于合成的具体化合物。使用紫外光(245和366nm)观察分离的组分。
[0122]
快速柱色谱法(cc)
[0123]
使用50微米颗粒大小的高效硅胶柱,在interchim puriflash 430上进行快速柱色谱法。样品以溶于dcm的浓缩溶液的形式涂在硅胶上(如果样品不溶于dcm,则用etoac代替)。用正己烷/etoac以不同比例纯化样品,具体比例取决于所合成的具体化合物。通过tlc分析含有所希望的产物的级分,然后合并在一起,在真空下除去溶剂。
[0124]
nmr光谱
[0125]
将1h和
13
c于25℃记录在brucker avance 500光谱仪(分别为500和126mhz)上。光谱根据所用的氘代溶剂的残留信号进行校准(氘代dmso-dmso-d
6-用于本文所示的所有化合物)。mestrenova(v6.0.2-5475)nmr处理软件用于分峰和计算耦合常数。化学位移δ以百万分之几(ppm)表示,四舍五入到小数点后两位。nmr信号分配中使用了以下缩写:s代表单峰、br s代表宽峰、d代表双峰、t代表三重峰、q代表四重峰、m代表多重峰。耦合常数(j)以赫兹(hz)为单位测量,并四舍五入到小数点后一位。
[0126]
高效液相色谱法(hplc)
[0127]
使用waters uplc系统,结合二极管阵列检测和电喷雾(esi)
+
ms检测,使用超高效液相色谱-质谱(uplc-ms)分析对测试化合物进行纯度/质量测定。固定相是waters acquity uplc beh c18 1.7μm 2.1
×
50mm色谱柱。流动相是含有0.1%甲酸的h2o(a)和含有0.1%甲酸的ch3cn(b)。色谱柱温为40℃,样品稀释液为乙腈,样品浓度为1μg/ml。在0.5ml/min的流速下,样品的注射量为2μl。所使用的方法包括3min的运行时间,在90%的a(0.1min)下进行等度洗脱,然后是从10%到100%的b的1.4min梯度,然后是100%的b下的1.4min等度洗脱,然后是0.1min的初始条件梯度。galaxie色谱数据系统用于数据分析。
[0128]
生物测定中测试的所有化合物纯度都》95%。除非另有说明,中间体的纯度》90%。
[0129]
制备化合物
[0130]
标准程序1a:化合物1的n-(ch2)n芳族类似物的制备
[0131]
在氮气气氛下,向纯化的2,3-二氯喹喔啉(化合物2,1当量-1eq.)的无水dmso混合搅拌溶液中加入适量的苯胺或苯基烷基胺(5eq.)。将反应混合物在130℃下搅拌30min。用正己烷/etoac(7:3),通过tlc监测反应。反应完成后,用etoac稀释混合物,并将混合物倒入冰水中。用etoac萃取水相三次,然后用6n盐酸洗涤合并的有机相(4次),并用盐水溶液洗涤一次。然后用无水na2so4干燥有机相,过滤并干燥,得到粗产物。通过快速色谱法(biotage isolera one)纯化粗产物,根据合成的具体类似物,用不同比例的正己烷/etoac洗脱。该程序提供了通式(vii)的化合物:
[0132]
其中n是0、1或2;
[0133]
标准程序1b:化合物1的n-酰基衍生物的制备
[0134]
在氮气气氛下,向溶解有化合物15(1eq.)的无水dcm溶液中加入无水吡啶(3.6eq.)。将适量的酰基衍生物(1.1eq.)滴加到上述溶液(在氮气下的冰浴中冷却至0℃)中。将所得混合物在室温下搅拌1小时。完成后,用dcm稀释反应混合物,并用饱和碳酸氢钠(nahco3)水溶液猝灭。首先用饱和nahco3水溶液(三次)和盐水(一次)洗涤有机相。然后用无水na2so4干燥有机层,过滤并干燥,得到粗产物。
[0135]
通过快速色谱法(biotage isolera one)纯化粗产物,根据合成的具体类似物,用不同比例的正己烷/etoac洗脱。该程序提供了通式(viii)的化合物:
[0136][0137]
实验部分和光谱数据
[0138]
n2,n
3-双(3,4-二氯苯基)-6-硝基喹喔啉-2,3-二胺(化合物1)的合成
[0139][0140]
化学式:c
20h11
cl4n5o2,分子量:495.14
[0141]
根据标准程序1a制备,由2,3-二氯喹喔啉2(0.50g,2.00mmol)和3,4-二氯苯胺(1.62g,10mmol)的dmso(25ml)溶液在130℃搅拌30min制备化合物1。反应完成后,用etoac(20ml)稀释混合物,并将混合物倒入冰水中。用etoac(3
×
10ml)萃取水相,然后用6n盐酸(4
×
10ml)洗涤合并的有机相,并用盐水(15ml)洗涤一次。用无水na2so4干燥合并的有机相,过滤并蒸发溶剂。通过自动快速色谱柱色谱法纯化粗产物,在10色谱柱体积(cv)中用正己烷:
etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物1为红色粉末,产率为36%。1h nmr(500mhz,dmso-d6)δ9.52(s,2h,2x nh),8.34-8.18(m,3h,3x arh),8.11(d,j=8.9hz,1h,arh),7.87(m,2h,2x arh),7.65(dd,j=8.8,6.9hz,3h,3x arh)。
13
c nmr(126mhz,dmso)δ139.65(arc),130.95(arc),130.57(3x arch),124.98(arc),124.50(arc),122.26(arch),121.66(arch),121.13(arch),120.82(arch),120.61(arch),119.87(arch)。uplc-ms:t
r 2.526min。ms(esi)
+
m/z计算值496.14[m+h]
+
,实验值494.00-496.08-498.02[m+h]
+
。注:数据与以前发表的论文一致(jonathan,2002;kher et al.,2015)。
[0142]
n2,n
3-双(4-氯苯基)-6-硝基喹喔啉-2,3-二胺(化合物4)的合成
[0143][0144]
化学式:c
20h13
cl2n5o2,分子量426.26
[0145]
根据标准程序1a制备,化合物4由2,3-二氯喹喔啉2(0.17g,0.70mmol)和4-氯苯胺(0.45g,3.52mmol)的dmso(9ml)溶液在130℃下搅拌30min衍生得到。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac100:0v/v增加至70:30v/v洗脱。获得的最终产物4为棕色粉末,产率为41%。1h nmr(500mhz,dmso-d6)δ9.57(s,1h,nh),9.41(s,1h,nh),8.34-8.27(m,1h,arh),8.10(dd,j=7.9,4.2hz,1h,arh),7.95(ddd,j=13.9,8.7,1.9hz,4h,arh),7.64(dd,j=9.4,4.1hz,1h,arh),7.48(ddd,j=8.9,4.0,1.4hz,4h,arh)。
13
c nmr(126mhz,dmso)δ144.39(arc),143.41(arc),142.70(arc),141.40(arc),138.87(arc),138.54(arc),135.59(arc),129.06(4x arch),127.89(arccl),127.36(arccl),126.50(arch),123.49(2x arch),122.96(2x arch),121.12(arch),119.84(arch)。uplc-ms:t
r 2.763min。ms(esi)
+
m/z计算值427.26[m+h]
+
,实验值426.18-428.19[m+h]
+
。
[0146]
n2,n
3-双(3-氯苯基)-6-硝基喹喔啉-2,3-二胺(化合物5)的合成
[0147][0148]
化学式:c
20h13
cl2n5o2,分子量426.26
[0149]
根据标准程序1a制备,由2,3-二氯喹喔啉2(0.09g,0.38mmol)和3-氯苯胺(0.24g,1.90mmol)的dmso(5ml)溶液在130℃下搅拌30min合成化合物5。反应的后处理与化合物1类
似。通过自动快速色谱柱色谱法纯化粗产物,在14cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物5为黄色粉末,产率为40%。1h nmr(500mhz,dmso-d6)δ9.57(s,1h,nh),9.42(s,1h,nh),8.31(d,j=2.7hz,1h,arh),8.17-8.03(m,3h,3x arh),7.86(dd,j=23.1,8.2hz,2h,2x arh),7.68(d,j=8.8hz,1h,arh),7.46(td,j=8.1,2.5hz,2h,2x arh),7.20(dd,j=11.9,8.5hz,2h,2x arh)。
13
c nmr(126mhz,dmso)δ144.04(arc),142.92(arc),142.20(arc),140.96(arc),140.82(arc),140.69(arc),135.04(arccl),132.98(arccl),130.41(3x arch),126.22(arch),123.31(arch),122.88(arch),120.74(arch),120.64(arch),120.09(arch),119.64(arch),119.13(arch)。uplc-ms:t
r 2.785min。ms(esi)
+
m/z计算值427.26[m+h]
+
,实验值426.20-428.18[m+h]
+
。
[0150]
n2,n
3-双(4-氟苯基)-6-硝基喹喔啉-2,3-二胺(化合物6)的合成
[0151][0152]
化学式:c
20h13
f2n5o2,分子量:393.35
[0153]
根据标准程序1a,由2,3-二氯喹喔啉2(0.10g,0.41mmol)和4-氟苯胺(0.23g,2.05mmol)的dmso(5ml)溶液在130℃搅拌30min制备化合物6。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物6为橙色粉末,产率为10%。1h nmr(500mhz,dmso-d6)δ9.56(s,1h,nh),9.39(s,1h,nh),8.29(d,j=2.6hz,1h,arh),8.19(dd,j=9.1,5.0hz,1h,arh),8.10(d,j=8.9hz,1h,arh),7.94(dd,j=16.4,10.6hz,3h,3x arh),7.67-7.60(m,1h,arh),7.29(td,j=8.6,4.3hz,4h,4x arh)。
13
c nmr(126mhz,dmso)δ176.35(2x arc),143.88(arc),143.35(arc),142.61(arc),141.32(arc),135.84(arc),135.83(arc),135.37(arc),126.11(arch),123.86(arch),123.79(arch),123.26(arch),123.20(arch),120.69(arch),119.43(arch),115.71(arch),115.67(arch),115.53(arch),115.49(arch)。uplc-ms:t
r 2.557min。ms(esi)
+
m/z计算值394.35[m+h]
+
,实验值394.24[m+h]
+
。
[0154]
n2,n
3-双(4-氟-3-(三氟甲基)苯基)-6-硝基喹喔啉-2,3-二胺(化合物7)的合成
[0155]
[0156]
化学式:c
22h11
f8n5o2,分子量:529.35
[0157]
根据标准程序1a,由2,3-二氯喹喔啉2(0.12g,0.49mmol)和4-氟-3-(三氟甲基)苯胺(0.44g,2.46mmol)的dmso(6ml)溶液在130℃下搅拌30min制备化合物7。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物7为红色粉末,产率为60%。1h nmr(500mhz,dmso-d6)δ9.61(s,2h,2x nh),8.32(br s,2h,2x arh),8.23(d,j=13.8hz,3h,3x arh),8.10(br s,1h,arh),7.57(ddd,j=17.4,11.5,7.0hz,3h,3x arh)。
13
c nmr(126mhz,dmso)δ174.16(arc),144.17(arc),142.96(arc),142.25(arc),140.72(arc),136.27(arc),135.96(arc),135.04(arc),127.22(arch),126.74(arch),126.26(arch),124.73(arc),123.71(arc),120.74(arch),119.81(arch),119.18(arch),118.62(arch),117.80(arch),117.63(arch)。uplc-ms:t
r 2.801min。ms(esi)
+
m/z计算值530.35[m+h]
+
,实验值530.08[m+h]
+
。
[0158]
n2,n
3-双(3-氟-5-(三氟甲基)苯基)-6-硝基喹喔啉-2,3-二胺(化合物8)的合成
[0159][0160]
化学式:c
22h11
f8n5o2,分子量:529.35
[0161]
根据标准程序1a制备,由2,3-二氯喹喔啉2(0.09g,0.36mmol)和3-氟-5-(三氟甲基)苯胺(0.32g,1.8mmol)的dmso(5ml)溶液在130℃下搅拌30min合成化合物8。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在15cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物8为橙色粉末,产率为10%。1h nmr(500mhz,dmso-d6)δ9.71(br s,2h,2x nh),8.34-8.18(m,3h,3x arh),8.10(d,j=8.9hz,1h,arh),7.92(d,j=31.7hz,2h,2x arh),7.65(d,j=9.0hz,1h,arh),7.33(dd,j=24.4,8.3hz,2h,2x arh)。
13
c nmr(126mhz,dmso)δ163.17(arc),161.24(arc),147.21(arc),144.53(arc),142.61(arc),141.94(arc),140.41(arc),134.88(arc),131.00(arc),126.63(arch),124.55(arc),122.38(arc),121.11(arch),120.20(arch),113.19(arch),112.71(arch),111.02(arch),110.82(arch),110.58(arch),110.36(arch)。uplc-ms:t
r 2.882min。ms(esi)
+
m/z计算值530.35[m+h]
+
,实验值529.98[m+h]
+
。
[0162]
n2,n
3-双(2-氟-5-(三氟甲基)苯基)-6-硝基喹喔啉-2,3-二胺(化合物9)的合成
[0163][0164]
化学式:c
22h11
f8n5o2,分子量:529.35
[0165]
根据标准程序1a,由2,3-二氯喹喔啉2(0.16g,0.66mmol)和2-氟-5-(三氟甲基)苯胺(0.59g,3.3mmol)的dmso(5ml)溶液在130℃下搅拌30min制备化合物9。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在12cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物9为黄色粉末,产率为10%。1h nmr(500mhz,dmso-d6)δ9.63(br s,2h,2x nh),7.67-7.48(m,4h,4x arh),7.26(dd,j=11.6,8.3hz,1h,arh),7.12(dd,j=20.4,10.5hz,1h,arh),6.93-6.86(m,1h,arh),6.74-6.67(m,1h,arh),6.63(dd,j=8.2,1.8hz,1h,arh)。
13
c nmr(126mhz,dmso)δ157.91(arc),153.77(arc),143.90(arc),135.84(arc),132.90(arch),131.10(arch),128.72(arch),125.29(arc),124.53(arch),122.03(arch),118.78(arc),115.49(arch),115.33(arch),115.19(arch),115.03(arch),114.93(arc),111.95(arc)。uplc-ms:t
r 2.378min。ms(esi)
+
m/z计算值530.35[m+h]
+
,实验值530.05[m+h]
+
。
[0166]
6-硝基-n2,n
3-双(3-(三氟甲基)苯基)喹喔啉-2,3-二胺(化合物10)的合成
[0167][0168]
化学式:c
22h13
f6n5o2,分子量:493.37
[0169]
根据标准程序1a,由2,3-二氯喹喔啉2(0.15g,0.61mmol)和3-(三氟甲基)苯胺(0.49g,3.1mmol)的dmso(8ml)溶液在130℃下搅拌30min制备化合物10。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在12cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物10为黄色粉末,产率为30%。1h nmr(500mhz,dmso-d6)δ9.74(s,1h,nh),9.60(s,1h,nh),8.36-8.21(m,5h,5x arh),8.15(dd,j=9.0,2.7hz,1h,arh),7.73-7.62(m,3h,3x arh),7.49(dd,j=12.8,7.9hz,2h,2x arh)。
13
c nmr(126mhz,dmso)δ144.16(arc),142.99(arc),142.27(arc),140.77(arc),140.29(arc),140.02(arc),135.04(arc),130.01(arch),129.97(arch),129.53(arc),126.26(arch),125.32(arc),124.64(arch),124.18(arch),120.76(arch),119.86(arch),119.79(arch),119.42(arch),117.28(arch),116.75(arch)。uplc-ms:t
r 2.344min。ms(esi)
+
m/z计算值494.37[m+h]
+
,实验值494.15[m+h]
+
。
[0170]
6-硝基-n2,n
3-双(4-(三氟甲基)苯基)喹喔啉-2,3-二胺(化合物11)的合成
[0171]
[0172]
化学式:c
22h13
f6n5o2,分子量:493.37
[0173]
根据标准程序1a制备,由2,3-二氯喹喔啉2(0.20g,0.85mmol)和4-(三氟甲基)苯胺(0.69g,4.25mmol)的dmso(10ml)溶液在130℃下搅拌30min合成化合物11。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在12cv中用正己烷:etoac 100:0v/v增加至80:20v/v洗脱。获得的最终产物11为黄色粉末,产率为50%。1h nmr(500mhz,dmso-d6)δ9.74(s,1h,nh),9.61(s,1h,nh),8.34(s,1h,arh),8.18-8.07(m,5h,5x arh),7.77(d,j=8.3hz,4h,4x arh),7.68(d,j=8.9hz,1h,arh)。
13
c nmr(126mhz,dmso)δ144.22(arc),143.16(arc),142.87(arc),142.79(arc),142.07(arc),140.67(arc),135.03(arc),125.90(5x arch),123.06(arcf3),122.81(arcf3),120.94(3x arch),120.42(2x arch),119.78(arch)。uplc-ms:t
r 2.357min。ms(esi)
+
m/z计算值494.37[m+h]
+
,实验值494.13[m+h]
+
。
[0174]
n2,n
3-双(4-甲氧基-3(三氟甲基)苯基-6-硝基喹喔啉-2,3-二胺(化合物12)的合成
[0175][0176]
化学式:c
24h17
f6n5o4,分子量:553.42
[0177]
根据标准程序1a,由2,3-二氯喹喔啉2(0.16g,0.61mmol)和4-甲氧基-3-(三氟甲基)苯胺(0.58g,3.05mmol)的dmso(8ml)溶液在130℃下搅拌30min制备化合物12。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac 100:0v/v增加至50:50v/v洗脱。获得的最终产物12为橙色粉末,产率为88%。1h nmr(500mhz,dmso-d6)δ9.50(s,1h,nh),9.34(s,1h,nh),8.28-8.03(m,6h,6x arh),7.55(d,j=8.8hz,1h,arh),7.35(d,j=9.1hz,2h,2x arh),3.92(s,3h,ch3),3.91(s,3h,ch3)。
13
c nmr(126mhz,dmso)δ153.16(arc-och3),152.86(arc-och3),143.68(arc),142.99(arc),142.31(arc),141.01(arc),135.07(arc),132.16(arc),131.83(arc),126.92(arch),126.53(arch),125.80(arch),124.70(arcf3),122.57(arcf3),120.35(arch),119.96(arch),119.44(arch),119.29(arch),116.73(arc),116.50(arc),113.37(arch),113.36(arch),56.28(2x ch3)。uplc-ms:t
r 2.273min。ms(esi)
+
m/z计算值554.42[m+h]
+
,实验值554.13[m+h]
+
。
[0178]
n2,n
3-二苄基-6-硝基喹喔啉-2,3-二胺(化合物13)的合成
[0179][0180]
化学式:c
22h19
n5o2,分子量:385.43
[0181]
根据标准程序1a制备,由2,3-二氯喹喔啉2(0.13g,0.51mmol)和苯基甲胺(0.27g,2.5mmol)的dmso(6ml)溶液在130℃下搅拌30min合成化合物13。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物13为橙色粉末,产率为65%。1h nmr(500mhz,dmso-d6)δ8.16(d,j=2.6hz,1h,arh),8.09(t,j=5.2hz,1h,nh),7.97(dd,j=8.9,2.7hz,1h,arh),7.85(t,j=5.2hz,1h,nh),7.51(d,j=8.9hz,1h,arh),7.46-7.39(m,4h,arh),7.36(t,j=7.6hz,4h,arh),7.30-7.25(m,2h,arh),4.76(d,j=5.2hz,2h,ch2),4.73(d,j=5.1hz,2h,ch2)。
13
c nmr(126mhz,dmso)δ145.08(arc),144.39(arc),142.59(arc),141.92(arc),138.68(arc),138.42(arc),135.58(arc),128.43(2x arch),128.40(2x arch),128.13(2x arch),128.12(2x arch),127.20(arch),127.13(arch),125.04(arch),119.77(arch),118.01(arch),44.50(2x ch2)。uplc-ms:t
r 2.186min。ms(esi)
+
m/z计算值386.43[m+h]
+
,实验值386.32[m+h]
+
。
[0182]
6-硝基-n2,n
3-二苯乙基喹喔啉-2,3-二胺(化合物15)的合成
[0183][0184]
化学式:c
24h23
n5o2,分子量:413.48
[0185]
根据标准程序1a,由2,3-二氯喹喔啉2(0.12g,0.49mmol)和2-苯基乙-1-胺(0.30g,2.5mmol)的dmso(6ml)溶液在130℃下搅拌30min制备化合物14。反应的后处理与化合物1类似。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物14为橙色粉末,产率为75%。1h nmr(500mhz,dmso-d6)δ8.18(d,j=2.7hz,1h,arh),7.97(dd,j=8.9,2.7hz,1h,arh),7.67(t,j=5.2hz,1h,nh),7.52(d,j=8.9hz,1h,arh),7.43(t,j=5.1hz,1h,nh),7.34-7.26(m,8h,8x arh),7.25-7.18(m,2h,2x arh),3.73(td,j=12.6,6.6hz,4h,2x ch
2-n),2.97(dd,j=8.1,6.6hz,4h,2x ch2)。
13
c nmr(126mhz,dmso)δ145.18(arc),144.48(arc),142.48(arc),141.96(arc),139.58(arc),139.46(arc),135.58(arc),128.74(2x arch),128.73(2x arch),128.39(2x arch),128.38(2x arch),126.20(arch),126.16(arch),125.04(arch),119.83(arch),117.87(arch),42.61(ch2),42.57(ch2),34.20(ch2),34.15(ch2)。uplc-ms:t
r 2.271min。ms(esi)
+
m/z计算值414.48[m+h]
+
,实验值414.35[m+h]
+
。
d6)δ9.12(s,1h,nh),8.97(s,1h,nh),8.27(d,j=2.6hz,1h,arh),8.19(d,j=2.5hz,1h,arh),7.94(dd,j=8.9,2.5hz,1h,arh),7.78(dd,j=8.9,2.5hz,1h,arh),7.67(d,j=8.8hz,1h,arh),7.62(d,j=8.8hz,1h,arh),7.51(d,j=8.9hz,1h,arh),6.93(dd,j=9.0,2.6hz,1h,arh),6.61(d,j=2.6hz,1h,arh),3.35(t,j=6.6hz,4h,2x ch2),2.04-1.96(m,4h,2x ch2)。
13
c nmr(126mhz,dmso)δ145.75(arc),141.34(arc),141.20(arc),140.63(arc),138.11(arc),136.89(arc),131.13(arc),131.04(arc),130.72(arch),130.58(arch),128.61(arc),126.51(arch),124.09(arc),122.91(arc),121.69(arch),120.62(arch),120.43(arch),119.49(arch),114.87(arch),105.12(arch),48.97(2x ch2),25.01(2x ch2)。uplc-ms:t
r 2.707min。ms(esi)
+
m/z计算值520.25[m+h]
+
,实验值515.95-518.05-591.13[m+h]
+
。
[0194]
n-(2,3-双((3,4-二氯苯基)氨基)喹喔啉-6-基)乙酰胺(化合物17)的合成
[0195][0196]
化学式:c
22h15
cl4n5o,分子量:507.20
[0197]
根据标准程序1b,在氮气气氛下,将乙酰氯(0.01g,0.13mmol)滴加入至含有化合物15(0.06g,0.12mmol)和无水吡啶(0.03g,0.43mmol)的无水dcm(4ml)溶液中,制备化合物17。将所得混合物在室温下搅拌1小时。完成后,用dcm(10ml)稀释反应并用饱和nahco3水溶液(15ml)猝灭。分别用饱和nahco3水溶液(3
×
10ml)和盐水(15ml)洗涤有机相。然后用无水na2so4干燥有机层,过滤并干燥,得到粗产物。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac 100:0v/v增加至50:50v/v洗脱。获得的最终产物17为浅黄色粉末,产率为52%。1h nmr(500mhz,dmso-d6)δ10.11(s,1h,nh-c=o),9.23(s,1h,nh),9.15(s,1h,nh),8.31(d,j=2.5hz,1h,arh),8.24(d,j=2.6hz,1h,arh),8.00(d,j=2.1hz,1h,arh),7.81(ddd,j=9.3,6.9,2.5hz,2h,2x arh),7.63(dd,j=18.7,8.8hz,2h,2x arh),7.58-7.50(m,2h,2x arh),2.09(s,3h,ch3)。
13
c nmr(126mhz,dmso)δ168.38(c=o),141.15(arc),140.64(arc),140.43(arc),139.82(arc),137.46(arc),136.30(arc),132.18(arc),130.79(2x arc),130.47(arch),130.43(arch),125.78(arch),123.52(arc),123.20(arc),121.04(arch),120.78(arch),120.05(arch),119.81(arch),118.78(arch),113.96(arch),24.12(ch3)。uplc-ms:t
r 2.195min。ms(esi)
+
m/z计算值508.20[m+h]
+
,实验值506.10-508.02-510.04[m+h]
+
。
[0198]
n-(2,3-双((3,4-二氯苯基)氨基)喹喔啉-6-基)己酰胺(化合物18)的合成
[0199][0200]
化学式:c
26h23
cl4n5o,分子量:563.30
[0201]
根据标准程序1b,在氮气气氛下,通过向含有化合物15(0.05g,0.11mmol)和无水吡啶(0.03g,0.39mmol)的无水dcm(5ml)溶液中己酰氯(0.02g,0.12mmol)来合成化合物18。将所得混合物在室温下搅拌1小时。反应的后处理与化合物17类似。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物18为棕色粉末,产率为66%。1h nmr(500mhz,dmso-d6)δ10.04(s,1h,nh-c=o),9.24(s,1h,nh),9.17(s,1h,nh),8.33(d,j=2.6hz,1h,arh),8.25(d,j=2.5hz,1h,arh),8.05(d,j=2.2hz,1h,arh),7.82(ddd,j=13.8,8.9,2.5hz,2h,2x arh),7.63(dd,j=18.7,8.8hz,2h,2x arh),7.59-7.51(m,2h,2x arh),2.34(t,j=7.4hz,2h,ch2),1.62(p,j=7.4hz,2h,ch2),1.36-1.28(m,4h,2x ch2),0.91-0.86(m,3h,ch3)。
13
c nmr(126mhz,dmso)δ171.39(c=o),141.06(arc),140.64(arc),140.44(arc),139.73(arc),137.48(arc),136.28(arc),132.13(arc),130.80(arc),130.43(arch),130.39(arch),125.73(arch),123.50(arc),123.20(arc),120.98(arch),120.76(arch),119.99(arch),119.78(arch),118.84(arch),114.01(arch),36.49(ch2),30.95(ch2),24.84(ch2),21.96(ch2),13.90(ch3)。uplc-ms:t
r 2.429min。ms(esi)
+
m/z计算值564.30[m+h]
+
,实验值562.04-564.08-566.01[m+h]
+
。
[0202]
n-(2,3-双((3,4-二氯苯基)氨基)喹喔啉-6-基)呋喃-2-甲酰胺(化合物19)的合成
[0203][0204]
化学式:c
25h15
cl4n5o2,分子量:559.23
[0205]
根据标准程序1b,在氮气气氛下,通过向含有化合物15(0.06g,0.13mmol)和无水吡啶(0.04g,0.47mmol)的无水dcm(4ml)溶液中滴加呋喃-2-羰基氯(0.02g,0.14mmol)制备化合物19。将所得混合物在室温下搅拌1小时。反应的后处理与化合物17类似。通过自动快速色谱柱色谱法纯化粗产物,在10cv中用正己烷:etoac 100:0v/v增加至70:30v/v洗脱。获得的最终产物19为黄色粉末,产率为55%。1h nmr(500mhz,dmso-d6)δ10.35(s,1h,nh-c=
o),9.26(s,1h,nh),9.20(s,1h,nh),8.35(d,j=2.5hz,1h,arh),8.26(d,j=2.5hz,1h,arh),8.14(d,j=2.3hz,1h,arh),7.96(dd,j=1.8,0.8hz,1h,arh),7.83(dt,j=8.9,2.0hz,3h,3x arh),7.69-7.55(m,3h,3x arh),7.39(dd,j=3.5,0.9hz,1h,arh),6.72(dd,j=3.5,1.7hz,1h,arh)。
13
c nmr(126mhz,dmso)δ156.61(c=o),147.88(arc),146.23(arch),141.57(arc),140.97(arc),140.80(arc),140.45(arc),137.07(arc),136.55(arc),133.03(arc),131.20(arc),130.85(arch),130.83(arch),126.07(arch),123.95(arc),123.70(arc),121.45(arch),121.26(arch),120.47(arch),120.28(arch),120.18(arch),115.79(arch),115.20(arch),112.59(arch)。uplc-ms:t
r 2.297min。ms(esi)
+
m/z计算值560.23[m+h]
+
,实验值557.99-559.93-561.85[m+h]
+
。
[0206]
具有以下所示结构的化合物20和21从specs商业获得。
[0207][0208]
对比化合物“对比化合物1(comp.1)”(通过与上述类似的方法制备),“对比化合物2(comp.2)”(从西格玛奥德里奇贸易有限公司获得)和“对比化合物3(comp.3)”(从西格玛奥德里奇贸易有限公司获得)被包括在作为对比实施例描述的实验中。这些化合物产生的结果如表1所示(前两行)。化合物“对比化合物1”具有以下结构。
[0209][0210]
化合物“对比化合物2”是吡喹酮,已知的治疗人血吸虫病的药物,具有以下结构:
[0211][0212]
化合物“对比化合物3”是三氯苯达唑(tbz),它是已知的抗寄生虫药,具有以下结构:
[0213][0214]
生物筛选
[0215]
72小时血吸虫童虫(schistosomula)药物筛选
96)测量全球组蛋白h3-k4甲基化。
[0233]
新脱囊(excysted)幼虫(nej)药物筛选
[0234]
肝片吸虫(f.hepatica)(意大利株)囊蚴获得自英国格洛斯特郡里奇韦研究所,并保存于4℃。根据dixon等和wilson等(dixon,k.e.,the physiology of excystment of the metacercaria of fasciola hep
á
tica l.parasitology,1966,56,431-456.;wilson,l.r.,good,r.t.,panaccio,m.,wijffels,g.l.,sandeman,r.m.,spithill,t.w,fasciola hepatica:characterization and cloning of the major cathepsin b protease secreted by newly excysted juvenile liver fluke.experimental parasitology 1998,88,85-94)基于引入到脱包囊方法的优化,从囊蚴中产生新脱囊幼虫(nej)。
[0235]
脱包囊后,将nej以每孔25个寄生虫的密度分配到24孔组织培养板中,每孔含有1ml预热的nej培养基。将化合物加入到各自的孔中,将nej/化合物共培养物在含5%的co2的气氛中于37℃培养72小时,最终浓度为10μm。药物对寄生虫表型和运动性的影响使用评分矩阵独立评分,如之前在edwards,j.,brown,m.,peak,e.,bartholomew,b.,nash,r.j.,hoffmann,k.f.,the diterpenoid 7-keto-sempervirol,derived from lycium chinense,displays anthelmintic activity against both schistosoma mansoni and fasciola hepatica,plos neglected tropical diseases 2015,9,e0003604-e0003604中所描述。
[0236]
hepg2细胞的mtt检测
[0237]
使用白种人肝细胞癌(hepg2)细胞(85011430,西格玛奥德里奇贸易有限公司)评估这些抗感染化合物的明显毒性。
[0238]
简而言之,hepg2细胞用化合物处理24h,如之前在crusco a,bordoni c,chakroborty a,whatley kcl,whiteland h,westwell ad,hoffmann kf.,eur j med chem.2018 may 25;152:87-100中所描述。每种化合物用于在不同的浓度点给细胞给药:200、100、75、50、20、10和1μm,每种一式三份。在hepg2培养基中制备每种化合物溶液,浓度为细胞毒性试验所需浓度的两倍(200-2μm,对于100-1μm最终浓度)。根据预定的设计,将50μl的化合物溶液加入到板的相应孔中。通过分别添加50μl不含化合物的新培养基和dmso(1.25%v/v),制备培养基和dmso对照(也是一式三份)。在每次筛选中还包括一个阴性对照(1%v/v triton x-100;x100,西格玛奥德里奇贸易有限公司)。加入化合物后,再培养每个平板20h,然后施用mtt试剂(如在nur-e-alam m,yousaf m,ahmed s,al-sheddi es,parveen i,fazakerley dm,bari a,ghabbour ha,threadgill md,whatley kcl,hoffmann kf,al-rehaily aj,j nat prod.2017 jun 23;80(6):1900-1908中描述的方法制备),使用mtt法评估化合物的细胞毒性。
[0239]
用测试化合物培养20h后,向每个孔中加入10μl(10%最终体积)的12mm mtt试剂。然后将板进一步培养4h。培养后,将每个板在层流下吸干以除去经mtt处理的培养基。然后向每个孔中加入100μl dmso:异丙醇(1:1)溶液,然后将板在37℃培养10分钟。培养后,再次摇动每个板,然后在570nm测量吸光度。基于用作空白(无细胞)的孔的平均值,校正吸光度读数。在graphpad prism 7.02中,根据每种浓度下三次重复的平均吸光度,生成用于计算测试化合物的cc
50
浓度值的剂量响应曲线。
[0240]
以这种方式获得的数据显示在表1中标记为“hepg2”的栏中。该数据还用于计算抗
血吸虫童虫和成虫活性相对于hepg2试验活性的选择性指数(毒性指标)。表1的最后两栏显示了血吸虫童虫和成虫的选择性指数。
[0241]
体外抗菌活性测定
[0242]
大肠杆菌(escherichia coli)-大肠杆菌(e.coli)-atcc 25922菌株、金黄色葡萄球菌(staphylococcus aureus)-金黄色葡萄球菌(s.aureus)-atcc 29213、耻垢分枝杆菌(mycobacterium smegmatis)-耻垢分枝杆菌mc215-atcc 700084、mrsa(usa300,atcc 33591,em rsa)、绿脓杆菌-atcc 27853、表皮葡萄球菌-ntct11077、蜡样芽胞杆菌菌株用于测试所有化合物,如之前在“untargeted metabolomics reveals a new mode of action of pretomanid(pa-824)”,baptista,rafael,fazakerley,david m.,beckmann,manfred,baillie,les and mur,luis a.j.2018.scientific reports 8(1),2018中所描述。粪肠球菌菌株-atcc 29212、nctc 12201、atcc 51299;肺炎链球菌(streptococcus pneumoniae)-atcc 49619、18778、21394、21395;流感嗜血杆菌(haemophilus influenza)-atcc 49766、18391、17428;金黄色葡萄球菌-nctc 12493、atcc baa-077、atcc 700698、11051;用于测试化合物,如之前在“clinical laboratory testing and in vitro diagnostics test systems-susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility devices-part 1:reference methods for testing the in vitro activity of antimicrobial agentes against bacteria involved in infectious diseases。iso/fdis 20776-1:2006(e)中所描述。所有程序均是在生物安全防护等级2下进行。
[0243]
抗血吸虫体内药效筛选
[0244]
本文描述的化合物的抗血吸虫功效试验使用以下程序在小鼠血吸虫病模型上进行。曼氏血吸虫尾蚴由感染的光滑双脐螺蜗牛经光照40分钟(在人工池塘水中)诱导同步脱落制备。小鼠通过将尾部暴露于每只小鼠120只曼氏血吸虫尾蚴中持续45分钟而经皮感染[smithers s,terry r.the infection of laboratory hosts with cercariae of schistosoma mansoni and the recovery of the adult worms.parasitology.1965;55(4):695-700]。在7周的感染期间,最多有6只小鼠被关在笼子里。
[0245]
在感染后6周(感染后第42天),使用高压灭菌的灌胃针给小鼠服用驱虫药进行口服给药。给药前,将灌胃针浸入蔗糖的浓溶液中(大约1g/ml),作为减少应激相关反应的一种细化措施。
[0246]
对于口服给药,称取化合物(干燥粉末)并在合适的赋形剂(例如10%dmso、20%巴斯夫蓖麻油(kolliphor el)和70%无菌水)中制备。每天制备新鲜的复合制剂,并丢弃任何剩余的。
[0247]
对于每种选定的化合物,一定数量的动物(3-6只的范围内)通过口服给药(例如剂量水平为100mg/kg,剂量体积为10ml/kg)。每只小鼠在两个非连续日(感染后第42天和第44天)每天给药一次。对照处理的每只小鼠只给药载体(10%dmso、20%巴斯夫蓖麻油和70%无菌水),剂量体积为10ml/kg,遵循相同的给药间隔。
[0248]
在治疗结束时(感染后第48天),在接受含有100u/ml肝素溶液(在1x pbs中)的不可恢复剂量的戊巴比妥钠(100μl/10g体重)的腹膜内给药后,对小鼠进行灌注。通过用预温(37℃)的灌注介质(补充有0.1%100u/ml肝素溶液(在1x pbs中)的dmem)肝门静脉灌注,从
每只小鼠获得曼氏血吸成虫。蠕虫被收集在置于灌注动物正下方的沉淀瓶中。随后,首先用灌注培养基通过沉降洗涤蠕虫,然后预温成虫培养基(补充有10%v/v fcs(gibco,paisley,uk)、1%v/v l-谷氨酰胺(gibco,paisley,uk)和抗生素混合物(150单位/ml青霉素和150μg/ml链霉素;gibco,uk)的dmem(gibco,paisley,uk))洗涤[如在crusco a,whiteland h,baptista r,forde-thomas je,beckmann m,mur laj,et al.antischistosomal properties of sclareol and its heck-coupled derivatives:design,synthesis,biological evaluation,and untargeted metabolomics.acs infectious diseases.2019;5(7):1188-99;whatley kcl,padalino g,whiteland h,geyer kk,hulme bj,chalmers iw,et al.the repositioning of epigenetic probes/inhibitors identifies new anti-schistosomal lead compounds and chemotherapeutic targets.plos neglected tropical diseases.2019;13(11):e0007693;和whiteland h,chakroborty a,forde-thomas j,crusco a,cookson a,hollinshead j,et al.an abeis procera-derived tetracyclic triterpene containing a steroid-like nucleus core and a lactone side chain attenuates in vitro survival of both fasciola hepatica and schistosoma mansoni.international journal for parasitology:drugs and drug resistance.2018;8中描述的]。在含5%co2的加湿环境中于37℃培养至少1小时后,对每次处理的每只小鼠的蠕虫负荷进行量化。
[0249]
灌注后,取出肝脏并称重,然后放入50ml离心管中,通过4%koh处理(37℃)进行过夜消化。随后对每个样本进行血吸虫卵计数(以每个器官重量的卵数表示),以评估药物处理笼和对照笼(例如载体)之间的任何差异。
[0250]
结果
[0251]
通过上述方法获得的化合物1和4-21的数据被转换成剂量响应曲线,基于每个浓度的平均分数,使用graphpad prism 7.02计算这些化合物的ec
50
值。表1显示了化合物1和4-21的抗血吸虫筛选数据。表2显示了化合物1、4、5、7、9-16、18、19和对照化合物3(tbz)对肝片吸虫的新脱囊幼虫,对dmso和rpmi培养基对照的活性,其中使用克鲁斯卡尔-沃利斯(kruskal-wallis)方差分析(随后是dunn’s post-hoc分析测试)对所有治疗条件进行统计评估(与dmso对照相比)。表3显示了化合物2、5、7、10-14和16-19的抗菌筛选数据。表4显示了化合物2、5、7、11、12和19的额外抗菌筛选数据。
[0252]
表1表明,与对比化合物“对比化合物1”和“对比化合物2”相比,实施例化合物显示出对曼氏血吸虫童虫、幼虫和成虫相似或改善的活性,并且许多这些化合物显示出比hepg2更高的选择性指数。因此,本发明的化合物可以为曼氏血吸虫感染提供安全且有效的治疗,并且通过抑制同源酶,还可以为肝片吸虫、恶性疟原虫和金黄色葡萄球菌感染提供治疗。
[0253]
表2中的数据表明,实施例化合物显示出抗肝片吸虫nej的活性,这与化合物对比化合物(tbz)相似或比化合物对比化合物(tbz)有所改进。
[0254]
表3和表4显示,本发明的许多实施例化合物在对抗金黄色葡萄球菌和mrsa方面也是有效的,因此可以为这些生物体的感染提供有效的治疗。此外,该数据表明,实施例化合物可以有效地消毒表面,例如外科装置或植入物的表面,包括病原细菌,例如金黄色葡萄球菌和mrsa。
[0255]
表1
[0256][0257]
表2
[0258][0259]
*在72h记录的表型和运动性评分以平均评分和标准偏差的形式呈现。
[0260]
**使用克鲁斯卡尔-沃利斯方差分析(随后是dunn’s post-hoc分析测试)对所有治疗条件进行统计评估(与dmso对照相比)。
[0261]
表3
[0262]
下表3中的所有数据点都是以μg/ml为单位的mic90值。
[0263][0264]
表4
[0265]
下表4中的所有数据点都是以mg/l为单位的mic值。
drug resist.2018dec;8(3):559-570中描述的进行。图1显示了分子对接研究结果,该结果支持化合物对蛋白质赖氨酸甲基转移酶(smp_138030)作用的假设机制。smp_138030的表面结构显示组蛋白位于底物结合区(substrate-binding pocket)中(用虚线圆圈突出显示)。化合物1(本发明化合物家族的代表)的结合模式叠加在底物结合区的组蛋白上,为这些化合物的假定作用机制提供支持(a部分)。在b部分中,smp_138030的表面结构被隐藏,以提供天然底物(组蛋白)和底物竞争抑制剂(化合物1)的假定结合模式的更好视图。
[0269]
药物治疗对寄生虫表位的影响
[0270]
图2显示了药物治疗(化合物1的亚致死浓度-0.076μm、化合物8的亚致死浓度和化合物9的亚致死浓度-0.0024μm)对h3k4(组蛋白3,赖氨酸4)甲基化的影响。图2显示化合物处理的蠕虫(雄性和雌性,分别用雄性和雌性符号表示)中h3k4甲基化减少。与阴性对照(dmso)相比,每种受试化合物的总h3k4甲基化显著降低%。然而,在三种处理中,性别(雄性和雌性成虫)之间没有统计学上的显著差异。进行了克鲁斯卡尔-沃利斯方差分析和dunn’s多重比较试验,以将每个群体平均值(三个不同生物重复的平均值)与dmso对照进行比较。*和**分别代表p《0.0163和p《0.0076。这些数据支持这些化合物是蛋白质赖氨酸甲基转移酶抑制剂的假设。
[0271]
rnai介导的smp_138030敲除影响蠕虫运动和血吸虫卵的体外产生
[0272]
图3和图4显示了rnai介导的smp_138030(蛋白质赖氨酸甲基转移酶)敲除如何影响蠕虫运动和血吸虫卵的体外生产。在a部分中,用5μg靶向荧光素酶的sirna双链体(siluc)或靶向smp_138030的sirna双链体(sismp_138030)对7周龄的成年雄性和雌性血吸虫进行电穿孔。48h后,收集总rna,并进行qrt-pcr。与用siluc处理的蠕虫相比,在用sismp_138030处理的蠕虫中检测到smp_138030丰度的60%的敲除(kd)。在b部分中,每种处理的五个蠕虫对(siluc和sismp_138030)在5%的co2的气氛中培养7天,每24h进行一次70%的介质交换。在第7天使用蠕虫分析gp2进行蠕虫运动的量化,其中分数越低,蠕虫运动越低(p《0.001)。c部分显示了sirna处理的蠕虫的每日蠕虫运动(第3天的数据,p《0.01;第4天至第7天的数据;p《0.001)。
[0273]
d部分和e部分(图4)显示了导入sirna后48h和168h的产卵量,48h数据,p《0.01;168h数据,p《0.001。f部分显示rnai介导的smp_138030敲除含有小于9%的h3k4甲基化。在rnai诱导的smp_138030敲除后,对来自rnai靶向蠕虫(sismp_138030)和对照蠕虫(siluc)的总组蛋白提取物进行h3k4甲基化分析。在sismp_138030处理的蠕虫中,发现h3k4甲基化略有下降(9%)。该数据也支持本发明化合物是蛋白质赖氨酸甲基转移酶抑制剂的假设。
[0274]
对肝片吸虫新脱囊幼虫(nej)的活性
[0275]
图5显示了两种选择的化合物对肝片吸虫新脱囊幼虫(nej)的活性。将肝片吸虫nej(每孔25个)与浓度为10μm的三种化合物(在0.1%dmso中)一起培养,并在含5%co2的气氛中于37℃培养72h。对照孔(每孔25nej)包括含有0.1%dmso(溶剂)和rmpi(培养基)的孔作为阴性对照,或含有10μm三氯苯达唑(0.1%dmso)的孔作为阳性对照,标记为“tbz”(对比化合物3)。72h后,对所有nej进行表型和运动性评分。对于每种治疗,基于个体寄生虫评分(跨越两个独立的重复)计算表型和活动性评分的平均值,其中较高的评分表示较低的蠕虫活性。条形图上报告了sd。
[0276]
在其它感染因子中鉴定推定的smp_138030同系物
[0277]
这些化合物的推定靶标的蛋白质序列(smp_138030)被用作蛋白质blast(blastp)搜索的查询,对照来自ncbi(https://blast.ncbi.nlm.nih.gov/blast.cgi)和wormbase parasite(wormbase-parasite-a comprehensive resource for helminth genomics.howe kl,bolt bj,shafie m,kersey p and berriman,m.mol biochem parasitol.2017jul;215:2-10)中不同物种基因组的预测蛋白质数据库,使用默认设置,除了使用较低阈值和blosum45作为评分矩阵的金黄色葡萄球菌。
[0278]
表5显示了在肝片吸虫、日本血吸虫、埃及血吸虫(s.haematobium)、柏氏鼠疟原虫(p.berghei)、恶性疟原虫、柔嫩艾美球虫(eimeria tenella)、犬恶丝虫(dirofilaria immitis)、捻转血茅线虫(haemonchus contortus)、多房棘球绦虫(echinococcus multilocularis)和金黄色葡萄球菌中同源smp_130830蛋白的鉴定。表5中的数据显示了曼氏血吸虫的smp_130830蛋白序列与其中所列的肝片吸虫、柔嫩艾美球虫、犬恶丝虫、捻转血茅线虫、多房棘球绦虫和疟原虫的蛋白赖氨酸甲基转移酶的紧密相似性,以及与金黄色葡萄球菌的prma蛋白序列的合理相似性。该数据表明,由于表5中鉴定的同源蛋白的抑制活性,被认为是smp_138030酶抑制剂的本发明化合物也可以有效地对抗肝片吸虫、日本血吸虫、埃及血吸虫、柏氏鼠疟原虫、恶性疟原虫、柔嫩艾美球虫、犬恶丝虫、捻转血茅线虫、多房棘球绦虫和金黄色葡萄球。
[0279]
表5
[0280][0281]
*ncbi blastp
[0282]
**wormbase parasite blastp
[0283]
adme数据
[0284]
表6显示了化合物4、9、11、12和18与所列已知对照化合物相比的adme数据。该数据是使用cyprotex(https://www.cyprotex.com/admepk)描述的方法获得的,进行这些分析的cro。
[0285]
这一数据表明,大多数被测试的化合物与血浆蛋白成分有很强的结合。此外,大多
数受试化合物的代谢稳定性(在小鼠肝微粒体中)被归类为中等(9至48μl/min/mg蛋白质)。最终,大多数化合物是部分可溶的(在1μm和100μm之间)。
[0286]
表6
[0287][0288]
nd-无法确定
[0289]
*三次重复中有一次检测到化合物
[0290]
na-不适用
[0291]
se-标准误差
[0292]
sd-标准偏差
[0293]
clint-内在性清除率
[0294]
**物种=小鼠,底物浓度为1μm
[0295]
fu-血浆中未结合药物的比例
[0296]
小鼠药代动力学
[0297]
化合物1、7、12、4、9、11和18的配方如下:0.25mg/ml,在10%dmso、20%聚氧乙烯蓖麻油el(cremophor el)、70%水(澄清溶液)。根据无锡(https://www.wuxiapptec.com;进行这些研究的cro)所采用的方案,口服施用2.5mg/kg标称剂量的盒式制剂(5种化合物/组)后,测定非房室小鼠药代动力学(雄性c57/bl6小鼠,禁食;每组3只小鼠)。
[0298]
结果如下表7所示。
[0299]
表7
[0300][0301]
表7中的结果显示了这些化合物的相似血浆分布,因为在给药后约3-4小时(t
max
)观察到每种化合物的最大血浆浓度(例如,每种化合物在血流中快速出现)。最有趣的是,与其它化合物(1、7和12)相比,服用单一剂量的化合物4、9和11的小鼠表现出更高的c
max
和auc
0-last
。总的来说,所有化合物在给药后几小时内有效,因为观察到的t
last
(当可检测到时)是给药后8小时。
[0302]
抗血吸虫体内药效筛选
[0303]
图6a和6b分别显示了使用前述抗血吸虫体内药效方法获得的化合物4的体内蠕虫负荷和卵计数结果。使用的载体是10%dmso、20%聚氧乙烯蓖麻油el和70%水。使用100mg/kg口服剂量的化合物4。在第1天和第3天施用两次剂量-100mg/kg。图6a和6b的图表显示,与载体相比,化合物4分别诱导体内蠕虫负担和卵数减少35.5%和39.9%。
[0304]
这些结果表明化合物4在实验性血吸虫病的鼠模型中部分减少了蠕虫和卵的负担。
[0305]
总之,本发明提供了用于治疗感染病原生物的患者的式(i)的化合物或其药学上可接受的盐或溶剂化物;
[0306][0307]
其中x和y各自独立地选自c、n、o和s,条件是x和y中的至少一者是n、o或s;其中r1和r2各自独立地选自可选地取代的c
1-c8烷基、c
1-c8烯基、芳基、杂芳基或烷基芳基基团;并且其中z选自h、-cn、-no2、-nr3r4、-nr5(co)r6、c
1-c4烷基、c
1-c4烷氧基、-(co)wr
12
、羟基、氨基、硫醇、氯、氟、cf3、chf2或ch2f基团。该化合物可有效治疗感染了寄生虫的患者,所述寄生虫选自血吸虫、肝片吸虫或疟原虫寄生虫。此外或可选地,式(i)的化合物可有效治疗感染选自金黄色葡萄球菌和mrsa的病原细菌的患者。
[0308]
除非在特定情况下另有限制,否则以下定义适用于本说明书中使用的术语。
[0309]
如本文所用,术语“烷基”是指直链和支链饱和烃基基团。烷基基团的例子包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基和仲丁基基团。此外,术语烷基包括环状烃基,例如环丙基、环丁基、环戊基、环己基基团等。
[0310]
如本文所用,术语“芳基”是指含有一个、两个或三个环的碳环芳族体系,其中这些环可以以悬垂方式连接在一起或可以稠合在一起。术语“芳基”包括芳族自由基,例如苄基、苯基、萘基、蒽基、菲基、茚满基、茚基、环烯基(annulenyl)、薁基(azulenyl)、四氢萘基和联苯基。
[0311]
如本文所用,术语“杂芳基”是指3至7元,优选5至7元的不饱和杂单环或稠合多环,其中至少一个稠合环是不饱和的,其中至少一个原子选自由o、s和n组成的组。该术语还包括稠合多环基团,其中杂环自由基与芳基自由基稠合,其中杂芳基自由基与其它杂芳基自由基稠合,或其中杂芳基自由基与环烷基自由基稠合。杂芳基基团的例子包括吡咯基、吡咯啉基、咪唑基、吡唑基、吡啶基、嘧啶基、吡嗪基、哒嗪基、三唑基、吡喃基、呋喃基、噻吩基、噁唑基、异噁唑基、噁二唑基、噻唑基、噻二唑基、异噻唑基、吲哚基、异吲哚基、吲嗪基(indolizinyl)、苯并咪唑基、喹啉基、异喹啉基、喹喔啉基、喹唑啉基、吲唑基、苯并三唑基、苯并二氧杂环戊烯基、苯并吡喃基、苯并噁唑基、苯并噁二唑基、苯并噻唑基、苯并噻二唑基、苯并呋喃基、苯并噻吩基、色酮基(chromonyl)、香豆素基(coumarinyl)、苯并吡喃基、四氢喹啉基(tetrahydroquinolinyl)、四唑并哒嗪基、四氢异喹啉基(tetrahydroisoquinolinyl)、噻吩并吡啶基、呋喃吡啶基、吡咯并吡啶基等。示例性的三环杂环基团包括咔唑基、苯并哚基(benzidolyl)、菲咯啉基(phenanthrolinyl)、二苯并呋喃基、吖啶基、菲啶基、呫吨基等。
[0312]
如本文所用,术语“环烷基”是指环状饱和烃基基团。环烷基的例子包括环丙基、环丁基、环戊基和环己基。
[0313]
如本文所用,术语“卤素”(halogen)或“卤素”(halo)是指氟、氯、溴或碘。氟和氯是特别优选的。
[0314]“药学上可接受的盐”是指例如在关于盐形成的标准文本中描述的那些盐,参见例如:p.stahl,et a/.,handbook of pharmaceutical salts:properties,selection and use(vcha/wney-vch,2002),或s.m.berge,et al.,"pharmaceutical salts"(1977)
journal of pharmaceutical sciences,66,1-19。根据本发明,适宜的盐包括那些用有机或无机酸或碱形成的盐。特别地,根据本发明,采用酸形成的适宜的盐包括用无机酸、强有机羧酸(例如未取代的或被如卤素取代的1-4个碳原子的链烷羧酸,如饱和或不饱和二羧酸,如羟基羧酸,如氨基酸),或用有机磺酸(如未取代或被例如卤素取代的c
1-c4烷基磺酸或芳基磺酸)形成的盐。药学上可接受的酸加成盐包括由盐酸、氢溴酸、硫酸、硝酸、柠檬酸、酒石酸、乙酸、磷酸、乳酸、丙酮酸、乙酸、三氟乙酸、琥珀酸、高氯酸、富马酸、马来酸、乙醇酸、乳酸、水杨酸、草酰乙酸、甲磺酸、乙磺酸、对甲苯磺酸、甲酸、苯甲酸、丙二酸、萘-2-磺酸、苯磺酸、羟乙基磺酸、抗坏血酸、苹果酸、邻苯二甲酸、天冬氨酸和谷氨酸、赖氨酸和精氨酸形成的那些。本身可能是或可能不是药学上可接受的其它酸可用作获得本发明化合物及其药学上可接受的酸加成盐的中间体。
[0315]
药学上可接受的碱盐包括铵盐、碱金属盐(例如钾盐和钠盐)、碱土金属盐(例如钙盐和镁盐),以及有机碱的盐,例如二环己胺、n-甲基-d-葡糖胺、吗啉、硫代吗啉、哌啶、吡咯烷、单-、二-或三-低级烷基胺(例如乙基-丙基胺、叔丁基-丙基胺、二乙基-丙基胺、二异丙基-丙基胺、三乙基-丙基胺、三丁基-丙基胺或二甲基-丙基胺),或单-、二-或三羟基低级烷基胺(例如单-、二-或三乙醇胺)。还可以形成相应的内盐。
[0316]“药学上可接受的溶剂化物”是指包含本发明化合物和一种或多种药学上可接受的溶剂分子(例如水或乙醇)的分子复合物。有机化学领域的技术人员将会理解,许多有机化合物可以与溶剂形成复合物,它们在该溶剂中反应或从该溶剂中沉淀或结晶。这些复合物被称为“溶剂化物”。例如,与水的复合物被称为“水合物”。当药物材料在晶格中以化学计量或非化学计量的量掺入溶剂如水时,就存在溶剂化物,如水合物。对药物材料进行常规水合物筛选,因为水合物可能在药物制造过程的任何阶段或在药物材料储存或剂型储存时出现。溶剂化物描述于s.byrn et al.,pharmaceutical research,1995.12(7):p.954-954,和water-insoluble drug formulation,2nd ed.r.liu,crc press,page 553,这些文献通过引用并入本文。
[0317]“疗法(therapy)”、“治疗(treatment)”和“治疗(treating)”包括对病症、疾病或障碍的预防性和治疗性治疗。它还包括减缓、中断、控制或停止病症、疾病或障碍的进展。它还包括预防、治疗、减缓、中断、控制或停止病症、疾病或障碍的症状。
[0318]
尽管已经示出和描述了几个优选实施方案,但是本领域技术人员将会理解,在不脱离如所附权利要求中限定的本发明的范围的情况下,可以进行各种改变和修改。
[0319]
在整个说明书中,术语“包括(comprising)”或“包括(comprise)”是指包括指定的组分,但不排除其它组分的存在。术语“基本上由
…
组成(consisting essentially of)”或“基本上由
…
组成(consists essentially of)”是指包括指定的组分,但不包括其它组分,除了作为杂质存在的材料、作为用于提供组分的方法的结果而存在的不可避免的材料以及为了实现本发明的技术效果以外的目的而添加的组分。通常地,当提及组合物时,基本上由一组组分组成的组合物将包含小于5wt%,通常地小于3wt%,更通常地小于1wt%的非指定组分。
[0320]
术语“由
…
组成(consisting of)”或“由
…
组成(consists of)”是指包括指定的成分,但不包括其它成分的添加。
[0321]
在适当的时候,根据上下文,术语“包括(comprise)”或“包括(comprising)”的使
用也可以被认为包含或包括“基本上由
…
组成(consists essentially of)”或“基本上由
…
组成(consisting essentially of)”的意思,并且也可以被认为包括“由
…
组成(consists of)”或“由
…
组成(consisting of)”的意思。
[0322]
为了避免疑问,其中组合物中组分的含量以wt%描述,这指特定组分相对于所涉及的整个组合物的重量百分比。
[0323]
在适当的情况下,本文阐述的可选特征可以单独使用或者彼此组合使用,特别是在所附权利要求中阐述的组合中。在适当的情况下,本文阐述的本发明的每个方面或示例性实施方案的可选特征也应理解为适用于本发明的任何其它方面或示例性实施方案。换句话说,阅读本说明书的技术人员应该认为本发明的每个示例性实施方案的可选特征在不同的示例性实施方案之间是可互换和可组合的。
[0324]
注意与本技术相关的本说明书同时或之前提交的所有文件和文献,这些文件和文献与本说明书一起公开供公众查阅,所有这些文件和文献的内容通过引用并入本文。
[0325]
本说明书(包括任何所附权利要求和附图)中公开的所有特征和/或如公开的任何方法或工艺的所有步骤可以以任何组合进行组合,除了至少一些这种特征和/或步骤相互排斥的组合之外。
[0326]
除非另外明确说明,否则本说明书(包括任何所附权利要求和附图)中公开的每个特征可以由用于相同、等同或类似目的的替代特征来代替。因此,除非明确声明,否则所公开的每个特征仅仅是一系列等同或相似特征的一个例子。
[0327]
本发明不限于前述实施方案的细节。本发明扩展到本说明书(包括任何所附权利要求和附图)中公开的特征的任何新颖的一种或任何新颖的组合,或者扩展到如公开的任何方法或工艺的步骤的任何新颖的一种或任何新颖的组合。
相关技术
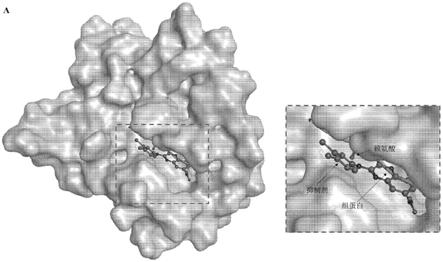
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1