含氟嘧啶化合物及其制造方法与流程
1.本发明涉及含氟嘧啶化合物及其制造方法。
背景技术:
2.一直以来,报告了含氟嘧啶化合物具有各种生物活性。其中,对于在嘧啶环的第2位上具有呋喃环结构的化合物,有望在医药/农药领域中使用。
3.更具体而言,在非专利文献1中报告了具有2-(2-呋喃基)-嘧啶结构的化合物具有抗菌活性,在非专利文献2中报告了具有2-(2-呋喃基)-嘧啶结构的化合物对心力衰竭、肾功能衰竭的治疗有效。另外,在非专利文献3中报告了具有2-(2-呋喃基)-嘧啶结构的化合物对抑制急性骨髓性白血病的发展和抑制肿瘤的转移是有效的,在非专利文献4中报告了具有2-(2-呋喃基)-嘧啶结构的化合物具有抗肿瘤活性。
4.在非专利文献5和6以及专利文献1中报告了具有2-(3-呋喃基)-嘧啶结构的化合物具有抗肿瘤活性,在专利文献2中报告了具有2-(3-呋喃基)-嘧啶结构的化合物对治疗胰腺炎有效。
5.一直以来,研究了在嘧啶环的第5位上具有三氟甲基、第4位和第6位上具有取代基的嘧啶化合物的合成法。更具体而言,在非专利文献7中报告了使用三氟碘甲烷的合成法,在非专利文献8中报告了使用三氟乙酸的合成法,在非专利文献9中报告了使用5-(三氟甲基)二苯并噻吩鎓盐(梅本试剂)的合成法。另外,在非专利文献10中报告了使用三氟甲磺酸衍生物的合成法,在专利文献3中报告了使用三氟甲烷亚磺酸钠(langlois试剂)的合成法,在专利文献4中报告了使用(三氟甲基)三甲基硅烷(ruppert试剂)的合成法。
6.在先技术文献
7.专利文献
8.专利文献1:中国专利申请公开第108503623号说明书;
9.专利文献2:中国专利申请公开第108299465号说明书;
10.专利文献3:中国专利申请公开第107286146号说明书;
11.专利文献4:中国专利申请公开第108218793号说明书。
12.非专利文献
13.非专利文献1:journal of heterocyclic chemistry,2019年,56卷,485~492页;
14.非专利文献2:bioorganic&medicinal chemistry letters,2019年,29卷,563~569页;
15.非专利文献3:journal of medicinal chemistry,2018年,61卷,6518~6545页;
16.非专利文献4:bioorganic&medicinal chemistry,2018年,26卷,4234~4239页;
17.非专利文献5:journal of medicinal chemistry,2019年,62卷,1577~1592页;
18.非专利文献6:journal of enzyme inhibition and medicinal chemistry,2018年,33卷,1089~1094页;
19.非专利文献7:chemical communications,2018年,54卷,13662~13665页;
20.非专利文献8:acs catalysis,2018年,8卷,2839~2843页;
21.非专利文献9:organic letters,2018年,20卷,1693~1697页;
22.非专利文献10:nature,2011年,480卷、224~228页。
技术实现要素:
23.发明要解决的问题
24.对于具有2-呋喃基-嘧啶结构的化合物,以其生物活性、结构扩展性的进一步提高为目的,在嘧啶环结构的第4位、第5位及第6位上具有取代基的化合物被看好。
25.但是,以往,从反应性、选择性的方面出发,在第5位上具有含氟取代基、在第2位上具有杂环作为取代基、在第4位和第6位上具有取代基的含氟嘧啶化合物的制造是困难的,没有报告这样的含氟嘧啶化合物。因此,期望确立在第4位、第5位及第6位上具有取代基、在第2位上具有呋喃环结构的含氟嘧啶化合物及其制造方法。
26.本发明人发现,通过使特定的原料反应,能够在嘧啶环上的两个氮原子之间的第2位上导入呋喃环结构,从而完成了本发明。即,本发明提供以往未知的、在第4位、第5位及第6位上具有取代基、在第2位上具有呋喃环结构作为取代基的新型含氟嘧啶化合物、以及能够简单地制造该含氟嘧啶化合物的制造方法。
27.解决问题的手段
28.本发明的主要结构如下所述。
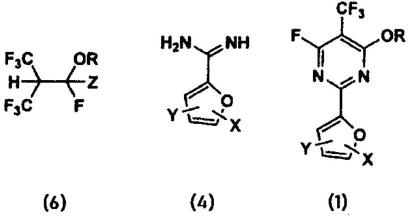
29.[1]一种含氟嘧啶化合物,其由下述通式(1)或(2)表示,
[0030]
[化学式1]
[0031][0032]
在上述通式(1)和(2)中,
[0033]
r表示碳原子数1~12的烃基,
[0034]
x和y分别独立地表示氢原子、卤素原子、碳原子数1~10的烃基、-c
nf2n+1
、硝基、硼酸基、-oa1、-soma1、-na1a2、-cooa1、或-cona1a2,
[0035]
其中,a1、a2分别独立地表示氢原子、或碳原子数1~10的烃基,n为1~10的整数,m为0~3的整数。
[0036]
[2]根据上述[1]所述的含氟嘧啶化合物,其中,
[0037]
所述r为碳原子数1~10的烷基。
[0038]
[3]一种含氟嘧啶化合物的制造方法,包括以下工序:
[0039]
(a)通过使下述通式(3)所示的氟异丁烯衍生物与下述通式(4)所示的化合物或其盐反应,得到下述通式(1)所示的含氟嘧啶化合物;或者
[0040]
[化学式2]
[0041][0042]
(b)通过使下述通式(3)所示的氟异丁烯衍生物与下述通式(5)所示的化合物或其盐反应,得到下述通式(2)所示的含氟嘧啶化合物,
[0043]
[化学式3]
[0044][0045]
在上述通式(1)~(5)中,
[0046]
r表示碳原子数1~12的烃基,
[0047]
x和y分别独立地表示氢原子、卤素原子、碳原子数1~10的烃基、-c
nf2n+1
、硝基、硼酸基、-oa1、-soma1、-na1a2、-cooa1、或-cona1a2,
[0048]
其中,a1、a2分别独立地表示氢原子、或碳原子数1~10的烃基,n为1~10的整数,m为0~3的整数。
[0049]
[4]一种含氟嘧啶化合物的制造方法,包括以下工序:
[0050]
(c)通过使下述通式(6)所示的氟异丁烷衍生物与下述通式(4)所示的化合物或其盐反应,得到下述通式(1)所示的含氟嘧啶化合物;或者
[0051]
[化学式4]
[0052][0053]
(d)通过使下述通式(6)所示的氟异丁烷衍生物与下述通式(5)所示的化合物或其盐反应,得到下述通式(2)所示的含氟嘧啶化合物,
[0054]
[化学式5]
[0055][0056]
在上述通式(1)~(2)和(4)~(6)中,
[0057]
r表示碳原子数1~12的烃基,
[0058]
x和y分别独立地表示氢原子、卤素原子、碳原子数1~10的烃基、-c
nf2n+1
、硝基、硼酸基、-oa1、-soma1、-na1a2、-cooa1、或-cona1a2,z表示卤素原子、-oa1、-soma1、或-na1a2,
[0059]
其中,a1、a2分别独立地表示氢原子、或碳原子数1~10的烃基,n为1~10的整数,m为0~3的整数。
[0060]
[5]根据上述[3]或[4]所述的含氟嘧啶化合物的制造方法,其中,
[0061]
所述r为碳原子数1~10的烷基。
[0062]
发明效果
[0063]
本发明能够提供在第4位、第5位及第6位上具有取代基、在第2位上具有呋喃环结构作为取代基的新型含氟嘧啶化合物、以及能够简单地制造该含氟嘧啶化合物的制造方法。
具体实施方式
[0064]
(含氟嘧啶化合物)
[0065]
一个实施方式的含氟嘧啶化合物由下述通式(1)或(2)表示。
[0066]
[化学式6]
[0067][0068]
在上述通式(1)和(2)中,r表示碳原子数1~12的烃基,x和y分别独立地表示氢原子、卤素原子、碳原子数1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、硼酸基、-oa1、-soma1(m为0~3的整数)、-na1a2、-cooa1、或-cona1a2,a1、a2分别独立地表示氢原子、或碳原子数1~10的烃基。在一个实施方式的含氟嘧啶化合物中,在嘧啶环的第2位上,作为取代基可以存在单环的呋喃基,也可以存在一部分包含呋喃环的缩合杂环基。
[0069]
r只要是碳原子数为1~12的由碳原子和氢原子构成的烃基,就没有特别限定,可以列举出链状烃基、芳香族烃基、脂环式烃基等。链状烃基只要总碳原子数为1~12就没有特别限定,可以为支链的链状烃基,也可以为未支链的链状烃基。芳香族烃基只要总碳原子数为5~12就没有特别限定,可以为具有取代基的芳香族烃基,也可以为不具有取代基的芳香族烃基。另外,芳香族烃基可以具有缩合多环结构。脂环式烃基只要总碳原子数为3~12
就没有特别限定,可以为具有取代基的脂环式烃基,也可以为不具有取代基的脂环式烃基。另外,脂环式烃基可以具有桥环结构。
[0070]
作为链状烃基,可列举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基等烷基;
[0071]
乙烯基、丙烯基、丁烯基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基、十一烯基、十二烯基等烯基;
[0072]
乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基、辛炔基、壬炔基、癸炔基、十一炔基、十二炔基等炔基等。
[0073]
作为芳香族烃基,可列举出苯基、萘基。
[0074]
作为脂环式烃基,可列举出饱和或不饱和的环状的烃基,作为环状的烃基的例子,可列举出环丙基、环丁基、环己基、环戊基、金刚烷基、降冰片基等。
[0075]
优选r为碳原子数1~10的烷基。通过r为碳原子数1~10的烷基,可以容易地制备含氟嘧啶化合物的原料、即通式(3)的氟异丁烯衍生物和通式(6)的氟异丁烷衍生物。
[0076]
作为x、y的卤素原子,可列举出f、cl、br、i。x、y的-oa1、-soma1(m为0~3的整数)中包含的a1表示氢原子、或碳原子数1~10的烃基。x、y的-na1a2中包含的a1、a2分别独立地表示氢原子、或碳原子数1~10的烃基。在a1、a2表示碳原子数1~10的烃基的情况下,例如,上述r可以是碳原子数为1~10的烃基。更具体而言,-soma1可以为甲烷磺酰基。
[0077]
x、y的-cooa1中包含的a1为氢原子、或碳原子数1~10的烃基,例如,上述r可以是碳原子数为1~10的烃基。更具体而言,-cooa1可以为甲氧羰基。
[0078]
x、y的-cona1a2中包含的a1、a2分别独立地表示氢原子、或碳原子数1~10的烃基。在a1、a2表示碳原子数1~10的烃基的情况下,例如,上述r可以是碳原子数为1~10的烃基。x和y优选为氢原子。
[0079]
在上述通式(1)和(2)中,在呋喃环结构上作为取代基存在的x、y相邻的情况下,x和y可以相互键合并与它们所键合的碳原子一起形成环。在x与y键合并形成环的情况下,可列举出在嘧啶环上的第2位上存在含有氧原子的缩合杂环基作为取代基的含氟嘧啶化合物。这种情况下,作为存在于嘧啶环上的第2位的取代基,可列举出苯并呋喃基。一个实施方式的含氟嘧啶化合物在嘧啶环的第2位上具有特定的取代基(呋喃基或一部分包含呋喃环的缩合杂环基)、在嘧啶环的第4位、第5位及第6位上具有特定的取代基(-or、-cf3、-f),因此从结构扩展性的观点考虑,可具有优异的效果。特别是能够期待所希望的生物活性(例如,激素、酶的阻碍活性、杀菌活性、杀虫活性、除草活性)。位于嘧啶环的第2位上的呋喃环结构作为2-呋喃基、3-呋喃基、或一部分包含呋喃环的缩合杂环基而存在,该呋喃环结构还可以具有取代基,也可以不具有取代基。通过呋喃环结构具有取代基,能够对一个实施方式的含氟嘧啶化合物赋予进一步的特性。另外,嘧啶环的第4位和第6位上的取代基为不同的基团(-or和-f),因此能够容易地对非对称的结构进行衍生化,也能够期待作为中间体的使用。更具体而言,可以通过在酸性条件下使含氟嘧啶化合物反应来修饰-or而得到衍生物。另外,通过在碱性条件下使含氟嘧啶化合物反应,能够对-f进行修饰而得到衍生物。一个实施方式的含氟嘧啶化合物例如在有机半导体、液晶等电子材料领域中是有用的。
[0080]
(含氟嘧啶化合物的制造方法)
[0081]
一个实施方式的含氟嘧啶化合物的制造方法包括以下工序:
[0082]
(a)通过使下述通式(3)所示的氟异丁烯衍生物与下述通式(4)所示的化合物或其盐反应,得到下述通式(1)所示的含氟嘧啶化合物;或者
[0083]
[化学式7]
[0084][0085]
(b)通过使下述通式(3)所示的氟异丁烯衍生物与下述通式(5)所示的化合物或其盐反应,得到下述通式(2)所示的含氟嘧啶化合物,
[0086]
[化学式8]
[0087][0088]
在上述通式(1)~(5)中,r表示碳原子数1~12的烃基,x和y分别独立地表示氢原子、卤素原子、碳原子数1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、硼酸基、-oa1、-soma1(m为0~3的整数)、-na1a2、-cooa1、或-cona1a2,a1、a2分别独立地表示氢原子、或碳原子数1~10的烃基。
[0089]
上述通式(1)~(3)中的r优选表示碳原子数1~10的烷基。另外,在工序(a)和(b)的通式(1)、(2)、(4)和(5)中,如上所述,在x和y相邻的情况下,x和y可以相互键合并与它们所键合的碳原子一起形成环。
[0090]
通式(3)所示的氟异丁烯衍生物与通式(4)所示的化合物的上述(a)的反应由下述反应式(a)表示。
[0091]
[化学式9]
[0092][0093]
通式(3)所示的氟异丁烯衍生物与通式(5)所示的化合物的上述(b)的反应由下述反应式(b)表示。
[0094]
[化学式10]
[0095][0096]
在上述反应式(a)和(b)中,通式(4)和(5)的化合物可以分别为盐的形态。在盐的形态的情况下,可以列举出如下形态:通式(4)和(5)的化合物的构成脒基的氨基部分(-nh2)和亚氨基部分(=nh)中的至少一个部分被阳离子化而成为(-nh
3+
)和(=nh
2+
),并与抗衡离子形成盐。抗衡离子只要是1价阴离子则没有特别限定,例如可以列举出f-、cl-、br-、i-等卤化物离子。
[0097]
在一个实施方式的含氟嘧啶化合物的制造方法中,例如可以在卤化氢捕获剂的存在下以一步进行上述(a)和(b)的反应。因此,可以简单地得到上述通式(1)和(2)的含氟嘧啶化合物。此外,在上述(a)和(b)的反应中,在氟异丁烯衍生物与通式(4)和(5)的化合物的脒基之间形成环状的嘧啶结构。源自通式(4)和(5)的化合物的呋喃环结构的基团位于该嘧啶结构的第2位。另外,源自氟异丁烯衍生物的-or、cf3、及f分别位于该嘧啶结构的第4位、第5位及第6位。
[0098]
卤化氢捕获剂是具有在上述(a)和(b)的反应式中捕获氟化氢(hf)的功能的物质,所述氟化氢(hf)由源自通式(4)和(5)的化合物中的脒基的氢原子和源自通式(3)的氟异丁烯衍生物的氟原子形成。作为卤化氢捕获剂,可以使用氢氧化钠、氢氧化钾、氢氧化钙、碳酸钠、碳酸钾、氟化钠、氟化钾、吡啶、三乙胺、二异丙基乙胺、二氮杂双环壬烯、二氮杂双环十一碳烯、甲基三氮杂双环碳烯、二氮杂双环辛烷等有机氮衍生物。
[0099]
上述(a)和(b)的反应时的反应温度优选为0~80℃,更优选为5~50℃,进一步优选为10~25℃。上述(a)和(b)的反应时的反应时间优选为8~72小时,更优选为12~48小时,进一步优选为16~36小时。
[0100]
作为在上述(a)和(b)的反应中使用的溶剂,可以列举出四氢呋喃、单甘醇二甲醚、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚、乙腈、二甲基甲酰胺、二甲基乙酰胺、甲基吡咯烷酮、二甲基乙烯脲、四甲基脲、二甲基亚砜、环丁砜等非质子性极性溶剂;或者,水等质子性极性溶剂与二氯甲烷、甲苯、二乙醚等非水溶性溶剂的二相类溶剂等。另外,作为上述(a)和(b)的反应的催化剂,可以使用苄基三乙基氯化铵等季铵卤化物、季鏻卤化物、冠醚类等。
[0101]
其他实施方式的含氟嘧啶化合物的制造方法包括以下工序:
[0102]
(c)通过使下述通式(6)所示的氟异丁烷衍生物与下述通式(4)所示的化合物或其盐反应,得到下述通式(1)所示的含氟嘧啶化合物;或者
[0103]
[化学式11]
[0104][0105]
(d)通过使下述通式(6)所示的氟异丁烷衍生物与下述通式(5)所示的化合物或其盐反应,得到下述通式(2)所示的含氟嘧啶化合物,
[0106]
[化学式12]
[0107][0108]
在上述通式(1)~(2)和(4)~(6)中,r表示碳原子数1~12的烃基,x和y分别独立地表示氢原子、卤素原子、碳原子数1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、硼酸基、-oa1、-soma1(m为0~3的整数)、-na1a2、-cooa1、或-cona1a2,z表示卤素原子、-oa1、-soma1(m为0~3的整数)、或-na1a2,a1、a2分别独立地表示氢原子、或碳原子数1~10的烃基。
[0109]
作为上述工序(c)和(d)的通式(1)~(2)和(4)~(6)的化合物中的a1、a2,具体而言,可以与上述工序(a)和(b)的通式(1)和(2)的化合物中的a1、a2相同。
[0110]
上述通式(1)、(2)及(6)中的r优选表示碳原子数1~10的烷基。另外,在工序(c)和(d)的通式(1)、(2)、(4)和(5)中,如上所述,在x和y相邻的情况下,x和y可以相互键合并与它们所键合的碳原子一起形成环。
[0111]
通式(6)所示的氟异丁烷衍生物与通式(4)所示的化合物的上述(c)的反应由下述反应式(c)表示。
[0112]
[化学式13]
[0113][0114]
通式(6)所表示的氟异丁烷衍生物与通式(5)所表示的化合物的上述(d)的反应由下述反应式(d)表示。
[0115]
[化学式14]
[0116][0117]
在上述反应式(c)~(d)中,通式(4)和(5)的化合物可以分别为盐的形态。在盐的形态的情况下,可以列举出如下形态:通式(4)和(5)的化合物的构成脒基的氨基部分(-nh2)和亚氨基部分(=nh)中的至少一个部分被阳离子化而成为(-nh
3+
)和(=nh
2+
),并与抗衡离子形成盐。抗衡离子只要是1价阴离子则没有特别限定,例如可以列举出f-、cl-、br-、i-等卤化物离子。
[0118]
在其他实施方式的含氟嘧啶化合物的制造方法中,例如,能够以一步进行上述(c)和(d)的反应。因此,可以简单地得到上述通式(1)和(2)的含氟嘧啶化合物。此外,在上述(c)和(d)的反应中,在氟异丁烷衍生物与通式(4)和(5)的化合物的脒基之间形成环状的嘧啶结构。源自通式(4)和(5)的化合物的呋喃环结构的基团位于该嘧啶结构的第2位。另外,源自氟异丁烷衍生物的-or、cf3、及f分别位于该嘧啶结构的第4位、第5位及第6位。
[0119]
上述(c)和(d)的反应时的反应温度优选为0~80℃,更优选为5~50℃,进一步优选为10~25℃。上述(c)和(d)的反应时的反应时间优选为8~72小时,更优选为12~48小时,进一步优选为16~36小时。在上述(c)和(d)的反应中,可以使用与上述(a)和(b)同样的卤化氢捕获剂。
[0120]
作为在上述(c)和(d)的反应中使用的溶剂,可以列举出四氢呋喃、单甘醇二甲醚、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚、乙腈、二甲基甲酰胺、二甲基乙酰胺、甲基吡咯烷酮、二甲基乙烯脲、四甲基脲、二甲基亚砜、环丁砜等非质子性极性溶剂;或者,水等质子性极性溶剂与二氯甲烷、甲苯、二乙醚等非水溶性溶剂的二相类溶剂等。另外,作为上述(c)和(d)的反应的催化剂,可以使用苄基三乙基氯化铵等季铵卤化物、季鏻卤化物、冠醚类等。
[0121]
以上,对本发明的实施方式进行了说明,但本发明并不限定于上述实施方式,包含本发明的概念以及权利要求书所包含的所有方式,能够在本发明的范围内进行各种改变。
[0122]
实施例
[0123]
接着,为了进一步明确本发明的效果,对实施例进行说明,但本发明并不限定于这些实施例。
[0124]
(实施例1)
[0125]
6-氟-4-甲氧基-2-(2-呋喃基)-5-三氟甲基嘧啶的制造
[0126]
在冰水冷却下,向75g的二氯甲烷、75g的水中加入25g(0.15mol)的2-脒基呋喃盐酸盐、25g(0.12mol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯。接着,以内温不超过10℃的方式滴加120ml(0.60mol)的5n氢氧化钠水溶液(卤化氢捕获剂),并升温至室温。搅拌约16小时后,分离有机相。减压蒸馏除去有机相二氯甲烷后,进行溶解于乙酸乙酯的溶液的柱纯化,得到由下述式(e)表示的目标物(6-氟-4-甲氧基-2-(2-呋喃基)-5-三氟甲基嘧啶)4.6g。6-氟-4-甲氧基-2-(2-呋喃基)-5-三氟甲基嘧啶的分离产率为14%。
[0127]
[化学式15]
[0128][0129]
得到的目标物的分析结果如下所述。
[0130]
质谱(apcl,m/z):262([m]
+
);
[0131]1h-nmr(300mhz,cdcl3)δppm:7.68(s,1h),7.45(d,1h),7.26(s,1h),4.20(s,3h)
19
f-nmr(300mhz、c6f6)δppm:-58.44(d,3f),-61.22(dd,1f)。
[0132]
(实施例2)
[0133]
6-氟-4-甲氧基-2-(3-呋喃基)-5-三氟甲基嘧啶的制造
[0134]
在冰水冷却下,向75g的二氯甲烷、75g的水中加入10g(61mmol)的3-脒基呋喃盐酸盐、11g(55mmol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯。接着,以内温不超过10℃的方式滴加48ml(0.24mol)的5n氢氧化钠水溶液(卤化氢捕获剂),并升温至室温。搅拌约16小时后,分离有机相。减压蒸馏除去有机相二氯甲烷后,进行溶解于乙酸乙酯的溶液的柱纯化,得到由下述式(f)表示的目标物(6-氟-4-甲氧基-2-(3-呋喃基)-5-三氟甲基嘧啶)2.0g。6-氟-4-甲氧基-2-(3-呋喃基)-5-三氟甲基嘧啶的分离产率为14%。
[0135]
[化学式16]
[0136][0137]
得到的目标物的分析结果如下所述。
[0138]
质谱(apcl,m/z):262([m]
+
);
[0139]1h-nmr(300mhz,cdcl3)δppm:8.29(s,1h),7.50(s,1h),7.01(d,1h),4.17(s,3h)
19
f-nmr(300mhz,c6f6)δppm:-58.43(d,3f),-62.14(dd,1f)。
[0140]
(实施例3)
[0141]
代替实施例1的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯而使用了1,1,1,3,3-五氟-3-甲氧基-2-三氟甲基-丙烷的6-氟-4-甲氧基-2-(2-呋喃基)-5-三氟甲基嘧啶的制造
[0142]
在冰水冷却下,向75g的二氯甲烷、75g的水中加入25g(0.15mol)的2-脒基呋喃盐酸盐、28g(0.12mol)的1,1,1,3,3-五氟-3-甲氧基-2-三氟甲基-丙烷。接着,以内温不超过10℃的方式滴加150ml(0.75mol)的5n氢氧化钠水溶液(卤化氢捕获剂),并升温至室温。搅拌约16小时后,分离有机相。减压蒸馏除去有机相二氯甲烷后,进行溶解于乙酸乙酯的溶液的柱纯化。得到的化合物的分析结果与实施例1的生成物相同。
[0143]
(实施例4)
[0144]
代替实施例2的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯而使用了1,1,1,3,3-五氟-3-甲氧基-2-三氟甲基-丙烷的6-氟-4-甲氧基-2-(3-呋喃基)-5-三氟甲基嘧啶的制造
[0145]
在冰水冷却下,向75g的二氯甲烷、75g的水中加入10g(61mmol)的3-脒基呋喃盐酸盐、13g(55mmol)的1,1,1,3,3-五氟-3-甲氧基-2-三氟甲基-丙烷。接着,以内温不超过10℃的方式滴加62ml(0.31mol)的5n氢氧化钠水溶液(卤化氢捕获剂),并升温至室温。搅拌约16小时后,分离有机相。减压蒸馏除去有机相二氯甲烷后,进行溶解于乙酸乙酯的溶液的柱纯化。得到的化合物的分析结果与实施例2的生成物相同。
[0146]
(实施例5)
[0147]
6-氟-4-甲氧基-2-(5-氯-2-呋喃基)-5-三氟甲基嘧啶的制造
[0148]
将0.7g(3.8mmol)的5-氯呋喃-2-羧基酰亚胺酰胺盐酸盐溶解于38ml的乙腈而制备乙腈溶液。在该乙腈溶液中加入0.9g(4.2mmol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯和2.6g(20.1mmol)的n,n-二异丙基乙胺,在室温下搅拌16.5小时,根据下述式(g)所示的式,从5-氯呋喃-2-羧基酰亚胺酰胺盐酸盐得到6-氟-4-甲氧基-2-(5-氯-2-呋喃基)-5-三氟甲基嘧啶。然后,对反应后的液体进行柱纯化,得到0.8g(2.7mmol)的目标物(6-氟-4-甲氧基-2-(5-氯-2-呋喃基)-5-三氟甲基嘧啶)。6-氟-4-甲氧基-2-(5-氯-2-呋喃基)-5-三氟甲基嘧啶的分离产率为72.1%。
[0149]
[化学式17]
[0150][0151]
得到的目标物的分析结果如下所述。
[0152]
质谱(apcims,m/z):296.0[m+h]
+
;
[0153]1h-nmr(400mhz,cdcl3)δ7.42(d,j=3.7hz,1h),6.41(d,j=3.4hz,1h),4.19(s,3h)。
[0154]
(实施例6)
[0155]
6-氟-4-甲氧基-2-(5-溴-2-呋喃基)-5-三氟甲基嘧啶的制造
[0156]
将0.6g(2.7mmol)的5-溴呋喃-2-羧基酰亚胺酰胺盐酸盐溶解于27ml的乙腈中,制备乙腈溶液。在该乙腈溶液中加入0.7g(3.3mmol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯和1.8g(13.9mmol)的n,n-二异丙基乙胺,在室温下搅拌20.7小时,根据下述式(h)所示的式,从5-溴呋喃-2-羧基酰亚胺酰胺盐酸盐得到6-氟-4-甲氧基-2-(5-溴-2-呋喃基)-5-三氟甲基嘧啶。然后,对反应后的液体进行柱纯化,得到0.7g(2.0mmol)的目标物(6-氟-4-甲氧基-2-(5-溴-2-呋喃基)-5-三氟甲基嘧啶)。6-氟-4-甲氧基-2-(5-溴-2-呋喃基)-5-三氟甲基嘧啶的分离产率为75.3%。
[0157]
[化学式18]
[0158][0159]
得到的目标物的分析结果如下所述。
[0160]
质谱(apcims,m/z):339.9[m+h];
[0161]1h-nmr(400mhz,cdcl3)δ7.39(d,j=3.4hz,1h),6.55(d,j=3.7hz,1h),4.19(s,3h)。
[0162]
(实施例7)
[0163]
6-氟-4-甲氧基-2-(2-甲基-3-呋喃基)-5-三氟甲基嘧啶的制造
[0164]
将0.3g(1.8mmol)的2-甲基呋喃-3-羧基酰亚胺酰胺盐酸盐溶解于18ml的乙腈中,制备乙腈溶液。在该乙腈溶液中加入0.4g(1.9mmol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯和1.2g(9.3mmol)的n,n-二异丙基乙胺,在室温下搅拌23.7小时,根据下述式(i)所示的式,从2-甲基呋喃-3-羧基酰亚胺酰胺盐酸盐得到6-氟-4-甲氧基-2-(2-甲基-3-呋喃基)-5-三氟甲基嘧啶。然后,对反应后的液体进行柱纯化,得到0.02g(0.05mmol)的目标物(6-氟-4-甲氧基-2-(2-甲基-3-呋喃基)-5-三氟甲基嘧啶)。6-氟-4-甲氧基-2-(2-甲基-3-呋喃基)-5-三氟甲基嘧啶的分离产率为3.0%。
[0165]
[化学式19]
[0166][0167]
得到的目标物的分析结果如下所述。
[0168]
质谱(apcims,m/z):277.0[m+h]
+
;
[0169]1h-nmr(400mhz,cdcl3)δ7.32(d,j=2.1hz,1h),6.97(d,j=4.1hz,1h),4.16(s,3h),2.77(s,3h)。
[0170]
(实施例8)
[0171]
6-氟-4-甲氧基-2-(5-硝基-2-呋喃基)-5-三氟甲基嘧啶的制备
[0172]
将0.6g(3.2mmol)的5-硝基呋喃-2-羧基酰亚胺酰胺盐酸盐溶解于34ml的乙腈中,制备乙腈溶液。在该乙腈溶液中加入0.8g(3.8mmol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯和2.3g(17.8mmol)的n,n-二异丙基乙胺,在室温下搅拌23.8小时,根据下述式(j)所示的式,从5-硝基呋喃-2-羧基酰亚胺酰胺盐酸盐得到6-氟-4-甲氧基-2-(5-硝基-2-呋喃基)-5-三氟甲基嘧啶。然后,对反应后的液体进行柱纯化,得到0.4g(1.1mmol)的目标物(6-氟-4-甲氧基-2-(5-硝基-2-呋喃基)-5-三氟甲基嘧啶)。6-氟-4-甲氧基-2-(5-硝基-2-呋喃基)-5-三氟甲基嘧啶的分离产率34.1%。
[0173]
[化学式20]
[0174][0175]
得到的目标物的分析结果如下所述。
[0176]
质谱(apcims,m/z):306.8[m-h]-;
[0177]1h-nmr(400mhz,cdcl3)δ7.54(d,j=3.7hz,1h),7.44(d,j=4.0hz,1h),4.26(s,
3h)。
[0178]
(实施例9)
[0179]
6-氟-4-甲氧基-2-(5-甲磺酰基-2-呋喃基)-5-三氟甲基嘧啶的制造
[0180]
将0.5g(2.3mmol)的5-甲磺酰基呋喃-2-羧基酰亚胺酰胺盐酸盐溶解于23ml的乙腈中,制备乙腈溶液。在该乙腈溶液中加入0.6g(2.8mmol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯和1.5g(11.6mmol)的n,n-二异丙基乙胺,在室温下搅拌23.5小时,根据下述式(k)所示的式,从5-甲磺酰基呋喃-2-羧基酰亚胺酰胺盐酸盐得到6-氟-4-甲氧基-2-(5-甲磺酰基-2-呋喃基)-5-三氟甲基嘧啶。然后,对反应后的液体进行柱纯化,得到0.4g(1.2mmol)的目标物(6-氟-4-甲氧基-2-(5-甲磺酰基-2-呋喃基)-5-三氟甲基嘧啶)。6-氟-4-甲氧基-2-(5-甲磺酰基-2-呋喃基)-5-三氟甲基嘧啶的分离产率为50.9%。
[0181]
[化学式21]
[0182][0183]
得到的目标物的分析结果如下所述。
[0184]
质谱(apcims,m/z):341.2[m+h]
+
;
[0185]1h-nmr(400mhz,cdcl3)δ7.49(d,j=3.7hz,1h),7.31(d,j=3.7hz,1h),4.23(s,3h),3.27(s,3h)。
[0186]
(实施例10)
[0187]
6-氟-4-甲氧基-2-(2-甲氧羰基-4-呋喃基)-5-三氟甲基嘧啶的制造
[0188]
将0.6g(3.0mmol)的5-氨基甲亚胺酰基呋喃-2-羧酸甲酯(5-carbamimidoylfuran-2-methyl carboxylate)盐酸盐溶解于30ml的乙腈中,制备乙腈溶液。在该乙腈溶液中加入0.7g(3.3mmol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯和2.0g(15.5mmol)的n,n-二异丙基乙胺,在室温下搅拌16小时,根据下述式(l)所示的式,从5-氨基甲亚胺酰基呋喃-2-羧酸甲酯盐酸盐得到6-氟-4-甲氧基-2-(2-甲氧羰基-4-呋喃基)-5-三氟甲基嘧啶。然后,对反应后的液体进行柱纯化,得到0.2g(0.5mmol)的目标物(6-氟-4-甲氧基-2-(2-甲氧羰基-4-呋喃基)-5-三氟甲基嘧啶)。6-氟-4-甲氧基-2-(2-甲氧羰基-4-呋喃基)-5-三氟甲基嘧啶的分离产率为16.2%。
[0189]
[化学式22]
[0190][0191]
得到的目标物的分析结果如下所述。
[0192]
质谱(apcims,m/z):321.5[m+h]
+
;
[0193]1h-nmr(400mhz,cdcl3)δ8.38(d,j=1.0hz,1h),7.76(d,j=0.8hz,1h),4.19(s,3h),3.95(s,3h)。
[0194]
(实施例11)
[0195]
6-氟-4-甲氧基-2-(5-碘-2-呋喃基)-5-三氟甲基嘧啶的制造
[0196]
将0.5g(1.9mmol)的5-碘呋喃-2-羧基酰亚胺酰胺盐酸盐溶解于26ml的乙腈中,制备乙腈溶液。在该乙腈溶液中加入0.6g(2.8mmol)的1,3,3,3-四氟-1-甲氧基-2-三氟甲基-1-丙烯和1.7g(13.2mmol)的n,n-二异丙基乙胺,在室温下搅拌16.7小时,根据下述式(m)所示的式,从5-碘呋喃-2-羧基酰亚胺酰胺盐酸盐得到6-氟-4-甲氧基-2-(5-碘-2-呋喃基)-5-三氟甲基嘧啶。然后,对反应后的液体进行柱纯化,得到0.5g(1.2mmol)的目标物(6-氟-4-甲氧基-2-(5-碘-2-呋喃基)-5-三氟甲基嘧啶)。6-氟-4-甲氧基-2-(5-碘-2-呋喃基)-5-三氟甲基嘧啶的分离产率66.3%。
[0197]
[化学式23]
[0198][0199]
得到的目标物的分析结果如下所述。
[0200]
质谱(apcims,m/z):387.6[m+h]
+
;
[0201]1h-nmr(400mhz,cdcl3)δ7.32(d,j=3.7hz,1h),6.78(d,j=3.4hz,1h),4.19(s,3h)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1