使用过渡金属双(酚盐)催化剂络合物获得的丙烯聚合物及生产该丙烯聚合物的均相方法与流程
使用过渡金属双(酚盐)催化剂络合物获得的丙烯聚合物及生产该丙烯聚合物的均相方法
1.优先权
2.本技术要求2020年2月11日提交的ussn 62/972,953的优先权和权益。
3.相关申请的交叉引用
4.本发明与以下申请相关:
5.1)2020年2月11日提交的ussn 16/788,022;
6.2)2020年2月11日提交的ussn 16/788,088;
7.3)2020年2月11日提交的ussn 16/788,124;
8.4)2020年2月11日提交的ussn 16/787,909;
9.5)2020年2月11日提交的ussn 16/787,837;
10.6)题目为“propylene copolymers obtained using transition metal bis(phenolate)catalyst complexes and homogeneous process for production thereof”的同时提交的pct申请号pct/us2020/____(代理人案号2020em048);
11.8)题目为“ethylene-alpha-olefin-diene monomer copolymers obtained using transition metal bis(phenolate)catalyst complexes and homogeneous process for production thereof”的同时提交的pct申请号pct/us2020/____(代理人案号2020em050);
12.9)题目为“polyethylene compositions obtained using transition metal bis(phenolate)catalyst complexes and homogeneous process for production thereof”的同时提交的pct申请号pct/us2020/____(代理人案号2020em051)。
发明领域
13.本发明涉及使用包含第4族双(酚盐)络合物的新型催化剂化合物制备的丙烯聚合物,包含这样的丙烯聚合物的组合物和制备这样的丙烯聚合物的方法。
14.发明背景
15.烯烃聚合催化剂广泛用于工业中。因此,有兴趣寻找提高催化剂的商业可用性并允许生产具有改进性质的聚合物的新的催化剂体系。
16.用于烯烃聚合的催化剂可基于双(酚盐)络合物作为催化剂前体,其通常通过铝氧烷或含有非配位阴离子的活化剂活化。双(酚盐)络合物的实例可发现于以下参考文献:
17.kr 2018-022137(lg chem.)描述双(甲基苯基酚盐)吡啶的过渡金属络合物。
18.us 7,030,256 b2(symyx technologies,inc.)描述桥连的双芳族配体、催化剂、聚合方法及其聚合物。
19.us 6,825,296(university of hong kong)描述双(酚盐)配体的过渡金属络合物,其以两个6元环与金属配位。
20.us 7,847,099(california institute of technology)描述双(酚盐)配体的过渡金属络合物,其以两个6元环与金属配位。
21.wo 2016/172110(univation technologies)描述三齿双(酚盐)配体的络合物,其特征为非环状醚或硫醚给体。
22.其它感兴趣的参考文献包括:baier,m.c.(2014)“post-metallocenes in the industrial production of polyolefins,”angew.chem.int.ed.2014,第53卷,第9722-9744页;和golisz,s.等人(2009)“synthesis of early transition metal bisphenolate complexes and their use as olefin polymerization catalysts,”macromolecules,第42(22)卷,第8751-8762页。
23.能够在高工艺温度下聚合烯烃以产生高分子量和/或高立构规整度聚合物的新催化剂对于聚烯烃的工业生产而言是期望的。本领域仍然需要用于烯烃聚合的新的且改进的催化剂体系,以便实现特定的聚合物性质,例如高分子量和/或高立构规整度聚合物,优选在高工艺温度下。
24.此外,有利的是在升高的温度下进行商业溶液聚合反应。通常阻止进行这样的高温聚合的主要催化剂限制是催化剂效率、所生产的聚合物的分子量和对于丙烯均聚而言的高聚合物结晶度。所有这些因素通常随着反应器温度的升高而降低。适用于生产全同立构聚丙烯的典型茂金属催化剂需要较低的工艺温度以实现期望的聚合物结晶度。
25.本文和在相关的2020年2月11日提交的题目为“transition metal bis(phenolate)complexes and their use as catalysts for olefin polymerization,”(代理人案卷号2020em045)的ussn16/787,909描述的新开发的单中心催化剂能够在升高的聚合温度下生产高分子量和高结晶全同立构聚丙烯。除了其它方面,这些催化剂当与各种类型的活化剂配对并使用在溶液方法中时可生产具有高结晶度和分子量的基于丙烯的共聚物。此外,催化剂活性高,这促进在商业相关工艺条件中使用。这种新的方法提供新的具有高结晶度的丙烯聚合物,其可在聚合物生产期间以提高的反应器生产量和在较高聚合温度下生产。
26.发明概述
27.本发明涉及丙烯聚合物例如丙烯均聚物、与c4和更高级α-烯烃的丙烯共聚物和包含这样的丙烯聚合物的共混物,其中丙烯聚合物在溶液方法中使用二阴离子三齿配体的过渡金属催化剂络合物制备,所述配体的特征为中心中性杂环路易斯碱和两个酚盐给体,其中三齿配体与金属中心配位以形成两个八元环。
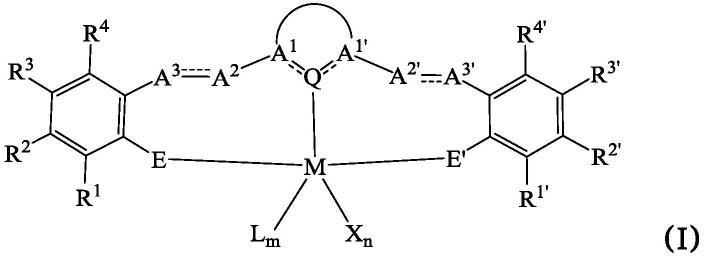
28.本发明还涉及丙烯均聚物例如全同立构丙烯聚合物、与c4和更高级α-烯烃的全同立构丙烯共聚物和包含这样的丙烯聚合物的共混物,其中丙烯聚合物在溶液方法中使用由式(i)表示的双(酚盐)络合物制备:
29.30.其中:
31.m是第3-6族过渡金属或镧系元素;
32.e和e'每个独立地为o、s或nr9,其中r9独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基或含杂原子基团;
33.q是与金属m形成配位键的第14、15或16族原子;
34.a1qa1’
是经由3-原子桥连接a2与a2’
的含有4-40个非氢原子的杂环路易斯碱的一部分,其中q是3-原子桥的中心原子,
35.a1和a
1'
独立地为c、n或c(r
22
),其中r
22
选自氢、c
1-c
20
烃基、c
1-c
20
取代的烃基;
36.是经由2-原子桥连接a1与e-键合的芳族基团的含有2-40个非氢原子的二价基团;
37.是经由2-原子桥连接a1'与e'-键合的芳族基团的含有2-40个非氢原子的二价基团;
38.l是中性路易斯碱;
39.x是阴离子配体;
40.n是1、2或3;
41.m是0、1或2;
42.n+m不大于4;
43.r1、r2、r3、r4、r
1'
、r
2'
、r
3'
和r
4'
中每个独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,或r1和r2、r2和r3、r3和r4、r
1'
和r
2'
、r
2'
和r
3'
、r
3'
和r
4'
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环;
44.任何两个l基团可以接合在一起从而形成双齿路易斯碱;
45.x基团可以与l基团接合从而形成单阴离子双齿基团;
46.任何两个x基团可以接合在一起从而形成二阴离子配体基团。
47.本发明还涉及聚合烯烃的溶液相方法,包括使如本文描述的催化剂化合物与活化剂接触。本发明还涉及通过本文描述的方法生产的丙烯聚合物组合物。
48.附图简要描述
49.图1是连续聚合装置中生产的聚合物样品的聚合温度(℃)相对聚丙烯tm(℃)的图。
50.定义
51.就本发明及其权利要求书的目的而言,应使用以下定义:
52.使用如chemical and engineering news,第63(5)卷,第27页(1985)中描述的周期表族的新编号方案。因此,“第4族金属”是来自周期表第4族的元素例如hf、ti或zr。
[0053]“催化剂生产率”是使用已知数量的聚合催化剂生产的聚合物的质量的量度。典型地,“催化剂生产率”以(g的聚合物)/(g的催化剂)或(g的聚合物)/(mmol的催化剂)等单位表示。如果没有规定单位,则“催化剂生产率”以(g的聚合物)/(g的催化剂)的单位计。为了计算催化剂生产率,仅使用催化剂的过渡金属组分的重量(即省略活化剂和/或助催化剂)。“催化剂活性”是对于间歇和半间歇聚合而言使用已知数量的聚合催化剂/单位时间生产的聚合物的质量的量度。典型地,“催化剂活性”以(g的聚合物)/(mmol的催化剂)/小时或(kg的聚合物)/(mmol的催化剂)/小时等的单位表示。如果没有规定单位,则“催化剂活性”以(g的聚合物)/(mmol的催化剂)/小时的单位计。
[0054]“转化率”是聚合中转化为聚合物产物的单体的百分比,并且报道为%并且基于聚合物收率、聚合物组成和加料至反应器中的单体的量计算。
[0055]“烯烃(olefin)”或者被称作“烯烃(alkene)”是具有至少一个双键的线性、支化或环状的碳和氢的化合物。就本说明书和所附权利要求书的目的而言,当聚合物或共聚物被称作包含烯烃时,在这样的聚合物或共聚物中存在的烯烃是该烯烃的经聚合的形式。例如,当共聚物据称具有35重量%至55重量%的“丙烯”含量时,应理解该共聚物中的单体(mer)单元衍生自聚合反应中的丙烯,并且所述衍生单元以基于所述共聚物重量的35重量%至55重量%存在。“聚合物”具有两个或更多个相同或不同单体单元。“均聚物”是具有相同单体单元的聚合物。“共聚物”是具有彼此不同的两种或更多种单体单元的聚合物。“三元共聚物”是具有彼此不同的三种单体单元的聚合物。因此,如本文使用的,共聚物的定义包括三元共聚物等。用于指代单体单元的“不同的”表示单体单元彼此相差至少一个原子或是同分异构上不同的。“丙烯聚合物”或“丙烯共聚物”是包含至少50摩尔%丙烯衍生单元的聚合物或共聚物,等等。
[0056]
α-烯烃定义为含有至少一个乙烯基(ch2=ch-)基团的线性或支化的c3或更高级α-烯烃。α-烯烃的非限制性实例包括丙烯、1-丁烯、1-戊烯、1-己烯、1-辛烯、1-癸烯、1-十二碳烯、1-十四碳烯、4-甲基-1-戊烯和苯乙烯。
[0057]
除非另外规定,术语“c
n”意指每个分子具有n个碳原子的烃(一种或多种),其中n是正整数。
[0058]
术语“烃”意指一类含有与碳键合的氢的化合物,并且涵盖(i)饱和的烃化合物、(ii)不饱和的烃化合物和(iii)烃化合物(饱和的和/或不饱和的)的混合物,包括具有不同n值的烃化合物的混合物。同样,“c
m-c
y”基团或化合物是指包含其总数在m-y范围内的碳原子的基团或化合物。因此,c
1-c
50
烷基基团是指包含其总数在1-50范围内的碳原子的烷基基团。
[0059]
术语“基团”、“自由基”和“取代基”可以互换使用。
[0060]
术语“烃基基团(hydrocarbyl radical)”、“烃基基团(hydrocarbyl group)”或“烃基”可以互换使用并定义为意指仅由氢和碳原子组成的基团。优选的烃基是c
1-c
100
基团,其可以是线性、支化或环状的,并且当是环状时可以是芳族或非芳族的。这样的基团的实例包括但不限于烷基基团例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、己基、辛基、环丙基、环丁基、环戊基、环己基、环辛基等,芳基基团例如苯基、苄基、萘-2-基等。
[0061]
除非另外表明,(例如“取代的烃基”的定义等),术语“取代的”意指至少一个氢原子已被至少一个非氢基团,例如烃基基团、杂原子或含有杂原子的基团,例如卤素(例如br、cl、f或i)或至少一个官能团例如-nr*2、-or*、-ser*、-ter*、-pr*2、-asr*2、-sbr*2、-sr*、-br*2、-sir*3、-ger*3、-snr*3、-pbr*3、-(ch2)
q-sir*3等代替,其中q是1至10和每个r*独立地是氢、烃基或卤代烃基,并且两个或更多个r*可以接合在一起以形成取代或未取代的完全
饱和、部分不饱和或芳族的环状或多环的环结构,或其中至少一个杂原子已插入烃基环内。
[0062]
术语“取代的烃基”意指这样的烃基基团,其中烃基基团的至少一个氢原子已被至少至少一个杂原子(例如卤素例如br、cl、f或i)或含有杂原子的基团(例如官能团例如-nr*2、-or*、-ser*、-ter*、-pr*2、-asr*2、-sbr*2、-sr*、-br*2、-sir*3、-ger*3、-snr*3、-pbr*3、-(ch2)
q-sir*3等,其中q是1至10并且每个r*独立地是氢、烃基或卤代烃基,并且两个或更多个r*可以接合在一起以形成取代或未取代的完全饱和、部分不饱和或芳族的环状或多环环结构)取代,或其中至少一个杂原子已插入烃基环内。
[0063]
甲硅烷基烃基(silylcarbyl)基团是这样的基团,其中一个或多个烃基氢原子已被至少一个含有sir*3的基团取代或其中至少一个
–
si(r*)
2-已插入烃基基团内,其中r*独立地是烃基或卤代烃基,并且两个或更多个r*可以接合在一起以形成取代或未取代的饱和、部分不饱和或芳族的环状或多环环结构。
[0064]
取代的甲硅烷基烃基基团是这样的基团,其中至少一个氢原子已被至少一个官能团例如nr*2、or*、ser*、ter*、pr*2、asr*2、sbr*2、sr*、br*2、ger*3、snr*3、pbr*3等取代或其中至少一个非烃原子或基团例如-o-、-s-、-se-、-te-、-n(r*)-、=n-、-p(r*)-、=p-、-as(r*)-、=as-、-sb(r*)-、=sb-、-b(r*)-、=b-、-ge(r*)
2-、-sn(r*)
2-、-pb(r*)
2-等已插入甲硅烷基烃基基团内,其中r*独立地是烃基或卤代烃基基团,并且两个或更多个r*可以接合在一起以形成取代或未取代的饱和、部分不饱和或芳族的环状或多环环结构。取代的甲硅烷基烃基基团仅通过碳或硅原子键合。
[0065]
术语“芳基”或“芳基基团”意指芳族环(通常由6个碳原子组成)及其取代变体,例如苯基、2-甲基-苯基、二甲苯基、4-溴-二甲苯基。同样,杂芳基意指其中环碳原子(或两个或三个环碳原子)已被杂原子例如n、o或s代替的芳基基团。如本文使用的,术语“芳族”还指假芳族杂环,其为具有与芳族杂环配体类似的性质和结构(几乎平面),但按定义不是芳族的杂环取代基。
[0066]
术语“取代的芳基”意指具有已被烃基、取代的烃基、杂原子或含有杂原子的基团代替的1个或多个氢基团的芳基基团。
[0067]“取代的酚盐”是这样的酚盐基团,其中2、3、4、5和/或6位置的至少一个、两个、三个、四个或五个氢原子已被至少一个非氢基团,例如烃基基团、杂原子或含有杂原子的基团,例如卤素(例如br、cl、f或i)或至少一个官能团例如-nr*2、-or*、-ser*、-ter*、-pr*2、-asr*2、-sbr*2、-sr*、-br*2、-sir*3、-ger*3、-snr*3、-pbr*3、-(ch2)
q-sir*3等代替,其中q是1至10和每个r*独立地是氢、烃基或卤代烃基,并且两个或更多个r*可以接合在一起以形成取代或未取代的完全饱和、部分不饱和或芳族的环状或多环的环结构,其中1位置是酚盐基团(ph-o-、ph-s-和ph-n(r^)-基团,其中r^是氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含有杂原子的基团)。优选地,本文描述的催化剂化合物中的“取代的酚盐”基团由下式表示:
[0068]
[0069]
其中r
18
是氢、c
1-c
40
烃基(例如c
1-c
40
烷基)或c
1-c
40
取代的烃基、杂原子或含杂原子的基团,e
17
是氧、硫或nr
17
,和r
17
、r
19
、r
20
和r
21
中每个独立地选自氢、c
1-c
40
烃基(例如c
1-c
40
烷基)或c
1-c
40
取代的烃基、杂原子或含杂原子的基团,或r
18
、r
19
、r
20
和r
21
中两个或更多个接合在一起以形成c
4-c
62
环状或多环的环结构或它们的组合,并且波浪线显示取代的酚盐基团与催化剂化合物的其余部分形成键的位置。
[0070]“烷基取代的酚盐”是这样的酚盐基团,其中2、3、4、5和/或6位置的至少一个、两个、三个、四个或五个氢原子已被至少一个烷基基团例如c
1-c
40
或者c
2-c
20
或者c
3-c
12
烷基例如甲基、乙基、甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、己基、辛基、环丙基、环丁基、环戊基、环己基、环辛基、金刚烷基等(包括它们的取代类似物)代替。
[0071]“芳基基取代的酚盐”是这样的酚盐基团,其中2、3、4、5和/或6位置的至少一个、两个、三个、四个或五个氢原子已被至少一个芳基基基团例如c
1-c
40
或者c
2-c
20
或者c
3-c
12
芳基例如苯基、4-氟苯基、2-甲基苯基、2-丙基苯基、2,6-二甲基苯基、均三甲苯基、2-乙基苯基、萘-2-基等(包括它们的取代类似物)代替。
[0072]
术语“环原子”意指作为环状环结构的一部分的原子。根据这个定义,苄基基团具有六个环原子而四氢呋喃具有5个环原子。
[0073]
杂环的环(还称作杂环的)是在环结构中具有杂原子的环,与“杂原子取代的环”相反,在后者中环原子上的氢被杂原子代替。例如,四氢呋喃是杂环的环而4-n,n-二甲基氨基-苯基是杂原子取代的环。取代的杂环的环意为具有1个或多个被烃基、取代的烃基、杂原子或含有杂原子的基团代替的氢基团的杂环的环。
[0074]
取代的烃基环意为包含碳和氢原子,具有1个或多个被烃基、取代的烃基、杂原子或含有杂原子的基团代替的氢基团的环。
[0075]
就本公开内容的目的而言,关于催化剂化合物(例如取代的双(酚盐)催化剂化合物),术语“取代的”意指氢原子已被烃基基团、杂原子或含有杂原子的基团,例如卤素(例如br、cl、f或i)或至少一个官能团例如-nr*2、-or*、-ser*、-ter*、-pr*2、-asr*2、-sbr*2、-sr*、-br*2、-sir*3、-ger*3、-snr*3、-pbr*3、-(ch2)
q-sir*3等代替,其中q是1至10和每个r*独立地是氢、烃基或卤代烃基,并且两个或更多个r*可以接合在一起以形成取代或未取代的完全饱和、部分不饱和/或芳族的环状或多环的环结构,或其中至少一个杂原子已经插入烃基环内。
[0076]
叔烃基基团拥有与三个其它碳原子键合的碳原子。当烃基团是烷基基团时,叔烃基基团还被称作叔烷基基团。叔烃基基团的实例包括叔丁基、2-甲基丁-2-基、2-甲基己-2-基、2-苯基丙-2-基、2-环己基丙-2-基、1-甲基环己基、1-金刚烷基、双环[2.2.1]庚-1-基等。叔烃基基团可由式a说明:
[0077][0078]
其中ra、rb和rc是可以任选彼此键合的烃基基团或取代的烃基基团,并且波浪线显示叔烃基基团彼此形成键的位置。
[0079]
环状的叔烃基基团定义为形成至少一个酯环族(非芳族)环的叔烃基基团。环状的叔烃基基团还被称作脂环族叔烃基基团。当烃基团是烷基基团时,环状的叔烃基基团还被称作环状的叔烷基基团或脂环族叔烷基基团。环状的叔烃基基团的实例包括1-金刚烷基、1-甲基环己基、1-甲基环戊基、1-甲基环辛基、1-甲基环癸基、1-甲基环十二烷基、双环[3.3.1]壬-1-基、双环[2.2.1]庚-1-基、双环[2.3.3]己-1-基、双环[1.1.1]戊-1-基、双环[2.2.2]辛-1-基等。环状的叔烃基基团可由式b说明:
[0080][0081]
其中ra是烃基基团或取代的烃基基团,每个rd独立地为氢或烃基基团或取代的烃基基团,w是1-约30的整数,和ra、和一个或多个rd和两个或更多个rd可以任选彼此键合以形成额外的环。
[0082]
当环状的叔烃基基团含有多于一个脂环族环时,它可被称作多环的叔烃基基团或如果烃基基团是烷基基团,它可以被称作多环的叔烷基基团。
[0083]
在本公开内容中术语“烷基基团”和“烷基”可互换使用。就本公开内容的目的而言,“烷基基团”被定义为c
1-c
100
烷基,其可以是线性、支化或环状的。这样的基团的实例可包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、己基、辛基、环丙基、环丁基、环戊基、环己基、环辛基等,包括它们的取代类似物。取代的烷基基团是这样的基团,其中烷基基团的至少一个氢原子已被至少一个非氢基团,例如烃基基团、杂原子或含有杂原子的基团,例如卤素(例如br、cl、f或i)或至少一个官能团例如-nr*2、-or*、-ser*、-ter*、-pr*2、-asr*2、-sbr*2、-sr*、-br*2、-sir*3、-ger*3、-snr*3、-pbr*3、-(ch2)q-sir*3等取代,其中q是1至10和每个r*独立地是氢、烃基或卤代烃基,并且两个或更多个r*可以接合在一起以形成取代或未取代的完全饱和、部分不饱和或芳族的环状或多环的环结构,或其中至少一个杂原子已插入烃基环内。
[0084]
当存在指定的烷基、烯基、烷氧基或芳基基团的异构体(例如正丁基、异丁基、仲丁基和叔丁基)时,提到该基团的一个成员(例如正丁基)应明确地公开该族中的剩余异构体(例如异丁基、仲丁基和叔丁基)。同样,在没有规定特定异构体(例如丁基)的情况下提到烷基、烯基、烷氧基或芳基基团明确地公开了所有异构体(例如正丁基、异丁基、仲丁基和叔丁基)。
[0085]
如本文使用的,mn是数均分子量,mw是重均分子量,和mz是z均分子量,重量%是重量百分比并且mol%是摩尔百分比。分子量分布(mwd),还被称作多分散性指数(pdi),定义为mw除以mn。除非另外指出,所有分子量单位(例如mw、mn、mz)是g/mol(g mol-1
)。
[0086]
本文可以使用以下缩写:me是甲基,et是乙基,pr是丙基,cpr是环丙基,npr是正丙基,ipr是异丙基,bu是丁基,nbu是正丁基,ibu是异丁基,sbu是仲丁基,tbu是叔丁基,oct是
辛基,ph是苯基,mao是甲基铝氧烷,dme(还称作dme)是1,2-二甲氧基乙烷,p-tbu是对-叔丁基,tms是三甲基甲硅烷基,tibal是三异丁基铝,tnoa和tnoal是三(正辛基)铝,p-me是对-甲基,bn是苄基(即ch2ph),thf(还称作thf)是四氢呋喃,rt是室温(并且除非另外指出是23℃),tol是甲苯,etoac是乙酸乙酯,cbz是咔唑和cy是环己基。微摩尔可以缩写为umol或μmol。微升可以缩写为ul或μl。
[0087]“催化剂体系”是包含至少一种催化剂化合物和至少一种活化剂的组合。当使用“催化剂体系”来描述活化之前的这样的对时,意指与活化剂和任选助活化剂一起的未活化的催化剂络合物(前催化剂)。当它用于描述活化之后的这一对时,意指活化的络合物和活化剂或其它电荷平衡的结构部分。过渡金属化合物可以是中性的(如在前催化剂中),或具有抗衡离子的带电物质(如在活化的催化剂体系中)。就本发明及其权利要求书的目的而言,当催化剂体系被描述为包含组分的中性稳定形式时,本领域普通技术人员将充分理解组分的离子形式是与单体反应而产生聚合物的形式。聚合催化剂体系是可将单体聚合为聚合物的催化剂体系。
[0088]
在本文的描述中,可以将催化剂描述为催化剂、催化剂前体、前催化剂化合物、催化剂化合物或过渡金属化合物,并且这些术语可以互换使用。
[0089]“阴离子配体”是向金属离子提供一对或多对电子的带负电的配体。术语“阴离子给体”与“阴离子配体”可以互换使用。在本发明的上下文中阴离子给体的实例包括但不限于甲基、氯基、氟基、烷氧基、芳氧基、烷基、烯基、硫醇盐、羧酸盐、氨基(amido)、甲基、苄基、氢基、脒基、氨基(amidate)和苯基。两个阴离子给体可以接合以形成二阴离子基团。
[0090]“中性路易斯碱”或“中性给体基团”是向金属离子提供一对或多对电子的不带电的(即中性的)基团。中性路易斯碱的非限制性实例包括醚、硫醚、胺、膦、乙醚、四氢呋喃、二甲基硫醚、三乙基胺、吡啶、烯烃、炔烃、丙二烯和碳烯(carbene)。路易斯碱可以接合在一起以形成二齿或三齿路易斯碱。
[0091]
就本发明及其权利要求书的目的而言,酚盐给体包括ph-o-、ph-s-和ph-n(r^)-基团,其中r^是氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,和ph是任选取代的苯基。
[0092]
详细描述
[0093]
本发明涉及包含特征是中心中性给体基团和两个酚盐给体的二阴离子三齿配体的过渡金属络合物的新的催化剂族生产丙烯聚合物的溶液方法,其中三齿配体与金属中心配位以形成两个八元环。在这类络合物中,中心中性给体是杂环基团是有利的。杂环基团在相对杂原子的α位置缺少氢是特别有利的。在这类络合物中,酚盐被一种或多种环状的叔烷基取代基取代也是有利的。环状的叔烷基取代的酚盐的使用显示改进这些催化剂生产高分子量聚合物的能力。
[0094]
本文可用的取代的双(酚盐)配体(例如金刚烷基取代的双(酚盐)配体)的络合物当与活化剂例如非配位阴离子或铝氧烷活化剂组合时形成活性烯烃聚合催化剂。可用的双(芳基酚盐)吡啶络合物包含与第4族过渡金属配位的三齿双(芳基酚盐)吡啶配体,形成两个八元环。
[0095]
本发明还涉及使用包含以下的金属络合物生产丙烯聚合物的溶液方法:选自第3-6族或镧系元素金属的金属,和含有两个阴离子给体基团和中性路易斯碱给体的三齿二阴
离子配体,其中中性路易斯碱给体共价键合在两个阴离子给体之间,并且其中金属-配体络合物特征是一对8元金属环状物环。
[0096]
本发明涉及在制备丙烯聚合物的溶液方法中使用的催化剂体系,包含活化剂和一种或多种如本文描述的催化剂化合物。
[0097]
本发明还涉及使用本文描述的催化剂化合物从而聚合丙烯的溶液方法(优选在较高温度下),包括使丙烯与包含活化剂和本文描述的催化剂化合物的催化剂体系接触。
[0098]
本发明还涉及使用本文描述的催化剂化合物共聚丙烯和至少一种c
4-c
20
α-烯烃的溶液方法(优选在较高温度下),包括使丙烯和至少一种c
4-c
20
α-烯烃与包含活化剂和本文描述的催化剂化合物的催化剂体系接触。
[0099]
本公开内容还涉及催化剂体系,其包含如本文所述活化剂化合物和过渡金属化合物,涉及这样的活化剂化合物用于活化催化剂体系中的过渡金属化合物用于聚合丙烯的用途,并且涉及聚合丙烯的方法,该方法包括在聚合条件下使丙烯与包含过渡金属化合物和活化剂化合物的催化剂体系接触,其中不存在芳族溶剂例如甲苯(例如相对于活化剂的摩尔数以0mol%存在,供选择地以小于1mol%存在,优选催化剂体系、聚合反应和/或产生的聚合物不含“可检测的芳族烃溶剂”例如甲苯)。就本公开内容的目的而言,“可检测的芳族烃溶剂”意指通过气相色谱法测定的1ppm或更大。就本公开内容的目的而言,“可检测的甲苯”意指通过气相色谱法测定的1ppm或更大。
[0100]
本文使用的催化剂体系优选含有0ppm(或者小于1ppm)的芳族烃。优选地,本文使用的催化剂体系含有0ppm(或者小于1ppm)的甲苯。
[0101]
催化剂化合物
[0102]
术语“催化剂”、“化合物”、“催化剂化合物”、“前催化剂”和“络合物”可以互换使用以描述当与合适的活化剂组合时形成烯烃聚合催化剂的过渡金属或镧系元素金属络合物。
[0103]
本发明的催化剂络合物包含选自元素周期表的第3、4、5或6族或镧系元素金属的金属,含有两个阴离子给体基团和中性杂环的路易斯碱给体的三齿二阴离子配体,其中杂环的给体在两个阴离子给体之间共价连接。优选地,二阴离子三齿配体的特征是中心杂环的给体基团和两个酚盐给体,和三齿配体与金属中心配位以形成两个八元环。
[0104]
金属优选选自第3、4、5或6族元素。优选地金属m是第4族金属;最优选地,金属m是锆或铪。当期望较高结晶度聚丙烯或丙烯-α-烯烃共聚物时,m优选是铪。
[0105]
优选地杂环的路易斯碱给体特征为氮或氧给体原子。优选的杂环基团包括吡啶、吡嗪、嘧啶、三嗪、噻唑、咪唑、噻吩、唑、噻唑、呋喃的衍生物,和它们的取代变体。优选地杂环的路易斯碱在相对给体原子的α位置缺少氢(一个或多个)。特别优选的杂环的路易斯碱给体包括吡啶、3-取代的吡啶和4-取代的吡啶。
[0106]
三齿二阴离子配体的阴离子给体可以是芳基硫醇盐、酚盐或n-酰苯胺(anilide)。优选的阴离子给体是酚盐。优选的是三齿二阴离子配体与金属中心配位以形成缺少对称的镜像平面的络合物。优选的是三齿二阴离子配体与金属中心配位以形成具有对称的二重旋转轴的络合物;当确定双(酚盐)络合物的对称性时仅考虑金属和二阴离子三齿配体(即忽略剩余的配体)。
[0107]
第4族双(酚盐)催化剂化合物是通过二阴离子的二齿、三齿或四齿配体配位的第4族过渡金属(ti、zr或hf)的络合物,其中阴离子基团是酚盐阴离子。优选的第4族双(酚盐)
催化剂化合物的特征是以形成一对7元或8元金属环状物环的方式与第4族金属配位的三齿或四齿二阴离子配体。更优选的第4族双(酚盐)催化剂络合物的特征是以形成一对8元金属环状物环的方式与第4族金属配位的三齿二阴离子配体。
[0108]
可用于本发明的双(酚盐)配体优选是以形成一对8元金属环状物环的方式与金属m配位的三齿二阴离子配体。优选地,双(酚盐)配体围绕金属以形成具有2重旋转轴的络合物,因此赋予络合物c2对称性。c2几何形状和8元金属环状物环是这些络合物的特征,这使得它们对于生产聚烯烃,特别是全同立构聚(α-烯烃)而言是有效的催化剂组分。如果配体以络合物具有镜面(cs)对称性的方式与金属配位,则催化剂将预期仅产生无规立构的聚(α-烯烃),这些对称性-反应性规律由bercaw,j.(2009)macromolecules,第42卷,第8751-8762页总结。本发明络合物的一对8元金属环状物环也是有利于催化剂活性、温度稳定性和单体连接的等规选择性(isoselectivity)的显著特征。已知特征为较小6元金属环状物环的相关第4族络合物(macromolecules 2009,第42卷,第8751-8762页)在烯烃聚合中使用时形成c2和cs对称络合物的混合物并因此不太适合生产高度全同立构的聚(α-烯烃)。
[0109]
本发明的双(酚盐)配体的特征是优选被烷基、取代的烷基、芳基或其它基团取代的酚盐基团。有利的是在与氧给体原子相邻的环位置取代每个酚盐基团。优选的是与氧给体原子相邻位置处的取代是含有1-20个碳原子的烷基基团。优选的是紧挨着氧给体原子位置处的取代是具有一个或多个五元或六元环的非芳族环状烷基基团。优选的是紧挨着氧给体原子位置处的取代是环状的叔烷基基团。高度优选的是紧挨着氧给体原子位置处的取代是金刚烷-1-基或取代的金刚烷-1-基。
[0110]
中性杂环的路易斯碱给体经由接合杂环的路易斯碱与酚盐基团的“连接基团”共价键合在两个阴离子给体之间。“连接基团”由式(i)中的(a3a2)和(a2’
a3’
)表示。每个连接基团的选择可以影响催化剂性能例如生产的聚(α-烯烃)的立构规整度。每个连接基团通常是两原子长度的c
2-c
40
二价基团。一个或两个连接基团可以独立地为亚苯基、取代的亚苯基、杂芳基、亚乙烯基或非环状的二原子长的连接基团。当一个或两个连接基团是亚苯基时,可以选择亚苯基基团上的烷基取代基以优化催化剂性能。通常,一个或两个亚苯基可以是未取代的或可以独立地被c
1-c
20
烷基,例如甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基或它们的异构体例如异丙基等取代。
[0111]
本发明还涉及催化剂化合物,和包含这样的化合物的催化剂体系,所述化合物由式(i)表示:
[0112]
[0113]
其中:
[0114]
m是第3、4、5或6族过渡金属或镧系元素(例如hf、zr或ti);
[0115]
e和e'每个独立地为o、s或nr9,其中r9独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基或含杂原子优选o的基团,优选e和e'都是o;
[0116]
q是与金属m形成配位键的第14、15或16族原子,优选地q是c、o、s或n,更优选q是c、n或o,最优选q是n;
[0117]
a1qa1’
是经由3-原子桥连接a2与a2’
的含有4-40个非氢原子的杂环的路易斯碱的一部分,其中q是3-原子桥的中心原子(与接合a1和a1’
的曲线组合的a1qa1’
表示杂环的路易斯碱),
[0118]
a1和a1’
独立地为c、n或c(r
22
),其中r
22
选自氢、c
1-c
20
烃基和c
1-c
20
取代的烃基。优选地,a1和a1’
是c;
[0119]
是经由2-原子桥连接a1与e-键合芳基基团的含有2-40个非氢原子的二价基团,例如邻-亚苯基、取代的邻-亚苯基、邻-亚芳基(ortho-arene)、亚吲哚基(indolene)、取代的亚吲哚基、苯并噻吩、取代的苯并噻吩、亚吡咯基(pyrrolene)、取代的亚吡咯基、噻吩、取代的噻吩、1,2-亚乙基(-ch2ch
2-)、取代的1,2-亚乙基、1,2-亚乙烯基(-hc=ch-)或取代的1,2-亚乙烯基,优选地是二价烃基基团;
[0120]
是经由2-原子桥连接a1'与e'-键合芳基基团的含有2-40个非氢原子的二价基团,例如邻-亚苯基、取代的邻-亚苯基、邻-亚芳基、亚吲哚基、取代的亚吲哚基、苯并噻吩、取代的苯并噻吩、亚吡咯基、取代的亚吡咯基、噻吩、取代的噻吩、1,2-亚乙基(-ch2ch
2-)、取代的1,2-亚乙基、1,2-亚乙烯基(-hc=ch-)或取代的1,2-亚乙烯基,优选地是二价烃基基团;
[0121]
每个l独立地为路易斯碱;
[0122]
每个x独立地为阴离子配体;
[0123]
n是1、2或3;
[0124]
m是0、1或2;
[0125]
n+m不大于4;
[0126]
r1、r2、r3、r4、r
1'
、r
2'
、r
3'
和r
4'
中每个独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团(优选r
1'
和r1独立地为环状基团例如环状的叔烷基基团),或r1和r2、r2和r3、r3和r4、r
1'
和r
2'
、r
2'
和r
3'
、r
3'
和r
4'
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环;
[0127]
任何两个l基团可以接合在一起从而形成双齿路易斯碱;
[0128]
x基团可以与l基团接合从而形成单阴离子双齿基团;
[0129]
任何两个x基团可以接合在一起从而形成二阴离子配体基团。
[0130]
本发明还涉及催化剂化合物,和包含这样的化合物的催化剂体系,所述化合物由式(ii)表示:
[0131][0132]
其中:
[0133]
m是第3、4、5或6族过渡金属或镧系元素(例如hf、zr或ti);
[0134]
e和e'每个独立地为o、s或nr9,其中r9独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基或含杂原子的基团,优选o,优选e和e'都是o;
[0135]
每个l独立地为路易斯碱;
[0136]
每个x独立地为阴离子配体;
[0137]
n是1、2或3;
[0138]
m是0、1或2;
[0139]
n+m不大于4;
[0140]
r1、r2、r3、r4、r
1'
、r
2'
、r
3'
和r
4'
中每个独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,或r1和r2、r2和r3、r3和r4、r
1'
和r
2'
、r
2'
和r
3'
、r
3'
和r
4'
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环;
[0141]
任何两个l基团可以接合在一起从而形成双齿路易斯碱;
[0142]
x基团可以与l基团接合从而形成单阴离子双齿基团;
[0143]
任何两个x基团可以接合在一起从而形成二阴离子配体基团;
[0144]
r5、r6、r7、r8、r5’
、r6’
、r7’
、r8’
、r
10
、r
11
和r
12
中每个独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,或r5和r6、r6和r7、r7和r8、r5’
和r6’
、r6’
和r7’
、r7’
和r8’
、r
10
和r
11
或r
11
和r
12
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环。
[0145]
金属m优选选自第3、4、5或6族元素,更优选第4族。最优选地,金属m是锆或铪。
[0146]
中性杂环的路易斯碱(式(i)中)的给体原子q优选是氮、碳或氧。优选的q是氮。
[0147]
中性杂环的路易斯碱基团的非限制性实例包括吡啶、吡嗪、嘧啶、三嗪、噻唑、咪唑、噻吩、唑、噻唑、呋喃的衍生物,和它们的取代变体。优选的杂环的路易斯碱基团包括吡啶、吡嗪、噻唑和咪唑的衍生物。
[0148]
杂环的路易斯碱(在式(i)中)的每个a1和a1’
独立地为c、n或c(r
22
),其中r
22
选自氢、c
1-c
20
烃基和c
1-c
20
取代的烃基。优选地,a1和a1'是碳。当q是碳时,优选的是a1和a
1'
选自
氮和c(r
22
)。当q是氮时,优选的是a1和a1’
是碳。优选的是q=氮和a1=a1’
=碳。当q是氮或氧时,优选的是式(i)中的杂环的路易斯碱不具有与a1或a1’
原子结合的任何氢原子。这是优选的因为认为那些位置的氢可能经历不期望的分解反应,这减小催化活性物质的稳定性。
[0149]
由与接合a1和a1’
的曲线组合的a1qa1’
表示的杂环的路易斯碱(具有式(i))优选选自以下,其中每个r
23
基团选自氢、杂原子、c
1-c
20
烷基、c
1-c
20
烷氧基、c
1-c
20
氨基和c
1-c
20
取代的烷基。
[0150][0151]
在式(i)或(ii)中,e和e’每个选自氧或nr9,其中r9独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基或含杂原子基团。优选的是e和e’是氧。当e和/或e’是nr9时,优选的是r9选自c
1-c
20
烃基、烷基或芳基。在一种实施方案中,e和e’每个选自o、s或n(烷基)或n(芳基),其中烷基优选是c
1-c
20
烷基例如甲基、乙基、丙基、丁基、戊基、己基、辛基、壬基、癸基、十一烷基、十二烷基等,和芳基是c
6-c
40
芳基基团例如苯基、萘-2-基、苄基、甲基苯基等。
[0152]
在实施方案中,和独立地为二价烃基团例如c
1-c
12
烃基团。
[0153]
在式(i)或(ii)的络合物中,当e和e’是氧时有利的是每个酚盐基团在紧挨着氧原子的位置被取代(即式(i)和(ii)中的r1和r1’
)。因此,当e和e’是氧时优选的是r1和r
1'
中每个独立地为c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,更优选地r1和r
1'
中每个独立地为具有一个或多个五元或六元环的非芳族环状烷基基团(例如环己基、环辛基、金刚烷基或1-甲基环己基或取代的金刚烷基),最优选地非芳族环状叔烷基基团(例如1-甲基环己基、金刚烷基或取代的金刚烷基)。
[0154]
在式(i)或(ii)的本发明一些实施方案中,r1和r
1'
中每个独立地为叔烃基基团。在式(i)或(ii)的本发明其它实施方案中,r1和r
1'
中每个独立地为环状的叔烃基基团。在式(i)或(ii)的本发明其它实施方案中,r1和r
1'
中每个独立地为多环的叔烃基基团。
[0155]
在式(i)或(ii)的本发明一些实施方案中,r1和r
1'
中每个独立地为叔烃基基团。在式(i)或(ii)的本发明其它实施方案中,r1和r
1'
中每个独立地为环状的叔烃基基团。在式(i)或(ii)的本发明其它实施方案中,r1和r
1'
中每个独立地为多环的叔烃基基团。
[0156]
连接基团(即式(i)中的和)每个优选是邻亚苯基基团,优选取代的邻亚苯基基团的一部分。对于式(ii)的r7和r7’
位置优选为氢或c
1-c
20
烷基,例如甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基或它们的异构体例如异丙基等。对于目标为具有高立构规整度的聚合物的应用而言,对于式(ii)的r7和r7’
位置优选为c
1-c
20
烷基,对于r7和r7’
两者最优选是c
1-c3烷基。
[0157]
在本文式(i)的实施方案中,q是c、n或o,优选q是n。
[0158]
在本文式(i)的实施方案中,a1和a1’
独立地为碳、氮或c(r
22
),其中r
22
选自氢、c
1-c
20
烃基、c
1-c
20
取代的烃基。优选地,a1和a1'是碳。
[0159]
在本文式(i)的实施方案中,式(i)中的a1qa1’
是杂环的路易斯碱例如吡啶、吡嗪、嘧啶、三嗪、噻唑、咪唑、噻吩、唑、噻唑、呋喃,或它们的取代变体的一部分。
[0160]
在本文式(i)的实施方案中,a1qa1’
是经由3-原子桥连接a2与a2’
的含有2-20个非氢原子的杂环的路易斯碱的一部分,其中q是3-原子桥的中心原子。优选地每个a1和a
1'
是碳原子和a1qa1片段形成吡啶、吡嗪、嘧啶、三嗪、噻唑、咪唑、噻吩、唑、噻唑、呋喃,或它们基团的取代变体,或它们的取代变体的一部分。
[0161]
在本文式(i)的一种实施方案中,q是碳,和每个a1和a
1'
是n或c(r
22
),其中r
22
选自氢、c
1-c
20
烃基、c
1-c
20
取代的烃基、杂原子或含杂原子基团。在这种实施方案中,a1qa1’
片段形成环状碳烯、n-杂环碳烯、环状氨烷基碳烯,或它们基团的取代变体,或它们的取代变体的一部分。
[0162]
在本文式i的实施方案中,是经由2-原子桥连接a1与e-键合芳基基团的含有2-20个非氢原子的二价基团,其中是线性烷基或形成环状基团(例如任选取代的邻亚苯基基团或邻亚芳基基团)或它们的取代变体的一部分。
[0163]
是经由2-原子桥连接a
1'
与e'-键合芳基基团的含有2-20个非氢原子的二价基团,其中是线性烷基或形成环状基团(例如任选取代的邻亚苯基基团或邻亚芳基基团,或它们的取代变体的一部分。
[0164]
在本发明的实施方案中,在式(i)和(ii)中,m是第4族金属例如hf或zr。
[0165]
在本发明的实施方案中,在式(i)和(ii)中,e和e'是o。
[0166]
在本发明的实施方案中,在式(i)和(ii)中,r1、r2、r3、r4、r
1'
、r
2'
、r
3'
和r
4'
独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,或r1和r2、r2和r3、r3和r4、r
1'
和r
2'
、r
2'
和r
3'
、r
3'
和r
4'
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环,优选氢、甲基、乙基、丙基、丁基、戊基、己基或它们的异构体。
[0167]
在本发明的实施方案中,在式(i)和(ii)中,r1、r2、r3、r4、r
1'
、r
2'
、r
3'
、r
4'
和r9独立地选自甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、二十一烷基、二十二烷基、二十三烷基、二十四烷基、二十五烷基、二十六烷基、二十七烷基、二十八
烷基、二十九烷基、三十烷基、苯基、取代的苯基(例如甲基苯基和二甲基苯基)、苄基、取代的苄基(例如甲基苄基)、萘-2-基、环己基、环己烯基、甲基环己基和它们的异构体。
[0168]
在本发明的实施方案中,在式(i)和(ii)中,r4和r4’
独立地为氢或c
1-c3烃基例如甲基、乙基或丙基。
[0169]
在本发明的实施方案中,在式(i)和(ii)中,r9是氢、c
1-c
40
烃基、c
1-c
40
取代的烃基或含杂原子基团,优选氢、甲基、乙基、丙基、丁基、戊基、己基或它们的异构体。优选地,r9是甲基、乙基、丙基、丁基、c
1-c6烷基、苯基、2-甲基苯基、2,6-二甲基苯基或2,4,6-三甲基苯基。
[0170]
在本发明的实施方案中,在式(i)和(ii)中,每个x独立地选自以下:具有1-30个碳原子的烃基(例如烷基或芳基或烷芳基)、具有3-30个碳原子的甲硅烷基烃基、氢基、氨基、烷氧基、硫基、磷基、卤基、烷基磺酸根和它们的组合(两个或更多个x可以形成稠环或环体系的一部分),优选每个x独立地选自卤基、芳基和c1-c5烷基基团、c7-c30烷芳基,优选每个x独立地选自氢基、二甲基氨基、二乙基氨基、甲基三甲基甲硅烷基、新戊基、苯基、苄基、甲基苄基、乙基苄基、丙基苄基、丁基苄基(包括对-叔丁基苄基)、4-己基苄基、4-辛基苄基、4-癸基苄基、4-十二烷基苄基、4-十四烷基苄基、4-十六烷基苄基、4-十八烷基苄基、4-十九烷基苄基、4-二十烷基苄基、4-二十一烷基苄基、亚甲基(三甲基硅烷)、亚甲基(三乙基硅烷)、甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、氟基、碘基、溴基或氯基。
[0171]
供选择地,每个x可以独立地为卤基、氢基、烷基基团、烯基基团或芳基烷基基团。
[0172]
在本发明的实施方案中,在式(i)和(ii)中,每个l是路易斯碱,独立地选自以下:醚、硫醚、胺、腈、亚胺、吡啶、卤代烃和膦,优选醚和硫醚和它们的组合,任选地两个或更多个l可以形成稠环或环体系的一部分,优选地每个l独立地选自醚和硫醚基团,优选地每个l是乙醚、四氢呋喃、二丁醚或二甲基硫醚。
[0173]
在本发明的实施方案中,在式(i)和(ii)中,r1和r1'独立地为环状的叔烷基基团。
[0174]
在本发明的实施方案中,在式(i)和(ii)中,n为1、2或3,通常为2。
[0175]
在本发明的实施方案中,在式(i)和(ii)中,m为0、1或2,通常为0。
[0176]
在本发明的实施方案中,在式(i)和(ii)中,r1和r1’
不是氢。
[0177]
在本发明的实施方案中,在式(i)和(ii)中,m是hf或zr,e和e'是o,r1和r1’
中每个独立地为c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,每个r2、r3、r4、r
2'
、r
3'
和r
4'
独立地为氢、c
1-c
20
烃基、c
1-c
20
取代的烃基、杂原子或含杂原子的基团,或r1和r2、r2和r3、r3和r4、r
1'
和r
2'
、r
2'
和r
3'
、r
3'
和r
4'
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环;每个x独立地选自以下:具有1-20个碳原子的烃基基团(例如烷基或芳基)、氢基、氨基、烷氧基、硫基、磷基、卤基和它们的组合(两个或更多个x可以形成稠环或环体系的一部分);每个l独立地选自以下:醚、硫醚和卤烃(两个或更多个l可以形成稠环或环体系的一部分)。
[0178]
在本发明的实施方案中,在式(ii)中,r5、r6、r7、r8、r5’
、r6’
、r7’
、r8’
、r
10
、r
11
和r
12
中每个独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,或一个或多个相邻的r基团可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接
合从而形成额外的环。
[0179]
在本发明的实施方案中,在式(ii)中,r5、r6、r7、r8、r5’
、r6’
、r7’
、r8’
、r
10
、r
11
和r
12
中每个独立地是氢、甲基、乙基、丙基、丁基、戊基、己基或它们的异构体。
[0180]
在本发明的实施方案中,在式(ii)中,r5、r6、r7、r8、r5’
、r6’
、r7’
、r8’
、r
10
、r
11
和r
12
中每个独立地选自甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、二十一烷基、二十二烷基、二十三烷基、二十四烷基、二十五烷基、二十六烷基、二十七烷基、二十八烷基、二十九烷基、三十烷基、苯基、取代的苯基(例如甲基苯基和二甲基苯基)、苄基、取代的苄基(例如甲基苄基)、萘-2-基、环己基、环己烯基、甲基环己基和它们的异构体。
[0181]
在本发明的实施方案中,在式(ii)中,m是hf或zr,e和e'是o,r1和r
1'
中每个独立地为c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子基团,
[0182]
每个r1、r2、r3、r4、r
1'
、r
2'
、r
3'
和r
4'
独立地为氢、c
1-c
20
烃基、c
1-c
20
取代的烃基、杂原子或含杂原子的基团,或r1和r2、r2和r3、r3和r4、r
1'
和r
2'
、r
2'
和r
3'
、r
3'
和r
4'
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环;r9是氢、c
1-c
20
烃基、c
1-c
20
取代的烃基或含杂原子基团,例如氢、甲基、乙基、丙基、丁基、戊基、己基或它们的异构体;
[0183]
每个x独立地选自以下:具有1-20个碳原子的烃基基团(例如烷基或芳基)、氢基、氨基、烷氧基、硫基、磷基、卤基、二烯、胺、膦、醚和它们的组合(两个或更多个x可以形成稠环或环体系的一部分);n是2;m是0;和r5、r6、r7、r8、r5’
、r6’
、r7’
、r8’
、r
10
、r
11
和r
12
中每个独立地为氢、c
1-c
20
烃基、c
1-c
20
取代的烃基、杂原子或含杂原子的基团,或一个或多个相邻的r基团可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环,例如r5、r6、r7、r8、r5’
、r6’
、r7’
、r8’
、r
10
、r
11
和r
12
中每个独立地选自甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、二十一烷基、二十二烷基、二十三烷基、二十四烷基、二十五烷基、二十六烷基、二十七烷基、二十八烷基、二十九烷基、三十烷基、苯基、取代的苯基(例如甲基苯基和二甲基苯基)、苄基、取代的苄基(例如甲基苄基)、萘基、环己基、环己烯基、甲基环己基和它们的异构体。
[0184]
式(i)的优选实施方案是m是zr或hf,q是氮,a1和a1’
都是碳,e和e’都是氧,和r1和r1’
都是c
4-c
20
环状叔烷基。
[0185]
式(i)的优选实施方案是m是zr或hf,q是氮,a1和a1’
都是碳,e和e’都是氧,和r1和r1’
都是金刚烷-1-基或取代的金刚烷-1-基。
[0186]
式(i)的优选实施方案是m是zr或hf,q是氮,a1和a1’
都是碳,e和e’都是氧,和r1和r1’
都是c
6-c
20
芳基。
[0187]
式(ii)的优选实施方案是m是zr或hf,e和e’都是氧,和r1和r1’
都是c
4-c
20
叔烃基。
[0188]
式(ii)的优选实施方案是m是zr或hf,e和e’都是氧,和r1和r1’
都是c
4-c
20
环状叔烷基。
[0189]
式(ii)的优选实施方案是m是zr或hf,e和e’都是氧,和r1和r1’
都是金刚烷-1-基或
取代的金刚烷-1-基。
[0190]
式(ii)的优选实施方案是m是zr或hf,e和e’都是氧,和r1、r1’
、r3和r3’
中每个是金刚烷-1-基或取代的金刚烷-1-基。
[0191]
式(ii)的优选实施方案是m是zr或hf,e和e’都是氧,和r1和r1’
都是c
4-c
20
环状叔烷基,和r7和r7’
都是c
1-c
20
烷基。
[0192]
在式(i)和(ii)的一些优选实施方案中,m是hf。
[0193]
特别可用于本发明的催化剂化合物包括以下中一者或多者:二甲基锆[2',2”'-(吡啶-2,6-二基)双(3-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐)],二甲基铪[2',2”'-(吡啶-2,6-二基)双(3-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐)],二甲基锆[6,6'-(吡啶-2,6-二基双(苯并[b]噻吩-3,2-二基))双(2-金刚烷-1-基)-4-甲基酚盐)],二甲基铪[6,6'-(吡啶-2,6-二基双(苯并[b]噻吩-3,2-二基))双(2-金刚烷-1-基)-4-甲基酚盐)],二甲基锆[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-5-甲基-[1,1'-联苯]-2-酚盐)],二甲基铪[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)金刚烷-1-基)-5-甲基-[1,1'-联苯]-2-酚盐)],二甲基锆[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-4',5-二甲基-[1,1'-联苯]-2-酚盐)]、二甲基铪[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-4',5-二甲基-[1,1'-联苯]-2-酚盐)]。
[0194]
特别可用于本发明的催化剂化合物包括由下式中一者或多者表示的那些:
[0195]
[0196]
[0197]
[0198]
[0199]
[0200]
[0201][0202]
在一些实施方案中,在本文使用的催化剂体系中存在两种或更多种不同的催化剂化合物。在一些实施方案中,在进行本文描述的方法(一种或多种)的反应区中存在两种或更多种不同的催化剂化合物。当在一个反应器中使用两种基于过渡金属化合物的催化剂作为混合的催化剂体系时,优选选择两种过渡金属化合物使得两种是相容的。对于过渡金属化合物优选使用相同的活化剂,然而,可组合使用两种不同的活化剂例如非配位阴离子活化剂和铝氧烷。如果一种或多种过渡金属化合物含有不是氢基、烃基或取代的烃基的x基团,则铝氧烷可在添加非配位阴离子活化剂之前与过渡金属化合物接触。
[0203]
可以以任何比率使用两种过渡金属化合物(前催化剂)。(a)过渡金属化合物与(b)过渡金属化合物的优选摩尔比落入1:1000至1000:1、供选择地1:100至500:1、供选择地1:10至200:1、供选择地1:1至100:1、和供选择地1:1至75:1和供选择地5:1至50:1的(a:b)的范围内。选择的具体比率将取决于选择的确切前催化剂、活化方法和期望的终产物。在特定实施方案中,当使用两种前催化剂(其中两者使用相同活化剂活化)时,可用的摩尔百分比基于前催化剂的分子量为10至99.9%a比0.1至90%b、供选择地25至99%a比0.5至50%b、供选择地50至99%a比1至25%b、和供选择地75至99%a比1至10%b。
[0204]
制备催化剂化合物的方法
[0205]
配体合成
[0206]
可以使用方案1中显示的一般方法制备双(酚)配体。通过化合物a与化合物b的偶联形成双(酚)配体(方法1)可以通过已知的pd-和ni-催化的偶联例如negishi、suzuki或kumada偶联完成。通过化合物c与化合物d的偶联形成双(酚)配体(方法2)也可以通过已知的pd-和ni-催化的偶联例如negishi、suzuki或kumada偶联完成。化合物d可以由化合物e通过化合物e与有机锂试剂或镁金属的反应,之后任选与主族金属卤化物(例如zncl2)或基于硼的试剂(例如b(oipr)3、iprob(pin))反应制备。化合物e可以在非催化反应中通过芳基锂或芳基格氏试剂(化合物f)与二卤代芳烃(化合物g)例如1-溴-2-氯苯反应制备。化合物e也可以在pd-或ni-催化反应中通过芳基锌或芳基硼试剂(化合物f)与二卤代芳烃(化合物g)反应制备。
[0207]
方案1
[0208][0209][0210]
其中m’是第1、2、12或13族元素或取代的元素例如li、mgcl、mgbr、zncl、b(oh)2、b(频那醇酯(pinacolate)),p是保护基团例如甲氧基甲基(mom)、四氢吡喃基(thp)、叔丁基、烯丙基、乙氧基甲基、三烷基甲硅烷基、叔丁基二甲基甲硅烷基或苄基,r是c
1-c
40
烷基、取代基烷基、芳基、叔烷基、环状叔烷基、金刚烷基或取代的金刚烷基和每个x'和x是卤素例如cl、br、f或i。
[0211]
碳烯双(酚)配体的合成
[0212]
在方案2中显示生产碳烯双(酚)配体的一般合成方法。取代的苯酚可为邻位溴代的,然后用已知的苯酚保护基团例如mom、thp、叔丁基二甲基甲硅烷基(tbdms)、苄基(bn)等保护。然后将溴化物转化为硼酸酯(化合物i)或硼酸,其可用于与溴苯胺的suzuki偶联。联苯基苯胺(化合物j)可通过与二溴乙烷反应或与草酰醛缩合而桥连,然后脱保护(化合物k)。与原甲酸三乙酯反应形成亚铵盐,其去质子化成碳烯。
[0213]
方案2
[0214][0215]
向溶解在二氯甲烷中的取代的苯酚(化合物h)添加1当量n-溴代琥珀酰亚胺和0.1当量的二异丙胺。在环境温度下搅拌直至完成之后,反应用10%hcl溶液淬灭。用卤水洗涤有机部分,通过硫酸镁干燥,过滤并在减压下浓缩产生通常为固体的溴代苯酚。将取代的溴代苯酚、甲氧基氯甲烷和碳酸钾溶解在干燥的丙酮中并在环境温度下搅拌直至反应完成。过滤溶液并浓缩滤液从而产生保护的苯酚(化合物i)。供选择地,将取代的溴代苯酚和1当量的二氢吡喃溶解在二氯甲烷中并冷却至0℃。添加催化量的对甲苯磺酸并搅拌反应10min,然后用三甲基胺淬灭。用水和卤水洗涤混合物,然后通过硫酸镁干燥,过滤并在减压下浓缩产生四氢吡喃保护的苯酚。
[0216]
将芳基溴(化合物i)溶解在thf中并冷却至-78℃。缓慢添加正丁基锂,然后添加三甲氧基硼酸酯。使反应在环境温度下搅拌直至完成。去除溶剂并用戊烷洗涤固体硼酸酯。硼酸可由硼酸酯通过用hcl处理制成。将硼酸酯或酸溶解在含有一当量的邻溴苯胺和催化量的四(三苯基膦)钯的甲苯中。添加碳酸钠的水溶液并在回流下加热反应过夜。冷却后,层分离并且用乙酸乙酯提取水层。用卤水洗涤合并的有机部分,干燥(mgso4),过滤并在减压下浓缩。通常使用柱色谱法以纯化偶联产物(化合物j)。
[0217]
苯胺(化合物j)和二溴乙烷(0.5当量)溶解在乙腈中并在60℃下加热过夜。过滤反应并浓缩以产生亚乙基桥连的二苯胺。通过与hcl反应使保护的苯酚脱保护以产生桥连的双氨基(联苯基)酚(化合物k)。
[0218]
将二胺(化合物k)溶解在三乙基原甲酸酯。添加氯化铵并在回流下加热反应过夜。
methylalumoxane类型3a商购得到,涵盖在专利号美国专利号5,041,584中)。另一种可用的铝氧烷是如us 9,340,630、us 8,404,880和us 8,975,209中描述的固体聚甲基铝氧烷。
[0227]
当活化剂是铝氧烷(改性的或未改性的)时,通常最大活化剂量为相对于催化剂化合物(每个金属催化中心)至多5,000倍摩尔过量al/m。最小的活化剂与催化剂化合物之比为1:1摩尔比。供选择的优选范围包括1:1-500:1、供选择地1:1-200:1、供选择地1:1-100:1或供选择地1:1-50:1。
[0228]
在供选择的实施方案中,在本文描述的聚合方法中很少或不使用铝氧烷。优选地,铝氧烷以0摩尔%存在,供选择地铝氧烷以铝与催化剂化合物过渡金属的摩尔比小于500:1、优选小于300:1、优选小于100:1、优选小于1:1存在。
[0229]
离子化/非配位阴离子活化剂
[0230]
术语“非配位阴离子”(nca)意指未与阳离子配位的或者仅与阳离子弱配位的阴离子,由此保持足够的不稳定性以被中性路易斯碱置换。此外,阴离子将不会转移阴离子取代基或片段至阳离子从而使其形成中性过渡金属化合物和来自阴离子的中性副产物。按照本发明可用的非配位阴离子是那些,其是相容的,在平衡其离子电荷+1的意义上稳定过渡金属阳离子,并且还保持足够的不稳定性以允许在聚合过程中置换。术语nca还被定义为包括多组分含有nca的活化剂例如四(五氟苯基)硼酸n,n-二甲基苯铵,其含有酸性阳离子基团和非配位阴离子。术语nca还被定义为包括中性路易斯酸例如三(五氟苯基)硼,其可与催化剂反应以通过夺取阴离子基团以形成活化物质。可以在非配位阴离子中使用或含有可形成相容的弱配位络合物的任何金属或准金属。合适的金属包括但不限于铝、金、和铂。合适的准金属包括但不限于硼、铝、磷和硅。
[0231]
使用中性或离子的离子化活化剂在发明的范围内。还在本发明的范围内的是,单独地或与铝氧烷或改性铝氧烷活化剂组合使用中性的或离子的活化剂。
[0232]
在本发明的实施方案中,活化剂由式(iii)表示:
[0233]
(z)
d+
(a
d-)(iii)
[0234]
其中z是(l-h)或可还原的路易斯酸,l是中性路易斯碱,h是氢,(l-h)
+
是布朗斯台德酸;a
d-是具有电荷d-的非配位阴离子;并且d是1-3的整数(例如1、2或3),优选z是(ar3c
+
),其中ar是芳基或被杂原子、c1-c40烃基或取代的c1-c40烃基取代的芳基。阴离子组分ad-包括具有式[m
k+qn
]
d-的那些,其中k是1、2或3;n是1、2、3、4、5或6(优选1、2、3或4);n-k=d;m是选自元素周期表中第13族的元素,优选硼或铝,和q独立地为氢基、桥连或未桥连的二烷基氨基、卤基、烷氧基、芳氧基、烃基、取代的烃基、卤代烃基、取代的卤代烃基和卤素取代的烃基基团,所述q具有至多40个碳原子(任选条件是q在不多于1次出现时为卤基)。优选地,每个q是具有1-40(例如1-20)个碳原子的氟化烃基基团,更优选每个q是氟化芳基基团例如全氟化芳基基团和最优选每个q是五氟芳基基团或全氟萘-2-基基团。合适的a
d-的实例还包括如美国专利号5,447,895中公开的二硼化合物,其通过引用完全并入本文。
[0235]
当z是活化阳离子(l-h)时,它可为布朗斯台德酸,能够向过渡金属催化前体提供质子,从而产生过渡金属阳离子,包括铵、氧锍和它们的混合物,例如甲胺、苯胺、二甲胺、二乙胺、n-甲基苯胺、n-甲基-4-十九烷基-n-十八烷基苯胺、n-甲基-4-十八烷基-n-十八烷基苯胺、二苯胺、三甲胺、三乙胺、n,n-二甲基苯胺、甲基二苯胺、吡啶、对-溴-n,n-二甲基苯胺、对-硝基-n,n-二甲基苯胺、二(十八烷基)甲胺的铵,来自三乙基膦、三苯基膦
和二苯基膦的来自醚例如二甲醚、二乙醚、四氢呋喃和二氧六环的氧来自硫醚例如二乙硫醚、四氢噻吩的锍,和它们的混合物。
[0236]
在本发明特别有用的实施方案中,活化剂可溶于非芳族烃溶剂例如脂族溶剂。
[0237]
在一种或多种实施方案中,活化剂化合物在正己烷、异己烷、环己烷、甲基环己烷或它们的组合中的20重量%混合物在25℃下形成澄清均匀的溶液,优选地活化剂化合物在正己烷、异己烷、环己烷、甲基环己烷或它们的组合中的30重量%混合物在25℃下形成澄清均匀的溶液。
[0238]
在本发明的实施方案中,本文描述的活化剂具有在25℃下(搅拌2小时)在甲基环己烷中大于10mm(或大于20mm或大于50mm)的溶解度。
[0239]
在本发明的实施方案中,本文描述的活化剂具有在25℃下(搅拌2小时)在异己烷中大于1mm(或大于10mm或大于20mm)的溶解度。
[0240]
在本发明的实施方案中,本文描述的活化剂具有在25℃下(搅拌2小时)在甲基环己烷中大于10mm(或大于20mm或大于50mm)的溶解度和在25℃下(搅拌2小时)在异己烷中大于1mm(或大于10mm或大于20mm)的溶解度。
[0241]
在优选实施方案中,活化剂是可溶于非芳族烃的活化剂化合物。
[0242]
本文可用的可溶于非芳族烃的活化剂化合物包括由式(v)表示的那些:
[0243]
[r1′
r2′
r3′
eh]
d+
[mt
k+qn
]
d-ꢀꢀꢀ
(v)
[0244]
其中:
[0245]
e是氮或磷;
[0246]
d是1、2或3;k是1、2或3;n是1、2、3、4、5或6;n-k=d(优选d是1、2或3;k是3;n是4、5或6);
[0247]
r1′
、r2′
和r3′
独立地为c
1-c
50
烃基基团,任选被一种或多种烷氧基基团、甲硅烷基基团、卤素原子或含卤素基团取代,
[0248]
其中r1′
、r2′
和r3′
总共包含15个或更多个碳原子;
[0249]
mt是选自元素周期表中第13族的元素,例如b或a1;和
[0250]
每个q独立地为氢基、桥连或未桥连的二烷基氨基、卤基、烷氧基、芳氧基、烃基、取代的烃基、卤代烃基、取代卤代烃基或卤素取代的烃基基团。
[0251]
本文可用的可溶于非芳族烃的活化剂化合物包括由式(vi)表示的那些:
[0252]
[r1′
r2′
r3′
eh]
+
[br4′
r5′
r6′
r7′
]-ꢀꢀꢀ
(vi)
[0253]
其中:e是氮或磷;r1′
是甲基基团;r2′
和r3′
独立地为c
4-c
50
烃基基团,任选被一种或多种烷氧基基团、甲硅烷基基团、卤素原子或含卤素基团取代,其中r2′
和r3′
总共包含14个或更多个碳原子;b是硼;和r4′
、r5′
、r6′
和r7′
独立地是氢基、桥连或未桥连的二烷基氨基、卤基、烷氧基、芳氧基、烃基、取代烃基、卤代烃基、取代卤代烃基或卤素取代的烃基基团。
[0254]
本文可用的可溶于非芳族烃的活化剂化合物包括由式(vii)或式(viii)表示的那些:
[0255][0256]
其中:
[0257]
n是氮:
[0258]
r2′
和r3′
独立地为c
6-c
40
烃基基团,任选被一种或多种烷氧基基团、甲硅烷基基团、卤素原子或含卤素基团取代,其中r2′
和r3′
(如果存在的话)总共包含14个或更多个碳原子;
[0259]
r8′
、r9′
和r
10
′
独立地为c
4-c
30
烃基或取代的c
4-c
30
烃基基团;
[0260]
b是硼;
[0261]
和r4′
、r5′
、r6′
和r7′
独立地为氢基、桥连或未桥连的二烷基氨基、卤基、烷氧基、芳氧基、烃基、取代的烃基、卤代烃基、取代卤代烃基或卤素取代的烃基基团。
[0262]
任选地,在任何本文式(v)、(vi)、(vii)或(viii)中,r4′
、r5′
、r6′
和r7′
是五氟苯基。
[0263]
任选地,在任何本文式(v)、(vi)、(vii)或(viii)中,r4′
、r5′
、r6′
和r7′
是全氟萘-2-基。
[0264]
任选地,在本文式(viii)的任何实施方案中,r8′
和r
10
′
是氢原子和r9′
是c
4-c
30
烃基基团,其任选被一种或多种烷氧基基团、甲硅烷基基团、卤素原子或含卤素基团取代。
[0265]
任选地,在本文式(viii)的任何实施方案中,r9′
是c
8-c
22
烃基基团,其任选被一种或多种烷氧基基团、甲硅烷基基团、卤素原子或含卤素基团取代。
[0266]
任选地,在本文式(vii)或(viii)的任何实施方案中,r2′
和r3′
独立地为c
12-c
22
烃基基团。
[0267]
任选地,r1′
、r2′
和r3′
总共包含15或更多个碳原子(例如18或更多个碳原子、例如20或更多个碳原子、例如22或更多个碳原子、例如25或更多个碳原子、例如30或更多个碳原子、例如35或更多个碳原子、例如38或更多个碳原子、例如40或更多个碳原子、例如15至100个碳原子、例如25至75个碳原子)。
[0268]
任选地,r2′
和r3″
总共包含15或更多个碳原子(例如18或更多个碳原子、例如20或更多个碳原子、例如22或更多个碳原子、例如25或更多个碳原子、例如30或更多个碳原子、例如35或更多个碳原子、例如38或更多个碳原子、例如40或更多个碳原子、例如15至100个碳原子、例如25至75个碳原子)。
[0269]
任选地,r8′
、r9′
和r
10
′
总共包含15或更多个碳原子(例如18或更多个碳原子、例如20或更多个碳原子、例如22或更多个碳原子、例如25或更多个碳原子、例如30或更多个碳原子、例如35或更多个碳原子、例如38或更多个碳原子、例如40或更多个碳原子、例如15至100个碳原子、例如25至75个碳原子)。
[0270]
任选地,当q是氟代苯基基团时,则r2′
不是c
1-c
40
线性烷基基团(供选择地r2′
不是任选取代的c
1-c
40
线性烷基基团)。
[0271]
任选地,r4′
、r5′
、r6′
和r7′
中每个是芳基基团(例如苯基或萘-2-基),其中r4′
、r5′
、r6′
和r7′
中至少一个被至少一个氟原子取代,优选r4′
、r5′
、r6′
和r7′
中每个是全氟芳基基团(例如全氟苯基或全氟萘-2-基)。
[0272]
任选地,每个q是芳基基团(例如苯基或萘-2-基),其中至少一个q被至少一个氟原子取代,优选每个q是全氟芳基基团(例如全氟苯基或全氟萘-2-基)。
[0273]
任选地,r1′
是甲基基团;r2′
是c
6-c
50
芳基基团;和r3′
独立地为c
1-c
40
线性烷基或c
5-c
50-芳基基团。
[0274]
任选地,r2′
和r3′
中每个独立地为未取代的或取代有卤素、c
1-c
35
烷基、c
5-c
15
芳基、c
6-c
35
芳烷基、c
6-c
35
烷芳基中至少一种,其中r2和r3总共包含20个或更多个碳原子。
[0275]
任选地,每个q独立地为氢基、桥连或未桥连的二烷基氨基、卤基、烷氧基、芳氧基、烃基、取代的烃基、卤代烃基、取代的卤代烃基或卤素取代的烃基基团,条件是当q是氟代苯基基团时,则r2′
不是c
1-c
40
线性烷基基团,优选r2′
不是任选取代的c
1-c
40
线性烷基基团(供选择地当q是取代的苯基基团时,则r2′
不是c
1-c
40
线性烷基基团,优选地r2′
不是任选取代的c
1-c
40
线性烷基基团)。任选地,当q是氟代苯基基团时(供选择地当q是取代的苯基基团时),则r2′
是间位-和/或对位-取代的苯基基团,其中间位和对位取代基独立地为任选取代的c
1-c
40
烃基基团(例如c
6-c
40
芳基基团或线性烷基基团、c
12-c
30
芳基基团或线性烷基基团或c
10-c
20
芳基基团或线性烷基基团),任选取代的烷氧基基团或任选取代的甲硅烷基基团。优选地,每个q是具有1-30个碳原子的氟化烃基团,更优选每个q是氟化芳基(例如苯基或萘-2-基)基团,并且最优选每个q是全氟芳基(例如苯基或萘-2-基)基团。合适的[mt
k+qn
]
d-的实例还包括如美国专利号5,447,895中公开的二硼化合物,其通过引用完全并入本文。任选地,至少一个q不是取代的苯基。任选地全部q不是取代的苯基。任选地,至少一个q不是全氟苯基。任选地全部q不是全氟苯基。
[0276]
在发明的一些实施方案中,r1′
不是甲基,r2′
不是c
18
烷基和r3′
不是c
18
烷基,供选择地r1′
不是甲基,r2′
不是c
18
烷基和r3′
不是c
18
烷基和至少一个q不是取代的苯基,任选地全部q不是取代的苯基。
[0277]
式(iii)和(v)至(viii)中可用的阳离子组分包括由下式表示的那些:
[0278][0279][0280]
式(iii)和(v)至(viii)中可用的阳离子组分包括由式表示的那些:
[0281]
本文所述活化剂的阴离子组分包括由式[mt
k+qn
]-表示的那些,其中k是1、2或3;n是1、2、3、4、5或6(优选1、2、3或4),(优选地k为3,n为4、5或6,优选当m为b时,n为4);mt是选自元素周期表中第13族的元素,优选为硼或铝,和q独立地是氢基、桥连或未桥连的二烷基氨基、卤基、烷氧基、芳氧基、烃基、取代烃基、卤代烃基、取代卤代烃基和卤素取代的烃基基团,所述q具有至多20个碳原子,条件是q在不多于1次出现时为卤基。优选地,每个q是氟化烃基团,任选具有1-20个碳原子,更优选每个q是氟化芳基基团,并且最优选每个q是全氟芳基基团。优选地,至少一个q不是取代的苯基例如全氟苯基,优选地全部q不是取代的苯基例如全氟苯基。
[0282]
在一种实施方案中,硼酸盐活化剂包含四(七氟萘-2-基)硼酸盐。
[0283]
在一种实施方案中,硼酸盐活化剂包含四(五氟苯基)硼酸盐。
[0284]
用于在本文所述非配位阴离子活化剂中使用的阴离子包括由以下式(7)表示的那些:
[0285][0286]
其中:
[0287]
m*是第13族原子,优选b或al,优选为b;
[0288]
每个r
11
独立地是卤基,优选氟基;
[0289]
每个r
12
独立地是卤基、c
6-c
20
取代的芳族烃基基团或具有式-o-si-ra的甲硅烷氧基基团,其中ra是c
1-c
20
烃基或烃基甲硅烷基基团,优选r
12
是氟基或全氟苯基基团;
[0290]
每个r
13
是卤基、c
6-c
20
取代的芳族烃基基团或具有式-o-si-ra的甲硅烷氧基基团,其中ra是c
1-c
20
烃基或烃基甲硅烷基基团,优选r
13
是氟基或c6全氟芳族烃基基团;
[0291]
其中r
12
和r
13
可形成一个或多个饱和或不饱和的,取代或未取代的环,优选r
12
和r
13
形成全氟苯基环。优选地阴离子具有大于700g/mol的分子量,并且优选地m*原子上的取代基中至少三个每个具有大于180立方的分子体积。
[0292]“分子体积”在本文用作溶液中活化剂分子的空间立体体积的近似值。比较具有不同分子体积的取代基使具有较小分子体积的取代基与具有较大分子体积的取代基相比被认为“体积更小”。相反,具有较大分子体积的取代基可以被认为比具有较小分子体积的取代基“体积更大”。
[0293]
可以按照“a simple“back of the envelope”method for estimating the densities and molecular volumes of liquids and solids,”journal of chemical education,第71(11)卷,1994年11月,第962-964页中所报道的来计算分子体积。使用下式计算以立方为单位的分子体积(mv):mv=8.3vs,其中vs是缩放体积(scaled volume)。vs是构成原子相对体积之和,并且使用以下表a的相对体积由取代基的分子式计算。对于稠环,每个稠环vs降低7.5%。阴离子的计算总mv是每个取代基的mv的总和,例如全氟苯基的mv是mv是并且四(全氟苯基)硼酸盐的计算总mv是四倍或
[0294]
表a
[0295]
元素相对体积h1第一短周期,li至f2第二短周期,na至cl4第一长周期,k至br5第二长周期,rb至i7.5第三长周期,cs至bi9
[0296]
在以下表b中显示本文可用的示例性阴离子和它们各自的缩放体积和分子体积。虚键表示结合至硼。
[0297]
表b
[0298]
[0299][0300]
可以以使用例如[m2hth]+[nca]-的离子对的形式将活化剂添加至聚合,其中二(氢化牛脂)甲胺(“m2hth”)阳离子与过渡金属络合物上的碱性离去基团反应,以形成过渡金属络合物阳离子和[nca]-。供选择地,可以将过渡金属络合物与中性nca前体例如b(c6f5)3反应,其从络合物夺取阴离子基团以形成活化的物质。可用的活化剂包括[四(五氟苯基)硼酸]二(氢化牛脂)甲基铵(即[m2hth]b(c6f5)4)和[四(五氟苯基)硼酸]二(十八烷基)甲苯基铵(即[dodth]b(c6f5)4)。
[0301]
特别可用于本发明的活化剂化合物包括以下一种或多种:
[0302]
[四(全氟苯基)硼酸]n,n-二(氢化牛脂)甲基铵、
[0303]
[四(全氟苯基)硼酸]n-甲基-4-十九烷基-n-十八烷基苯铵、
[0304]
[四(全氟苯基)硼酸]n-甲基-4-十六烷基-n-十八烷基苯铵、
[0305]
[四(全氟苯基)硼酸]n-甲基-4-十四烷基-n-十八烷基苯铵、
[0306]
[四(全氟苯基)硼酸]n-甲基-4-十二烷基-n-十八烷基苯铵、
[0307]
[四(全氟苯基)硼酸]n-甲基-4-癸基-n-十八烷基苯铵、
[0308]
[四(全氟苯基)硼酸]n-甲基-4-辛基-n-十八烷基苯铵、
[0309]
[四(全氟苯基)硼酸]n-甲基-4-己基-n-十八烷基苯铵、
[0310]
[四(全氟苯基)硼酸]n-甲基-4-丁基-n-十八烷基苯铵、
[0311]
[四(全氟苯基)硼酸]n-甲基-4-十八烷基-n-癸基苯铵、
[0312]
[四(全氟苯基)硼酸]n-甲基-4-十九烷基-n-十二烷基苯铵、
[0313]
[四(全氟苯基)硼酸]n-甲基-4-十九烷基-n-十四烷基苯铵、
[0314]
[四(全氟苯基)硼酸]n-甲基-4-十九烷基-n-十六烷基苯铵、
[0315]
[四(全氟苯基)硼酸]n-乙基-4-十九烷基-n-十八烷基苯铵、
[0316]
[四(全氟苯基)硼酸]n-甲基-n,n-二(十八烷基)铵、
[0317]
[四(全氟苯基)硼酸]n-甲基-n,n-二(十六烷基)铵、
[0318]
[四(全氟苯基)硼酸]n-甲基-n,n-二(十四烷基)铵、
[0319]
[四(全氟苯基)硼酸]n-甲基-n,n-二(十二烷基)铵、
[0320]
[四(全氟苯基)硼酸]n-甲基-n,n-二癸基铵、
[0321]
[四(全氟苯基)硼酸]n-甲基-n,n-二辛基铵、
[0322]
[四(全氟苯基)硼酸]n-乙基-n,n-二(十八烷基)铵、
[0323]
[四(全氟苯基)硼酸]n,n-二(十八烷基)甲苯基铵、
[0324]
[四(全氟苯基)硼酸]n,n-二(十六烷基)甲苯基铵、
[0325]
[四(全氟苯基)硼酸]n,n-二(十四烷基)甲苯基铵、
[0326]
[四(全氟苯基)硼酸]n,n-二(十二烷基)甲苯基铵、
[0327]
[四(全氟苯基)硼酸]n-十八烷基-n-十六烷基-甲苯基铵、
[0328]
[四(全氟苯基)硼酸]n-十八烷基-n-十六烷基-甲苯基铵、
[0329]
[四(全氟苯基)硼酸]n-十八烷基-n-十四烷基-甲苯基铵、
[0330]
[四(全氟苯基)硼酸]n-十八烷基-n-十二烷基-甲苯基铵、
[0331]
[四(全氟苯基)硼酸]n-十八烷基-n-癸基-甲苯基铵、
[0332]
[四(全氟苯基)硼酸]n-十六烷基-n-十四烷基-甲苯基铵、
[0333]
[四(全氟苯基)硼酸]n-十六烷基-n-十二烷基-甲苯基铵、
[0334]
[四(全氟苯基)硼酸]n-十六烷基-n-癸基-甲苯基铵、
[0335]
[四(全氟苯基)硼酸]n-十四烷基-n-十二烷基-甲苯基铵、
[0336]
[四(全氟苯基)硼酸]n-十四烷基-n-癸基-甲苯基铵、
[0337]
[四(全氟苯基)硼酸]n-十二烷基-n-癸基-甲苯基铵、
[0338]
[四(全氟苯基)硼酸]n-甲基-n-十八烷基苯铵、
[0339]
[四(全氟苯基)硼酸]n-甲基-n-十六烷基苯铵、
[0340]
[四(全氟苯基)硼酸]n-甲基-n-十四烷基苯铵、
[0341]
[四(全氟苯基)硼酸]n-甲基-n-十二烷基苯铵、
[0342]
[四(全氟苯基)硼酸]n-甲基-n-癸基苯铵、和
[0343]
[四(全氟苯基)硼酸]n-甲基-n-辛基苯铵。
[0344]
额外可用的活化剂和合成可溶于非芳族烃的活化剂描述于2019年4月25日提交的ussn 16/394,166、2019年4月25日提交的ussn 16/394,186和2019年4月25日提交的ussn 16/394,197,其通过引用并入本文。
[0345]
同样,特别可用的活化剂还包括四(五氟苯基)硼酸二甲基苯铵和四(七氟-2-萘-2-基)硼酸二甲基苯铵。关于可用的活化剂的更详细描述请参阅wo 2004/026921第72页第[00119]段至第81页第[00151]段。在本发明实践中使用的额外特别可用的活化剂的列表可见于wo2004/046214的第72页第[00177]段至第74页第[00178]段。
[0346]
关于可用的活化剂的描述,请参阅us 8,658,556和us 6,211,105。
[0347]
用于本文使用的优选活化剂还包括四(五氟苯基)硼酸n-甲基-4-十九烷基-n-十八烷基苯铵、四(全氟萘-2-基)硼酸n-甲基-4-十九烷基-n-十八烷基苯铵、四(全氟萘-2-基)硼酸n,n-二甲基苯铵、四(全氟联苯基)硼酸n,n-二甲基苯铵、四(全氟苯基)硼酸n,n-二甲基苯铵、四(3,5-双(三氟甲基)苯基)硼酸n,n-二甲基苯铵、四(全氟萘-2-基)硼酸三苯基碳四(全氟联苯基)硼酸三苯基碳四(3,5-双(三氟甲基)苯基)硼酸三苯基碳四(全氟苯基)硼酸三苯基碳[me3nh
+
][b(c6f5)4-]、1-(4-(三(五氟苯基)硼酸)-2,3,5,6-四氟苯基)吡咯烷和四(五氟苯基)硼酸盐、4-(三(五氟苯基)硼酸)-2,3,5,6-四氟吡啶。
[0348]
在优选实施方案中,活化剂包含三芳基碳(例如四苯基硼酸三苯基碳四(五氟苯基)硼酸三苯基碳四-(2,3,4,6-四氟苯基)硼酸三苯基碳四(全氟萘-2-基)硼酸三苯基碳四(全氟联苯基)硼酸三苯基碳四(3,5-双(三氟甲基)苯基)硼酸三苯基碳)。
[0349]
在另一实施方案中,活化剂包含以下中一种或多种:四(五氟苯基)硼酸三烷基铵、四(五氟苯基)硼酸n,n-二烷基苯铵、四(五氟苯基)硼酸-二(十八烷基)甲基铵、四(全氟萘-2-基)硼酸-二(十八烷基)甲基铵、四(五氟苯基)硼酸n,n-二甲基-(2,4,6-三甲基苯铵)、四(2,3,4,6-四氟苯基)硼酸三烷基铵、四(2,3,4,6-四氟苯基)硼酸n,n-二烷基苯铵、四(全氟萘-2-基)硼酸三烷基铵、四(全氟萘-2-基)硼酸n,n-二烷基苯铵、四(全氟联苯基)硼酸三烷基铵、四(全氟联苯基)硼酸n,n-二烷基苯铵、四(3,5-双(三氟甲基)苯基)硼酸三烷基铵、四(3,5-双(三氟甲基)苯基)硼酸n,n-二烷基苯铵、四(3,5-双(三氟甲基)苯基)硼酸n,n-二烷基-(2,4,6-三甲基苯铵)、四(五氟苯基)硼酸二(异丙基)铵,(其中烷基是甲基、乙基、丙基、正丁基、仲丁基或叔丁基)。
[0350]
通常的活化剂与催化剂之比例如所有nca活化剂与催化剂之比为约1:1摩尔比。供选择的优选范围包括0.1:1-100:1、供选择地0.5:1-200:1、供选择地1:1-500:1、供选择地1:1-1000:1。特别可用的范围是0.5:1-10:1、优选1:1至5:1。
[0351]
还在本公开内容的范围内的是催化剂化合物可与铝氧烷和nca的组合合并(例如参阅us 5,153,157,us 5,453,410,ep 0 573 120 b1,wo 1994/07928和wo 1995/014044(其公开内容通过引用全部并入本文),其讨论了使用铝氧烷与离子化活化剂的组合)。
[0352]
任选的清除剂、助活化剂、链转移剂
[0353]
除活化剂化合物之外,可以使用清除剂或助活化剂。清除剂是通常添加从而通过
清除杂质来促进聚合的化合物。一些清除剂还可以充当活化剂,并且可以被称作助活化剂。还可以结合活化剂使用助活化剂(其不是清除剂)以便形成活性催化剂。在一些实施方案中,助活化剂可与过渡金属化合物预混合以形成烷基化的过渡金属化合物。
[0354]
助活化剂可包括铝氧烷例如甲基铝氧烷,改性铝氧烷例如改性甲基铝氧烷和烷基铝例如三甲基铝、三异丁基铝、三乙基铝、和三异丙基铝、三正己基铝、三正辛基铝、三正癸基铝或三正十二烷基铝。当前催化剂不是二烃基或二氢基络合物时,通常连同路易斯酸活化剂和离子活化剂使用助活化剂。有时助活化剂还用作清除剂从而使进料或反应器中的杂质去活化。
[0355]
可以被用作清除剂或助活化剂的烷基铝或有机铝化合物包括例如三甲基铝、三乙基铝、三异丁基铝、三正己基铝、三正辛基铝和二烷基锌例如二乙基锌。
[0356]
可以在本文描述的方法和或组合物中使用链转移剂。可用的链转移剂通常是氢、烷基铝氧烷,由式alr3、znr2表示的化合物(其中每个r独立地是c
1-c8脂族基团,优选甲基、乙基、丙基、丁基、戊基、己基辛基或它们的异构体)或它们的组合,例如二乙基锌、三甲基铝、三异丁基铝、三辛基铝或它们的组合。
[0357]
聚合方法
[0358]
就本文描述的聚合方法而言,术语“连续的”意指在没有中断或停止的情况下运行的系统。例如,产生聚合物的连续方法将是这样的方法,其中将反应物连续引入一个或多个反应器并且连续地抽出聚合物产物。
[0359]
溶液聚合意指其中聚合物溶解在液体聚合介质(例如惰性溶剂或单体(一种或多种)或它们的共混物)中的聚合方法。溶液聚合通常是均相的。均相聚合是其中聚合物产物溶解在聚合介质中的聚合。如在j.vladimir oliveira等人(2000)ind.eng.chem.res.,第29卷,第4627页中描述,这样的体系优选不是浑浊的。
[0360]
本体聚合意指其中将所聚合的单体和/或共聚单体用作溶剂或稀释剂,几乎没有或没有使用惰性溶剂作为溶剂或稀释剂的聚合方法。小部分的惰性溶剂可用作催化剂和清除剂的载体。本体聚合体系含有小于25重量%的惰性溶剂或稀释剂,优选小于10重量%,优选小于1重量%,优选0重量%。如果进行本体聚合方法,使得聚合物保持溶解在聚合介质中,则可以被认为是一类均相聚合方法。
[0361]
在本文的实施方案中,本发明涉及溶液聚合方法,其中丙烯单体和任选一种或多种c4或更高级α-烯烃共聚单体与如以上描述的包含活化剂和至少一种催化剂化合物的催化剂体系接触。可以按照任何顺序合并催化剂化合物和活化剂,并且通常在与单体接触之前合并催化剂化合物和活化剂。经常这样的溶液聚合方法被称作均相聚合方法。
[0362]
本文可用的单体包括取代的或未取代的c
3-c
40
α-烯烃、优选c
3-c
20
α-烯烃、优选c
3-c
12
α-烯烃、优选丙烯、丁烯、戊烯、己烯、庚烯、辛烯、壬烯、癸烯、十一碳烯、十二碳烯和它们的异构体。在本发明的优选实施方案中,单体包含丙烯和任选的共聚单体,其包含一种或多种c
4-c
40
烯烃、优选c
4-c
20
烯烃或优选c
6-c
12
烯烃。c
4-c
40
烯烃单体可以是线性、支化或环状的。c
4-c
40
环状烯烃可以是张紧的(strained)或未张紧的(unstrained),单环或多环的,并且可以任选地包括杂原子和/或一个或多个官能团。在另一优选实施方案中,单体包含丙烯和任选的共聚单体,其包含一种或多种c
4-c
40
烯烃、优选c
4-c
20
烯烃或优选c
4-c8烯烃。c
4-c
40
烯烃共聚单体可以是线性、支化或环状的。c
4-c
40
环状烯烃可以是张紧的或未张紧的,单环
或多环的,并且可以任选地包括杂原子和/或一个或多个官能团。
[0363]
示例性c
3-c
40
烯烃单体和任选的共聚单体包括丙烯、丁烯、戊烯、己烯、庚烯、辛烯、壬烯、癸烯、十一碳烯、十二碳烯、降冰片烯、环丁烯、环戊烯、环庚烯、环辛烯、环十二碳烯、它们的取代衍生物、和它们的异构体,优选己烯、庚烯、辛烯、壬烯、癸烯、十二碳烯、环辛烯、5-甲基环戊烯、环戊烯、降冰片烯、5-乙叉基-2-降冰片烯、和它们各自的同系物和衍生物。
[0364]
在实施方案中,一种或多种二烯以至多10重量%、优选以0.00001至1.0重量%、优选0.002至0.5重量%、甚至更优选0.003至0.2重量%存在于本文生产的聚合物中,基于该组合物的总重量。在一些实施方案中,将500ppm或更少、优选400ppm或更少、优选300ppm或更少的二烯添加至聚合中。在其它实施方案中,将至少50ppm或100ppm或更多或150ppm或更多的二烯添加至聚合中。
[0365]
优选的可用于本发明的二烯烃单体包括具有至少两个不饱和键的任何烃结构,优选c
5-c
30
。在某些实施方案中,二烯烃单体含有至少两个容易并入聚合物中的不饱和键。在某些实施方案中,二烯烃单体含有仅一个容易并入聚合物中的不饱和键。二烯可以是共轭的或非共轭的、无环的或环状的。优选地,二烯是非共轭的。二烯可包括5-乙叉基-2-降冰片烯(enb)、5-乙烯基-2-降冰片烯(vnb)、1,4-己二烯、5-亚甲基-2-降冰片烯(mnb)、1,6-辛二烯、3,7-二甲基-1,6-辛二烯(mod)、1,3-环戊二烯、1,4-环己二烯、二环戊二烯(dcpd)和它们的组合。其它示例性二烯包括丁二烯、戊二烯、己二烯、庚二烯、辛二烯、壬二烯、癸二烯、十一碳二烯、十二碳二烯、十三碳二烯、十四碳二烯、十五碳二烯、十六碳二烯、十七碳二烯、十八碳二烯、十九碳二烯、二十碳二烯、二十一碳二烯、二十二碳二烯、二十三碳二烯、二十四碳二烯、二十五碳二烯、二十六碳二烯、二十七碳二烯、二十八碳二烯、二十九碳二烯、三十碳二烯和它们的异构体。α,ω-二烯的实例包括1,6-庚二烯、1,7-辛二烯、1,8-壬二烯、1,9-癸二烯、1,10-十一碳二烯、1,11-十二碳二烯、1,12-十三碳二烯、1,13-十四碳二烯和二乙烯基苯。低分子量聚丁二烯(mw小于1,000g/mol)还可以用作二烯,其有时还称作多烯。环状二烯包括在各个环位置有或没有取代基的环戊二烯、降冰片二烯、5-乙叉基-2-降冰片烯、5-乙烯基-2-降冰片烯、二乙烯基苯、二环戊二烯或含更高级环的二烯烃。
[0366]
在一些实施方案中,二烯优选是5-乙叉基-2-降冰片烯、5-乙烯基-2-降冰片烯、降冰片二烯、1,4-己二烯、5-亚甲基-2-降冰片烯、1,6-辛二烯、3,7-二甲基-1,6-辛二烯、二环戊二烯、环戊二烯和它们的组合。
[0367]
可采用本领域已知的任何方式进行本发明的聚合方法。可使用本领域已知的任何悬浮、均相、本体或溶液聚合方法。这样的方法可采用间歇、半间歇或连续模式运行。均相聚合方法是优选的。(均相聚合方法优选是其中至少90重量%的产物可溶于反应介质中的方法。)在一些实施方案中,本体均相方法是优选的。本体方法优选是所有反应器的进料中单体浓度为70体积%或更大的方法。在可用的实施方案中,该方法是其中添加溶剂的溶液方法。供选择地,在反应介质中不存在或没有添加溶剂或稀释剂(除了少量被用作催化剂体系或其它添加剂的载体,或者通常与单体一起发现的量,例如丙烯中的丙烷)。
[0368]
用于聚合的合适的稀释剂/溶剂包括非配位惰性液体。实例包括直链和支链烃,例如异丁烷、丁烷、戊烷、异戊烷、己烷、异己烷、庚烷、辛烷、十二烷和它们的混合物;环状和脂环烃,例如环己烷、环庚烷、甲基环己烷、甲基环庚烷和它们的混合物,例如可商购获得的(isopar
tm
流体);全卤化烃,例如全氟化的c4-10烷烃、氯苯,和芳族和烷基取代的芳族化合
物,例如苯、甲苯、均三甲苯和二甲苯。合适的溶剂还包括可以充当单体或共聚单体的液体烯烃,包括丙烯。在优选实施方案中,脂族烃溶剂用作溶剂,例如异丁烷、丁烷、戊烷、异戊烷、己烷、异己烷、庚烷、辛烷、十二烷、和它们的混合物;环状和脂环族烃,例如环己烷、环庚烷、甲基环己烷、甲基环庚烷、和它们的混合物。在另一种实施方案中,溶剂不是芳族的,优选芳族化合物以小于1重量%、优选小于0.5重量%、优选小于0重量%存在于溶剂中,基于溶剂的重量。
[0369]
在优选实施方案中,用于聚合的丙烯的进料浓度为60体积%溶剂或更少,优选40体积%或更少,或优选20体积%或更少,基于进料料流的总体积。
[0370]
优选的聚合可在适合于获得期望丙烯聚合物的任何温度和/或压力下进行。典型的温度和/或压力包括在约0℃-约300℃、优选约20℃-约200℃、优选约70℃-约200℃、优选约90℃-约180℃、优选约100℃-约170℃、优选约120℃-约170℃范围内的温度,和在约0.35mpa-约18mpa、优选约0.45mpa-约6mpa或优选约0.5mpa-约4mpa范围内的压力。
[0371]
供选择地,典型的温度和/或压力包括在约0℃-约300℃、优选约20℃-约200℃、优选约35℃-约150℃、优选约40℃-约120℃、优选约45℃-约80℃范围内的温度,和在约0.35mpa-约18mpa、优选约0.45mpa-约6mpa或优选约0.5mpa-约4mpa范围内的压力。
[0372]
在典型的聚合中,反应的运行时间为至多300分钟,优选在约5-250分钟或优选约10-120分钟的范围内。在连续聚合中运行时间与平均停留时间相同。
[0373]
在一些实施方案中,氢气以0.001至50psig(0.007至345kpa)、优选0.01-25psig(0.07至172kpa)、更优选0.1至10psig(0.7至70kpa)的分压存在于聚合反应器中。
[0374]
在供选择的实施方案中,催化剂活性为至少10,000g/mmol/小时、优选100,000g/mmol/小时或更大、优选500,000g/mmol/小时或更大、优选1,000,000g/mmol/小时或更大、优选2,000,000g/mmol/小时或更大、优选5,000,000g/mmol/小时或更大。在供选择的实施方案中,催化剂生产率为至少10,000g聚合物/g催化剂或更大、优选50,000g聚合物/g催化剂或更大、优选100,000g聚合物/g催化剂或更大、优选200,000g聚合物/g催化剂或更大、优选500,000g聚合物/g催化剂或更大。在供选择的实施方案中,烯烃单体的转化率为至少10%,基于聚合物收率和进入反应区的单体的重量,优选20%或更多、优选30%或更多、优选50%或更多、优选80%或更多。在优选实施方案中,在生产聚合物的方法中很少或不使用铝氧烷。优选地,铝氧烷以0mol%存在,供选择地铝氧烷以铝与过渡金属的摩尔比小于500:1、优选小于300:1、优选小于100:1、优选小于1:1存在。
[0375]
在一些实施方案中,在生产聚合物的方法中很少或不使用清除剂。优选地,清除剂(例如三烷基铝)以0mol%存在,供选择地清除剂以清除剂金属与过渡金属的摩尔比小于100:1、优选小于50:1、优选小于15:1、优选小于10:1存在。
[0376]
在优选实施方案中,均相(溶液或本体)丙烯聚合:1)在0至300℃(优选25至150℃,优选40至140℃,优选50至130℃,优选60至120℃,供选择地的65至110℃,供选择地70至100℃)的温度下进行;2)在大气压力至18mpa(优选0.35至16mpa,优选0.45-14mpa,优选0.5-12mpa,优选0.5-10mpa)的压力下进行;3)在脂族烃溶剂(例如异丁烷、丁烷、戊烷、异戊烷、己烷、异己烷、庚烷、辛烷、癸烷和它们的混合物;环状和脂环烃例如环己烷、环庚烷、甲基环己烷、甲基环庚烷和它们的混合物;优选其中芳族化合物优选以小于1重量%,优选小于0.5重量%,优选以0重量%存在于溶剂中,基于溶剂的重量)中进行;4)其中在聚合中使用的催
化剂体系包含小于0.5mol%,优选0mol%铝氧烷,供选择地铝氧烷以铝与过渡金属的摩尔比小于500:1,优选小于300:1,优选小于100:1,优选小于1:1存在;5)聚合优选发生在一个反应区中;6)催化剂生产率为至少10,000g聚合物/g催化剂(优选至少100,000g聚合物/g催化剂、优选至少200,000g聚合物/g催化剂、优选至少500,000g聚合物/g催化剂、优选至少1,000,000g聚合物/g催化剂);7)任选地不存在清除剂(例如三烷基铝化合物)(例如以0mol%存在,供选择地清除剂以清除剂金属与过渡金属的摩尔比小于100:1,优选小于50:1,优选小于15:1,优选小于10:1存在);和8)任选地氢气以0.001至50psig(0.007至345kpa)(优选0.01-25psig(0.07至172kpa),更优选0.1至10psig(0.7至70kpa))的分压存在于聚合反应器中。在优选实施方案中,聚合中使用的催化剂体系包含不多于一种催化剂化合物/反应区。“反应区”(还称作“聚合区”)是其中发生聚合的容器,例如间歇式反应器。当以串联或并联构造使用多个反应器时,每个反应器被认为是单独的聚合区。对于在间歇式反应器和连续反应器两者中的多阶段聚合而言,每个聚合阶段被认为是单独的聚合区。在优选实施方案中,在一个反应区中发生聚合。在供选择的实施方案中,聚合发生在两个反应区中,其中每个区域使用相同的聚合催化剂。
[0377]
在us 7,812,104中定义术语“致密流体”“固体-流体相转变温度”“相转变”“固体-流体相转变压力”“流体-流体相转变压力”“流体-流体相转变温度”“浊点”“浊点压力”“浊点温度”“超临界状态”“临界温度(tc)”“临界压力(pc)”“超临界聚合”“均相聚合”“均相聚合体系”,其通过引用并入本文。
[0378]
超临界聚合意为其中聚合体系在致密(即它的密度为300kg/m3或更高)超临界状态下的聚合方法。
[0379]
超溶液聚合或超溶液聚合体系是其中聚合发生在65℃至150℃的温度和250至5,000psi(1.72至34.5mpa)之间的压力下的一种,优选超溶液聚合聚合c
3-c
20
单体(优选丙烯),并具有:1)0至20重量%的一种或多种选自c
4-c
12
烯烃的共聚单体(基于进料中存在的所有单体和共聚单体的重量),2)20-65重量%稀释剂或溶剂,基于聚合反应器进料的总重量,3)0至5重量%清除剂,基于聚合反应器进料的总重量,4)烯烃单体和任何共聚单体以15重量%或更大存在于聚合体系中,5)聚合温度大于聚合体系的固体-流体相转变温度并大于聚合体系的浊点压力以下1mpa的压力,然而条件是聚合发生在:(1)低于聚合体系的临界温度的温度下,或(2)低于聚合体系的临界压力的压力下。
[0380]
在本发明的优选实施方案中,聚合方法在均相(例如溶液、超溶液或超临界)条件下进行,优选包括约60℃至约200℃、优选65℃至195℃、优选90℃至190℃、优选从大于100℃至约180℃例如105℃至170℃、优选约110℃-约160℃的温度。方法可以在超过1.7mpa的压力下,尤其在包括在1.7mpa和30mpa之间的压力的超溶液条件下,或尤其在包括在15mpa和1,500mpa之间的压力的超临界条件下进行,尤其是当单体组合物包含丙烯或丙烯与至少一种c
4-c
20
α-烯烃的混合物时。在优选实施方案中,单体是丙烯和丙烯以15重量%或更大、优选以20重量%或更大、优选以30重量%或更大、优选以40重量%或更大、优选以50重量%或更大、优选以60重量%或更大、优选以70重量%或更大、优选80重量%或更大存在于聚合体系中。在供选择的实施方案中,单体和存在的任何共聚单体以15重量%或更大、优选以20重量%或更大、优选以30重量%或更大、优选以40重量%或更大、优选以50重量%或更大、优选以60重量%或更大、优选以70重量%或更大、优选80重量%或更大存在于聚合体系中。
[0381]
在本发明的优选实施方案中,聚合方法在包括温度为约65℃-约150℃、优选约75℃-约140℃、优选约90℃-约140℃、更优选约100℃-约140℃和压力在1.72mpa和35mpa之间、优选在5和30mpa之间的超溶液条件下进行。
[0382]
在本发明的另一特别实施方案中,聚合方法在包括温度为约90℃-约200℃和压力在15mpa和1,500mpa之间、优选在20mp和140mpa之间的超临界条件(优选均相超临界条件,例如高于超临界点和高于浊点)下进行。
[0383]
本发明特别的实施方案涉及聚合丙烯的方法,包括在60℃或更高的温度和在15mpa(150bar或约2,175psi)至1,500mpa(15,000bar或约217,557psi)之间的压力下使一种或多种具有三个或更多个碳原子的烯烃单体与以下接触:1)催化剂体系,2)任选的一种或多种共聚单体,3)任选的稀释剂或溶剂,和4)任选的清除剂,其中:a)烯烃单体和任何共聚单体以40重量%或更多存在于聚合体系中,b)丙烯以80重量%或更大存在,基于进料中存在的所有单体和共聚单体的重量,c)聚合发生在高于聚合体系的固体-流体相转变温度的温度和压力不低于聚合体系的浊点压力以下2mpa下发生。
[0384]
本发明的另一特别实施方案涉及聚合烯烃的方法,包括在65℃至150℃的压力和在250至5,000psi之间(1.72至34.5mpa)的压力下使丙烯与以下接触:1)催化剂体系,2)0至20重量%的一种或多种选自c
4-c
12
烯烃的共聚单体(基于进料中存在的所有单体和共聚单体的重量),和3)20-65重量%稀释剂或溶剂,基于聚合反应器进料的总重量,和4)0至5重量%清除剂,基于聚合反应器进料的总重量,其中:a)烯烃单体和任何共聚单体以15重量%或更大存在于聚合体系,b)丙烯以80重量%或更大存在,基于进料中存在的所有单体和共聚单体的重量,c)聚合发生在高于聚合体系的固体-流体相转变温度的温度和高于大于聚合体系的浊点压力以下1mpa的压力,然而条件是聚合发生在:(1)低于聚合体系的临界温度的温度下,或(2)低于聚合体系的临界压力的压力下。
[0385]
在另一实施方案中,聚合发生在高于聚合体系的固体-流体相转变温度的温度和不低于聚合体系的浊点压力(cpp)以下10mpa(优选不低于cpp以下8mpa、优选不低于cpp以下6mpa、优选不低于cpp以下4mpa、优选不低于cpp以下2mpa)的压力下。优选地,聚合发生在高于聚合体系的固体-流体相转变温度和压力,并优选高于聚合体系的流体-流体相转变温度和压力的温度和压力下。
[0386]
在供选择实施方案中,聚合发生在高于聚合体系的固体-流体相转变温度的温度和大于聚合体系的浊点压力(cpp)以下1mpa(优选大于cpp以下0.5mpa、优选大于cpp)的压力下,并且聚合发生在:(1)低于聚合体系的临界温度的温度下,或(2)低于聚合体系的临界压力的压力下,优选聚合发生在低于聚合体系临界点的压力和温度下,最优选聚合发生在:(1)低于聚合体系的临界温度的温度下,和(2)低于聚合体系的临界压力的压力下。
[0387]
供选择地,聚合发生在高于聚合体系的固体-流体相转变温度和压力的温度和压力下。供选择地,聚合发生在高于聚合体系的流体-流体相转变温度和压力的温度和压力下。供选择地,聚合发生在低于聚合体系的流体-流体相转变温度和压力的温度和压力下。
[0388]
在另一实施方案中,聚合体系优选是均匀单相聚合体系,优选均匀致密的流体聚合体系。
[0389]
在另一实施方案中,反应温度优选低于聚合体系的临界温度。优选地,温度高于在反应器压力下含有聚合物的流体反应介质的固体-流体相转变温度,或比在反应器压力下
含有聚合物的流体反应介质的固体-流体相转变温度高至少5℃,或比在反应器压力下含有聚合物的流体反应介质的固体-流体相转变点高至少10℃。在另一实施方案中,温度大于反应器压力下单相流体反应介质的浊点,或大于反应器压力下流体反应介质的浊点2℃或更高。在又一实施方案中,温度在60℃和150℃之间、在60℃和140℃之间、在70℃和130℃之间或在80℃和130℃之间。在一种实施方案中,温度大于60℃、65℃、70℃、75℃、80℃、85℃、90℃、95℃、100℃、105℃或110℃。在另一实施方案中,温度低于150℃、140℃、130℃或120℃。在另一实施方案中,浊点温度低于聚合体系的超临界温度或在70℃和150℃之间。
[0390]
在另一实施方案中,聚合发生在大于聚合体系的固体-流体相转变温度的温度和压力下,优选聚合发生在比固体-流体相转变温度高至少5℃(优选高至少10℃、优选高至少20℃)的温度下和在比聚合体系的浊点压力高至少2mpa(优选高至少5mpa、优选高至少10mpa)的压力下。在优选实施方案中,聚合发生在大于聚合体系的流体-流体相转变压力(比流体-流体相转变压力优选高至少2mpa、优选高至少5mpa、优选高至少10mpa)的压力下。供选择地,聚合发生在比固体-流体相转变温度高至少5℃(优选高至少10℃、优选高至少20℃)的温度下和在比聚合体系的流体-流体相转变压力高(优选高至少2mpa、优选高至少5mpa、优选高至少10mpa)的压力下。
[0391]
在另一实施方案中,聚合发生的温度高于在反应器压力下含有聚合物的流体反应介质的固体-流体相转变温度,优选比在反应器压力下含有聚合物的流体反应介质的固体-流体相转变温度高至少5℃,或优选比在反应器压力下含有聚合物的流体反应介质的固体-流体相转变点高至少10℃。
[0392]
在另一可用的实施方案中,聚合发生的温度高于在反应器压力下单相流体反应介质的浊点,更优选比在反应器压力下流体反应介质的浊点高2℃或更大(优选5℃或更大、优选10℃或更大、优选30℃或更大)。供选择地,在另一可用的实施方案中,聚合发生的温度高于在反应器压力下聚合体系的浊点,更优选比聚合体系的浊点高2℃或更大(优选5℃或更大、优选10℃或更大、优选30℃或更大)。
[0393]
在另一实施方案中,聚合工艺温度高于在反应器压力下含有聚合物的流体聚合体系的固体-流体相转变温度,或比在反应器压力下含有聚合物的流体聚合体系的固体-流体相转变温度高至少2℃,或比在反应器压力下含有聚合物的流体聚合的固体-流体相转变温度高至少5℃,或比在反应器压力下含有聚合物的流体聚合体系的固体-流体相转变点高至少10℃。在另一实施方案中,聚合工艺温度应高于在反应器压力下单相流体聚合体系的浊点,或比反应器压力下流体聚合体系的浊点高2℃或更大。在再另一实施方案中,聚合工艺温度在50℃和350℃之间,或在60℃和250℃之间,或在70℃和250℃之间。或在80℃和250℃之间。示例性聚合温度下限为50℃或60℃或70℃或80℃或90℃或95℃或100℃或110℃或120℃。示例性聚合温度上限为350℃或250℃或240℃或230℃或220℃或210℃或200℃。
[0394]
在发明的一些实施方案中,优选的聚合为100℃或更高,并当100℃时,生产的聚合物可具有大于155℃、优选大于158℃、优选大于160℃的峰值熔点tm。
[0395]
在发明的其它实施方案中,优选的聚合为70℃或更高,并当70℃时,生产的聚合物可具有大于155℃、优选大于160℃、优选大于163℃的峰值熔点tm。
[0396]
室温为23℃,除非另外说明。
[0397]
还可以在聚合中根据需要使用其它添加剂,例如一种或多种清除剂、氢气、烷基
铝、硅烷或链转移剂(例如烷基铝氧烷、由式alr3或znr2表示的化合物(其中每个r独立地是c
1-c8脂族基团,优选甲基、乙基、丙基、丁基、戊基、己基辛基或它们的异构体)或它们的组合,优选二乙基锌、甲基铝氧烷、mmao-3a、三甲基铝、三异丁基铝、三辛基铝或它们的组合)。
[0398]
聚烯烃产物
[0399]
本发明还涉及通过本文所述方法生产的物质组合物。本文描述的方法可以用于产生烯烃的聚合物或烯烃的混合物。可以制备的聚合物包括具有以下描述性质的聚丙烯均聚物。
[0400]
本发明还涉及本文描述的物质的聚合物组合物。
[0401]
通常,本发明的方法产生烯烃聚合物,优选聚丙烯均聚物和丙烯与c
4-c
20
α-烯烃的共聚物。
[0402]
虽然丙烯聚合物的分子量受许多工艺条件的影响,所述工艺条件包括温度、单体浓度和压力、链转移剂的存在等,但是通过本方法生产的聚丙烯均聚物和共聚物产物通常具有约1,000至约1,000,000g/mol,供选择地约10,000至约600,000g/mol,或供选择地约100,000至约500,000g/mol的重均分子量(mw)(其中所有分子量值(mn、mw和mz)均以计算的聚丙烯分子量表示)。
[0403]
供选择地,在本发明的一些实施方案中,本文生产的聚合物具有1,000至2,000,000g/mol(优选5,000至1,000,000g/mol,供选择地10,000至500,000g/mol,供选择地10,000至300,000g/mo l)的mw,和/或大于1至40(供选择地1.2至20,供选择地1.3至10,供选择地1.4至5,1.5至4,供选择地1.5至3)的mw/mn,其中分子量值相对于线性聚苯乙烯标准物。
[0404]
同样,虽然工艺条件可影响聚合物熔点,但是通过本方法生产的聚丙烯均聚物和共聚物产物通常具有约100℃至约175℃、供选择地约120℃至约170℃、供选择地约140℃至约168℃的tm。供选择地生产的聚合物具有150℃或更高的tm。另外,聚合物产物通常具有至多160j/g、供选择地从20直至150j/g、供选择地约80-120j/g、供选择地约90-110j/g、供选择地大于90j/g、供选择地大于100j/g、供选择地大于110j/g、供选择地大于120j/g的熔化热(hf或δhf)。
[0405]
在实施方案中,本发明涉及丙烯-α-烯烃共聚物,其具有1)20重量%α-烯烃或更少(供选择地15重量%α-烯烃或更少、供选择地10重量%α-烯烃或更少),2)50℃或更高(供选择地70℃或更高、供选择地80℃或更高、供选择地90℃或更高、供选择地100℃或更高、供选择地110℃或更高)的tm;和3)大于0.02不饱和端基/1,000c,如通过1h nmr测定(供选择地大于0.05不饱和端基/1,000c、供选择地大于0.10不饱和端基/1,000c、供选择地大于0.30不饱和端基/1,000c、供选择地大于0.50不饱和端基/1,000c)并且其中α-烯烃是c
4-c
20
α-烯烃。
[0406]
在优选实施方案中,单体是丙烯和共聚单体是丁烯或己烯、优选0.5-50摩尔%丁烯或己烯、供选择地1至40摩尔%、供选择地1至30摩尔%、供选择地1至25摩尔%、供选择地1至20摩尔%、供选择地1至15摩尔%、供选择地1至10摩尔%。
[0407]
在优选实施方案中,单体是丙烯并且不存在共聚单体。
[0408]
在优选实施方案中,单体是丙烯,不存在共聚单体和聚合物是全同立构的。
[0409]
在优选实施方案中,本文生产的聚合物具有单峰或多峰分子量分布(mwd=mw/mn),如通过凝胶渗透色谱法(gpc)测定。“单峰”意为gpc迹线具有一个峰或拐点。“多峰”意
为gpc迹线具有至少两个峰或拐点。拐点是曲线的二阶导数符号改变的点(例如,从负到正或反之亦然)。
[0410]
在优选实施方案中本文生产的聚丙烯具有150℃或更高(优选155℃或更高或160℃或更高或162℃或更高或165℃或更高)的tm和20,000g/mol或更大、优选50,000g/mol或更大、更优选100,000g/mol或更大、更优选150,000g/摩尔或更大的mn(gpc-dri,相对于线性聚苯乙烯标准物)。gpc-dri,相对于线性聚苯乙烯标准物意为数值没有相对于聚丙烯值校正。
[0411]
在优选实施方案中本文生产的聚丙烯具有150℃或更高(优选155℃或更高、160℃或更高或162℃或更高或165℃或更高)的tm和50,000g/mol或更大、优选100,000g/mol或更大、优选150,000g/mol或更大、更优选200,000g/mol或更大、更优选250,000g/摩尔或更大的mw(gpc-dri,相对于线性聚苯乙烯标准物)。在优选实施方案中本文生产的聚丙烯具有145℃或更高(优选150℃或更高、155℃或更高或160℃或更高或163℃或更高)的tm和50,000至350,000g/mol、优选100,000至300,000g/mol、优选150,000至275,000g/mol、更优选200,000至260,000g/mol的mw(gpc-dri,相对于线性聚苯乙烯标准物)。gpc-dri,相对于线性聚苯乙烯标准物意为数值没有相对于聚丙烯值校正。
[0412]
在本发明的优选实施方案中,聚合物mw(gpc-dri,相对于线性聚苯乙烯标准物)小于1e-08e
0.1962x
,其中x是聚合物的tm(℃),如通过dsc测量(第2次熔融)(供选择地小于4e-09e
0.2019x
、供选择地小于1e-09e
0.2096x
)且大于2e-16e
0.2956x
,其中x是聚合物的tm,如通过dsc测量(第2次熔融)(供选择地大于y=5e-16e
0.291x
、供选择地大于1e-15e
0.2869x
)并且其中聚丙烯的tm为155℃或更高。
[0413]
供选择地,聚合物mw(gpc-dri,相对于线性聚苯乙烯标准物)小于(10-8
)(e
0.1962z
),其中z是聚合物的tm(℃),如通过dsc测量(第2次熔融)(供选择地小于(4x10-9
)(e
0.2019z
)、供选择地小于(10-9
)(e
0.2096z
))且大于(2x10-16
)(e
0.2956z
),其中z是聚合物的tm,如通过dsc测量(第2次熔融)(供选择地大于(5x10-16
)(e
0.291z
)、供选择地大于(10-15
)(e
0.2869z
))并且其中聚丙烯的tm为155℃或更高。
[0414]
在另一实施方案中,本文生产的聚丙烯具有150℃或更高(优选155℃或更高、160℃或更高或162℃或更高、165℃或更高)的tm和50,000g/mol或更大、优选80,000g/mol或更大、更优选100,000g/mol或更大的mw(gpc-dri,相对于聚丙烯值校正)。gpc-dri,相对于聚丙烯值校正意为虽然将gpc仪器相对于线性聚苯乙烯样品校准,但是使用大致的mark houwink系数将报道的值相对于聚丙烯值校正。
[0415]
在本发明的优选实施方案中,本文生产的聚合物是全同立构的,优选高度全同立构的。“全同立构的”聚合物具有至少10%全同立构五单元组,“高度全同立构的”聚合物具有至少50%全同立构五单元组和“间同立构的”聚合物具有至少10%间同立构五单元组,根据通过
13
c-nmr的分析。优选地全同立构的聚合物具有至少50%(优选至少60%、优选至少70%、优选至少80%、优选至少90%)全同立构五单元组。如果聚烯烃具有小于5%全同立构五单元组和小于5%间同立构五单元组则它是“无规立构的”。
[0416]
在本发明的实施方案中,本文生产的聚合物具有75%或更大(优选80%或更大、优选85%或更大、优选90%或更大、优选95%或更大、优选96%或更大、优选97%或更大、优选98%或更大)的mmmm五单元组立构规整度指数,如通过以下描述的
13
c nmr确定。
[0417]
在本发明的优选实施方案中,本文生产的聚合物是全同立构的并含有2,1-并在一些情况下1,3-区域缺陷(1,3-区域缺陷有时还称作3,1-区域缺陷,并且术语区域缺陷还称作区域-误差)。在本发明的一些实施方案中,本文生产的聚合物具有小于200个总区域缺陷/10,000个单体单元(定义为2,1-赤式和2,1-苏式插入和3,1-异构化(还称作1,3-插入)之和),如通过
13
c-nmr测量(优选小于100个总区域缺陷/10,000个单体单元、优选小于50个总区域缺陷/10,000个单体单元、优选小于35个总区域缺陷/10,000个单体单元、优选小于30个总区域缺陷/10,000个单体单元、优选小于25个总区域缺陷/10,000个单体单元、优选小于20个总区域缺陷/10,000个单体单元),条件是总区域缺陷不小于1个总区域缺陷/10,000个单体单元,优选不小于2个总区域缺陷/10,000个单体单元,供选择地不小于5个总区域缺陷/10,000个单体单元。在本发明的一些实施方案中,全同立构聚合物不含有可测量的1,3-区域缺陷。
[0418]
在优选实施方案中,全同立构聚丙烯聚合物具有30个/10,000个单体单元或更小(优选小于20个/10,000个单体单元、优选小于10个/10,000个单体单元、优选小于5个/10,000个单体单元、优选小于4个/10,000个单体单元、优选小于3个/10,000个单体单元、优选小于2个/10,000个单体单元、优选小于1个/10,000个单体单元)的1,3-区域缺陷,如通过
13
c nmr确定。
[0419]
在优选实施方案中,全同立构聚丙烯聚合物具有155℃或更高(优选157℃或更高、供选择地159℃或更高、供选择地160℃或更高、供选择地161℃或更高)的通过dsc测量的tm,并且其中总区域缺陷/10,000个单体单元小于-1.18x tm(℃)+210,供选择地小于-1.18x tm(℃)+209.5,供选择地1.18x tm(℃)+209,条件是总区域缺陷不小于3个总区域缺陷/10,000个单体单元、优选不小于4个总区域缺陷/10,000个单体单元、供选择地不小于5个总区域缺陷/10,000个单体单元。
[0420]
除了以上限定的总区域缺陷,全同立构聚合物还表现出立构缺陷。“总缺陷”定义为总区域缺陷加上立构缺陷。总区域缺陷乘100并除以“总缺陷”被称作总区域缺陷的百分比。在本发明的一些实施方案中,总区域缺陷的百分比小于40%、优选小于35%、优选小于32%、优选小于30%、供选择地小于25%。
[0421]
在本发明的一些实施方案中,全同立构聚丙烯具有大于0.05个不饱和端基/1000c(供选择地大于0.10个不饱和端基/1000c、供选择地大于0.30个不饱和端基/1000c、供选择地大于0.50个不饱和端基/1000c),如通过1h nmr测定。
[0422]
在本发明的一些实施方案中,基于丙烯的聚合物是丙烯-α-烯烃共聚物,其中α-烯烃是c
4-c
20
α-烯烃。优选地,丙烯-α-烯烃共聚物含有50mol%丙烯或更大、供选择地60mol%丙烯或更大、供选择地70mol%丙烯或更大、供选择地80mol%丙烯或更大、供选择地90mol%丙烯或更大,其中c
4-c
20
α-烯烃的下限是1mol%、供选择地3mol%、供选择地5mol%、供选择地10mol%、供选择地15mol%、供选择地20mol%、供选择地30mol%。在本发明的优选实施方案中,丙烯-α-烯烃共聚物具有至少50%(优选至少60%、优选至少70%、优选至少80%、优选至少90%)全同立构三单元组,如通过
13
c nmr测量。
[0423]
对聚烯烃进行的
13
c-nmr波谱法
[0424]
通过
13
c-nmr波谱法测定聚丙烯微观结构,包括全同立构和间同立构二单元组([m]和[r])、三单元组([mm]和[rr])和五单元组([mmmm]和[rrrr])的浓度。标号“m”或“r”描述
邻近的丙烯基对的立体化学,“m”表示内消旋和“r”表示外消旋。样品溶解在d
2-1,1,2,2-四氯乙烷中,并且在120℃下使用125mhz(或更高)的
13
c频率的nmr波谱仪记录谱图。聚合物共振峰参照mmmm=21.8ppm。f.a.bovey在polymer conformation and configuration(academic press,纽约1969)和j.randall在polymer sequence determination,
13
c-nmr method(academic press,纽约,1977)描述了在通过nmr表征聚合物中涉及的计算。
[0425]“丙烯立构规整度指数”,本文表示为[m/r],如h.n.cheng(1984)macromolecules,第17卷,第1950页中定义的计算。当[m/r]为0至小于1.0时,聚合物通常描述为间同立构的,当[m/r]为1.0时聚合物是无规立构的,并且当[m/r]大于1.0时聚合物通常描述为全同立构的。
[0426]
聚合物的“mm三单元组立构规整度指数”是以首尾相连构型连接的三个相邻的丙烯单元序列的相对全同立构规整度的量度。更具体地,在本发明中,聚丙烯均聚物或共聚物的mm三单元组立构规整度指数(还称作“mm分数”)表述为内消旋立构规整度单元数与共聚物中全部丙烯三单元组之比:
[0427][0428]
其中ppp(mm)、ppp(mr)和ppp(rr)表示在三个首尾相连丙烯单元的可能的三单元组构型中,来源于第二单元的甲基基团的峰面积,以下在费歇尔投影图中显示:
[0429]
ppp(mm):
[0430]
ppp(mr):
[0431]
ppp(rr):
[0432]
丙烯聚合物的mm分数的计算描述于美国专利5,504,172(均聚物:第25栏第49行至第27栏第26行;共聚物:第28栏第38行至第29栏第67行)。关于可如何从
13
c-nmr谱确定mm三单元组立构规整度的更多信息,参阅1)j.a.ewen(1986),catalytic polymerization of olefins:proceedings of the international symposium on future aspects of olefin polymerization,t.keii and k.soga,eds.(elsevier),第271-292页,和2)美国专利申请公开号us2004/054086(第[0043]至[0054]段)。
[0433]
类似地,m二单元组和r二单元组可如下计算,其中mm、mr和mr如以上所定义:
[0434]
m=mm+1/2mr
[0435]
r=rr+1/2mr。
[0436]
在本发明另一实施方案中,本文生产的丙烯聚合物(优选均聚聚丙烯)具有区域缺
陷(如通过
13
c nmr测定),基于总丙烯单体。三类缺陷被定义为区域缺陷:2,1-赤式、2,1-苏式和3,1-异构化。这些的结构和峰归属在[l.resconi等人(2000),chem.rev.,第100卷,第1253-1345页]给出。区域缺陷在碳nmr谱图中各自产生多个峰,并且将这些积分和平均(以它们从谱图中的其它峰中分辨出来的程度),以改进测量精度。分析中使用的可分辨共振的化学位移偏移列于下表。精确的峰位置可以随nmr溶剂选择变化而位移。
[0437]
区域缺陷化学位移范围(ppm)2,1-赤式42.3,38.6,36.0,35.9,31.5,30.6,17.6,17.22,1-苏式43.4,38.9,35.6,34.7,32.5,31.2,15.4,15.03,1插入37.6,30.9,27.7
[0438]
每个缺陷的平均积分除以主要丙烯信号(ch3、ch、ch2)之一的积分,并乘10,000以确定每10,000个单体的缺陷浓度。
[0439]
根据以下nmr方法测定mn(1h nmr):在室温或120℃下(就权利要求的目的而言,应使用120℃)在10mm探针中使用bruker波谱仪以500mhz或更高的1h频率(就权利要求的目的而言,使用600mhz的质子频率并将聚合物样品溶解在1,1,2,2-四氯乙烷-d2(tce-d2)中并转移到10mm玻璃nmr管中)收集1h nmr数据。使用最大脉冲宽度为45
°
、脉冲间隔5秒和平均512个瞬态的信号来记录数据。积分波谱信号并其且通过将不同的组乘以1,000并将结果除以总碳数来计算不饱和度类型数/1,000个碳原子。mn通过将不饱和物质的总数除以14,000来计算,并具有单位为g/mol。烯烃类型的化学位移区域定义为在以下空间区域之间。
[0440]
不饱和类型区域(ppm)每个结构的氢数乙烯基4.98-5.132乙烯叉基(vyd)4.69-4.882亚乙烯基5.31-5.552三取代的5.11-5.301
[0441]
共混物
[0442]
在另一实施方案中,在形成为膜、模塑零件或其它制品之前将本文产生的丙烯均聚物或具有c4或更高级α-烯烃的丙烯共聚物与一种或多种额外的聚合物合并。其它可用的聚合物包括聚乙烯、全同立构聚丙烯、高度全同立构聚丙烯、间同立构聚丙烯、丙烯和乙烯和/或丁烯和/或己烯的无规共聚物、聚丁烯、乙烯乙酸乙烯酯、ldpe、lldpe、hdpe、乙烯乙酸乙烯酯、乙烯丙烯酸甲酯、丙烯酸的共聚物、聚甲基丙烯酸甲酯或任何其它可通过高压自由基方法聚合的聚合物、聚氯乙烯、聚丁烯-1、全同立构聚丁烯、abs树脂、乙烯-丙烯橡胶(epr)、硫化epr、epdm、嵌段共聚物、苯乙烯类嵌段共聚物、聚酰胺、聚碳酸酯、pet树脂、交联聚乙烯、乙烯和乙烯醇的共聚物(evoh)、芳族单体的聚合物例如聚苯乙烯、聚-1酯、聚缩醛、聚偏二氟乙烯、聚乙二醇和/或聚异丁烯。
[0443]
在优选实施方案中,丙烯聚合物(优选均聚聚丙烯)以10-99重量%、优选20至95重量%、甚至更优选至少30至90重量%、甚至更优选至少40至90重量%、甚至更优选至少50至90重量%、甚至更优选至少60至90重量%、甚至更优选至少70至90重量%存在于以上共混物中,基于共混物中聚合物的重量。
[0444]
可以如下来生产以上所述共混物:通过混合本发明的聚合物与一种或多种聚合物(如以上所述)、通过串联地将反应器连接在一起来制造反应器共混物或通过在同一反应器
中使用多于一种催化剂来生产多种聚合物物质。聚合物可在放入挤出机之前混合在一起或者可以在挤出机中混合。
[0445]
可以如下形成共混物:使用常规设备和方法例如通过干混各个组分并随后在混合器中熔融混合,或通过直接在混合器中将组分混合在一起,混合器例如banbury混合器、haake混合器、brabender密炼机或单螺杆或双螺杆挤出机,其可以包括在聚合工艺下游直接使用的配混挤出机和侧臂挤出机,其可以包括在膜挤出机料斗处共混树脂的粉末或丸剂。另外,根据需要,可以在共混物中,在共混物的一个或多个组分中和/或在由共混物形成的产物例如膜中包括添加剂。这样的添加剂在本领域是公知的,并且可包括例如:填料;抗氧化剂(例如受阻酚例如可从ciba-geigy得到的irganox
tm 1010或irganox
tm 1076);亚磷酸酯(例如可从ciba-geigy得到的irgafos
tm 168);抗粘(anti-cling)添加剂;增粘剂例如聚丁烯、萜烯树脂、脂族和芳族烃树脂、碱金属和甘油硬脂酸酯、和氢化松香;uv稳定剂;热稳定剂;抗粘连剂;脱模剂;抗静电剂;颜料;着色剂;染料;蜡;氧化硅;填料;滑石等。
[0446]
通过本方法生产的聚合物产物可以与一种或多种其它聚合物共混,包括但不限于热塑性聚合物(一种或多种)和/或弹性体(一种或多种),例如wo 2004/014998第59页公开的那些。
[0447]
原位或通过物理共混形成的本发明的聚合物(和如以上描述的它们的共混物)优选使用在任何已知的热塑性或弹性体应用中。实例包括使用在模塑零件、膜、胶带、片、管、软管、片材、线和线缆涂层、胶黏剂、鞋底、缓冲器、垫、波纹管、膜、纤维、弹性纤维、无纺布、纺粘材料、密封剂、手术罩袍和医疗设备。本文生产的聚合物膜可以根据wo 2004/014998第63页第1行至第66页第26行制造,包括本文生产的聚合物膜可以与如在wo 2004/014998第63页第21行至第65页第2行描述的一个或多个其它层合并。
[0448]
任何前述聚合物和组合物连同任选的添加剂(参阅例如美国专利申请公开号2016/0060430第[0082]-[0093]段)可以用于各种最终用途应用中。可以通过本领域已知的方法产生这样的最终用途。最终用途包括聚合物产品和具有具体最终用途的产品。示例性最终用途是膜,基于膜的产品,尿布背片,家用缠绕膜(housewrap),电线和电缆涂层组合物,由模塑技术(例如注塑或吹塑、挤出涂覆、发泡、流延和它们的组合)形成的制品。最终用途还包括由膜制成的产品,例如袋、包装、和个人护理膜、小袋、医用产品例如医用膜和静脉注射(iv)袋。
[0449]
膜
[0450]
具体地,可以在各种最终用途应用中使用任何前述聚合物,例如前述聚丙烯或它们的共混物。这样的应用包括例如单层或多层吹塑、挤出和/或收缩膜。可以通过任何数量的公知挤出或共挤出技术形成这些膜,例如吹泡膜(blown bubble film)加工技术,其中可在熔融状态通过环型模头挤出组合物并然后膨胀以形成单轴或双轴取向熔体,然后冷却以形成管状吹塑膜,然后可将该管状吹塑膜轴向切割并展开形成平膜。膜可以随后未取向、单轴取向或双轴取向至相同或不同的程度。可以相同或不同程度地在横向和/或纵向上取向膜的一个或多个层。可使用通常的冷拉(cold drawing)法或热拉(hot drawing)法来完成单轴取向。可使用拉幅机设备或双膜泡方法来完成双轴取向,并且双轴取向可以发生在将各个层集合在一起之前或之后。例如,可将聚乙烯层挤出涂覆或层合至取向的聚丙烯层上或者可将聚乙烯和聚丙烯一起共挤出为膜然后取向。同样,可将取向的聚丙烯层合至取向
的聚乙烯,或者可将取向的聚乙烯涂覆至聚丙烯上然后任选地可甚至进一步取向该组合。通常,以至多15、优选在5和7之间的比率在纵向(md)上和以至多15、优选7至9的比率在横向(td)上取向膜。然而,在另一实施方案中,在md和td方向两者上以相同程度地取向膜。
[0451]
取决于意图的应用,膜厚度可以改变;然而,具有1-50μm厚度的膜通常是合适的。意图用于包装的膜常为10-50μm厚。密封层的厚度通常为0.2至50μm。可以在膜的内表面和外表面两者上都存在密封层或者可以仅在内表面或外表面上存在密封层。
[0452]
在另一实施方案中,可以通过电晕处理、电子束照射、伽马照射、火焰处理或微波来改性一个或多个层。在优选实施方案中,通过电晕处理改性一个或两个表面层。
[0453]
在另一实施方案中,本发明涉及:
[0454]
1.聚合方法,包括在均相中使丙烯与包含活化剂和由式(i)表示的催化剂化合物的催化剂体系接触:
[0455][0456]
其中:
[0457]
m是第3、4、5或6族过渡金属或镧系元素;
[0458]
e和e'每个独立地为o、s或nr9,其中r9独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基或含杂原子基团;
[0459]
q是与金属m形成配位键的第14、15或16族原子;
[0460]
a1qa1’
是经由3-原子桥连接a2与a2’
的含有4-40个非氢原子的杂环路易斯碱的一部分,其中q是3-原子桥的中心原子,
[0461]
a1和a1'独立地为c、n或c(r
22
),其中r
22
选自氢、c
1-c
20
烃基、c
1-c
20
取代的烃基;
[0462]
是经由2-原子桥连接a1与e-键合的芳族基团的含有2-40个非氢原子的二价基团;
[0463]
是经由2-原子桥连接a
1'
与e'-键合的芳族基团的含有2-40个非氢原子的二价基团;
[0464]
l是路易斯碱;x是阴离子配体;n为1、2或3;m为0、1或2;n+m不大于4;
[0465]
r1、r2、r3、r4、r
1'
、r
2'
、r
3'
和r
4'
中每个独立地是氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子基团,
[0466]
以及r1和r2、r2和r3、r3和r4、r
1'
和r
2'
、r
2'
和r
3'
、r
3'
和r
4'
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环;
[0467]
任何两个l基团可以接合在一起从而形成双齿路易斯碱;
[0468]
x基团可以与l基团接合从而形成单阴离子双齿基团;
[0469]
任何两个x基团可以接合在一起从而形成二阴离子配体基团。
[0470]
2.段落1的方法,其中催化剂化合物由式(i i)表示:
[0471][0472]
其中:
[0473]
m是第3、4、5或6族过渡金属或镧系元素;
[0474]
e和e'每个独立地为o、s或nr9,其中r9独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基或含杂原子基团;
[0475]
每个l独立地为路易斯碱;每个x独立地为阴离子配体;n为1、2或3;m为0、1或2;n+m不大于4;
[0476]
r1、r2、r3、r4、r
1'
、r
2'
、r
3'
和r
4'
中每个独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,或r1和r2、r2和r3、r3和r4、r
1'
和r
2'
、r
2'
和r
3'
、r
3'
和r
4'
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环;任两个l基团可以接合在一起以形成双齿路易斯碱;
[0477]
x基团可以与l基团接合从而形成单阴离子双齿基团;
[0478]
任何两个x基团可以接合在一起从而形成二阴离子配体基团;
[0479]
r5、r6、r7、r8、r5’
、r6’
、r7’
、r8’
、r
10
、r
11
和r
12
中每个独立地为氢、c
1-c
40
烃基、c
1-c
40
取代的烃基、杂原子或含杂原子的基团,或r5和r6、r6和r7、r7和r8、r5’
和r6’
、r6’
和r7’
、r7’
和r8’
、r
10
和r
11
或r
11
和r
12
中一者或多者可以接合从而形成一个或多个取代的烃基环、未取代的烃基环、取代的杂环的环或未取代的杂环的环,每个具有5个、6个、7个或8个环原子,并且其中环上的取代基可接合从而形成额外的环。
[0480]
3.段落1或2的方法,其中m是hf、zr或ti,优选是hf。
[0481]
4.段落1、2或3的方法,其中e和e'每个是o。
[0482]
5.段落1、2、3或4的方法,其中r1和r1’
独立地为c
4-c
40
叔烃基基团、优选c
4-c
40
环状叔烃基基团、优选c
4-c
40
多环叔烃基基团。
[0483]
6.段落1至5中任一项的方法,其中每个x独立地选自以下:具有1-30个(例如1-20个)碳原子的取代或未取代的烃基基团、具有3-30个碳原子的取代或未取代的甲硅烷基烃基基团、氢基、氨基、烷氧基、硫基、磷基、卤基、具有8-30个碳原子的取代的苄基和它们的组合(两个x可以形成稠环或环体系的一部分)。
[0484]
7.段落1至6中任一项的方法,其中每个l独立地选自以下:醚、硫醚、胺、膦、乙醚、四氢呋喃、二甲基硫醚、三乙基胺、吡啶、烯烃、炔烃、丙二烯和碳烯和它们的组合,任选地两个或更多个l可以形成稠环或环体系的一部分。
[0485]
8.段落1的方法,其中m是zr或hf,优选是hf,q是氮,a1和a1’
都是碳,e和e’都是氧,和r1和r1’
都是c
4-c
20
环状叔烷基。
[0486]
9.段落1的方法,其中m是zr或hf,优选是hf,q是氮,a1和a1’
都是碳,e和e’都是氧,和r1和r1’
都是金刚烷-1-基或取代的金刚烷-1-基。
[0487]
10.段落1或2的方法,其中m是hf。
[0488]
11.段落1或2的方法,其中r1和r1’
都是金刚烷-1-基或取代的金刚烷-1-基。
[0489]
12.段落1的方法,其中q是碳,a1和a1’
都是氮和e和e’都是氧。
[0490]
13.段落1的方法,其中q是碳,a1是氮,a1’
是c(r
22
),和e和e’都是氧,其中r
22
选自氢、c
1-c
20
烃基、c
1-c
20
取代的烃基。
[0491]
14.段落1至13中任一项的方法,其中杂环路易斯碱选自由下式表示的基团:
[0492][0493]
其中每个r
23
独立地选自氢、c
1-c
20
烷基和c
1-c
20
取代的烷基。
[0494]
15.段落2的方法,其中m是zr或hf,优选是hf,e和e’都是氧,和r1和r1’
都是c
4-c
20
环状叔烷基。
[0495]
16.段落2的方法,其中m是zr或hf,优选是hf,e和e’都是氧,和r1和r1’
都是金刚烷-1-基或取代的金刚烷-1-基。
[0496]
17.段落2的方法,其中m是zr或hf,优选是hf,e和e’都是氧,和r1、r1’
、r3和r3’
中每个是金刚烷-1-基或取代的金刚烷-1-基。
[0497]
18.段落2的方法,其中m是zr或hf,优选是hf,e和e’都是氧,r1和r1’
都是c
4-c
20
环状叔烷基,和r7和r7’
都是c
1-c
20
烷基。
[0498]
19.段落2的方法,其中m是zr或hf,优选是hf,e和e’都是o,r1和r1’
都是c
4-c
20
环状叔烷基,和r7和r7’
都是c
1-c
20
烷基。
[0499]
20.段落2的方法,其中m是zr或hf,优选是hf,e和e’都是o,r1和r1’
都是c
4-c
20
环状叔烷基,和r7和r7’
都是c
1-c3烷基。
[0500]
21.段落1的方法,其中催化剂化合物由下式中一种或多种表示:
[0501]
[0502]
[0503]
[0504]
[0505]
[0506][0507]
22.段落21的方法,其中催化剂化合物选自络合物1、2、5、7、9、10、11、12、14、15、16、19、20、23和25。
[0508]
23.段落1至22中任一项的方法,其中活化剂包含铝氧烷或非配位阴离子。
[0509]
24.段落1至23中任一项的方法,其中活化剂可溶于非芳族烃溶剂。
[0510]
25.段落1至24中任一项的方法,其中催化剂体系不含芳族溶剂。
[0511]
26.段落1至25中任一项的方法,其中活化剂由下式表示:
[0512]
(z)
d+
(a
d-)
[0513]
其中z是(l-h)或可还原的路易斯酸,l是中性路易斯碱,h是氢,(l-h)
+
是布朗斯台德酸;a
d-是具有电荷d-的非配位阴离子;并且d是1-3的整数。
[0514]
27.段落1至25中任一项的方法,其中活化剂由下式表示:
[0515]
[r1′
r2′
r3′
eh]
d+
[mt
k+qn
]
d-ꢀꢀ
(v)
[0516]
其中:
[0517]
e是氮或磷;
[0518]
d是1、2或3;k是1、2或3;n是1、2、3、4、5或6;n-k=d;
[0519]
r1′
、r2′
和r3′
独立地为c
1-c
50
烃基基团,任选被一种或多种烷氧基基团、甲硅烷基基团、卤素原子或含卤素基团取代,
[0520]
其中r1′
、r2′
和r3′
总共包含15个或更多个碳原子;
[0521]
mt是选自元素周期表中第13族的元素;和
[0522]
每个q独立地为氢基、桥连或未桥连的二烷基氨基、卤基、烷氧基、芳氧基、烃基、取代的烃基、卤代烃基、取代卤代烃基或卤素取代的烃基基团。
[0523]
28.段落1至22中任一项的方法,其中活化剂由下式表示:
[0524]
(z)
d+
(a
d-)
[0525]
其中a
d-是具有电荷d-的非配位阴离子;和d是1-3的整数和(z)
d+
由以下中的一种或多种表示:
[0526][0527][0528]
29.段落1至25中任一项的方法,其中活化剂是以下中的一种或多种:
[0529]
四(五氟苯基)硼酸n-甲基-4-十九烷基-n-十八烷基苯铵,
[0530]
四(全氟萘-2-基)硼酸n-甲基-4-十九烷基-n-十八烷基苯铵,
[0531]
四(五氟苯基)硼酸二(十八烷基)甲基铵,
[0532]
四(全氟萘-2-基)硼酸二(十八烷基)甲基铵,
[0533]
四(五氟苯基)硼酸n,n-二甲基苯铵,
[0534]
四(五氟苯基)硼酸三苯基碳
[0535]
四(全氟萘-2-基)硼酸三甲基铵,
[0536]
四(全氟萘-2-基)硼酸三乙基铵,
[0537]
四(全氟萘-2-基)硼酸三丙基铵,
[0538]
四(全氟萘-2-基)硼酸三(正丁基)铵,
[0539]
四(全氟萘-2-基)硼酸三(叔丁基)铵,
[0540]
四(全氟萘-2-基)硼酸n,n-二甲基苯铵,
[0541]
四(全氟萘-2-基)硼酸n,n-二乙基苯铵,
[0542]
四(全氟萘-2-基)硼酸n,n-二甲基-(2,4,6-三甲基苯铵),
[0543]
四(全氟萘-2-基)硼酸
[0544]
四(全氟萘-2-基)硼酸三苯基碳
[0545]
四(全氟萘-2-基)硼酸三苯基
[0546]
四(全氟萘-2-基)硼酸三乙基甲硅烷
[0547]
四(全氟萘-2-基)硼酸苯(重氮),
[0548]
四(全氟联苯基)硼酸三甲基铵,
[0549]
四(全氟联苯基)硼酸三乙基铵,
[0550]
四(全氟联苯基)硼酸三丙基铵,
[0551]
四(全氟联苯基)硼酸三(正丁基)铵,
[0552]
四(全氟联苯基)硼酸三(叔丁基)铵,
[0553]
四(全氟联苯基)硼酸n,n-二甲基苯铵,
[0554]
四(全氟联苯基)硼酸n,n-二乙基苯铵,
[0555]
四(全氟联苯基)硼酸n,n-二甲基-(2,4,6-三甲基苯铵),
[0556]
四(全氟联苯基)硼酸
[0557]
四(全氟联苯基)硼酸三苯基碳
[0558]
四(全氟联苯基)硼酸三苯基
[0559]
四(全氟联苯基)硼酸三乙基甲硅烷
[0560]
四(全氟联苯基)硼酸苯(重氮),
[0561]
[4-叔丁基-phnme2h][(c6f3(c6f5)2)4b],
[0562]
四苯基硼酸三甲基铵,
[0563]
四苯基硼酸三乙基铵,
[0564]
四苯基硼酸三丙基铵,
[0565]
四苯基硼酸三(正丁基)铵,
[0566]
四苯基硼酸三(叔丁基)铵,
[0567]
四苯基硼酸n,n-二甲基苯铵,
[0568]
四苯基硼酸n,n-二乙基苯铵,
[0569]
四苯基硼酸n,n-二甲基-(2,4,6-三甲基苯铵),
[0570]
四苯基硼酸
[0571]
四苯基硼酸三苯基碳
[0572]
四苯基硼酸三苯基
[0573]
四苯基硼酸三乙基甲硅烷
[0574]
四苯基硼酸苯(重氮),
[0575]
四(五氟苯基)硼酸三甲基铵,
[0576]
四(五氟苯基)硼酸三乙基铵,
[0577]
四(五氟苯基)硼酸三丙基铵,
[0578]
四(五氟苯基)硼酸三(正丁基)铵,
[0579]
四(五氟苯基)硼酸三(仲丁基)铵,
[0580]
四(五氟苯基)硼酸n,n-二甲基苯铵,
[0581]
四(五氟苯基)硼酸n,n-二乙基苯铵,
[0582]
四(五氟苯基)硼酸n,n-二甲基-(2,4,6-三甲基苯铵),
[0583]
四(五氟苯基)硼酸
[0584]
四(五氟苯基)硼酸三苯基碳
[0585]
四(五氟苯基)硼酸三苯基
[0586]
四(五氟苯基)硼酸三乙基甲硅烷
[0587]
四(五氟苯基)硼酸苯(重氮),
[0588]
四(2,3,4,6-四氟苯基)硼酸三甲基铵,
[0589]
四(2,3,4,6-四氟苯基)硼酸三乙基铵,
[0590]
四(2,3,4,6-四氟苯基)硼酸三丙基铵,
[0591]
四(2,3,4,6-四氟苯基)硼酸三(正丁基)铵,
[0592]
四(2,3,4,6-四氟苯基)硼酸二甲基(叔丁基)铵,
[0593]
四(2,3,4,6-四氟苯基)硼酸n,n-二甲基苯铵,
[0594]
四(2,3,4,6-四氟苯基)硼酸n,n-二乙基苯铵,
[0595]
四(2,3,4,6-四氟苯基)硼酸n,n-二甲基-(2,4,6-三甲基苯铵),
[0596]
四(2,3,4,6-四氟苯基)硼酸
[0597]
四(2,3,4,6-四氟苯基)硼酸三苯基碳
[0598]
四(2,3,4,6-四氟苯基)硼酸三苯基
[0599]
四(2,3,4,6-四氟苯基)硼酸三乙基甲硅烷
[0600]
四(2,3,4,6-四氟苯基)硼酸苯(重氮),
[0601]
四(3,5-双(三氟甲基)苯基)硼酸三甲基铵,
[0602]
四(3,5-双(三氟甲基)苯基)硼酸三乙基铵,
[0603]
四(3,5-双(三氟甲基)苯基)硼酸三丙基铵,
[0604]
四(3,5-双(三氟甲基)苯基)硼酸三(正丁基)铵,
[0605]
四(3,5-双(三氟甲基)苯基)硼酸三(叔丁基)铵,
[0606]
四(3,5-双(三氟甲基)苯基)硼酸n,n-二甲基苯铵,
[0607]
四(3,5-双(三氟甲基)苯基)硼酸n,n-二乙基苯铵,
[0608]
四(3,5-双(三氟甲基)苯基)硼酸n,n-二甲基-(2,4,6-三甲基苯铵),
[0609]
四(3,5-双(三氟甲基)苯基)硼酸
[0610]
四(3,5-双(三氟甲基)苯基)硼酸三苯基碳
[0611]
四(3,5-双(三氟甲基)苯基)硼酸三苯基
[0612]
四(3,5-双(三氟甲基)苯基)硼酸三乙基甲硅烷
[0613]
四(3,5-双(三氟甲基)苯基)硼酸苯(重氮),
[0614]
四(五氟苯基)硼酸二(异丙基)铵,
[0615]
四(五氟苯基)硼酸二环己基铵,
[0616]
四(五氟苯基)硼酸三(邻甲苯基)
[0617]
四(五氟苯基)硼酸三(2,6-二甲基苯基)
[0618]
四(五氟苯基)硼酸三苯基碳
[0619]
1-(4-(三(五氟苯基)硼酸)-2,3,5,6-四氟苯基)吡咯烷
[0620]
四(五氟苯基)硼酸盐,
[0621]
4-(三(五氟苯基)硼酸)-2,3,5,6-四氟吡啶,和
[0622]
四(3,5-双(三氟甲基)苯基)硼酸三苯基碳
[0623]
30.段落1至29中任一项的方法,其中方法是溶液方法。
[0624]
31.段落1至30中任一项的方法,其中方法在约0℃-约300℃的温度下、约0.35mpa-约18mpa范围内的压力下和以至多300min的时间进行。
[0625]
32.段落1至31中任一项的方法,其中方法在65℃至约150℃的温度下进行。
[0626]
33.段落1至32中任一项的方法,还包括获得丙烯聚合物,优选其中丙烯聚合物是全同立构的并具有75%或更大的mmmm五单元组立构规整度指数。
[0627]
34.段落33的方法,其中聚合物具有150℃或更高的tm,如通过dsc测量。
[0628]
35.段落33或34的方法,其中聚合物具有50,000g/mol或更大的mw(如通过gpc-dri测量,相对于线性聚苯乙烯标准物)。
[0629]
36.段落33、34或35的方法,其中聚合物具有小于200个总区域缺陷/10,000个单体单元且大于1个总区域缺陷/10,000个单体单元,如通过
13
c-nmr测量。
[0630]
37.段落33、34、35或36的方法,其中聚合物具有小于30个1,3-区域缺陷/10,000个单体单元,如通过
13
c-nmr测量。
[0631]
38.段落33至37中任一项的方法,其中聚合物具有的总区域缺陷百分比小于40%。
[0632]
39.段落33的方法,其中聚合物具有1)155℃或更高的如通过dsc测量的tm,2)其中总区域缺陷/10,000个单体单元小于-1.18x tm(℃)+210,和3)其中总区域缺陷不小于3个总区域缺陷/10,000个单体单元。
[0633]
40.段落33至39中任一项的方法,其中聚合物具有大于0.05个不饱和端部基团/1000c,如通过1h nmr测定。
[0634]
41.段落33至40中任一项的方法,其中聚合物具有1)mw(gpc-dri,相对于线性聚苯乙烯标准物)小于(10-8
)(e
0.1962z
),其中z是通过dsc(第2次熔融)测量的聚合物的tm(℃),和2)mw大于(2x10-16
)(e
0.2956z
),其中z是通过dsc(第2次熔融)测量的聚合物的tm,和3)其中聚合物的tm为155℃或更高。
[0635]
42.段落33至41中任一项的方法,其中聚合物是丙烯-α-烯烃共聚物,其中α-烯烃是c
4-c
20
α-烯烃和其中丙烯-α-烯烃共聚物含有20mol%或更多的丙烯,其中c
4-c
20
α-烯烃的下限为1mol%。
[0636]
43.段落42的方法,其中α-烯烃是c
4-c8α-烯烃或它们的混合物。
[0637]
44.42或43的方法,其中丙烯-α-烯烃共聚物具有至少50%全同立构三单元组,如通过
13
c nmr测量。
[0638]
45.全同立构聚丙烯聚合物,其具有:
[0639]
1)155℃或更高的tm,如通过dsc测量(第2次熔融),
[0640]
2)90%或更大的mmmm五单元组立构规整度指数,
[0641]
3)50,000g/mol或更大的mw(如通过gpc-dri测量,相对于线性聚苯乙烯标准物),
[0642]
4)小于35个总区域缺陷/10,000个单体单元且大于1个总区域缺陷/10,000个单体单元,如通过
13
c-nmr测量。
[0643]
46.段落45的聚合物,其中聚合物具有小于5个1,3-区域缺陷/10,000个单体单元,如通过
13
c-nmr测量。
[0644]
47.段落45或46的聚合物,其中聚合物具有的总区域缺陷百分比小于30%。
[0645]
48.段落45、46或47的聚合物,其中聚合物具有1)总区域缺陷/10,000个单体单元小于-1.18x tm+210,和2)其中总区域缺陷不小于3个总区域缺陷/10,000个单体单元。
[0646]
49.段落45至48中任一项的聚合物,其中聚合物具有大于0.05个不饱和端部基团/1000c,如通过1h nmr测定。
[0647]
50.段落45至49中任一项的聚合物,其中聚合物具有1)mw(gpc-dri,相对于线性聚苯乙烯标准物)小于(10-8
)(e
0.1962z
),其中z是通过dsc(第2次熔融)测量的聚合物的tm(℃),和2)mw大于(2x10-16
)(e
0.2956z
),其中z是通过dsc(第2次熔融)测量的聚合物的tm,和3)其中聚合物的tm为155℃或更高。
[0648]
51.段落45至50中任一项的聚合物,其中tm为160℃或更高。
[0649]
52.段落45至51中任一项的聚合物,其中mw为100,000g/mol或更大。
[0650]
53.段落45至52中任一项的聚合物,其中mmmm五单元组立构规整度指数为95%或更大。
[0651]
54.全同立构结晶丙烯聚合物,在这样的方法中生产,所述方法包括在均相中使丙烯与包含活化剂和二阴离子三齿配体的过渡金属催化剂络合物的催化剂体系接触,所述配体的特征为中心中性杂环路易斯碱和两个酚盐给体,其中三齿配体与金属中心配位以形成两个八元环。
[0652]
55.段落54的聚合物,其中聚合物具有120℃或更高的熔点。
[0653]
56.段落54或55的聚合物,其中聚合物具有70%或更大的mmmm五单元组立构规整度指数。
[0654]
57.段落54、55或56的聚合物,其中聚合温度为70℃或更高。
[0655]
58.段落45至57中任一项的方法,其中丙烯共聚物具有大于100j/g、优选大于110j/g的熔化热。
[0656]
59.段落1至44中任一项的方法,还包括获得具有大于100j/g、优选大于110j/g的熔化热的丙烯共聚物。
[0657]
60.全同立构结晶丙烯聚合物,由这样的聚合方法生产,所述聚合方法包括在均相中使丙烯与包含活化剂和第4族双(酚盐)催化剂化合物的催化剂体系接触,其中聚合方法在90℃或更高的温度下进行,以生产具有以下特性的聚合物:
[0658]
i.mw(gpc-dri,相对于线性聚苯乙烯标准物)小于(10-8
)(e
0.1962z
),其中z是聚合物的tm(℃),如通过dsc测量(第2次熔融);
[0659]
ii.mw(gpc-dri,相对于线性聚苯乙烯标准物)大于(2x10-16
)(e
0.2956z
),其中z是聚合物的tm(℃),如通过dsc测量(第2次熔融)。
[0660]
61.段落60的聚合物,其中tm为160℃或更高。
[0661]
62.段落60的聚合物,其中mw为100,000g/mol或更大。
[0662]
63.段落60的聚合物,其中mmmm五单元组立构规整度指数为95%或更大。
[0663]
实验
[0664]
起始材料
[0665]
以接收状态使用4-甲基苯酚(merck)、三苯基膦(merck)、2-溴-4-异丙基碘苯(abcr gmbh)、2-溴吡啶(abcr gmbh)、2,6-二溴-4-甲氧基吡啶(abcr gmbh)、2,6-二氯-4-三氟甲基吡啶(abcr gmbh)、3,5-二甲基金刚烷-1-醇(abcr gmbh)、3,5-二甲基-1-溴代金刚烷(abcr gmbh)、苯并[b]噻吩(merck)、n-溴代琥珀酰亚胺(merck)、双(频哪醇合)二硼(aldrich)、环己酮(merck)、2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(aldrich)、2,6-二溴吡啶(aldrich)、2-溴碘苯(acros)、己烷中2.5m n
buli(acros)、pd(pph3)4(aldrich)、pdcl2(aurat、俄罗斯)、rucl3水合物(aurat、俄罗斯)、1,1
’‑
双(二叔丁基膦基)二茂铁(merck)、甲氧基氯甲烷(亦称momcl、aldrich)、n-甲基吲哚(merck)、n-(5-氯-2-吡啶基)双(三氟甲磺酰亚胺)(aldrich)、矿物油中60重量%nah(aldrich)、乙酸乙酯(merck)、甲醇(merck)、甲苯(merck)、正己烷(merck)、正戊烷(merck)、异丙醇(merck)、二乙醚(merck)、乙腈(merck)、己烷(merck)、四氯化碳(merck)、1,4-二氧六环(merck)、二氯甲烷(merck)、hfcl4(《0.05%zr、strem)、zrcl4(merck)、cs2co3(merck)、过碘酸钠(merck)、碘(merck)、溴(merck)、甲磺酸(merck)、乙酸(aldrich)、叔丁醇钾(merck)、碳酸氢钠(merck)、硫酸98%(merck)、氨溶液28-30%(merck)、12nhcl(merck)、k2co3(merck)、na2so4(akzo nobel)、硅胶60,40-63um(merck)、celite 503(aldrich)、cdcl3(deutero gmbh)。在
使用前通过ms(分子筛)4a干燥苯-d6(deutero gmbh)和二氯甲烷-d2(deutero gmbh)。从二苯甲酮羰游基(ketyl)钠新蒸馏用于有机金属合成的四氢呋喃(亦称thf,merck)、二乙醚和1,4-二氧六环。通过ms 4a干燥用于有机金属合成的甲苯、正己烷、己烷和正戊烷。从相应的试剂经过用蒸馏水稀释来制备3%氨水和10%hcl。从sigma aldrich购买二氯化乙基铝(己烷中1.0m)和(三甲基甲硅烷基)甲基氯化镁(二乙醚中1.0m)。
[0666]
如在[chem.commun.2015,51,第16675-16678页]中描述制备1-(叔丁基)-2-(甲氧基甲氧基)-5-甲基苯。如在[j.organomet.chem.1972,36(1),第87-92页]中描述制备四苄基铪。由4-叔丁基苯酚(merck)和金刚烷醇-1(aldrich)如在[organic letters,2015,第17(9)卷,第2242-2245页]中描述制备2-(金刚烷-1-基)-4-(叔丁基)苯酚。如在[angew.chem.,int.ed.,2002,41(16),第3059-3061页]中描述制备2-(金刚烷-1-基)-4-甲基苯酚。
[0667]
使用来自tetrahedron 2019,第75(32)卷,第4298-4306页的修改程序使用4-叔丁基苄基溴代替苄基溴来制备4-叔丁基苄基格式试剂。
[0668]
用至少400mhz波谱仪(例如bruker avance-400波谱仪)使用在氘化溶剂中1-10%溶液来记录1h和
13
c{1h}nmr频谱。1h和
13
c的化学位移参考氘化溶剂的残余1h或
13
c共振。
[0669]
如下制备过渡金属络合物5和络合物6:
[0670]
2-(金刚烷-1-基)-6-溴-4-(叔丁基)苯酚
[0671][0672]
在室温下向57.6g(203mmol)的2-(金刚烷-1-基)-4-(叔丁基)苯酚在400ml的氯仿中的溶液逐滴添加10.4ml(203mmol)的溴在200ml的氯仿中的溶液30分钟。所得的混合物用400ml的水稀释。用二氯甲烷(3
×
100ml)提取获得的混合物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。收率71.6g(97%)的白色固体。1h nmr(cdcl3,400mhz):δ7.32(d,j=2.3hz,1h),7.19(d,j=2.3hz,1h),5.65(s,1h),2.18-2.03(m,9h),1.78(m,6h),1.29(s,9h)。
13
c nmr(cdcl3,100mhz):δ148.07,143.75,137.00,126.04,123.62,112.11,40.24,37.67,37.01,34.46,31.47,29.03。
[0673]
(1-(3-溴-5-(叔丁基)-2-(甲氧基甲氧基)苯基)金刚烷
[0674][0675]
在室温下向71.6g(197mmol)的2-(金刚烷-1-基)-6-溴-4-(叔丁基)苯酚在1,
000ml的thf中的溶液分批添加8.28g(207mmol,在矿物油中60重量%)的氢化钠。在室温下向产生的悬浮液逐滴添加16.5ml(217mmol)的甲氧基氯甲烷10分钟。获得的混合物搅拌过夜,然后倒入1,000ml的水中。用二氯甲烷(3
×
300ml)提取获得的混合物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。收率80.3g(~数量)的白色固体。1h nmr(cdcl3,400mhz):δ7.39(d,j=2.4hz,1h),7.27(d,j=2.4hz,1h),5.23(s,2h),3.71(s,3h),2.20-2.04(m,9h),1.82-1.74(m,6h),1.29(s,9h)。
13
c nmr(cdcl3,100mhz):δ150.88,147.47,144.42,128.46,123.72,117.46,99.53,57.74,41.31,38.05,36.85,34.58,31.30,29.08。
[0676]
(2-(3-金刚烷-1-基)-5-(叔丁基)-2-(甲氧基甲氧基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷
[0677][0678]
在-80℃下向22.5g(55.0mmol)的(1-(3-溴-5-(叔丁基)-2-(甲氧基甲氧基)苯基)金刚烷在300ml的干燥thf中的溶液逐滴添加23.2ml(57.9mmol,2.5m)的在己烷中的nbuli持续20分钟。在这个温度下搅拌反应混合物1小时,然后添加14.5ml(71.7mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入300ml的水中。用二氯甲烷(3
×
300ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率25.0g(~数量)的无色粘性油。1h nmr(cdcl3,400mhz):δ7.54(d,j=2.5hz,1h),7.43(d,j=2.6hz,1h),5.18(s,2h),3.60(s,3h),2.24-2.13(m,6h),2.09(br.s.,3h),1.85-1.75(m,6h),1.37(s,12h),1.33(s,9h)。
13
c nmr(cdcl3,100mhz):δ159.64,144.48,140.55,130.58,127.47,100.81,83.48,57.63,41.24,37.29,37.05,34.40,31.50,29.16,24.79。
[0679]
1-(2'-溴-5-(叔丁基)-2-(甲氧基甲氧基)-[1,1'-联苯]-3-基)金刚烷
[0680][0681]
向25.0g(55.0mmol)的(2-(3-金刚烷-1-基)-5-(叔丁基)-2-(甲氧基甲氧基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷在200ml的二氧六环中的溶液随后添加15.6g
(55.0mmol)的2-溴碘苯、19.0g(137mmol)的碳酸钾、和100ml的水。用氩气吹扫获得的混合物10分钟之后添加3.20g(2.75mmol)的pd(pph3)4。在100℃搅拌如此获得的混合物12小时,然后冷却至室温并用100ml的水稀释。用二氯甲烷(3
×
100ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二氯甲烷=10:1体积)上纯化残余物。收率23.5g(88%)的白色固体。1h nmr(cdcl3,400mhz):δ7.68(dd,j=1.0,8.0hz,1h),7.42(dd,j=1.7,7.6hz,1h),7.37-7.32(m,2h),7.20(dt,j=1.8,7.7hz,1h),7.08(d,j=2.5hz,1h),4.53(d,j=4.6hz,1h),4.40(d,j=4.6hz,1h),3.20(s,3h),2.23-2.14(m,6h),2.10(br.s.,3h),1.86-1.70(m,6h),1.33(s,9h)。
13
c nmr(cdcl3,100mhz):δ151.28,145.09,142.09,141.47,133.90,132.93,132.41,128.55,127.06,126.81,124.18,123.87,98.83,57.07,41.31,37.55,37.01,34.60,31.49,29.17。
[0682]
2-(3'-(金刚烷-1-基)-5'-(叔丁基)-2'-(甲氧基甲氧基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷
[0683][0684]
在-80℃下向30.0g(62.1mmol)的1-(2'-溴-5-(叔丁基)-2-(甲氧基甲氧基)-[1,1'-联苯]-3-基)金刚烷在500ml的干燥thf中的溶液逐滴添加25.6ml(63.9mmol,2.5m)的在己烷中的nbuli持续20分钟。在这个温度下搅拌反应混合物1小时,然后添加16.5ml(80.7mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入300ml的水中。用二氯甲烷(3
×
300ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率32.9g(~数量)的无色玻璃状油。1h nmr(cdcl3,400mhz):δ7.75(d,j=7.3hz,1h),7.44-7.36(m,1h),7.36-7.30(m,2h),7.30-7.26(m,1h),6.96(d,j=2.4hz,1h),4.53(d,j=4.7hz,1h),4.37(d,j=4.7hz,1h),3.22(s,3h),2.26-2.14(m,6h),2.09(br.s.,3h),1.85-1.71(m,6h),1.30(s,9h),1.15(s,6h),1.10(s,6h)。
13
c nmr(cdcl3,100mhz):δ151.35,146.48,144.32,141.26,136.15,134.38,130.44,129.78,126.75,126.04,123.13,98.60,83.32,57.08,41.50,37.51,37.09,34.49,31.57,29.26,24.92,24.21。
[0685]
2',2”'-(吡啶-2,6-二基)双((3-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚))(qq)
[0686][0687]
向32.9g(62.0mmol)的2-(3'-(金刚烷-1-基)-5'-(叔丁基)-2'-(甲氧基甲氧基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷在140ml的二氧六环中的溶液随后添加7.35g(31.0mmol)的2,6-二溴吡啶、50.5g(155mmol)的碳酸铯、和70ml的水。用氩气吹扫获得的混合物10分钟之后添加3.50g(3.10mmol)的pd(pph3)4。在100℃下搅拌该混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向产生的油随后添加300ml的thf、300ml的甲醇和21ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入500ml的水中。用二氯甲烷(3
×
350ml)提取获得的混合物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。用70ml的正戊烷研制获得的玻璃状固体,过滤掉获得的沉淀物,用2
×
20ml的正戊烷洗涤,并在真空中干燥。收率21.5g(87%)的作为白色粉末的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ8.10+6.59(2s,2h),7.53
–
7.38(m,10h),7.09+7.08(2d,j=2.4hz,2h),7.04+6.97(2d,j=7.8hz,2h),6.95+6.54(2d,j=2.4hz),2.03
–
1.79(m,18h),1.74
–
1.59(m,12h),1.16+1.01(2s,18h)。
13
cnmr(cdcl3,100mhz,用*标出微小异构体位移):δ157.86,157.72*,150.01,149.23*,141.82*,141.77,139.65*,139.42,137.92,137.43,137.32*,136.80,136.67*,136.29*,131.98*,131.72,130.81,130.37*,129.80,129.09*,128.91,128.81*,127.82*,127.67,126.40,125.65*,122.99*,122.78,122.47,122.07*,40.48,40.37*,37.04,36.89*,34.19*,34.01,31.47,29.12,29.07*。
[0688]
二甲基铪[2',2”'-(吡啶-2,6-二基)双((3-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐))](络合物5)
[0689][0690]
在0℃下通过注射器向3.22g(10.05mmol)的四氯化铪(《0.05%zr)在250ml的干燥
甲苯中的悬浮液一次添加14.6ml(42.2mmol,2.9m)的在二乙醚中的memgbr。搅拌产生的悬浮液1分钟,并分批添加8.00g(10.05mmol)的2',2”'-(吡啶-2,6-二基)双((3-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚))1分钟。反应混合物在室温下搅拌36小时并然后蒸发至接近干燥。用2
×
100ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用50ml的正己烷研制残余物,过滤掉获得的沉淀物(g3),用20ml的正己烷洗涤两次(2
×
20ml),并然后在真空中干燥。收率6.66g(61%,~1:1溶剂与正己烷)的浅米色固体。c
59h69
hfno2×
1.0(c6h
14
)的分析计算:c,71.70,h,7.68,n,1.29。发现:c 71.95,h 7.83,n 1.18。1h nmr(c6d6,400mhz):δ7.58(d,j=2.6hz,2h),7.22-7.17(m,2h),7.14-7.08(m,4h),7.07(d,j=2.5hz,2h),7.00-6.96(m,2h),6.48-6.33(m,3h),2.62-2.51(m,6h),2.47-2.35(m,6h),2.19(br.s,6h),2.06-1.95(m,6h),1.92-1.78(m,6h),1.34(s,18h),-0.12(s,6h)。
13
c nmr(c6d6,100mhz):δ159.74,157.86,143.93,140.49,139.57,138.58,133.87,133.00,132.61,131.60,131.44,127.98,125.71,124.99,124.73,51.09,41.95,38.49,37.86,34.79,32.35,30.03。
[0691]
二甲基锆[2',2”'-(吡啶-2,6-二基)双((3-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐))](络合物6)
[0692][0693]
在0℃下通过注射器向2.92g(12.56mmol)的四氯化锆在300ml的干燥甲苯中的悬浮液一次添加18.2ml(52.7mmol,2.9m)的在二乙醚中的memgbr。向产生的悬浮液立即一次添加10.00g(12.56mmol)的2',2”'-(吡啶-2,6-二基)双((3-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚))。反应混合物在室温下搅拌2小时并然后蒸发至接近干燥。用2
×
100ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用50ml的正己烷研制残余物,过滤掉获得的沉淀物(g3),用正己烷洗涤两次(2
×
20ml),并然后在真空中干燥。收率8.95g(74%,~1:0.5溶剂与正己烷)的米色固体。c
59h69
zrno2×
0.5(c6h
14
)的分析计算:c,77.69,h,7.99,n,1.46。发现:c 77.90,h 8.15,n 1.36。1h nmr(c6d6,400mhz):δ7.56(d,j=2.6hz,2h),7.20-7.17(m,2h),7.14-7.07(m,4h),7.07(d,j=2.5hz,2h),6.98-6.94(m,2h),6.52-6.34(m,3h),2.65-2.51(m,6h),2.49-2.36(m,6h),2.19(br.s.,6h),2.07-1.93(m,6h),1.92-1.78(m,6h),1.34(s,18h),0.09(s,6h)。
13
c nmr(c6d6,100mhz):δ159.20,158.22,143.79,140.60,139.55,138.05,133.77,133.38,133.04,131.49,131.32,127.94,125.78,124.65,124.52,42.87,41.99,38.58,37.86,34.82,32.34,30.04。
[0694]
(1s,3s,5s)-1,3,5-三甲基金刚烷(a)
[0695][0696]
在parr压力反应器中,向15.0g(62.0mmol)的3,5-二甲基-1-溴代金刚烷在80ml的二乙醚的溶液一次添加在二乙醚中的22.3ml(64.0mmol,2.9m)的memgbr。将所得溶液加热至105℃并在这个温度下搅拌过夜。在这之后,将反应器冷却至室温并释放压力。更进一步,小心地添加100ml的10%hcl。用二乙醚(3
×
30ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率11.3g(99%)的无色油。1h nmr(cdcl3,400mhz):δ1.98
–
2.03(m,1h),1.25
–
1.28(m,6h),1.00
–
1.12(m,6h),0.78(s,9h)。
13
c nmr(cdcl3,100mhz)δ51.1,43.2,31.4,30.7,30.0。
[0697]
(3s,5s,7s)-3,5,7-三甲基金刚烷-1-醇(b)
[0698][0699]
向11.3g(62.0mmol)的(1s,3s,5s)-1,3,5-三甲基金刚烷(a)在70ml的乙腈的溶液添加103ml的水、70ml的四氯化碳、55.0g(255mmol)的过碘酸钠和330mg(1.28mmol)的氯化钌(iii)(水合物)。在60℃下搅拌所得悬浮液12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。使用kugelrohr设备(1mbar,100℃)纯化残余物。收率12.1g(96%)的白色结晶固体。1h nmr(cdcl3,400mhz):δ1.44(br.s,1h),1.30(s,6h),0.97
–
1.15(m,6h),0.88(s,9h)。
13
c nmr(cdcl3,100mhz)δ70.5,50.7,49.8,34.1,29.5。
[0700]
4-甲基-2-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)苯酚(c)
[0701][0702]
在室温下向20.8g(192mmol)的4-甲基苯酚和18.7g(96.3mmol)的(3s,5s,7s)-3,5,7-三甲基金刚烷-1-醇(b)在100ml的二氯甲烷的溶液逐滴添加5.8ml的97%硫酸30分钟。所得混合物在室温下搅拌30分钟,并然后小心倒入300ml的3%氨水中。用二氯甲烷(3
×
50ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。使用kugelrohr设备(0.3mbar,160℃)纯化残余物从而产生23.1g(84%)的作为白色结晶固体的目标产物。1h nmr(cdcl3,400mhz):δ7.04(d,j=2.1hz,1h),6.86(ddd,j=7.9,2.2,0.6hz,1h),6.55(d,j=7.9hz),4.52(s,1h),2.29(s,3h),1.67(s,6h),1.10
–
1.18(m,6h),0.90(s,9h)。
13
c nmr(cdcl3,100mhz):δ151.9,135.2,129.7,127.7,127.0,116.6,50.4,46.1,39.1,32.1,30.6,20.9。
[0703]
2-溴-4-甲基-6-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)苯酚(d)
[0704][0705]
在室温下向8.97g(31.5mmol)的4-甲基-2-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)苯酚(c)在90ml的二氯甲烷的溶液逐滴添加5.04g(31.5mmol)的溴。所得混合物在室温下搅拌12小时,并然后小心倒入200ml的5%nahco3中。用二氯甲烷(3
×
50ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率11.4g(99%)的白色固体。1h nmr(cdcl3,400mhz):δ7.17(d,j=2.0hz,1h),6.99(d,j=2.0hz,1h),5.65(s,1h),2.28(s,3h),1.67(s.6h),1.10
–
1.21(m,6h),0.91(s,9h)。
13
c nmr(cdcl3,100mhz):δ148.1,136.5,130.3,129.4,127.3,112.1,50.3,45.8,39.9,32.1,30.5,20.6。
[0706]
(3r,5r,7r)-1-(3-溴-2-(甲氧基甲氧基)-5-甲基苯基)-3,5,7-三甲基金刚烷(e)
[0707][0708]
在室温下向11.4g(31.4mmol)的2-溴-4-甲基-6-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)苯酚(d)在100ml的干燥thf的溶液添加1.06g(34.9mmol,60重量%(在矿物油中)氢化钠。这之后,一次添加2.65ml(34.9mmol)的momcl。将反应混合物在60℃下加热24小时并然后倒入130ml的冷水中。用3
×
20ml的二氯甲烷提取粗产物。通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率11.9g(91%)的淡黄色固体。1h nmr(cdcl3,400mhz):δ7.25(d,j=2.0hz,1h),7.06(d,j=2.0hz,1h),5.23(s,2h),3.71(s,3h),2.29(s,3h),1.68(s,6h),1.10
–
1.21(m,6h),0.92(s,9h)。
13
c nmr(cdcl3,100mhz):δ151.3,144.0,134.4,131.9,127.4,117.6,99.9,57.8,50.2,46.8,40.3,32.2,30.6,20.7。
[0709]
2-(2-(甲氧基甲氧基)-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(f)
[0710]
[0711]
在-80℃下向12.4g(30.5mmol)的(3r,5r,7r)-1-(3-溴-2-(甲氧基甲氧基)-5-甲基苯基)-3,5,7-三甲基金刚烷(e)在200ml的干燥thf中的溶液逐滴添加14.6ml(30.5mmol)的在己烷中2.5m n
buli 20分钟。在这个温度下搅拌反应混合物1小时,然后添加9.33ml(45.7mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入130ml的水中。用二氯甲烷(3
×
40ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率12.9g(93%)的白色固体。1h nmr(cdcl3,400mhz):δ7.39(d,j=1.9hz,1h),7.22(d,j=1.9hz,1h),5.16(s,2h),3.61(s,3h),2.31(s,3h),1.72(s,6h),1.38(s,12h),1.09
–
1.18(m,6h),0.90(s,9h)。
13
c nmr(cdcl3,100mhz):δ159.8,140.4,134.7,131.6,131.2,101.2,83.6,57.9,50.4,46.7,39.5,32.2,30.6,24.74,20.8。
[0712]
(3r,5r,7r)-1-(2'-溴-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)-3,5,7-三甲基金刚烷(g)
[0713][0714]
向4.50g(9.90mmol)的2-(2-(甲氧基甲氧基)-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(f)在20ml的1,4-二氧六环中的溶液随后添加2.80g(9.90mmol)的2-溴碘苯、3.42g(24.8mmol)的碳酸钾、和10ml的水。用氩气吹扫获得的混合物10分钟之后添加286mg(0.25mmol)的pd(pph3)4。在105℃下搅拌这种混合物12小时,然后冷却至室温并用100ml的水稀释。用二氯甲烷(3
×
50ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二氯甲烷=10:1体积)上纯化残余物。收率3.90g(82%)的白色固体。1h nmr(cdcl3,400mhz):δ7.73(dd,j=8.0,0.9hz,1h),7.38
–
7.46(m,2h),7.24
–
7.28(m,1h),7.23(d,j=1.6hz,1h),6.97(d,j=1.6hz,1h),4.56
–
4.58(m,1h),4.47
–
4.48(m,1h),3.31(s,3h),2.41(s,3h),1.80(s,6h),1.17
–
1.29(m,6h),0.98(s,9h)。
13
c nmr(cdcl3,100mhz):δ151.9,141.8,141.1,134.5,132.9,132.2,132.0,130.0,128.6,127.8,127.1,124.0,99.1,57.1,50.3,46.8,39.8,32.2,30.7,21.1。
[0715]
2-(2'-(甲氧基甲氧基)-5'-甲基-3'-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(h)
[0716][0717]
在-80℃下向3.80g(7.86mmol)的(3r,5r,7r)-1-(2'-溴-5-甲基-2-(甲氧基甲氧基)-[1,1'-联苯]-3-基)-3,5,7-三甲基金刚烷(g)在40ml的干燥thf中的溶液逐滴添加4.10ml(10.2mmol)的在己烷中2.5m n
buli 20分钟。在这个温度下搅拌反应混合物1小时,之后添加2.57ml(12.6mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入100ml的水中。用二氯甲烷(3
×
100ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二乙醚=10:1体积)上纯化残余物。收率3.71g(90%)的无色玻璃状油。1h nmr(cdcl3,400mhz):δ7.78(dd,j=7.4,1.0hz,1h),7.32
–
7.45(m,3h),7.11(d,j=1.9hz,1h),6.89(d,j=1.9hz,1h),4.41
–
4.48(m,2h),3.32(s,3h),2.33(s,3h),1.79(br.s,6h),1.13
–
1.25(m,18h),0.94(s,9h)。
13
c nmr(cdcl3,100mhz):δ151.9,145.6,141.1,136.6,134.4,131.5,130.5,130.3,129.9,126.7,126.1,98.9,83.4,57.2,50.4,47.0,39.7,32.2,30.7,25.2,24.8,24.1,21.0。
[0718]
(3r,5r,7r)-1-(2'-溴-4
’‑
异丙基-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)-3,5,7-三甲基金刚烷(i)
[0719][0720]
向4.64g(10.2mmol)的2-(2-(甲氧基甲氧基)-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(f)在20ml的1,4-二氧六环中的溶液随后添加3.32g(10.2mmol)的2-溴-4-异丙基碘苯、3.53g(25.5mmol)的碳酸钾、和10ml的水。用氩气吹扫获得的混合物10分钟之后添加295mg(0.255mmol)的pd(pph3)4。在105℃下搅拌这种混合物12小时,然后冷却至室温并用100ml的水稀释。用二氯甲烷(3
×
50ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二氯甲烷=10:1体积)上纯化残余物。收率4.37g(81%)的黄色油。1h nmr(cdcl3,400mhz):δ7.56(d,j=1.5hz,1h),7.31
–
7.39(m,2h),7.20
–
7.26(m,
1h),7.18(d,j=2.0hz,1h),6.93(d,j=2.0hz,1h),4.43
–
4.54(m,2h),3.26(s,3h),2.96(sept,j=6.9hz,1h),2.37(s,3h),1.76(s,6h),1.32(d,j=6.9hz,6h),1.14
–
1.24(m,6h),0.95(s,9h)。
13
c nmr(cdcl3,100mhz):δ152.0,149.9,141.8,138.4,134.5,132.1,132.0,130.7,130.2,127.6,125.4,123.8,99.0,57.0,50.4,46.8,39.8,33.6,32.2,30.7,23.91,23.88,21.0。
[0721]
2-(4-异丙基-2'-(甲氧基甲氧基)-5'-甲基-3'-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(j)
[0722][0723]
在-80℃下向4.37g(8.30mmol)的(3r,5r,7r)-1-(2'-溴-4
’‑
异丙基-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)-3,5,7-三甲基金刚烷(i)在50ml的干燥thf中的溶液逐滴添加4.32ml(10.8mmol)的在己烷中2.5m n
buli 20分钟。在这个温度下搅拌反应混合物1小时,之后添加2.71ml(13.3mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入100ml的水中。用二氯甲烷(3
×
100ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二乙醚=10:1体积)上纯化残余物。收率4.32g(91%)的无色玻璃状油。1h nmr(cdcl3,400mhz):δ7.61(s,1h),7.29
–
7.37(m,2h),7.08(d,j=2.0hz,1h),6.88(d,j=2.0hz,1h),4.40
–
4.47(m,2h),3.30(s,3h),2.99(sept,j=6.9hz,1h),2.32(s,3h),1.78(br.s,6h),1.32(d,j=6.9hz,6h),1.12
–
1.29(m,18h),0.93(s,9h)。
13
c nmr(cdcl3,100mhz):δ152.0,146.5,143.1,141.0,136.7,132.5,131.4,130.6,130.3,127.8,126.5,98.9,83.3,57.2,50.4,47.0,39.7,33.8,32.2,30.7,25.2,24.8,24.1,24.0,21.0。
[0724]
2',2”'-(吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(k)
[0725][0726]
向1.50g(2.62mmol)的2-(4-异丙基-2'-(甲氧基甲氧基)-5'-甲基-3'-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(j)在7ml的1,4-二氧六环中的溶液随后添加310mg(1.31mmol)的2,6-二溴吡啶、2.13g(6.55mmol)的碳酸铯、和4ml的水。用氩气吹扫获得的混合物10分钟之后添加151mg(0.131mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加20ml的thf、20ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
70ml)提取粗产物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率770mg(67%)的作为白色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.24
–
7.40(m,7h),7.06(s,1h),6.88
–
6.96(m,6h),6.37(d,j=1.6hz,1h),2.97
–
3.06(m,2h),2.29+2.03(2s,6h),1.24
–
1.53(m,24h),0.88
–
1.07(m,12h),0.78+0.68(2s,18h)。
13
c nmr(cdcl3,100mhz)δ158.4,158.3,150.1,149.4,148.7,148.4,140.0,138.9,136.5,136.47,136.4,134.2,134.1,133.8,133.6,132.5,131.3,130.0,129.5,129.04,129.01,128.97,128.73,128.69,128.5,128.44,128.36,127.5,127.2,126.9,126.6,122.4,122.1,50.5,50.2,46.0,45.9,39.3,39.1,33.9,33.88,32.0,31.9,30.7,30.5,24.12,24.07,24.04,23.96,21.1,20.6。
[0727]
2',2”'-(4-甲氧基吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(l)
[0728][0729]
向1.50g(2.62mmol)的2-(4-异丙基-2'-(甲氧基甲氧基)-5'-甲基-3'-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(j)在7ml的1,4-二氧六环中的溶液随后添加350mg(1.31mmol)的2,6-二溴-4-甲氧基吡啶、2.13g(6.55mmol)的碳酸铯、和4ml的水。用氩气吹扫获得的混合物10分钟之后添加151mg(0.131mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加20ml的thf、20ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
70ml)提取粗产物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率930mg(78%)的作为白色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.25
–
7.50(m,8h),6.93
–
6.98+6.37
–
6.51(2m,6h),3.36+3.50(2s,3h),3.01
–
3.08(m,2h),2.06+2.31(2s,6h),1.25
–
1.60(m,24h),0.91
–
1.11(m,12h),0.80+0.70(2s,18h)。
13
c nmr(cdcl3,100mhz)δ165.63,159.83,159.64,150.15,149.57,148.61,148.36,139.91,138.70,136.68,136.63,134.29,134.27,132.46,131.32,130.37,129.84,129.09,129.04,128.71,128.45,128.39,127.63,127.21,126.82,126.59,108.71,108.38,55.08,54.61,50.42,50.17,46.18,45.84,39.34,39.11,33.89,33.87,32.02,31.86,30.69,30.46,24.10,24.06,23.94,21.06,20.59。
[0730]
2',2”'-(4-三氟甲基吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(m)
[0731][0732]
向1.50g(2.62mmol)的2-(4-异丙基-2'-(甲氧基甲氧基)-5'-甲基-3'-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(j)在7ml的1,4-二氧六环中的溶液随后添加283mg(1.31mmol)的2,6-二氯-4-三氟甲基吡啶、2.13g(6.55mmol)的碳酸铯、和4ml的水。用氩气吹扫获得的混合物10分钟之后添加151mg(0.131mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加20ml的thf、20ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
70ml)提取粗产物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率930mg(78%)的作为浅黄色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.32
–
7.46(m,7h),7.07
–
7.12(m,2h),6.93
–
7.00(m,3h),6.47+6.23+5.88(3m,2h),3.00
–
3.08(m,2h),2.10+2.31(2s,6h),1.27
–
1.56(m,24h),0.90
–
1.09(m,12h),0.79+0.73(2s,18h)。
13
c nmr(cdcl3,100mhz)δ159.59,159.49,149.54,149.24,149.00,148.78,139.14,138.36,136.34,136.13,133.90,133.82,133.76,133.62,132.36,131.46,129.22,128.86,128.84,128.75,128.71,128.69,128.66,128.57,128.51,128.44,128.37,127.98,127.77,127.25,127.03,117.95,117.66,50.41,50.22,45.94,45.74,39.26,39.07,33.96,33.93,32.01,31.89,30.61,30.46,24.09,24.04,24.00,23.97,20.98,20.60。
[0733]
2',2”'-(吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(n)
[0734][0735]
向1.20g(2.26mmol)的2-(2'-(甲氧基甲氧基)-5'-甲基-3'-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(h)在7ml的1,4-二氧六环中的溶液随后添加241mg(1.01mmol)的2,6-二溴吡啶、1.84g(6.55mmol)的碳酸铯、和4ml的水。用氩气吹扫获得的混合物10分钟之后添加131mg(0.113mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加20ml的thf、20ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
70ml)提取粗产物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率660mg(82%)的作为白色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.46-7.51(m,6h),7.34
–
7.40(m,3h),6.89
–
6.98(m,5h),6.47
–
6.60(m,3h),2.12+2.30(2s,6h),1.28
–
1.51(m,12h),0.91
–
1.07(m,12h),0.73+0.81(2s,18h)。
13
c nmr(cdcl3,100mhz)δ157.99,157.84,149.66,149.12,140.14,139.26,136.59,136.53,136.47,136.39,136.28,136.22,132.26,131.43,130.68,130.25,129.62,129.49,129.32,129.09,128.85,128.81,128.63,128.51,128.06,128.03,127.04,126.81,122.29,121.99,50.43,50.22,46.02,45.88,39.31,39.14,32.12,32.04,31.91,30.68,30.58,30.50,21.03,20.67。
[0736]
2',2”'-(4-甲氧基吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(o)
[0737][0738]
向1.20g(2.26mmol)的2-(2'-(甲氧基甲氧基)-5'-甲基-3'-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(h)在7ml的1,4-二氧六环中的溶液随后添加272mg(1.01mmol)的2,6-二溴-4-甲氧基吡啶、1.84g(6.55mmol)的碳酸铯、和4ml的水。用氩气吹扫获得的混合物10分钟之后添加131mg(0.113mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加20ml的thf、20ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
70ml)提取粗产物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率680mg(80%)的作为白色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.44
–
7.56(m,6h),7.34
–
7.40(m,2h),6.90
–
7.05(m,5h),6.44
–
6.50(m,3h),3.37+3.47(2s,3h),2.11+2.30(2s,6h),1.29
–
1.74(m,12h),0.91
–
1.18(m,12h),0.72+0.80(2s,18h)。
13
c nmr(cdcl3,100mhz)δ165.71,165.62,159.37,159.22,149.80,149.35,139.99,138.99,136.77,136.74,136.62,136.59,132.27,131.43,130.44,130.15,130.09,129.71,129.60,129.12,128.84,128.72,128.58,127.96,126.99,126.81,108.73,108.35,55.01,54.66,50.41,50.19,46.15,46.03,45.88,39.36,39.17,32.12,32.03,31.89,30.69,30.58,30.48,21.02,20.67。
[0739]
2',2”'-(4-三氟甲基吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(p)
[0740][0741]
向1.20g(2.26mmol)的2-(2'-(甲氧基甲氧基)-5'-甲基-3'-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(h)在7ml的1,4-二氧六环中的溶液随后添加220mg(1.01mmol)的2,6-二氯-4-三氟甲基吡啶、1.84g(6.55mmol)的碳酸铯、和4ml的水。用氩气吹扫获得的混合物10分钟之后添加131mg(0.113mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加20ml的thf、20ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
70ml)提取粗产物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率802mg(93%)的作为浅黄色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.43
–
7.56(m,8h),7.09
–
7.11(m,2h),6.97
–
7.01(m,2h),6.57+6.92(m,2h),5.57+5.72(2s,2h),2.17+2.32(2s,6h),1.28
–
1.54(m,12h),0.90
–
1.12(m,12h),0.77+0.82(2s,18h)。
13
c nmr(cdcl3,100mhz)δ159.12,159.02,149.14,148.61,139.31,138.78,136.26,136.21,136.18,136.10,132.02,131.48,130.59,130.37,130.06,129.81,129.33,129.04,128.47,128.40,128.33,128.19,127.37,127.24,117.81,117.48,50.39,50.25,45.92,45.75,39.27,39.13,32.02,31.93,30.59,30.47,20.90,20.66。
[0742]
2-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚(q)
[0743][0744]
在室温下向8.10g(75.0mmol)的4-甲基苯酚和13.5g(75.0mmol)的3,5-二甲基金刚烷-1-醇在150ml的二氯甲烷中的溶液逐滴添加4.90ml(75.0mmol)的甲磺酸和5ml的乙酸在100ml的二氯甲烷中的溶液1小时。所得混合物在室温下搅拌12小时,并然后小心倒入300ml的5%nahco3。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机
提取物并然后蒸发至干燥。使用kugelrohr设备(1mbar,70℃)纯化残余物从而产生14.2g(70%)的作为浅黄色油的目标产物。1h nmr(cdcl3,400mhz):δ7.02(s,1h),6.86(dd,j=8.0,1.5hz,1h),6.54(d,j=8.0hz,1h),4.61(s,1h),2.27(s,3h),2.14
–
2.19(m,1h),1.95(br.s,2h),1.65
–
1.80(m,4h),1.34
–
1.48(m,4h),1.21(br.s,2h),0.88(s,6h)。
13
c nmr(cdcl3,100mhz):δ152.0,135.5,129.7,127.7,127.0,116.6,51.1,46.8,43.2,39.0,38.3,31.4,30.9,30.0,20.8。
[0745]
2-溴-6-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚(r)
[0746][0747]
在室温下1小时内向14.2g(52.5mmol)的2-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚(q)在200ml的二氯甲烷的溶液逐滴添加2.70ml(52.5mmol)的溴在100ml的二氯甲烷的溶液。所得混合物在室温下搅拌12小时,并然后小心倒入200ml的5%nahco3。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率17.0g(92%)的浅黄色固体。1h nmr(cdcl3,400mhz):δ7.16(d,j=2.0hz,1h),6.97(d,j=1.8hz,1h),5.64(s,1h),2.27(s,3h),2.14
–
2.20(m,1h),1.94(br.s,2h),1.67
–
1.79(m,4h),1.35
–
1.47(m,4h),1.21(br.s,2h),0.88(s,6h)。
13
c nmr(cdcl3,100mhz):δ148.2,136.8,130.3,129.4,127.3,112.1,51.0,46.4,43.1,39.1,38.7,31.4,30.9,30.0,20.6。
[0748]
(1r,3r,5s,7r)-1-(3-溴-2-(甲氧基甲氧基)-5-甲基苯基)-3,5-二甲基金刚烷(s)
[0749][0750]
在室温下向17.0g(48.7mmol)的2-溴-6-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚(r)在200ml的干燥thf中的溶液分批添加1.95g(50.0mmol,在矿物油中60重量%)的氢化钠。在这之后,逐滴添加4.00ml(53.0mmol)的momcl持续1小时。将反应混合物在60℃下加热24小时并然后倒入300ml的冷水中。用3
×
200ml的二氯甲烷提取粗产物。通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率17.2g(90%)的白色固体。1h nmr(cdcl3,400mhz):δ7.22(d,j=1.5hz,1h),7.04(d,j=1.5hz,1h),5.21(s,2h),3.69(s,
3h),2.26(s,3h),2.11
–
2.19(m,1h),1.92(br.s,2h),1.65
–
1.80(m,4h),1.34
–
1.43(m,4h),1.20(s,2h),0.87(s.6h)。
13
c nmr(cdcl3,100mhz):δ151.21,144.4,134.4,131.9,127.5,117.6,99.8,57.9,50.9,47.5,43.0,39.8,39.5,31.5,31.0,30.0,20.7。
[0751]
2-(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(t)
[0752][0753]
在-80℃下向12.8g(32.4mmol)的(1r,3r,5s,7r)-1-(3-溴-2-(甲氧基甲氧基)-5-甲基苯基)-3,5-二甲基金刚烷(s)在200ml的干燥thf中的溶液逐滴添加14.3ml(35.6mmol)的在己烷中2.5mnbuli 20分钟。在这个温度下搅拌反应混合物1小时,之后添加10.0ml(48.7mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入300ml的水中。用二氯甲烷(3
×
100ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。从异丙醇再结晶残余物。收率11.1g(78%)的白色固体。1h nmr(cdcl3,400mhz):δ7.37(d,j=1.8hz,1h),7.20(d,j=2.0hz,1h),5.14(s,2h),3.60(s,3h),2.29(s,3h),2.11
–
2.18(m,1h),1.97(br.s,2h),1.69
–
1.84(m,4h),1.34
–
1.47(m,4h),1.36(s,12h),1.20(s,2h),0.87(s,6h)。
13
c nmr(cdcl3,100mhz):δ159.8,140.7,134.7,131.7,131.2,101.1,83.7,57.9,51.1,47.4,43.2,39.7,38.7,31.5,31.0,30.1,24.8,20.8。
[0754]
(1r,3r,5s,7r)-1-(2'-溴-4
’‑
异丙基-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)-3,5-二甲基金刚烷(u)
[0755][0756]
向4.00g(9.09mmol)的2-(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(t)在20ml的1,4-二氧六环中的溶液随后添加3.55g(10.9mmol)的2-溴-4-异丙基碘苯、7.40g(22.7mmol)的碳酸铯、和10ml的水。用氩气吹扫获得的混合物10分钟之后添加525mg(0.454mmol)的pd(pph3)4。
在105℃下搅拌这种混合物12小时,然后冷却至室温并用100ml的水稀释。用二氯甲烷(3
×
50ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二氯甲烷=10:1体积)上纯化残余物。收率3.16g(68%)的黄色油。1h nmr(cdcl3,400mhz):δ7.50(d,j=1.7hz,1h),7.24
–
7.25(m,1h),7.18(dd,j=8.0,1.7hz,1h),7.11(d,j=2.0hz,1h),6.88(d,j=1.7hz,1h),4.38
–
4.48(m,2h),3.18(s,3h),2.91(sept,j=6.9hz,1h),2.31(s,3h),2.13
–
2.19(m,1h),1.94
–
2.01(m,2h),1.78
–
1.86(m,2h),1.66
–
1.72(m,2h),1.34
–
1.46(m,4h),1.27(d,j=6.9hz,6h),1.19(s,2h),0.87(s,6h)。
13
c nmr(cdcl3,100mhz):δ151.9,149.9,142.1,138.4,134.6,132.0,130.7,130.2,127.6,125.4,123.9,99.0,57.0,51.0,47.53,47.49,43.2,39.7,39.0,33.6,31.5,31.1,30.1,23.90,23.88,21.0。
[0757]
2-(3'-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-异丙基-2'-(甲氧基甲氧基)-5'-甲基-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(v)
[0758][0759]
在-80℃下向3.15g(6.16mmol)的(1r,3r,5s,7r)-1-(2'-溴-4
’‑
异丙基-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)-3,5-二甲基金刚烷(u)在50ml的干燥thf中的溶液逐滴添加2.51ml(6.28mmol)的在己烷中2.5m n
buli 20分钟。在这个温度下搅拌反应混合物1小时,之后添加1.90ml(9.24mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入100ml的水中。用二氯甲烷(3
×
100ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二乙醚=10:1体积)上纯化残余物。收率2.96g(84%)的无色玻璃状油。1h nmr(cdcl3,400mhz):δ7.58(s,1h),7.28
–
7.30(m,2h),7.06(d,j=2.0hz,1h),6.85(d,j=1.7hz,1h),4.39
–
4.47(m,2h),3.27(s,3h),2.96(sept,j=6.9hz,1h),2.29(s,3h),2.15
–
2.21(m,1h),1.73
–
2.05(m,6h),1.34
–
1.52(m,4h),1.30(d,j=6.9hz,6h),1.16
–
1.23(m,14h),0.90(s,6h)。
13
c nmr(cdcl3,100mhz):δ151.8,146.5,143.1,141.3,136.7,132.4,131.4,130.6,130.3,127.8,126.5,98.8,83.3,57.2,51.0,43.2,39.9,38.9,33.8,31.5,31.0,30.2,25.2,24.2,24.1,24.05,21.0。
[0760]
2',2”'-(吡啶-2,6-二基)双(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4'-异丙基-5-甲基-[1,1'-联苯]-2-酚)(w)
[0761][0762]
向2.90g(5.30mmol)的2-(3'-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-异丙基-2'-(甲氧基甲氧基)-5'-甲基-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(v)在20ml的1,4-二氧六环中的溶液随后添加625mg(2.65mmol)的2,6-二溴吡啶、5.13g(15.4mmol)的碳酸铯、和10ml的水。用氩气吹扫获得的混合物10分钟之后添加355mg(0.300mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加20ml的thf、20ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
70ml)提取粗产物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率1.30g(57%)的作为白色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.42
–
7.50+7.67
–
7.75(m,2h),7.25
–
7.40(m,5h),7.10
–
7.24(m,2h),6.81
–
7.01(m,5h),6.18(br.s,1h),2.96
–
3.04(m,2h),1.96+2.25(2s,6h),1.46
–
1.91(m,8h),0.97
–
1.37(m,28h),0.80+0.71(2s,3h),0.77+0.68(2s,3h)。
13
c nmr(cdcl3,100mhz)δ150.44,149.62,148.52,148.29,136.86,134.84,134.61,132.37,131.35,129.28,129.03,128.66,128.42,127.58,126.79,122.13,51.23,50.89,47.46,47.02,46.48,43.29,43.04,42.88,38.36,38.17,33.85,33.74,31.47,31.25,31.16,31.13,31.00,30.92,30.81,30.14,30.06,23.99,23.94,21.03,20.57。
[0763]
(3r,5r,7r)-1-(2'-溴-4
’‑
异丙基-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)金刚烷(x)
[0764][0765]
向8.00g(19.4mmol)的2-(3-((3r,5r,7r)-金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(ll)在40ml的1,4-二氧六环中的溶液
随后添加6.92g(21.3mmol)的2-溴-4-异丙基碘苯、6.70g(48.5mmol)的碳酸钾、和20ml的水。用氩气吹扫获得的混合物10分钟之后添加1.15g(1.00mmol)的pd(pph3)4。在105℃下搅拌这种混合物12小时,然后冷却至室温并用100ml的水稀释。用二氯甲烷(3
×
50ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二氯甲烷=10:1体积)上纯化残余物。收率7.03g(75%)的无色油。1h nmr(cdcl3,400mhz):δ7.57(d,j=1.7hz,1h),7.31
–
7.33(m,1h),7.23(dd,j=7.9,1.7hz,1h),7.18(d,j=2.0hz,1h),6.94(d,j=1.7hz,1h),4.48
–
4.54(m,2h),3.22(s,3h),2.96(sept,j=6.9hz,1h),2.37(s,3h),2.20
–
2.24(m,6h),2.14(br.s,3h),1.80
–
1.88(m,6h),1.32(d,j=6.9hz,6h)。
13
c nmr(cdcl3,100mhz):δ151.6,149.9,142.8,138.4,134.7,132.1,132.0,130.7,130.0,127.6,125.3,123.9,98.8,56.9,41.3,37.2,37.0,33.6,29.2,23.88,23.87,21.0。
[0766]
4-((3r,5r,7r)-金刚烷-1-基)-6-异丙氧基-8-异丙基-2-甲基-6h-二苯并[c,e][1,2]氧杂硼杂苯(y)
[0767][0768]
在-80℃下向7.00g(14.5mmol)的(3r,5r,7r)-1-(2'-溴-4
’‑
异丙基-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)金刚烷(x)在150ml的干燥thf中的溶液逐滴添加8.71ml(21.7mmol)的在己烷中2.5m n
buli 20分钟。在这个温度下搅拌反应混合物1小时,之后添加7.40ml(36.3mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入100ml的水中。用二氯甲烷(3
×
100ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。从异丙醇再结晶残余物。收率3.01g(48%)的白色固体。1h nmr(cdcl3,400mhz):δ8.06(d,j=8.4hz,1h),7.89(d,j=1.8hz,1h),7.81(s,1h),7.51(dd,j=8.4,2.0hz,1h),7.12(d,j=1.6hz,1h),5.24(sept,j=6.1hz,1h),3.02(sept,j=6.9hz,1h),2.42(s,3h),2.25
–
2.29(m,6h),2.14(br.s,3h),1.83(br.s,6h),1.41(d,j=6.1hz,6h),1.32(d,j=6.9hz,6h)。
[0769]
2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-4'-异丙基-5-甲基-[1,1'-联苯]-2-酚)(z)
[0770][0771]
向2.90g(6.77mmol)的4-((3r,5r,7r)-金刚烷-1-基)-6-异丙氧基-8-异丙基-2-甲基-6h-二苯并[c,e][1,2]氧杂硼杂苯(y)在20ml的1,4-二氧六环中的溶液随后添加786mg(3.32mmol)的2,6-二溴吡啶、5.52g(16.9mmol)的碳酸铯、和10ml的水。用氩气吹扫获得的混合物10分钟之后添加313mg(0.271mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率1.60g(61%)的作为白色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.14
–
7.17+7.25
–
7.47+7.70
–
7.74(3m,9h),6.97
–
7.04(m,2h),6.85
–
6.90+6.15(2m,4h),3.00
–
3.10(m,2h),1.90
–
1.98+2.26(2m,18h),1.56
–
1.84(m,18h),1.35
–
1.38(m,12h)。
13
c nmr(cdcl3,100mhz)δ158.36,158.29,150.47,149.79,148.39,139.71,138.46,137.87,137.49,136.93,136.64,134.88,134.73,132.29,131.09,130.62,130.01,129.33,129.03,128.59,128.39,128.27,127.51,126.93,126.74,126.35,122.25,122.00,40.37,40.22,37.03,36.85,36.67,36.48,33.82,33.65,29.11,28.99,23.98,23.94,23.92,20.87,20.52。
[0772]
2-(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)苯并[b]噻吩(aa)
[0773][0774]
在-10℃下向6.14g(45.8mmol)的苯并[b]噻吩在200ml的干燥thf中的溶液逐滴添加17.4ml(43.5mmol,2.5m)的在己烷中的nbuli。在0℃下搅拌反应混合物2小时,之后添加5.94g(43.5mmol)的zncl2。接下来,加热获得的溶液至室温,随后添加9.00g(22.9mmol)的(1r,3r,5s,7r)-1-(3-溴-2-(甲氧基甲氧基)-5-甲基苯基)-3,5-二甲基金刚烷(s)和1.17g
(2.29mmol)的pd[p
t
bu3]2。所得混合物在60℃下搅拌过夜,然后倒入250ml的水中。用3
×
150ml的二氯甲烷提取粗产物。通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率8.30g(81%)的浅黄色固体。1h nmr(cdcl3,400mhz):δ7.86(d,j=7.8hz,1h),7.80(d,j=7.6hz,1h),7.52(s,1h),7.32
–
7.40(m,2h),7.17
–
7.20(m,2h),4.76(s,2h),3.48(s,3h),2.37(s,3h),2.19
–
2.26(m,1h),2.04(br.s,2h),1.76
–
1.90(m,4h),1.40
–
1.52(m,4h),1.25(s,2h),0.93(s,6h)。
13
c nmr(cdcl3,100mhz):δ152.1,142.9,141.9,140.2,140.1,133.0,130.0,128.5,124.3,124.1,123.4,122.1,99.1,57.7,50.1,47.5,43.1,39.8,39.1,31.5,31.0,30.1,21.0。
[0775]
3-溴-2-(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)苯并[b]噻吩(bb)
[0776][0777]
在室温下向8.25g(18.5mmol)的2-(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷1-基)-2-(甲氧基甲氧基)-5-甲基苯基)苯并[b]噻吩(aa)在150ml的二氯甲烷的溶液添加3.29g(18.5mmol)的n-溴代琥珀酰亚胺。反应混合物在这个温度下搅拌12小时,然后倒入100ml的水中。用3
×
50ml的二氯甲烷提取粗产物。通过na2so4干燥合并的有机提取物并然后蒸发至干燥。从120ml的正己烷再结晶残余物。收率9.03g(93%)的米色固体。1h nmr(cdcl3,400mhz):δ7.92(d,j=8.0hz,1h),7.86(d,j=7.8hz,1h),7.52(t,j=7.8hz,1h),7.45(t,j=8.0hz,1h),7.27(s,1h),7.15(s,1h),4.68(s,2h),3.38(s,3h),2.41(s,3h),2.21
–
2.28(m,1h),2.08(br.s,2h),1.79
–
1.96(m,4h),1.40
–
1.56(m,4h),1.28(s,2h),0.96(s,6h)。
13
c nmr(cdcl3,100mhz):δ153.4,142.4,138.6,138.2,137.4,132.4,130.8,129.3,125.9,125.4,125.0,123.4,122.2,107.7,99.4,57.4,51.0,47.4,43.1,39.6,39.0,31.5,31.0,30.1,21.0。
[0778]
6,6'-(吡啶-2,6-二基双(苯并[b]噻吩-3,2-二基))双(2-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚)(cc)
[0779][0780]
在-80℃下向4.00g(7.55mmol)的3-溴-2-(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)苯并[b]噻吩(bb)在50ml的干燥thf的溶液逐滴添加3.08ml(7.70mmol,2.5m)的在己烷中的nbuli。在这个温度下搅拌反应混合物30分钟,然后添加1.03g(7.70mmol)的zncl2。加热获得的混合物至室温,然后随后添加0.86g(3.63mmol)的2,6-二溴吡啶和194mg(0.38mmol)的pd[p
t
bu3]2。获得的混合物在60℃下搅拌过夜,并然后倒入100ml的水中。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加50ml的thf、50ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯-三乙胺=100:10:1体积)上纯化残余物。收率1.12g(35%)的浅黄色泡沫。1h nmr(cdcl3,400mhz):δ7.87
–
7.93(m,5h),7.66(t,j=7.8hz,1h),7.39
–
7.46(m,5h),7.23(d,j=7.8hz,2h),6.90
–
6.98(m,4h),2.24(s,6h),1.78
–
1.82(m,2h),1.50
–
1.56(m,4h),0.97
–
1.34(m,18h),0.70(s,12h)。
13
c nmr(cdcl3,100mhz):δ153.5,150.6,140.3,140.0,138.9,137.9,137.8,131.9,129.5,128.7,128.5,124.9,124.8,123.9,122.9,122.1,50.9,46.6,42.9,38.3,37.8,31.2,30.9,30.2,20.9。
[0781]
3-((3r,5r,7r)-金刚烷-1-基)-5-甲基-2'-(吡啶-2-基)-[1,1'-联苯]-2-酚(dd)
[0782][0783]
向2.42g(6.27mmol)的4-((3r,5r,7r)-金刚烷-1-基)-6-异丙氧基-2-甲基-6h-二苯并[c,e][1,2]氧杂硼杂苯(nn)在20ml的1,4-二氧六环中的溶液随后添加1.04g(6.58mmol)的2-溴吡啶、5.11g(15.7mmol)的碳酸铯、和10ml的水。用氩气吹扫获得的混合物10分钟之后添加362mg(0.310mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率1.83g(74%)作为白色固体。1h nmr(cdcl3,400mhz):δ9.62(s,1h),8.41
–
8.44(m,1h),7.67(td,j=7.8,1.8hz,1h),7.44
–
7.49(m,3h),7.31
–
7.36(m,2h),7.18(ddd,j=7.6,5.0,1.1hz,1h),6.97(d,j=1.9hz,1h),6.68(d,j=2.1hz,1h),2.16
–
2.27(m,6h),2.21(s,3h),2.10(br.s,3h),1.75
–
1.86(m,6h)。
13
c nmr(cdcl3,100mhz)δ159.2,151.4,147.0,139.5,139.0,138.6,137.3,133.3,132.3,129.5,129.0,128.9,128.6,127.5,126.7,123.9,122.2,40.6,37.2,36.9,29.2,20.9。
[0784]
1-(叔丁基)-3-碘-2-(甲氧基甲氧基)-5-甲基苯(ee)
[0785][0786]
在0℃下向20.0g(96.1mmol)的1-(叔丁基)-2-(甲氧基甲氧基)-5-甲基苯在500ml的二乙醚的溶液逐滴添加77.1ml(192mmol,2.5m)的在己烷中的nbuli。在室温下搅拌所得溶液过夜。更进一步,将反应混合物冷却至-80℃,并一次添加51.2g(202mmol)的碘。获得的混合物在室温下搅拌过夜,并然后倒入100ml的水中。用二氯甲烷(3
×
50ml)提取获得的混合物,用饱和na2so3洗涤合并的有机提取物两次,通过na2so4干燥并然后蒸发至干燥。通过真空蒸馏(1mbar,沸点127℃)纯化残余物。收率26.7g(83%)的黄色油。1h nmr(cdcl3,400mhz):δ7.52(d,j=2.1hz,1h),7.14(d,j=1.5hz,1h),5.19(s,2h),3.72(s,3h),2.27
(s,3h),1.42(s,9h)。
13
c nmr(cdcl3,100mhz)δ153.1,144.5,138.5,135.9,135.1,128.9,99.5,57.8,35.6,30.9,20.4。
[0787]
2-(3-(叔丁基)-2-(甲氧基甲氧基)-5-甲基苯基)环己-1-酮(ff)
[0788][0789]
向21.0g(62.9mmol)的1-(叔丁基)-3-碘-2-(甲氧基甲氧基)-5-甲基苯(ee)在60ml的干燥1,4-二氧六环中的溶液随后添加51.2g(157mmol)的碳酸铯、1.00g的pd2(dba)3、1.70g的1,1
′‑
双(二叔丁基膦基)二茂铁和12.3g(126mmol)的环己酮。在80℃下搅拌所得悬浮液过夜,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。使用kugelrohr设备(0.4mbar,210℃)纯化残余物。收率13.0g(68%)的红色固体。1h nmr(cdcl3,400mhz):δ7.05(d,j=2.2hz,1h),6.86(d,j=2.2hz,1h),4.92
–
4.93(m,1h),4.63
–
4.64(m,1h),4.32(dd,j=12.0,5.0hz,1h),3.58(s,3h),2.52
–
2.57(m,2h),2.31(s,3h),2.14
–
2.20(m,2h),1.82
–
2.04(m,4h),1.38(s,9h)。
13
c nmr(cdcl3,100mhz)δ211.6,153.6,142.2,132.8,132.7,128.3,126.7,100.7,56.6,51.6,42.3,35.6,34.8,31.1,28.0,26.1,21.3。
[0790]
3'-(叔丁基)-2'-(甲氧基甲氧基)-5'-甲基-3,4,5,6-四氢-[1,1'-联苯]-2-基三氟甲磺酸酯(gg)
[0791][0792]
在0℃下向9.54g(31.4mmol)的2-(3-(叔丁基)-2-(甲氧基甲氧基)-5-甲基苯基)环己-1-酮(ff)在100ml的thf中的溶液添加4.22g(37.7mmol)的叔丁醇钾。所得的悬浮液在室温下搅拌2小时,并然后冷却至-30℃。更进一步,一次添加14.8g(37.7mmol)的n-(5-氯-2-吡啶基)双(三氟甲烷磺酰亚胺)。所得混合物在室温下搅拌30分钟,并然后用50ml的水稀释。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40
–
63um;淋洗液:二氯甲烷)上纯化残余物。收率13.0g(95%)作为黄色油。1h nmr(cdcl3,400mhz):δ7.11(d,j=2.2hz,1h),6.83(d,j=2.2hz,1h),4.95
–
4.96(m,1h),4.89
–
4.90(m,1h),3.60(s,3h),2.60
–
2.70(m,1h),2.49
–
2.54(m,
2h),2.35
–
2.43(m,1h),2.30(s,3h),1.87
–
1.94(m,2h),1.76
–
1.82(m,2h),1.42(s,9h)。
13
c nmr(cdcl3,100mhz)δ151.7,144.1,142.8,132.4,130.0,129.5,128.5,127.9,119.6,99.4,57.2,35.0,30.7,30.6,28.0,22.9,22.0,20.9。
[0793]
6',6”'-(吡啶-2,6-二基)双(3-(叔丁基)-5-甲基-2',3',4',5'-四氢-[1,1'-联苯]-2-酚)(hh)
[0794][0795]
在室温下向1.13g(4.30mmol)的三苯基膦在50ml的1,4-二氧六环中的溶液添加380mg(2.15mmol)的pdcl2。在90℃下加热反应混合物10分钟并然后冷却至室温。在这之后,随后添加11.7g(26.9mmol)的3'-(叔丁基)-2'-(甲氧基甲氧基)-5'-甲基-3,4,5,6-四氢-[1,1'-联苯]-2-基三氟甲磺酸酯(gg)、7.50g(29.5mmol)的双(频哪醇合)二硼和11.2g(80.5mmol)的碳酸钾。所得混合物在90℃下搅拌2天,然后用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥,产生11.2g的粗产物。向3.90g(9.28mmol)的这个产物添加1.00g(4.22mmol)的2,6-二溴吡啶、8.25g(25.3mmol)的碳酸铯、490mg(0.42mmol)的pd(pph3)4、20ml的1,4-二氧六环和10ml的水。所得混合物在90℃下搅拌7天,然后用50ml的水稀释。用二氯甲烷(3
×
50ml)提取如此获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。残余物通过预备的hplc(淋洗液:乙腈)纯化。收率290mg(10%)的白色泡沫。1h nmr(cdcl3,400mhz):δ6.49
–
7.16(m,7h),2.32
–
2.71(m,6h),2.11+2.21(2s,8h),1.78
–
1.89(m,8h),1.27+1.14(2s,18h).
13
c nmr(cdcl3,100mhz)δ161.7,148.0,140.7,137.9,136.9,136.2,135.0,130.2,128.3,126.6,126.3,125.8,122.1,74.1,58.3,34.5,32.7,32.2,29.6,29.54,29.49,27.7,23.1,22.9,22.7,22.6,20.9。
[0796]
2-(3-((3r,5r,7r)-金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)-1-甲基-1h-吲哚(ii)
[0797][0798]
在-10℃下向3.52g(26.9mmol)的n-甲基吲哚在250ml的干燥thf中的溶液逐滴添
加10.0ml(25.0mmol,2.5m)的在己烷中的nbuli。在0℃下搅拌反应混合物1小时,之后添加3.40g(25.0mmol)的zncl2。接下来,温热获得的溶液至室温,随后添加7.00g(19.2mmol)的(3r,5r,7r)-1-(3-溴-2-(甲氧基甲氧基)-5-甲基苯基)金刚烷和447mg(0.876mmol)的pd[p
t
bu3]2。所得混合物在60℃下搅拌过夜,然后倒入250ml的水中。用3
×
50ml的二氯甲烷提取粗产物。通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um;淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率4.04g(51%)的黄色固体。1h nmr(cdcl3,400mhz):δ7.65-7.68(m,1h),7.37
–
7.41(m,1h),7.13
–
7.28(m,3h),7.08
–
7.10(m,1h),6.55
–
6.56(m,1h),4.42
–
4.53(m,2h),3.64(s,3h),3.23(s,3h),2.38(s,3h),2.21(s,6h),2.14(br.s,3h),1.82(br.s,6h)。
13
c nmr(cdcl3,100mhz):δ152.4,143.0,139.9,137.5,132.8,131.0,128.6,128.1,126.1,121.4,120.4,119.6,109.4,101.6,98.6,57.4,41.2,37.2,37.0,30.7,29.1,21.0。
[0799]
2-(3-((3r,5r,7r)-金刚烷-1-基)-3-溴-2-(甲氧基甲氧基)-5-甲基苯基)-1-甲基-1h-吲哚(jj)
[0800][0801]
在室温下向3.15g(7.58mmol)的2-(3-((3r,5r,7r)-金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)-1-甲基-1h-吲哚(ii)在80ml的氯仿的溶液添加1.38g(7.73mmol)的n-溴代琥珀酰亚胺。反应混合物在这个温度下搅拌2小时,然后倒入100ml的水中。用3
×
50ml的二氯甲烷提取粗产物。通过na2so4干燥合并的有机提取物并然后蒸发至干燥。用5ml的正己烷研制残余物并在真空中干燥。收率3.66g(98%)的浅黄色固体。1h nmr(cdcl3,400mhz):δ7.64(d,j=7.8hz,1h),7.35
–
7.40(m,1h),7.30
–
7.35(m,1h),7.23
–
7.28(m,2h),7.09(m,1h),4.66
–
4.67(m,1h),4.24
–
4.26(m,1h),3.61(s,3h),3.15(s,3h),2.40(s,3h),2.13
–
2.23(m,9h),1.83(br.s,6h)。
13
c nmr(cdcl3,100mhz):δ153.2,143.0,136.8,136.3,132.7,131.4,129.3,127.0,123.7,122.6,120.3,119.2,109.5,99.0,90.2,57.3,41.2,37.2,37.0,31.1,29.1,21.0。
[0802]
6,6'-(吡啶-2,6-二基双(1-甲基-1h-吲哚-3,2-二基))双(2-((3r,5r,7r)-金刚烷-1-基)-4-甲基苯酚)(kk)
[0803][0804]
在-80℃下向3.61g(7.30mmol)的2-(3-((3r,5r,7r)-金刚烷-1-基)-3-溴-2-(甲氧基甲氧基)-5-甲基苯基)-1-甲基-1h-吲哚(jj)在100ml的干燥thf的溶液逐滴添加3.02ml(7.45mmol,2.5m)的在己烷中的nbuli。在这个温度下搅拌反应混合物30分钟,然后添加1.01g(7.45mmol)的zncl2。温热获得的混合物至室温,然后随后添加822mg(3.47mmol)的2,6-二溴吡啶和311mg(0.61mmol)的pd[p
t
bu3]2。获得的混合物在60℃下搅拌过夜,并然后倒入100ml的水中。用二氯甲烷(3
×
50ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加50ml的thf、50ml的甲醇和4ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入200ml的水中。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯-三乙胺=100:10:1体积)上纯化残余物。收率1.92g(67%)的作为黄色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ8.91+8.52(2br.s,2h),7.83
–
7.85+7.89
–
7.91(2m,2h),7.54+7.60(2t,j=7.6hz,1h),7.42
–
7.44(m,2h),7.33
–
7.36(m,2h),7.13
–
7.27(m,4h),6.98(s,2h),6.60+6.91(2s,2h),3.61+3.57(2s,6h),2.30+2.18(2s,6h),1.39
–
1.93(m,30h)。
13
c nmr(cdcl3,100mhz):δ154.0,153.7,152.5,152.0,139.4,138.8,137.7,137.4,137.3,135.7,135.5,129.6,129.1,128.7,128.5,128.3,128.1,126.8,126.6,122.5,122.4,121.8,121.6,121.1,120.7,120.5,119.5,119.3,115.2,114.7,109.62,109.58,40.3,40.0,36.9,36.8,36.7,36.6,30.9,30.7,29.0,28.95,20.9,20.8。
[0805]
2-((3r,5r,7r)-金刚烷-1-基)-6-溴-4-甲基苯酚(oo)
[0806][0807]
在室温下10分钟内向21.2g(87.0mmol)的2-(金刚烷-1-基)-4-甲基苯酚在200ml的二氯甲烷的溶液逐滴添加4.50ml(87.0mmol)的溴在100ml的二氯甲烷的溶液。所得的混合物用400ml的水稀释。用二氯甲烷(3
×
70ml)提取粗产物,用5%nahco3洗涤合并的有机提
取物,通过na2so4干燥并然后蒸发至干燥。收率21.5g(77%)的白色固体。1h nmr(cdcl3,400mhz):δ7.17(s,1h),6.98(s,1h),5.65(s,1h),2.27(s,3h),2.10
–
2.13(m,9h),1.80(m,6h),
13
c nmr(cdcl3,100mhz):δ148.18,137.38,130.24,129.32,127.26,112.08,40.18,37.32,36.98,28.99,20.55。
[0808]
(3r,5r,7r)-1-(3-溴-2-(甲氧基甲氧基)-5-甲基苯基)金刚烷(adamantine)(pp)
[0809][0810]
在室温下向21.3g(66.4mmol)的2-((3r,5r,7r)-金刚烷-1-基)-6-溴-4-甲基苯酚(oo)在400ml的thf中的溶液分批添加2.79g(69.7mmol,在矿物油中60重量%)的氢化钠。在室温下向产生的悬浮液逐滴添加5.55ml(73.0mmol)的甲氧基氯甲烷10分钟。获得的混合物搅拌过夜,然后倒入200ml的水中。用二氯甲烷(3
×
200ml)提取如此获得的混合物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。收率24.3g(数量)的白色固体。1h nmr(cdcl3,400mhz):δ7.24(d,j=1.5hz,1h),7.05(d,j=1.8hz,1h),5.22(s,2h),3.71(s,3h),2.27(s,3h),2.05
–
2.12(m,9h),1.78(m,6h)。
13
c nmr(cdcl3,100mhz):δ151.01,144.92,134.34,131.80,127.44,117.57,99.56,57.75,41.27,37.71,36.82,29.03,20.68。
[0811]
2-(3-((3r,5r,7r)-金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(ll)
[0812][0813]
在-80℃下向20.0g(55.0mmol)的(3r,5r,7r)-1-(3-溴-2-(甲氧基甲氧基)-5-甲基苯基)金刚烷(pp)在400ml的干燥thf中的溶液逐滴添加22.5ml(56.4mmol)的在己烷中2.5m n
buli 20分钟。在这个温度下搅拌反应混合物1小时,之后添加16.7ml(82.2mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入300ml的水中。用二氯甲烷(3
×
300ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率22.4g(99%)的无色粘性油。1h nmr(cdcl3,400mhz):δ7.35(d,j=2.3hz,1h),7.18(d,j=2.3hz,1h),5.14(s,2h),3.58(s,3h),2.28(s,3h),2.14(m,6h),
2.06(m,3h),1.76(m,6h),1.35(s,12h)。
13
c nmr(cdcl3,100mhz):δ159.68,141.34,134.58,131.69,131.14,100.96,83.61,57.75,41.25,37.04,29.14,24.79,20.83。
[0814]
(3r,5r,7r)-1-(2'-溴-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)金刚烷(mm)
[0815][0816]
向10.0g(24.3mmol)的2-(3-((3r,5r,7r)-金刚烷-1-基)-2-(甲氧基甲氧基)-5-甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(ll)在100ml的1,4-二氧六环中的溶液随后添加7.22g(25.5mmol)的2-溴碘苯、8.38g(60.6mmol)的碳酸钾、和50ml的水。用氩气吹扫获得的混合物10分钟之后添加1.40g(1.21mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用100ml的水稀释。用二氯甲烷(3
×
150ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二氯甲烷=10:1体积)上纯化残余物。收率10.7g(数量)的白色固体。1h nmr(cdcl3,400mhz):δ7.72(d,j=7.9hz,1h),7.35
–
7.44(m,3h),7.19
–
7.26(m,1h),6.94(m,1h),4.53(dd,j=20.0,4.6hz,2h),3.24(s,3h),2.38(s,3h),2.23(m,6h),2.15(m,3h),1.84(m,6h)。
13
c nmr(cdcl3,100mhz):δ151.51,142.78,141.11,134.63,132.76,132.16,132.13,129.83,128.57,127.76,127.03,124.05,98.85,56.95,41.21,37.18,36.94,29.07,21.00。
[0817]
4-((3r,5r,7r)-金刚烷-1-基)-6-异丙氧基-2-甲基-6h-二苯并[c,e][1,2]氧杂硼杂苯(nn)
[0818][0819]
在-80℃下向10.0g(22.7mmol)的1-(2'-溴-2-(甲氧基甲氧基)-5-甲基-[1,1'-联苯]-3-基)金刚烷(mm)在120ml的干燥thf中的溶液逐滴添加10.9ml(27.2mmol)的在己烷中2.5m n
buli 20分钟。在这个温度下搅拌反应混合物1小时,之后添加6.93ml(40.0mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,
然后倒入300ml的水中。用二氯甲烷(3
×
300ml)提取粗产物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。从30ml的异丙醇再结晶残余物。收率6.48g(74%)的白色晶体。1h nmr(cdcl3,400mhz):δ8.16(d,j=8.3hz,1h),8.09(dd,j=7.4,1.0hz,1h),7.86(d,j=1.2hz,1h),7.63
–
7.68(m,1h),7.43(td,j=7.3,1.0hz),7.19(d,j=1.8hz,1h),5.27(sept,j=6.1hz,1h),2.46(s,3h),2.30
–
2.32(m,6h),2.17(br.s,3h),1.86(br.s,6h),1.44(d,j=6.1hz,6h)。
13
c nmr(cdcl3,100mhz):δ148.4,140.6,139.3,133.0,131.8,130.7,127.5,126.6,122.8,121.9,121.6,65.7,40.7,37.2,29.1,24.7,21.4。
[0820]
((4-(甲氧基甲氧基)-1,3-亚苯基)双(丙烷-2,2-二基))二苯(rr)
[0821][0822]
在室温下向30.0g(90.8mmol)的2,4-双(2-苯基丙烷-2-基)苯酚在500ml的thf中的溶液分批添加3.81g(95.3mmol,在矿物油中60重量%)的氢化钠。在室温下向产生的悬浮液逐滴添加7.60ml(99.9mmol)的甲氧基氯甲烷10分钟。获得的混合物搅拌过夜,然后倒入500ml的水中。用二氯甲烷(3
×
300ml)提取获得的混合物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。收率34.0g(数量)的浅黄色油。1h nmr(cdcl3,400mhz):δ7.49(d,j=2.3hz,1h),7.37
–
7.42(m,4h),7.25
–
7.32(m,5h),7.15
–
7.19(m,2h),7.00(d,j=8.5hz,1h),4.68(s,2h),3.06(s,3h),1.84(s,6h),1.74(s,6h)。
13
c nmr(cdcl3,100mhz):δ153.09,151.59,150.96,143.14,137.65,127.90,127.58,126.72,125.63,125.49,125.41,124.75,114.23,93.75,55.28,42.59,42.04,30.99,29.55。
[0823]
2-(2-(甲氧基甲氧基)-3,5-双(2-苯基丙烷-2-基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(ss)
[0824][0825]
在0℃下向15.0g(40.1mmol)的((4-(甲氧基甲氧基)-1,3-亚苯基)双(丙烷-2,2-二基))二苯(rr)在400ml的干燥二乙醚中的溶液逐滴添加32.0ml(80.2mmol)的在己烷中的2.5m n
buli20分钟。在室温下搅拌反应混合物3小时,然后冷却至-80℃之后添加24.5ml(120mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入400ml的水中。用二氯甲烷(3
×
300ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。收率20.0g(数量)的无色粘性油。1h nmr(cdcl3,400mhz):δ7.49(d,j=2.4hz,1h),7.34(d,j=2.5hz,1h),7.29(d,j=4.7hz,4h),7.06
–
7.22(m,6h),4.13(s,2h),3.10(s,3h),1.74(s,6h),1.61(s,6h),1.32(s,12h)。
13
c nmr(cdcl3,100mhz):δ156.94,151.72,150.92,143.88,140.51,131.17,129.39,127.81,127.70,126.74,125.82,125.41,124.95,98.10,83.57,82.74,56.52,42.66,42.22,30.88,30.11,26.15,25.36,24.76,13.85。
[0826]
2'-溴-2-(甲氧基甲氧基)-3,5-双(2-苯基丙烷-2-基)苯基)-1,1'-联苯(tt)
[0827][0828]
向20.0g(40.0mmol)的2-(2-(甲氧基甲氧基)-3,5-双(2-苯基丙烷-2-基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(ss)在200ml的1,4-二氧六环中的溶液随后添加12.5g(44.0mmol)的2-溴碘苯、13.8g(100mmol)的碳酸钾、和100ml的水。用氩气吹扫获得的混合物10分钟之后添加2.30g(2.00mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,冷却至室温并然后用100ml的水稀释。用二氯甲烷(3
×
200ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗
液:己烷-二氯甲烷=10:1体积)上纯化残余物。收率15.6g(74%)的黄色粘性油。1h nmr(cdcl3,400mhz):δ7.62(dd,j=7.9,1.1hz,1h),7.49(d,j=2.4hz,1h),7.35
–
7.39(m,7h),7.30(d,j=4.4hz,4h),7.22
–
7.26(m,1h),7.13
–
7.18(m,1h),7.08(d,j=2.4hz,1h),3.51(d,j=4.7hz,1h),3.44(d,j=4.7hz,1h),2.73(s,3h),1.82(s,3h),1.80(s,3h),1.76(s,3h),1.75(s,3h)。
13
c nmr(cdcl3,100mhz):δ151.47,150.67,150.48,144.76,142.49,140.96,134.66,132.53,132.15,128.72,128.45,127.93,127.89,126.75,125.94,125.58,125.53,125.23,124.33,97.59,56.12,42.82,42.41,31.08,30.85,30.22,30.06。
[0829]
2-(2'-(甲氧基甲氧基)-3',5'-双(2-苯基丙烷-2-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(uu)
[0830][0831]
在-80℃下向15.6g(29.5mmol)的2'-溴-2-(甲氧基甲氧基)-3,5-双(2-苯基丙烷-2-基)-1,1'-联苯(tt)在250ml的干燥thf中的溶液逐滴添加15.4ml(38.4mmol)的在己烷中的2.5m n
buli20分钟。在这个温度下搅拌反应混合物1小时,之后添加10.8ml(53.1mmol)的2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷。获得的悬浮液在室温下搅拌1小时,然后倒入300ml的水中。用二氯甲烷(3
×
300ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-二乙醚=10:1体积)上纯化残余物。收率9.90g(58%)的无色玻璃状油。1h nmr(cdcl3,400mhz):δ7.82(d,j=7.2hz,1h),7.30
–
7.43(m,8h),7.20
–
7.27(m,5h),7.12
–
7.17(m,1h),7.08(d,j=2.4hz,1h),3.57(d,j=4.1hz,1h),3.27(d,j=4.1hz,1h),2.70(s,3h),1.81(s,3h),1.79(s,3h),1.78(s,3h),1.69(s,3h),1.22(s,12h)。
13
c nmr(cdcl3,100mhz):δ152.03,151.10,149.74,146.07,143.65,141.71,137.16,134.63,130.40,129.69,128.49,127.79,127.69,126.73,126.05,125.99,125.41,125.31,125.12,96.52,83.13,56.13,42.70,42.38,31.27,31.02,29.42,24.80,24.58。
[0832]
2',2”'-(吡啶-2,6-二基)双(3,5-双(2-苯基丙烷-2-基)-[1,1'-联苯]-2-酚)(vv)
[0833][0834]
向3.63g(6.30mmol)的2-(2'-(甲氧基甲氧基)-3',5'-双(2-苯基丙烷-2-基)-[1,1'-联苯]-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(uu)在14ml的1,4-二氧六环中的溶液随后添加745mg(3.15mmol)的2,6-二溴吡啶、5.13g(15.8mmol)的碳酸铯、和7ml的水。用氩气吹扫获得的混合物10分钟之后添加315mg(0.315mmol)的pd(pph3)4。在100℃下搅拌这种混合物12小时,然后冷却至室温并用50ml的水稀释。用二氯甲烷(3
×
50ml)提取获得的混合物,通过na2so4干燥合并的有机提取物并然后蒸发至干燥。向所得油随后添加30ml的thf、30ml的甲醇和2ml的12n hcl。反应混合物在60℃下搅拌过夜,并然后倒入500ml的水中。用二氯甲烷(3
×
35ml)提取获得的混合物,用5%nahco3洗涤合并的有机提取物,通过na2so4干燥并然后蒸发至干燥。通过快速色谱在硅胶60(40-63um,淋洗液:己烷-乙酸乙酯=10:1体积)上纯化残余物。收率2.22g(79%)的作为白色泡沫的两种异构体的混合物。1h nmr(cdcl3,400mhz):δ7.05
–
7.40(m,29h),6.82
–
6.90(m,2h),6.73(d,j=7.8hz,2h),4.85+5.52(s,2h),1.31
–
1.65(m,24h)。
13
c nmr(cdcl3,100mhz)δ158.02,151.02(宽),149.77(宽),148.46(宽),141.56,140.17(宽),136.75(宽),134.89(宽),131.31(宽),130.62(宽),128.32,128.23,127.78,127.72,126.57,125.71,125.61,125.33,124.68(宽),122.22(宽),42.39(宽),41.99,30.97(宽),30.77(宽),29.53(宽),29.34(宽)。
[0835]
二甲基铪[2',2”'-(吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物40)
[0836][0837]
在0℃下通过注射器向120mg(0.375mmol)的四氯化铪(《0.05%zr)在50ml的干燥
甲苯中的悬浮液一次添加530ul(1.54mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加330mg(0.375mmol)的2',2”'-(吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(k)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率272mg(67%)的米白色固体。c
65h81
hfno2的分析计算:c,71.83,h,7.51,n,1.29。发现:c 72.08,h 7.82,n 1.15。1h nmr(cd2cl2,400mhz):δ7.77(t,j=7.8hz,1h),7.42(dd,j=8.1,1.7hz,2h),7.17(d,j=8.1,2h),7.16(d,j=7.8hz,2h),7.02(d,j=1.9hz,2h),6.80(d,j=1.5hz,2h),6.58(d,j=1.6hz,2h),3.30(sept,j=6.9hz,2h),2.20(s,6h),1.64
–
1.71(m,6h),1.50
–
1.57(m,6h),1.30(d,j=6.9hz,6h),1.20(d,j=6.9hz,6h),1.14
–
1.21(m,6h),0.97
–
1.04(m,6h),0.83(s,18h),-0.59(s,6h)。
13
c nmr(cd2cl2,100mhz)δ159.7,159.2,148.8,140.2,140.1,137.6,133.8,133.3,132.4,129.2,129.0,128.7,127.8,126.7,124.8,51.9,50.9,46.5,40.3,33.4,32.5,30.1,24.3,23.5,21.0。
[0838]
二甲基锆[2',2”'-(吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物41)
[0839][0840]
在-30℃下通过注射器向88mg(0.375mmol)的四氯化锆在50ml的干燥甲苯中的悬浮液一次添加530ul(1.54mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加330mg(0.375mmol)的2',2”'-(吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(k)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率217mg(58%)的米色固体。c
65h81
zrno2的分析计算:c,78.10,h,8.17,n,1.40。发现:c 78.42,h 8.35,n1.23。1h nmr(cd2cl2,400mhz):7.77(t,j=7.8hz,1h),7.41(dd,j=8.1,1.7hz,2h),7.17(d,j=8.1hz,2h),7.14(d,j=7.8hz,2h),7.01(d,j=2.0hz,2h),6.78(d,j=1.6hz,2h),6.58(d,j=
1.6hz,2h),3.02(sept,j=6.8hz,2h),2.20(s,6h),1.67
–
1.74(m,6h),1.53
–
1.60(m,6h),1.29(d,j=6.8hz,6h),1.19(d,j=6.8hz,6h),1.13
–
1.19(m,6h),0.97
–
1.04(m,6h),0.83(s,18h),-0.36(s,6h)。
13
c nmr(cd2cl2,100mhz)δ159.4,159.3,148.8,140.2,140.0,137.1,134.1,133.2,132.7,129.3,128.9,128.6,127.7,126.8,124.4,50.9,46.6,43.8,40.4,33.3,32.5,31.0,24.4,23.4,21.0。
[0841]
二甲基铪[2',2”'-(4-(三氟甲基)吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物42)
[0842][0843]
在0℃下通过注射器向135mg(0.422mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加600ul(1.73mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.422mmol)的2',2”'-(4-(三氟甲基)吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(m)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率317mg(65%)的黄色固体。c
66h80
f3hfno2的分析计算:c,68.64,h,6.98,n,1.21。发现:c 68.87,h 7.13,n 1.05。1h nmr(cd2cl2,400mhz):δ7.19
–
7.29(m,6h),7.11(s,2h),6.98(d,j=1.5hz,2h),6.71(d,j=1.6hz,2h),3.06(sept,j=6.9hz,2h),2.20(s,6h),1.91
–
1.97(m,6h),1.76
–
1.82(m,6h),1.27
–
1.34(m,6h),1.28(d,j=6.9hz,6h),1.18(d,j=6.9hz,6h),1.05
–
1.10(m,6h),0.98(s,18h),0.04(s,6h)。
13
c nmr(c6d6,100mhz)δ161.4,160.1,149.1,140.7,138.1,134.1,133.4,132.3,129.9,129.4,128.5,127.4,120.4(q,j
c,f
=3.3hz),53.5,51.0,46.9,40.7,33.7,32.7,31.4,24.7,23.7,21.4。
[0844]
二甲基锆[2',2”'-(4-(三氟甲基)吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物43)
[0845][0846]
在-30℃下通过注射器向98mg(0.422mmol)的四氯化锆在50ml的干燥甲苯中的悬浮液一次添加600ul(1.73mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.422mmol)的2',2”'-(4-(三氟甲基)吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(m)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率390mg(86%)的黄色固体。c
66h80
f3zrno2的分析计算:c,74.25,h,7.55,n,1.31。发现:c 74.46,h 7.71,n 1.13。1h nmr(c6d6,400mhz):δ7.22
–
7.35(m,8h),7.02(d,j=1.7hz,2h),6.76(d,j=1.7hz,2h),3.12(sept,j=6.9hz,2h),2.26(s,6h),2.00
–
2.07(m,6h),1.84
–
1.91(m,6h),1.34
–
1.40(m,6h),1.33(d,j=6.9hz,6h),1.24(d,j=6.9hz,6h),1.10
–
1.17(m,6h),1.04(s,18h),0.33(s,6h)。
13
cnmr(c6d6,100mhz)δ161.6,159.7,149.1,140.6,137.6,134.0,133.7,132.6,129.7,129.5,128.5,127.5,120.0(q,j
c,f
=3.5hz),51.0,46.9,45.7,40.8,33.7,32.7,31.4,24.7,23.6,21.4。
[0847]
二甲基铪[2',2”'-(4-(甲氧基)吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物44)
[0848][0849]
在0℃下通过注射器向123mg(0.384mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加540ul(1.58mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加350mg(0.384mmol)的2',2”'-(4-(甲氧基)吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(l)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率332mg(77%)的米色固体。c
66h83
hfno3的分析计算:c,70.98,h,7.49,n,1.25。发现:c 71.28,h 7.72,n 1.07。1h nmr(c6d6,400mhz):δ7.28
–
7.32(m,4h),7.22(dd,j=8.1,1.9hz,2h),7.06(d,j=1.9hz,2h),6.78(d,j=2.0hz,2h),6.32(s,2h),3.13(sept,j=6.9hz,2h),2.44(s,3h),2.24(s,6h),2.01
–
2.08(m,6h),1.88
–
1.95(m,6h),1.33
–
1.39(m,6h),1.29(d,j=6.9hz,6h),1.22(d,j=6.9hz,6h),1.06
–
1.13(m,6h),1.01(s,18h),0.06(s,6h)。
13
c nmr(c6d6,100mhz)δ168.0,161.0,160.5,148.6,138.1,134.4,134.1,132.9,129.6,129.2,128.3,126.7,111.0,55.0,52.8,51.1,47.0,40.8,33.6,32.8,31.4,24.8,23.7,21.5。
[0850]
二甲基锆[2',2”'-(4-(甲氧基)吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物45)
[0851][0852]
在-30℃下通过注射器向102mg(0.439mmol)的四氯化锆在50ml的干燥甲苯中的悬浮液一次添加620ul(1.58mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.439mmol)的2',2”'-(4-(甲氧基)吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(l)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率334mg(74%)的米色固体。c
66h83
zrno3的分析计算:c,76.99,h,8.13,n,1.36。发现:c 77.28,h 8.27,n 1.24。1h nmr(c6d6,400mhz):δ7.28
–
7.32(m,4h),7.19
–
7.24(m,2h),7.04(m,2h),6.78(m,2h),6.32(s,2h),3.12(sept,j=6.8hz,2h),2.45(s,3h),2.23(s,6h),2.04
–
2.13(m,6h),1.90
–
1.99(m,6h),1.32
–
1.41(m,6h),1.28(d,j=6.8hz,6h),1.23(d,j=6.8hz,6h),1.07
–
1.13(m,6h),1.01(s,18h),0.29(s,6h)。
13
c nmr(c6d6,100mhz)δ168.0,161.2,160.0,148.6,140.8,137.6,134.7,134.0,133.2,129.7,129.0,128.3,126.8,110.6,55.0,51.1,47.0,44.5,40.9,33.6,32.8,31.4,24.8,23.6,21.5。
[0853]
二甲基铪[2',2”'-(4-(三氟甲基)吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物46)
[0854][0855]
在0℃下通过注射器向111mg(0.347mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加490ul(1.43mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加300mg(0.347mmol)的2',2”'-(4-(三氟甲基)吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(p)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率272mg(73%)的黄色固体。c
60h68
f3hfno2的分析计算:c,67.31,h,6.40,n,1.31。发现:c 67.66,h 6.58,n 1.19。1h nmr(cd2cl2,400mhz):7.58(td,j=7.6,1.3hz,2h),7.50(td,j=7.5,1.2hz,2h),7.40(s,2h),7.22
–
7.28(m,2h),7.10
–
7.14(m,2h),7.08(d,j=2.1hz,2h),6.63(d,j=1.8hz,2h),2.21(s,6h),1.77
–
1.85(m,6h),1.59
–
1.68(m,6h),1.19
–
1.27(m,6h),1.00
–
1.09(m,6h),0.90(s,18h),-0.70(s,6h)。δ
13
c nmr(cd2cl2,100mhz)δ159.6,159.4,143.0,138.0,133.4,132.2,131.6,129.9,129.8,128.9,128.6,127.2,121.5,50.9,50.8,47.0,40.5,32.7,31.2,21.0。
[0856]
二甲基锆[2',2”'-(4-(三氟甲基)吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物47)
[0857][0858]
在-30℃下通过注射器向76mg(0.324mmol)的四氯化锆在50ml的干燥甲苯中的悬浮液一次添加460ul(1.33mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加280mg(0.324mmol)的2',2”'-(4-(三氟甲基)吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(p)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率256mg(80%)的黄色固体。c
60h68
f3zrno2的分析计算:c,73.28,h,6.97,n,1.42。发现:c 73.62,h 7.17,n 1.19。1h nmr(cd2cl2,400mhz):δ7.56(td,j=7.6,1.3hz,2h),7.48(td,j=7.5,1.2hz,2h),7.38(s,2h),7.24
–
7.29(m,2h),7.05
–
7.12(m,4h),6.63(d,j=2.0hz,2h),2.21(s,6h),1.79
–
1.86(m,6h),1.62
–
1.69(m,6h),1.19
–
1.27(m,6h),1.00
–
1.09(m,6h),0.89(s,18h),-0.45(s,6h)。
13
c nmr(cd2cl2,100mhz)δ160.0,158.9,142.9,137.4,133.3,132.6,132.4,131.5,129.8,129.7,128.9,128.6,127.3,121.0,50.9,47.0,42.9,40.6,32.7,31.2,21.0。
[0859]
二甲基铪[2',2”'-(吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物48)
[0860][0861]
在0℃下通过注射器向121mg(0.377mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加530ul(1.54mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加300mg(0.377mmol)的2',2”'-(吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(n)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率254mg(67%)的米白色固体。c
59h69
hfno2的分析计算:c,70.67,h,6.94,n,1.40。发现:c 70.83,h 7.12,n 1.31。1h nmr(c6d6,400mhz):δ7.36(td,j=7.3,2.0hz,2h),7.30(d,j=2.2hz,2h),7.15
–
7.25(m,4h),7.10(d,j=7.8hz,2h),6.73(d,j=2.3hz,2h),6.38
–
6.48(m,3h),2.21(s,6h),2.02
–
2.09(m,6h),1.85
–
1.92(m,6h),1.30
–
1.39(m,6h),1.03
–
1.10(m,6h),1.01(s,18h),-0.13(s,6h)。
[0862]
二甲基锆[2',2”'-(吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物49)
[0863][0864]
在-30℃下通过注射器向88mg(0.375mmol)的四氯化锆在50ml的干燥甲苯中的悬
浮液一次添加530ul(1.54mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加330mg(0.375mmol)的2',2”'-(吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(n)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率217mg(58%)的米色固体。c
59h69
zrno2的分析计算:c,77.41,h,7.60,n,1.53。发现:c 77.75,h 7.73,n 1.38。1h nmr(c6d6,400mhz):δ7.34(td,j=7.5,1.5hz,2h),7.29(d,j=2.3hz,2h),7.13
–
7.24(m,4h),7.04-7.09(m,2h),6.73(d,j=2.3hz,2h),6.38
–
6.50(m,3h),2.21(s,6h),2.04
–
2.12(m,6h),1.87
–
1.94(m,6h),1.31
–
1.38(m,6h),1.04
–
1.10(m,6h),1.01(s,18h),0.11(s,6h)。
13
c nmr(cd2cl2,100mhz)δ159.1,158.2,142.9,140.1,137.4,133.4,133.1,132.9,130.9,129.9,129.6,128.9,128.2,126.8,124.9,50.9,47.0,42.1,40.5,32.7,31.2,21.0。
[0865]
二甲基铪[2',2”'-(4-(甲氧基)吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物50)
[0866][0867]
在0℃下通过注射器向97mg(0.302mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加430ul(1.24mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加250mg(0.302mmol)的2',2”'-(4-(甲氧基)吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(o)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率247mg(80%)的米色固体。c
60h71
hfno3的分析计算:c,69.78,h,6.93,n,1.36。发现:c 69.97,h 7.06,n 1.25。1h nmr(c6d6,400mhz):δ7.38(td,j=7.6,1.5hz,2h),7.31(d,j=2.6hz,2h),7.15
–
7.25(m,6h),6.78(d,j=2.2hz,2h),6.13(s,2h),2.45(s,3h),2.22(s,6h),2.05
–
2.13(m,6h),1.87
–
1.97(m,6h),1.33
–
1.40(m,6h),1.05
–
1.11(m,6h),1.02(s,18h),-0.11(s,6h)。
[0868]
二甲基锆[2',2”'-(4-(甲氧基)吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,
7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚盐)](络合物51)
[0869][0870]
在-30℃下通过注射器向102mg(0.439mmol)的四氯化锆在50ml的干燥甲苯中的悬浮液一次添加620ul(1.58mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.439mmol)的2',2”'-(4-(甲氧基)吡啶-2,6-二基)双(5-甲基-3-((3r,5r,7r)-3,5,7-三甲基金刚烷-1-基)-[1,1'-联苯]-2-酚)(o)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率334mg(74%)的米色固体。c
60h71
zrno3的分析计算:c,76.22,h,7.57,n,1.48。发现:c 76.51,h 7.78,n 1.23。1h nmr(c6d6,400mhz):δ7.37(td,j=7.5,1.4hz,2h),7.29(d,j=2.3hz,2h),7.12
–
7.20(m,6h),6.78(d,j=2.0hz,2h),6.13(s,2h),2.46(s,3h),2.22(s,6h),2.08
–
2.15(m,6h),1.90
–
1.98(m,6h),1.33
–
1.40(m,6h),1.05
–
1.11(m,6h)《1.02(s,18h),0.13(s,6h)。
[0871]
二甲基铪[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-4'-异丙基-5-甲基-[1,1'-联苯]-2-酚盐)](络合物52)
[0872]
[0873]
在0℃下通过注射器向161mg(0.502mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加710ul(2.06mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.502mmol)的2',2”'-(吡啶-2,6-二基)双(4'-异丙基-5-甲基-3-((3r,5r,7r)-金刚烷-1-基)-[1,1'-联苯]-2-酚)(z)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率380mg(76%)的白色固体。c
59h69
hfno2的分析计算:c,70.67,h,6.94,n,1.40。发现:c 70.85,h 7.05,n 1.31。1h nmr(c6d6,400mhz):δ7.75(t,j=7.8hz,1h),7.45(dd,j=8.1,1.8hz,2h),7.13-7.18(m,4h),6.98(d,j=2.1hz,2h),6.92(d,j=1.7hz,2h),6.59(d,j=2.1hz,2h),2.96(sept,j=6.9hz,2h),2.19(s,6h),2.17
–
2.22(m,6h),2.04
–
2.13(m,6h),1.95
–
2.05(m,6h),1.75
–
1.84(m,6h),1.65
–
1.74(m,6h),1.33(d,j=6.9hz,6h),1.21(d,j=6.9hz,6h),-0.71(s,6h)。
13
c nmr(c6d6,100mhz)δ159.4,158.2,149.0,140.7,140.0,138.7,133.4,132.81,132.78,129.6,129.4,128.0,127.7,126.8,125.9,50.0,41.2,37.6,37.5,33.7,29.7,26.3,22.1,21.0。
[0874]
二甲基锆[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-4'-异丙基-5-甲基-[1,1'-联苯]-2-酚盐)](络合物53)
[0875][0876]
在-30℃下通过注射器向102mg(0.439mmol)的四氯化锆在50ml的干燥甲苯中的悬浮液一次添加620ul(1.58mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.439mmol)的2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-4'-异丙基-5-甲基-[1,1'-联苯]-2-酚)(z)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率334mg(74%)的米色固体。c
59h69
zrno2的分析计算:c,77.41,h,7.60,n,1.53。发现:c 77.74,h 7.78,n 1.32。1h nmr(c6d6,400mhz):δ7.74(t,j=7.8hz,1h),7.44(dd,j=8.1,1.8hz,2h),7.11
–
7.18(m,4h),6.98(d,j=
2.0hz,2h),6.90(d,j=1.8hz,2h),6.59(d,j=1.7hz,2h),2.94(sept,j=6.9hz,2h),2.19(s,6h),2.18
–
2.27(m,6h),2.07
–
2.14(m,6h),1.96
–
2.06(m,6h),1.76
–
1.84(m,6h),1.67
–
1.75(m,6h),1.32(d,j=6.9hz,6h),1.20(d,j=6.9hz,6h),-0.47(s,6h)。
13
c nmr(c6d6,100mhz)δ158.9,158.5,148.9,140.6,140.0,138.1,133.3,133.2,133.1,129.5,129.46,127.9,127.6,126.9,125.4,41.7,41.2,37.7,37.5,33.7,29.7,26.3,22.1,21.0。
[0877]
二甲基铪[2',2”'-(吡啶-2,6-二基)双(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4'-异丙基-5-甲基-[1,1'-联苯]-2-酚盐)](络合物54)
[0878][0879]
在0℃下通过注射器向150mg(0.469mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加663ul(1.92mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.469mmol)的2',2”'-(吡啶-2,6-二基)双(3-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4'-异丙基-5-甲基-[1,1'-联苯]-2-酚)(w)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率375mg(76%)的白色固体。c
63h77
hfno2的分析计算:c,71.47,h,7.33,n,1.32。发现:c 71.74,h 7.48,n 1.14。1h nmr(cd2cl2,400mhz):δ7.75(t,j=7.8hz,1h),7.45(dd,j=8.1,1.8hz,2h),7.14
–
7.18(m,4h),7.00(d,j=2.1hz,2h),6.91(d,j=1.8hz,2h),6.59(d,j=1.7hz,2h),2.98(sept,j=6.9hz,2h),2.65
–
2.73(m,2h),2.50
–
2.58(m,2h),2.19(s,6h),1.97
–
2.08(m,2h),1.28
–
1.45(m,6h),1.33(d,j=6.9hz,6h),1.21(d,j=6.9hz,6h),1.10
–
1.23(m,6h),1.00
–
1.05(m,2h),0.92(s,6h),0.77(s,6h),-0.69(s,6h)。
13
c nmr(c6d6,100mhz)δ159.4,158.3,149.0,140.7,140.0,138.1,133.4,132.9,132.7,129.45,129.43,128.2,127.7,126.8,125.8,52.0,50.4,49.9,45.9,44.1,42.6,39.3,38.6,33.7,32.2,31.8,31.6,31.0,30.5,26.0,22.4,21.0。
[0880]
三苄基铪[3-((3r,5r,7r)-金刚烷-1-基)-5-甲基-2'-(吡啶-2-基)-[1,1'-联苯]-2-酚盐](络合物55)
[0881][0882]
在室温下向200mg(0.505mmol)的3-((3r,5r,7r)-金刚烷-1-基)-5-甲基-2'-(吡啶-2-基)-[1,1'-联苯]-2-酚(dd)在50ml的甲苯的溶液添加274mg(0.505mmol)的四苄基铪。所得混合物搅拌过夜并然后蒸发至干燥。用5ml的正戊烷研制残余物,过滤掉获得的沉淀物(g4),用3ml的正戊烷洗涤,并然后在真空中干燥。收率288mg(67%)的浅黄色固体。c
49h49
hfno的分析计算:c,69.53,h,5.84,n,1.65。发现:c 69.78,h 5.99,n 1.48。1h nmr(cd2cl2,400mhz):δ7.69(d,j=5.4hz,1h),7.12
–
7.19(m,6h),7.11(td,j=7.6,1.5hz,1h),7.04(d,j=2.0hz,1h),7.00(td,j=7.6,1.5hz,1h),6.84
–
6.93(m,9h),6.68(d,j=2.2hz,1h),6.35
–
6.47|(m,2h),6.20
–
6.27(m,1h),6.05(dd,j=7.6,1.0hz,1h),2.19
–
2.30(m,6h),2.10
–
2.18(m,9h),1.86
–
1.96(m,6h),1.70
–
1.78(m,6h)。
13
c nmr(c6d6,100mhz)δ159.4,157.3,148.1,144.0,143.8,139.4,138.8,133.4,132.8,132.1,132.0,131.7,129.1,129.0,128.7,128.5,127.9,127.4,123.9,122.4,82.6,41.4,37.8,37.7,29.9,21.3。
[0883]
二甲基铪[6,6'-(吡啶-2,6-二基双(1-甲基-1h-吲哚-3,2-二基))双(2-((3r,5r,7r)-金刚烷-1-基)-4-甲基苯酚盐)](络合物56)
[0884][0885]
在-80℃下通过注射器向195mg(0.611mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加860ul(2.50mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加500mg(0.611mmol)的6,6'-(吡啶-2,6-二基双(1-甲基-1h-吲哚-3,2-二基))双(2-((3r,5r,7r)-金刚烷-1-基)-4-甲基苯酚)(kk)。反应混合物在室温下搅拌4小时
并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率394mg(63%,大约80%纯度)的白色固体。1h nmr(c6d6,400mhz):δ7.20
–
7.30(m,6h),7.09
–
7.15(m,4h),6.75
–
6.81(m,3h),6.48(d,j=2.2hz,2h),3.13(s,6h),2.28
–
2.36(m,6h),2.19(s,6h),2.04
–
2.13(m,6h),1.88
–
1.94(m,6h),1.78
–
1.85(m,6h),1.68
–
1.74(m,6h),-0.21(s,6h)。
13
c nmr(cd2cl2,100mhz)δ161.0,154.3,141.7,140.3,138.9,129.8,129.3,128.1,126.9,126.6,123.2,122.2,121.5,119.0,110.1,107.0,48.3,40.8,37.6,37.3,31.5,29.4,21.0。
[0886]
二甲基铪[6,6'-(吡啶-2,6-二基双(苯并[b]噻吩-3,2-二基))双(2-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚盐)](络合物57)
[0887][0888]
在0℃下通过注射器向145mg(0.454mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加640ul(1.86mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.454mmol)的6,6'-(吡啶-2,6-二基双(苯并[b]噻吩-3,2-二基))双(2-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚)(cc)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率337mg(68%)的米色固体。c
61h65
hfno2s2的分析计算:c,67.42,h,6.03,n,1.29。发现:c 67.64,h 6.25,n 1.07。1h nmr(c6d6,400mhz):δ7.34
–
7.38(m,2h),7.28(d,j=2.2hz,2h),7.05
–
7.15(m,6h),6.90(d,j=7.2hz,2h),6.67(t,j=7.6hz,1h),6.40
–
6.45(m,2h),2.54
–
2.60(m,2h),2.20(s,6h),2.18
–
2.27(m,2h),1.63
–
1.75(m,6h),1.54
–
1.59(m,2h),1.45
–
1.49(m,2h),1.28
–
1.39(m,6h),1.07
–
1.17(m,6h),0.91(s,6h),0.82(s,6h),0.18(s,6h).
13
c nmr(cd2cl2,100mhz)δ160.1,154.5,149.0,141.3,140.9,140.3,139.3,134.4,134.2,130.7,129.9,127.0,125.9,125.7,124.0,122.8,122.6,51.8,48.9,45.7,43.8,42.4,39.4,38.4,31.9,31.6,31.5,30.9,30.0,21.0。
[0889]
二甲基锆[6,6'-(吡啶-2,6-二基双(苯并[b]噻吩-3,2-二基))双(2-((1r,3r,5s,
7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚盐)](络合物58)
[0890][0891]
在-30℃下通过注射器向80mg(0.340mmol)的四氯化锆在50ml的干燥甲苯中的悬浮液一次添加480ul(1.40mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加300mg(0.340mmol)的6,6'-(吡啶-2,6-二基双(苯并[b]噻吩-3,2-二基))双(2-((1r,3r,5s,7r)-3,5-二甲基金刚烷-1-基)-4-甲基苯酚)(cc)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率214mg(63%)的米色固体。c
61h65
zrno2s2的分析计算:c,73.30,h,6.56,n,1.40。发现:c 73.54,h 6.70,n 1.24。1h nmr(c6d6,400mhz):δ7.32
–
7.37(m,2h),7.28(m,2h),7.08
–
7.16(m,6h),6.87
–
6.92(m,2h),6.67(t,j=8.0hz,1h),6.40
–
6.44(m,2h),2.56
–
2.63(m,2h),2.23
–
2.29(m,2h),2.20(s,6h),1.65
–
1.78(m,6h),1.54
–
1.60(m,2h),1.44
–
1.50(m,2h),1.30
–
1.40(m,6h),1.06
–
1.18(m,6h),0.91(s,6h),0.82(s,6h),0.41(s,6h)。
13
c nmr(cd2cl2,100mhz)δ159.5,154.7,148.7,141.3,140.9,140.2,138.7,134.3,134.2,130.7,129.8,127.2,126.6,125.9,125.6,122.8,122.6,51.8,48.8,45.8,43.8,42.4,39.5,38.5,31.9,31.6,31.5,30.9,30.0,21.0。
[0892]
二甲基铪[6',6”'-(吡啶-2,6-二基)双(3-(叔丁基)-5-甲基-2',3',4',5'-四氢-[1,1'-联苯]-2-酚盐)](络合物59)
[0893]
[0894]
在0℃下通过注射器向91mg(0.283mmol)的四氯化铪(《0.05%zr)在50ml的干燥甲苯中的悬浮液一次添加400ul(1.17mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加160mg(0.283mmol)的6',6”'-(吡啶-2,6-二基)双(3-(叔丁基)-5-甲基-2',3',4',5'-四氢-[1,1'-联苯]-2-酚)(hh)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物(g4),用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率146mg(67%,大约90%纯度)的白色固体。1h nmr(c6d6,400mhz):δ7.07(d,j=1.9hz,2h),6.62(d,j=2.2hz,2h),6.47(t,j=7.8hz,1h),6.19(d,j=7.8hz,2h),2.32
–
2.48(m,4h),2.18
–
2.28(m,2h),2.14(s,6h),1.73
–
1.89(m,6h),1.70(s,18h),1.47
–
1.58(m,4h),0.86(s,6h)。
13
c nmr(cd2cl2,100mhz)δ160.7,158.2,143.9,140.5,138.1,134.3,129.4,126.9,126.8,123.6,50.0,35.4,34.8,31.6,30.4,22.8,22.7,21.0。
[0895]
二氯化锆[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐)](络合物60)
[0896][0897]
向二甲基锆[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐)](络合物6)(1.00g,1.09mmol)在甲苯(10ml)中的搅拌悬浮液逐滴添加二氯化乙基铝(2.4ml,己烷中1.0m,2.4mmol,2.2当量)。反应然后搅拌并加热至60℃持续1小时。然后,在去除热之后,反应在氮气流下然后在高真空下浓缩。在己烷(10ml)中搅拌残余物。通过塑料熔料漏斗过滤所得悬浮液。将过滤的固体用另外的己烷(10ml)洗涤。收集过滤的固体并在高真空下浓缩从而产生产物为灰色固体(0.99g,95%收率)。1h nmr(400mhz,cd2cl2):δ7.86(t,1h,j=7.8hz),7.65(td,2h,j=7.6,1.4hz),7.46(td,2h,j=7.6,1.3hz),7.35(dd,2h,j=7.8,1.2hz),7.27(d,2h,j=7.8hz),7.25-7.20(m,4h),6.91(d,2h,j=2.5hz),2.18-2.08(m,6h),2.09-1.97(m,12h),1.86(br d,6h,j=12.0hz),1.71(br d,6h,j=12.0hz),1.25(s,18h)。
[0898]
双([三甲基甲硅烷基]甲基)锆[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐)](络合物61)
[0899][0900]
向二氯化锆[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐)](络合物60)(0.208g,0.218mmol)在甲苯(5ml)中的搅拌悬浮液添加(三甲基甲硅烷基)甲基氯化镁(1.1ml,二乙醚中1.0m,1.1mmol,5.1当量)。在室温下搅拌反应24小时。然后将反应加热至90℃并搅拌额外1.5小时。反应去除热,并在氮气流下然后在高真空下随后浓缩内容物。用己烷(10ml)洗涤残余物并通过celite过滤。用甲苯(3
×
3ml)进一步提取过滤的固体。将合并的甲苯滤液在氮气流下在90℃下并然后在高真空下浓缩产生一部分产物为灰白色泡沫(0.150g,65%收率)。原始己烷滤液在氮气流下然后在高真空下浓缩。残余物(棕色油)与己烷(2ml)混合并冷却至-35℃。在塑料熔料漏斗上过滤所得沉淀同时冷却。收集过滤的固体并在高真空下浓缩从而产生单独一部分产物(0.030g,13%收率)。1hnmr(400mhz,c6d6):δ7.54(d,2h,j=2.6hz),7.46(dd,2h,j=7.7,1.2hz),7.27(td,2h,j=7.6,1.4hz),7.14-6.99(m,4h),6.97(dd,2h,j=7.6,1.4hz),6.45(dd,1h,j=8.3,7.1hz),6.35-6.30(m,2h),2.57(br d,6h,j=12.1hz),2.39(br d,6h,j=12.1hz),2.22(br s,6h),2.02(br d,6h,j=12.1hz),1.85(br d,6h,j=12.1hz),1.29(s,18h),1.17(d,2h,j=11.8hz),0.21(s,18h),-1.57(d,2h,j=11.8hz)。
[0901]
四(4-叔丁基苄基)锆(络合物62)
[0902][0903]
向冷却至-70℃的氯化锆(0.290g,1.25mmol)在二氯甲烷(5ml)的搅拌悬浮液通过加料漏斗逐滴添加4-叔丁基苄基溴化镁(2.31g,含有二乙醚,56.6质量%纯度,在5ml二氯甲烷中,大约1.04m,5.20mmol,4.18当量)的溶液。然后去除加料漏斗,将反应容器覆盖在箔
中以避光,并且搅拌反应2小时同时缓慢加热至室温。通过celite过滤反应。滤液在氮气流下然后在高真空下浓缩。在戊烷中搅拌残余物。在塑料熔料漏斗上过滤所得悬浮液。收集过滤的固体并在高真空下浓缩从而产生产物为橙黄色固体,含有二乙醚(1.74当量)(0.973g,96%收率)。
[0904]
双(4-叔丁基苄基)锆[2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚盐)](络合物63)
[0905][0906]
向四(4-叔丁基苄基)锆(络合物62)(0.171g,0.251mmol,1当量)在甲苯(10ml)中的搅拌溶液缓慢添加2',2”'-(吡啶-2,6-二基)双(3-((3r,5r,7r)-金刚烷-1-基)-5-(叔丁基)-[1,1'-联苯]-2-酚)(qq)(0.200g,0.251mmol)在甲苯(5ml)中的溶液。在室温下搅拌反应4小时。通过celite过滤反应。滤液在氮气流下然后在高真空下浓缩。用戊烷(5ml)洗涤残余物并在高真空下浓缩。将所得固体用最少的甲苯洗涤并在高真空下浓缩从而产生产物为灰白色固体(0.108g,36%收率)。1h nmr(400mhz,c6d6):δ7.64(d,2h,j=2.6hz),7.53-7.47(m,2h),7.15-6.95(m,12h),6.78(d,4h,j=8.2hz),6.48(dd,1h,j=8.4,7.1hz),6.38-6.34(m,2h),2.53(br d,6h,j=12.3hz),2.45-2.35(m,8h),2.22(br s,6h),2.06(br d 6h,j=11.9hz),1.86(br d,6h,j=12.1hz),1.32(s,18h),1.29(s,18h),0.19(d,2h,j=11.2hz)。
[0907]
二甲基铪[2',2”'-(吡啶-2,6-二基)双(3,5-双(2-苯基丙烷-2-基)-[1,1'-联苯]-2-酚盐)(催化剂64)
[0908][0909]
在0℃下通过注射器向144mg(0.450mmol)的四氯化铪在50ml的干燥甲苯中的悬浮液一次添加698ul(2.03mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加400mg(0.450mmol)的2',2”'-(吡啶-2,6-二基)双(3,5-双(2-苯基丙烷-2-基)-[1,1'-联
苯]-2-酚)(vv)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
20ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物,用2
×
5ml的正己烷洗涤,并然后在真空中干燥。收率335mg(68%)的米白色固体。c
67h65
hfno2的分析计算:c,73.51,h,5.98,n,1.28。发现:c 73.85,h 6.12,n 1.13。1h nmr(c6d6,400mhz):δ7.33
–
7.35(m,6h),7.23-7.24(m,4h),7.03
–
7.20(m,15h),6.98(t,j=7.2hz,2h),6.86(d,j=7.4hz,2h),6.58(t,j=7.6hz,1h),6.33(d,j=7.8hz,2h),1.96(s,6h),1.76(s,6h),1.61(s,6h),1.60(s,6h),-0.74(s,6h)。
13
c nmr(cdcl3,100mhz)δ158.12,157.62,151.61,150.77,142.27,138.95,138.69,136.28,132.75,132.18,131.68,130.74,127.67,127.40,126.91,126.83,126.65,126.20,125.21,124.88,48.42,42.89,42.32,32.58,30.96,30.84,28.46。
[0910]
二甲基锆[2',2”'-(吡啶-2,6-二基)双(3,5-双(2-苯基丙烷-2-基)-[1,1'-联苯]-2-酚盐)(络合物65)
[0911][0912]
在-40℃下通过注射器向584mg(2.50mmol)的四氯化锆在100ml的干燥甲苯中的悬浮液一次添加3.50ml(10.2mmol)的在二乙醚中的2.9m memgbr。向产生的悬浮液立即一次添加2.22g(2.50mmol)的2',2”'-(吡啶-2,6-二基)双(3,5-双(2-苯基丙烷-2-基)-[1,1'-联苯]-2-酚)(vv)。反应混合物在室温下搅拌4小时并然后蒸发至接近干燥。用2
×
30ml的热的甲苯提取获得的固体,并且通过celite 503的薄垫过滤合并的有机提取物。接下来,蒸发滤液至干燥。用5ml的正己烷研制残余物,过滤掉获得的沉淀物,用5ml的正己烷洗涤两次,并然后在真空中干燥。收率2.37g(94%)的米白色固体。c
67h65
zrno2的分析计算:c,79.88,h,6.50,n,1.39。发现:c 80.17,h 6.71,n 1.34。1h nmr(c6d6,400mhz):δ7.34
–
7.37(m,6h),7.24
–
7.26(m,4h),7.20(dd,j=7.7,1.1hz,2h),7.12
–
7.19(m,8h),7.02
–
7.10(m,8h),6.97(t,j=7.3hz,2h),6.84(dd,j=7.4,1.3hz,2h),6.59(t,j=7.7hz,1h),6.32(d,j=7.8hz,2h),1.97(s,6h),1.75(s,6h),1.62(s,6h),1.61(s,6h),-0.49(s,6h)。
[0913]
在聚合实验中使用以下过渡金属络合物。关于一些络合物的详细合成程序可见于以下共同未决的申请:
[0914]
1)2020年2月11日提交的ussn 16/788,022;
[0915]
2)2020年2月11日提交的ussn 16/788,088;
[0916]
3)2020年2月11日提交的ussn 16/788,124;
[0917]
4)2020年2月11日提交的ussn 16/787,708;和
[0918]
5)题目为“propylene copolymers obtained using transition metal bis
(phenolate)catalyst complexes and homogeneous process for production thereof”的同时提交的pct申请号____(代理人案号2020em048),其要求2020年2月11日提交的ussn 62/972,962的优先权。
[0919]
[0920]
[0921]
[0922]
[0923]
[0924][0925]
使用以下对比络合物:
[0926][0927]
小规模聚合:
[0928]
聚合试剂。使用在甲苯(exxonmobil chemical-无水的,储存在n2下)(98%)中溶解的给定过渡金属络合物制备前催化剂溶液,通常浓度为0.5mmol/l。当指出时,一些络合物使用甲基铝氧烷(mao,在甲苯中10重量%,可从albemarle corp.得到)预烷基化。如下来进行预烷基化:通过首先将茂金属络合物溶解在适当量的甲苯中,并然后添加20当量的mao,从而产生0.5mmol络合物/l和10mmol mao/l的最终前催化剂溶液浓度。
[0929]
使用甲基铝氧烷(活化剂d,mao,在甲苯中10重量%,albemarle corp.)、四全氟苯基硼酸二甲基苯铵(活化剂a,boulder scientific或w.r.grace)、四全氟苯基硼酸三苯基碳(活化剂b,strem chemical co.)或四(全氟萘-2-基)硼酸二甲基苯铵(活化剂c,
w.r.grace)进行络合物的活化。mao通常作为0.5重量%或1.0重量%甲苯溶液使用。以下报道的mao的微摩尔数基于mao中铝的微摩尔数,其具有58.0克/摩尔的分子量。四(全氟苯基)硼酸n,n-二甲基苯铵(a)、四(全氟苯基)硼酸三苯基碳(b)和四(全氟萘-2-基)硼酸n,n-二甲基苯铵(c)通常作为5mmol/l的甲苯溶液使用。
[0930]
对于使用硼酸盐活化剂(a、b或c)的聚合运行而言,在引入活化剂和茂金属络合物至反应器中之前三正辛基铵(tnoal,纯的,akzonobel)还用作清除剂。tnoal通常作为5mmol/l的甲苯溶液使用。
[0931]
由exxonmobil chemical co.供应并通过以下一系列的柱纯化溶剂、聚合级甲苯和/或异己烷:来自labclear(加利福尼亚州奥克兰)的两个串联的500cc oxyclear圆柱,之后是两个串联的填充有干燥的分子筛(mole sieve)(8-12目,aldrich chemical company)的500cc柱和两个串联的填充有干燥的分子筛(8-12目,aldrich chemical company)的500cc柱。
[0932]
聚合级丙烯由通过以下一系列的柱纯化:来自labclear的2,250cc oxiclear圆柱,之后是填充有分子筛(8-12目,aldrich chemical company)的2,250cc柱,然后两个串联的填充有分子筛(8-12目,aldrich chemical company)的500cc柱,然后填充有selexsorb cd(basf)的500cc柱和最后填充有selexsorb cos(basf)的500cc柱。
[0933]
通过用氮气除气、通过na/k搅拌、通过干燥celite过滤、之后使用brockman碱性氧化铝柱纯化来纯化1-辛烯(c8)、1-癸烯(c
10
)、1-十四碳烯(c
14
)和4-甲基-1-戊烯(4mp1)。
[0934]
反应器描述和准备:在惰性气氛(n2)干燥箱中使用配备有用于温度控制的外部加热器,玻璃插入件(反应器的内部体积~23.5ml),隔膜入口,氮气、乙烯和丙烯的调整供应和一次性peek机械搅拌器(800rpm)的高压釜中进行聚合。通过用干燥的氮气在110℃或115℃下吹扫5小时并然后在25℃下吹扫5小时来准备高压釜。
[0935]
丙烯聚合(pp):
[0936]
如以上描述准备反应器,加热至40℃并然后用丙烯气体在大气压力下吹扫。对于mao活化运行,通过注射器添加甲苯、mao、丙烯(1.0ml,除非在表中另外列出)和共聚单体(如果使用)。然后加热反应器至工艺温度(通常70℃或100℃,除非另外提到)同时以800rpm搅拌。在工艺条件下通过注射器向反应器添加前催化剂溶液。监测反应器温度并通常维持在+/-1℃内。通过添加大约50psi o2/ar(5摩尔%o2)或空气混合物至高压釜大约30秒使聚合停止。基于大约8psi(除非不同规定)的预定压力损失(以psi为单位的最大淬灭值)或持续最大30分钟聚合时间(除非不同规定)使聚合淬灭。然后冷却反应器并排气。在真空中去除溶剂之后分离聚合物。报道实际淬灭时间。小于最大反应时间的淬灭时间表明反应以摄取量淬灭。报告的收率包括聚合物和残余催化剂的总重量。催化剂活性报告为克聚合物/mmol茂金属络合物/小时的反应时间(gp/mmol cat
·
hr)。在以下表1至4和9中总结丙烯均聚实例包括表征。在以下表9和10中总结丙烯共聚实例包括表征。
[0937]
小规模聚合物表征。对于分析测试而言,通过在165℃下在摇动式烘箱(shaker oven)中将聚合物溶解在含有2,6-二叔丁基-4-甲基苯酚(bht,sigma-aldrich,99%)的1,2,4-三氯苯(tcb,99+%纯度)中大约3小时来制备聚合物样品溶液。聚合物在溶液中的通常
浓度为0.1-0.9mg/ml,其中bht浓度为1.25mg bht/ml的tcb。将样品冷却至135℃用于测试。
[0938]
使用如在美国专利6,491,816;6,491,823;6,475,391;6,461,515;6,436,292;6,406,632;6,175,409;6,454,947;6,260,407和6,294,388中描述的自动“快速gpc”系统来进行高温尺寸排阻色谱法,上述专利每个通过引用并入本文。通过凝胶渗透色谱法使用配备有蒸发光散射检测器(elsd)并使用聚苯乙烯标准物(polymer laboratories:聚苯乙烯校准试剂盒s-m-10:mp(峰mw)在5,000和3,390,000之间)校准的symyx technology gpc来测量聚合物的分子量(重均分子量(mw)、数均分子量(mn)、z均分子量(mz))和分子量分布(pdi=mwd=mw/mn),其有时也称作聚合物的多分散性(pdi)。供选择地,通过凝胶渗透色谱法使用配备有双波长红外检测器并使用聚苯乙烯标准物(polymer laboratories:聚苯乙烯校准试剂盒s-m-10:mp(峰mw)在580和3,039,000之间)校准的symyx technology gpc测量样品。在2.0ml/分钟的淋洗液流速下(135℃样品温度,165℃烘箱/柱)使用串联的三个polymer laboratories:plgel 10μm混合-b 300
×
7.5mm柱运行样品(将250μl的在tcb中的聚合物溶液注入体系)。没有使用柱扩散修正。使用可从symyx technologies得到的软件或可从freeslate得到的automation studio软件进行数据分析。获得的分子量是相对于线性聚苯乙烯标准物。在以下表格中如以上定义的标题mn、mw、mz和pdi下报道分子量数据。
[0939]
在ta-q100仪器上进行差示扫描量热法(dsc)测量以测定聚合物的熔点。在220℃下预先退火样品15分钟(第一次熔融)并然后使其冷却至室温过夜。然后将样品以100℃/分钟的速率加热至220℃(第2次熔融),并然后以50℃/分钟的速率冷却。在加热过程中收集熔点。报道的值是峰值熔融温度并出于本公开内容的目的被称作第二次熔融。表中在标题tm下报道了结果。
[0940]
表1.丙烯聚合运行。催化剂号(cat id)对应于图表中表示的络合物号。标准条件包括:当使用活化剂a、b或c时1.1当量活化剂,或当使用活化剂d时500当量活化剂。活化剂号(act id):[phme2nh][b(c6f5)4]是a,其中c6f5是全氟苯基,[ph3c][b(c6f5)4]是b,[phme2nh][b(c
10
f7)4]是c,其中c
10
f7是全氟萘-2-基,和甲基铝氧烷(mao)是d。当使用活化剂a、b或c时,使用0.5umol tnoal(三正辛基铝)作为清除剂。使用1ml丙烯和总计4.1ml的溶剂。反应以800rpm搅拌,并且在8psi的压力损失或未满足淬灭压力最大30分钟的反应时间之后淬灭。
[0941]
表9.丙烯聚合和共聚运行。催化剂号对应于图表中表示的络合物号。标准条件包括:1.1当量活化剂a[phme2nh][b(c6f5)4],1ml丙烯,0、100或200ul的共聚单体(1-辛烯、1-庚烯或1-十四碳烯),0.5umoltnoal(三正辛基铝)用作清除剂和如表中表明3.9-4.1ml的溶剂。反应在70℃下进行并以800rpm搅拌,并且在8psi的压力损失或未满足淬灭压力最大30分钟的反应时间之后淬灭。如果表9中没有报道tm,则聚合物是无定形的。
[0942]
表10.使用4-甲基-1-戊烯作为共聚单体的丙烯共聚运行。催化剂号对应于图表中表示的络合物号。标准条件包括:1.1当量活化剂a[phme2nh][b(c6f5)4],如表中表明0.1至0.5ml丙烯(c3),500ul的4-甲基-1-戊烯,0.5umol tnoal(三正辛基铝)用作清除剂和如表中表明4.1-4.5ml的溶剂。反应在100℃下进行并以800rpm搅拌,并且在8psi的压力损失或未满足淬灭压力最大30分钟的反应时间之后淬灭。生产的聚合物是无定形的。
[0943]
表1:丙烯均聚
[0944][0945]
表1:丙烯均聚(续)
[0946][0947]
表1:丙烯均聚(续)
[0948][0949]
表1:丙烯均聚(续)
[0950][0951]
表1:丙烯均聚(续)
[0952][0953]
表1:丙烯均聚(续)
[0954][0955]
表1:丙烯均聚(续)
[0956][0957]
表1:丙烯均聚(续)
[0958][0959]
表1:丙烯均聚(续)
[0960][0961]
表1:丙烯均聚(续)
[0962][0963]
表1:丙烯均聚(续)
[0964][0965]
表1:丙烯均聚(续)
[0966][0967]
表1:丙烯均聚(续)
[0968][0969]
表9:丙烯均聚和共聚
[0970][0971]
表10:丙烯与4-甲基-1-戊烯共聚
[0972][0973]
表2.使用高度全同立构催化剂的对比丙烯聚合数据
[0974]
标准条件包括当使用活化剂a或c时1.1当量活化剂或当使用活化剂d时500当量活化剂。活化剂号:[phme2nh][b(c6f5)4]是a,其中c6f5是全氟苯基,[phme2nh][b(c
10
f7)4]是c,其中c
10
f7是全氟萘-2-基,和甲基铝氧烷(mao)是d。当使用活化剂a、b或c时,使用0.5umol tnoal(三正辛基铝)作为清除剂。使用1ml丙烯和总计4.1ml的溶剂。反应以800rpm搅拌,并且在8psi的压力损失或未满足淬灭压力最大30分钟的反应时间之后淬灭,或除非另外规定。在注射至反应器中之前催化剂c1用20当量的mao预活化,其中使用总计500当量的mao用于反应。**使用20psi压力损失的淬灭压力。*使用15psi压力损失或最大15分钟反应时间的
淬灭压力。当量(equiv.)作为摩尔比给出。
[0975][0976]
表2.使用高度全同立构催化剂的对比丙烯聚合数据(续)
[0977]
标准条件包括当使用活化剂a或c时1.1当量活化剂或当使用活化剂d时500当量活化剂。活化剂号:[phme2nh][b(c6f5)4]是a,其中c6f5是全氟苯基,[phme2nh][b(c
10
f7)4]是c,其中c
10
f7是全氟萘-2-基,和甲基铝氧烷(mao)是d。当使用活化剂a、b或c时,使用0.5umol tnoal(三正辛基铝)作为清除剂。使用1ml丙烯和总计4.1ml的溶剂。反应以800rpm搅拌,并且在8psi的压力损失或未满足淬灭压力最大30分钟的反应时间之后淬灭,或除非另外规定。在注射至反应器中之前催化剂c1用20当量的mao预活化,其中使用总计500当量的mao用于反应。**使用20psi压力损失的淬灭压力。*使用15psi压力损失或最大15分钟反应时间的淬灭压力。当量(equiv.)作为摩尔比给出。
[0978][0979]
表3.来自表1和2的选择实施例和对比例的
13
c nmr数据。
[0980]
^表示合并用于nmr分析的样品。更具体地,合并以下实施例用于
13
c nmr分析:160-161;169和171;179-179;230-231;260和262;266-268;298-300;326,328和329;349-351;376-378;379-381;394和396;397-399;404-405;406-408;409-411;412-413;415-417;418-420;421-423;454-456;457-459;469-471;475-477;514-515;517-518;523-524;528-530;534-536;552-553;558-560。
[0981][0982][0983]
表3.来自表1和2的选择实施例和对比例的
13
c nmr数据。(续)
[0984]
^表示合并用于nmr分析的样品。更具体地,合并以下实施例用于
13
c nmr分析:160-161;169和171;179-179;230-231;260和262;266-268;298-300;326,328和329;349-351;376-378;379-381;394和396;397-399;404-405;406-408;409-411;412-413;415-417;418-420;421-423;454-456;457-459;469-471;475-477;514-515;517-518;523-524;528-530;534-536;552-553;558-560。
[0985][0986][0987]
表3.来自表1和2的选择实施例和对比例的
13
c nmr数据。(续)
[0988]
^表示合并用于nmr分析的样品。更具体地,合并以下实施例用于
13
c nmr分析:160-161;169和171;179-179;230-231;260和262;266-268;298-300;326,328和329;349-351;376-378;379-381;394和396;397-399;404-405;406-408;409-411;412-413;415-417;418-420;421-423;454-456;457-459;469-471;475-477;514-515;517-518;523-524;528-530;534-536;552-553;558-560。
[0989][0990][0991]
表3.来自表1和2的选择实施例和对比例的
13
c nmr数据。(续)
[0992]
^表示合并用于nmr分析的样品。更具体地,合并以下实施例用于
13
c nmr分析:160-161;169和171;179-179;230-231;260和262;266-268;298-300;326,328和329;349-351;376-378;379-381;394和396;397-399;404-405;406-408;409-411;412-413;415-417;418-420;421-423;454-456;457-459;469-471;475-477;514-515;517-518;523-524;528-530;534-536;552-553;558-560。
[0993][0994][0995]
表3.来自表1和2的选择实施例和对比例的
13
c nmr数据。(续)
[0996]
^表示合并用于nmr分析的样品。更具体地,合并以下实施例用于
13
c nmr分析:160-161;169和171;179-179;230-231;260和262;266-268;298-300;326,328和329;349-351;376-378;379-381;394和396;397-399;404-405;406-408;409-411;412-413;415-417;418-420;421-423;454-456;457-459;469-471;475-477;514-515;517-518;523-524;528-530;534-536;552-553;558-560。
[0997][0998]
表4.说明所选实施例的链端不饱和度的1h nmr数据
[0999][1000]
连续搅拌釜反应器运行:在连续搅拌釜反应器中进行聚合。高压釜反应器(1l)配备有搅拌器、具有温度控制器的水冷却/料流加热元件和压力控制器。反应器维持在超过反应物混合物的起泡点的压力下从而保持反应物处于液相。反应器以充满液体操作。异己烷(用作溶剂)和丙烯通过氧化铝床和分子筛纯化。还通过相同的技术纯化用于制备催化剂溶液的甲苯。通过pulsa进料泵将所有进料泵入反应器。使用brooks质量流动控制器控制所有液体流速。丙烯进料与已冷却至至少0℃的预冷却的异己烷料流混合。通过单个口将混合物加料至反应器中。
[1001]
在其即将进入反应器之前向合并的溶剂和单体料流加入三正辛基铝(tnoal)(己烷中25重量%,sigma aldrich)清除剂的异己烷溶液以进一步减少任何催化剂毒物。调节清除剂溶液的进料速率以优化催化剂活性。
[1002]
使用的催化剂是以上描述的络合物6。催化剂(大约20mg)以约1:1的摩尔比在900ml的甲苯中用四(全氟苯基)硼酸n,n-二甲基苯铵(活化剂a)活化。然后将催化剂溶液通过单独的口使用isco注射器泵加入反应器。
[1003]
反应器中生产的聚合物通过减小压力至大气压的背压控制阀离开。这引起溶液中未转化的单体闪蒸为气相,其从气液分离器的顶部排出。收集主要包含聚合物和溶剂的液相用于聚合物回收。首先将收集的样品在通风橱中空气干燥以蒸发大部分溶剂,并然后在约90℃温度下的真空烘箱中干燥约12小时。称重真空烘箱干燥的样品从而获得收率。在以下表5-8中列出详细聚合工艺条件。调节清除剂进料速率和催化剂进料速率以达到列出的
目标转化率。除非另外提到,所有反应在约2.4mpa/g的压力下进行。
[1004]
表5:制备聚丙烯的连续搅拌釜反应器运行。
[1005][1006][1007]
表5:制备聚丙烯的连续搅拌釜反应器运行。(续)
[1008]
实施例pp-1pp-2pp-3亚乙烯基/1000c0.000.030.01乙烯叉基/1000c0.080.150.01三取代烯烃/1000c0.000.080.00
13
c nmr数据
ꢀꢀꢀ
[mmmm]0.9660.9550.973[mmmr]0.0090.0110.008[rmmr]0.0050.0070.003[mmrr]0.0090.0100.008[mmrm+rmrr]0.0040.0060.003[rmrm]0.0020.0030.001
[rrrr]0.0010.0010.000[mrrr]0.0010.0020.000[mrrm]0.0050.0060.004立构缺陷/10000个单体71.695.957.62,1-区域(ee)缺陷/10000个单体65.066.765.92,1-区域(et)缺陷/10000个单体9.110.810.12,1-区域(te)缺陷/10000个单体0.00.00.01,3-区域缺陷/10000个单体0.00.00.0总区域缺陷/10000个单体74.177.576.0总区域和立构缺陷/10000个单体145.7173.4133.6平均内消旋运行长度68.657.774.9
[1009]
*转化率%=[(聚合物收率)/(丙烯进料)]x100
[1010]
表6:制备聚丙烯的连续搅拌釜反应器运行。
[1011][1012][1013]
表6:制备聚丙烯的连续搅拌釜反应器运行。(续)
[1014]
实施例pp-4pp-5pp-6mn_ls(g/mol)47,29779,783124,115mw_ls(g/mol)97,536165,215249,622mz_ls(g/mol)155,206271,176390,773g'vis0.9910.9901.001tc(℃)115.5112.9114.8tm(℃)154.6156.2158.6δh(j/g)106.1105.1103.2
13
c nmr数据
ꢀꢀꢀ
[mmmm]0.9660.9690.978
[mmmr]0.0070.0060.005[rmmr]0.0060.0050.003[mmrr]0.0080.0070.007[mmrm+rmrr]0.0050.0040.002[rmrm]0.0020.0020.001[rrrr]0.0010.0010.001[mrrr]0.0010.0010.001[mrrm]0.0040.0040.003立构缺陷/10000个单体77.167.348.82,1-区域(ee)缺陷/10000个单体16.916.415.12,1-区域(et)缺陷/10000个单体4.54.54.32,1-区域(te)缺陷/10000个单体0001,3-区域缺陷/10000个单体000总区域缺陷/10000个单体21.420.919.4总区域和立构缺陷/10000个单体98.588.268.2平均内消旋运行长度102113147
[1015]
*转化率%=[(聚合物收率)/(丙烯进料)]x100
[1016]
表7:制备聚丙烯的连续搅拌釜反应器运行。
[1017][1018][1019]
表7:制备聚丙烯的连续搅拌釜反应器运行。(续)
[1020]
实施例pp-7pp-8pp-9mn_ftir(g/mol)45,37167,086101,759mw_ftir(g/mol)93,593138,233213,356mz_ftir(g/mol)153,407223,683348,288mwd ftir(mw/mn)2.062.062.10tc(℃)120.7119.7118.6tm(℃)157.1159.0161.4
δh(j/g)111.9111.0110.7
13
c nmr数据
ꢀꢀꢀ
[mmmm]0.9600.9560.951[mmmr]0.0070.0060.006[rmmr]0.0110.0100.013[mmrr]0.0080.0080.008[mmrm+rmrr]0.0050.0070.007[rmrm]0.0010.0020.004[rrrr]0.0010.0020.003[mrrr]0.0040.0040.004[mrrm]0.0040.0050.005立构缺陷/10000个单体67.883.788.92,1-区域(ee)缺陷/10000个单体21.320.417.42,1-区域(et)缺陷/10000个单体0002,1-区域(te)缺陷/10000个单体0001,3-区域缺陷/10000个单体000总区域缺陷/10000个单体21.320.417.4总区域和立构缺陷/10000个单体89.1104.1106.3平均内消旋运行长度1129694
[1021]
*转化率%=[(聚合物收率)/(丙烯进料)]x100
[1022]
表8:制备聚丙烯的对比连续搅拌釜反应器运行。
[1023]
4.98ppm之间共振,乙烯基端基测量为乙烯基数/1,000个碳原子。使用在4.88-4.69ppm之间共振,乙烯叉基端基测量为乙烯叉基数/1,000个碳原子。值报道为%亚乙烯基、%三取代的(%trisub)、%乙烯基和%乙烯叉基,其中百分比相对于总烯属不饱和/1,000个碳原子。
[1032]
在140℃下将丙烯-4-甲基-1-戊烯共聚物以67mg/ml的浓度溶解在氘化的1,1,2,2-四氯(乙烷tce-d2)中。在120℃下使用至少600mhz的bruker nmr波谱仪与10mm冷冻探针来记录谱图。使用90
°
脉冲、60秒延迟、512个瞬态和反向门控去耦来测量
13
c nmr。对于基于丙烯的材料而言聚合物共振峰参照21.83ppm下的ch3。从s.losio等人macromolecules,2011,第44卷,第3276-3286页确定归属。从谱图的ααch2区域确定二单元组(αα在该论文中定义)。峰积分区域如下:
[1033][1034][1035]
sc=4-甲基-1-戊烯的侧链、y=4-甲基-1-戊烯、p=丙烯
[1036]
为了测定pp二单元组,区域a=2pp+0.5*py,所以pp=(a-0.5*b)/2)/总计、py=b/总计和区域yy=c/总计。总计=pp+py+yy。对于摩尔分数,p=pp+0.5*py,和y=yy+0.5*py乘以100以产生摩尔%。
[1037]
dsc-大规模聚合。
[1038]
根据astm d3418-03使用以下dsc程序来测定峰值熔点tm(还称作熔点)、峰值结晶温度tc(还称作结晶温度)、玻璃化转变温度(tg)、熔化热(δhf)和百分比结晶度。使用ta instruments q200机器或类似机器获得差示扫描量热法(dsc)数据。将重量为大约5-10mg的样品密封在铝气密样品盘中。通过首先以10℃/分钟的速率逐渐加热样品至200℃来记录dsc数据。样品保持在约200℃下2分钟,然后以10℃/分钟的速率冷却至-90℃,之后恒温2分钟并以10℃/分钟加热至200℃。记录第一和第二循环的热事件。测量吸热峰下方面积并用于确定熔化热和结晶度百分比。使用式:[熔融峰下方面积(焦耳/克)/b(焦耳/克)]*100来计算百分比结晶度,其中b是主要单体组分的100%结晶均聚物的熔化热。从提供的john wiley and sons(纽约)于1999年出版的polymer handbook(第四版)获得这些b值;然而,使用189j/g的值(b)作为100%结晶聚丙烯的熔化热,使用290j/g的值用于100%结晶聚乙烯的熔化热。除非另外指出,在第二加热/冷却循环过程中获得此处报道的熔化温度和结晶温度。描述的这种dsc技术用于由连续搅拌釜反应器运行生产的聚合物。
[1039]
根据astm d1238使用2.16kg的载荷在230℃的温度下测定熔体流动速率(mfr)。根据astm d1238使用21.6kg的载荷在230℃的温度下测定高载荷条件的熔体流动速率(hl mfr)。
[1040]
通过与多个检测器联用的gpc-ir(gpc-4d)用于分子量和共聚单体组成测定的gpc 4d程序。
[1041]
除非另外表明,通过使用配备有基于多通道带通滤波器的红外检测器ir5、18-角
度光散射检测器和粘度计的高温凝胶渗透色谱法(polymer char gpc-ir)测定分子量的矩(moment)和分布(mw、mn、mw/mn等)和共聚单体含量(c2、c3、c6等)。使用三个agilent plgel 10-μm混合-b ls柱来提供聚合物分离。使用具有300ppm抗氧化剂丁基化羟基甲苯(bht)的aldrich试剂级1,2,4-三氯苯(tcb)作为流动相。通过0.1-μm特氟龙过滤器过滤tcb混合物并且在进入gpc仪器之前用在线脱气器脱气。标称流动速率为1.0ml/min,并且标称注射体积为200μl。在维持在145℃下的烘箱中容纳包括转移管线、柱和检测器的整个系统。称量聚合物样品并密封在具有添加至其中的80μl流动标记物(庚烷)的标准瓶中。在自动进样机中装载该瓶之后,聚合物自动溶解在具有8ml添加的tcb溶剂的仪器中。在160℃下对于几乎pe样品而言连续摇动约1小时或对于pp样品而言连续摇动2小时从而溶解聚合物。用于浓度计算的tcb密度为在室温下1.463g/ml和在145℃下为1.284g/ml。样品溶液浓度为0.2-2.0mg/ml,其中较低浓度用于较高分子量样品。从减去基线的ir5宽带信号强度(i)使用以下等式来计算色谱图中每个点处的浓度(c):c=βi,其中β是质量常数。从浓度色谱法在淋洗体积内的积分面积与注射质量(其等于预定浓度乘注射环路体积)的比计算质量回收率。通过将通用校准关系与柱校准(其采用700g/mol-10,000,000g/mol范围的一系列单分散聚苯乙烯(ps)标准物进行)结合来确定常规分子量(ir mw)。采用(1)计算在每个淋洗体积的mw:
[1042][1043]
其中具有下标“ps”的变量代表聚苯乙烯,而没有下标的那些代表测试样品。在此方法中,α
ps
=0.67和k
ps
=0.000175,如在文献(sun,t.等人(2001)macromolecules,第34卷,第6812页)中公开和计算对于其它材料的α和k,除了就本发明及其权利要求书的目的而言,对于线性乙烯聚合物而言α=0.695和k=0.000579,对于线性丙烯聚合物而言α=0.705和k=0.0002288,对于线性丁烯聚合物而言α=0.695和k=0.000181。除非另外指出,浓度以g/cm3为单位表示,分子量以g/mol为单位表示,并且特性粘度(因此mark-houwink等式中的k)以dl/g为单位表示。
[1044]
通过对应于ch2和ch3通道(其采用由nmr或ftir预定标称值的一系列pe和pp均聚/共聚物标准物校准)的ir5检测器强度的比测定共聚单体组成。特别地,这提供作为分子量函数的甲基/1,000个总碳(ch3/1000tc)。然后通过将链端校正应用于ch3/1000tc函数,假设每个链为线性并在每个端部由甲基基团封端,计算作为分子量函数的每1000tc的短链分支(scb)含量(scb/1000tc)。然后从以下表达式获得重量%共聚单体,其中对于c3、c4、c6、c8等共聚单体f分别是0.3、0.4、0.6、0.8等:
[1045]
w2=f*scb/1000tc
ꢀꢀ
(2)
[1046]
通过考虑在浓度色谱图的积分限之间ch3和ch2通道的整个信号获得来自gpc-ir和gpc-4d分析的聚合物的本体组成。首先,获得以下比
[1047][1048]
然后应用ch3和ch2信号比相同的校准(如先前获得为分子量函数的ch3/1000tc中提到的)以获得本体ch3/1000tc。通过在分子量范围内加权平均链端校正获得本体甲基链端/1000tc(本体ch3端/1000tc)。
[1049]
然后
[1050]
w2b=f*本体ch3/1000tc
ꢀꢀ
(4)
[1051]
本体scb/1000tc=本体ch3/1000tc-本体ch3端/1000tc
ꢀꢀ
(5)
[1052]
和如以上所述相同的方式将本体scb/1000tc转变为本体w2。
[1053]
ls检测器是18-角度wyatt technology high temperature dawn heleosii。通过使用用于静态光散射的zimm模型分析ls的输出来确定色谱图中每个点处的ls分子量(m)(light scattering from polymer solutions,huglin,m.b.编者,academic press,1972):
[1054][1055]
在此,δr(θ)是在散射角θ处测量的过量瑞利散射强度,c是从ir5分析确定的聚合物浓度,a2是第二维里系数,p(θ)是单分散无规线圈的形状因子,和ko是系统的光学常数:
[1056][1057]
其中na是阿伏伽德罗常数,和(dn/dc)是系统的折射率增量。tcb在145℃和λ=665nm下的折射率n=1.500。
[1058]
使用高温agilent(或viscotek corporation)粘度计(其具有以惠斯通电桥构造布置的四个毛细管,以及两个压力传感器)测定比粘度。一个传感器测量横跨检测器的总压降,放置在电桥的两侧之间的另一个传感器测量压差。通过它们的输出计算流过粘度计的溶液的比粘度ηs。由等式[η]=ηs/c计算在色谱图中每个点处的特性粘度[η],其中c是浓度并且由ir5宽带通道输出测定。每个点处的粘度mw计算为其中α
ps
为0.67并且k
ps
为0.000175。
[1059]
本文所述的所有文件通过引用并入本文,包括任何优先权文件和/或测试程序,只要它们不与本文相矛盾。如由前面一般性的描述和具体实施方案显而易见的,尽管已经阐述和描述了本发明的形式,但是在不背离本发明的精神和范围的情况下可进行各种改变。因此,不意在由此限制本发明。同样地,术语“包含”被认为与术语“包括”同义。同样地,无论何时,组成、要素或要素的组前面带有连接词“包含”,应该理解我们也考虑了在所述组成、一种或多种要素的记载前面带有连接词“基本上由...组成”、“由...组成”、“选自由...组成的组”或“是”的相同的组成或要素的组,反之亦然。
[1060]
凝胶渗透色谱法(gpc-dri)。
[1061]
使用具有dri检测器的waters 2000(凝胶渗透色谱图)进行分析。在以下表11中列出详细gpc条件。在抑制的tcb(1,2,4-三氯苯)溶剂中制备标准物和样品。使用十九个聚苯乙烯标准物(ps)用于校准gpc。使用的ps标准物来自easical预先制备的聚合物校准物(pl laboratories)。用于将窄聚苯乙烯标准峰值分子量(例如7,500,000聚苯乙烯)转化为聚丙烯峰值分子量(4630505)的计算为m
pp
=10^(log10(0.000175/0.0002288)/(1+0.705)+log10(m
ps
)*(1+0.67)/(1+0.705)),其中m
pp
是聚丙烯分子量和m
ps
是聚苯乙烯分子量。从这里获得淋洗保持时间与聚丙烯分子量关系。
[1062]
将样品精确称重并稀释至~0.75mg/ml浓度并记录。将标准物和样品置于160℃下
pl labs 260加热器/振荡器上两小时。这些通过0.45微米钢过滤杯过滤并分析。
[1063]
表11:凝胶渗透色谱法(gpc)测量条件
[1064]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1